Перейти к:
Плейотропные свойства прямых оральных антикоагулянтов — новые горизонты терапии
https://doi.org/10.20996/1819-6446-2025-3212
EDN: HXLSOY
Аннотация
Прямые оральные антикоагулянты (ПОАК), включая ингибиторы фактора Xa (ривароксабан, апиксабан, эдоксабан) и прямой ингибитор тромбина (дабигатран), широко применяются для профилактики и лечения тромботических осложнений, в частности при эндопротезировании крупных суставов, неклапанной фибрилляции предсердий (ФП), а также в составе двойной антитромботической терапии (антикоагулянт + антиагрегант) у пациентов после острого коронарного синдрома и чрескожных коронарных вмешательств, особенно в контексте сопутствующей ФП и повышенного риска системной эмболии. В последние годы значительно усиливается интерес к исследованию плейотропных эффектов ПОАК, выходящих за пределы их основного антикоагулянтного действия. Накапливающиеся экспериментальные и клинические данные свидетельствуют о наличии у этих препаратов дополнительных фармакологических свойств — в частности, противовоспалительного, антиаритмического и нейропротективного действия. Предложенные молекулярные и клеточные механизмы включают снижение уровня провоспалительных цитокинов, модуляцию функций эндотелия, уменьшение выраженности оксидативного стресса, а также положительное влияние на процессы ремоделирования миокарда и нейроваскулярную защиту. Подобные плейотропные эффекты могут играть важную патофизиологическую роль в замедлении прогрессирования сердечно-сосудистых и цереброваскулярных заболеваний, способствуя уменьшению частоты осложнений и улучшая клинические исходы пациентов. Понимание плейотропных свойств ПОАК формирует предпосылки для их более широкого клинического применения в составе комплексной терапии сердечно-сосудистых, воспалительных и цереброваскулярных заболеваний. В настоящем обзоре рассматриваются современные данные о плейотропных свойствах ПОАК и обсуждается их потенциальный вклад в повышение эффективности и индивидуализацию фармакотерапии в клинической кардиологии.
Ключевые слова
Для цитирования:
Давтян П.А., Загидуллин Н.Ш. Плейотропные свойства прямых оральных антикоагулянтов — новые горизонты терапии. Рациональная Фармакотерапия в Кардиологии. 2025;21(4):396-403. https://doi.org/10.20996/1819-6446-2025-3212. EDN: HXLSOY
For citation:
Davtian P.A., Zagidullin N.S. Pleiotropic properties of direct oral anticoagulants — new therapeutic horizons. Rational Pharmacotherapy in Cardiology. 2025;21(4):396-403. (In Russ.) https://doi.org/10.20996/1819-6446-2025-3212. EDN: HXLSOY
Введение
Прямые оральные антикоагулянты (ПОАК) за последние два десятилетия существенно изменили стратегию профилактики и лечения тромбоэмболических осложнений. Их внедрение привело к смене парадигмы в первичной и вторичной профилактике ишемического инсульта у пациентов с неклапанной фибрилляцией предсердий (ФП), а также в лечении и профилактике венозной тромбоэмболии, включая тромбоз глубоких вен и тромбоэмболию лёгочной артерии [1]. Несмотря на то, что антагонисты витамина K (АВК) на протяжении более 60 лет оставались стандартной терапией [2], накопление убедительных данных рандомизированных клинических исследований и более высокий уровень клинической управляемости способствовали широкому распространению ПОАК в клинической практике [3-5]. На сегодняшний день доступны две основные группы ПОАК: прямые ингибиторы тромбина (дабигатран) и прямые ингибиторы активированного фактора Ха ((ФXa), ривароксабан, апиксабан и эдоксабан).
Кроме антикоагулянтного действия, в последнее время активно обсуждаются плейотропные свойства ПОАК. В частности, имеются данные о противовоспалительном действии, связанном с ингибированием факторов свертывания, вовлечённых в провоспалительные патофизиологические пути при сердечно-сосудистых заболеваниях [3][4]. Экспериментальные и клинические исследования также указывают на возможные противовирусные свойства, особенно в контексте респираторных вирусных инфекций, включая новую коронавирусную инфекцию (COVID-19), где участие тромбина и ФХа может способствовать усилению воспаления и вирусной репликации [6]. Дополнительно обсуждается потенциальный антиаритмический эффект ПОАК, который, вероятно, обусловлен их способностью снижать уровень воспалительных медиаторов, участвующих в патогенезе ФП
Кроме того, предполагается, что нейропротективные свойства этих препаратов могут способствовать снижению риска когнитивных нарушений, особенно у пациентов с ФП [7].
Настоящий нарративный обзор посвящён анализу современных данных о плейотропных эффектах ПОАК.
Характеристика ПОАК
ПОАК обладают рядом фармакологических преимуществ по сравнению с АВК: фиксированная дозировка, отсутствие необходимости в регулярном мониторинге международного нормализованного отношения, быстрое начало действия, короткий период полувыведения, а также меньшая выраженность лекарственных и пищевых взаимодействий [8].
Клинические исследования продемонстрировали не меньшую эффективность ПОАК по сравнению с АВК при более высоком профиле безопасности, что делает их предпочтительной альтернативой в профилактике тромбоэмболических осложнений, в частности у пациентов с ФП [3][5][9][10]. Дабигатран, ривароксабан и апиксабан на сегодняшний день являются препаратами выбора для профилактики инсульта и системной эмболии у пациентов с неклапанной ФП. Эффективность и безопасность каждого из этих препаратов подтверждена результатами масштабных многоцентровых рандомизированных исследований: RE-LY, ROCKET AF и ARISTOTLE, соответственно [11-13].
Противовоспалительная активность ПОАК
ПОАК помимо своего основного антикоагулянтного действия, демонстрируют значительные противовоспалительные свойства, что расширяет их терапевтический потенциал в различных клинических сценариях. Факторы свёртывания, в частности тромбин и ФXa, помимо своей центральной роли в каскаде коагуляции, выполняют важные функции в регуляции воспалительного ответа. В частности, Г. С. Галяутдинов и соавт. [3] показали, что применение ПОАК сопровождается снижением уровней провоспалительных цитокинов (интерлейкина (ИЛ)-6, фактора некроза опухоли (ФНО)-α) и улучшением функционального состояния эндотелия, что может играть важную роль в уменьшении сосудистого воспаления. О. И. Боева и соавт. подчёркивают, что плейотропные эффекты ПОАК, включая подавление воспалительной активации эндотелия и снижение выраженности оксидативного стресса, способны дополнительно снижать кардиоваскулярный риск у пациентов с ФП и сопутствующим атеросклерозом [14]. Данные исследования H. Macleod и соавт. [15] подтверждают противовоспалительный потенциал ПОАК в онкологической популяции: установлено, что у пациентов с тромбозом, ассоциированным с онкологическим процессом, терапия ПОАК не приводит к увеличению уровней циркулирующих внеклеточных везикул и воспалительных цитокинов, что сопоставимо с эффектом низкомолекулярных гепаринов.
Исследования показывают, что ФXa, взаимодействуя с рецептором эффекторной клеточной протеазы-1, может выступать медиатором острого воспаления in vivo. Этот механизм способствует усилению как коагуляционного, так и воспалительного ответа, что в свою очередь может приводить к повреждению тканей [16-19]. Было также установлено, что воздействие ФXa на эндотелиальные клетки пупочной вены человека вызывает дозозависимую стимуляцию продукции ключевых провоспалительных цитокинов – ИЛ-6, ИЛ-8 и моноцитарный хемотаксический протеин 1 (monocyte chemoattractant protein 1, MCP-1), а также повышает экспрессию молекул адгезии, включая E-селектин, межклеточную молекулу адгезии-1 и сосудистую молекулу адгезии-1 [17]. В результате усиливается адгезия полиморфно-ядерных лейкоцитов к эндотелию, что является важным этапом воспалительного процесса. Доказано, что активность ФXa в этом контексте зависит от его каталитического центра, поскольку заблокированная форма ФXa не оказывала влияния на продукцию цитокинов и экспрессию молекул адгезии [17]. Помимо этого, ФXa усиливает действие тромбина, провоцируя кальций-зависимые и провоспалительные реакции в эндотелиальных клетках [18]. Он также способен индуцировать профибротические и воспалительные процессы в фибробластах [20], тканях предсердия человека [20] и макрофагах линии RAW 264.7 [21] через активацию рецептора, активируемого протеазой-2 (PAR-2) [16][22] (рис. 1).
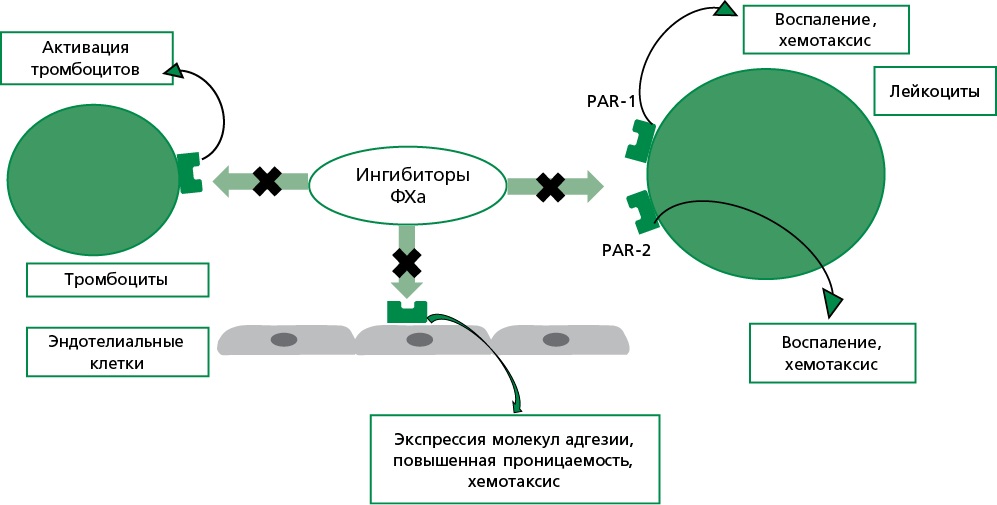
ПОАК – прямые оральные антикоагулянты
Рисунок. 1. Противоспалительные эффекты ПОАК.
Таким образом, сигнальные механизмы, опосредованные ФXa, играют важную роль в развитии воспалительных реакций, способствуют эндотелиальной дисфункции, окислительному стрессу, нарушению функции гладкомышечных клеток сосудов, а также активации иммунных клеток и воспалительных процессов [19-21].
ПОАК могут модулировать воспалительные и фибротические процессы. Ингибитор ФXa в экспериментальных условиях продемонстрировал способность подавлять продукцию MCP-1 в эндотелиальных клетках за счет блокады сигнального пути через активируемый протеиназой рецептор 1 (PAR)-1 [17]. Исследования A. Goette и соавт. показали, что эдоксабан подавляет провоспалительные сигнальные пути, уменьшая экспрессию цитокинов и фибробластов, а также снижает активность рецепторов PAR-1 и PAR-2, что может замедлять развитие эндотелиальной дисфункции и атеросклероза [23]. Приём ривароксабана по данным исследования X-VeRT приводил к снижению уровней D-димера и ИЛ-6 у пациентов с ФП [24]. В рамках post hoc-анализа, проведённого P. Kirchhof и соавт. было продемонстрировано, что терапия ривароксабаном значительно снижает уровни биомаркеров воспаления, таких как С-реактивный белок (СРБ) и ИЛ-6 [25]. В свою очередь, исследование V. Paar и соавт. показало, что дабигатран снижает уровни цитокинов и факторов роста, уменьшая провоспалительные реакции и открывая возможности для его использования в терапии воспалительных заболеваний [26].
Апиксабан продемонстрировал противовоспалительный эффект в остром периоде ишемического инсульта: раннее его назначение ассоциировалось со снижением провоспалительных цитокинов и меньшей выраженностью нейровоспаления [27]. Механизм предполагает ингибирование PAR-рецепторов и подавление активности транскрипционного фактора NF-κB, что приводит к снижению экспрессии молекул клеточной адгезии и провоспалительных медиаторов.
Таким образом, использование ПОАК обладает выраженным противовоспалительным эффектом. Ингибиторы ФХа оказывают влияние на воспалительные механизмы, препятствуя активации протеаз-активируемых рецепторов, что в свою очередь снижает уровень провоспалительных цитокинов, таких как ИЛ-6 и ФНО-α. Это влияние на воспаление играет ключевую роль в уменьшении сосудистых осложнений и поддержании нормальной функции эндотелия [24][25].
Противовирусная активность
В дополнение к антикоагулянтному и противовоспалительному действию, всё больше внимания уделяется возможному противовирусному потенциалу ПОАК, в частности ингибиторов ФХа. Исследования последних лет показали, что компоненты системы свёртывания крови активно участвуют не только в формировании тромбоза, но и в патогенезе вирусных инфекций, включая усиление воспаления, повреждение эндотелия и развитие коагулопатий. Противовирусный потенциал ингибиторов ФXa подтверждён на моделях вирусных инфекций. Так, ингибирование ФXa улучшало функцию левого желудочка при миокардите, индуцированном вирусом Коксаки B3, способствуя восстановлению миокарда [28]. Кроме того, было показано снижение заражаемости мышей аденоассоциированным вирусом 2-го типа на фоне терапии ингибитором ФXa [6]. В клетках эндотелия пупочной вены человека ФXa усиливал инфицирование вирусом простого герпеса через активацию PAR-2, что указывает на потенциальную возможность снижения инфекционности при фармакологическом ингибировании ФXa [22].
Данные, полученные с использованием методов молекулярного анализа, демонстрируют потенциальную способность ингибиторов ФXa угнетать активность трансмембранной протеазы TMPRSS2, что расширяет спектр их антивирусной активности [6]. Подобные эффекты описаны и для других РНК-содержащих вирусов. В частности, установлено, что ФXa необходим для эффективной репликации вируса гепатита E, где он, предположительно, участвует в процессинге полипротеина ORF1 [28]. Следовательно, ингибиторы ФXa могут вмешиваться не только в процесс проникновения вируса, но и в его внутриклеточную репликацию.
Совокупность экспериментальных данных демонстрирует, что прямые ингибиторы ФXa обладают многосторонним противовирусным потенциалом, проявляя как прямое влияние на механизмы проникновения вируса в клетку, так и опосредованное – за счёт модуляции клеточных протеаз и рецепторов (рис. 2). Это указывает на перспективность их использования в качестве дополнительного терапевтического инструмента при лечении вирусных заболеваний [28]. Особенно очевидным это стало в ходе пандемии COVID-19, когда у инфицированных пациентов наблюдались выраженная гиперкоагуляция и системный воспалительный ответ.
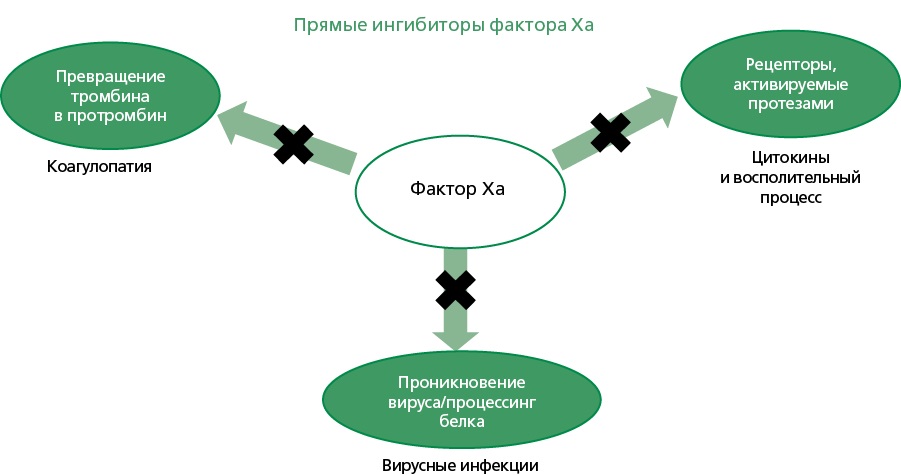
ПОАК – прямые оральные антикоагулянты, COVID-19 – новая коронавирусная инфекция
Рисунок 2. Потенциальные противовирусные эффекты ПОАК при COVID-19.
Ведение пациентов в постгоспитальном периоде после перенесённой новой коронавирусной инфекции остаётся актуальной клинической задачей, особенно в контексте сохраняющегося воспаления и протромботических состояний, которые сопровождают COVID-19. Одним из ведущих механизмов, способствующих тромбообразованию и сосудистым осложнениям после заболевания, является хроническое воспаление, которое сохраняется длительное время после острого периода инфекции. Важным элементом этого процесса являются активация тромбоцитов, эндотелиальная дисфункция и повышение продукции провоспалительных цитокинов [29][30].
Экспериментальные исследования показали, что ингибирование ФXa препятствует проникновению SARS-CoV в клетки, подавляя протеолитическое расщепление S-белка на субъединицы S1 и S2. Применение селективного ингибитора ФXa дозозависимо снижало образование вирусных бляшек SARS-CoV в клетках Vero E6, указывая на возможность прямого противовирусного действия [6].
Несмотря на данные о сравнительно низкой частоте тромбоэмболических осложнений в первые 30-45 дней после выписки, крупные исследования демонстрируют сохраняющийся риск развития неблагоприятных сердечно-сосудистых событий при COVID-19 в течение 1 года после выписки из стационара. В проспективном исследовании CORE-19, включавшем >4900 пациентов, госпитализированных с COVID-19, было показано, что в течение 90 дней после выписки у больных отмечалась высокая частота венозных и артериальных тромбоэмболий, а также смертности [29]. Продлённая антикоагулянтная терапия ассоциировалась со снижением риска осложнений на 46% без увеличения серьёзных кровотечений. В рандомизированном исследовании MICHELLE продлённая тромбопрофилактика ривароксабаном (10 мг/сут, 35 дней) у пациентов с COVID-19 и высоким риском венозных тромбоэмболий после выписки статистически значимо снижала комбинированную частоту тромбоэмболических осложнений и сердечно-сосудистой смертности без увеличения риска тяжёлых кровотечений [30].
В исследованиях, проведенных авторами настоящего обзора, было изучено развитие неблагоприятных сердечно-сосудистых событий у 1746 пациентов в отдалённом периоде COVID-19 после выписки из стационара в зависимости от постгоспитальной антикоагулянтной терапии с использованием ПОАК (или ривароксабана 10 мг 1 раз в день, или дабигатрана 110 мг 2 раза в день, или апиксабана 2,5 мг 2 раза в день на протяжении 4 недель) [31]. Было показано, что у пациентов, перенёсших COVID-19-пневмонию, приём ПОАК в профилактических дозах в течение 30 дней после выписки из стационара статистически значимо снижал сердечно-сосудистую смертность в течение 12 мес. наблюдения (p<0,001). Кроме того, применение ПОАК ассоциировалось со снижением риска ишемического инсульта (p=0,012) и ТЭЛА (p=0,028).
Полученные данные свидетельствуют о том, что постгоспитальная терапия ПОАК в течение 1 мес. обладает выраженным кардиопротективным эффектом у пациентов с COVID-19, способствуя снижению как тромбоэмболических, так и сердечно-сосудистых осложнений в отдалённом периоде.
Таким образом, имеющиеся данные позволяют предположить, что ингибиторы ФХа способны не только снижать воспалительную нагрузку, но и потенциально влиять на патогенез вирус-ассоциированных коагулопатий, а также модулировать чрезмерный иммунный ответ, возникающий при вирусных инфекциях, а значит уменьшать частоту сердечно-сосудистых событий например, при COVID-19 [6][30-32].
Антиаритмический потенциал ПОАК
ПОАК, включая дабигатран, ривароксабан, апиксабан и эдоксабан, в настоящее время считаются препаратами первого выбора для профилактики тромбоэмболических осложнений у пациентов с ФП и трепетанием предсердий.
Помимо антикоагулянтного действия, имеются данные, свидетельствующие о возможном антиаритмическом эффекте ПОАК. В частности, в экспериментальных исследованиях на модели индуцированной ФП у крыс было показано, что дабигатран и ривароксабан снижают аритмогенную активность, уменьшают продолжительность эпизодов аритмии, а также снижают уровень провоспалительных цитокинов, таких как ИЛ-6 и ФНО-α, что может указывать на их дополнительное противовоспалительное и антиаритмическое действие [18]. В исследовании M. Mele и соавт., было показано, что переход с варфарина на ПОАК у пациентов с ФП и хронической сердечной недостаточностью не только обеспечивает эффективную антикоагуляцию, но и сопровождается выраженными плейотропными эффектами, включая антиаритмическое действие [33]. Пациенты, получавшие ПОАК, имели более низкую частоту эпизодов ФП и замедленное прогрессирование хронической сердечной недостаточности по сравнению с группой варфарина. Предполагаемый механизм связан с улучшением эндотелиальной функции, снижением оксидативного стресса и подавлением воспалительных маркеров, таких как ИЛ-6 и СРБ.
Данные об антиаритмическом эффекте подтверждаются и в других работах. В исследовании H. Kondo и соавт. отмечено, что применение ПОАК сопровождается снижением уровня биомаркеров воспаления, что может способствовать стабилизации электрофизиологической активности предсердий и уменьшению фиброза миокарда — ключевых факторов развития и поддержания ФП [20].
- Atzemian и соавт. подчёркивают, что ингибиторы тромбина и ФXa оказывают плейотропное действие на эндотелиальные клетки, включая антифибротический, противовоспалительный и антиоксидантный эффекты, что может способствовать замедлению ремоделирования предсердий и снижению риска рецидивов ФП [34].
Антиаритмический потенциал ПОАК дополнительно подтверждается результатами проспективного когортного исследования L. Fiedler и соавт., в котором оценивалось влияние 30-дневной постгоспитальной терапии ривароксабаном (10 мг/сут.) на риск развития новых случаев ФП и внезапной сердечной смерти у 1804 пациентов, перенесших COVID-19. В течение 350 дней наблюдения было зафиксировано значительное снижение частоты новых случаев ФП и внезапной сердечной смерти в группе ривароксабана по сравнению с контрольной группой, не получавшей антитромботическую терапию [35]. Позитивный эффект ингибиторов ФXa, в частности ривароксабана, может быть связан с их способностью модулировать воспалительный каскад, снижать активацию протеаз-активируемых рецепторов и, как следствие, уменьшать электрическое и структурное ремоделирование миокарда, лежащее в основе возникновения аритмий [35]. Данный механизм представляет собой возможное объяснение антиаритмического действия ингибиторов ФXa, выходящего за пределы их основного антикоагулянтного действия. Эти наблюдения согласуются с данными P. Kirchhof и соавт., которые подчёркивают ключевую роль воспаления и коагуляционного дисбаланса в патогенезе и прогрессировании ФП [25]. Антикоагулянтная терапия с применением ривароксабана способствует снижению уровней провоспалительных цитокинов и маркеров системного воспаления, таких как ИЛ-6, ФНО-α и СРБ. Такая модуляция воспалительного ответа может оказывать опосредованное антиаритмическое действие за счёт уменьшения структурного и электрического ремоделирования предсердий [25].
Нейропротективный эффект ПОАК
В последние годы всё больше внимания уделяется потенциальным нейропротективным свойствам ПОАК, особенно у пациентов с ФП. Так, в исследовании A. Gupta и соавт. было установлено, что у пациентов с болезнью Альцгеймера и сосудистой деменцией наблюдаются повышенные уровни как воспалительных (включая СРБ и ИЛ-6), так и коагуляционных маркеров, что указывает на значительную роль системного воспаления и нарушений гемостаза в развитии когнитивных расстройств [36]. В связи с этим применение ПОАК может ассоциироваться со снижением риска развития деменции и когнитивных нарушений у этой группы пациентов. По данным ретроспективного когортного исследования W. Bezabhe и соавт. установлено, что применение ПОАК у пациентов с ФП приводит к статистически значимому снижению риска деменции по сравнению как с отсутствием антикоагулянтной терапии, так и с приёмом варфарина [37].
Согласно данным систематического обзора и метаанализа, проведённого K. Lee и соавт., применение ПОАК (апиксабана, ривароксабана) у пациентов с ФП ассоциировалось с более медленным темпом когнитивного снижения по сравнению с терапией варфарином [7]. Метаанализ C. Zhang и соавт. подтвердил преимущество ПОАК над АВК в снижении риска когнитивных нарушений и деменции у данной категории пациентов [38].
Предполагается, что нейропротективный эффект ПОАК обусловлен ингибированием тромбина, снижением уровня фибрин-амилоидных комплексов и модуляцией нейровоспалительных процессов, что подтверждается молекулярными данными, представленными в исследовании Z. Bian, и соавт. [39]. Важным преимуществом ПОАК в доклинических моделях является отсутствие усиления микрокровоизлияний и когнитивного дефицита, в отличие от варфарина, что подчеркивает их более благоприятный профиль безопасности [40]. Так, в доклинической модели болезни Альцгеймера установлено, что ривароксабан способен оказывать выраженное нейропротективное действие за счёт подавления активности протеиназ-активируемых рецепторов PAR-1 и PAR-2, опосредующих воспалительные и нейротоксические эффекты тромбина. Применение ривароксабана у трансгенных мышей сопровождалось снижением амилоидной нагрузки и уменьшением маркеров нейровоспаления [39]. Эти результаты согласуются с концептуальным обзором K. Grossmann и соавт., в котором подчёркивается роль тромбина как ключевого медиатора цереброваскулярной и нейрональной дисфункции в патогенезе нейродегенеративных заболеваний. Автор рассматривает ПОАК как патогенетическую терапию благодаря их способности блокировать тромбин-опосредованные сигнальные пути, вовлечённые в прогрессирование нейровоспаления и нейродегенерации [41].
Плейотропные свойства ПОАК — резюме
На протяжении последних десятилетий пероральная антикоагулянтная терапия являлась краеугольным камнем профилактики инсульта у пациентов с ФП [42]. Традиционное использование АВК, в частности варфарина, несмотря на клиническую эффективность, сопровождалось рядом ограничений, включая узкое терапевтическое окно, необходимость частого лабораторного контроля и выраженные лекарственные взаимодействия [3][9]. В этой связи внедрение ПОАК, таких как ривароксабан, апиксабан, дабигатран и эдоксабан, стало важным шагом в эволюции антитромботической терапии при ФП [43].
Особое внимание в последние годы уделяется плейотропным свойствам ПОАК, выходящим за пределы их антикоагулянтного действия. В частности, ривароксабан, как ингибитор ФХа, демонстрирует значительный противовоспалительный, ангиопротективный и антиаритмический потенциал, что может иметь важное клиническое значение, особенно у пациентов с коморбидными состояниями [44].
В ряде клинических исследований, включая работу L. Fiedler и соавт., было показано, что профилактическое применение ривароксабана в дозе 10 мг в сутки в течение 30 дней после госпитализации по поводу COVID-19 статистически значимо снижает риск развития новых эпизодов ФП и внезапной сердечной смерти [35]. Эти эффекты могут быть обусловлены способностью ривароксабана модулировать воспалительный каскад и процессы электрического ремоделирования миокарда. Ранее аналогичные плейотропные эффекты ингибиторов ФХа были показаны в экспериментальных моделях, где их применение сопровождалось подавлением экспрессии провоспалительных цитокинов, снижением активности протеаз-активируемых рецепторов и улучшением сосудистой функции [22].
Благоприятное влияние ривароксабана на функциональное состояние эндотелия и морфофункциональную целостность сосудистой стенки может представлять собой один из ключевых механизмов снижения тромбоэмболического риска у пациентов с сердечно-сосудистыми заболеваниями. С учётом ключевой роли эндотелиальной дисфункции в патогенезе атеросклероза, способность прямых ингибиторов ФXa оказывать влияние на воспалительные механизмы, потенциально снижая риск сердечно-сосудистых осложнений и летальности, особенно у пациентов с хроническим сосудистым воспалением и прогрессирующим атеросклерозом [19][44].
Дополнительное направление клинического интереса связано с потенциальной ролью ривароксабана в противовирусной защите. Имеются экспериментальные данные, свидетельствующие о вовлечении фактора Ха в процессы вирусной инвазии, включая протеолитическую активацию спайкового белка SARS-CoV-2, что способствует проникновению вируса в клетки-мишени [29, 45]. Эти наблюдения обосновывают гипотезу о целесообразности включения ингибиторов фактора Ха в состав многофакторной терапии у пациентов с вирусными инфекциями, особенно при наличии высокого риска тромботических осложнений.
У пациентов с ФП, получающих дабигатран [46] отмечается снижение частоты когнитивных и аффективных нарушений. Кроме того, в доклинических моделях болезни Альцгеймера терапия дабигатраном ассоциировалась с уменьшением нейровоспаления и проявлений нейродегенерации [47]. Эти данные свидетельствуют о возможной роли ПОАК в поддержании когнитивного резерва у пациентов с ФП, особенно в условиях возрастного снижения нейрональной пластичности и персистирующего сосудистого воспаления.
Заключение
Таким образом, нарастающий массив данных указывает на то, что ПОАК обладают более широкой фармакологической активностью, чем ранее предполагалось. Наряду с выраженным антикоагулянтным действием, они демонстрируют противовоспалительные, ангиопротективные, нейропротективные, антиаритмические и противовирусные свойства. Это важно, учитывая увеличение за последнее время показаний к приему ПОАК (острый коронарный синдром, профилактика венозных и артериальных тромбозов, профилактика тромботических осложнений при опухолях и др.).
Тем не менее, несмотря на многообещающие результаты, применение ПОАК с целью реализации их плейотропного потенциала требует дальнейшего клинического обоснования. Необходимы рандомизированные контролируемые исследования, направленные на оценку долгосрочного влияния таких эффектов на клинические исходы, включая когнитивную дисфункцию, аритмию, внезапную сердечную смерть и сосудистые осложнения в разных популяциях пациентов с сердечно-сосудистыми и другими заболеваниями.
Список литературы
1. Durand M, Schnitzer ME, Pang M, et al.; Canadian Network for Observational Drug Effect Studies Investigators. Comparative effectiveness and safety of direct oral anticoagulants versus vitamin K antagonists in nonvalvular atrial fibrillation: a Canadian multicentre observational cohort study. CMAJ Open. 2020;8(4): E877-86. DOI:10.9778/cmajo.20200055.
2. Franchini M, Liumbruno GM, Bonfanti C, Lippi G. The evolution of anticoagulant therapy. Blood Transfus. 2016;14(2):175-84. DOI:10.2450/2015.0096-15.
3. Галяутдинов Г.С., Фейсханова Л.И., Абдуллаев Ш.П. Плейотропные эффекты оральных антикоагулянтов. Гематология и трансфузиология. 2019;64(1):90-8. DOI:10.35754/0234-5730-2019-64-1-90-98.
4. Ballestri S, Romagnoli E, Arioli D, et al. Risk and management of bleeding complications with direct oral anticoagulants in patients with atrial fibrillation and venous thromboembolism: a narrative review. Adv Ther. 2023;40(1):41-66. DOI:10.1007/s12325-022-02333-9.
5. Hellfritzsch M., Adelborg K., Damkier P, et al. Effectiveness and safety of direct oral anticoagulants in atrial fibrillation patients switched from vitamin K antagonists: a systematic review and meta-analysis. Basic Clin Pharmacol Toxicol. 2020;126(1):21-31. DOI:10.1111/bcpt.13283.
6. Roguljić H, Arambašić J, Ninčević V, et al. The role of direct oral anticoagulants in the era of COVID-19: are antiviral therapy and pharmacogenetics limiting factors? Croat Med J. 2022;63(3):287-94. DOI:10.3325/cmj.2022.63.287.
7. Lee KH, Yeh JT, Wu ML, et al. Oral anticoagulants and cognitive impairment in patients with atrial fibrillation: a systematic review with meta-analysis and trial sequential analysis. Thromb Res. 2024;238:132-40. DOI:10.1016/j.thromres.2024.04.032.
8. Hindley B, Lip GYH, McCloskey AP, Penson PE. Pharmacokinetics and pharmacodynamics of direct oral anticoagulants. Expert Opin Drug Metab Toxicol. 2023;19(12):911-23. DOI:10.1080/17425255.2023.2287472.
9. Kearon C, Akl EA, Moores L, et al. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016;149(2):315-52. DOI:10.1016/j.chest.2015.11.026.
10. Chan YH, Lee KT, Kao YW, et al. The comparison of non-vitamin K antagonist oral anticoagulants versus well-managed warfarin with a lower INR target of 1.5 to 2.5 in Asian patients with non-valvular atrial fibrillation. PLoS One. 2019;14(3):e0213517. DOI:10.1371/journal.pone.0213517.
11. Connolly SJ, Ezekowitz MD, Yusuf S, et al.; RE-LY Steering Committee and Investigators. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med. 2009;361(12):1139-51. DOI:10.1056/NEJMoa0905561.
12. Patel MR, Mahaffey KW, Garg J, et al.; ROCKET AF Investigators. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med. 2011;365(10):883-91. DOI:10.1056/NEJMoa1009638.
13. Granger CB, Alexander JH, McMurray JJ, et al.; ARISTOTLE Committees and Investigators. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2011;365(11):981-92. DOI:10.1056/NEJMoa1107039.
14. Боева О. И., Кокорин В. А. Прямые оральные антикоагулянты – новый стандарт лечения тромбоз-ассоциированных состояний. Терапия. 2021;7(4):101-13. DOI:10.18565/therapy.2021.4.101-113.
15. Macleod H, Copty N, Doherty D, et al. Direct Oral Anticoagulants Are Comparable to Low Molecular Weight Heparin at Sustaining the Circulating Extracellular Vesicle and Inflammatory Profiles of Cancer Associated Thrombosis Patients: An Observational Pilot Study. Cancer Med. 2025;14(9):e70920. DOI:10.1002/cam4.70920.
16. Zuo P, Zuo Z, Wang X, et al. Factor Xa induces pro-inflammatory cytokine expression in RAW 264.7 macrophages via protease-activated receptor-2 activation. Am J Transl Res. 2015;7(11):2326-34.
17. Shinozawa E, Nakayama M, Imura Y. TAK-442, a Direct Factor Xa Inhibitor, Inhibits Monocyte Chemoattractant Protein 1 Production in Endothelial Cells via Involvement of Protease-Activated Receptor 1. Front Pharmacol. 2018;9:1431. DOI:10.3389/fphar.2018.01431.
18. Bukowska A, Zacharias I, Weinert S, et al. Coagulation factor Xa induces an inflammatory signalling by activation of protease-activated receptors in human atrial tissue. Eur J Pharmacol. 2013;718(1-3):114-23. DOI:10.1016/j.ejphar.2013.09.006.
19. Borissoff JI, Spronk HM, ten Cate H. The hemostatic system as a modulator of atherosclerosis. N Engl J Med. 2011;364(18):1746–60. DOI:10.1056/NEJMra1011670.
20. Kondo H, Abe I, Fukui A, et al. Possible role of rivaroxaban in attenuating pressure-overload-induced atrial fibrosis and fibrillation. J Cardiol. 2018;71(3):310-9. DOI:10.1016/j.jjcc.2017.08.007.
21. Scott L, Li N, Dobrev D. Role of inflammatory signaling in atrial fibrillation. Int J Cardiol. 2019;287:195-200. DOI:10.1016/j.ijcard.2018.10.020.
22. Ellinghaus P, Perzborn E, Hauenschild P, et al. Expression of pro-inflammatory genes in human endothelial cells: Comparison of rivaroxaban and dabigatran. Thromb Res. 2016;142:44-51. DOI:10.1016/j.thromres.2016.04.008.
23. Goette A, Mollenhauer M, Rudolph V, et al. Pleiotropic effects of NOACs with focus on edoxaban: scientific findings and potential clinical implications. Herzschrittmacherther Elektrophysiol. 2023;34(2):142-52. DOI:10.1007/s00399-023-00944-5.
24. Cappato R, Ezekowitz MD, Klein AL, et al.; X-VeRT Investigators. Rivaroxaban vs. vitamin K antagonists for cardioversion in atrial fibrillation: the X-VeRT trial. Eur Heart J. 2014;35(47):3346-55. DOI:10.1093/eurheartj/ehu367.
25. Kirchhof P, Ezekowitz MD, Purmah Y, et al. Effects of Rivaroxaban on Biomarkers of Coagulation and Inflammation: A Post Hoc Analysis of the X-VeRT Trial. TH Open. 2020;4(1):e20-32. DOI:10.1055/s-0040-1701206.
26. Paar V, Jirak P, Gruber S, et al. Influence of dabigatran on pro-inflammatory cytokines, growth factors and chemokines - Slowing the vicious circle of coagulation and inflammation. Life Sci. 2020;262:118474. DOI:10.1016/j.lfs.2020.118474.
27. Lee MH, Koo J, Kwon H, et al. Early apixaban administration considering the size of infarction and functional outcome in acute ischemic stroke. Front Neurol. 2024;15:1302738. DOI:10.3389/fneur.2024.1302738.
28. Kanade GD, Pingale KD, Karpe YA. Activities of Thrombin and Factor Xa Are Essential for Replication of Hepatitis E Virus and Are Possibly Implicated in ORF1 Polyprotein Processing. J Virol. 2018;92(6):e01853-17. DOI:10.1128/JVI.01853-17.
29. Giannis D, Allen SL, Tsang J, et al. Postdischarge thromboembolic outcomes and mortality of hospitalized patients with COVID-19: the CORE-19 registry. Blood. 2021;137(20):2838-47. DOI:10.1182/blood.2020010529.
30. Ramacciotti E, Barile Agati L, Calderaro D, et al.; MICHELLE investigators. Rivaroxaban versus no anticoagulation for post-discharge thromboprophylaxis after hospitalisation for COVID-19 (MICHELLE): an open-label, multicentre, randomised, controlled trial. Lancet. 2022;399(10319):50-9. DOI:10.1016/S0140-6736(21)02392-8.
31. Motloch LJ, Jirak P, Mirna M, et al. Early antithrombotic post-discharge therapy using prophylactic DOAC or dipyridamole improves long-term survival and cardiovascular outcomes in hospitalized COVID-19 survivors. Front Cardiovasc Med. 2022;9:916156. DOI:10.3389/fcvm.2022.916156.
32. Zemer-Wassercug N, Haim M, Leshem-Lev D, et al. The effect of dabigatran and rivaroxaban on platelet reactivity and inflammatory markers. J Thromb Thrombolysis. 2015;40(3):340-6. DOI:10.1007/s11239-015-1245-z. Erratum in: J Thromb Thrombolysis. 2015;40(4):523. DOI:10.1007/s11239-015-1271-x.
33. Mele M, Mele A, Imbrici P, et al. Pleiotropic Effects of Direct Oral Anticoagulants in Chronic Heart Failure and Atrial Fibrillation: Machine Learning Analysis. Molecules. 2024;29(11):2651. DOI:10.3390/molecules29112651.
34. Atzemian N, Kareli D, Ragia G, Manolopoulos VG. Distinct pleiotropic effects of direct oral anticoagulants on cultured endothelial cells: a comprehensive review. Front Pharmacol. 2023;14:1244098. DOI:10.3389/fphar.2023.1244098.
35. Fiedler L, Motloch LJ, Dieplinger AM, et al. Prophylactic rivaroxaban in the early post-discharge period reduces the rates of hospitalization for atrial fibrillation and incidence of sudden cardiac death during long-term follow-up in hospitalized COVID-19 survivors. Front Pharmacol. 2023;14:1093396. DOI:10.3389/fphar.2023.1093396.
36. Gupta A, Watkins A, Thomas P, et al. Coagulation and inflammatory markers in Alzheimer’s and vascular dementia. Int J Clin Pract. 2005;59(1):52-7. DOI:10.1111/j.1742-1241.2004.00143.x.
37. Bezabhe WM, Bereznicki LR, Radford J, et al. Oral anticoagulant treatment and the risk of dementia in patients with atrial fibrillation: A population-based cohort study. J Am Heart Assoc. 2022;11(7):e023098. DOI:10.1161/JAHA.121.023098.
38. Zhang C, Gu ZC, Shen L, et al. Non-vitamin K Antagonist Oral Anticoagulants and Cognitive Impairment in Atrial Fibrillation: Insights From the Meta-Analysis of Over 90,000 Patients of Randomized Controlled Trials and Real-World Studies. Front Aging Neurosci. 2018;10:258. DOI:10.3389/fnagi.2018.00258.
39. Bian Z, Liu X, Feng T, et al. Protective Effect of Rivaroxaban Against Amyloid Pathology and Neuroinflammation Through Inhibiting PAR-1 and PAR-2 in Alzheimer’s Disease Mice. J Alzheimers Dis. 2022;86(1):111-23. DOI:10.3233/JAD-215318.
40. Graff-Radford J, Lesnick T, Rabinstein AA, et al. Cerebral Microbleeds: Relationship to Antithrombotic Medications. Stroke. 2021;52(7):2347-55. DOI:10.1161/STROKEAHA.120.031515.
41. Grossmann K. Direct Oral Anticoagulants (DOACs) for Therapeutic Targeting of Thrombin, a Key Mediator of Cerebrovascular and Neuronal Dysfunction in Alzheimer’s Disease. Biomedicines. 2022;10(8):1890. DOI:10.3390/biomedicines10081890.
42. January CT, Wann LS, Calkins H, et al. 2019 AHA/ACC/HRS Focused Update on the Management of Patients With Atrial Fibrillation: А Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. J Am Coll Cardiol. 2019;74(1):104-32. DOI:10.1016/j.jacc.2019.01.011. Erratum in: J Am Coll Cardiol. 2019;74(4):599. DOI:10.1016/j.jacc.2019.06.034.
43. Ruff CT, Giugliano RP, Braunwald E, et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomised trials. Lancet. 2014;383(9921):955-62. DOI:10.1016/S0140-6736(13)62343-0.
44. Hara T, Fukuda D, Tanaka K, et al. Rivaroxaban, a novel oral anticoagulant, attenuates atherosclerotic plaque progression and destabilization in ApoEdeficient mice. Atherosclerosis. 2015;242(2):639-46. DOI:10.1016/j.atherosclerosis.2015.03.023.
45. Sriram K, Insel PA. Inflammation and thrombosis in COVID-19 pathophysiology: proteinase-activated and purinergic receptors as drivers and candidate therapeutic targets. Physiol Rev. 2021;101(2):545-67. DOI:10.1152/physrev.00035.2020.
46. Cortes-Canteli M, Kruyer A, Fernandez-Nueda I, et al. Long-Term Dabigatran Treatment Delays Alzheimer’s Disease Pathogenesis in the TgCRND8 Mouse Model. J Am Coll Cardiol. 2019;74(15):1910-23. DOI:10.1016/j.jacc.2019.07.081.
47. Caramelli B, Yu PC, Cardozo FAM, et al. Effects of dabigatran versus warfarin on 2-year cognitive outcomes in old patients with atrial fibrillation: results from the GIRAF randomized clinical trial. BMC Med. 2022;20(1):374. DOI:10.1186/s12916-022-02563-2.
48. Jun M, Scaria A, Andrade J, et al. Kidney function and the comparative effectiveness and safety of direct oral anticoagulants vs. warfarin in adults with atrial fibrillation: a multicenter observational study. Eur Heart J Qual Care Clin Outcomes. 2023;9(6):621-31. DOI:10.1093/ehjqcco/qcac069.
Об авторах
П. А. ДавтянРоссия
Давтян Паруйр Артакович
Уфа
Н. Ш. Загидуллин
Россия
Загидуллин Науфаль Шамилевич
Уфа
Рецензия
Для цитирования:
Давтян П.А., Загидуллин Н.Ш. Плейотропные свойства прямых оральных антикоагулянтов — новые горизонты терапии. Рациональная Фармакотерапия в Кардиологии. 2025;21(4):396-403. https://doi.org/10.20996/1819-6446-2025-3212. EDN: HXLSOY
For citation:
Davtian P.A., Zagidullin N.S. Pleiotropic properties of direct oral anticoagulants — new therapeutic horizons. Rational Pharmacotherapy in Cardiology. 2025;21(4):396-403. (In Russ.) https://doi.org/10.20996/1819-6446-2025-3212. EDN: HXLSOY
JATS XML
















































