Перейти к:
Коронарная микрососудистая дисфункция: эпидемиология, клиника, диагностика и лечение
https://doi.org/10.20996/1819-6446-2023-04-02
Аннотация
У значительного числа пациентов с симптомами стенокардии или инфаркта миокарда с ишемическими изменениями в миокарде по результатам инструментальных методов исследования отсутствует гемодинамически значимый стеноз коронарных артерий. В этих случаях как причину ишемической болезни сердца рассматривают вазоспастическую стенокардию или микрососудистую дисфункцию. Коронарная микрососудистая дисфункция (КМД) обусловлена несколькими патологическими механизмами, вызывающими структурные и функциональные нарушения в микрососудистом русле сердца. Клинические группы КМД включают стенокардию и ишемию миокарда без обструктивного поражения коронарных артерий (первичная КМД), в сочетании с обструктивным атеросклерозом коронарных сосудов, при поражении миокарда и ятрогенного характера. Диагностика микрососудистых нарушений проводится на основании результатов неинвазивных и инвазивных методов, позволяющих уточнить характер изменений и выбрать эффективное немедикаментозное и медикаментозное лечение. Прогноз при КМД неблагоприятный, обусловлен развитием сердечно-сосудистых осложнений и смерти, высоким риском инвалидности, снижением качества жизни пациентов.
Ключевые слова
Для цитирования:
Трисветова Е.Л. Коронарная микрососудистая дисфункция: эпидемиология, клиника, диагностика и лечение. Рациональная Фармакотерапия в Кардиологии. 2023;19(2):186-196. https://doi.org/10.20996/1819-6446-2023-04-02
For citation:
Trisvetova E.L. Coronary Microvascular Dysfunction: Epidemiology, Clinical Presentation, Diagnosis and Treatment. Rational Pharmacotherapy in Cardiology. 2023;19(2):186-196. (In Russ.) https://doi.org/10.20996/1819-6446-2023-04-02
Введение
В одном из клинических сценариев хронических коронарных синдромов, понятие о которых предложено Европейским обществом кардиологов (ESC) в 2019 г., описана стенокардия, основу которой составляют микрососудистые нарушения. В практической деятельности в течение многих лет применяют термин «микрососудистой стенокардии», включенный в клиническую классификацию стабильной ишемической болезни сердца (ИБС). Исследования с выполнением коронарной ангиографии больших контингентов пациентов с ангинозной болью в грудной клетке показали, что в половине случаев коронарные артерии не изменены или с незначимыми (<50%) гемодинамическими изменениями, обусловленными атеросклеротическим поражением сосуда. В этих случаях предложено рассматривать один из патофизиологических вариантов стенокардии – вазоспастическую или микрососудистую. Коронарная микрососудистая дисфункция (КМД) возникает как самостоятельная форма ИБС или в сочетании с обструктивным поражением коронарных артерий, при поражении миокарда либо под влиянием других факторов. Характерными признаками КМД являются структурные и функциональные изменения коронарных артериол и капилляров, повышенная чувствительность к вазоконстрикторным стимулам и ограниченная вазодилатационная способность микрососудов. Диагностика проводится преимущественно с применением инструментальных визуализирующих методов: трансторакальная эхокардиография, магнитно-резонансная томография, позитронно-эмиссионная томография, а также внутрикоронарных тестов на вазореактивность. Лечение начинают с изменения образа жизни и контроля факторов риска. Применение антиангинальных, гиполипидемических препаратов обсуждается индивидуально.
Эпидемиология
За истекшие 10-15 лет описание КМД (кардиальный синдром Х, микрососудистая стенокардия) как причины стенокардии у пациентов, часто встречалось в публикациях. Поскольку стандартизация диагностических критериев КМД проведена в 2014-2015 гг., в более ранних исследованиях не отмечалось единого подхода в выявлении патологии. Исследователи нередко диагностировали КМД случайно при наличии болевого синдрома, характерного для типичной или нетипичной стенокардии и результатов ангиографического исследования, свидетельствующих об отсутствии гемодинамически значимого поражения коронарных артерий. В табл. 1 указано количество исследованных пациентов в разные годы авторами, применявших различные методы диагностики КМД для оценки распространенности у мужчин и женщин. Во многих исследованиях отмечали, что у пациентов с ангинозной болью в грудной клетке при коронароангиографии (КАГ) в 10- 30% случаев не обнаруживали гемодинамически значимых стенозов коронарных артерий [1]. В одном из ранних исследований пациентов со стенокардитической болью в грудной клетки и нормальными коронарными артериями при КАГ в 59% случаев (n=120; 158 женщин и 45 мужчин в возрасте 17-78 лет) выявлены патологические реакции на вазодилатирующие препараты (аденозин и ацетилхолин), свидетельствующие о КМД (см. табл. 1) [2]. В другом исследовании при оценке резерва коронарного кровотока (CFR – coronary flow reserve) методом трансторакальной эхокардиографии (ЭхоКГ) у женщин (средний возраст 52,9 года) с болевым синдромом подобным стенокардии и ангиографически не измененными коронарными артериями в 40% случаев выявили снижение показателя как проявление микрососудистой дисфункции. При многомерном регрессионном анализе единственным независимым предиктором КМД оказался показатель толщины эпикардиального жира, чувствительность которого для обнаружения CFR <2 составила 85% и специфичность 75% (р<0,0001) [3].
Table 1. Prevalence of coronary microvascular dysfunction in studies with different testing methods
Таблица 1. Распространенность КМД в исследованиях с разными методами тестирования
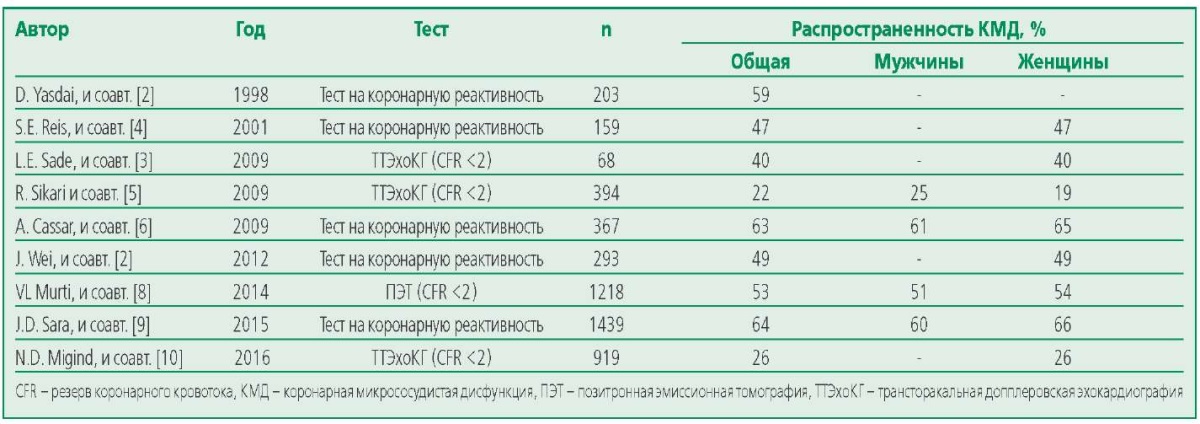
S.E. Reis и соавт. оценивали синдром ишемии у женщин со стенокардией без обструктивного поражения коронарных артерий с помощью теста с внутрикоронарным введением аденозина. Признаки КМД со снижением скорости коронарного кровотока выявили у 47% пациентов, при этом связи с уровнем гормонов, липидов крови, артериальным давлением и фракцией выброса левого желудочка авторы не обнаружили [4].
В выполненных за истекшие годы исследованиях указывают на различную частоту проявлений КМД у мужчин и женщин, вместе с тем большая распространенность заболевания отмечена у женщин в постменопаузальном периоде (см. табл. 1) [5][6]. E. Aribas и соавт. выполнили систематический обзор с целью определения распространенности КМД. Авторы отметили, что в 20 исследованиях по результатам неинвазивных тестов при предположении о наличии КМД (стабильная стенокардия при отсутствии обструктивного поражения коронарных артерий) средняя распространенность составила 43%, с использованием неинвазивных и инвазивных тестов – 28%, достоверный диагноз КМД установлен в 30% случаев. Соотношение мужчин и женщин составило 1:2,5 [11]. Таким образом, распространенность КМД была существенной, вместе с тем ее значение зависит от применяемых методов диагностики и участвующих в исследовании контингентов пациентов. В настоящее время отсутствуют доказательства о наиболее информативном инструментальном методе диагностики КМД.
Клинические симптомы и признаки
У пациентов с КМД возникает типичная, вероятная стенокардия или появляются симптомы эквивалентные приступу стенокардии. Характерными субъективными ощущениями пациентов являются дискомфорт или боль в грудной клетке и/или одышка, появляющиеся при физическом либо эмоциональном напряжении. Боль возникает изредка после прекращения нагрузки или в покое, по характеру давящая или колющая, различная по продолжительности – короткая или в виде длительного дискомфорта в области сердца. Нитроглицерин редко оказывает эффект во время болевого приступа [8][12]. У некоторых пациентов в отсутствии болевого синдрома в грудной клетке КМД диагностируют инструментальными методами [8][9].
Факторы риска традиционные для сердечно-сосудистых заболеваний: дислипидемия, артериальная гипертензия, ожирение, курение, выявляют часто у пациентов с КМД [13]. В исследовании iPOWER (ImProve diagnOsis and treatment of Women with angina pEctoris and micRovessel disease) участвовали 963 женщины со стенокардией без гемодинамически значимых нарушений в коронарных артериях [10]. В 26% случаев выявлено снижение CFR <2 и диагностирована КМД. К факторам риска пациентов с КМД отнесли возраст (постменопаузальный период), курение, артериальную гипертензию, низкий уровень липопротеидов высокой плотности и тахикардию [10][14].
По мнению L. Badimon и соавт., к основным факторам риска КМД при хроническом коронарном синдроме с необструктивным поражением коронарных сосудов относится дислипидемия, ожирение, метаболический синдром и диабет [15].
Определение, диагностические критерии, классификация
КМД рассматривают как многофакторный синдром с вовлечением сосудистых компартаментов диаметром <500 мкм с клиническими проявлениями стенокардии, ишемическими изменениями при электрокардиографическом исследовании, отсутствием обструкции коронарных артерий и с признаками, характерными для нарушения функции микрососудистого русла миокарда [16].
Стандартизация диагностических критериев КМД разработана и согласована на саммитах (2014-2015 гг.) Международной исследовательской группы по коронарным вазомоторным расстройствам (COVADIS – Coronary Vasomotor Disorders International Study Group). В диагностике КМД учитывают следующие признаки:
- наличие симптомов, указывающих на ишемию миокарда;
- объективные признаки ишемии миокарда, выявленные имеющимися на данный момент методами;
- отсутствие обструктивного поражения коронарных артерий (<50% уменьшение диаметра коронарной артерии) и/или фракционный резерв кровотока (FFR – fractional flow reserve) <0,80;
- подтверждение снижения CFR и/или индуцируемого спазма микрососудов [16-18].
Клинические группы заболеваний и состояний, при которых определяют КМД, указаны в табл. 2. В каждой из четырех клинических групп заболеваний и состояний с микрососудистой дисфункцией в ответ на воздействие факторов риска, единичных или комбинации, развиваются функциональные и/или структурные изменения, вызывающие снижение коронарного резерва.
Table 2. Clinical groups and mechanisms of coronary microvascular dysfunction development
Таблица 2. Клинические группы и механизмы развития КМД

Функциональные изменения обусловлены нарушением вазодилатации или вазоспазмом микрососудов. Патологическая вазодилатация появляется в результате эндотелий-зависимых или эндотелий-независимых механизмов с участием вазоактивных факторов, регулируемых клетками эндотелия и вегетативной нервной системой [16]. Вазоспазм развивается из-за повышения концентрации циркулирующих эндогенных вазоконстрикторов, гиперреактивности коронарных артериол, адренергического гипертонуса (рис. 1) [13].
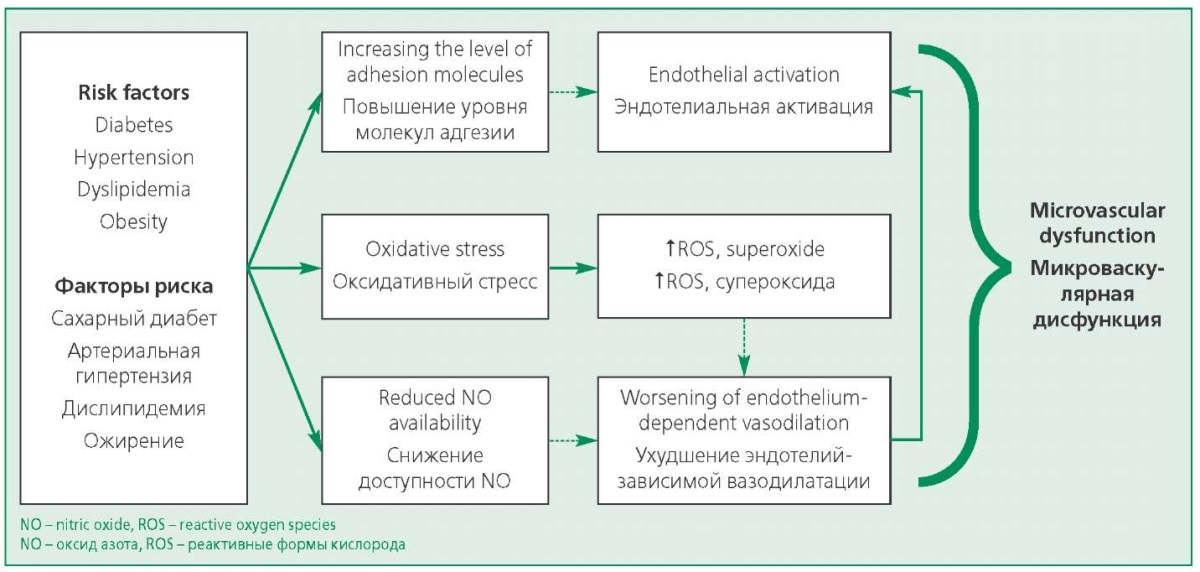
Figure 1. Risk factors influencing the development of coronary microvascular dysfunction
Рисунок 1. Факторы риска, влияющие на развитие КМД
Структурные нарушения, возникающие при КМД, включают ремоделирование артериол и капилляров с уменьшением просвета сосуда, развитие периваскулярного фиброза, оказывающего давление извне на стенки сосудов, рарефикацию сосудов, характерную для гипертрофированного миокарда, отек и инфильтрацию мышцы сердца при миокардите и инфильтративных кардиомиопатиях [13].
Группу 1 описывают как первичную КМД, возникающую при наличии факторов риска, под влиянием которых активируются проявления оксидативного стресса, происходит усиление синтеза активных форм кислорода, с последующей воспалительной реакцией, и снижением активности оксида азота, вызывающих нарушения функции эндотелия и гладкомышечных клеток стенок коронарных артериол, способствующих функциональным и структурным расстройствам в микроциркуляторном русле [19]. Активация RhoA/Rho – киназы, участвующей в развитии КМД, также приводит к выработке реактивных форм кислорода, повышению активности эндотелина-1 и провоспалительному эффекту, вызывающих вазоконстрикцию. Еще один фактор – снижение экспрессии антиоксидантных ферментов, повышение синтеза провоспалительных цитокинов, способствует активации эндотелиальных клеток, повышению адгезии тромбоцитов и лейкоцитов и появлению эндотелиальной дисфункции (см. рис. 1) [13].
При длительном воздействии факторов риска микрососудистая дисфункция развивается независимо от нарушений функции эндотелия. В случае наличия обструктивного поражения крупных коронарных артерий при ИБС микрососудистую дисфункцию рассматривают как независимый фактор риска сердечно-сосудистых осложнений [20]. Существование микрососудистой дисфункции, не проявляющейся стенокардией, нередко инициирует развитие обструктивного поражения эпикардиальных коронарных артерий с образованием атеросклеротических бляшек и тромботических осложнений (рис. 2).
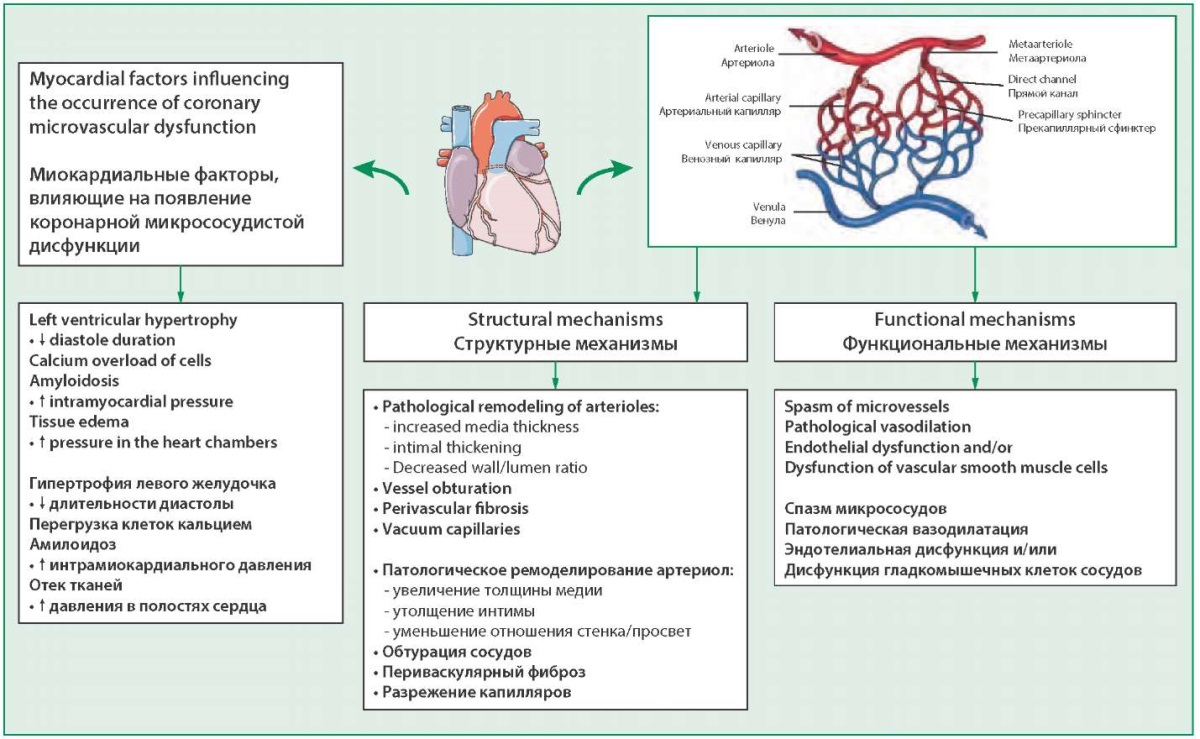
Figure 2. Structural and functional mechanisms of coronary microvascular dysfunction development
Рисунок 2. Структурные и функциональные механизмы развития КМД
В группу 2 включают заболевания миокарда (дилатационная, гипертрофическая кардиомиопатия, кардиомиопатия, возникающая вследствие клапанной дисфункции с гемодинамическими нарушениями и т.п.), состояния и заболевания, сопровождающиеся гипертрофией миокарда (артериальная гипертензия, сахарный диабет, ожирение) с развитием гипертрофии кардиомиоцитов, появлением интерстициального и периваскулярного фиброза, снижением плотности распределения капилляров (рарефикация) и повышением жесткости стенок артерий [21-23]. Вследствие возникших нарушений диффузия газов из-за разрежения капилляров затруднена, повышенная потребность миокарда в кислороде не удовлетворяется доставкой, появляются признаки ишемии миокарда.
В группе 3 описывают микроваскулярную дисфункцию при обструктивном поражении коронарных артерий. При стабильном течении ИБС или остром коронарном синдроме степень и тяжесть микрососудистой дисфункции в постстенотических участках определяют вариабельность клинически манифестирующей ишемии миокарда [23].
Так доказано, что после успешной чрескожной коронарной ангиопластики и установки стента, симптомы стенокардии могут сохраняться из-за наличия микрососудистой дисфункции [18]. У пациентов с острым коронарным синдромом без подъема сегмента ST микрососудистая дисфункция в постстенотическом регионе оказывает влияние на взаимодействие сосудистой стенки с повышением активности тромбоцитов, воспаление и нарушения кровотока [23][24].
Группа 4 включает пациентов после успешного чрескожного коронарного вмешательства (ЧКВ) с микрососудистой дисфункцией, развившейся в результате микроэмболизации остатками атеросклеротической бляшки или тромба, взывающих обструкцию просвета сосуда. Сосудосуживающий эффект появляется после ЧКВ в связи с повышением активности альфа-адренорецепторов и, вследствие того, повышением резистентности микрососудов [23].
В случае острого коронарного синдрома с подъемом сегмента ST после чрескожного коронарного вмешательства микрососудистая дисфункция в области миокарда, кровоснабжаемого повторно открывшейся инфаркт-связанной артерии, приводит к феномену «noreflow» в 5-50% случаев [23]. Феномен «no-reflow» обусловлен структурными и функциональными нарушениями микроциркуляции и внесосудистой компрессией. Отек эндотелия, микроагрегаты, состоящие из нейтрофилов и тромбоцитов, могут вызывать обструкцию сосудов, усугубляющуюся под влиянием оксидативного стресса, цитокинов, вегетативного дисбаланса и дистальных эмболов. К тому же возникает компрессия интрамуральных сосудов вследствие интерстициального отека и кровоизлияний из-за выхода лейкоцитов из кровеносного русла, набухание кардиомиоцитов и сокращение миофибрилл.
Различные механизмы, участвующие в развитии КМД, у всех групп пациентов появляются последовательно или одновременно.
В развитии КМД участвуют внесосудистые механизмы, которые включают повышение частоты сердечных сокращений, уменьшение времени диастолической перфузии, снижение артериального давления и компрессию сосудов во время систолы, наиболее выраженную в эндокарде [21].
Объективизация ишемии миокарда
Согласно рекомендациям по диагностике и лечению хронических коронарных синдромов пациентам с признаками предтестовой вероятности наличия ИБС с необструктивными изменениями коронарных артерий рекомендовано пройти неинвазивное диагностическое обследование [18]. Ишемию миокарда необходимо подтвердить результатами ЭхоКГ исследования в покое и в условиях стресса, при неинвазивной визуализации, оценивая перфузию миокарда методом однофотонной эмиссионной компьютерной томографии или магнитно-резонансной томографии (МРТ).
Признаками ишемии миокарда считают смещение сегмента ST на ЭКГ, появление приступа стенокардии, преходящие дефекты перфузии миокарда (в 20-30% случаев), аномалии движения стенок (гипокинезия) встречаются редко [20]. В настоящее время in vivo ни один из диагностических методов не рассчитан на визуализацию анатомических особенностей коронарной микроциркуляции, поэтому оценка основывается на результатах исследования миокардиального кровотока и CFR. В табл. 3 представлены методы исследования и признаки, указывающие на наличие КМД.
Table 3. Clinical signs and results of the main instrumental studies, suggesting the presence of coronary microvascular dysfunction
Таблица 3. Клинические признаки и результаты основных инструментальных исследований, позволяющие предполагать наличие КМД

Диагноз определенной КМД возможен в случае выявления всех четырех критериев, подозрение на КМД – в случае обнаружения критериев 1, 2, критерия 3 (а) или 4 (б) [16].
Методы диагностики КМД
Диагностика КМД проводится на основании жалоб, данных анамнеза с выявлением факторов риска и результатов комплексного обследования инвазивными и неинвазивными инструментальными методами. В случае подозрения на КМД рекомендуют не ограничиваться выявленными симптомами стенокардии и результатами КАГ, необходимо выполнить доступный спектр исследований [24].
Ишемию миокарда выявляют по результатам нагрузочных тестов и мониторирования ЭКГ. При проведении ЭКГ с нагрузкой (велоэргометрия) признаком ишемии миокарда является горизонтальная или косонисходящая депрессия сегмента ST c амплитудой ≥ 1 мм в двух соседних отведениях, локализующейся в ≥ 60-80 миллисекундах от конца комплекса QRS (от точки J) во время или вскоре после прекращения нагрузки. В случае вазоспазма на высоте нагрузки определяют транзиторный подъем сегмента ST не менее чем на 0,1 Мв в двух и более отведениях.
Оценка микрососудистой дисфункции проводится по результатам исследования нарушений микроциркуляции, определяемой по величине CFR и индекса микрососудистой резистентности (IMR – microvascular resistance index) методами трансторакальной допплеровской ЭхоКГ, МРТ или позитронно-эмиссионной томографии (ПЭТ); и артериолярной дисрегуляции, выявляемой по функции эндотелия коронарной микроциркуляции методом селективного интракоронарного введения ацетилхолина [19][24]. В случае дисфункции эндотелия сосудов или нарушения функции гладкомышечных клеток эндотелий-зависимый вазодилататор ацетилхолин вызовет спазм микрососудов и появление симптомов стенокардии, иногда с ишемическими изменениями на ЭКГ, снижением скорости коронарного кровотока [19].
Метод трансторакальной (или чреспищеводной) допплеровской ЭхоКГ служит скрининг-тестом для выявления значительных нарушений КМД. ЭхоКГ исследование позволяет определить CFR, представленного отношением скорости коронарного кровотока (в дистальном отделе левой передней нисходящей артерии) во время максимальной коронарной вазодилатации, вызванной внутривенно введенным препаратом (аденозином или дипиридамолом) к скорости коронарного кровотока в покое. В нормальных условиях скорость коронарного кровотока увеличивается в 3-4 раза в ответ на повышенные потребности миокарда в кислороде. При КМД величина CFR – показателя, отражающего способность коронарного кровотока соответствовать метаболической потребности миокарда, снижается до <2-2,5 (рис. 3) [25]. Применяемый при пробе дипиридамол (или аденозин) ингибирует фосфодиэстеразу, увеличивает концентрацию в клетке аденозинмонофосфата и циклического гуанозинмонофосфата, вызывающих расширение коронарных сосудов. Показатель CFR отражает способность к вазодилатации коронарных эпикардиальных и микрососудов, следовательно, необходимо оценивать и FFR, отражающего степень стеноза эпикардиальных артерий [26]. Результаты исследования резерва коронарного кровотока методом ЭхоКГ сопоставимы с показателями, полученными при инвазивных внутрикоронарных исследованиях с помощью допплеровского потока и ПЭТ [25][27].
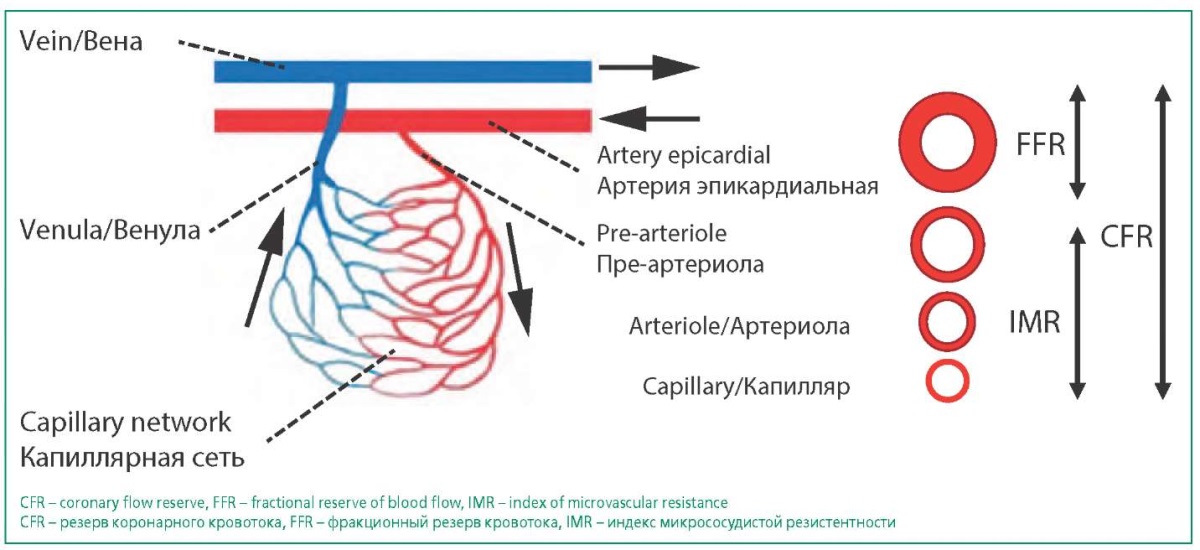
Figure 3. Functional components of diagnostic tests
Рисунок 3. Функциональные компоненты диагностических тестов
Помимо ЭхоКГ метода исследования для оценки CFR применяют инвазивный метод оценки, позволяющий измерять и коронарное микрососудистое сопротивление. Коронарное микрососудистое сопротивление выражается в виде IMR и наряду с коронарной микрососудистой функцией измеряется на основании записи скорости коронарного кровотока с использованием интракоронарной допплерографии в сочетании с устройством давления/термодилюции на фоне введения вазодилататора (аденозина или регадонозона) [19][27].
CFR рассчитывается также, как при ЭхоКГ исследовании, на основании отношения значений среднего времени транзита при гиперемии и в покое. IMR определяют при максимальной гиперемии как произведение дистального коронарного давления на среднее время транзита. КМД указанным методом диагностируют при пороговых значениях IMR ≥25 и CFR <2,0 [18][19].
Позднее предложен метод изучения коронарного кровотока, эпикардиальной и микрососудистой резистентности, основанный на термодилюции и непрерывном введении физиологического раствора через катетер (RayFlow) в коронарную артерию [2][28].
Среди неинвазивных методов исследования коронарной микроциркуляции перфузионная ПЭТ является эталонным исследованием для количественной оценки кровотока миокарда, поскольку оценивается в мл/мин на г массы миокарда [18][20]. ПЭТ выполняют в состоянии покоя и во время фармакологически индуцированной максимальной вазодилатации с использованием радиотреисеров – низкомолекулярных пре ̆ - паратов 13N‐аммоний, 15O‐H2O и 82Rb, накопление которых в миокарде зависит от объёмной скорости миокардиального кровотока. Метод позволяет выявлять повсеместное неоднородное распределение дефектов перфузии, не ограничивающихся зоной одной коронарной артерии. Дефекты перфузии указывают на нарушения расслабления гладких мышц стенок артериальных микрососудов и снижение коронарного кровотока у пациентов с незначимыми гемодинамически поражениями коронарных артерий [20][21].
Методом компьютерной томографии и МРТ сердца с гадолинием оценивается индекс резерва перфузии миокарда (MPRI), т.е. помимо визуализации транзита контраста и выявления снижения перфузии с помощью кинетического моделирования рассчитывают количественные показатели в мл/мин/г [27]. Преимущества МРТ включают высокое пространственное разрешение, которое позволяет характеризовать трансмуральный кровоток миокарда, комплексную оценку структуры и функции сердца и сосудов, отсутствие ионизирующего излучения. MPRI является полуколичественной суррогатной результирующей, отражающей способность коронарных микрососудов к вазодилатации, и его величина ≤1,84 имеет диагностическое значение для прогноза при КМД [29][30]. Величина MPRI≤1,47 связана с развитием неблагоприятных сердечно-сосудистых событий [31].
Показатели основных инструментальных методов исследования служат для дифференциальной диагностики микрососудистой и вазоспастической стенокардии. Согласно Рекомендациям ESC 2019 г. при подозрении на микроваскулярную стенокардию проводят следующие исследования:
- измерение резерва коронарного кровотока и/или микрососудистой резистентности у пациентов с сохраняющимися симптомами и ангиографически неизмененными коронарными артериями, либо с умеренными стенозами и сохраненным моментальным резервом кровотока/FFR (Класс рекомендаций IIa уровень доказательности В);
- внутрикоронарное введение ацетилхолина с мониторированием ЭКГ во время ангиографии для оценки микрососудистого спазма в случае ангиографически неизмененных коронарных артерий, либо с умеренными стенозами и сохраненным моментальным резервом кровотока/фракционным резервом кровотока (Класс рекомендаций IIb уровень доказательности В);
- трансторакальную допплеровскую ЭхоКГ передней нисходящей коронарной артерии, МРТ и ПЭТ выполняют для неинвазивной оценки коронарного резерва кровотока (Класс рекомендаций IIb уровень доказательности В) [18].
Лечение
Лечение КМД представляет сложную задачу из-за незначительного количества публикаций по эффективности проводимой терапии, малой выборки пациентов и гетерогенности контингентов, участвующих в исследованиях, отсутствия рандомизированных исследований [27].
В случае выявления факторов сердечно-сосудистого риска лечение при КМД направлено на коррекцию диагностированных нарушений липидного, углеводного обмена, снижение массы тела, повышение физической активности, контроль артериального давления, и других факторов.
Современный подход к лечению включает применение антиангинальных и антиатеросклеротических лекарственных средств, рекомендованных для пациентов с ИБС [18].
Статины, ингибиторы ангиотензинпревращающего фермента (АПФ) или блокаторы рецепторов ангиотензина II, низкие дозы аспирина относятся к лекарственным средствам для вторичной профилактики осложнений, обусловленных развитием атеросклеротических и тромботических изменений в коронарных артериях.
Статины обладают гиполипидемическими свойствами и проявляют плейотропные эффекты (противовоспалительный, антитромботический, антиоксидантный, уменьшают дисфункцию эндотелия). В двух исследованиях показано, что аторвастатин у пациентов с КМД улучшал CFR, при применении в течение 2 или 6 мес [32][33].
Ингибиторы АПФ, блокируя активность ренин-ангиотензин-альдостероновой системы, уменьшают вазоконстрикцию, повышают толерантность к физической нагрузке и уменьшают симптомы стенокардии при микроваскулярной дисфункции [34][35]. У пациентов с артериальной гипертензией и КМД, получавших ингибиторы АПФ в течение 12 мес, отметили улучшение CFR и эндотелиальной функции, по результатам эндомиокардиальной биопсии выявили структурную перестройку коронарных артериол и регресс периартериолярного фиброза [36].
Лечение микрососудистой стенокардии направлено на основной механизм развития микрососудистой дисфункции. В случае снижения CFR <2,0 или повышения IMR ≥25 ед. и отрицательного ацетилхолинового теста применяют бета-адреноблокаторы, ингибиторы АПФ и статины [18].
При преобладании вазоспазма с проявлениями в виде стенокардии и ишемических изменений на ЭКГ при выполнении теста с ацетилхолином, препаратами выбора являются блокаторы кальциевых каналов (нифедипин) и нитраты длительного действия [18].
Бета-адреноблокаторы снижают потребление миокардом кислорода и увеличивают время диастолического наполнения. Они особенно эффективны в случаях повышения адренергической активности у пациентов с высокой частотой сердечных сокращений, повышенным артериальным давлением [29]. В исследованиях показано улучшение функции эндотелия при применении карведилола – препарата, блокирующего α- и ß-адренорецепторы, и проявляющего антиоксидантные свойства [38].
Блокаторы кальциевых каналов относятся к препаратам первой линии для лечения стенокардии, их назначают при непереносимости или противопоказаниях для назначения бета-адреноблокаторов [18]. При преобладании вазоспазма с проявлениями в виде стенокардии и ишемических изменений на ЭКГ при выполнении теста с ацетилхолином, но без выраженного эпикардиальноговазоспазма, препаратами выбора являются блокаторы кальциевых каналов (нифедипин) и менее эффективные нитраты длительного действия [18][37].
Ранолазин – антиангинальный препарат второй линии, ингибитор позднего тока ионов натрия в клетках миокарда, снижает уровень внутриклеточного кальция, что улучшает расслабление миокарда желудочков [40]. Одно пилотное исследование показало, что у женщин без обструктивного поражения коронарных артерий ранолазин уменьшал симптомы стенокардии и улучшал CFR при низких показателях [41]. В другом исследовании у 46 пациентов со стабильной стенокардией и не измененными коронарными артериями со сниженным CFR <2,5 на фоне применения ранолазина 375 мг два раза в день увеличилось время до появления депрессии сегмента ST и продолжительность физической нагрузки, но не отмечено улучшения КМД [42]. В 2019 г. H. Zhu и соавт. на основании мета-анализа рандомизированных исследований сравнительной эффективности ранолазина, ивабрадина и никорандила у пациентов с КМД отметили улучшение глобальной MPRI на фоне применения ранолазина, снижение IMR при лечении никорандилом. Проявления стенокардии уменьшились на фоне применения ранолазина или ивабрадина [43].
Поскольку рокиназный путь описан в развитии эндотелиальной дисфункции, спазма гладких мышц стенок сосудов и накоплении клеток воспаления в адвентиции, при вазоспастической стенокардии применяли фасудил – селективный ингибитор RhoA/Rhoкиназы [44]. Предварительные исследования показали эффективность препарата при эпикардиальном и микрососудистом спазме у пациентов, получавших фасудил. На фоне лечения препаратом пациентов с КМД и вазоспастической стенокардией исчезли признаки ишемии миокарда при пробе с ацетилхолином. Возможно, в дальнейшем при продолжении исследований фасудила будут получены убедительные доказательства эффективности препарата при КМД.
Результаты исследования эмпаглифлозина – ингибитора глюкозо-натриевого котранспортера 2 (SGLT2), гипогликемического препарата с многочисленными плейотропными свойствами, влияющими на сердечно-сосудистые осложнения и смертность при сахарном диабете 2 типа, свидетельствуют о его положительном эффекте при КМД [45][46]. Авторы отметили участие препарата в регуляции сокращения и расслабления сердца у пациентов с сахарным диабетом 2 типа и сердечной недостаточностью с сохраненной фракцией выброса, снижение частоты неблагоприятных сердечно-сосудистых событий у пациентов с высоким риском.
Ингибитор фосфодиэстеразы типа 5, силденафил, усиливает эффекты оксида азота, ингибируя распад циклического гуанозинмонофосфата, вызывая расслабление гладких мышц. Так, увеличение CFR после введения препарата отмечено у пациентов с нарушением микрососудистой функции [47]. Рандомизированных клинических исследований, подтверждающих эффективность силденафила при КМД, не проводили.
Показания для назначения ингибиторов тромбоцитов для лечения КМД не установлены, тем не менее применение аспирина нередко оправдано поскольку возможно атеросклеротическое поражение коронарных артерий при ИБС. Тикагрелор – селективный и обратимый антагонист Р212 рецептора к аденозиндифосфату, благодаря аденозин-опосредованным эффектам, вызывает вазодилатацию и в экспериментальных работах улучшает эндотелиальную функцию [48]. Исследования L-аргинина у пациентов с необструктивной ИБС, получавших препарат в течение шести месяцев, показали, что улучшается функция эндотелия, коронарный кровоток и качество жизни, вместе с тем не наблюдали улучшения CFR [49].
Таким образом, не существует универсального подхода для лечения пациентов с КМД, в каждом случае необходимо после уточнения патофизиологических механизмов применять персонифицированную терапию.
Прогноз
В настоящее время известно, что КМД ассоциируется с неблагоприятными сердечно-сосудистыми осложнениями и исходом, включая инфаркт миокарда, высокий риск инвалидности, повторные госпитализации по поводу стенокардии, увеличение смертности, снижение качества жизни.
J.A. Suwaidi и соавт. отметили, что по сравнению с пациентами с легкой дисфункцией эндотелия в случае тяжелой эндотелиальной дисфункции при микрососудистой стенокардии, выявленной на основании результатов теста с ацетилхолином, без обструктивного поражения коронарных артерий у 14% пациентов приступы стенокардии возникали часто, развивался инфаркт миокарда [50]. В другом исследовании из 147 пациентов c КМД и эндотелиальной дисфункцией по результатам теста с ацетилхолином, в 30% случаев за 10-ти летний период наблюдения появилась ИБС с обструктивным поражением коронарных артерий и неблагоприятными сердечно-сосудистыми событиями [51]. Авторы отметили, что положительные тесты на вазореактивность коронарных микрососудов являлись независимыми предикторами плохого прогноза.
В исследовании WISE (Women's Ischemia Syndrome Evaluation) в течение 5,2 лет наблюдали женщин с синдромом ишемии без обструктивного поражения коронарных артерий по данным КАГ [4][52]. По сравнению с бессимптомными женщинами, не страдающими сердечно-сосудистыми заболеваниями, в исследуемой группе у пациентов отметили большую распространенность ожирения, артериальной гипертензии, сахарного диабета, наследственной отягощенности по сердечно-сосудистым заболеваниям. Среднегодовая частота сердечно-сосудистых событий, встречавшихся часто у женщин с четырьмя и более факторами риска, за 5 лет составила 25,3% при необструктивной ИБС (стеноз любой коронарной артерии 1-49%), 13,9% при неизмененных коронарных артериях, и 6,5% при отсутствии симптомов.
При исследовании КМД C. Ozcan и соавт. показали связь микрососудистых нарушений с фибрилляцией предсердий и сердечной недостаточностью с сохраненной фракцией выброса [53]. Авторы отметили частую встречаемость КМД у пациентов с фибрилляцией предсердий, доказали, что нарушения в микрососудистом русле миокарда являются предикторами фибрилляции предсердий и сердечной недостаточности с сохраненной фракцией выброса, обусловливающих высокий риск смертности и госпитализации в связи с обострением синдромов.
Заключение
Исследования коронарного кровотока показали, что у многих пациентов с необструктивным коронарным атеросклерозом встречается КМД, проявляющаяся микрососудистой стенокардией или протекающая бессимптомно. Инструментальные методы диагностики позволяют диагностировать с качественной и количественной оценкой кровоток в миокарде и определять клиническую форму КМД, протекающую как первичный процесс, в сочетании с обструктивным поражением коронарных артерий, изменениями миокарда или в результате ятрогенных воздействий. За прошедшее десятилетие выявлен неблагоприятный прогноз КМД с прогрессированием атеросклероза и развитием сердечной недостаточности, серьезных сердечно-сосудистых событий, снижением качества жизни пациентов. Улучшения сердечно-сосудистых исходов достигают персонализированным лечением с учетом состояния функции эндотелия и других показателей.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Список литературы
1. Farrehi PM, Bernstein SJ, Rasak M, et al. Frequency of negative coronary arteriographic findings in patients with chest pain is related to community practice patterns. Am J Manag Care. 2002;8(7): 643-8.
2. Hasdai D, Holmes DR, Higano ST, et al. Prevalence of coronary blood flow reserve abnormalities among patients with nonobstructive coronary artery disease and chest pain. Mayo Clin Proc. 1998;73(12):1133-40. DOI:10.4065/73.12.1133.
3. Sade LE, Eroglu S, Bozbas H, et al. Relation between epicardial fat thickness and coronary flow reserve in women with chest pain and angiographically normal coronary arteries. Atherosclerosis. 2009;204(2):580-5. DOI:10.1016/j.atherosclerosis.2008.09.038.
4. Reis SE, Holubkov R, Conrad Smith AJ, et al. Coronary microvascular dysfunction is highly prevalent in women with chest pain in the absence of coronary artery disease: Results from the NHLBI WISE study. Am Heart J. 2001;141(5):735-41. DOI:10.1067/mhj.2001.114198.
5. Sicari R, Rigo F, Cortigiani L, et al. Additive prognostic value of coronary flow reserve in patients with chest pain syndrome and normal or near-normal coronary arteries. Am J Cardiol. 2009;103(5):626- 31. DOI:10.1016/j.amjcard.2008.10.033.
6. Cassar A, Chareonthaitawi P, Richal SS, et al. Lack of correlation between non-invasive stress tests and invasive coronary vasomotor dysfunction in patients with non-obstructive coronary artery disease. Circ Cardiovasc Interv. 2009;2(3):237-244. DOI:10.1161/CIRCINTERVENTIONS.108.841056.
7. Wei J, Mehta PK, Johnson BD, et al. Safety of coronary reactivity testing in women with no obstructive coronary artery disease: results from the NHLBI-sponsored WISE (Women’s Ischemia Syndrome Evaluation) study. JACC Cardiovasc Interv. 2012;5(6):646-53. DOI:10.1016/j.jclin.2012.01.023.
8. Murthy VL, Naya M, Taqueti VR, et al. Effects of sex on coronary microvascular dysfunction and cardiac outcomes. Circulation. 2014;129:2518-27. DOI:10/1161/CIRCULATIONAHA.113.008507.
9. Sara GD, Widmer RJ, Matsuzawa Y, et al. Prevalence of Coronary Microvascular Dysfunction Among Patients With Chest Pain and Nonobstructive Coronary Artery Disease. JACC Cardiovasc Interv. 2015;8(11):1445-53. DOI:10.1016/j.jcin.2015.06.017.
10. Mygind ND, Michelsen MM, Pena A, et al. Coronary microvascular function and cardiovascular risk factors in women with angina pectoris and no obstructive coronary artery disease: The iPOWER Study. J Am Heart Assoc. 2016;5(3):e003064. DOI:10.1161/JAHA.115003064.
11. Aribas E, Roeters van Lennep JE, Elias-Smale SE, et al. Prevalence of microvascular angina among patients with stable symptoms in the absence of obstructive coronary artery disease: a systematic review. Cardiovasc Res. 2022;118(3):763-71. DOI:10.1093/cvr/cvab061.
12. Ong P, Athanasiadis A, Borgulya GI, et al. Clinical usefulness, angiographic characteristics, and safety evaluation of intracoronary acetylcholine provocation testing among 921 consecutive white patients with unobstructed coronary arteries. Circulation. 2014;129(17):1723-30. DOI:10.1161/CIRCULATIONAHA.113.004096.
13. Crea F, Montone RA, Rinaldi R. Pathophysiology of Coronary Microvascular Dysfunction. Circ J. 2022;86(9):1319-28. DOI:10.1253/circj.CJ-21-0848.
14. Wessel TR, Arant CB, McGorray SP, et al. Coronary microvascular reactivity is only partially by atherosclerosis risk factors or coronary artery disease in women evaluated for suspected ischemia: results from the NHLBI Women's Ischemia Syndrome Evaluation (WISE). Clin Cardiol. 2007;30(2):69-74. DOI:10.1002/clc.19.
15. Badimon L, Bugiardini R, Cenko E, et al. Position paper of the European Society of Cardiologyworking group of coronary pathophysiology and microcirculation: obesity and heart disease. Eur Heart J. 2017;38(25):1951-8. DOI:10.1093/eurhertj/ehx181.
16. Ong P, Camici PG, Beltrame JF, et al. International standardization of diagnostic criteria for microvascular angina. Int J Cardiol. 2018;250:16-20. DOI:10.1016/j.ijcard.2017.08.068.
17. Montalescot G, Sechtem U, Achenbach S, et al. 2013 ESC guidelines on the management of stable coronary artery disease: the Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J. 2013;34(38):2949-3003. DOI:10.1093/eurheartj/egt296.
18. Knuuti J, Wijns W, Saraste A, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020;41(3):407-77. DOI:10.1093/eurheartj/ehz425.
19. Lanza GA, De Vita A, Kaski JC. ‘Primary’ microvascular angina: clinical characteristics, pathogenesis and management. Interv Cardiol. 2018;13(3):108-11. DOI:10.15420/icr.2018.15.2.
20. Lu DY, Yalcin H, Yalcin F, et al. Stress myocardial blood flow heterogeneity is a positron emission tomography biomarker of ventricular arrhythmias in patients with hypertrophic cardiomyopathy. Am J Cardiol. 2018;121(9):1081-9. DOI:10.1016/j.amjcard.2018.01.022.
21. Cecchi F, Olivotto I, Gistri R, et al. Coronary microvascular dysfunction and prognosis in hypertrophic cardiomyopathy. N Engl J Med. 2003;349(11):1027-35. DOI:10.1056/NEJMoa025050.
22. Celeng C, Leiner T, Maurovich-Horvat P, et al. Anatomical and functional computed tomography for diagnosing hemodynamically significant coronary artery disease: a meta-analysis. JACC Cardiovasc Imaging. 2019;12(7 Pt 2):1316-25. DOI:10.1016/j.jcmg.2018.07.022.
23. Godo S, Suda A, Takahashi J, et al. Coronary Microvascular Dysfunction. Arterioscler Tromb Vasc Biol. 2021;41(5):1625-37. DOI:10.1161/ATVBAHA.121.316025.
24. Montecucco F, Carbone F, Schindler TH. Pathophysiology of ST-segment elevation myocardial infarction: novel mechanisms and treatments. Eur Heart J. 2016;37(16):1268-83. DOI:10.1093/eurheartj/ehv592.
25. Padro T, Manfrini O, Bugiardini R, et al. ESC Working Group on Coronary Pathophysiology and Microcirculation position paper on ‘coronary microvascular dysfunction in cardiovascular disease. Cardiovasc Res. 2020;116(4):741-55. DOI:10.1093/cvr/cvaa003.
26. Carbon A, D’Andrea A, Sperlongano S, et al. Echocardiographic assessment of coronary microvascular dysfunction: basic concepts, technical aspects and clinical conditions. Echocardiography. 2021;38(6):993-1001. DOI:10.1111/echo.15059.
27. Chen C, Wei J, AlBadri A, et al. Coronary Microvascular Dysfunction – Epidemiology, Pathogenesis, Prognosis, Diagnosis, Risk Factors and Therapy. Circ J. 2016;81(1):3-11. DOI:10.1253/circj.CJ16-1002.
28. Xaplanteris P, Fournier S, Keulards DCJ, et al. Catheter-Based Measurements of Absolute Coronary Blood Flow and Microvascular Resistance: Feasibility, Safety, and Reproducibility in Humans. Circ Cardiovasc Interv. 2018;11(3):e006194. DOI:10.1161/CIRCINTERVENTIONS.117.006194.
29. Schindler TH, Dilsizian V. Coronary Microvascular Dysfunction: Clinical Considerations and Noninvasive Diagnosis. J Am Coll Cardiol Img. 2020;13(1 Pt 1):140-155. DOI:10.1016/j.jcmg.2018.11.036.
30. Wöhrle J, Nusser T, Merkle N, et al. Myocardial perfusion reserve in cardiovascular magnetic resonance: Correlation to coronary microvascular dysfunction. J Cardiovasc Magn Reson. 2006;8(6):781-7. DOI:10.1080/10976640600737649.
31. Zhou W, Lee JCY, Leung ST, et al. Long-Term Prognosis of Patients with Coronary Microvascular Disease Using Stress Perfusion Cardiac Magnetic Resonance. JACC Cardiovasc Imaging. 2021;14(3):602-11. DOI:10.1016/j.jcmg.2020.09.304.
32. Caliskan M, Erdogan D, Gullu H, et al. Effects of atorvastatin on coronary flow reserve in patients with slow coronary flow. Clin Cardiol. 2007;30(9):475-9. DOI:10.1002/clc.20140.
33. Eshtehardi P, McDaniel MC, Dhawan SS, et al. Effect of intensive atorvastatin therapy on coronary atherosclerosis progression, composition, arterial remodeling and microvascular function. J Invasive Cardiol. 2012;24(10):522-9.
34. Pizzi C, Manfrini O, Fontana F, Bugiardini R. Angiotensin-converting enzyme inhibitors and 3-hydroxy-3-methylglutaryl coenzyme A reductase in cardiac Syndrome X: role of superoxide dismutase activity. Circulation. 2004;109(1):53-8. DOI:10.1161/01.CIR.0000100722.34034.E4.
35. Pauly DF, Johnson BD, Anderson RD, et al. In women with symptoms of cardiac ischemia, nonobstructive coronary arteries, and microvascular dysfunction, angiotensin-converting enzyme inhibition is associated with improved microvascular function: A double-blind randomized study from the National Heart, Lung and Blood Institute Women's Ischemia Syndrome Evaluation (WISE). Am Heart J. 2011;162(4):678-784. DOI:10.1016/j.ahj.2011.07011.
36. Schwartzkopff B, Brehm M, Mundchenke M, Strauer BE. Repair of Coronary Arterioles After Treatment with Perindopril in Hypertensive Heart Disease. Hypertension. 2000;36(2):220-5. DOI:10.1161/01.HYP.36.2.220.
37. Kunadian V, Chieffo A, Gamici PG, et al. An EAPCI Expert Consensus Document on Ischaemia with Non-Obstructive Coronary Arteries in Collaboration with European Society of Cardiology Working Group on Coronary Pathophysiology & Microcirculation Endorsed by Coronary Vasomotor Disorders International Study Group. Eur Heart J. 2020;41(37):3504-20. DOI:10.1093/eurheartj/ahaa503.
38. Matsuda Y, Akita H, Terashima M, et al. Carvedilol improves endothelium-dependent dilatation in patients with coronary artery disease. Am Heart J. 2000;140(5):753-9. DOI:10.1067/mhj.2000.110093.
39. Merz CNB, Pepine CJ, Shimokawa H, Berry C. Treatment of coronary microvascular dysfunction. Cardiovasc Res 2020;116(4):856-70. DOI:10.1093/cvr/cvaa006.
40. Hazenfuss G, Mayer LS. Mechanism of action of the new anti-ischemia drug ranolazine. Clin Res Cardiol. 2008;97(4):222-6. DOI:10.1007/s00392-007-0612-y.
41. Mehta PK, Goykhman P, Thomson LJ, et al. Ranolazine improves angina in women with evidence of myocardial ischemia but no obstructive coronary artery disease. JACC Cardiovasc Imaging. 2011;4(5):514-22. DOI:10.1016/j.jcmg.2011.03.007.
42. Villano A, DiFranco A, Nerla R, et al. Effects of ivabradine and ranolazine in patients with microvascular angina pectoris. Am J Cardiol. 2013;112(1):8-13. DOI:10.1016/j.amjcard.2013.02.045.
43. Zhu H, Xu X, Fang X, et al. Effects of the Antianginal Drugs Ranolazine, Nicorandil, and Ivabradine on Coronary Microvascular Function in Patients With Nonobstructive Coronary Artery Disease: A Meta-analysis of Randomized Controlled Trials. Clin Ther. 2019;41(10):2137-52.e12. DOI:10.1016/j.clinthera.2019.08.008.
44. Mochri M, Shimokawa H, Hirakawa Y, et al. Rho-kinase inhibition with intracoronary fasudil prevents myocardial ischemia in patients with coronary microvascular spasm. J Am Coll Cardiol. 2003;41(1):15- 9. DOI:10.1016/s0735-1097(02)02632-3.
45. Del Buono MG, Montone RA, Camilli M, et al. Coronary Microvascular Dysfunction across the Spectrum of Cardiovascular Diseases: JACC State-of-the-Art Review. J Am Coll Cardiol. 2021;78(13):1352-71. DOI:10.1016/j.jacc.2021.07042.
46. Juni RP, Kuster DWD, Goebel M, et al. Cardiac Microvascular Endothelial Enhancement of Cardiomyocyte Function Is Impaired by Inflammation and Restored by Empagliflozin. JACC Basic Transl Sci. 2019;4(5):575-91. DOI:10.1016/j.jacbts.2019.04.003.
47. Nagayama T, Hsu S, Zhang M, et al. Sildenafil stops progressive chamber, cellular, and molecular remodeling and improves calcium handling and function in hearts with pre-existing advanced hypertrophy caused by pressure overload. J Am Coll Card. 2009;53(2):207-15. DOI:10.1016/j.jacc.2008.08.069.
48. Feliu C, Peyret H, Brassart-Pasco S, et al. Ticagrelor Prevents Endothelial Cell Apoptosis through the Adenosine Signalling Pathway in the Early Stages of Hypoxia. Biomolecules. 2020;10(5):740. DOI:10.3390/biom10050740.
49. Lerman A, Burnett JC, Higano ST, et al. Long-term L-arginine supplementation improves smallvessel coronary endothelial function in humans. Circulation. 1998;97(21):2123-8. DOI:10.1161/01.cir.97.21.2123.
50. Suwaidi JA, Hamasaki S, Higano ST, et al. Long-term follow-up of patients with mild coronary artery disease and endothelial dysfunction. Circulation. 2000;101(9):948-54. DOI:10.1161/01/cir.101.9.948.
51. Schachinger V, Britten MB, Zeiher AM. Prognostic impact of coronary vasodilator dysfunction on adverse long-term outcome of coronary heart disease. Circulation. 2000;101(16):1899-906. DOI:10.1161/01.cir.101.16.1899.
52. Gulati M, Cooper-DeHoff RM, McClure C, et al. Adverse cardiovascular outcomes in women with nonobstructive coronary artery disease: A report from the Women’s Ischemia Syndrome evaluation study and the St James Women Take Heart project. Arch Intern Med. 2009;169(9):843-50. DOI:10.1001/archinternmed.2009.50.
53. Ozcan C, Allan T, Besser SA, et al. The relationship between coronary microvascular dysfunction, atrial fibrillation and heart failure with preserved ejection fraction. Am J Cardiovasc Dis. 2021;11(1):29- 38.
Об авторе
Е. Л. ТрисветоваБеларусь
Трисветова Евгения Леонидовна,
Минск
Дополнительные файлы
Рецензия
Для цитирования:
Трисветова Е.Л. Коронарная микрососудистая дисфункция: эпидемиология, клиника, диагностика и лечение. Рациональная Фармакотерапия в Кардиологии. 2023;19(2):186-196. https://doi.org/10.20996/1819-6446-2023-04-02
For citation:
Trisvetova E.L. Coronary Microvascular Dysfunction: Epidemiology, Clinical Presentation, Diagnosis and Treatment. Rational Pharmacotherapy in Cardiology. 2023;19(2):186-196. (In Russ.) https://doi.org/10.20996/1819-6446-2023-04-02

















































