Перейти к:
Ингибиторы PCSK9 в клинической практике: опыт работы специализированного липидного центра
https://doi.org/10.20996/1819-6446-2021-12-01
Аннотация
Цель. Охарактеризовать пул пациентов, получающих ингибиторы PCSK9, и оценить эффективность их лечения в условиях специализированного липидного центра.
Материал и методы. Проведен ретроспективный анализ медицинских карт пациентов, наблюдающихся в Липидной клинике ФГБУ «НМИЦ ТПМ» Минздрава России, получающих ингибиторы PCSK9 и имеющих доступные для оценки данные липидного спектра в динамике (n=77). Сердечно-сосудистый риск (ССР) и целевые уровни холестерина липопротеидов низкой плотности (ХС ЛПНП) оценивали в соответствии с российскими рекомендациями по диагностике и коррекции дислипидемий 2020 г.
Результаты. Из 77 пациентов, принимающих ингибиторы PCSK9 (44,2% лиц мужского пола, медиана возраста 56 [47; 66] лет), 64,0% имели вероятный или определенный диагноз семейной гиперхолестеринемии (СГХС). Доля других нарушений липидного обмена, чистой гиперхолестеринемии и комбинированной гиперлипидемии составила 21% и 15% соответственно. Более половины пациентов (68,8%) имели очень высокий ССР, в основном обусловленный наличием ишемической болезни сердца (84,9%). Доля лиц, получающих ингибиторы PCSK9 в качестве монотерапии, составила 7,8%, в сочетании с высокоинтенсивной терапией статинами – 33,8%, в составе тройной гиполипидемической терапии (высокоинтенсивная доза статина, эзетимиб, ингибитор PCSK9) – 50,6%. При добавлении к комбинированной гиполипидемической терапии ингибиторов PCSK9 удалось снизить уровень ХС ЛПНП до 1,02 [0,62; 1,39] ммоль/л с суммарным его снижением от исходного уровня на 87,3%. На фоне приема ингибиторов PCSK9 ХС ЛПНП<1,8 ммоль/л и <1,4 ммоль/л достигли 78,3% и 57,7% пациентов с СГХС высокого и очень высокого ССР соответственно. Среди пациентов с другими гиперлипидемиями целевого уровня ХС ЛПНП <1,4 ммоль/л достигли 74,1% пациентов очень высокого ССР.
Заключение. В условиях специализированного липидного центра ингибиторы PCSK9 назначали пациентам высокого или очень высокого ССР, большинство из которых составляли больные с СГХС. Эффективность применения ингибиторов PCSK9 в клинической практике сопоставима с результатами крупных клинических исследований.
Ключевые слова
Для цитирования:
Блохина А.В., Ершова А.И., Лимонова А.С., Копылова О.В., Мешков А.Н., Драпкина О.М. Ингибиторы PCSK9 в клинической практике: опыт работы специализированного липидного центра. Рациональная Фармакотерапия в Кардиологии. 2021;17(6):808-815. https://doi.org/10.20996/1819-6446-2021-12-01
For citation:
Blokhina A.V., Ershova A.I., Limonova A.S., Kopylova O.V., Meshkov A.N., Drapkina O.M. PCSK9 Inhibitors in Clinical Practice: Experience of a Specialized Lipid Center. Rational Pharmacotherapy in Cardiology. 2021;17(6):808-815. (In Russ.) https://doi.org/10.20996/1819-6446-2021-12-01
Введение
Холестерин липопротеидов низкой плотности (ХС ЛПНП) – известный фактор риска развития сердечнососудистых заболеваний (ССЗ) атеросклеротического генеза, представляющих основную причину заболеваемости и смертности во всем мире [1][2].
Данные исследований свидетельствуют о том, что чем ниже уровень ХС ЛПНП, тем больших клинических преимуществ удается достичь, а степень снижения сердечно-сосудистого риска (ССР) пропорциональна степени снижения ХС ЛПНП [2]. Данные позиции нашли отражение в последних клинических рекомендациях Европейского кардиологического общества (ESC) и Европейского общества по изучению атеросклероза (EAS) 2019 г. по нарушениям липидного обмена, а также в российских рекомендациях по диагностике и коррекции дислипидемий 2020 г., согласно которым целевой уровень ХС ЛПНП определяется по ССР пациента. В случае недостижения целевого уровня ХС ЛПНП на фоне приема статина и эзетимиба или непереносимости этих классов гиполипидемических препаратов следует назначать гиполипидемические препараты нового класса – ингибиторы пропротеиновой конвертазы субтилизин-кексинового типа 9 (PCSK9) [3][4]. Учитывая достаточную доказательную базу эффективности применения ингибиторов PCSK9 с целью снижения уровня ХС ЛПНП и риска повторных сердечно-сосудистых событий, их применение у пациентов очень высокого ССР, в т.ч. с диагнозом семейной гиперхолестеринемии (СГХС) имеет класс рекомендаций А. Однако широкое использование в клинической практике ингибиторов PCSK9 ограничено их высокой стоимостью, и данных относительно их использования в клинической практике на сегодняшний день немного.
Целью данного исследования было охарактеризовать пул пациентов, получающих ингибиторы PCSK9, и оценить эффективность их лечения в условиях специализированного липидного центра.
Материал и методы
Проведен ретроспективный анализ медицинских карт пациентов, наблюдающихся в Липидной клинике ФГБУ «Национального медицинского исследовательского центра терапии и профилактической медицины» Минздрава России (НМИЦ ТПМ), которым были назначены ингибиторы PCSK9 за период 2016-2021 гг., и имеющих доступные для оценки данные липидного спектра в динамике. В исследование было включено 77 человек.
Тип гиперлипидемии (ГЛП) устанавливали в соответствии с классификацией МКБ-10. Для постановки диагноза СГХС использовали критерии Dutch Lipid Clinic Network (DLCN) [5]. ССР и целевые уровни ХС ЛПНП оценивали в соответствии с российскими рекомендациями по диагностике и коррекции дислипидемий 2020 г. [3][4].
Анализировали наличие у пациентов установленных или перенесенных ССЗ и их осложнений. Ранним началом ССЗ атеросклеротического генеза считали развитие ишемической болезни сердца или атеротромботического ишемического инсульта, транзиторной ишемической атаки, периферического атеросклероза в возрасте <55 лет у мужчин и <60 лет у женщин. Под значимым периферическим атеросклерозом понимали наличие атеросклеротических бляшек в экстракраниальных брахиоцефальных артериях, почечных артериях или артериях нижних конечностей по данным дуплексного сканирования артерий или ангиографии. Значимым считали атеросклероз при наличии атеросклеротической бляшки, сужающей просвет артерии на 50% и более, и/или с признаками нестабильности.
Оценивали наличие факторов риска развития и прогрессирования ССЗ атеросклеротического генеза, таких как изменения метаболизма (избыточная масса тела или ожирение), курение, артериальная гипертония (артериальное давление ≥140/90 мм рт. ст. или постоянный прием антигипертензивной терапии), сахарный диабет, хроническая болезнь почек.
Непереносимость статинов определяли как наличие подтвержденных нежелательных побочных реакций, ассоциированных с приемом статинов, на фоне приема как минимум двух статинов, один из которых в минимальной стартовой дозе, а второй – в любой.
Из показателей липидного обмена оценивали уровни общего холестерина (ОХС), ХС ЛПНП, холестерина липопротеидов высокой плотности (ХС ЛПВП), триглицеридов (ТГ), липопротеида (а). Диагноз гиперлипопротеидемия (а) устанавливали при уровне липопротеида (а) >30 мг/дл.
Для оценки статинотерапии дозы различных статинов переводили в эквивалентную дозу аторвастатина. Под высокоинтенсивной терапией статинами считали дозу аторвастатина 40-80 мг.
Для обработки полученных результатов использовали статистический пакет Statistica 8.0. Нормальным считалось распределение при критерии ШапироУилка >0,05. Учитывая отсутствие нормального распределения у большинства сравниваемых признаков, количественные данные представлены в виде медианы (Me) с интерквартильным размахом [ 25%; 75% ]. Для определения статистической значимости различий непрерывных величин в двух независимых группах использовали непараметрический критерий МаннаУитни. Для качественных признаков различия устанавливали методом точного критерия Фишера. Сравнение клинико-лабораторных параметров в динамике для пациентов с СГХС, имеющих анализ на каждой анализируемой терапии, проводили с помощью непараметрического критерия Вилкоксона для парных величин. Для всех проведенных анализов различия считали значимыми при р<0,05.
Результаты
За период наблюдения доступные для анализа данные в виде контроля липидного спектра на фоне приема ингибиторов PCSK9 были получены у 77 пациентов. Клиническая характеристика пациентов, включенных в исследование, представлена в табл. 1.
Table 1. Clinical characteristics of patients receiving PCSK9 inhibitors
Таблица 1. Клиническая характеристика пациентов, получающих ингибиторы PCSK9
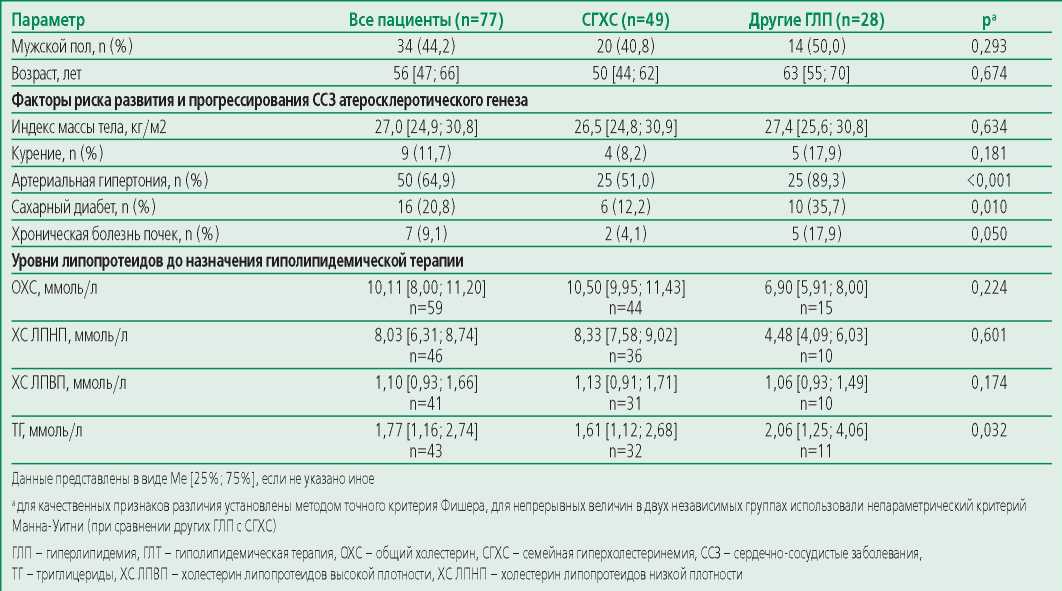
Большинство пациентов были среднего возраста, доля лиц мужского пола составила 44,2%.
Большинство пациентов (88,3%) имели как минимум 2 фактора риска атеросклероза, одним из которых была ГЛП, а 3 и более фактора имели 44,2% пациентов. Вторым по распространенности фактором риска ССЗ была артериальная гипертония (63,6%).
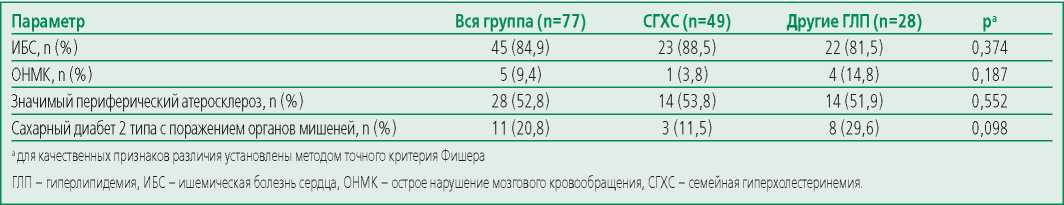
Распределение пациентов в зависимости от ССР представлено на рис. 1. В Липидной клинике «НМИЦ ТПМ» 52,8% пациентов очень высокого ССР имели раннее развитие ССЗ атеросклеротического генеза (46,5 [ 38,5; 50,0 ] лет). 11,0% пациентов очень высокого ССР имели сахарный диабет 2 типа с поражением органов-мишеней. У 28,0% был верифицирован значимый периферический атеросклероз, в том числе, мультифокальный (35,7%) (табл. 2).
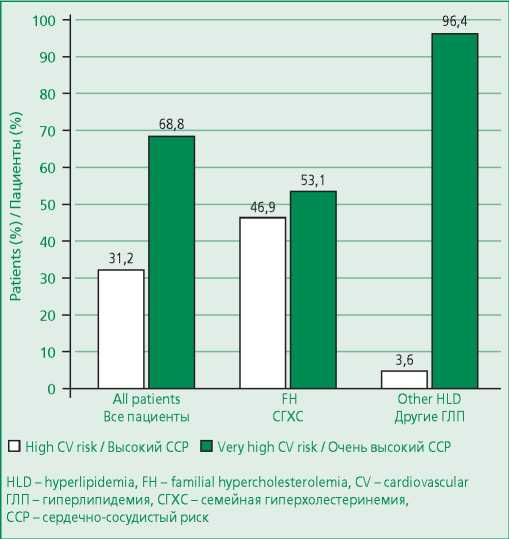
Figure 1. Distribution of patients according to cardiovascular risk
Рисунок 1. Распределение пациентов в зависимости от ССР
Table 2. The frequency of cardiovascular and other diseases explaining a very high cardiovascular risk
Таблица 2. Частота ССЗ и других заболеваний, обуславливающих очень высокий ССР
В Липидной клинике «НМИЦ ТПМ» чаще назначали алирокумаб, чем эволокумаб (58,4% против 41,6%), при этом частота назначения конкретного ингибитора PCSK9 не зависела от вида ГЛП (p=0,524).
Доля лиц, получающих ингибиторы PCSK9 в качестве монотерапии, составила 7,8%, в сочетании с умеренной или высокоинтенсивной терапией статинами – 1,3% и 33,8% соответственно, в составе тройной гиполипидемической терапии (статин, эзетимиб, ингибитор PCSK9) – 54,5%. Из них именно высокоинтенсивная доза статина была у большинства (50,6%) пациентов. Ингибитор PCSK9 в сочетании с эзетимибом принимали 2,6% пациентов.
Среди всех пациентов 14,3% указывали на развитие у них нежелательных побочных реакций на фоне терапии статинами. Подтвердить непереносимость статинов удалось у 5 пациентов (6,5%). Нежелательные побочные реакции на фоне приема ингибитора PCSK9 эволокумаба в виде аллергической реакции в месте инъекции были зарегистрированы только у одного пациента (1,3%).
Большинство (63,6%) пациентов имели вероятный или определенный диагноз семейной гиперхолестеринемии. Одному из пациентов был установлен диагноз наследственной комбинированной ГЛП, у других пациентов четкие данные за наличие наследственных нарушений липидного обмена получены не были: у 20,8% была выявлена чистая гиперхолестеринемия, у 14,3% – комбинированная ГЛП.
Следует отметить, что среди других ГЛП преобладали пациенты очень высокого ССР, получающие ингибиторы PCSK9 в качестве вторичной профилактики ССЗ. Также пациенты с другими ГЛП по сравнению с пациентами с СГХС чаще имели такие сопутствующие факторы риска ССЗ, как артериальная гипертония (р<0,001) и сахарный диабет (p=0,01).
Уровень ХС ЛПНП без приема гиполипидемической терапии был доступен у 46 пациентов и составил 8,03 [ 6,31; 8,74 ] ммоль/л.
Были изучены уровни ХС ЛПНП при гиполипидемической терапии различной интенсивности. На фоне высокоинтенсивной терапии статинами (n=42) уровень ХС ЛПНП был ниже на 51,7% от такового при отсутствии гиполипидемической терапии, в комбинации высокоинтенсивной терапии статинами с эзетимибом (n=46) – на 63,6%, а при высокоинтенсивной терапии статинами с эзетимибом и ингибитором PCSK9 (n=39) – на 87,3% (рис. 2).
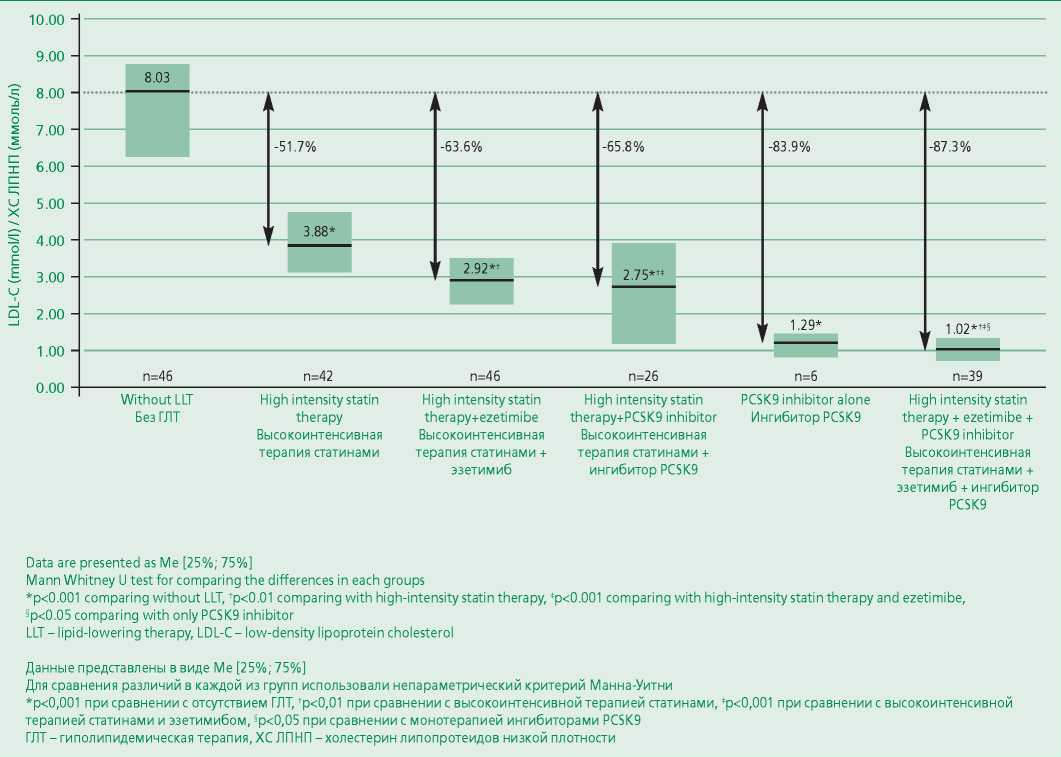
Figure 2. LDL-C levels at variety intensity lipid-lowering therapy
Рисунок 2. Уровни ХС ЛПНП на фоне гиполипидемической терапии различной интенсивности
Следует отметить, что при сравнении уровня ХС ЛПНП до и после назначения ингибиторов PCSK9 их добавление к гиполипидемической терапии (статин+/–эзетимиб) дополнительно снижало уровень ХС ЛПНП на 63,4%.
Медиана уровня ХС ЛПНП у пациентов с СГХС, имеющих данные липидного спектра на каждой комбинации гиполипидемических препаратов (n=23), до назначения гиполипидемической терапии составила 8,33 [ 7,46; 9,20 ] ммоль/л. Прием высокоинтенсивной терапии статинами в сочетании с эзетимибом позволил снизить уровень ХС ЛПНП на 63,4%. При добавлении к терапии ингибиторов PCSK9 суммарное снижение уровня ХС ЛПНП от исходного составило 87,6% (рис. 3).

Figure 3. LDL-C before and after PCSK9 inhibitors treatment in FH patients (n=23)
Рисунок 3. Уровень ХС ЛПНП до назначения и на фоне приема ингибиторов PCSK9 у больных СГХС (n=23)
В целом среди пациентов, получающих ингибиторы PCSK9, большинство (68,8%) достигли целевого уровня ХС ЛПНП (рис. 4).
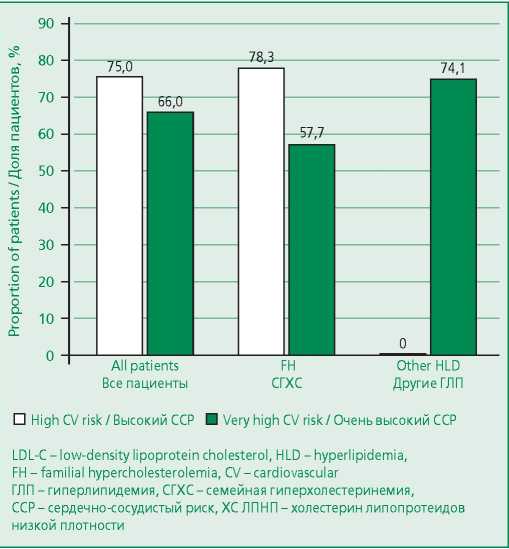
Figure 4. Achievement of LDL-C target level with PCSK9 inhibitors treatment
Рисунок 4. Доля пациентов, достигших целевого уровня ХС ЛПНП на фоне приема ингибиторов PCSK9
У пациентов с непереносимостью статинов целевой уровень ХС ЛПНП на фоне добавления к терапии эзетимибом ингибиторов PCSK9 был достигнут у 60%. Следует отметить, что у 2 пациентов, которым не удалось достигнуть целевого уровня ХС ЛПНП, была также подтверждена непереносимость эзетимиба, что делало невозможным назначение данного препарата для более эффективного снижения уровня ХС ЛПНП.
Среди пациентов, получающих ингибиторы PCSK9 и имеющих доступные данные (n=35), гиперлипопротеидемия (а) зарегистрирована у 18 (51,4%) пациентов. Оценить снижение уровня липопротеида (а) на фоне добавления к терапии ингибиторов PCSK9 представлялось возможным у 7 пациентов. Снижение уровня липопротеида (а) составило 42,4%, с минимальным снижением на 13,0% и максимальным – на 52,8%.
Обсуждение
Для пациентов очень высокого ССР при недостижении целевого уровня ХС ЛПНП на фоне максимально переносимой дозы статинов и эзетимиба добавление к терапии ингибиторов PCSK9 позволяет дополнительно снизить уровень ХС ЛПНП и предотвратить развитие сердечно-сосудистых событий [9]. Более половины пациентов (68,8%), включенных в исследование, имели очень высокий ССР, в основном обусловленный наличием ишемической болезни сердца (84,9%). Аналогичные данные представлены в национальном регистре Дании, где большинство пациентов (68,0%), получающих ингибиторы PCSK9, имели в анамнезе ишемическую болезнь сердца [8]. В одной из липидных клиник Франции частота наличия ишемической болезни у пациентов была ниже – 66,7%, однако именно она в значительной мере обуславливала очень высокий ССР у пациентов [10]. Учитывая, что большая доля пациентов очень высокого ССР имела раннее развитее ССЗ, а также исходно высокий уровень ХС ЛПНП, это может говорить о недостаточном лечении пациентов с гиперхолестеринемией.
В нашей работе отмечен хороший профиль переносимости статинов и низкая частота нежелательных побочных реакций на фоне приема ингибиторов PCSK9 (1,3%). В других липидных клиниках и по данным амбулаторной практики непереносимость статинов (31,6-77,0% [6][7][12]), как и непереносимость ингибиторов PCSK9 (10,0-15,5% [6][11]) встречались чаще.
СГХС – самое распространенное наследственное нарушение липидного обмена, при наличии которого необходимо раннее назначение комбинированной гиполипидемической терапии [12-14]. Полученные нами данные сопоставимы с клиническим опытом других липидных клиник, где ингибиторы PCSK9 также чаще назначались пациентам с СГХС, чем пациентам с другими нарушениями липидного обмена или непереносимостью статинов [6,12,15]. При анализе клинического опыта применения ингибиторов PCSK9 в одной из липидных клиник Израиля выявлено, что пациенты с СГХС были значительно моложе пациентов с другими нарушениями липидного обмена [6], однако в Липидной клинике «НМИЦ ТПМ» различий по возрасту назначения ингибиторов PCSK9 между группами выявлено не было. Это может быть связано с недостаточной диагностикой СГХС в медицинских учреждениях, более поздним обращением пациентов в специализированные липидные центры (медиана возраста пациентов с СГХС составила 50 [44; 62] лет).
Следует отметить исходно высокий уровень ХС ЛПНП среди пациентов Липидной клиники «НМИЦ ТПМ». Так, например, по данным единовременного амбулаторного регистра пациентов с ГЛП в США (2016 г.) уровень ХС ЛПНП без гиполипидемической терапии был меньше, и составил 4,7±1,0 ммоль/л [7]. Данные различия могут быть обусловлены более частым направлением в специализированный центр пациентов именно с выраженной ГЛП.
Согласно данным крупных клинических исследований, подтвержденных метаанализами, ингибиторы PCSK9 способны снижать уровень ХС ЛПНП на 60% от исходного в виде монотерапии [16-18], на 75% – при сочетании с высокоинтенсивной терапией статинами и на 85% – при сочетании с высокоинтенсивной терапией статинами и эзетимибом [4][17][18]. Полученные нами данные сопоставимы с результатами клинических исследований [17][18]. Таким образом, для эффективного снижения ХС ЛПНП в большинстве случаев требуется назначение комбинированной гиполипидемической терапии. Суммарное снижение уровня ХС ЛПНП в Липидной клинике «НМИЦ ТПМ» при добавлении к терапии ингибиторов PCSK9 превосходит данные, полученные в одной из липидных клиник Франции, где на тройной гиполипидемической терапии (статин, эзетимиб и ингибитор PCSK9) удалось снизить уровень ХС ЛПНП на 66,3% от исходного [10].
При изучении эффективности ингибиторов PCSK9 в реальной клинической практике в Нидерландах было показано, что 67,1% пациентов очень высокого ССР достигают целевого уровня ХС ЛПНП <1,8 ммоль/л при присоединении к терапии ингибиторов PCSK9 [11], что значительно ниже результатов, полученных в Липидной клинике «НМИЦ ТПМ» – 84,9%. По данным липидных клиник Израиля целевого уровня ХС ЛПНП<1,8 ммоль/л достигли 50% пациентов с СГХС, получающих ингибиторы PCSK9, что меньше, чем результаты, полученные нами (79,6%; p=0,002) [6]. Большая частота достижения целевого уровня ХС ЛПНП в Липидной клинике «НМИЦ ТПМ» может быть связана с неоднократным ее посещением пациентами, возможностью назначения более интенсивной гиполипидемической терапии с дальнейшим динамическим наблюдением пациентов. Так, из 69 пациентов, получающих терапию статинами, практически все (92,8%) получали именно высокоинтенсивную терапию статинами, из них 56,5% пациентов принимали эзетимиб. По данными амбулаторного регистра пациентов с ГЛП в США (2016 г.), только 6% пациентов получали комбинированную гиполипидемическую терапию (статин и эзетимиб). Высокоинтенсивную терапию статинами получали 75% пациентов, принимающих ингибиторы PCSK9 [7].
Следует отметить, что полученные нами данные превосходят показатели достижения целевого уровня ХС ЛПНП, описанные нами в более ранней работе, где с учетом назначенной гиполипидемической терапии ожидалось достижение целевого уровня <1,8 ммоль/л у 40,7% пациентов [19]. Более частое назначение комбинированной гиполипидемической терапии, в том числе, назначение ингибиторов PCSK9 позволило значительно увеличить долю лиц, достигших целевого уровня ХС ЛПНП.
Повышенная концентрация липопротеида (а) в плазме крови является независимым фактором риска развития ССЗ [20]. При этом на данный момент ингибиторы PCSK9 являются единственной группой препаратов, способной эффективно и безопасно снижать его уровень на 30-40% согласно данным клинических исследований [21][22]. Полученные нами данные сопоставимы с результатами клинических исследований [21][22]. Меньшее снижение липопротеида (а) – на 23% получено на когорте пациентов, наблюдающихся в специализированном центре в США [20].
Ограничения исследования. Не у всех пациентов, включенных в исследование, был доступен уровень ХС ЛПНП на каждой из анализируемой гиполипидемической терапии.
Заключение
В условиях работы специализированного липидного центра ингибиторы PCSK9 чаще назначают пациентам высокого или очень высокого ССР, большинство из которых составляют больные с СГХС, нуждающиеся во вторичной профилактике ССЗ и имеющие сопутствующие факторы риска, а также при непереносимости терапии статинами. Эффективность применения ингибиторов PCSK9 в клинической практике сопоставима с результатами крупных клинических исследований.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование. Исследование проведено при поддержке Национального медицинского исследовательского центра терапии и профилактической медицины.
Funding. The study was performed with the support of the National Medical Research Center for Therapy and Preventive Medicine.
Список литературы
1. Townsend N, Wilson L, Bhatnagar P, et al. Cardiovascular disease in Europe: epidemiological update 2016. Eur Heart J. 2016;37(42):3232-45. DOI:10.1093/EURHEARTJ/EHW334.
2. Ference B, Ginsberg H, Graham I, et al. Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J. 2017;38(32):2459-72. DOI:10.1093/EURHEARTJ/EHX144.
3. Mach F, Baigent C, Catapano ALб et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk: The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS). Eur Heart J. 2020;41(1):111-88. DOI:10.1093/EURHEARTJ/EHZ455.
4. Кухарчук В.В., Ежов М.В., Сергиенко И.В., и др. Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Российские рекомендации, VII пересмотр. Атеросклероз и дислипидемии. 2020;1(38):7-40. DOI:10.34687/2219-8202.JAD.2020.01.0002.
5. Civeira F. Guidelines for the diagnosis and management of heterozygous familial hypercholesterolemia. Atherosclerosis. 2004;173(1):55-68. DOI:10.1016/j.atherosclerosis.2003.11.010.
6. Zafrir B, Jubran A. Lipid‐lowering therapy with PCSK 9‐inhibitors in the real‐world setting: Two‐year experience of a regional lipid clinic. Cardiovascular Therapeutics. 2018;36(5):e12439. DOI:10.1111/1755-5922.12439.
7. Rane PB, Patel J, Harrison DJ, et al. Patient Characteristics and Real-World Treatment Patterns Among Early Users of PCSK9 Inhibitors. Am J Cardiovasc Drugs. 2018;18(2):103-8. DOI:10.1007/s40256-017-0246-z.
8. Jensen JS, Weeke PE, Bang LE, et al. Clinical characteristics and lipid lowering treatment of patients initiated on proprotein convertase subtilisin-kexin type 9 inhibitors: a nationwide cohort study. BMJ Open. 2019;9(4):e022702. DOI:10.1136/bmjopen-2018-022702.
9. Turgeon RD, Tsuyuki RT, Gyenes GT, Pearson GJ. Cardiovascular Efficacy and Safety of PCSK9 Inhibitors: Systematic Review and Meta-analysis Including the ODYSSEY OUTCOMES Trial. Can J Cardiol. 2018;34(12):1600-5. DOI:10.1016/j.cjca.2018.04.002.
10. Matta A, Bongard V, Bouisset F, et al. Real-World Efficacy of Proprotein Convertase Subtilisin/Kexin Type 9 Inhibitors (PCSK9i) in Heterozygous Familial Hypercholesterolemia Patients Referred for Lipoprotein Apheresis. Medical Science Monitor: International Medical Journal of Experimental and Clinical Research. 2021;27:e928784-1. DOI:10.12659/MSM.928784.
11. Stoekenbroek RM, Hartgers ML, Rutte R, et al. PCSK9 inhibitors in clinical practice: Delivering on the promise? Atherosclerosis. 2018;270:205-10. DOI:10.1016/j.atherosclerosis.2017.11.027.
12. Beheshti SO, Madsen CM, Varbo A, Nordestgaard BG. Worldwide prevalence of familial hypercholesterolemia: meta-analyses of 11 million subjects. J Am Coll Cardiol. 2020;75(20):2553-66. DOI:10.1016/j.jacc.2020.03.057.
13. Meshkov AN, Ershova AI, Kiseleva AV, et al. The Prevalence of Heterozygous Familial Hypercholesterolemia in Selected Regions of the Russian Federation: The FH-ESSE-RF Study. J Pers Med. 2021;11(6):464. DOI:10.3390/jpm11060464.
14. Ежов М.В., Бажан С.С., Ершова А.И., и др. Клинические рекомендации по семейной гиперхолестеринемии. Атеросклероз. 2019;15(1):58-98.
15. Piccinni C, Antonazzo IC, Maggioni AP, et al. PCSK9 Inhibitors' New Users: Analysis of Prescription Patterns and Patients' Characteristics from an Italian Real-world Study. Clin Drug Investig. 2020;40(2):173-81. DOI:10.1007/s40261-019-00877-3.
16. Schmidt AF, Pearce LS, Wilkins JT, et al. PCSK9 monoclonal antibodies for the primary and secondary prevention of cardiovascular disease. Cochrane Database of Systematic Reviews. 2017;4(4):CD011748. DOI:10.1002/14651858.CD011748.pub2.
17. Sabatine MS, Giugliano RP, Keech AC, et al. Evolocumab and clinical outcomes in patients with cardiovascular disease. N Engl J Med. 2017;376(18):1713-22. DOI:10.1056/NEJMoa1615664.
18. Schwartz GG, Steg PG, Szarek M, et al. Alirocumab and cardiovascular outcomes after acute coronary syndrome. N Engl J Med. 2018;379(22):2097-107. DOI:10.1056/NEJMoa1801174.
19. Блохина А.В., Ершова А.И., Мешков А.Н., и др. Липидная клиника как эффективная модель профилактической медицины. Рациональная Фармакотерапия в Кардиологии. 2021;17(1):4-10. DOI:10.20996/1819-6446-2021-01-02.
20. Pechlivanis S, Mahabadi AA, Hoffmann P, et al. Association between lipoprotein (a)(Lp (a)) levels and Lp (a) genetic variants with coronary artery calcification. BMC Med Genet. 2020;21(1):1-10. DOI:10.1186/s12881-020-01003-3.
21. Gaudet D, Watts GF, Robinson JG, et al. Effect of Alirocumab on Lipoprotein(a) Over ≥1.5 Years (from the Phase 3 ODYSSEY Program). Am J Cardiol. 2017;1;119(1):40-6. DOI:10.1016/j.amjcard. 2016.09.010.
22. Raal FJ, Giugliano RP, Sabatine MS, et al. Reduction in lipoprotein(a) with PCSK9 monoclonal antibody evolocumab (AMG 145): a pooled analysis of more than 1,300 patients in 4 phase II trials. J Am Coll Cardiol. 2014;8;63(13):1278-88. DOI:10.1016/j.jacc.2014.01.006.
Об авторах
А. В. БлохинаРоссия
Блохина Анастасия Викторовна.
Москва.
eLibrary SPIN 1103-6168
А. И. Ершова
Россия
Ершова Александра Игоревна.
Москва.
eLibrary SPIN 5292-5612
А. С. Лимонова
Россия
Лимонова Алена Сергеевна.
Москва.
eLibrary SPIN 1762-2462
О. В. Копылова
Россия
Копылова Оксана Викторовна.
Москва.
eLibrary SPIN 9127-0692
А. Н. Мешков
Россия
Мешков Алексей Николаевич.
Москва.
eLibrary SPIN 6340-5187
О. М. Драпкина
Россия
Драпкина Оксана Михайловна.
Москва.
eLibrary SPIN 4456-1297
Рецензия
Для цитирования:
Блохина А.В., Ершова А.И., Лимонова А.С., Копылова О.В., Мешков А.Н., Драпкина О.М. Ингибиторы PCSK9 в клинической практике: опыт работы специализированного липидного центра. Рациональная Фармакотерапия в Кардиологии. 2021;17(6):808-815. https://doi.org/10.20996/1819-6446-2021-12-01
For citation:
Blokhina A.V., Ershova A.I., Limonova A.S., Kopylova O.V., Meshkov A.N., Drapkina O.M. PCSK9 Inhibitors in Clinical Practice: Experience of a Specialized Lipid Center. Rational Pharmacotherapy in Cardiology. 2021;17(6):808-815. (In Russ.) https://doi.org/10.20996/1819-6446-2021-12-01

















































