Перейти к:
Омега-3 полиненасыщенные жирные кислоты: значение в профилактике фибрилляции предсердий у пациентов с ишемической болезнью сердца после проведения коронарного шунтирования
https://doi.org/10.20996/1819-6446-2021-12-02
Аннотация
Цель. Изучить значение омега-3 полиненасыщенных жирных кислот (ПНЖК) в предотвращении развития фибрилляции предсердий (ФП) после плановой операции коронарного шунтирования (КШ).
Материал и методы. Обследовали 306 пациентов, которых затем разделили на две группы: I группа не принимала омега-3 ПНЖК – (n=158; 82,7% мужчин), II группа принимала омега-3 ПНЖК (n=148; 89,3% мужчин). ПНЖК назначались в дозе 2000 мг/сут за 5 дней до КШ и в дозе 1000 мг/сут в послеоперационном периоде в течение 21 дня.
Результаты. В процессе наблюдения послеоперационная ФП развилась у 29,7% пациентов I группы и у 16,9% больных II группы (р=0,009). После КШ в I группе уровень интерлейкина-6 был на 39,3% выше (р=0,001), интерлейкина-10 – на 20,2% выше (р=0,01), супероксиддисмутазы плазмы – на 78,9% выше (р<0,001), малонового диальдегида – на 33,8% выше (р=0,03), докозагексаеновой кислоты – на 55% ниже (р=0,01), омега-3 индекс – на 43,4% ниже (р=0,04) при сравнении со II группой. Многофакторный регрессионный анализ показал статистически значимую ассоциацию между показателями воспаления, окислительного стресса и риском развития послеоперационной ФП.
Заключение. В группе терапии омега-3 ПНЖК после проведения КШ наблюдалась меньшая активация параметров воспаления и окислительного стресса на фоне повышения уровня докозагексаеновой кислоты и омега-3 индекса, что сопровождалось снижением частоты послеоперационной ФП на 12,8%.
Ключевые слова
Для цитирования:
Рубаненко О.А., Щукин Ю.В., Лимарева Л.В., Рязанова Т.К., Рубаненко А.О., Давыдкин И.Л. Омега-3 полиненасыщенные жирные кислоты: значение в профилактике фибрилляции предсердий у пациентов с ишемической болезнью сердца после проведения коронарного шунтирования. Рациональная Фармакотерапия в Кардиологии. 2022;18(1):12-19. https://doi.org/10.20996/1819-6446-2021-12-02
For citation:
Rubanenko O.A., Shchukin Yu.V., Limareva L.V., Ryazanova T.K., Rubanenko A.O., Davydkin I.L. Omega-3 Polyunsaturated Fatty Acids: the Role in Prevention of Atrial Fibrillation in Patients with Coronary Artery Disease after Coronary Artery Bypass Graft Surgery. Rational Pharmacotherapy in Cardiology. 2022;18(1):12-19. https://doi.org/10.20996/1819-6446-2021-12-02
Введение
Вопросы профилактики послеоперационной фибрилляции предсердий (ФП) остаются актуальными в кардиохирургической практике. Послеоперационная ФП является многофакторным осложнением у пациентов с ишемической болезнью сердца (ИБС) при проведении планового коронарного шунтирования (КШ). В литературе обсуждается роль различных показателей воспаления, маркеров окислительного стресса, тропонина, натрийуретического пептида в развитии этой аритмии [1]. По данным литературы тактика ведения пациентов с целью профилактики развития послеоперационной ФП включала в себя назначение антиаритмических препаратов (в частности, амиодарона), сердечных гликозидов, бета-адреноблокаторов, антагонистов кальция, которые в некоторых случаях могли спровоцировать развитие гипотензии, брадикардии и даже атриовентрикулярной блокады [2][3]. Применение омега-3 полиненасыщенных жирных кислот (ПНЖК) для предотвращения новых случаев послеоперационной ФП демонстрирует противоречивые результаты [4][5]. При использовании данных препаратов на практике нужно принимать во внимание назначаемую дозу, продолжительность приема, а также способ введения омега-3 ПНЖК, что способствует изменению в плазменных и тканевых уровнях данного препарата и может объяснять разнообразие результатов клинических исследований [6]. В настоящее время рассматривается значимость омега-3 индекса, который представляет собой процент ПНЖК, состоящий из эйкозапентаеновой (ЭПК) и докозагексаеновой (ДГК) кислот в мембранах эритроцитов [7][8]. Оценка данного параметра может характеризовать индивидуальную реакцию на применение омега-3 ПНЖК и способствовать лучшему пониманию их фармакокинетики и фармакодинамики. Однако в настоящее время в литературе имеются противоречивые данные о назначении омега-3 ПНЖК перед проведением операции КШ для профилактики новых случаев послеоперационной ФП, а также недостаточно сведений о влиянии омега-3 ПНЖК на содержание ЭПК и ДГК и омега-3 индекс в мембране эритроцитов у пациентов с послеоперационной ФП, подвергавшихся КШ.
Цель исследования – изучить значение омега-3 ПНЖК в предотвращении развития ФП после плановой операции КШ.
Материал и методы
При формировании дизайна исследования были приняты основополагающие принципы, отражающие соответствие исследования единым стандартам представления результатов испытания (рекомендации CONSORT) (рис. 1). Протокол исследования был одобрен на локальным этическим комитетом ФГБОУ ВО СамГМУ Минздрава России (№166 от 02.12.2015).
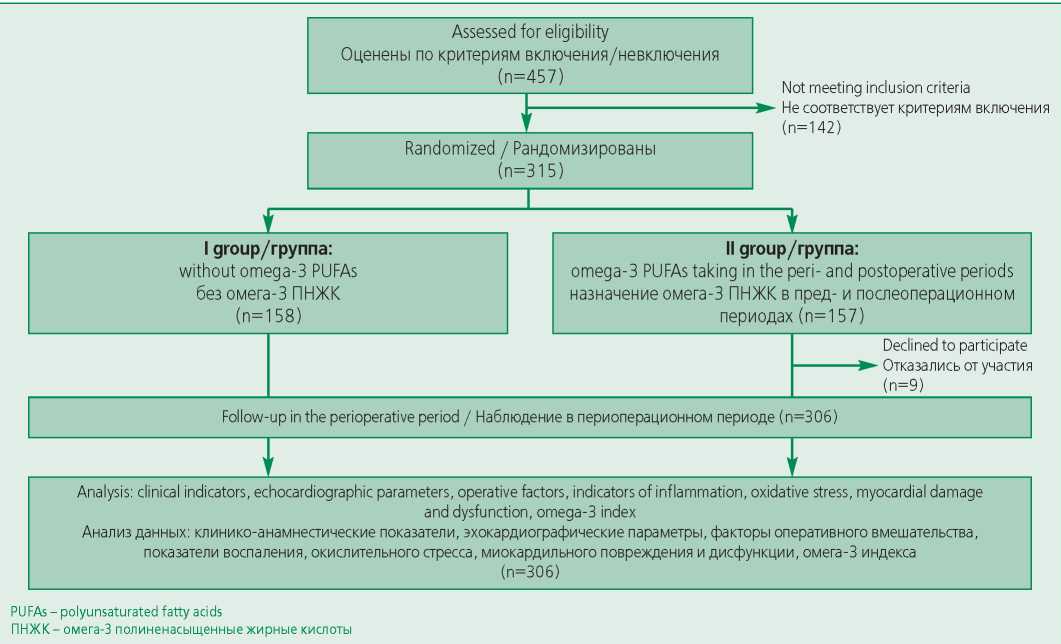
Figure 1. Study design
Рисунок 1. Дизайн исследования
После получения информированного согласия на участие в исследование с 2015 по 2018 гг. включено 306 пациентов (85,9% мужчин, медиана возраста 62,0 [ 57,0; 66,0] года) с ИБС, которым было запланировано КШ. Длительность наблюдения составила 12 мес. Для выявления послеоперационной ФП пациентам проводилась регистрация ЭКГ в 12 общепринятых отведениях, во время пребывания в отделении реанимации – прикроватный мониторинг ЭКГ в 3 отведениях. Регистрация на стационарном этапе осуществлялась ежедневно, а также при обращении пациента с жалобами на сердцебиение, нарушения ритма и чувство нехватки воздуха.
Диагноз стабильной стенокардии напряжения ставился на основании Европейских рекомендаций по ведению пациентов со стабильной ишемической болезни сердца (2013) [9].
Показания для проведения КШ определялись в соответствии с рекомендациями по реваскуляризации миокарда [10].
Пациенты рандомизированы на две группы в зависимости от назначения омега-3 ПНЖК (1000 мг) в пре- и послеоперационном периоде: I группа не принимала омега-3 ПНЖК (n=158; 131 (82,9%) мужчин); медиана возраста 63,0 [ 57,0;67,0] года), II группа принимала омега-3 ПНЖК (n=148; 132 (89,2%) мужчин); медиана возраста 60,0 [ 57,0;64,0] лет). Омега3 ПНЖК назначались в дозе 2000 мг/сут за 5 дней до КШ и в дозе 1000 мг/сут в послеоперационном периоде в течение 21 дня, препарат выдавался пациентам в рамках исследования.
Исследование лабораторных показателей было возможным у 192 пациентов. Проводилось определение содержания интерлейкинов 6 (ИЛ-6), 8 (ИЛ8) и 10 (ИЛ-10), также исследовались концентрации NT-proBNP, тропонина, супероксиддисмутазы (СОД) плазмы крови, малонового диальдегида (МДА), восстановленного глутатиона (ВГ) и активности глутатионредуктазы, омега-3 индекса. Определение концентрации интерлейкинов, NT-proBNP и СОД плазмы проводилось методом иммуноферментного анализа на анализаторе Thermo Scientific Multiscan FC (China) с помощью тест-систем производства ЗАО «Вектор-Бест» (Новосибирск, Россия) и ООО «Цитокин» (Санкт-Петербург, Россия). Концентрация тропонина I измерялась с помощью иммунохимического анализатора UNICEL® DXI 600 ACCESS (Beckman Coulter, USA). Уровни МДА, ВГ и активность глутатионредуктазы в эритроцитах рассчитывали спектрофотометрическим методом на спектрофотометре ЛOMO СФ-56 (ОКБ Спектр, г. СанктПетербург). Определение омега-3 индекса проводили хроматографическим анализом. Исследование параметров осуществлялось перед проведением операции и в среднем на 3-4 сут после вмешательства.
Проведение эхокардиографии осуществлялось с помощью УЗИ-сканеров Logiq – 5;7 (США) в М-, В-, D- режимах.
Статистическая обработка результатов проводилась с использованием пакета прикладных программ Statistica 7.0 (StatSoft Inc., США). Полученные данные анализировались с помощью методов непараметрической статистики, поскольку данные не соответствовали закону нормального распределения. Непрерывные переменные представлены в виде медианы (Мe), а также 25-го и 75-го процентилей [Q25; Q75], качественные переменные – в виде абсолютного числа пациентов (n) и процентов (%). С целью оценки статистической значимости различий непрерывных переменных для несвязанных совокупностей использовался критерий U Манна-Уитни, для связанных – критерий Вилкоксона. Для оценки статистической значимости различий между качественными переменными использовался критерий Хи-квадрат. Для выявления показателей, ассоциированных с развитием послеоперационной ФП, использовался метод бинарной логистической регрессии. Отрезные точки непрерывных показателей оценивались с помощью ROC-анализа с определением чувствительности и специфичности. Различия считали статистически значимыми при р<0,05.
Результаты
Характеристика пациентов представлена в табл. 1.
Table 1. Clinical characteristics of patients
Таблица 1. Клиническая характеристика пациентов
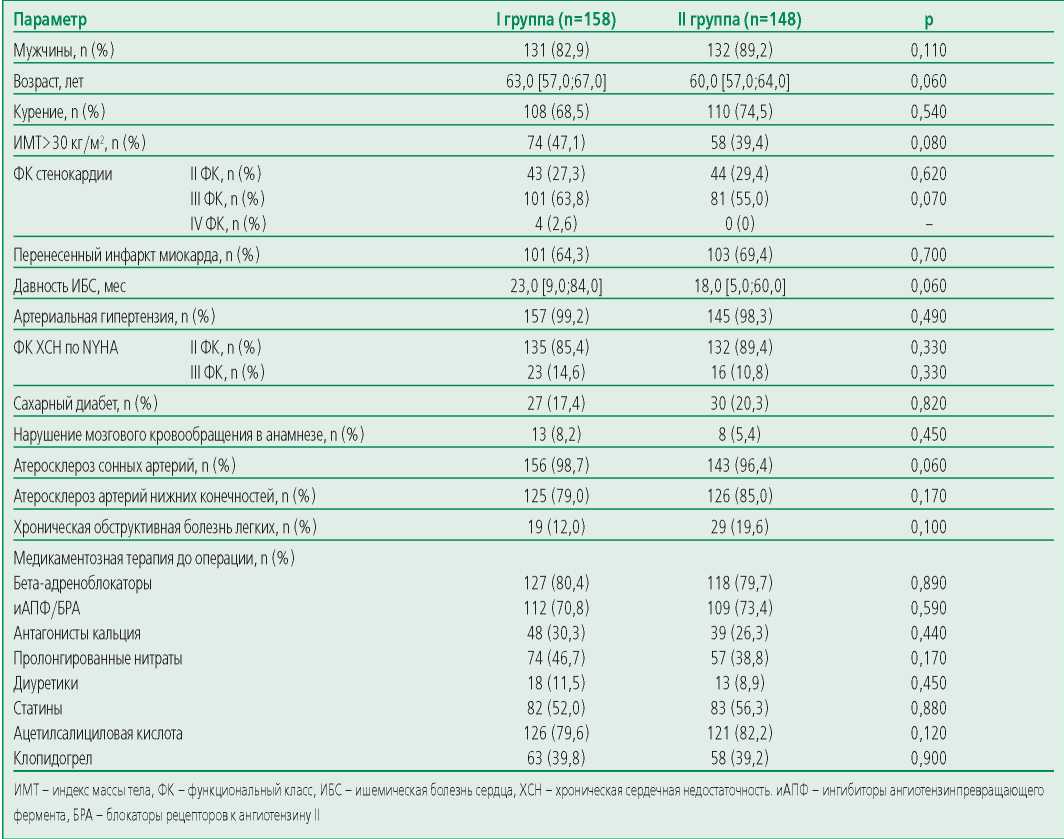
Статистически значимых различий между группами по клинико-анамнестическим данным выявлено не было.
В процессе наблюдения послеоперационная ФП в I группе развилась у 29,7% пациентов, а во II группе – у 16,9% (р=0,009).
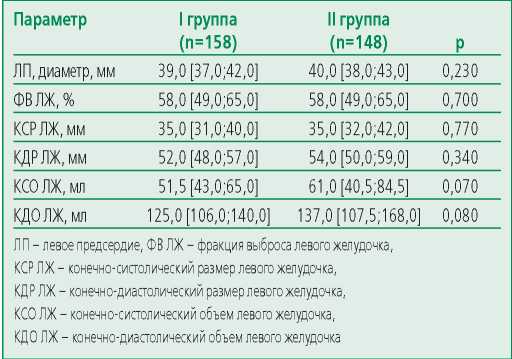
Нами проводился сравнительный анализ эхокардиографических показателей между группами (табл. 2), статистически значимых различий по изучаемым эхокардиографическим параметрам выявлено не было.
Table 2. Echocardiographic parameters
Таблица 2. Эхокардиографические показатели
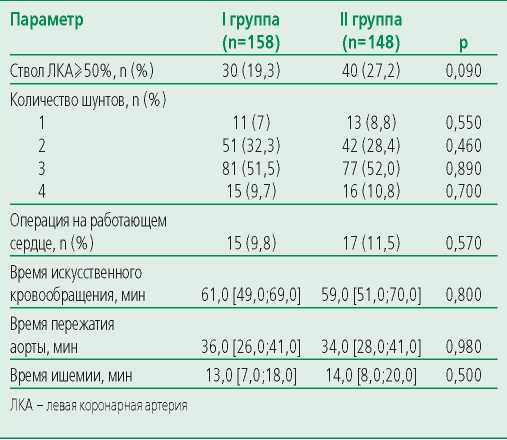
Далее проводилась оценка факторов оперативного вмешательства (табл. 3). Не выявлены статистически значимые различия между группами по следующим показателям: время искусственного кровообращения, время пережатия аорты, время ишемии миокарда, проведение КШ на работающем сердце, количество накладываемых шунтов.
Table 3. Surgical parameters of patients
Таблица 3. Хирургические параметры пациентов
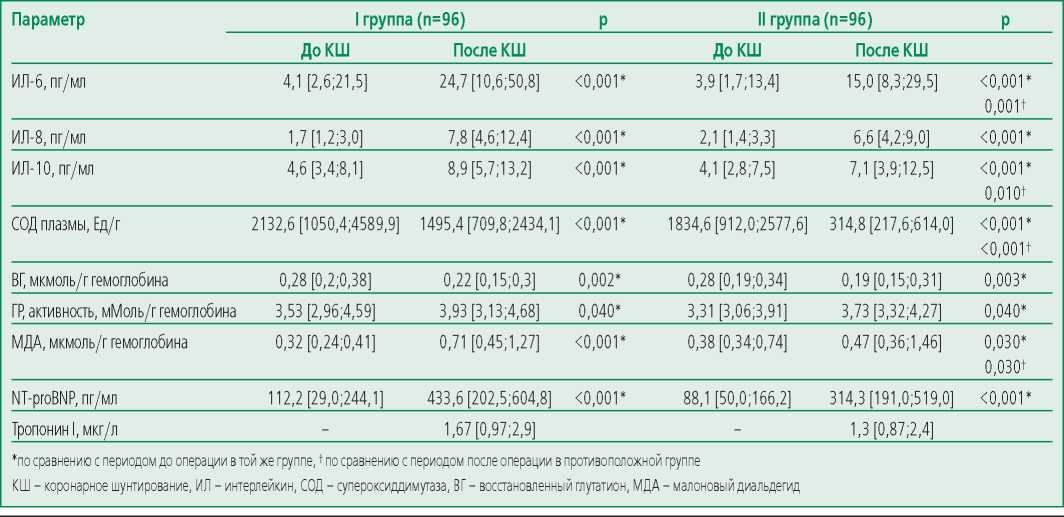
Оценка лабораторных показателей воспаления, окислительного стресса, миокардиального повреждения и дисфункции до КШ показала отсутствие статистически значимых различий между группами.
Анализ изменений представленных показателей после проведения КШ в I группе показал повышение уровня ИЛ-6 на 83,4% (p<0,001), ИЛ-8 – на 78,2% (p<0,001), ИЛ-10 – на 48,3% (p<0,001), NT-proBNP – на 74,1% (p<0,001). Активность СОД плазмы уменьшилась на 30% (p<0,001), глутатионредуктазы эритроцитов повысилась на 10,2% (р=0,04), уровень ВГ эритроцитов снизился на 21,4% (р=0,002), МДА – повысился на 32% (р=0,001).
Оценка концентрации указанных показателей после проведения КШ во II группе показала увеличение уровня ИЛ-6 на 74% (p<0,001), ИЛ-8 – на 68,2% (p<0,001), ИЛ-10 – на 42,3% (p<0,001), NT-proBNP – на 72% (p<0,001). Активность СОД плазмы уменьшилась на 82,8% (p<0,001), глутатионредуктазы эритроцитов повысилась на 11,3% (р=0,04), уровень ВГ эритроцитов снизился на 32% (р=0,003), МДА – повысился на 19% (р=0,03).
После КШ отмечено значимое увеличение концентрации ИЛ-6 на 39,3% (р=0,001), ИЛ-10 на 20,2% (р=0,01) среди пациентов I группы по сравнению со II группой. При проведении анализа показателей окислительного стресса между группами после операции КШ среди пациентов II группы отмечалось снижение активности СОД плазмы на 78,9% (р<0,001), а среди пациентов I группы – увеличение концентрации МДА на 33,8% (р=0,03). По остальным параметрам различия не выявлены (табл. 4).
Table 4. Indicators of inflammation, oxidative stress, myocardial damage and dysfunction in groups without omega-3 PUFAs and with omega-3 PUFAs
Таблица 4. Показатели воспаления, окислительного стресса, миокардиального повреждения и дисфункции в группах без применения омега-3 ПНЖК и с применением омега-3 ПНЖК
В нашей работе проводилась оценка омега-3 индекса в I и II в группах (табл. 5). Анализ предоперационной концентрации ЭПК, ДГК и омега-3 индекса между I и II группами статистически значимые различия не выявил.
Table 5. Concentration of PUFAs and the level of omega-3 index in the group without the use of omega-3 PUFAs and the group with the use of omega-3 PUFAs
Таблица 5. Концентрация ПНЖК и уровень омега-3 индекса в группе без применения омега-3 ПНЖК и группе с применением омега-3 ПНЖК
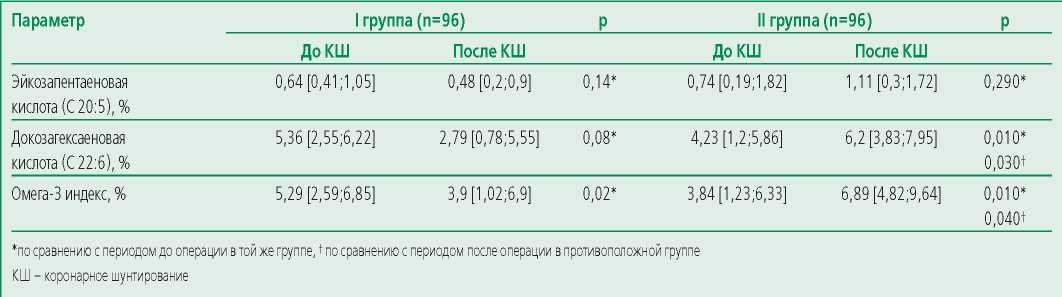
После проведения КШ наблюдалось изменение содержания ПНЖК и омега-3 индекса в представленных группах. В I группе отмечалось снижение содержания ЭПК на 25% (р=0,14), ДГК на 47,9% (р=0,08), омега-3 индекса на 26,3% (р=0,02). Во II группе выявлено повышение содержания ЭПК на 33,3% (р=0,29), ДГК на 31,8% (р=0,01), омега-3 индекса – на 44,3% (р=0,01).
В послеоперационном периоде во II группе концентрация ДГК оказалась на 55% больше (р=0,03), а значение омега-3 индекса – на 43,4% выше (р=0,04) по сравнению с I группой.
По данным однофакторного регрессионного анализа отношение шансов (ОШ) развития послеоперационной ФП у пациентов, подвергавшихся КШ, для концентрации ВГ гемоглобина после операции ≤0,194 мкмоль/г составило 5,5 (95% доверительный интервал [ДИ] 1,4-21,1, р=0,01), ИЛ-6 после операции >19,53 пг/мл – 5,3 (95% ДИ 1,97-14,4, р=0,001), омега-3 индекса после операции ≥1,83% – 0,42 (95% ДИ 0,26-0,68, р=0,0003), СОД плазмы после операции >1129,6 Ед/г – 6,6 (95% ДИ 2,4-14,5, р=0,0002), МДА гемоглобина после операции >0,78 мкмоль/г – 3,4 (95% ДИ 1,1-11,2, p=0,04).
В многофакторный регрессионный анализ включались показатели, значимо ассоциированные с развитием послеоперационной ФП по данным однофакторного анализа.
По данным многофакторного регрессионного анализа ОШ развития послеоперационной ФП у пациентов, подвергавшихся КШ, для концентрации ВГ гемоглобина после операции ≤0,194 мкмоль/г составило 4,0 (95% ДИ 1,1-14,3, р=0,03), ИЛ-6 после операции >19,53 пг/мл – 4,4 (95% ДИ 1,3-15,4, р=0,02), омега-3 индекса после операции ≥1,83% – 0,4 (95% ДИ 0,3- 0,54, р<0,001), СОД плазмы после операции >1129,6 Ед/г – 4,5 (95% ДИ 1,2-17,8, р=0,04). Для концентрации МДА гемоглобина после операции >0,78 мкмоль/г ассоциация с послеоперационной ФП стала статистически незначимой (р>0,05).
Обсуждение
В литературе рассматривается несколько моментов влияния омега-3 ПНЖК на снижение риска развития послеоперационной ФП [11][12]. В экспериментах выявлено, что омега-3 ПНЖК обладают такими плейотропными эффектами, как антиаритмический, антитромботический, гипотриглицеридемический, противовоспалительный и рядом других, объясняющихся воздействием различных механизмов [13]. Следует отметить, что при низких концентрациях омега-3 ПНЖК, они проявляют быстроразвивающийся антиаритмический эффект, не требующий биотрансформации кислот [14].
По данным L. Darghosian и соавт. эффективность омега-3 ПНЖК в профилактике рецидивов ФП является спорным, и их воздействие на воспаление и окислительный стресс у данной популяции неизвестно [15]. O. Stanger и соавт. предположили, что назначение омега-3 ПНЖК в качестве антиоксидантной защиты может способствовать снижению риска ФП в группе пациентов, подвергающихся КШ [16].
По нашим данным назначение омега-3 ПНЖК сопровождалось уменьшением частоты возникновения послеоперационной ФП при проведении планового КШ при сравнении с группой, не принимающей данный препарат. Наши результаты согласуются со сведениями мета-анализа H. Wang и соавт. [5], при этом автор подчеркивает, что эффективность применения омега3 ПНЖК отмечается на фоне изолированной операции КШ, без наличия предшествующей ФП, а также при соотношении ЭПК/ДГК<1. Таким образом, оценка факторов воспаления, окислительного стресса и омега-3 индекса позволит оценить изменения вышеуказанных параметров, определяющих риск послеоперационной ФП, при проведении планового КШ у пациентов, принимающих омега-3 ПНЖК.
У пациентов, принимающих омега-3 ПНЖК, уровни показателей воспаления были ниже при сравнении с пациентами без назначения препарата. В литературе представлены противоречивые данные.
L. Bo и соавт. в эксперименте с эндотелиальными клетками умбиликальной вены человека показали снижение концентрации ИЛ-6 и фактора некроза опухоли-α под воздействием омега-3 ПНЖК [17]. В эксперименте F. Zhang и соавт. продемонстрировано, что применение омега-3 ПНЖК статистически значимо снижало уровень ИЛ-6, эпидермального фактора роста, а также активных форм кислорода, оказывая тем самым протективное действие на клетки либеркюновой крипты крыс и тем самым защищая их от повреждения тяжелыми металлами [18]. В то же время в проведенных клинических исследованиях нужно учитывать данные, полученные M.S. Ellulu и соавт., которые указывают на то, что применение омега-3 ПНЖК в течение 8 нед не приводило к статистически значимому снижению концентрации ИЛ-6 у пациентов с артериальной гипертензией на фоне сахарного диабета [19]. Сами авторы статьи объяснили отсутствие влияния препарата на концентрацию ИЛ-6 назначением низкой дозы, а также небольшим периодом наблюдения за пациентами.
При проведении КШ ряд авторов отмечают повышение тропонина вследствие длительной ишемии миокарда, применения искусственного кровообращения [20]. В нашей работе тропонин повышался после КШ, но значимых различий между группами больных без назначения и с применением омега-3 ПНЖК не выявлено. Полученные данные отличаются от результатов M.L. Narducci и соавт., которые показали ассоциацию тропонина с риском послеоперационной ФП [21].
Также при проведении нашего исследования не было выявлено статистически значимых различий концентрации NT-proBNP среди пациентов, которые принимали омега-3 ПНЖК перед проведением КШ по сравнению с пациентами, не принимавшими этот препарат. Наши результаты согласуются с данными литературы [22].
Одним из механизмов, обуславливающих возникновение послеоперационной ФП, считается оксидативный стресс [23][24]. Развитие этого стресса связано с активацией свободно-радикального окисления и/или уменьшением антиоксидантной защиты, что сопровождается накоплением различных активных форм кислорода. Последние провоцируют развитие окислительной модификации белковых и липидных молекул, а также повреждение и дальнейшее нарушение структуры мембран. Вместе с тем известно, что активные формы кислорода являются внутриклеточными сигналами, участвующими в регуляции различных клеточных процессов, в том числе, апоптоза [25].
В нашей работе среди пациентов, принимавших омега-3 ПНЖК, выявлен статистически значимо низкий уровень СОД плазмы и МДА при сравнении с пациентами без применения омега-3 ПНЖК. Наши результаты частично согласуются со сведениями литературы. По данным мета-анализа J. Heshmati и соавт. продемонстрировано, что применение омега-3 ПНЖК значимо увеличивает активность сывороточной глутатионпероксидазы и общую антиоксидантную способность, снижает уровень МДА. Однако влияние омега-3 ПНЖК на активность оксида нитрита, глутатиона, СОД, каталазы было незначимым [26].
По нашим данным в ходе применения омега-3 ПНЖК после КШ отмечалось повышение содержания ЭПК, ДГК и омега-3 индекса в мембране эритроцитов, что согласуется с данными литературы [27].
U. Benedetto и соавт. провели сравнительный анализ трех рандомизированных контролируемых исследований, включивших всего 431 пациента и посвященных значению омега-3 ПНЖК в развитии послеоперационной ФП у пациентов, подвергшихся операции на сердце [28]. Обобщив сведения исследований, авторы получили данные, что омега-3 ПНЖК существенно не воздействовали на риск данной аритмии [отношение рисков 0,89; 95% ДИ 0,55-1,44; р=0,63]. В то же время проведенный мета-регрессионный анализ продемонстрировал тенденцию к полезности назначения омега-3 ПНЖК в случае, когда соотношение между ЭПК и ДГК находится в пределах 1:2 (Q модель = 7,4; р = 0,02), а также когда отмечается недостаточная приверженность к приему бета-адреноблокаторов перед проведением КШ (Q модель = 8,0; р = 0,01).
Таким образом, из данного анализа можно сделать вывод, что в целом прием омега-3 ПНЖК не снижает распространенность послеоперационной ФП у пациентов, подвергающихся операции на сердце [28]. В то же время сами авторы подчеркивают, что на данный результат могли повлиять несколько факторов, что нужно подтвердить или опровергнуть в дальнейших исследованиях.
Saravanan P. и соавт. получили данные, что прием омега-3 ПНЖК не уменьшает риск послеоперационной ФП после операции КШ, однако авторы продемонстрировали статистически значимое увеличение концентрации ЭПК и ДГК в сыворотке у тех пациентов, которые получали этот препарат, по сравнению с группой плацебо. При этом ЭПК и ДГК в ткани ушка правого предсердия, изученной во время проведения КШ, были статистически значимо выше на фоне приема препарата омега-3 ПНЖК [29].
Таким образом, в настоящем исследовании нами показано, что с развитием послеоперационной ФП ассоциируются послеоперационные концентрации ВГ, ИЛ-6, СОД плазмы, омега-3 индекс, что подтверждается нашей предыдущей работой [30].
Ограничения исследования. Исследование было одноцентровым, включало небольшое количество пациентов, наблюдение за пациентами было ограничено пред- и послеоперационными периодами.
Заключение
Таким образом, среди пациентов, принимающих омега-3 ПНЖК, после проведения КШ наблюдалась меньшая активация параметров воспаления и окислительного стресса на фоне повышения уровня ДГК и омега-3 индекса, что сопровождалось снижением частоты развития новых случаев ФП. Выявленный нами благоприятный эффект ПНЖК, вероятнее всего, обуславливает профилактическое влияние этой группы препаратов на развитие послеоперационной ФП.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование. Исследование проведено при поддержке Самарского государственного медицинского университета.
Funding. The study was performed with the support of the Samara State Medical University.
Список литературы
1. Korantzopoulos P, Letsas K, Fragakis N. et al. Oxidative Stress and Atrial Fibrillation: An Update. Free Radic Res. 2018;52(11-12):1199-209. DOI:10.1080/10715762.2018.1500696.
2. Conti VR. Preventing Postoperative Atrial Fibrillation: Is There One Best Option? Semin Thorac Cardiovasc Surg. 2018;30(1):14-15. DOI:10.1053/j.semtcvs.2018.02.015.
3. Oesterle A, Weber B, Tung R, et al. Preventing Postoperative Atrial Fibrillation After Noncardiac Surgery: A Meta-analysis. Am J Med. 2018;131(7):795-804. DOI:10.1016/j.amjmed.2018.01.032.
4. Nomani H, Mohammadpour AH, Moallem SM, et al. Anti-inflammatory Drugs in the Prevention of Post-Operative Atrial Fibrillation: A Literature Review. Inflammopharmacology. 2020;28 (1):111-29. DOI:10.1007/s10787-019-00653-x.
5. Wang H, Chen J, Zhao L. N-3 Polyunsaturated Fatty Acids for Prevention of Postoperative Atrial Fibrillation: Updated Meta-Analysis and Systematic Review. J Interv Card Electrophysiol. 2018;51(2):105-15 DOI:10.1007/s10840-018-0315-5.
6. Wu JH, Marchioli R, Silletta MG, et al. Plasma phospholipid omega-3 fatty acids and incidence of postoperative atrial fibrillation in the OPERA trial. J Am Heart Assoc. 2013;2:e000397. DOI:10.1161/JAHA.113.000397.
7. Gu J, Lundbye-Christensen S, Eschen RB, et al. Marine n-3 Fatty Acids Are Incorporated Into Atrial Tissue but Do Not Correlate With Postoperative Atrial Fibrillation in Cardiac Surgery. Vascul Pharmacol. 2016;87:70-5. DOI:10.1016/j.vph.2016.11.004.
8. Tribulova N, Szeiffova Bacova B, Egan Benova T, et al. Omega-3 Index and Anti-Arrhythmic Potential of Omega-3 PUFAs. Nutrients. 2017;9(11):E1191. DOI:10.3390/nu9111191.
9. 2013 ESC guidelines on the management of stable coronary artery disease: the Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J. 2013;34(38):2949-3003. DOI:10.1093/eurheartj/eht296.
10. 2014 ESC/EACTS Guidelines on Myocardial Revascularization: The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS) Developed With the Special Contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI). Eur Heart J. 2014;35(37):2541-619. DOI:10.1093/eurheartj/ehu278.
11. Рубаненко О.А., Фатенков О.В., Хохлунов С.М. с соавт. Влияние омега-3 полиненасыщенных жирных кислот на развитие фибрилляции предсердий после хирургической реваскуляризации миокарда. Клиническая Медицина. 2017;95(8):693-9. DOI:10.18821/0023-2149-2017-95-8-693-699.
12. Рубаненко О.А., Фатенков О.В., Хохлунов С.М. с соавт. Комбинация омега-3 полиненасыщенных жирных кислот и статинов в профилактике фибрилляции предсердий после операции коронарного шунтирования. Клиническая медицина. 2017;95(9):817-23. DOI:10.18821/0023-2149-2017-95-9-817-823.
13. De Caterina R. N-3 fatty acids in cardiovascular disease. N Engl J Med. 2011;364(25):2439-50. DOI:10.1056/NEJMra1008153.
14. Billman GE. The effects of omega-3 polyunsaturated fatty acids on cardiac rhythm: a critical reassessment. Pharmacol Ther. 2013;140(1):53-80. DOI:10.1016/j.pharmthera.2013.05.011.
15. Darghosian L, Free M, Li J, et al. Effect of omega-three polyunsaturated fatty acids on inflammation, oxidative stress, and recurrence of atrial fibrillation. Am J Cardiol. 2015;115(2):196-201. DOI:10.1016/j.amjcard.2014.10.022.
16. Stanger O, Aigner I, Schimetta W. et al. Antioxidant supplementation attenuates oxidative stress in patients undergoing coronary artery bypass graft surgery. Tohoku J Exp Med. 2014;232(2):145-54. DOI:10.1620/tjem.232.145.
17. Bo L, Jiang S, Xie Y. Effect of Vitamin E and Omega-3 Fatty Acids on Protecting Ambient PM2.5-Induced Inflammatory Response and Oxidative Stress in Vascular Endothelial Cells. PLoS One. 2016;11(3):e0152216. DOI:10.1371/journal.pone.0152216.
18. Zhang F, Yu H, Ni X, et al. Effect of ω-3 polyunsaturated fatty acids on the growth of IEC-6 cells injured by heavy metals. Biomed Rep. 2016;4(5):635-41. DOI:10.3892/br.2016.621.
19. Ellulu MS, Khaza'ai H, Patimah I, et al. Effect of long chain omega-3 polyunsaturated fatty acids on inflammation and metabolic markers in hypertensive and/or diabetic obese adults: a randomized controlled trial. Food Nutr Res. 2016;60:29268. DOI:10.3402/fnr.v60.29268.
20. Alam SR, Stirrat C, Spath N, et al. Myocardial inflammation, injury and infarction during on-pump coronary artery bypass graft surgery. J Cardiothorac Surg. 2017;12(1):115. DOI:10.1186/s13019-017-0681-6.
21. Narducci ML, Pelargonio G, Rio T, et al. Predictors of postoperative atrial fibrillation in patients with coronary artery disease undergoing cardiopulmonary bypass: a possible role for myocardial ischemia and atrial inflammation. J Cardiothorac Vasc Anesth. 2014;28(3):512-9. DOI:10.1053/j.jvca. 2013.06.002.
22. Hoogeveen EK, Geleijnse JM, Kromhout D, et al. No effect of n-3 fatty acids supplementation on NT-proBNP after myocardial infarction: the Alpha Omega Trial. Eur J Prev Cardiol. 2015;22(5):648-55. DOI:10.1177/2047487314536694.
23. Рубаненко О.А., Фатенков О.В., Хохлунов С.М., Лимарева Л.В. Роль супероксиддисмутазы в развитии послеоперационной фибрилляции предсердий у пациентов с ишемической болезнью сердца. Российский Кардиологический Журнал. 2017;22 (3):20-4. DOI:10.15829/1560-4071-2017-3-20-24
24. Рубаненко О.А., Фатенков О.В., Хохлунов С.М., Лимарева Л.В. Значение факторов оксидативного стресса и антиоксидантной защиты в возникновении фибрилляции предсердий после хирургической реваскуляризации миокарда. Вестник Аритмологии. 2016;84:17-21.
25. Pasdois P, Parker JE, Griffiths EJ, et al. The role of oxidized cytochrome С in regulating mitochondrial reactive oxygen species production and its perturbation in ischaemia. Biochem J. 2011;436(2):493-505. DOI:10.1042/BJ20101957.
26. Heshmati J, Morvaridzadeh M, Maroufizadeh S, et al. Omega-3 fatty acids supplementation and oxidative stress parameters: A systematic review and meta-analysis of clinical trials. Pharmacol Res. 2019;149:104462. DOI:10.1016/j.phrs.2019.104462.
27. Harris WS, Masson S, Barlera S, et al. Red blood cell oleic acid levels reflect olive oil intake while omega-3 levels reflect fish intake and the use of omega-3 acid ethyl esters: The Gruppo Italiano per lo Studio della Sopravvivenzanell‘Infarto Miocardico-Heart Failure trial. Nutr Res. 2016;36:989-94. DOI:10.1016/j.nutres.2016.06.012.
28. Benedetto U, Angeloni E, Melina G, et al. N-3 Polyunsaturated fatty acids for the prevention of post-operative atrial fibrillation: a meta-analysis of randomized controlled trials. J Cardiovasc Med (Hagerstown). 2013;14:104-9. DOI:10.2459/JCM.0b013e32834a13c1.
29. Saravanan P, Bridgewater B, West AL, et al. Omega-3 fatty acid supplementation does not reduce risk of atrial fibrillation after coronary artery bypass surgery: a randomized, double-blind, placebo-controlled clinical trial. Circ Arrhythm Electrophysiol. 2010;3(1):46-53. DOI:10.1161/CIRCEP. 109.899633.
30. Рубаненко О.А., Рубаненко А.О., Щукин Ю.В., и др. Клинические, эхокардиографические показатели и маркеры окислительного стресса, ассоциированные с развитием фибрилляции предсердий у пациентов, подвергающихся операции коронарного шунтирования. Российский Кардиологический Журнал. 2020;25(7):3896. DOI:10.15829/1560-4071-2020-3896.
Об авторах
О. А. РубаненкоРоссия
Рубаненко Олеся Анатольевна.
Самара.
eLibrary SPIN 1546-2237
Ю. В. Щукин
Россия
Щукин Юрий Владимирович.
Самара.
eLibrary SPIN 1558-7591
Л. В. Лимарева
Россия
Лимарева Лариса Владимировна.
Самара.
SPIN 8741-4433
Т. К. Рязанова
Россия
Рязанова Татьяна Константиновна.
Самара.
eLibrary SPIN 1489-9183
А. О. Рубаненко
Россия
Рубаненко Анатолий Олегович.
Самара.
eLibrary SPIN 6947-1028
И. Л. Давыдкин
Россия
Давыдкин Игорь Леонидович.
Самара.
eLibrary SPIN 1830-7497
Рецензия
Для цитирования:
Рубаненко О.А., Щукин Ю.В., Лимарева Л.В., Рязанова Т.К., Рубаненко А.О., Давыдкин И.Л. Омега-3 полиненасыщенные жирные кислоты: значение в профилактике фибрилляции предсердий у пациентов с ишемической болезнью сердца после проведения коронарного шунтирования. Рациональная Фармакотерапия в Кардиологии. 2022;18(1):12-19. https://doi.org/10.20996/1819-6446-2021-12-02
For citation:
Rubanenko O.A., Shchukin Yu.V., Limareva L.V., Ryazanova T.K., Rubanenko A.O., Davydkin I.L. Omega-3 Polyunsaturated Fatty Acids: the Role in Prevention of Atrial Fibrillation in Patients with Coronary Artery Disease after Coronary Artery Bypass Graft Surgery. Rational Pharmacotherapy in Cardiology. 2022;18(1):12-19. https://doi.org/10.20996/1819-6446-2021-12-02

















































