Перейти к:
Ведущие факторы прогрессирования амилоидоза сердца
https://doi.org/10.20996/1819-6446-2022-04-02
Аннотация
Цель. Изучить прогностическое значение ведущих клинических проявлений системного AL-амилоидоза, в первую очередь, структурных и функциональных изменений в миокарде в соотношении с другими органными вовлечениями.
Материал и методы. Проведен анализ выживаемости у 147 больных морфологически подтвержденным системным иммуноглобулиновым (AL, AH) амилоидозом по результатам длительного наблюдения за период с 1995 по 2016 гг. В группе специального исследования у 58 пациентов с морфологически подтвержденным системным кардиопатическим амилоидозом (AL, n=52; AH, n=3; ATTR, n=3) методом стандартной эхокардиографии и импульсноволновой тканевой допплерометрии на ультразвуковом аппарате экспертного класса исследовали наиболее важные в прогностическом отношении структурно-функциональные изменения сердца, были оценены уровни NTproBNP.
Результаты. Несмотря на существенное улучшение показателей выживаемости в настоящее время (медиана 90 мес), показано, что ведущими факторами неблагоприятного прогноза в дебюте заболевания по-прежнему являются ортостатическая гипотензия и амилоидная кардиопатия (медиана 25 мес), в дальнейшем влияние этих синдромов снижается, и через год низкие показатели выживаемости характерны для пациентов с хронической болезнью почек 3-5 стадий (медиана 28 мес). Влияние сниженной клубочковой фильтрации связано, в первую очередь, с неблагоприятным воздействием на внутрисердечную гемодинамику, ее вклад в повышение NTproBNP является вторым (47,9%) по значимости после снижения скорости (Strain Rate) систолического укорочения миокарда (48,5%) в модели множественной регрессии высокой объясняющей силы (R=0,702, F-критерий (4,21)=5,095, p=0,005), и в меньшей степени связано со снижением клиренса NTproBNP.
Заключение. Амилоидная кардиопатия является одним из наиболее прогностически неблагоприятных проявлений системного амилоидоза вследствие резкого ухудшения упругих свойств миокарда, в процессе дальнейшего развития амилоидоза ведущим фактором прогрессирования заболевания становится ухудшение профиля кардиоренальных взаимовлияний, маркером которых является уровень NTproBNP.
Ключевые слова
Для цитирования:
Рамеева А.С., Рамеев В.В., Бобкова И.Н., Сафарова А.Ф., Кобалава Ж.Д., Моисеев С.В. Ведущие факторы прогрессирования амилоидоза сердца. Рациональная Фармакотерапия в Кардиологии. 2022;18(2):143-152. https://doi.org/10.20996/1819-6446-2022-04-02
For citation:
Rameeva A.S., Rameev V.V., Bobkova I.N., Safarova A.F., Kobalava Zh.D., Moiseev S.V. Leading Factors of Progression in Patients with Cardiac Amyloidosis. Rational Pharmacotherapy in Cardiology. 2022;18(2):143-152. (In Russ.) https://doi.org/10.20996/1819-6446-2022-04-02
Введение
Амилоидоз объединяет группу белковых дистрофий, общим признаком которых является депозиция в интерстиции разных органов фибрилл амилоида. Разные формы амилоидоза отличаются по основному белкупредшественнику, формирующему амилоид, масса которого достигает 80% массы фибриллы. Таких белков-предшественников в настоящее время известно более 30, соответственно, выделяют более 30 разных форм амилоидоза. Нозологическая самостоятельность каждой формы определяется тем, что механизмы синтеза и метаболизма каждого белка отличаются, таким образом, отличаются и методы борьбы с синтезом этого белка при лечении амилоидоза [1].
Поражение сердца является одним из наиболее тяжелых проявлений системного амилоидоза, в первую очередь, иммуноглобулинового (AL, AH, AHL), а также ATTR-типа.
AL-амилоидоз является наиболее распространенной формой и обусловлен депозицией в тканях легких цепей иммуноглобулинов, обладает наихудшими показателями выживаемости. В случае естественной эволюции средняя выживаемость пациентов ранее составляла 12 мес [2], а при наличии у них тяжелой сердечной недостаточности – не превышала 6 мес. Современные методы лечения позволили значительно улучшить показатели выживаемости при AL-амилоидозе, однако и в настоящее время тяжесть состояния данных больных по-прежнему определяется поражением сердца, которое отмечается у 50-70% пациентов [3-5] и примерно у 76% пациенов является причиной смерти [5].
Белком-предшественником ATTR-амилоидоза выступает сывороточный транстиретин. Распад нормальной тетрамерной структуры транстиретина под влиянием мутаций или из-за возрастной деградации тетрамеров приводит к преобладающей циркуляции мономерных форм транстиретина, которые отличаются высокой физико-химической нестабильностью и легко агрегируют в тканях с образованием амилоида [6]. Наследственный ATTR-амилоидоз является редкой патологией в мире, за исключением отдельных эндемичных очагов. На ранних стадиях амилоидоза выявляют бессимптомное утолщение стенки левого желудочка (ЛЖ)>12 мм в диастолу. По мере прогрессирования кардиопатии развивается сердечная недостаточность, при этом доминируют нарушения диастолической функции по рестриктивному типу, в то время как систолическая дисфункция присоединяется лишь на поздних стадиях заболевания.
Диастолическая дисфункция часто сопровождается расширением предсердий, что создает предпосылки для нарушений ритма и проводимости. Важным показателем диастолической дисфункции с нарушением внутрипредсердной гемодинамики является NTproBNP. Уровень NTproBNP≥332 нг/л является одним из диагностических и неблагоприятных прогностических критериев поражения сердца при системном AL-амилоидозе. Данный маркер стал широко использоваться в оценке прогноза амилоидной кардиопатии благодаря разработанной в клинике Mayo системе стадирования AL-амилоидоза [7], которая неоднократно обновлялась [8]. По результатам исследования с участием 810
пациентов наиболее точными независимыми факторами неблагоприятного прогноза оказались уровень NT-proBNP ≥1800 пг/мл, уровень тропонина Т ≥0,025 нг/мл и абсолютная разница уровней причинной и невовлеченной свободной легкой цепи (κ-λ или λ-κ) ≥18 мг/дл, определяемых методом FREELITE. Согласно пересмотренной прогностической системе, пациенты относятся к стадиям I-IV в завиcимости от наличия 0, 1, 2 или 3 вышеуказанных факторов риска, соответственно. При I стадии AL-амилоидоза медиана общей выживаемости составляет 94,1 мес, II – 40,3 мес, III – 14 мес, IV – 5,8 мес [9]. Прогностическая ценность NT-proBNP у пациентов c терминальной почечной недостаточностью возрастает при использовании более высокого порогового значения – 4409 нг/л [10]. Необходимо еще раз подчеркнуть, что уровень натрийуретических пептидов зависит от скорости клубочковой фильтрации, и использование этого показателя в качестве прогностических маркеров должно проводиться аккуратно, с учетом стадии хронической болезни почек (ХБП) и тесных кардиоренальных взаимосвязей.
Важным фактором тяжести течения амилоидоза сердца является выраженная полиорганность поражения, в частности, наличие тяжелой ортостатической гипотензии (ОГ), обусловленной поражением вегетативной нервной системы, часто с синкопальными состояниями, и нефропатии, причем, поражение почек разной степени тяжести отмечается практических у всех больных (74-80%) в совокупной группе системных форм амилоидоза [2][5][11].
Эффективная диагностика кардиопатии, в т.ч. с использованием информативных методов визуализации, таких как тканевая допплерометрия миокарда, определение уровня сердечных биомаркеров (натрийуретические пептиды) является необходимым условием успешного лечения системного амилоидоза. Цель исследования – изучить прогностическое значение ведущих клинических проявлений системного AL-амилоидоза, в первую очередь, структурных и функциональных изменений в миокарде в соотношении с другими органными вовлечениями.
Материал и методы
Проведен ретроспективный анализ амбулаторных и стационарных медицинских карт за период с 1995 по 2016 гг. 147 пациентов старше 18 лет с морфологически подтвержденным системным иммуноглобулиновым (AL, AH) амилоидозом (группа ретроспективного анализа). Анализ клинических данных в динамике по данным медицинской документации за указанный промежуток времени по каждому пациенту позволил оценить частоту, тяжесть и влияние амилоидного поражения сердца на прогноз выживаемости в сравнении с другими клиническими проявлениями амилоидоза. Наблюдение пациентов продолжалось до 2021г.
Для уточнения характера кардиоренальных отношений в процессе прогрессирования амилоидоза сердца была набрана группа специального наблюдения из 58 пациентов (35 мужчин, 60%; медиана возраста 57 [ 51; 66] лет) с морфологически подтвержденным системным кардиопатическим амилоидозом (AL – 90% [n=52], AH – 5% [n=3], ATTR – 5% [n=3]), исходно не получавших патогенетической терапии, госпитализированных в клинику с 2016 г по 2021 г. Пациенты получали стандартные схемы патогенетической терапии, находились под ежеквартальным наблюдением, медиана длительности наблюдения составила 44 [ 8; 56] мес. В эту группу включены все пациенты, имеющие клинически очевидные признаки амилоидоза сердца в соответствии с критериями [12].
Протокол исследования одобрен независимым Этическим комитетом при Сеченовском Университете. Все пациенты подписали информированное согласие на участие в исследовании.
Методом стандартной эхокардиографии и тканевой допплерометрии исследовали структурно-функциональные изменения сердца у всех больных, и выявляли наиболее важные в прогностическом отношении признаки амилоидоза сердца. Проведена импульсноволновая тканевая допплерометрия (Vivid 7, GE; секторный датчик М3S с частотой сканирования 3,5 МГц) с опредением систолической (s`), ранней (a`) и поздней (e`) диастолических скоростей смещения ткани миокарда в медиальном и латеральном отделах фиброзного кольца митрального клапана (ФКМК). По показателям максимальных систолических и диастолических скоростей движения миокарда среднего сегмента межжелудочковой перегородки (МЖП) средствами интегрированной рабочей станции EchoPAC7 рассчитывали значения продольной пиковой деформации (Strain) миокарда, пиковой систолической (SRs), ранней (SRe) и поздней (SRa) диастолических скоростей деформации среднего сегмента миокарда. В качестве референсных значений использовали протокол из рекомендаций Американского общества эхокардиографии [13][14].
Уровень NT-proBNP определяли твердофазным двухсторонним хемилюминесцентным иммунохимическим методом на аппарате Immulite 2000 (Siemens Healthcare Diagnostics, Германия; чувствительность – 10 пг/мл).
Статистический анализ данных проводили с помощью компьютерной программы Statistica 8.0 (StatSoft Inc., США). Ограниченный объем выборки определил преимущественное использование непараметрических статистических критериев. Были определены абсолютные значения и процентные отношения для качественных показателей, количественные показатели представлены в виде медианы (Me) и межквартильного диапазона [ 25%; 75%]. Для сравнения различий в подгруппах использовали критерий χ2 для качественных, или критерий Манна-Уитни для количественных признаков, при сравнении показателей выживаемости предпочтение отдавалось критерию Гехана для непересекающихся кривых, иначе – модели Кокса. Сравнение зависимостей проводилось с помощью моделей множественной или логистической регрессии.
Результаты
Анализ клинических проявлений AL-амилоидоза и покзателей выживаемости в группе ретроспективного анализа
Группа ретроспективного наблюдения была более многочисленной, поэтому спектр, тяжесть клинических проявлений и их влияние на выживаемость изучалось, в первую очередь, на примере этой группы. Практически у всех больных отмечалось поражение почек (табл. 1). У 18 больных (12%) прогрессирование ХБП со снижением фильтрационной функции опережало наступление стадии нефротического синдрома уже на этапе субнефротической протеинурии. Среди больных с хронической почечной недостаточностью (ХПН, соответствует 3-5 стадиям ХБП) число летальных исходов было выше (χ2=4,99, p=0,03), в то время как наличие нефротического синдрома, в т.ч. с выраженной гипоальбуминемией менее 25 г/л, не сказывалось на летальности (χ2=2,06, p=0,15).
Table 1. Main clinical manifestations of AL and AH-amyloidosis
Таблица 1. Основные клинические проявления AL и AH-амилоидоза
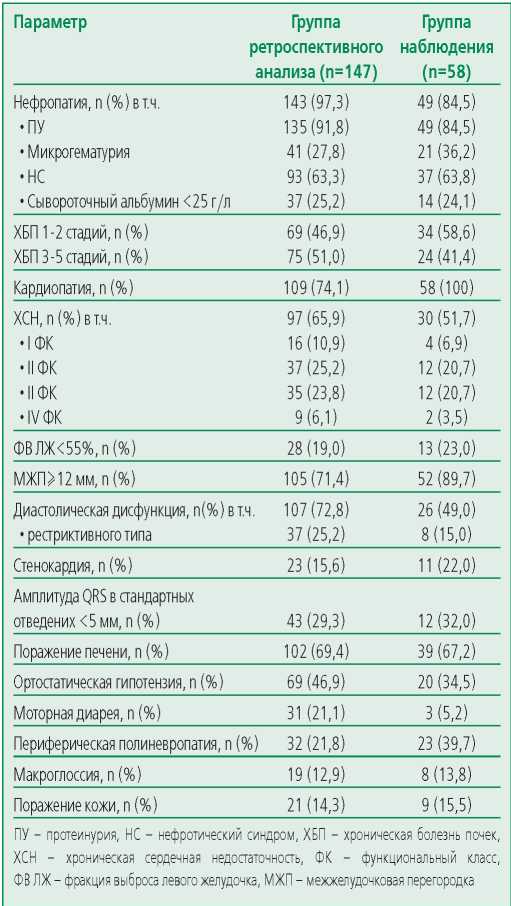
Поражение сердца отмечалось у 74,1% больных, у 65,9% выявлялись признаки хронической сердечной недостаточности (ХСН). У 12 больных этой группы без клинических признаков ХСН отмечалось утолщение
стенок миокарда или диастолическая дисфункция 1 типа, указывавшие на наличие кардиопатии. При этом у 8 из них в анамнезе отсутствовали артериальная гипертензия, ишемическая болезнь сердца, или иные причины формирования гипертрофии миокарда, а диастолическая дисфункция 1 типа у остальных 4 не сопровождала какие-либо заболевания сердечно-сосудистой системы, что также позволяло связывать эти изменения с амилоидной кардиопатией.
Важно отметить, что у больных ретроспективной группы с ХБП 3-5 стадии толщина стенок была больше (U=741,0; p=0,006), при этом у больных с толщиной миокарда >14 мм медиана выживаемости не превышала 26 мес в отличие от больных с меньшим утолщением – 72 мес (F-критерий Кокса [ 52, 50] =2,21; p=0,003).
Среди различных параметров внутрисердечной гемодинамики чаще всего выявлялись нарушения диастолической функции, в т.ч. у 25% больных – тяжелые рестриктивные нарушения гемодинамики, ассоциированные с повышенным риском летального исхода (χ2=11,9, p<0,001).
Более низкие показатели выживаемости были характерны также для лиц со снижением сократительной способности миокарда (25,7 мес против 73,8 мес у лиц без снижения фракции выброса левого желудочка (ФВ ЛЖ), F-критерий Кокса [ 66, 32] =1,73, p=0,045), снижение ФВ ЛЖ<55% выявлялось у 19% больных.
У 47% больных AL-амилоидозом тяжелым проявлением была ОГ вследствие поражения нервных сплетений стенки сосудов. У 17% больных тяжелая сосудистая недостаточность сочеталась с эпизодами синкопальных состояний, ортостатическая гипотензия характеризовалсь более высокой частотой летальных исходов (χ2=5,30; df=1; p=0,021). Приблизительно у половины больных имелись и другие, менее значимые с точки зрения прогрессирования органные вовлечения.
Медиана продолжительности жизни среди пациентов группы ретроспективного анализа с 2006 по 2021 гг. составила 90 мес против 42 мес в период с 1995 по 2006 гг. (до срока 90 мес дожили лишь 22,1% больных).
В дебюте заболевания признаки ХСН отмечены у 34% больных (n=50), у 29% (n=43) развился нефротический синдром, у 14% (n=21) – ОГ. Относительно редко на этом этапе у больных встречалась ХПН (у 10 больных – 7%). Наиболее неблагоприятное влияние на прогноз среди дебютных проявлений оказывали ХСН и ОГ (медиана ожидаемой продолжительности жизни по таблицам дожития – 25 мес), в то время как у больных с нефротическим синдромом медиана составила 48 мес. Быстрое прогрессирование амилоидоза у 14,5% больных (n=22) привело к летальному исходу уже в дебюте заболевания (первые 6 мес), в основном – вследствие тяжелой ортостатической сосудистой недостаточности или ХСН.
У 125 больных (85%) через 12 [ 8; 23] мес от начала заболевания к 2 [ 1; 4] дебютным синдромам присоединялись еще 3 новых клинических проявления (всего 5 [ 3; 6] синдромов). Наиболее характерным
событием через 12 мес от начала заболевания было резкое увеличение числа больных ХПН с 7% в дебюте до 27%, при этом медиана выживаемости у больных ХПН составила 28,8 мес, а в целом у больных нефропатией – 74 мес. С этим же сроком совпадал первый пик летальности больных AL, все последующие пики развития ХПН также четко совпадали с пиками летальности больных (рис. 1). При этом терминальная стадия нефропатии развилась лишь у одной эффективно леченной пациентки (на фоне иммунохимической ремиссии амилоидогенной моноклональной гаммапатии исчез НС) на 5-м году сопутствующей диабетической нефропатии (показатели углеводного обмена не поддавались эффективному контролю).
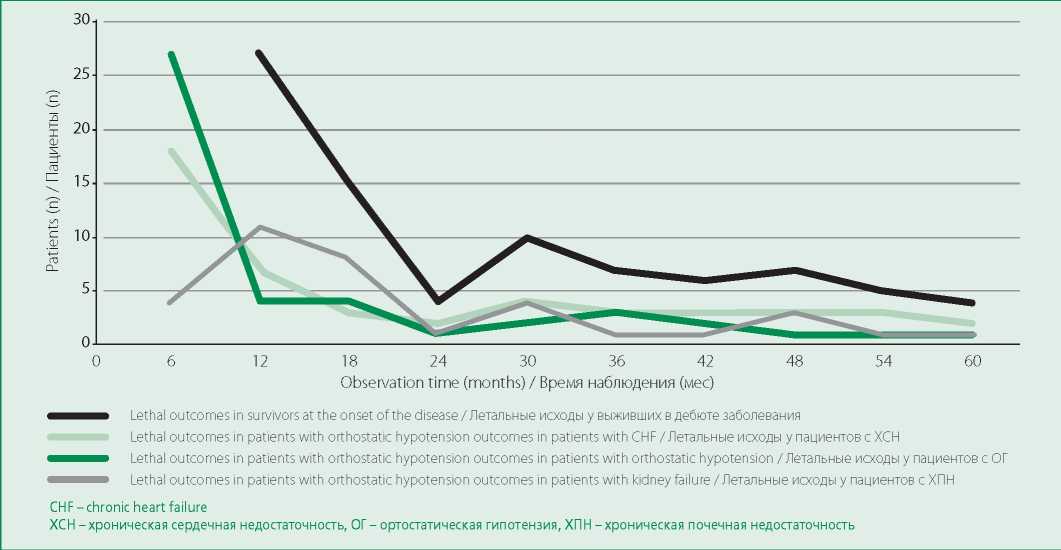
Figure 1. Timeline of developing for orthostatic hypotension, heart failure and kidney insufficiency in patients with lethal outcome
Рисунок 1. Динамика появления ортостатической гипотензии, ХСН и ХПН у лиц с летальным исходом в сравнении с общей летальностью на разных сроках заболевания
В противоположность влиянию 3-5 стадий ХБП среди выживших больных ХСН медиана ожидаемой продолжительности жизни, наоборот, увеличивалась до 96 мес. Выделить среди этих больных подгруппу с неблагоприятным значением было возможно только в случае ассоциации ХСН и ХПН (медиана ожидаемой продолжительности жизни 28,2 мес).
Анализ показателей прогрессирования амилоидоза сердца и кардиоренальных отношений в группе специального наблюдения.
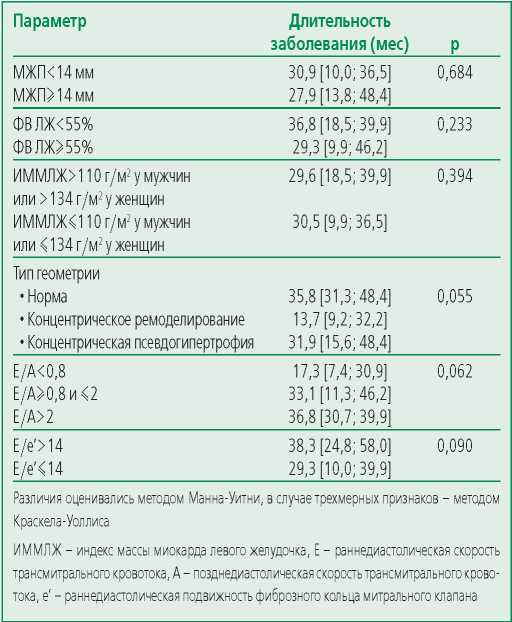
В связи с высокими темпами прогрессирования амилоидоза тяжесть изменений в миокарде не была связана с давностью заболевания (табл. 2), поэтому при изучении признаков прогрессирования поражения сердца их этапность оценивали, главным образом, по показателям выживаемости.
Table 2. The disease duration before basic structural changes formed in myocardium
Таблица 2. Длительность заболевания до формирования основных структурных эхокардиографических изменений в миокарде
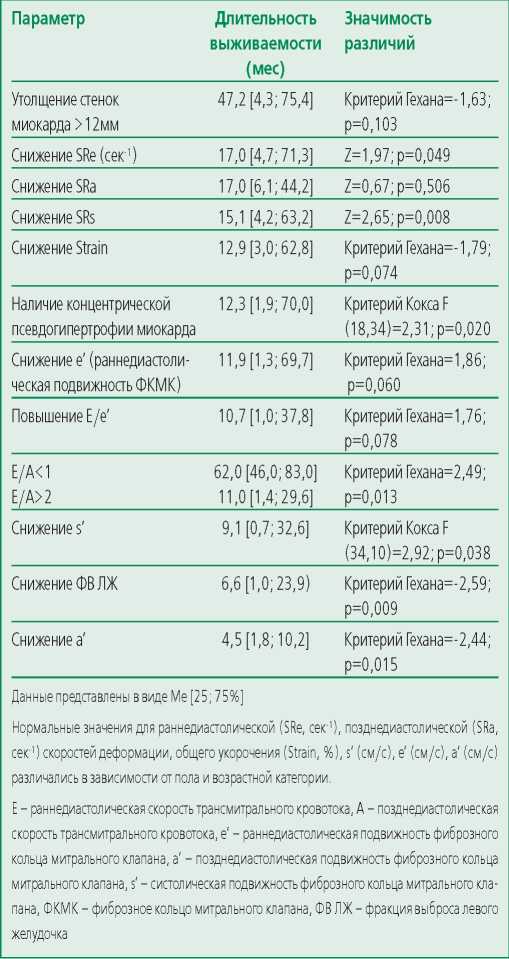
Утолщение миокарда обнаружено практически у всех больных амилоидозом сердца, но это не оказывало влияния на показатель выживаемости (табл. 3), в то время как наличие псевдогипертрофии миокарда, отражающее значительную массу накопленного амилоида, степень ригидности и измененной геометрии миокарда, снижало медиану выживаемости до 12,3 мес. Наиболее неблагоприятными изменениями, отражающими глубокую стадию амилоидного поражения сердца, являлись рестриктивные нарушения диастолы, снижение ФВ ЛЖ, систолическое (s’) и позднедиастолическое (a’) снижение подвижности ФКМК.
Table 3. Cardiac factors of the amylodotic cardiopathy progression
Таблица 3. Кардиальные факторы прогрессирования амилоидоза сердца
Медиана выживаемости снижалась также у лиц с понижением скоростей систолического укорочения (SRs) и раннедиастолического удлинения (SRe) миокарда, причем, эти параметры, изначально не коррелирующие (Rs=0,12; p=0,584), по мере снижения вступали в тесную корреляционную зависимость между собой (Rs=0,64, p<0,001, рис. 2).
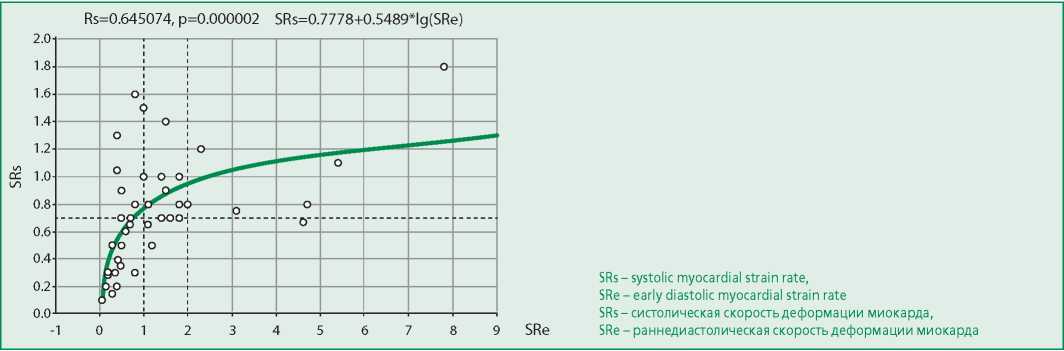
Figure 2. Interrelations between systolic and earliar diastolic strain rates in myocardium
Рисунок 2. Взаимосвязи между показателями систолической и раннедиастолической скоростей деформации миокарда
Присоединение 3-5 стадий ХБП у 41,4% (n=24) в группе специального исследования не сказывалось на показателях трансмитрального кровотока (Е критерий Манна-Уитни U=299,5, p=0,278; А: U=327,0, p=0,669; Е/А: U=281,5, p=0,217) региональных скоростей укорочения и релаксации миокарда (SRs: U=216,5, p=0,428; SRe: U=195,0, p=0,249; SRa: U=204,0, p=0,288), также как увеличение общего укорочения Strain (U=231,5, p=0,153), позднедиастолического (a’: U=229,0, p=0,164) и систолического (s’: U=210,0, p=0,076196) движения ФКМК. Однако взаимосвязь между скоростью укорочения и величиной общего укорочения усиливалась (без ХПН Rs=0,57; с ХБП 3-5 Rs=0,87, р<0,001), т.е. при одной и той же скорости укорочения суммарное укорочение оказывается более значительным.
У больных 3-5 стадиями ХБП отмечались более высокие показатели расчетного давления заклинивания легочных капилляров (ДЗЛК, 13,7 [10,8; 23,5] против 10,2 [7,9; 14,4] мм рт.ст. у пациентов с ХБП 1-2 стадий; U=181, p=0,033) и систолического давления в легочной артерии (21 [ 17; 30] против 12 [ 9; 20] мм рт.ст. у лиц с 1-2 стадиями ХБП; U=29,5, p=0,004).
ХБП 3-5 стадий являлась существенным фактором ухудшения прогноза, т.к. медиана ожидаемой продолжительности жизни снизилась у этих больных с 28,5 мес до 16,0 мес (критерий Гехана=-2,00, p=0,046). В то же время наличие нефротического синдрома противостояло снижению показателя выживаемости, который у лиц с нефротическим синдромом не снижался (критерий Гехана=-1,36, p=0,173).
Повышение уровня NTproBNP (суммирующего показателя преднагрузки на миокард, повышающегося в ответ на повышение конечного диастолического давления в предсердиях) >1800 нг/л было ассоциировано со снижением SRe (2500,0 [ 291,5; 10000,0] нг/л; U=42,0, p=0,009) и SRs (2008,5 [ 290,3; 7957,6] нг/л; U=53,0, p=0,030), в то время как нормальные значения SRe и SRs характеризовались нормальными или пограничными значениями пропептида (208,0 [ 122,8; 393,2] нг/л).
Сходные или более существенные уровни повышения NTproBNP отмечались и при изменении подвижности ФКМК (снижение е’: 2008,5 [ 350,4; 4894,0] нг/л, U=26,0, p<0,001; повышение Е/е’: 2500,0 [ 966,1-9114,0] нг/л, U=23,0, p=0,039; снижение a’: 4059,3 [ 2500,0; 9114,0] нг/л, U=7,0, p<0,001); снижении ФВ ЛЖ (5822,0 [ 4479,4; 7514,6] нг/л, U=22,0, p=0,033), повышении индекса объема левого предсердия (7957,0 [ 3902,54; 16622,8] нг/л, U=7,0, p<0,001).
Уровень NTproBNP повышался также при ХБП 3-5 стадий (3230,0 [ 820,3-10000,0] нг/л, U=65,0, p=0,002). Даже у больных с минимальными признаками поражения миокарда, представленными только утолщением стенок, уровень NTproBNP при ХБП 3-5 стадий повышался до 893,2 [ 259,3; 2118,6] нг/л.
Изучение вклада различных факторов начальных этапов прогрессирования поражения сердца в уровень NTproBNP методом множественной регрессии показало, что регрессионное уравнение достаточно высокой объясняющей силы (RS=0,702) включает, в первую очередь, показатели среднеперегородочной скорости укорочения миокарда и уровень клубочковой фильтрации (табл. 4). Причем, действие этих параметров равно по силе (в т.ч. по результатам оценки частных коэффициентов корреляции (табл. 5), дающих независимую оценку по другим компонентам уравнения), и в совокупности достигает 96,4% (0,485+0,479=0,964), в то время как параметрами скоростей релаксации можно пренебречь.
Table 4. Multiple regression model for the myocardial deformation parameters and glomerular filtration rate influencing on the NTproBNP level
Таблица 4. Модель множественной регрессии влияния показателей деформации миокарда и СКФ на уровень NTproBNP
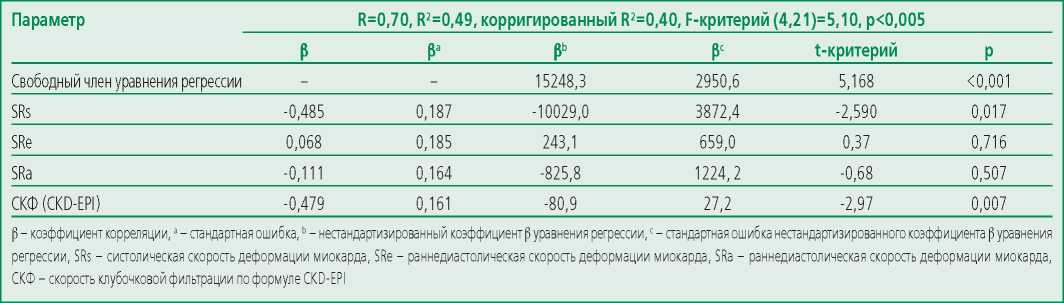
Table 5. Partial correlation coefficients of myocardial deformation and GFR with NTproBNP levels
Таблица 5. Частные коэффициенты корреляции между показателями деформации миокарда и СКФ с уровнем NTproBNP
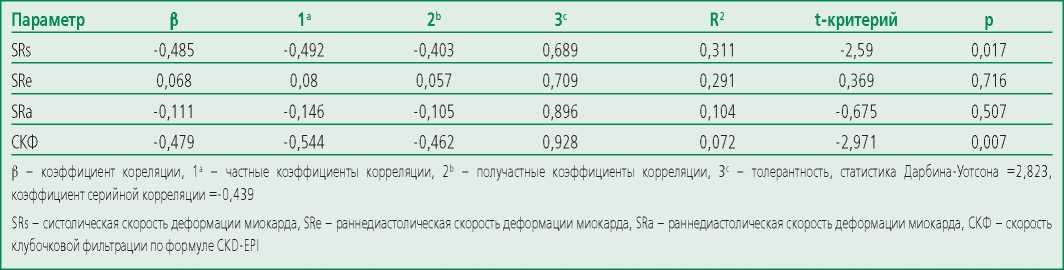
Table 6. Multiple regression model for myocardial deformation, intracardial hemodynamics and GFR influence on NTproBNP levels
Таблица 6. Модель множественной регрессии влияния показателей деформации миокарда, внутрисердечной гемодинамики и СКФ на уровень NTproBNP
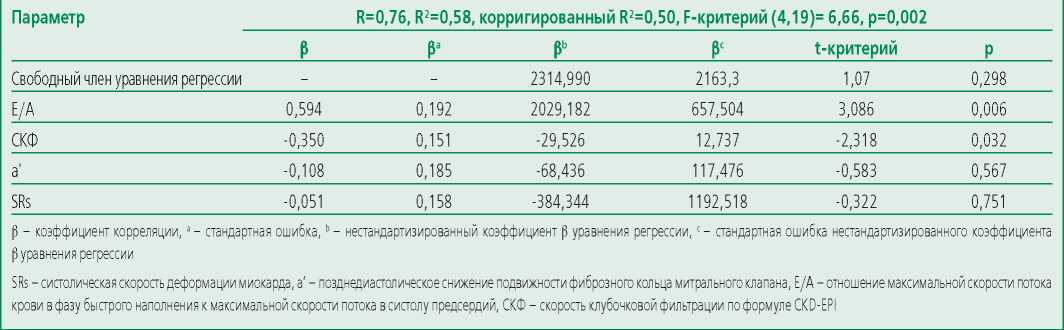
В отличие от показателей посегментной деформации миокарда вклад клубочковой фильтрации в уровень NTproBNP не снижался при добавлении в модель множественной регрессии (R=0,76, табл. 6) такого мощного показателя диастолической дисфункции, как отношение скоростей трансмитрального кровотока Е/А (этот параметр на 59,4% объяснял повышение NtproBNP), и был вторым по значимости (35%), превышая значимость позднедиастолической скорости ФКМК в 3 раза.
За счет существенных взаимовлияний эта модель несколько уступала в адекватности (статистика Дарбина-Уотсона =1,92, коэффициент серийной корреляции =-0,23) модели первого этапа, однако при устранении малозначимых факторов (SRs и a’) адекватность модели практически возвращалась к исходному уровню (статистика Дарбина-Уотсона =2,47, коэффициент серийной корреляции =-0,34).
Оценка весомости уровня NTproBNP по отношению к вероятности летального исхода в логистической модели (χ2[1]=10,7, p=0,001, рис. 3) показывает высокую долю корректных предсказаний летального исхода (56,3%) и, особенно, вероятности выживания (90,0%) пациента по уровню NTproBNP.
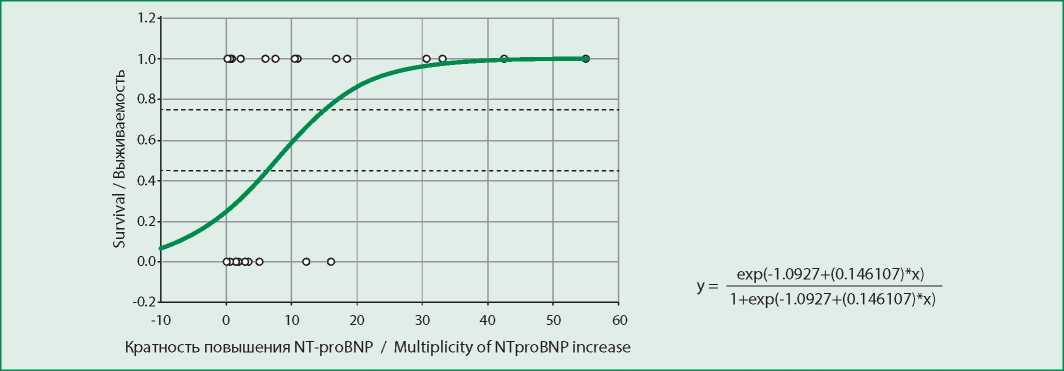
Figure 3. Log-rank model of NTproBNP level influence on survival
Рисунок 3. Логистическая модель влияния уровня NTproBNP на вероятность летального исхода
Обсуждение
Сообщество экспертов по проблеме амилоидоза в мире и авторы статьи, едины во мнении: несмотря на выраженную системность поражения, ведущими факторами неблагоприятного прогноза при AL-амилоидозе являются поражение сердца и ОГ [15-18]. Однако авторы настоящей статьи подчеркивают, что важность этих органных вовлечений имеет неблагоприятное значение, в первую очередь, в дебюте заболевания, в дальнейшем их влияние на выживаемость амилоидоза сердца существенно снижается, вероятно, в условиях современных эффективных схем лечения. В целом изучение этапности прогрессирования амилоидоза сердца затруднено из-за высоких темпов прогрессирования, при этом тяжесть поражения не зависит от давности заболевания. Поэтому исследователи оценивали динамику болезни, главным образом, по показателям выживаемости.
Данные нашего исследования показывают, что такие тяжелые глобальные нарушения внутрисердечной гемодинамики, как падение систолической функции миокарда и рестриктивные нарушения диастолы у больных амилоидозом наиболее четко коррелируют с параметрами подвижности ФКМК, которые отражают не только изменения в самом миокарде, но и перегрузки, связанные с нарушениями гемодинамики. Изменения механических свойств собственно миокарда, пораженного амилоидом, в наибольшей мере возможно по посегментным параметрам деформации. Причем, скорость релаксации в раннюю диастолу (SRe), по сути, отражает активность возврата миокарда к исходному состоянию сокращения и является показателем реакции на скорость систолического укорочения (SRs). Иначе говоря, эта связь является практической моделью растяжения упругой пружины, описываемой законом Гука – выраженность упругой отдачи сильнее при более значительном растяжении. Прямое приложение закона Гука сдерживается вязкостными свойствами миокарда, и в нормальном диапазоне корреляции между SRs и SRe не отмечалось, однако по мере снижения этих параметров ассоциация между параметрами нарастает и становится существенной, что указывает на усиление упругости и ригидности миокарда, пораженного амилоидом.
Снижение скоростей деформации сопровождалось снижением выживаемости, однако менее значительным по сравнению с другими указанными показателями, что позволяет рассматривать эти параметры как ранние признаки амилоидной кардиопатии.
Присоединение нарушений подвижности ФКМК на более продвинутых этапах амилоидной кардиопатии сопровождается, как уже указывалось, более активной реализацией сил Старлинга. Для этих этапов характерно прогрессирование ХБП до 3-5 стадий и, следовательно, эффективное функционирование закона Старлинга может отражать нарастание объемной нагрузки на миокард в результате снижения почечной фильтрации.
Мнение о нарастании объемной перегрузки сердца при присоединении ХБП 3-5 стадий поддерживается также увеличением у этих больных расчетного давления заклинивания легочных капилляров и систолического давления в легочной артерии.
Самостоятельное значение фактора прогрессирования нефропатии подчеркивается существенным снижением медианы выживаемости у этих больных. В то же время выравнивание показателя выживаемости у лиц с нефротическим синдромом, для которого характерно снижение объемной нагрузки, косвенно подчеркивает, что основным действующим фактором 3-5 стадий ХБП на миокард является именно объемная перегрузка
Важность измененных кардиоренальных отношений при амилоидозе и определения уровня NTproBNP в оценке риска амилоидоза сердца подчеркивают многие исследователи [15-18]. Достоинством настоящего исследования является то, что вклад нефропатии в уровень NTproBNP оценен в единой модели с сугубо кардиальными прогностическими маркерами, причем, многократное (в 9,7 раз) превышение NTproBNP, существенно преодолевающее предел, обусловленный ограничением клиренса этого пропептида на 3-5 стадии ХБП, указывает на значимость ренокардиальных отношений в прогрессировании кардиопатии. Уровень NTproBNP, по нашему мнению, важен именно как суммирующий интегральный маркер измененного кардиоренального континуума и может рассматриваться как важнейший диагностический показатель нарушений в этом континууме при амилоидозе. Попытки разделения почечного и кардиального вклада в уровень NTproBNP, характерные для ряда работ [16][17], по мнению авторов статьи, являются несколько умозрительными.
Ограничения исследования. Исследование является по преимуществу описательным с элементами проспективного наблюдения. Тем не менее, значительная группа больных с таким редким заболеванием, как амилоидоз, тщательное многолетнее наблюдение пациентов и адекватные методы статистического сравнения между подгруппами позволяет сделать хорошо обоснованные выводы.
Заключение
В работе показана этапность прогрессирования амилоидоза сердца, причем, прогностическая роль собственно кардиального фактора важна, главным образом, в начальных фазах заболевания, на поздних этапах прогрессирования ведущее значение приобретает взаимовлияние кардиопатии и нефропатии, во многом проявляющееся возрастающей объемной перегрузкой миокарда. В качестве интегрального маркера нарушения кардиоренальных взаимоотношений, подчеркивающего системный характер амилоидоза, выступает уровень NTproBNP, что обосновано в настоящей работе.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование. Исследование проведено при поддержке Первого Московского государственного медицинского университета имени И.М. Сеченова (Сеченовский Университет).
Funding. The study was performed with the support of the Sechenov University
Список литературы
1. Rosenzweig M, Landau H. Light chain (AL) amyloidosis: update on diagnosis and management. J Hematol Oncol. 2011;47(4). DOI:10.1186/1756-8722-4-47.
2. Kyle R, Gertz M. Primary systemic amyloidosis: clinical and laboratory features in 474 cases. Semin Hematol. 1995;32(1):45-59.
3. Patel KS, Hawkins PN. Cardiac amyloidosis: where are we today? J Intern Med. 2015; 278(2):126-44. DOI:10.1111/joim.12383.
4. Rapezzi C, Merlini G, Quarta CC, et al. Systemic cardiac amyloidoses: disease profiles and clinical courses of the 3 main types. Circulation. 2009;120(13):1203-12. DOI:10.1161/CIRCULATIONAHA.108.843334.
5. Obici L, Perfetti V, Palladini G, et al. Clinical aspects of systemic amyloid diseases. Biochim Biophys Acta. 2005;1753(1):11-22. DOI:10.1016/j.bbapap.2005.08.014.
6. Рамеев В.В. Современные методы диагностики и лечения транстиретинового наследственного амилоидоза. Manage Pain. 2018;(1):20-4.
7. Dispenzieri A, Gertz MA, Kyle RA, et al. Serum cardiac troponins and N-terminal pro-brain natriuretic peptide: a staging system for primary systemic amyloidosis. J Clin Oncol. 2004;22(18):375177. DOI:10.1200/JCO.2004.03.029.
8. Dittrich T, Kimmich C, Hegenbart U, Schönland SO. Prognosis and Staging of AL Amyloidosis. Acta Haematol 2020;143:388-399. DOI:10.1159/000508287.
9. Kumar S, Dispenzieri A, Lacy MQ, et al. Revised prognostic staging system for light chain amyloidosis incorporating cardiac biomarkers and serum free light chain measurements. J Clin Oncol. 2012;30(9):989-95. DOI:10.1200/JCO.2011.38.5724.
10. Palladini G, Foli A, Milani P, et al. Best use of cardiac biomarkers in patients with AL amyloidosis and renal failure. Am J Hematol. 2012;87(5):465-71. DOI:10.1002/ajh.23141.
11. Dubrey SW, Hawkins PN, Falk RH. Amyloid diseases of the heart: assessment, diagnosis, and referral. Heart. 2011;97(1):75-84. DOI:10.1136/hrt.2009.190405.
12. Gertz MA, Comenzo R, Falk RH, et al. Definition of organ involvement and treatment response in immunoglobulin light chain amyloidosis (AL): a consensus opinion from the 10th International Symposium on Amyloid and Amyloidosis, Tours, France, 18-22 April 2004. Am J Hematol. 2005;79(4):319-28.
13. Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2015;16(3):233-70. DOI:10.1093/ehjci/jev014.
14. Nagueh SF, Smiseth OA, Appleton CP, et al. Recommendations for the Evaluation of Left Ventricular Diastolic Function by Echocardiography: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr. 2016;29(4):277-314. DOI:10.1016/j.echo.2016.01.011.
15. Muchtar E, Dispenzieri A, Magen H, et al. Systemic amyloidosis from A (AA) to T (ATTR): a review. J Intern Med. 2021;289(3):268-92. DOI:10.1111/joim.13169.
16. Mavrogeni SI, Vartela V, Ntalianis A, et al. Cardiac amyloidosis: in search ofthe ideal diagnostic tool. Herz. 2021;46(Suppl 1):S9-S14. DOI:10.1007/s00059-019-04871-5.
17. Rezk T, Lachmann HJ, Fontana M, et al. Cardiorenal AL amyloidosis: risk stratification and outcomesbased upon cardiac and renal biomarkers. Br J Haematol. 2019;186(3):460-77. DOI:10.1111/bjh.15955.
18. Гудкова А.Я., Лапекин С.В., Бежанишвили Т.Г., и др. AL-амилоидоз с преимущественным поражением сердца. Алгоритм неинвазивной диагностики амилоидной кардиомиопатии. Терапевтический Архив. 2021;93(4):487-96. DOI:10.26442/00403660.2021.04.200689.
Об авторах
А. С. РамееваРоссия
Рамеева Анна Сергеевна
eLibrary SPIN 1322-1017
Москва
В. В. Рамеев
Россия
Рамеев Вилен Вилевич
eLibrary SPIN 1884-4450
Москва
И. Н. Бобкова
Россия
Бобкова Ирина Николаевна
eLibrary SPIN 4217-4514
Москва
А. Ф. Сафарова
Россия
Сафарова Айтен Фуадовна
eLibrary SPIN 2661-6501
Москва
Ж. Д. Кобалава
Россия
Кобалава Жанна Давидовна
eLibrary SPIN-код: 9828-5409
Москва
С. В. Моисеев
Россия
Моисеев Сергей Валентинович
eLibrary SPIN 3462-7884
Москва
Рецензия
Для цитирования:
Рамеева А.С., Рамеев В.В., Бобкова И.Н., Сафарова А.Ф., Кобалава Ж.Д., Моисеев С.В. Ведущие факторы прогрессирования амилоидоза сердца. Рациональная Фармакотерапия в Кардиологии. 2022;18(2):143-152. https://doi.org/10.20996/1819-6446-2022-04-02
For citation:
Rameeva A.S., Rameev V.V., Bobkova I.N., Safarova A.F., Kobalava Zh.D., Moiseev S.V. Leading Factors of Progression in Patients with Cardiac Amyloidosis. Rational Pharmacotherapy in Cardiology. 2022;18(2):143-152. (In Russ.) https://doi.org/10.20996/1819-6446-2022-04-02

















































