Перейти к:
Влияние коронарного шунтирования на возникновение послеоперационной фибрилляции предсердий у пациентов пожилого возраста
https://doi.org/10.20996/1819-6446-2022-04-06
Аннотация
Цель. Изучить факторы, ассоциированные с развитием послеоперационной фибрилляции предсердий (ПОФП) при одно- или двух- и более сосудистом шунтировании у пациентов с ишемической болезнью сердца пожилого возраста.
Материал и методы. Обследовано 454 пациента с ишемической болезнью сердца, подвергнувшихся коронарному шунтированию. Пациенты составили 4 группы: с одно- (1 группа), с двух- (2 группа), с трех- (3 группа) и с четырехсосудистым (4 группа) шунтированием соответственно. За период наблюдения послеоперационная фибрилляция предсердий (ПОФП) развилась у 7,5%, 18,4%, 17,5% и 19,2% пациентов в 1, 2, 3 и 4 группах соответственно. В дальнейшем произведено объединение групп с 2-4-х сосудистым шунтированием ввиду статистически незначимых различий между ними по частоте ПОФП: I группа – пациенты, которым выполнено однососудистое шунтирование (79 больных, 76,0% мужчин, медиана возраста 65,0 [63,0;68,0] лет), II группа – 2-4-x сосудистое шунтирование (357 больных, 78,4% мужчин, медиана возраста 67,5 [64,5;69,0] лет).
Результаты. ПОФП была зарегистрирована в 7,5% случаев в I группе и в 18,4% случаев – во II группе (р=0,03), медиана ее появления – 4,9 [1,2;8,7] сут после КШ. По данным проведенного многофакторного анализа с возникновением ПОФП ассоциировалось время пережатия аорты >36 мин (отношение шансов [ОШ] 1,4; 95% доверительный интервал [ДИ] 1,1-2,8; р=0,03), время ишемии миокарда >19 мин (ОШ 1,7; 95% ДИ 1,2-3,3; р=0,02), возраст >65 лет (ОШ 1,8; 95% ДИ 1,1-4,1; р=0,01), диаметр левого предсердия >39 мм (ОШ 2,9; 95% ДИ 1,5-5,4; р=0,005), а также фракция выброса левого желудочка <51% (ОШ 1,9; 95% ДИ 1,2-3,0; р=0,04).
Заключение. Развитие ПОФП после проведения операции КШ чаще отмечалось у пациентов, перенесших многососудистое коронарное шунтирование. Показателями, ассоциированными с развитием данного нарушения ритма, являлись возраст пациентов >65 лет, время пережатия аорты >36 мин, время ишемии миокарда >19 мин, диаметр левого предсердия >39 мм и фракция выброса левого желудочка <51%.
Ключевые слова
Для цитирования:
Рубаненко О.А., Рубаненко А.О. Влияние коронарного шунтирования на возникновение послеоперационной фибрилляции предсердий у пациентов пожилого возраста. Рациональная Фармакотерапия в Кардиологии. 2022;18(2):160-164. https://doi.org/10.20996/1819-6446-2022-04-06
For citation:
Rubanenko O.A., Rubanenko A.O. The Influence of Multivessel Bypass Surgery on the Onset of Atrial Fibrillation in Elderly Patients. Rational Pharmacotherapy in Cardiology. 2022;18(2):160-164. (In Russ.) https://doi.org/10.20996/1819-6446-2022-04-06
Введение
Ишемическая болезнь сердца (ИБС), как известно, относится к числу ведущих причин смертности и инвалидизации пациентов пожилого возраста. При неэффективности медикаментозной терапии проведение хирургической реваскуляризации, в том числе, коронарного шунтирования (КШ), является приоритетным направлением в лечении заболевания. С другой стороны, оперативное вмешательство на открытом сердце сопряжено с развитием различных осложнений: декомпенсация сердечной недостаточности (СН), когнитивная дисфункция, нарушения ритма, кровотечения.
Фибрилляция предсердий (ФП) является распространенным осложнением после КШ и носит, как правило, транзиторный характер. При этом даже кратковременный эпизод данной аритмии осложняет послеоперационный период, способствуя развитию инсульта и нарастанию СН. В настоящее время активно обсуждается роль сосудистых анастомозов в развитии послеоперационной ФП (ПОФП) [1]. В литературе имеются данные о том, что у пациентов с вышеуказанной аритмией среднее количество дистальных анастомозов статистически значимо не отличалось по сравнению с больными без нее [2]. В исследовании A. Lotfi и соавт. [3] не продемонстрировано значимого влияния количества, а также типа шунтов на частоту возникновения ПОФП, что находит свое отражение и в публикациях других авторов [4]. В то же время нами показано, что многососудистое шунтирование у пациентов до 60 лет чаще сопровождалось возникновением новых случаев ПОФП при сравнении с пациентами с однососудистым шунтированием [5]. Как следует из данных литературы, шкала SYNTAX Score II, разработанная в рандомизированном исследовании SYNTAX Trial и валидизированная в мультицентровом регистре DELTA для оптимизации принятия решения между проведением КШ и чрескожном коронарном вмешательстве у пациентов с многососудистым поражением коронарных артерий, независимо ассоциировалась с риском развития ПОФП [6].
Цель исследования – изучить факторы, ассоциированные с развитием ПОФП при одно- или двух- и более сосудистом шунтировании у пациентов с ИБС пожилого возраста.
Материалы и методы
В исследование было включено 454 пациента с ИБС и выполненным КШ в 2014-2015 гг. на базе СОККД им. В.П. Полякова. Все пациенты подписывали протокол добровольного информированного согласия на участие в исследовании.
В исследование не включались пациенты с острым нарушением мозгового кровообращения, острым инфарктом миокарда, врожденными или приобретенными пороками сердца, документированным значительным снижением функции печени (Класс В и С по Чайлд-Пью) и/или почек (скорость клубочковой фильтрации <50 мл/мин/1,73 м2), диагностированными онкологическими заболеваниями, коагулопатиями, а также нарушением функции щитовидной железы и заболеваниями органов дыхания.
Трансторакальную эхокардиографию выполняли с помощью ультразвуковых сканеров моделей Logiq 5 и 7 (США) по общепринятой методике. Диагноз ФП ставился по прикроватным мониторам во время нахождения пациентов в отделении реанимации и интенсивной терапии, а также при регистрации электрокардиограммы в 12 общепринятых отведениях.
Операция планового КШ осуществлялась по стандартному протоколу на работающем сердце и в условиях искусственного кровообращения с применением тепловой постоянной кровяной кардиоплегии.
Исследование было выполнено в соответствии с принципами Хельсинской декларации. Исследование одобрено на заседании этического комитета ФГБОУ ВО СамГМУ Минздрава России №166 от 02.12.2015.
Для статистической обработки полученных данных мы использовали пакет прикладных программ Statistica 6.1 (Statsoft Inc., США). Ввиду неподчинения данных закону нормального распределения, определяемого графическим методом и с помощью критерия хиквадрат, при статистическом анализе использовались непараметрические методы. Непрерывные переменные представлены в виде медианы (Мe) и межквартильного диапазона [ 25%; 75%], качественные переменные – в виде абсолютного и относительного числа пациентов. Для несвязанных переменных использовался критерий U Манна-Уитни. Для определения показателей, ассоциированных с развитием ПОФП, рассчитывались отношения шансов с помощью логистического регрессионного анализа. Различия считали статистически значимыми при р<0,05.
Результаты
Исходно пациенты были разделены на четыре группы: с одно- (n=79; 76,0% мужчин, медиана возраста 65,0 [ 63,0;68,0] лет), двух- (n=132; 78,0% мужчин, медиана возраста 67,0 [ 64,0;68,0] лет), трех- (n=176; 77,0% мужчин, медиана возраста 68,0 [ 65,5;70,0] лет) и четырехсосудистым (n=67; 80,0% мужчин, медиана возраста 68,5 [ 65,5;69,0] лет) шунтированием. ПОФП развилась соответственно у 7,5%, 18,4%, 17,5% и 19,2% пациентов сформированных групп. Статистически значимых различий по частоте возникновения ПОФП среди пациентов с двух-, трех- и четырехсосудистым шунтированием выявлено не было, поэтому в дальнейшем они были объединены во II группу. Новые случаи развития ПОФП у пациентов, которым проводилось однососудистое шунтирование (I группа), были на 41% реже по сравнению с пациентами II группы (p<0,05).
У пациентов II группы статистически значимо чаще встречался сахарный диабет, они имели более высокие значения диаметра левого предсердия (p<0,05). При
проведении сравнительного анализа не выявлено значимых гендерных различий между группами. По данным коронарографии у пациентов с многососудистым шунтированием на 70% чаще отмечалось стволовое поражение левой коронарной артерии (ЛКА) ≥50%, а время пережатия аорты, искусственного кровообращения (ИК) и ишемии миокарда были на 38%, 27% и 62% соответственно статистически значимо выше, чем у пациентов с однососудистым шунтированием (табл. 1).
Table 1. Clinical characteristics of patients
Таблица 1. Клиническая характеристика больных
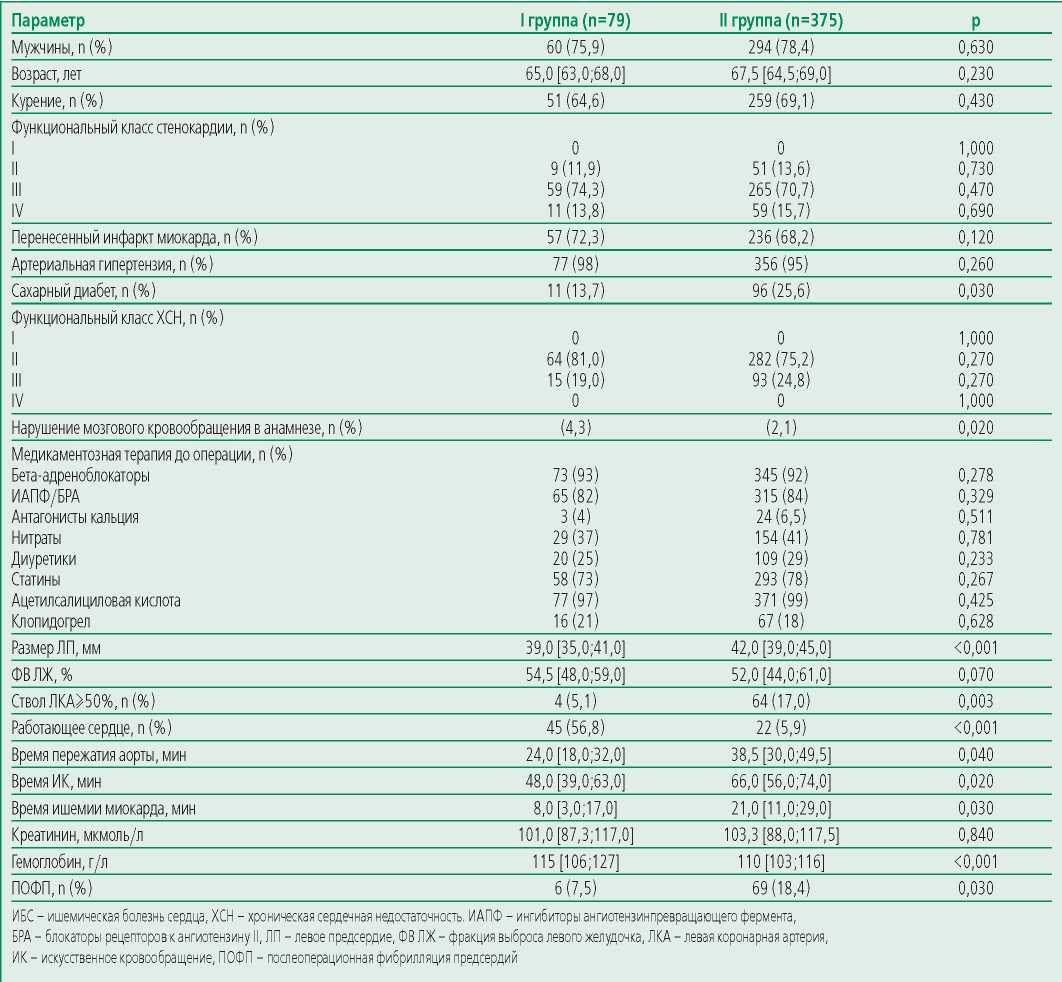
Выявлено, что частота выполнения операции на работающем сердце была выше в I группе по сравнению со II группой (56,8% против 5,9%, р<0,001).
Следует отметить, что время пережатия аорты, ИК и ишемии миокарда при двухсосудистом шунтировании составили 28,0 [ 19,0;37,0] мин, 49,5 [ 40,5;58,0] мин и 8,0 [ 5,0;17,0] мин, при трехсосудистом – 36,0 [ 25,0;44,0] мин, 62,0 [ 54,0;71,0] мин и 14,5 [ 9,0;19,5] мин, при четырехсосудистом – 45,0 [ 37,0;52,0] мин, 74,0 [ 67,0;80,0] мин и 18,5 [ 13,5;24,0] мин соответственно, таким образом, при увеличении количества накладываемых шунтов естественно происходило увеличение затрачиваемого времени.
Для анализа факторов, способствующих возникновению ФП, пациенты разделены на 2 группы: с новыми случаями ПОФП и без данной аритмии.
По данным проведенного однофакторного регрессионного анализа (рис. 1) показателями, статистически значимо ассоциированными с развитием ПОФП, оказались время ИК >56 мин (отношение шансов [ОШ] 2,1; 95% доверительный интервал [ДИ] 1,3-3,7; р=0,004), возраст >65 лет (ОШ 2,2; 95% ДИ 1,2- 4,8; р=0,007), время пережатия аорты >36 мин (ОШ 1,7; 95% ДИ 1,1-5,1; р=0,007), время ишемии миокарда >19 мин (ОШ 2,0; 95% ДИ 1,4-4,9; р=0,01), диаметр ЛП>39 мм (ОШ 3,7; 95% ДИ 2,0-6,4; р=0,002), фракция выброса левого желудочка (ФВ ЛЖ) <51% (ОШ 2,3; 95% ДИ 1,4-4,1; р=0,005). Использование ИК как фактора, ассоциированного с развитием ПОФП, не оценивалось в регрессионном анализе ввиду отсутствия статистически значимых различий в значении данного показателя среди пациентов с ПОФП и без аритмии (р=0,27).
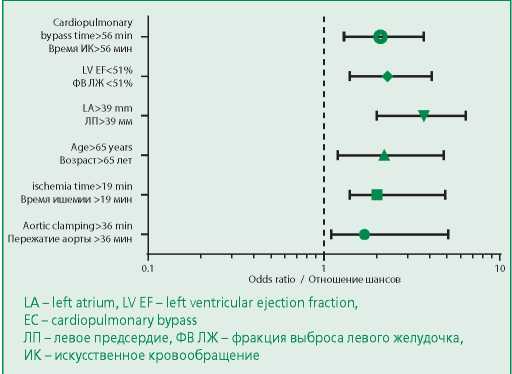
Figure 1. Parameters affecting the development of postoperative atrial fibrillation (univariate analysis)
Рисунок 1. Параметры, влияющие на развитие ПОФП (однофакторный анализ)
Следует отметить, что, многофакторный регрессионный анализ (рис. 2) выявил сохранение предсказательной ценности для таких показателей, как время пережатия аорты (ОШ 1,4; 95% ДИ 1,1-2,8; р=0,03) и ишемии миокарда (ОШ 1,7; 95% ДИ 1,2-3,3; р=0,02), возраста лет (ОШ 1,8; 95% ДИ 1,1-4,1; р=0,01), диаметра ЛП (ОШ 2,9; 95% ДИ 1,5-5,4; р=0,005), ФВ ЛЖ (ОШ 1,9; 95% ДИ 1,2-3,0; р=0,04), однако не для времени ИК (ОШ 1,3; 95% ДИ 0,7-2,9; р=0,54).
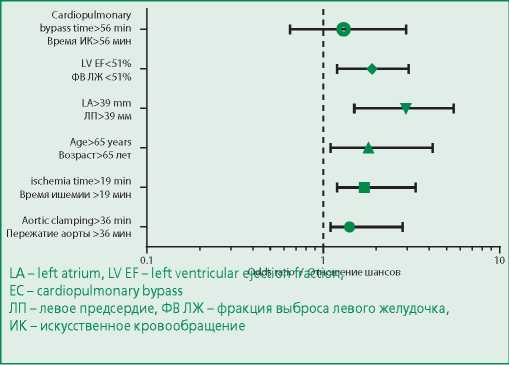
Figure 2. Parameters affecting the development of postoperative atrial fibrillation (multivariate analysis)
Рисунок 2. Параметры, влияющие на развитие ПОФП (многофакторный анализ)
Обсуждение
В нашем исследовании встречаемость ФП после операции КШ была 7,5% при наложении одного шунта и 18,4% – при двух- и более сосудистом шунтировании, что отмечено и в работах других авторов [6, 7].
На данный момент выделяют различные факторы, ассоциирующиеся с возникновением ПОФП. По результатам нашей работы из клинических данных только возраст при многофакторном анализе ассоциировался с риском развития аритмии. Нами не установлено статистически значимых различий среди пациентов обеих групп по значению ФВ ЛЖ (р=0,07), однако было отмечено увеличение диаметра ЛП у пациентов с двухи более сосудистым шунтированием по сравнению с однососудистым (р<0,05). По данным регрессионного анализа среди гемодинамических показателей только размер ЛП и ФВ ЛЖ ассоциировались с развитием ПОФП, что подтверждается работами и других авторов [8, 9].
Стволовое поражение ЛКА≥50%, определяемое в ходе коронарографии, наиболее часто отмечалось у пациентов с трехсосудистым шунтированием, но ассоциация с развитием ПОФП нами выявлена не была, что отличается от результата работы I. Kosmidou и соавт., показавшего, что поражение ЛКА в группе пациентов с данным нарушением ритма встречалось статистически значимо чаще [10].
Существенное влияние на возникновение ПОФП оказывали факторы оперативного вмешательства. В литературе рассматривается ассоциация между количеством шунтов, накладываемых во время реваскуляризации миокарда, и частотой послеоперационной аритмии [7]. Наше исследование показало, что ПОФП чаще возникала у пациентов с двух- и более сосудистым шунтированием, в то же время различий по частоте появления данного нарушения ритма среди этих пациентов нами не продемонстрировано, что согласуется с данными литературы [7]. Это может быть связано с тем, что пациентов с однососудистым шунтированием чаще оперировали на работающем сердце, а пациентов с двух- и более сосудистым шунтированием – чаще в условиях ИК. По имеющимся литературным сведениям, экстракорпоральное кровообращение при низких температурах выступает в качестве негативного фактора оперативного воздействия [11]. В литературе имеются сведения об изменении проницаемости мембран клеток миокарда под воздействием различных гуморальных факторов при проведении КШ [12]. Кроме того, определенную роль может сыграть и травма при канюляции предсердий [12].
Таким образом, применение ИК – возможный фактор риска развития ПОФП. Контакт крови с синтетическими поверхностями системы экстракорпорального кровообращения приводит к активации белковых и клеточных компонентов воспалительного ответа. Воспаление является одним из предикторов ПОФП, влияя на предсердную проводимость. Предполагается, что после ишемически-реперфузионного повреждения миокарда вследствие остановки кардиоплегии в ходе ИК электрическое ремоделирование играет роль в развитии ПОФП [13].
В нашей работе оценка времени ишемии миокарда, пережатия аорты и ИК продемонстрировала нарастание их длительности от одно- до четырехсосудистого шунтирования. По данным E. Bidar и соавт. время пережатия аорты сопряжено с увеличением новых случаев ПОФП [14]. Анализ наших данных показал, что распространенность ПОФП остается сопоставимой в группе двух-, трех- и четырехсосудистого шунтирования. Это можно объяснить наибольшей прогностической ценностью в возникновении аритмии размера ЛП (р=0,005) по данным многофакторного анализа.
По результатам нашего исследования возраст, ФВ ЛЖ, время пережатия аорты и ишемии миокарда также было статистически значимо ассоциировано с риском развития ПОФП. В нашей работе время ИК значимо не связано с риском развития ПОФП по данным многофакторного регрессионного анализа. Наши сведения отличаются от данных литературы, где продемонстрирована большая частота возникновения ПОФП при проведении КШ в условиях ИК при сравнении с операцией без экстракорпорального кровообращения [15].
Ограничения исследования. Одноцентровой характер исследования, небольшое количество пациентов могли оказать влияние на статистическую мощность исследования. Наблюдение за пациентами было ограничено пред- и послеоперационными периодами, что не позволяет судить об отдаленных событиях.
Заключение
Развитие ПОФП после проведения операции КШ чаще отмечалось у пациентов, перенесших многососудистое коронарное шунтирование. Показателями, ассоциированными с развитием данного нарушения ритма, являлись возраст пациентов >65 лет, время пережатия аорты >36 минут, время ишемии миокарда >19 мин, диаметр левого предсердия >39 мм и ФВ ЛЖ<51%. Время ИК не ассоциировалось с риском развития ПОФП по результатам многофакторного регрессионного анализа.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование: Исследование проведено при поддержке Самарского государственного медицинского университета.
Funding: The study was performed with the support of the Samara State Medical University
Список литературы
1. Saito A, Kumamaru H, Ono M, et al. Propensity-matched analysis of a side-clamp versus an anastomosis assist device in cases of isolated coronary artery bypass grafting. Eur J Cardiothorac Surg. 2018;54(5):889-95. DOI:10.1093/ejcts/ezy177.
2. Schoell T, Genser L, Clément M, et al. Bilateral Internal Thoracic Artery Grafting in Women: A Word of Caution. Heart Surg Forum. 2019;22(1):E045-E049. DOI:10.1532/hsf.2067.
3. Lotfi A, Wartak S, Sethi P, et al. Postoperative atrial fibrillation is not associated with an increase risk of stroke or the type and number of grafts: a single-center retrospective analysis. Clin Cardiol. 2011;34(12):787-90. DOI:10.1002/clc.21001.
4. Erdolu B, As AK, Engin M. The Relationship between the HATCH Score, Neutrophil to Lymphocyte Ratio and Postoperative Atrial Fibrillation After Off-Pump Coronary Artery Bypass Graft Surgery. Heart Surg Forum. 2020;23(1):E088-E092. DOI:10.1532/hsf.2771.
5. Рубаненко О.А., Фатенков О.В., Хохлунов С.М., Дупляков Д.В. Объем оперативного вмешательства при проведении коронарного шунтирования и риск послеоперационной фибрилляции предсердий. Кардиология. 2016;56(11):55-60. DOI: 10.18565/cardio.2016.11.55-60.
6. Ozturk S, Kalyoncuoglu M, Sahin M. Comparison of SYNTAX Score I and SYNTAX Score II for Predicting Postoperative Atrial Fibrillation in Patients Undergoing Coronary Artery Bypass Graft Surgery. Heart Surg Forum. 2019;22(5):E319-E324. DOI:10.1532/hsf.2495.
7. Altarabsheh SE, Deo SV, Rababa'h AM. Off-Pump Coronary Artery Bypass Reduces Early Stroke in Octogenarians: A Meta-Analysis of 18,000 Patients. Ann Thorac Surg. 2015;99(5):1568-75. DOI:10.1016/j.athoracsur.2014.12.057.
8. Baeza-Herrera LA, Rojas-Velasco G, Márquez-Murillo MF, et al. Atrial fibrillation in cardiac surgery. Arch Cardiol Mex. 2019;89(4):348-59. DOI:10.24875/ACM.19000134.
9. Stefàno PL, Bugetti M, Del Monaco G, et al. Overweight and aging increase the risk of atrial fibrillation after cardiac surgery independently of left atrial size and left ventricular ejection fraction. J Cardiothorac Surg. 2020;15(1):316. DOI:10.1186/s13019-020-01366-x.
10. Kosmidou I, Chen S, Kappetein AP, et al. New-Onset Atrial Fibrillation After PCI or CABG for Left Main Disease: The EXCEL Trial. J Am Coll Cardiol. 2018;71(7):739-48. DOI:10.1016/j.jacc.2017.12.012.
11. El-Essawi A, Abdelhalim A, Groeger S, et al. Predictors of postoperative atrial fibrillation persisting beyond hospital discharge after coronary artery bypass grafting. Perfusion. 2020:267659120978647. DOI:10.1177/0267659120978647.
12. Yan YB, Shi S, Wu QB, et al. Effect of different cardioprotective methods on extracorporeal circulation in fetal sheep: a randomized controlled trial. J Cardiothorac Surg. 2021;16(1):94. DOI:10.1186/s13019-021-01486-y.
13. Kraft F, Schmidt C, Van Aken H, Zarbock A. Inflammatory response and extracorporeal circulation. Best Pract Res Clin Anaesthesiol. 2015;29(2):113-23. DOI:10.1016/j.bpa.2015.03.001.
14. Bidar E, Maesen B, Nieman F, et al. A prospective randomized controlled trial on the incidence and predictors of late phase post-operative atrial fibrillation up to 30 days and the preventive value of biatrial pacing. Heart Rhythm. 2014;11(7):1156-62. DOI:10.1016/j.hrthm.2014.03.040.
15. Jakubová M, Mitro P, Stančák B, et al. The occurrence of postoperative atrial fibrillation according to different surgical settings in cardiac surgery patients. Interact Cardiovasc Thorac Surg. 2012;15(6):1007-12. DOI:10.1093/icvts/ivs361.
Об авторах
О. А. РубаненкоРоссия
Рубаненко Олеся Анатольевна
Самара
А. О. Рубаненко
Россия
Рубаненко Анатолий Олегович
Самара
Рецензия
Для цитирования:
Рубаненко О.А., Рубаненко А.О. Влияние коронарного шунтирования на возникновение послеоперационной фибрилляции предсердий у пациентов пожилого возраста. Рациональная Фармакотерапия в Кардиологии. 2022;18(2):160-164. https://doi.org/10.20996/1819-6446-2022-04-06
For citation:
Rubanenko O.A., Rubanenko A.O. The Influence of Multivessel Bypass Surgery on the Onset of Atrial Fibrillation in Elderly Patients. Rational Pharmacotherapy in Cardiology. 2022;18(2):160-164. (In Russ.) https://doi.org/10.20996/1819-6446-2022-04-06

















































