Перейти к:
Острое почечное повреждение после транскатетерной имплантации аортального клапана
https://doi.org/10.20996/1819-6446-2022-06-10
Аннотация
Цель. Изучить частоту острого почечного повреждения (ОПП), связанного с транскатетерной имплантацией аортального клапана (TAVI), и выявить предикторы его развития.
Материал и методы. Обследовано 50 больных (39 женщин, 11 мужчин) в возрасте 76 (71; 80) лет, перенесших TAVI. Через сутки после TAVI определяли уровень креатинина в крови по методу Яффе и тропонина I высокочувствительным методом (hs-cTnI). ОПП диагностировали в соответствии с критериями KDIGO (2012). Оценивали следующие госпитальные осложнения: случаи сердечной смерти, интраоперационного инфаркта миокарда (ИМ), инсульта и транзиторной ишемической атаки, имплантации постоянного электрокардиостимулятора, вновь возникших пароксизмов фибрилляции предсердий.
Результаты. ИМ в анамнезе имели 22% больных, стентирование коронарных артерий – 38% лиц, артериальную гипертензию – 98%, хроническую болезнь почек – 48%, сахарный диабет – 24% пациентов, хроническую сердечную недостаточность (ХСН) II функциональный класс (ФК) по NYHA– 52%, IIIФК – 46%, IVФК – 2%. Риск операционной смертности по EuroScore II составил 6,3±5,4%. ОПП после TAVI зарегистрировано у 6 (12%) больных (1 степень – 8%, 2 степень – 2%, 3 степень – 2%). С ОПП после TAVI были ассоциированы высокий ФК ХСН (р=0,020), повышение уровня hs-cTnI (р=0,013), интраоперационный ИМ (р=0,035). Предиктором развития ОПП после TAVI явилось повышение уровня hs-cTnI (отношение шансов 4,0; 95% доверительный интервал 1,0-16,1). Среди больных с ОПП после TAVI по отношению к пациентам без ОПП показатель кумулятивной частоты случаев сердечной смерти, интраоперационного ИМ, инсультов и транзиторных ишемических атак, доле лиц с пароксизмами фибрилляции предсердий и имплантации постоянного электрокардиостимулятора в госпитальный период был в 5,8 раза выше (66,7% против 11,4% соответственно, р=0,001).
Заключение. ОПП после TAVI имелось у 12% больных. Предиктором развития ОПП было повышение уровня hs-cTnI после имплантации TAVI. Госпитальный прогноз после TAVI хуже у больных с послеоперационным ОПП.
Ключевые слова
Для цитирования:
Кремнева Л.В., Гапон Л.И., Шалаев С.В., Крашенинин Д.В. Острое почечное повреждение после транскатетерной имплантации аортального клапана. Рациональная Фармакотерапия в Кардиологии. 2022;18(3):261-267. https://doi.org/10.20996/1819-6446-2022-06-10
For citation:
Kremneva L.V., Gapon L.I., Shalaev S.V., Krasheninin D.V. Acute Kidney Injury after Transcatheter Aortic Valve Implantation. Rational Pharmacotherapy in Cardiology. 2022;18(3):261-267. (In Russ.) https://doi.org/10.20996/1819-6446-2022-06-10
Введение
Достижения медицины последних десятилетий привели к увеличению продолжительности жизни населения различных стран. Однако данная положительная тенденция сопровождается ростом распространенности некоторых заболеваний среди пожилых лиц, в частности, дегенеративных поражений клапанного аппарата сердца, и в том числе – аортальных стенозов. Так, среди лиц старше 75 лет распространенность аортального порока достигает 13% [1].
Основной метод лечения тяжелых пороков – протезирование клапанов сердца. Данные вмешательства увеличивают продолжительность жизни больных, а также существенно улучшают ее качество [2]. Однако у пациентов пожилого и старческого возраста с тяжелой коморбидной патологией операции на открытом сердце с применением искусственного кровообращения являются весьма проблематичными, т.к. сопряжены с очень высоким риском различных послеоперационных осложнений и смертности [3], из-за чего таким больным нередко отказывали в выполнении хирургических вмешательств [4]. Внедрение в клиническую практику малоинвазивного эндоваскулярного способа имплантации аортального клапана (АК), предложенного в 2002 г. A. Cribier и соавт. [5] без преувеличения можно считать одним из наиболее известных достижений современности. У пожилых пациентов с коморбидной патологией транскатетерная имплантация АК (transcatheter aortic valve implantation – TAVI) зачастую является единственным способом устранения аортального стеноза, увеличения продолжительности жизни и улучшения ее качества.
Однако, как любое оперативное вмешательство, TAVI может сопровождаться осложнениями, одним из которых является острое почечное повреждение (ОПП). В ранее проведенных работах показано, что ОПП, связанное с проведением TAVI, как и ОПП, связанное с любыми другими причинами, прогностически неблагоприятно, ассоциировано с прогрессированием хронической болезни почек (ХБП), хронической сердечной недостаточности (ХСН), повышенным риском сердечно-сосудистой и общей смертности [6-8].
В связи с появлением биологических протезов клапанов нового поколения, совершенствованием систем доставки клапанов, повышением опыта сосудистых хирургов необходима повторная оценка частоты и предикторов ОПП, возникшего после TAVI.
Цель исследования – изучить частоту ОПП, связанного с TAVI и выявить предикторы его развития.
Материал и методы
Проведен анализ случаев заболеваний пациентов с тяжелым дегенеративным аортальным пороком сердца, которым выполнена TAVI. Показания к TAVI определяли в соответствии с актуальными рекомендациями [9]. Критериями исключения являлись: необходимость в двух- и трехклапанном протезировании, репротезировании клапана аорты, протезировании восходящего отдела аорты.
Всем больным до выполнения TAVI проводилось общеклиническое обследование, в том числе, определение уровня сывороточного креатинина, электрокардиография, эхокардиография (ЭХОКГ) на аппарате Vivid E 90 (GE, США), мультиспиральная компьютерная томография (МСКТ) – ангиография аорты и сердца на аппарате Somatom Definition Flash 256 (Германия), коронарография (КАГ) по методу M.P.Judkins [10] на установке Philips Polidiagnos C (Нидерланды).
Пациентам выполнялась транскатетерная имплантация биологического протеза в нативный аортальный клапан. Размер биопротеза клапана подбирали соответственно данным ранее выполненной МСКТ – ангиографии аорты и сердца. При этом измеряли размеры фиброзного кольца аортального клапана (максимальный, минимальный диаметр, площадь и периметр), расстояние от устьев коронарных артерий до фиброзного кольца, диаметры восходящего отдела аорты, выносящего тракта левого желудочка, аорты на уровне синусов Вальсальвы и синотубулярного сочленения, высоту синусов Вальсальвы, угол аорты, проводили оценку выраженности и симметричности кальциноза створок аортального клапана, а также измеряли размеры и оценивали атеротромботические изменения подвздошных и бедренных артерий. Использовали трансфеморальный доступ. При имплантации клапана вводили рентгеноконтрастное средство (йопромид), при этом учитывали максимально допустимый объем вводимого контраста.
До и через 24 ч после TAVI определяли сывороточный уровень креатинина кинетическим методом (метод Яффе) на аппарате Synchron CX Systems (Beckman Coulter, США). При нарастании уровня креатинина в крови через 24 ч после TAVI в сравнении с исходным исследование повторяли ежедневно до достижения значений, имевшихся до вмешательства, или до периода выписки пациента из стационара. При расчете скорости клубочковой фильтрации (СКФ) применяли формулу CKD-EPI. О наличии ОПП и его тяжести судили по нарастанию уровня сывороточного креатинина после операции в сравнении с исходным уровнем (критерии KDIGO, 2012) [11]. Всем пациентам через 24 ч после TAVI определяли уровень сердечного тропонина I (hs-cTnI) в крови высокочувствительным хемилюминесцентным иммуноферментным методом на приборе PATHFAST (LSI Medience Corporation, Япония). Уровень 99-го процентиля hs-cTnI составил 0,012 нг/мл у женщин и 0,017 нг/мл у мужчин. Исходно и неоднократно в первые сутки после TAVI определяли уровень гликемии электрохимическим методом с помощью чип-сенсоров на аппарате BIOSENC-line Clinic (Германия), рассчитывали средний уровень гликемии. Электрокардиографию проводили исходно и после TAVI ежедневно до выписки больного из стационара. В период нахождения пациентов в палате интенсивной терапии проводили непрерывное мониторирование электрокардиограммы. За период стационарного лечения неоднократно выполняли ЭХОКГ – исходно, на следующие сут после TAVI, перед выпиской из стационара.
Оценивали следующие госпитальные осложнения: случаи смерти от кардиальных причин, ОПП, интраоперационного инфаркта миокарда (ИМ), инсульта и транзиторной ишемической атаки, имплантации постоянного электрокардиостимулятора (ЭКС), пароксизма фибрилляции предсердий (ФП). Интраоперационный ИМ диагностировали в соответствии с критериями ИМ 4 типа [12].
Исследование проводилось в соответствии с принципами Хельсинской декларации. Протокол исследования одобрен этическими комитетами ФГБОУ ВО «Тюменский государственный медицинский университет» и Тюменского кардиологического научного центра – филиала ФГБНУ «Томский национальный исследовательский медицинский центр РАН». У всех пациентов получено добровольное информированное согласие на участие в исследовании.
Статистическую обработку материалов исследования проводили с использованием пакета программ SPSS Statistics 23 (IBM, США). При оценке нормальности распределения данных использовали критерий Колмогорова-Смирнова. При уровне критерия Колмогорова-Смирнова более 0,05 распределение переменных считали нормальным, при значении менее 0,05 – ненормальным. В зависимости от вида распределения данных результаты представлены в виде среднего и стандартного отклонения (М±SD) или медианы (Me) и межквартильного диапазона (25%; 75%). При оценке значимости различий между группами для количественных показателей использовали двухсторонний критерий Стьюдента, критерий Манна-Уитни. Качественные данные сравнивали с использованием таблиц сопряженности и применением критерия χ2 Пирсона, а также с использованием точного критерия Фишера. Максимально допустимый объем вводимого рентгеноконтрастного средства рассчитывали по формуле R.G. Cigarroa [13]. Рассчитывали также коэффициент, отражающий отношение количества введенного рентгеноконтрастного средства к количеству максимально допустимого контраста. Для выявления предикторов развития ОПП использовали метод пошагового логистического регрессионного анализа, при этом проводили оценку отношения шансов (ОШ) и границ 95% доверительного интервала (ДИ). Статистически значимыми считали различия показателей при p<0,05.
Результаты
В анализ включено 50 больных (39 женщин и 11 мужчин), перенесших TAVI. Клинические характеристики пациентов и проводимая терапия представлены в табл. 1. Это были пожилые пациенты, 98% из которых имели АГ, 48% – ХБП, 50% – ожирение, 24% – сахарный диабет 2 типа. Больные имели высокий риск операционной смертности по EuroScore II. Результаты ЭХОКГ обследования больных представлены в табл. 2.
Table 1. Clinical characteristics of patients who underwent transcatheter aortic valve implantation (n=50)
Таблица 1. Клиническая характеристика больных, перенесших TAVI (n=50)

Table 2. Baseline echocardiographic parameters of patients undergoing TAVI (n=50)
Таблица 2. Исходные эхокардиографические показатели больных, перенесших TAVI (n=50)
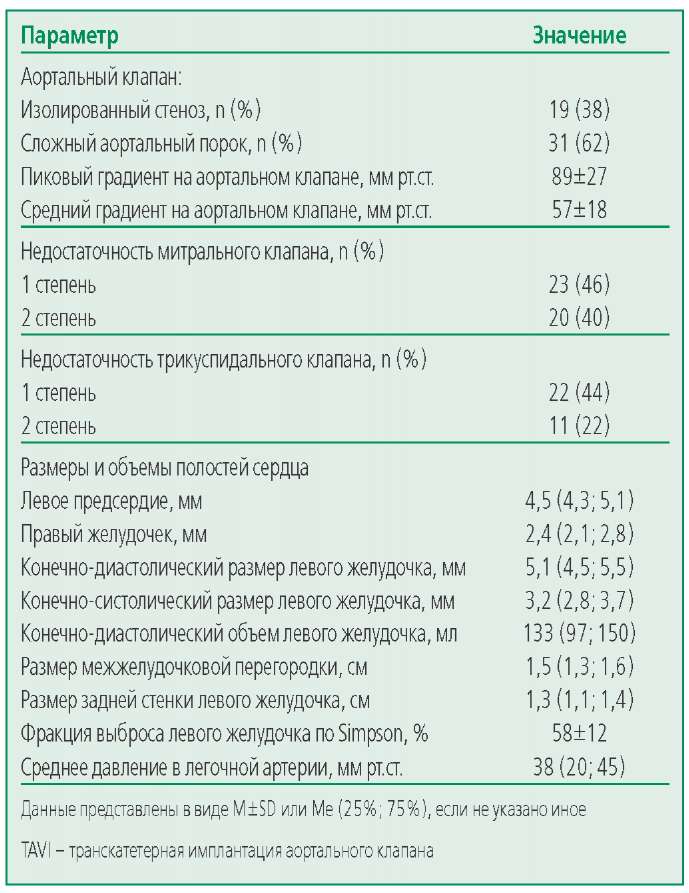
Транскатетерная имплантация клапана Core Valve Evolut R (Medtronic, США) проведена 36 (72%) больным, клапанa ACURATE neo AORTIC BIOPROSTHESIS (Boston Scientific, CША) – 14 (28%). Медиана длительности операции составила 90 (70; 110) мин, кровопотери во время операции – 100 (70; 200) мл. В среднем было введено 118±39,3 мл рентгеноконтрастного средства (максимально допустимое количество – 308±87 мл; отношение количества введенного контраста к максимально допустимому 0,42±0,20). Ни у одного их пациентов количество введенного контраста не превышало максимально допустимый объем. За первые сутки после вмешательства объем инфузионной терапии составил 1500 (1400; 1800) мл, выпито пациентом – 600 (400; 650) мл, диурез – 1250 (1100; 1825) мл, т.е. имелся положительный гидробаланс. Уровень hscTnI через 24 ч после TAVI составил 0,19 (0,11; 0,34) нг/мл, уровень гликемии в первые сутки вмешательства – 7,3 (5,9; 8,0) ммоль/л. Для поддержания гемодинамики во время операции и раннем послеоперационном периоде вазопрессорные и инотропные препараты (адреналин, допамин) использованы у 18 (36%) пациентов. Всем больным на следующий день после TAVI выполнено ЭХОКГ. Пиковый градиент на АК после TAVI составил 16,5±5,5 мм рт.ст., средний – 9,5±3,4. Остаточная паравальвулярная недостаточность 1 степени имелась у 42 (84%) лиц. При ЭХОКГ, проведенной через 8,0±5,7 дней после TAVI (перед выпиской пациентов из стационара), пиковый градиент на АК составил 13,6±2,7мм рт.ст., средний – 6,9±1,7. ОПП развилось у 6 (12%) больных, перенесших TAVI. ОПП 1 стадии выявлено у 4 (8%), 2 – у 1 (2%), 3 – у 1 (2%) пациента. Отсутствовали статистически значимые различия в частоте ОПП, связанного с TAVI, между группами больных с исходной ХБП и без таковой. Так, ОПП в группе больных с ХБП отмечена у 4 из 24 (16,7%), среди пациентов без ХБП – у 2 из 26 (7,7%) лиц (р=0,409). Статистически значимых отличий в количестве введенного рентгеноконтрастного средства между группами больных с ХБП и без ХБП не выявлено [ 110 (96; 150) против 100 (100; 150) мл соответственно, р=0,488]. Отношение количества введенного контраста к максимально допустимому был выше у больных с ХБП [ 0,46 (0,38; 0,67) против 0,29 (0,21; 0,44), р=0,001].
Объем введенного рентгеноконтрастного средства во время операции в группе пациентов с ОПП составил 105±24 мл против 120±41 мл у лиц без ОПП, р=0,353), максимально допустимый объем контраста – 273±84 и 313±87 мл соответственно (р=0,324), отношение количества введенного контраста к максимально допустимому – 0,40±0,11 и 0,42±0,21 (р=0,869).
Уровень сывороточного креатинина после TAVI в сравнении с исходным не изменился (91±44,9 и 91±26,6 мкмоль/л соответственно, р=0,977). Среди пациентов с ОПП концентрация креатинина после TAVI в сравнении с исходным значением значимо повысилась (с 104±27,4 до 193±43,5 мкмоль/л, р=0,008).
ОПП 2 и 3 стадий зарегистрировано по 1 случаю, которые были связаны с интраоперационным ИМ. Одному пациенту проводилась заместительная почечная терапия (гемофильтрация), на 4-е сут зарегистрирована его смерть вследствие тяжелой полиорганной недостаточности. У другого больного на фоне терапии уровень креатинина снизился до исходных значений ко времени выписки из отделения.
Для выявления предикторов ОПП, возникшего после TAVI, проведен пошаговый логистический регрессионный анализ с включением изучаемых характеристик. Показателями, ассоциированными с развитием ОПП после TAVI, явились: более высокий ФК ХСН, повышение уровня hs-cTnI через 24 ч после вмешательства, развитие интраоперационного ИМ (табл. 3). У больных с интраоперационным ИМ уровень hscTnI через 24 ч после TAVI составил 4,4±2,43 нг/мл. По результатам логистического регрессионного анализа предиктором развития ОПП, связанного с проведением TAVI, явилось повышение hs-cTnI через сут после вмешательства (табл. 4).
Table 3. Indicators associated with transcatheter aortic valve implantation related with acute kidney injury (results of univariate analysis)
Таблица 3. Показатели, ассоциированные с ОПП, связанным с TAVI (результаты унивариантного анализа)
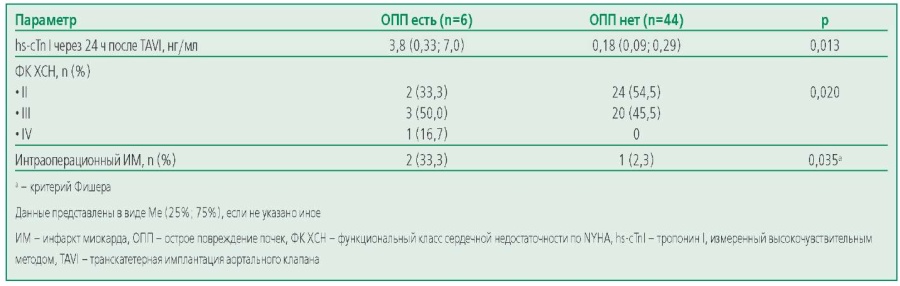
Table 4. Predictors of transcatheter aortic valve implantation related with acute kidney injury (results of stepwise logistic regression analysis)
Таблица 4. Предикторы ОПП, связанного с TAVI (результаты пошагового логистического регрессионного анализа)

Доля больных, имевших госпитальные осложнения после TAVI, составила 18% (n=9). Зарегистрировано 6 (12%) случаев ОПП, 3 (6%) – интраоперационного ИМ, 2 (4%) – инсультов/транзиторной ишемической атаки (ТИА), 3 (6%) – имплантации постоянного ЭКС, 1 (2%) – пароксизмов ФП, 2 (4%) – смерти от сердечно-сосудистых причин. Один случай смерти наступил на 2-е, второй – на 4-е сут после TAVI вследствие интраоперационного ИМ.
Также проанализирована частота послеоперационных госпитальных осложнений в группах больных с ОПП и без ОПП, связанного с TAVI (табл. 5).
Table 5. Hospital postoperative complications in groups of patients with or without acute kidney injury associated with transcatheter aortic valve implantation
Таблица 5. Госпитальные послеоперационные осложнения в группах больных с или без ОПП, связанного с TAVI
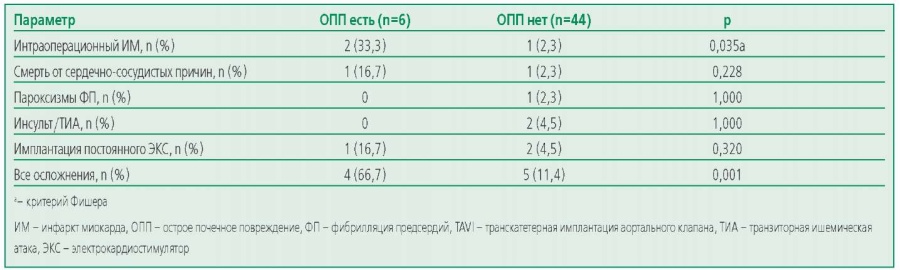
Между анализируемыми группами больных выявлены статистически значимые различия только в частоте интраоперационного ИМ, количество которых было больше в группе пациентов с послеоперационным ОПП. Среди пациентов с ОПП, связанным с TAVI, по сравнению с группой без ОПП госпитальные осложнения отмечались в 5,8 раз чаще.
Обсуждение
В нашем исследовании частота ОПП после TAVI составила 12%. У большинства пациентов зарегистрировано ОПП 1 стадии (8%), и только 4% больных имели 2 и 3 стадию заболевания. У преобладающего числа лиц послеоперационное ОПП было транзиторным, и уровень креатинина возвращался к исходному еще до выписки из стационара. Полученные нами результаты о частоте ОПП после TAVI вполне соответствуют данным ранее проведенных крупных зарубежных исследований. Так, частота ОПП после TAVI по данным различных крупных исследований, включавших от 420 до 1086 больных, составляла от 6,7% [14] до 15-18% [ 6,15,16], при этом основная доля приходилась на пациентов с 1 и 2 стадией заболевания.
Следует отметить, что у 24 (48%) больных, включенных в наш анализ, исходно имелась ХБП. Нами не получено данных об ассоциации предшествовавшей ХБП с повышенным риском развития ОПП после TAVI. В литературе приводятся данные о том, что ХБП – один из основных факторов риска развития послеоперационного ОПП [17]. Так, в крупном мета-анализе J. Wang и соавт., включавшем 2673 пациента, перенесших TAVI, показано, что факторами, существенно повышавшими риск развития послеоперационного ОПП, являлись ХСН IV ФК по NYHA [отношение рисков (ОР) 7,8], предшествующая ХБП (ОР 2,8), необходимость в переливании крови после вмешательства (ОР 2,0) [17].
Согласно данным других авторов независимыми предикторами развития ОПП после TAVI были пожилой возраст, сахарный диабет, большие и умеренные кровотечения [6][15]. В нашем исследовании факторами, ассоциированными с развитием послеоперационного ОПП, связанного с TAVI, оказались ХСН III и IV ФК по NYHA (р=0,020), интраоперационный ИМ (р=0,035) и повышение уровня hs-cTnI после вмешательства (р=0,013). При этом предиктором развития послеоперационного ОПП было повышение hs-cTnI через 24 ч после TAVI (OШ 4,0, 95% ДИ 1,0-16,114).
В отличие от других работ [6][15] нами не получено данных об ассоциации послеоперационного ОПП, связанного с TAVI, с возрастом больных, исходной ХБП, наличием сахарного диабета, послеоперационной кровопотерей, что может быть связано с небольшим количеством включенных в исследование пациентов.
Вместе с тем следует обратить внимание на тот факт, что повышение уровня hs-cTnI после TAVI как предиктор развития послеоперационного ОПП ранее не был описан и выявлен нами впервые. Механизм развития ОПП при повреждении миокарда, связанном с TAVI, может быть обусловлен снижением сердечного выброса, нестабильностью гемодинамики, гипоперфузией и гипоксией почек.
Нами получены данные о неблагоприятном госпитальном прогнозе у больных с ОПП, развившимся после TAVI. Так, кумулятивная частота госпитальных осложнений была в 5,8 раз больше среди больных с послеоперационным ОПП (р<0,001). При анализе отдельных госпитальных осложнений значимые различия установлены только в частоте интраоперационного ИМ, количество которых было больше среди пациентов с ОПП, возникшим после TAVI, что соответствует литературным данным. Так, в мета-анализе исследований М. Najjar и соавт. (n=6000) [18], а также в ряде крупных исследований с участием 794-1086 пациентов [6-8] показано, что ОПП, возникшее после TAVI, является независимым предиктором 30-дневной и годовой смертности от сердечно-сосудистых и всех причин. При этом A. Haase-Fielitz и соавт. обращают внимание на тот факт, что у 48% больных, перенесших ОПП после TAVI, в течение последующих 6 мес происходило прогрессирование ХБП, предшествовавшей оперативному вмешательству [8].
Ограничения исследования. Ограничением нашего исследования явилось небольшое количество включенных пациентов, что оказывает влияние на мощность полученных результатов.
Заключение
У больных с критическим дегенеративным аортальным пороком сердца частота ОПП после TAVI составила 12%. Факторами, ассоциированными с развитием ОПП, связанного с TAVI, явились: высокий ФК ХСН, интраоперационный ИМ, повышение hs-cTnI через 24 ч после вмешательства. Предиктором развития ОПП, связанного с TAVI, было повышение уровня hs-cTnI через 24 ч после вмешательства. Госпитальный прогноз после TAVI оказался хуже у пациентов с послеоперационным ОПП.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование. Исследование проведено при поддержке государственного бюджетного учреждения здравоохранения Тюменской области «Областная клиническая больница №1».
Funding. The study was performed with the support of the Tyumen Regional Clinical Hospital №1.
Список литературы
1. Nkomo VT, Gardin IM, Skelton TN, et al. Burden of valvular heart diseases: a population-based study. Lancet. 2006;368(9540):1005-11. DOI:10.1016/S0140-6736(06)69208-9.
2. Ross J, Braunwald E. Aortic stenosis. Circulation. 1968;38(1s5):61-7.DOI: 10.1161/01cir.38.1s5.6167.
3. Smith CR, Leon MB, Mack MJ, et al. PARTNER Trial Investigators. Transcatheter versus surgical aortic - valve replacement in high-risk patients. N Engl J Med. 2011;364(23):2187-98. DOI:10.1056/NEJMoA1103510.
4. Iung B, Cachier A, Baron G, et al. Decision - making in elderly patients with severe aortic stenosis: why are so many denied surgery? Eur Heart J. 2005;26(24):2714-20. DOI:10.1093/eurheartj/ehi471.
5. Cribier A, Eltchaninoff H, Bash A, et al. Percutaneous transcatheter implantation of an aortic valve prosthesis for calcific aortic stenosis: first human case description. Circulation. 2002;106(24):30068. DOI:10.1161/01.cir.0000047200.36165.b8.
6. Filho ACB, Katz M, Campos CM, et al. Impact of Acute Kidney Injury on Short - and Long-term Outcomes After Transcatheter Aortic Valve Implantation. Rev Esp Cardiol. 2019;72(1):1:21-9. DOI:10.1016/j.rec.2017.11.024.
7. Bassat OKB, Finkelstein A, Bazan S, et al. Acute kidney injury after transcatheter aortic valve implantation and mortality risk-long-term follow-up. Nephrol Dial Transplant. 2020;35(3):433-8. DOI:10.1093/ndt/gfy264.
8. Haase-Fielitz A, Altendeitering F, Iwers R, et al. Acute Kidney injury may Impede results after transcatheter aortic valve implantation. Clin Kidney J. 2020;14(1):261-8. DOI:10.1093/ckj/sfaa179.
9. Baumgartner H, Falk V, Bax JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2017;38(36):2739-91. DOI:10.1093/eurheartj/ehx391.
10. Judkins MP. Selective coronary arteriography, a percutaneous transfemoral technic. Radiology 1967;89(5):815-22. DOI:10.1148/89.5.815.
11. Fliser D, Laville M, Covic A, et al. A European Renal Best Practice (ERBP) position statement of the Kidney Disease Improving Global Outcomes (KDIGO) Clinical Practice Guidelines on Acute Kidney Injury. Part 1. Definition, Conservative management and contrast-induced nephropathy. Nephrol Dial Transplant. 2012;27(12):4263-72. DOI:10.1093/ndt/gfs375.
12. Thygesen K, Alpert JS, Jaffe AS, et al. Fourth universal definition of myocardial infarction. 2018. Eur Heart J. 2018;138(20):e618-51. DOI:10.1093/eurheartj/ehy462.
13. Cigarroa RG, Lange RA, Williams RH, Hillis D. Dosing of contrast material to prevent contrast nephropathy in patients with renal disease. Am J Med. 1989:86(6):649-52. DOI:10.1016/00029343(89)90437-3.
14. Venturi G, Pighi M, Pesarini G, et al. Contrast-induced Acute Kidney Injury in Patients Undergoing TAVI Compared With Coronary Interventions. J Am Heart Assoc. 2020;9(16):e017194. DOI:10.1161/JAHA.120.017194.
15. Konigsten M, Ben-Assa E, Banai S, et al. Periprocedural bleeding, acute kidney injury, and long-term mortality after transcatheter aortic valve implantation. Can J Cardiol. 2015;31(1):56-62. DOI:1016/j.cjca.2014.11.006.
16. Bassat OK, Finkelstein A, Bazan S, et al. Acute kidney injury after transcatheter aortic valve implantation and mortality risk-long-term follow-up. Nephrol Dial Transplant. 2020;35(3):433-8. DOI:10.1093/ndt/gfy264.
17. Wang J, Yu W, Zhou Y, et al. Independent Risk Factors Contributing to аcute Kidney Injury According to Uptated Valve Academic Research Consortium-2 Criteria After Transcarheter Aortic Valve Implantation: A Meta-analysis and Meta-regression of 13 Studies. J Cardiothorac Vasc Anesth. 2017;31(3):816-26. DOI:10.1053/j.jvca.2016.12.021.
18. Najjar M, Salna M, George I. Acute Kidney injury after aortic valve replacement: incidence, risk factors and outcomes. Expert Rev Cardiovasc Ter. 2015;13(3):301-16. DOI:10.1586/ 14779072.2015.1002467.
Об авторах
Л. В. КремневаРоссия
Кремнева Людмила Викторовна- eLibrary SPIN 9369-3526.
Тюмень
Л. И. Гапон
Россия
Гапон Людмила Ивановна - eLibrary SPIN 2291-2342.
Тюмень
С. В. Шалаев
Россия
Шалаев Сергей Васильевич - eLibrary SPIN 5285-0082.
Тюмень
Д. В. Крашенинин
Россия
Крашенинин Дмитрий Владиславович- eLibrary SPIN 3585-2274.
Тюмень
Рецензия
Для цитирования:
Кремнева Л.В., Гапон Л.И., Шалаев С.В., Крашенинин Д.В. Острое почечное повреждение после транскатетерной имплантации аортального клапана. Рациональная Фармакотерапия в Кардиологии. 2022;18(3):261-267. https://doi.org/10.20996/1819-6446-2022-06-10
For citation:
Kremneva L.V., Gapon L.I., Shalaev S.V., Krasheninin D.V. Acute Kidney Injury after Transcatheter Aortic Valve Implantation. Rational Pharmacotherapy in Cardiology. 2022;18(3):261-267. (In Russ.) https://doi.org/10.20996/1819-6446-2022-06-10

















































