Перейти к:
Ароматические аминокислоты: фенилаланин и тирозин у пациентов с артериальной гипертензией и ишемической болезнью сердца
https://doi.org/10.20996/1819-6446-2022-06-05
Аннотация
Цель. Оценить изменение профиля ароматических аминокислот (АА): фенилаланина (Фен) и тирозина (Тир), являющихся предшественниками биологически активных веществ и гормонов, у пациентов с сердечно-сосудистыми заболеваниями (ССЗ): артериальной гипертензией (АГ) и ишемической болезнью сердца (ИБС) в сравнении со здоровыми участниками исследования.
Материал и методы. В исследование были включены 131 участников: в группу АГ вошло 58 человек, в группу ИБС – 46, в контрольную группу – 27 человек без ССЗ. Использовалась сверхпроизводительная жидкостная хроматография в сочетании с тройным квадрупольным анализатором для измерения AA (Фен, Тир) в плазме крови у всех участников исследования. Была проанализирована связь АA с показателями липидного профиля, параметрами эхокардиографии, уровнем артериального давления и наличием атеросклероза периферических и коронарных артерий (КА).
Результаты. При сравнении трех групп было выявлено статистически значимое различие по уровню концентрация Фен и Тир (p=0,002 и р=0,024 соответственно). При проведении апостериорного попарного сравнения с помощью post-hoc анализа, циркулирующий уровень обеих аминокислот различался только у пациентов с ИБС и группой контроля (p=0,008 и р=0,020 соответственно), также отмечалось статистически значимое различие по уровню Фен групп АГ и ИБС (p=0,017). Обнаружена обратная корреляция липопротеинов низкой плотности (ЛНП) с уровнем Фен (r=-0,685, р<0,05) и Тир (r=-0,583, р<0,05), а также уровня фенилаланина с общим холестерином (r=-0,461, р<0,05) в группе без ССЗ. В группе АГ лишь между липопротеинами очень низкой плотности и уровнями АА была выявлена слабая положительная корреляция (Фен r=0,326 и Тир r=0,365, р<0,05), в то время как у пациентов с ИБС уровень Фен и Тир обратно коррелировал с показателем липопротеина высокой плотности (r=-0,378 и r=-0,543 соответственно, р<0,05), а уровень Тир – с показателем ЛНП (r=-0,349, р<0,05). При выделении группы с доказанным атеросклерозом периферических артерий и/или КА выявлено статистически значимое различие между группой пациентов с ССЗ и клинико-инструментальными признаками атеросклероза и группой пациентов с ССЗ без доказанного атеросклероза по уровню Фен (p=0,019).
Заключение. У пациентов с ССЗ определялись значимо более высокие концентрации АА в сравнении с контрольной группой. При этом повышение уровня Фен характерно для наличия периферического или коронарного атеросклероза. Выявленные корреляции АА с параметрами ремоделирования миокарда и показателями липидного спектра требуют дальнейшего изучения для понимания участия АА в патогенезе ССЗ и их потенциальную роль в качестве терапевтической мишени.
Для цитирования:
Кривова А.В., Кожевникова М.В., Коробкова Е.О., Зекцер В.Ю., Железных Е.А., Агеев А.А., Москалева Н.Е., Кухаренко А.В., Апполонова С.А., Беленков Ю.Н. Ароматические аминокислоты: фенилаланин и тирозин у пациентов с артериальной гипертензией и ишемической болезнью сердца. Рациональная Фармакотерапия в Кардиологии. 2022;18(3):297-305. https://doi.org/10.20996/1819-6446-2022-06-05
For citation:
Krivova A.V., Kozhevnikova M.V., Korobkova E.O., Zektser V.Yu., Zheleznykh E.A., Ageev А.A., Moskaleva N.E., Kukharenko A.V., Appolonova S.A., Belenkov Yu.N. Aromatic Amino Acids: Phenylalanine and Tyrosine in Patients with Hypertension and Coronary Artery Disease. Rational Pharmacotherapy in Cardiology. 2022;18(3):297-305. (In Russ.) https://doi.org/10.20996/1819-6446-2022-06-05
Введение
Благодаря достижениям в области анализа низкомолекулярных соединений, в течение последнего десятилетия активно ведутся работы по оценке метаболомного профиля плазмы при различных сердечнососудистых заболеваниях (ССЗ) [1-3]. Учитывая, что при любом заболевании возникает дисбаланс циркулирующих аминокислот, что, в свою очередь, оказывает специфическое влияние на различные патофизиологические процессы и функции организма, их изучение представляется перспективным направлением для наилучшего понимания патогенеза конкретного заболевания, а также поиска новых эффективных биомаркеров и терапевтических мишеней [1].
Особого внимания в контексте экспериментальных и клинических исследований заслуживают ароматические аминокислоты (АА), которые служат предшественниками синтеза биологически активных веществ, гормонов и некоторых пигментов (меланин) и участвуют в синтезе белков [4-6]. АА, получившие название за наличие в своей структуре ароматического бензольного кольца, являются гликокетогенными аминокислотами, которые используются для синтеза глюкозы и кетоновых тел, так как в процессе их катаболизма образуются 2 продукта – фумарат и ацетоацетат. К ним относятся незаменимая аминокислота фенилаланин (Фен) и частично заменимая – тирозин (Tир). Одним из основных путей метаболизма Фен, который катализирует фенилаланингидроксилаза, является его преобразование в Тир. В свою очередь роль Tир заключается в его использовании в разных тканях для синтеза катехоламинов (дофамин, норадреналин, адреналин), йодтиронинов (тироксин, трийодтиронин) и пигмента меланина. На данный момент наиболее изучена роль АА в развитии таких заболеваний, как фенилкетонурия, альбинизм, болезнь Паркинсона, шизофрения. По данным экспериментальных и клинических исследований, роль изменений уровня циркулирующих AA в развитии ССЗ достаточно противоречива [7]. Большинство опубликованных данных относительно вклада АА в развитие ССЗ демонстрирует связь АА с ожирением, дислипидемией и, возможно, с артериальной гипертензией (АГ) [4][5]. Более того, показано что АА являются независимыми предикторами развития сахарного диабета, а также связаны с повышенным риском прогрессирования атеросклероза. Остается неясным, способны ли эти аминокислоты служить маркерами ишемической болезни сердца (ИБС), особенно – при субклиническом атеросклерозе [6]. Наибольший интерес представляет изучение уровня циркулирующих аминокислот Фен и Tир у пациентов с АГ и ИБС, как самых распространенных ССЗ.
Цель исследования – изучить изменение профиля АА (Фен и Тир), являющихся предшественниками биологически активных веществ и гормонов, у пациентов с АГ или ИБС в сравнении со здоровыми участниками исследования.
Материал и методы
В исследование были включены 131 пациент, обследованные в отделении кардиологии №1 Университетской клинической больницы №1 (Сеченовский Университет) в период с 2018 по 2020 гг. В группу с АГ вошло 58 пациентов, в группу с ИБС – 46, а группу контроля составили 27 участников без признаков ССЗ. Критерии включения в основные группы: подписанное информированное согласие, возраст от 18 лет, верифицированный диагноз АГ или ИБС в соответствии с актуальными клиническими рекомендациями [8][9]. Критерии невключения: вторичная АГ, приобретенные и врожденные пороки сердца, гемодинамически значимые клапанные поражения, кардиомиопатии, бронхиальная астма и хроническая обструктивная болезнь легких в стадии обострения, заболевания соединительной ткани, онкологические заболевания, хронические вирусные инфекции, заболевания желудочно-кишечного тракта и гепатобиллиарной системы в стадии обострения, хроническая болезнь почек 4-5 стадии.
Исследование одобрено локальным этическим комитетом Сеченовского Университета и проводилось с учетом свода этических принципов проведения медицинских исследований с участием людей, изложенных в Хельсинкской декларации. Участники исследования были устно проинформированы о подробном протоколе и дали письменное информированное согласие на участие в этом исследовании.
Всем участникам исследования проведено обследование: измерение антропометрических показателей (рост, масса тела), расчет индекса массы тела (ИМТ), измерение офисного систолического и диастолического артериального давления (САД, ДАД), был выполнен биохимический анализ крови (глюкоза, липидный спектр, креатинин, мочевая кислота), определение уровня тиреотропного гормона (ТТГ). Реагенты «ADVIA» и биохимический анализатор ADVIA® 2400 производителя Siemens Healthcare Diagnostics® были использованы для проведения рутинного биохимического анализа. Забор крови для оценки уровня биохимических показателей производился в вакуумные пробирки с активатором свертывания Improvacuter 5 мл, а для оценки уровня ТТГ – в вакуумные пробирки с активатором свертывания и гелем Lind-Vac 5 мл. Показатели липидного спектра, мочевая кислота определялись колориметрическим методом, уровень креатинина – кинетическим методом, уровень глюкозы венозной плазмы натощак – гексокиназным методом, а уровень ТТГ – методом иммуноферментного анализа. Нарушение толерантности к глюкозе выявлялось при проведении перорального глюкозотолерантного теста (ПГТТ) при концентрации глюкозы в венозной плазме >7,8, но <11,1 ммоль/л, а сахарный диабет – при повышении уровня глюкозы >7,0 ммоль/л натощак и >11,1 ммоль/л при ПГТТ [10]. Были проведены электрокардиография (ЭКГ), суточное мониторирование АД и ЭКГ проводилось с использованием портативного медицинского оборудования Spacelabs (Hellige, Германия), эхокардиография (ЭхоКГ) с использованием метода двумерной эхокардиографии в режимах M и B, импульсной и непрерывной допплерографии в положении лежа с помощью эхокардиографа Vivid7 Dimension/Vivid 7 PRO версии 6.0.x (GE, Германия). С помощью ЭхоКГ были оценены толщина межжелудочковой перегородки (МЖП) и задней стенки (ЗС), конечно-диастолический размер (КДР), объем левого предсердия (ОЛП) и правого предсердия (ОПП), фракция выброса левого желудочка (ФВ ЛЖ). Визуализация и оценка степени поражения коронарных артерий (КА) проводилась с помощью коронароангиографии (КАГ) или мультиспиральной компьютерной томографии (МСКТ), в зависимости от предтестовой вероятности (ПТВ) ИБС, которая рассчитывалась с помощью шкалы CAD Consortium [9]. При ПТВ ИБС 1585% выполнялась МСКТ на компьютерном томографе Canon Medical Systems, Aquilion ONE, а у пациентов с ПТВ более 85% – КАГ на ангиографической системе GE Innova 2100IQ. Всем пациентам также было выполнено ультразвуковое доплерографическое исследование (УЗДГ) магистральных артерий головы на ультразвуковом аппарате GE Vivid 7 Pro. В случае наличия стенозирующего поражения артерий данные пациенты были отнесены в группу с атеросклерозом.
У всех участников исследования между 08:00 и 09:00 утра были взяты образцы крови из вены после ночного голодания в пробирки, содержащие дегидратдикалиевую соль этилендиаминтетрауксусной кислоты. Образцы центрифугировали при 2000 об/мин в течение 20 мин, и полученную плазму крови хранили при -80°C до проведения анализа. Нами был проведен метаболомный анализ полученных образцов, в ходе которого были определены 106 различных метаболитов, значимо отличающихся у пациентов с ССЗ и здоровых добровольцев, однако данная статья будет подробно посвящена АА. Измерялись концентрации циркулирующих аминокислот с использованием высокоэффективной жидкостной хроматографии (ВЭЖК) с масс-спектрометрическим детектированием. Органические растворители для приготовления подвижной фазы получены от фирмы PanReac, и стандарты Фен и Тир были приобретены в Sigma-Aldrich (Сент-Луис, Миссури, США). Для калибровки методом внутреннего стандарта использован набор Mass Chrom Amino Acids and Acylcarnitines Non Derivatised kit 57000 (Chromsystems, Германия), содержащий D5-Фен и D4-Тир.
Содержание Фен и Тир в плазме анализировали с использованием системы ВЭЖХ Waters Acquity I, соединенной с тройным квадрупольным масс-спектрометром Waters TQ-S-micro (Waters Corp, Милфорд, США). Хроматографическое разделение проводили на колонке Waters ACQUITY BEH C18 1,7 мкм, 100 мм×2,1 мм (Waters, США). Подвижная фаза А (вода) и фаза В (ацетонитрил) содержали 0,1% муравьиной кислоты. Линейный градиент: 1% B через 1 мин, 20% B через 3 мин, 90% B через 5 мин, 90% B через 8 мин, 1% B через 8,1 мин и 1% B через 12 мин. Скорость потока составляла 0,3 мл/мин, а температуру колонки устанавливали на уровне 40°С. Масс-спектрометрию проводили при следующих условиях: напряжение на капилляре 2 кВ; температура источника была установлена на уровне 150 ° C, температура осушающего газа 400°С, расход 800л/мин. Определение метаболитов проводили в режиме мониторинга множественных реакций в положительной области. Характеристичные переходы 166,1 – 120,1 (Фен); 171,1 – 125,1 (D5Фен); 182,1 – 136,1 (Тир); 186,1 – 140,1 (D4Тир).
Обработка полученных данных проводилась с использованием программного обеспечения Target Lynx (Уотерс, Массачусетс, США). Метод прошел валидацию по показателям селективности, линейности, правильности и прецизионности, степени извлечения, эффекту матрицы и стабильности в соответствии с рекомендациями FDA США и EMA по валидации биоаналитических методов (EMA, 2019; USFDA, 2018). Калибровочные кривые получены методом внутреннего стандарта, и были линейными в диапазоне 1-1000 мкМ с коэффициентом корреляции более 0,99. Нижний предел количественного определения составлял 1 мкМ. Внутрисерийная и межсерийная правильность и прецизионность для всех аналитов были ниже 5,4% и 7,1% соответственно. Матричный эффект колебался от 95,1% до 99,4%, а степень извлечения колебалось от 93,8% до 99,1%. Все образцы были проанализированы в одной партии. Использовался контроль качества.
Определение уровней Фен и Тир в плазме проводили в лаборатории фармакокинетики и метаболомного анализа НИИ трансляционной медицины и биотехнологии Первого МГМУ им. И.М. Сеченова (Сеченовский Университет).
Статистическая обработка полученных данных проводилась при помощи программы Statistica10.0 (StatSoft Inc., США). Для описательной статистики нормального распределения количественных показателей использовались средние арифметические (М) и стандартные отклонения (SD), для распределения отличного от нормального – медиана (Ме) и межквартильный диапазон (25%; 75%), качественные показатели представлены в абсолютных числах (n) и процентах (%). Для сравнения количественных показателей трех независимых групп использовался непараметрический критерий Краскела-Уоллиса. При выявлении статистически значимых различий проводилось апостериорное попарное сравнение групп с помощью posthoc тестов. Для сравнения категориальных переменных трех независимых групп применялся хи-квадрат Пирсона. Для анализа силы корреляционной связи между исследуемыми признаками отдельно в каждой группе использовался коэффициент корреляции Пирсона (при нормальном распределении), коэффициент корреляции Спирмена (при ненормальном распределении).
Результаты
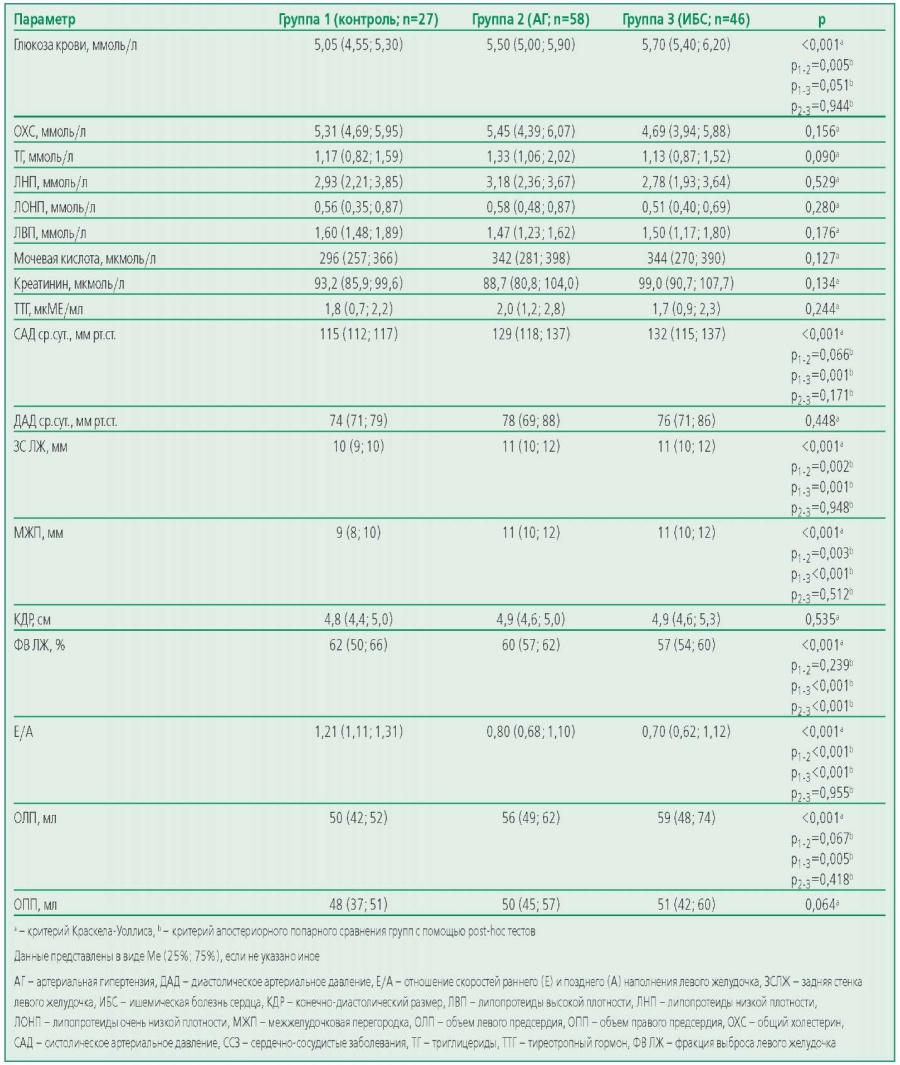
Пациенты трех групп были сопоставимы по полу и различались по возрасту (табл. 1). Большинство пациентов групп АГ и ИБС (98,3% и 84,6% соответственно) имели избыточную массу тела. В контрольной группе 66,7% участников были с повышенным ИМТ. Следует отметить, что несмотря на то, что на момент взятия крови на гиполипидемической терапии находилось 34,5% (n=20) участников группы АГ и 65,2% (n=30) пациентов с ИБС, дислипидемия была выявлена у 97,8% пациентов с ИБС и у 84,5% больных с АГ. В группе контроля нарушения липидного профиля встречались статистически значимо реже (25,9%, р<0,05) по сравнению с основными группами. В контрольной группе испытуемые не принимали никаких лекарственных препаратов (n=27). Среди пациентов с ИБС у 82,6% участников была диагностирована АГ. Антигипертензивные лекарственные препараты принимали 81,0% пациентов в группе АГ и 71,7% – в группе ИБС. Однако, несмотря на то, что большинство пациентов с АГ или ИБС на момент включения в исследование находилось на оптимально подобранной антигипертензивной терапии, и средние значения АД находились в пределах целевых уровней, цифры систолического АД были статистически значимо выше в группах АГ и ИБС по сравнению с контрольной группой (табл. 2). Нарушение толерантности к глюкозе (НТГ) или сахарный диабет (СД) были диагностированы у 21,7% пациентов группы ИБС и у 13,8% пациентов в группе АГ. Группы АГ и ИБС были сопоставимы по таким параметрам ЭхоКГ, как размер левого и правого предсердий, КДР, толщина МЖП и ЗС, а также по показателю диастолической дисфункции. Группа ИБС ожидаемо статистически значимо отличалась от остальных групп по уровню ФВ ЛЖ (табл. 2). Таким образом по данным ЭхоКГ для исследуемых пациентов был характерно сочетание умеренной гипертрофии миокарда, увеличение полости ЛП и наличие диастолической дисфункции.
Table 1. The main demographic and clinical characteristics of the study participants
Таблица 1. Основные демографические и клинические характеристики участников исследования
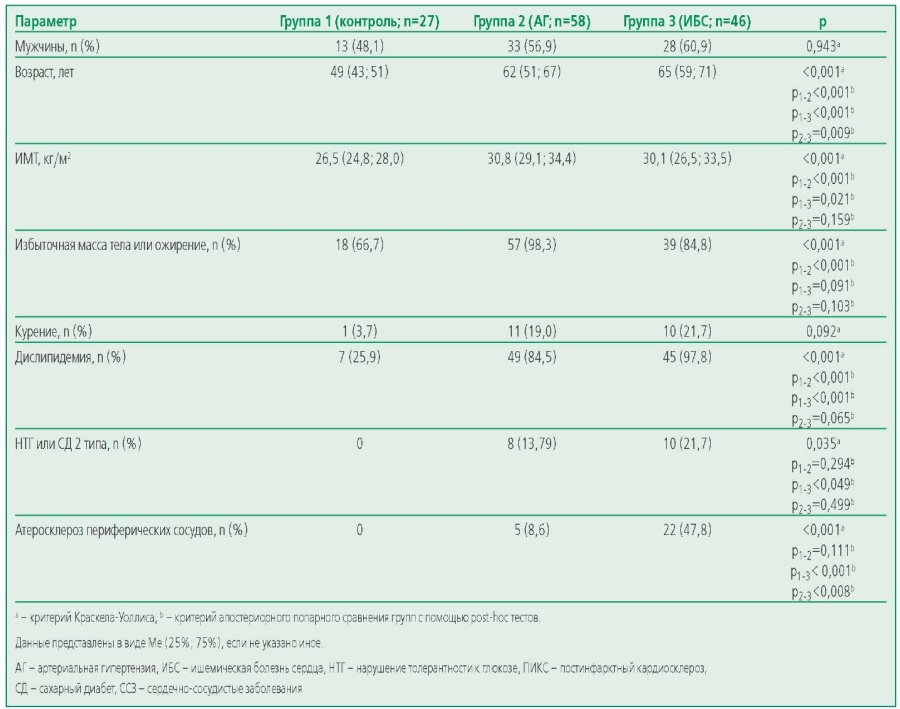
Table 2. Laboratory and instrumental characteristics of the study participants
Таблица 2. Лабораторные и инструментальные характеристики участников исследования
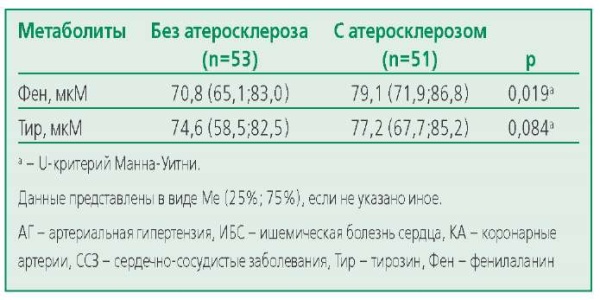
Количественный анализ уровней аминокислот Фен и Тир был проведен всем участникам исследования (табл. 3). Выявлено статистически значимое различие по уровню Фен и Tир (p=0,002 и p=0,024 соответственно). Однако при проведении апостериорного попарного сравнения с помощью post-hoc анализа уровень обеих циркулирующих аминокислот различался только у пациентов с ИБС и группы контроля (Фен p=0,008 и Tир p=0,020), также отмечалось статистически значимое различие по уровню Фен групп АГ и ИБС (p=0,017). Даже после поправки на возраст обнаруженные нами значимые различия сохранялись по уровню Фен между группами ИБС и АГ, а также группами ИБС и группой без ССЗ. С учетом полученных данных мы предположили, что повышение уровня изучаемых аминокислот может быть связано в большей степени с наличием атеросклероза КА и/или периферических артерий. Для проверки гипотезы среди всех пациентов с АГ и ИБС мы выделили группу пациентов с доказанным атеросклерозом периферических (n=27) и/или КА (n=46). При сравнении уровней Фен и Tир было выявлено статистически значимое различие между группой пациентов с ССЗ и клинико-инструментальными признаками атеросклероза и группой пациентов с ССЗ без атеросклероза по уровню Фен (p=0,019) (табл. 4).
Table 3. Aromatic amino acids concentrations in the study groups
Таблица 3. Концентрации АА в исследуемых группах
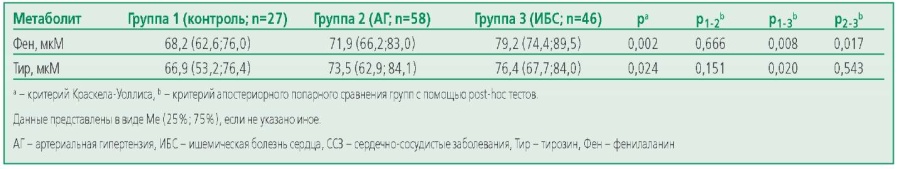
Table 4. Differences in the level of aromatic amino acids in patients with cardiovascular diseases and proven atherosclerosis of peripheral and/or coronary arteries and without atherosclerosis
Таблица 4. Различия уровня АА у пациентов ССЗ с доказанным атеросклерозом периферических и/или КА и без атеросклероза
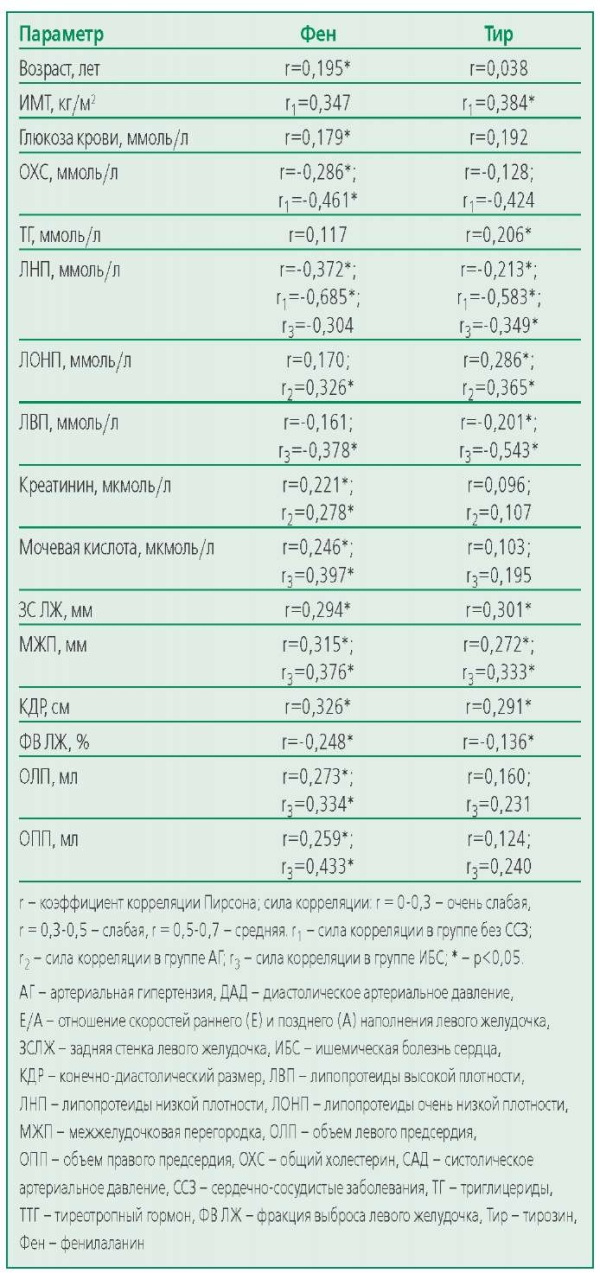
Взаимосвязи между концентрациями AA, показателями липидного профиля, уровнем глюкозы, креатинина, мочевой кислоты, ТТГ, уровнем САД и ДАД и параметрами ЭхоКГ были исследованы с помощью корреляционного анализа (табл. 5). Нами обнаружена обратная связь уровня липопротеинов низкой плотности (ЛНП) с уровнем Фен и Тир, а также уровня Фен с уровнем общего холестерина в группе контроля. В группе АГ лишь между уровнями липопротеинов очень низкой плотности (ЛОНП) и уровнями АА была выявлена слабая положительная корреляция, в то время как у пациентов с ИБС уровень Фен и Тир обратно коррелировал с показателем липопротеинов высокой плотности (ЛВП), а уровень Тир – с показателем ЛНП. При этом стоит отметить, что наиболее сильные корреляции были выявлены в группе контроля, не получавшей терапию статинами. Кроме того, выявлены положительные корреляции с параметрами гипертрофии левого желудочка и дилатации обоих предсердий с уровнем Фен у пациентов с ИБС. Корреляций изучаемых аминокислот с уровнем АД не выявлено, что может говорить в пользу оптимально подобранной антигипертензивной терапии. Помимо прочего, прямая связь с уровнем Фен была выявлена с уровнем мочевой кислоты в группе ИБС и с уровнем креатинина в группе АГ.
Table 5. Correlation coefficients between concentrations of aromatic amino acids and laboratory and instrumental indicators for the hypertension group and the coronary artery disease group
Таблица 5. Коэффициенты корреляции между концентрациями AA и лабораторными и инструментальными показателями для группы АГ и группы ИБС
Обсуждение
В нашем исследовании мы выявили повышение АА у пациентов с такими ССЗ, как АГ и ИБС, однако статистически значимые различия по уровню Фен и Тир по сравнению с контрольной группой наблюдались только у пациентов с ИБС. При этом Фен был значимо выше у пациентов с ИБС по сравнению с пациентами с АГ. Корреляционный анализ не выявил связи уровня АА с уровнем АД. С одной стороны, это может быть обусловлено контролируемой АГ на фоне оптимальной антигипертензивной терапии у исследуемых, с другой – мы предположили, что уровни АА могут быть в большей степени связаны с наличием атеросклероза КА и/или периферических артерий, что и было подтверждено в отношении Фен. Интересно, что в нашем исследовании более высокие уровни АА ассоциировались с более низкими значениями общего холестерина и ЛНП, учитывая, что среди участников исследования не было людей, соблюдавших вегетарианскую диету.
Следует отметить, что группы различались по возрасту в связи с тем, что для минимизации влияния сопутствующей патологии на уровень АА в группу без ССЗ вошли преимущественно лица более молодого возраста. Однако, обращая внимание на то, что уровень Фен, согласно клиническим исследованиям, имеет прямую корреляцию с возрастом, был проведен многофакторный анализ, который показал отсутствие влияния возраста на различия между группами по уровню Фен [11].
Обращая внимание на основной путь превращения Фен, считается, что его влияние на АД потенциально связано с изменениями уровня Тир и, как следствие, уровня катехоламинов. Однако B.M. Mitchell и соавт. в своем исследовании продемонстрировали, что Фен может оказывать независимое влияние на эндотелиальную функцию посредством повышения синтеза кофермента тетрагидробиоптерина, необходимого для образования оксида азота, который играет важную роль в регулировании сосудистого тонуса и снижении АД [12]. В свою очередь в экспериментальных исследованиях было продемонстрировано, что введение Тир лабораторным крысам, которые представляют собой животную модель эссенциальной АГ, приводит как к увеличению оборота норадреналина, так и к значительному снижению АД [13][14]. Полученные экспериментальные данные позволили предположить, что пищевые добавки Тир могут способствовать снижению АД. Однако такие эффекты не были обнаружены у пациентов с АГ, длительно принимающих пищевые добавки Тир [15]. С другой стороны, в исследовании W. Altorf-vander Kuil и соавт. отмечено, что более высокое потребление Tир с пищей было связано со снижением САД, однако при проспективном анализе после 6-летнего наблюдения связи между потреблением Тир с частотой АГ описано не было [16]. Что касается незаменимых аминокислот, ни одна из них не была значимо связана с возникновением АГ [16]. В то же время в других исследованиях было показано, что прием АА повышает риск развития АГ [17][18]. В исследовании M.H. Mahbub и соавт. изучались уровни циркулирующих АА, которые были статистически значимо повышены у пациентов с АГ, но в скорректированных моделях не продемонстрировали устойчивую связь с АГ [19]. Следует отметить, что после проведения поправки на возраст, пол и ИМТ только уровень Tир положительно коррелировал с наличием АГ, в связи с чем было высказано предположение, что влияние на АД потенциально связано с изменением уровня именно Tир. Помимо этого, M.H. Mahbub и соавт. предположили, что AA имеют гидрофобные или громоздкие остатки, которые могут быть релевантны для связывания биоактивных пептидов с ангиотензин-превращающим ферментом, тем самым увеличивая его активность, которая приводит к повышению АД [19].
Аналогичные нашим данные о том, что более высокие уровни АА ассоциировались с более низкими значениями общего холестерина и ЛНП, были получены C. Cannet и соавт. при изучении липидного профиля у пациентов с фенилкетонурией [20]. Фенилкетонурия – наследственное нарушение метаболизма ароматических аминокислот, вследствие чего происходит накопление потребляемого Фен, который оказывает токсическое действие на организм. У пациентов с фенилкетонурией уровни общего холестерина и холестерина ЛНП были значительно ниже по сравнению с контрольной группой, также отмечено наличие отрицательной корреляционной связи уровня общего холестерина и холестерина ЛНП с уровнем Фен. Авторы предположили, что более низкие значения ЛНП в исследуемой группе обусловлены соблюдением веганской диеты, которая входит в рекомендации по лечению фенилкетонурии, что неприменимо к нашим результатам [20]. Учитывая, что незаменимая аминокислота Фен поступает в организм человека преимущественно с пищей животного происхождения, можно предположить, что эта аминокислота является отражением нарушения пищевого поведения и несоблюдения гиполипидемической диеты, что может быть причиной развития атеросклероза. В то же время известно, что с пищей поступает лишь 10-20% холестерина. Может ли Фен оказывать влияние на синтез холестерина в печени? Предположительно негативное влияние высокого уровня Фен на синтез холестерина обусловлено его статиноподобным эффектом за счет снижения уровня 3-гидрокси-3-метилглутарил-КоА-редуктазы (HMGR), поскольку ингибирование HMGR приводит к увеличению HMG-CoA, который подает ацетил-CoA в цитратный цикл [20].
Xuan C. с соавторами исследовали профиль аминокислот у пациентов с ранним началом ИБС [21]. Было установлено значимое повышение уровней Фен у пациентов с ИБС с инфарктом миокарда (ИМ) по сравнению с группой ИБС без ИМ и контрольной группой [21]. Достоверная разница также была выявлена между контрольной группой и группой ИБС без ИМ. Значительные различия по концентрации Тир наблюдались между группами ИБС с ИМ и контрольной группой, но не с уровнем в группе ИБС без ИМ [21]. В исследовании C. Murr и соавт. было высказано предположение о том, что повышенные уровни Фен и Тир в сыворотке крови у пациентов с ИБС могут быть связаны с активацией иммунной системы и воспалением [22].
Особого внимания заслуживает проспективное исследование трех популяционных когорт, в котором изучались ассоциации метаболитов с сердечно-сосудистыми событиями: популяционное национальное исследование FINRISK в Финляндии и двух популяционных исследованиях в Великобритании – исследование Southall and Brent Revisited (SABRE) и исследование British Women's Health and Heart Study (BWHHS), которые продемонстрировали связь четырех метаболитов с развитием сердечно-сосудистых событий [11]. Один из них – Фен, высокий уровень которого был достоверно ассоциирован с увеличением риска сердечно-сосудистых событий. Наиболее сильная связь между уровнем Фен и риском сердечно-сосудистых событий была отмечена в молодом возрасте и отсутствовала у наблюдаемых старше 69 лет [11].
Ограничения исследования
Ограничением нашего исследования являлось небольшое число участников, различие групп по численности, а также отсутствие при проведении исследования контроля диеты участников исследования.
Заключение
При сравнении трех групп уровень циркулирующего Фен в плазме был статистически значимо выше у пациентов с ИБС по сравнению с контрольной группой, а также положительно связан с наличием периферического или коронарного атеросклероза. Выявлена положительная корреляция концентраций АА с параметрами гипертрофии левого желудочка и дилатации обоих предсердий, в особенности, у пациентов с ИБС, что позволяет предположить, что АА в дальнейшем могут изучаться в качестве потенциальных маркеров ремоделирования миокарда.
Корреляции изучаемых аминокислот с уровнем АД не выявлено, что может говорить в пользу оптимально подобранной антигипертензивной терапии. Обнаружена четкая ассоциация уровня АА с параметрами липидного профиля. Вероятно, существуют метаболические пути с АА в качестве конечных и промежуточных метаболитов, ассоциированные с обменом липопротеинов, так как наиболее сильные корреляции между уровнями аминокислот и ЛНП, ЛВП, ЛОНП были выявлены в группе контроля, не получавшей терапию статинами. Полученные нами данные позволяют предположить значимый вклад АА в развитие и прогрессирование ССЗ и могут явиться потенциальными терапевтическими мишенями, что требует дальнейших исследований.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование: Исследование проведено при поддержке Сеченовского Университета.
Funding: The study was performed with the support of the Sechenov University.
Список литературы
1. Беленков Ю.Н., Привалова Е.В., Кожевникова М.В., и др. Метаболомное профилирование больных с сердечно-сосудистыми заболеваниями. Кардиология. 2018;58(9):59-62. DOI:10.18087/cardio.2018.9.10172.
2. Шакарьянц Г.А., Кожевникова М.В., Каплунова В.Ю., и др. Взгляд на гипертрофию миокарда с позиции транскриптомики и метаболомики. Кардиология. 2020;60(4):120-9 DOI:10.18087/cardio.2020.4.n1063.
3. Коробкова Е.О., Кожевникова М.В., Ильгисонис И.С., и др. Метаболомное профилирование больных с метаболическим синдромом. Кардиология. 2020;60(3):37-43. DOI:10.18087/cardio.2020.3.n903.
4. Yang R, Dong J, Guo H, et al. Rapid and precise measurement of serum branched-chain and aromatic amino acids by isotope dilution liquid chromatography tandem mass spectrometry. PLoS One. 2013;8(12):e81144. DOI:10.1371/journal.pone.0081144.
5. National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) final report. Circulation. 2002;106(25):3143-421.
6. Yang R, Dong J, Zhao H, et al. Association of branched-chain amino acids with carotid intima-media thickness and coronary artery disease risk factors. PLoS One. 2014;9(6):e99598. DOI:10.1371/journal.pone.0099598.
7. Poggiogalle E, Fontana M, Giusti AM, et al. Amino Acids and Hypertension in Adults. Nutrients. 2019;11(7):1459. DOI:10.3390/nu11071459.
8. Кобалава Ж.Д., Конради А.О., Недогода С.В., и др. Артериальная гипертензия у взрослых. Клинические рекомендации 2020. Российский Кардиологический Журнал. 2020;25(3):3786. DOI:10.15829/1560-4071-20203-3786.
9. Стабильная ишемическая болезнь сердца. Клинические рекомендации 2020. Российский Кардиологический Журнал. 2020;25(11):4076. DOI:10.15829/1560-4071-2020-4076.
10. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Сахарный диабет 2 типа у взрослых. Сахарный Диабет. 2020;23(2S):4-102. DOI:10.14341/DM12507.
11. Würtz P, Havulinna AS, Soininen P, et al. Metabolite profiling and cardiovascular event risk: a prospective study of 3 population-based cohorts. Circulation. 2015;131(9):774-85. DOI:10.1161/CIRCULATIONAHA.114.013116.
12. Mitchell BM, Dorrance AM, Webb RC. Phenylalanine improves dilation and blood pressure in GTP cyclohydrolase inhibition-induced hypertensive rats. J Cardiovasc Pharmacol. 2004;43(6):758-63. DOI:10.1097/00005344-200406000-00004.
13. Sved AF, Fernstrom JD, Wurtman RJ. Tyrosine administration reduces blood pressure and enhances brain norepinephrine release in spontaneously hypertensive rats. Proc Natl Acad Sci USA. 1979;76(7):3511-4. DOI:10.1073/pnas.76.7.3511.
14. Yamori Y, Fujiwara M, Horie R, et al. The hypotensive effect of centrally administered tyrosine. Eur J Pharmacol. 1980;68(2):201-4. DOI:10.1016/0014-2999(80)90323-4.
15. Sole MJ, Benedict CR, Myers MG, et al. Chronic dietary tyrosine supplements do not affect mild essential hypertension. Hypertension. 1985;7(4):593-6. DOI:10.1161/01.hyp.7.4.593.
16. Altorf-van der Kuil W, Engberink MF, De Neve M, et al. Dietary amino acids and the risk of hypertension in a Dutch older population: the Rotterdam Study. Am J Clin Nutr. 2013;97(2):40310. DOI:10.3945/ajcn.112.038737.
17. Teymoori F, Asghari G, Mirmiran P, et al. High dietary intake of aromatic amino acids increases risk of hypertension. J Am Soc Hypertens. 2018;12(1):25-33. DOI:10.1016/j.jash.2017.11.004.
18. Teymoori F, Asghari G, Farhadnejad H, et al. Do dietary amino acid ratios predict risk of incident hypertension among adults? Int J Food Sci Nutr. 2019;70(4):387-95. DOI:10.1080/09637486.2018.1515183.
19. Mahbub MH, Yamaguchi N, Hase R, et al. Plasma Branched-Chain and Aromatic Amino Acids in Relation to Hypertension. Nutrients. 2020;12(12):3791. DOI:10.3390/nu12123791.
20. Cannet C, Pilotto A, Rocha JC, et al. Lower plasma cholesterol, LDL-cholesterol and LDL-lipoprotein subclasses in adult phenylketonuria (PKU) patients compared to healthy controls: results of NMR metabolomics investigation. Orphanet J Rare Dis. 2020;15(1):61. DOI:10.1186/s13023-0201329-5.
21. Xuan C, Li H, Tian QW, et al. Quantitative Assessment of Serum Amino Acids and Association with Early-Onset Coronary Artery Disease. Clin Interv Aging. 2021;16:465-74. DOI:10.2147/CIA.S298743.
22. Murr C, Grammer TB, Meinitzer A, et al. Immune activation and inflammation in patients with cardiovascular disease are associated with higher phenylalanine to tyrosine ratios: the ludwigshafen risk and cardiovascular health study. J Amino Acids. 2014;2014:783730. DOI:10.1155/2014/783730.
Об авторах
А. В. КривоваРоссия
Кривова Анастасия Викторовна
Москва
М. В. Кожевникова
Россия
Кожевникова Мария Владимировна
Москва
Е. О. Коробкова
Россия
Коробкова Екатерина Олеговна
Москва
В. Ю. Зекцер
Россия
Зекцер Вита Юрьевна
Москва
Е. А. Железных
Россия
Железных Елена Анатольевна
Москва
А. А. Агеев
Россия
Агеев Антон Александрович
Москва
Н. Е. Москалева
Россия
Москалева Наталья Евгеньевна
Москва
А. В. Кухаренко
Россия
Кухаренко Алексей Владимирович
Москва
С. А. Апполонова
Россия
Апполонова Светлана Александровна
Москва
Ю. Н. Беленков
Россия
Беленков Юрий Никитич
Москва
Рецензия
Для цитирования:
Кривова А.В., Кожевникова М.В., Коробкова Е.О., Зекцер В.Ю., Железных Е.А., Агеев А.А., Москалева Н.Е., Кухаренко А.В., Апполонова С.А., Беленков Ю.Н. Ароматические аминокислоты: фенилаланин и тирозин у пациентов с артериальной гипертензией и ишемической болезнью сердца. Рациональная Фармакотерапия в Кардиологии. 2022;18(3):297-305. https://doi.org/10.20996/1819-6446-2022-06-05
For citation:
Krivova A.V., Kozhevnikova M.V., Korobkova E.O., Zektser V.Yu., Zheleznykh E.A., Ageev А.A., Moskaleva N.E., Kukharenko A.V., Appolonova S.A., Belenkov Yu.N. Aromatic Amino Acids: Phenylalanine and Tyrosine in Patients with Hypertension and Coronary Artery Disease. Rational Pharmacotherapy in Cardiology. 2022;18(3):297-305. (In Russ.) https://doi.org/10.20996/1819-6446-2022-06-05
















































