Перейти к:
Статины и высокочувствительные сердечные тропонины: кардиотоксичность или перекрестная реактивность?
https://doi.org/10.20996/1819-6446-2023-04-01
Аннотация
На сегодняшний день гиполипидемические препараты группы статинов являются одними из самых востребованных терапевтических агентов, применяемых для профилактики и лечения наиболее распространенных во всем мире атеросклеротических сердечно-сосудистых заболеваний (ССЗ). Поэтому к статинам приковано значительное внимание исследователей для изучения дополнительных эффектов данных препаратов, что сопровождается открытием новых механизмов действия и свойств, которые следует учитывать для оптимизации тактики ведения пациентов с ССЗ. Помимо ключевого гиполипидемического эффекта статинов, связанного с ингибирование скорость-лимитирующего фермента (3-гидрокси-3-метилглутарил-коэнзим А редуктазы), исследователи сообщают о множестве других свойств данных препаратов. Важными обстоятельствами, способствующими раскрытию новых эффектов статинов, являются: улучшение методов исследования, и в первую очередь, их чувствительности и специфичности; открытие новых молекул и молекулярных путей, которые могут быть подвержены действию статинов. В целом, установленные на настоящее время многочисленные нелипидные эффекты статинов, можно разделить на две группы: благоприятные и побочные, которые необходимо принимать во внимание при ведении пациентов с ССЗ и коморбидными заболеваниями. Благодаря недавним исследованиям с использованием современных клинико-диагностических кардиомаркеров (высокочувствительных сердечных тропонинов), молекулярно-генетических и морфологических методов были выявлены потенциальные кардиотоксические свойства препаратов группы статинов. Особые опасения вызывают данные о статин-индуцированном повышении концентрации высокочувствительных сердечных тропонинов, которые являются ключевым и общепризнанным критерием повреждения миокарда. В данной статье мы обсуждаем возможные механизмы повышения концентрации сердечных тропонинов и кардиотоксические эффекты при применении статинов.
Ключевые слова
Для цитирования:
Чаулин А.М., Дупляков Д.В. Статины и высокочувствительные сердечные тропонины: кардиотоксичность или перекрестная реактивность? Рациональная Фармакотерапия в Кардиологии. 2023;19(2):209-216. https://doi.org/10.20996/1819-6446-2023-04-01
For citation:
Chaulin A.M., Duplyakov D.V. Statins and highly sensitive cardiac troponins: cardiotoxicity or cross-reactivity? Rational Pharmacotherapy in Cardiology. 2023;19(2):209-216. (In Russ.) https://doi.org/10.20996/1819-6446-2023-04-01
Введение
С момента установления русскими учеными А.И. Игнатовским и Н.Н. Аничковым важной роли холестерина в патофизиологии атеросклероза и сердечно-сосудистых заболеваний (ССЗ), усилия большинства исследователей были направлены на разработку препаратов, понижающих уровень холестерина в сыворотке крови. Вдохновленные открытием пенициллина А. Флемингом, многие исследователи и фармакологические компании принялись активно изучать вещества, синтезируемые грибами и различными микроорганизмами. Так, в результате подобных исследований в 1971 г. японский ученый А. Эндо обнаружил, что продукты жизнедеятельности грибов обладают гиполипидемическим действием. Первый статиновый препарат ML 236B, выделенный из культуральной среды Penicillium citrinium и названный компактином, конкуренто ингибировал ключевой фермент биосинтеза холестерина – 3-гидрокси-3-метилглутарил-коэнзим А (ГМГКоА) ‒ редуктазу [1][2]. В последующих клинических исследованиях была продемонстрирована высокая эффективность статинов, и они вплоть до настоящего времени остаются основными гиполипидемическими препаратами для лечения и профилактики атеросклероза и ССЗ [2].
По эффективности гиполипидемического действия и безопасности статины уступают разве что только ингибиторам пропротеиновой конвертазы субтилизинкексинового типа-9 (PCSK-9) [3][4]. Данный фермент, относящийся к классу сериновых, является важным участником метаболизма липопротеинов низкой плотности путем регулирования плотности их рецепторов на клеточной мембране гепатоцитов [5]. Однако, несмотря на то что моноклональные антитела против PCSK-9 (алирокумаб и эволокумаб) получили одобрение ведущих зарубежных органов (FDA в США и EMEA в Европе), в ближайшее время из-за экономической составляющей (стоимость лечения в год составляет 14 000-15 000 долларов США) они вряд ли получат такое же высокое распространение, как статины. По подсчетам исследователей, для экономической целесообразности стоимость препаратов, ингибирующих PCSK-9, должна снизиться как минимум на 70% [6].
Препараты группы статинов помимо своего основного гиполипидемического действия (помимо ингибирования ГМГ-КоА редуктазы) оказывают множество дополнительных (нелипидных) как благоприятных (плейотропных), так и нежелательных (токсических) эффектов. К числу последних относится гепатотоксичность, диабетогенное действие, миотоксичность, нейротоксичность и ряд других [7-9]. Побочные эффекты статинов, в значительной степени обусловлены тем, что биосинтез холестерина крайне сложен и включает множество реакций и компонентов метаболического пути (рис. 1), которые могут иметь значение для нормальной физиологии организма человека. Статины, блокируя биосинтез холестерина на уровне фермента ГМГ-КоА-редуктазы, могут вызывать дефицит этих необходимых организму веществ. К числу последних относятся долихол, витамин D, желчные кислоты, стероидные гормоны, липопротеины и убихинон (коэнзим Q), играющий исключительную роль в организме, обладая энергетической [важнейший компонент дыхательной цепи в митохондриях клеток для генерации молекул аденозинтрифосфорной кислоты (АТФ)], антиоксидантной функциями, а также способностью стабилизировать мембраны клеток.
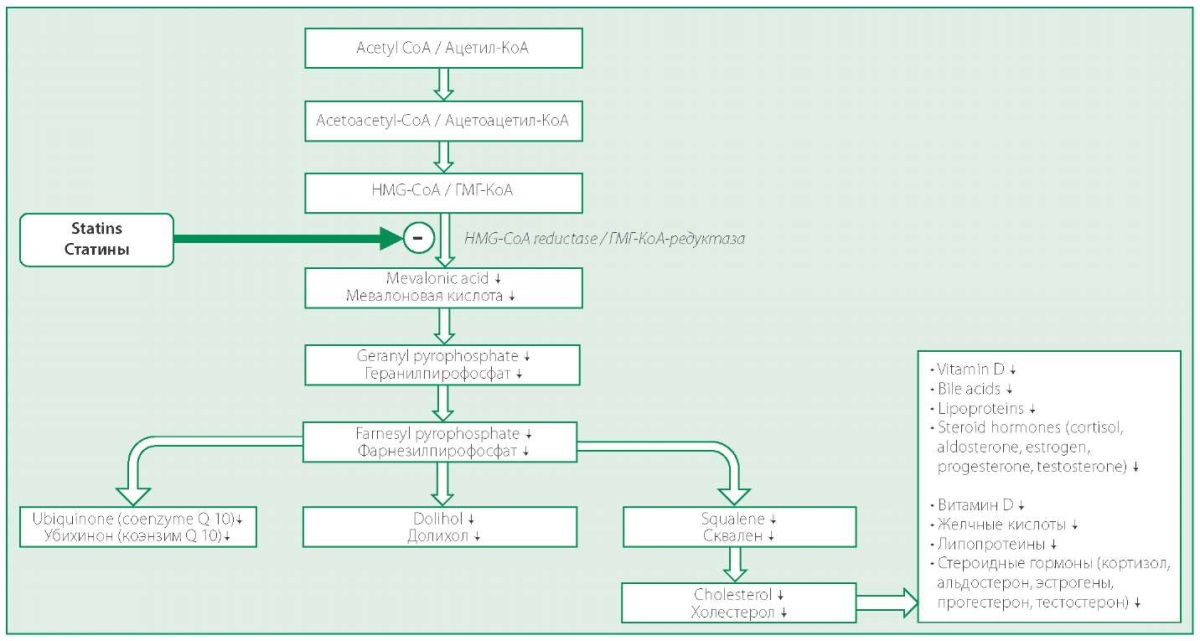
Figure 1. Schematic of cholesterol biosynthesis and additional metabolic pathways and components
Рисунок 1. Схема биосинтеза холестерина и дополнительные метаболические пути и компоненты
Важно отметить, что механизмы, лежащие в основе плейотропных и побочных эффектов, изучены не полностью, и по многим аспектам имеются противоречивые данные. Это обусловлено дизайном проводимых исследований. Что касается методов изучения, то они непрерывно совершенствуются, открывая новые возможности и изменяя наше представление о многих патологических и физиологических процессах, протекающих в организме. Наиболее наглядными примерами служат методы лабораторной диагностики, в частности иммунохимические анализы для определения сердечных тропонинов (СТ) в сыворотке крови, а также методы молекулярно-генетических и ультрамикроскопических исследований.
Первые методы определения сердечного тропонина-Т (СТ-Т) и сердечного тропонина-I (СТ-I), разработанные H. Katus и соавт. в 1989 г. и B. Cummins и соавт. в 1987 г. имели крайне низкую чувствительность (высокую минимальную определяемую концентрацию порядка 500-1000 нг/л и выше) и могли выявлять только крупноочаговые инфаркты миокарда (ИМ) на поздних сроках от момента поступления (12-24 ч и более), поэтому значительно уступали используемому тогда в качестве золотого стандарта ферменту креатинфосфокиназа-МВ-изоформа [10]. При этом СТ считались строго внутриклеточными молекулами, а их наличие в сыворотке крови считалось патологическим признаком, свидетельствующим о гибели (необратимом повреждении) кардиомиоцитов (КМЦ). Однако, по мере повышения чувствительности тропониновых иммуноанализов минимальная определяемая концентрация значительно уменьшилась, составляя в современных (высоко- и ультра-чувствительных иммуноанализах) всего несколько нг/л и меньше, что позволяет выявлять повреждение на уровне единичных КМЦ [11][12]. Так, в новом недавно разработанном анализе минимальная определяемая концентрация составляет всего 0,12 нг/л, что более чем в тысячу раз превышает чувствительность самых первых тропониновых иммуноанализов и в десятки раз больше, чем у высокочувствительных (ВЧ) анализов 1-го поколения [12]. Это позволило обнаружить СТ в сыворотке у всех полностью здоровых индивидуумов. В результате СТ перестали считаться только строго внутриклеточными молекулами, и при том условии, что их концентрация <99 перцентиля, они могут рассматриваться в качестве нормальных метаболитов сердечной мышечной ткани [13][14].
Более того, высоко- и ультрачувствительные методики определение СТ подняли вопрос о необходимость принимать во внимание гендерные, возрастные и циркадные особенности концентрации СТ при использовании быстрых алгоритмов диагностики ИМ [15-17]. Повышение чувствительности также способствовало появлению новых данных о диагностических возможностях неканонических для ССЗ биологических жидкостях, таких как моча [18] и ротовая жидкость [19][20], создавая фундамент для дальнейших исследований неинвазивных диагностических подходов.
Механизмы статин-индуцированного повышение СТ: анализ результатов исследований
По всей видимости, ВЧ СТ могут повышаться в сыворотке крови при действии ряда лекарственных препаратов и биологически-активных веществ, стимулирующих миокард, таких как кортизол, катехоламины и адреномиметики, тиреоидные гормоны, что объясняется тем, что у здоровых людей циркадные колебания уровней СТ совпадают с циркадными ритмами активности эндокринных желез, продуцирующих данные гормоны [17][21][22]. Тем самым, КМЦ стали рассматриваться как чрезвычайно чувствительные к действию различных факторов клетки. Считается, что некоторые лекарственные препараты, такие как статины, обладают благоприятными эффектами на миокард пациентов, в связи с чем их эффекты на уровень СТ не изучались. Поэтому весьма интересными являются данные S. Ünlü и соавт. [23], сообщившими о значимом влиянии статинов на уровни ВЧ СТ-Т. В исследование было включено 56 пациентов, из которых 26 принимали статины (основная группа), и 30 человек не принимали статины (контрольная группа). Все участники исследования выполняли умеренные физические упражнения по фиксированному протоколу. Образцы крови были взяты до физической нагрузки и через 4 ч после. У тех испытуемых, которые принимали статины и выполнили физические упражнения концентрация ВЧ СТ-Т через 4 ч значительно повысилась по сравнению с исходными показателями (11,4±15,2 против 7,7±12,6 нг/л, р=0,004). В контрольной группе пациентов, которые не принимали статины, а выполняли только физические упражнения, уровень ВЧ СТ-Т не был повышен через 4 ч (7,74±5,7 против 6,4±3,5 нг/л, р=0,664) [23]. Таким образом, концентрация ВЧ СТ-Т в опытной группе была значимо выше, чем в контрольной.
Кроме того, у некоторых пациентов, принимающих статины, кинетика подъема ВЧ СТ-Т соответствовала диагностическим критериям ИМ без подъема сегмента ST, утвержденным Европейским обществом кардиологов [23][24].
Результаты, полученные S. Ünlü и соавт. не согласуются с данными других исследователей [25][26]. A. Trentini и соавт. изучали влияние статинов на разные типы мышечных волокон. Оценивались изменения концентрации медленной и быстрой изоформ скелетных тропонинов (ssTnI и fsTnI соответственно) и общей креатинфосфокиназы, а также маркера повреждения сердечной мышцы – СТ-I. У пациентов, принимающих статины специфически повышалась концентрация fsTnI, но не ssTnI. Данная находка свидетельствует о более выраженном повреждающем действии статинов на быстросокращающиеся мышечные волокна. Кроме того, на фоне терапии статинами часто отмечалось субклиническое увеличение уровня fsTnI, но не общей креатинфосфокиназы, что свидетельствует о более высокой чувствительности и диагностической ценности fsTnI на ранних этапах развития статиновой миопатии. Уровни СТ-I не подвергались значимому изменению в группе лиц, принимающих статины, по сравнению с лицами их не принимающих, что дополнительно подтверждает избирательность (селективность) повреждающего действия статинов именно на скелетные мышечные волокна [25]. T. Eijsvogels и соавт. изучали влияние статинов на концентрацию СТ-I у бегунов-марафонцев через 1 и 24 часа после финиша. Применение статинов не оказало значимого влияния на величину высвобождения СТ-I (p=0,47) или количество бегунов, у которых уровень СТ-I превышал диагностическую точку для исключения ИМ (57% против 51%, р=0,65). Кроме того, не было выявлено значимой связи между дозировками статинов и высвобождением cTnI (r=0,09, p=0,65). На основании полученных результатов исследователи пришли к выводу, что индуцированное марафоном увеличение cTnI не изменяется при использовании статинов [26].
Анализируя возможные причины получения несогласованных результатов, можно отметить различия в дизайне проводимых исследований, а также методах определения СТ. Так, в исследовании T. Eijsvogels участники не были обследованы на наличие ишемической болезни сердца, в отличие от работы S. Ünlü и соавт. Помимо этого, в двух исследованиях A. Trentini и T. Eijsvogels концентрация СТ-I определялась при помощи умеренно чувствительных методик, тогда как S. Ünlü использовал ВЧ метод для определения СТ-Т. Различалось и время взятие биоматериала у пациентов после физических нагрузок. Например, слишком ранее (через 1 ч) и слишком позднее (через 24 ч) время взятие биоматериала, как в исследовании T. Eijsvogels, может не дать точного представления о уровне СТ, поскольку момент высвобождения СТ слишком ранний, а в течение суток уже возможна нормализация повышенных значений СТ у здоровых лиц.
Кроме того, чувствительности обычных (умеренно-чувствительных) методов определения СТ может не хватать для детекции нанесенного субклинического урона миокарду [25][26], тогда как ВЧ методики способны зарегистрировать факт даже самого незначительного повреждения [23]. Таким образом, статиновая терапия на фоне дополнительной умеренной физической нагрузки не только оказывает неблагоприятное действие на миокард, но и может повлиять на точность диагностики ИМ по данным современных диагностических алгоритмов Европейского общества кардиологов при использовании ВЧ СТ-Т. С другой стороны, можно предположить, что в исследовании S. Ünlü и соавт. [23] произошла перекрестная реакция анти-СТ-Т антител именно со скелетными изоформами тропонинов, повысившимися из-за миотоксического действия статинов, т.е. имело место ложное повышение СТ [27]. Повышение уровней ВЧ СТ-Т и ВЧ СТ-I в 68% и 4% случаях соответственно, недавно были обнаружены у пациентов с различными миопатиями при отсутствии явных признаков ССЗ [28]. Весьма примечательно, что перекрестные реакции более всего характерны для ВЧ методов определения СТ-Т, который и был использован в исследовании [23].
Интересный случай повышения уровней СТ после приема статинов был описан английскими исследователями P. Collinson и P. Kiely [29]. У стабильной пожилой пациентки, принимающей аторвастатин, уровни ВЧ СТ-Т были значительно повышены и составили 55 нг/л (99 перцентиль=14 нг/л). При повторных (серийных) измерениях ВЧ СТ-Т также были обнаружены повышенные концентрации ВЧ СТ-Т (120 нг/л и 25 нг/л), но концентрации ВЧ СТ-I все это время были в пределах нормы (5 и 7 нг/л при уровне 99 перцентиля=30 нг/л). Ввиду отсутствия сколько-нибудь значимой кардиологической симптоматики, исследователи сделали вывод о наличии ложноположительного повышения уровня ВЧ СТ-Т. В процессе дальнейшего изучения исследователями в качестве возможных ложноположительных факторов были исключены такие причины, как гетерофильные антитела и образование макротропонинового комплекса [29]. Тем самым наиболее вероятными механизмами повышения ВЧ СТ-Т является либо прямое кардиотоксическое действия аторвастатина на КМЦ, либо ложноположительные реакция анти-СТ-антител с молекулами скелетного тропонина Т, который высвободился из скелетных мышечных волокон из-за их повреждения аторвастатином.
Повреждение скелетных мышц при определенных состояниях (при хронической почечной недостаточности [30], наследственных скелетных миопатиях [30][31] и некоторых типах гликогенозов (болезнь Помпе) [32]) может сопровождаться повторной экспрессий (реэкспрессией) молекул СТ в скелетных мышечных волокнах и соответственно приводить к повышению сывороточных уровней данных кардиоспецифических маркеров путем высвобождения последних в кровоток. Гипотетически, можно предположить, что статин-индуцированное повреждение скелетных мышц также приведет к внекардиальной реэкспрессии молекул СТ. Вместе с тем, следует отметить, что это весьма противоречивый механизм [27][28][33] и некоторые исследователи его опровергают.
В целом, основываясь на проведенном анализе литературы, возможные механизмы повышения СТ можно суммировать в табл. 1.
Table 1. Possible mechanisms for elevated cardiac troponins after statins taking
Таблица 1. Возможные механизмы повышения СТ после приема статинов

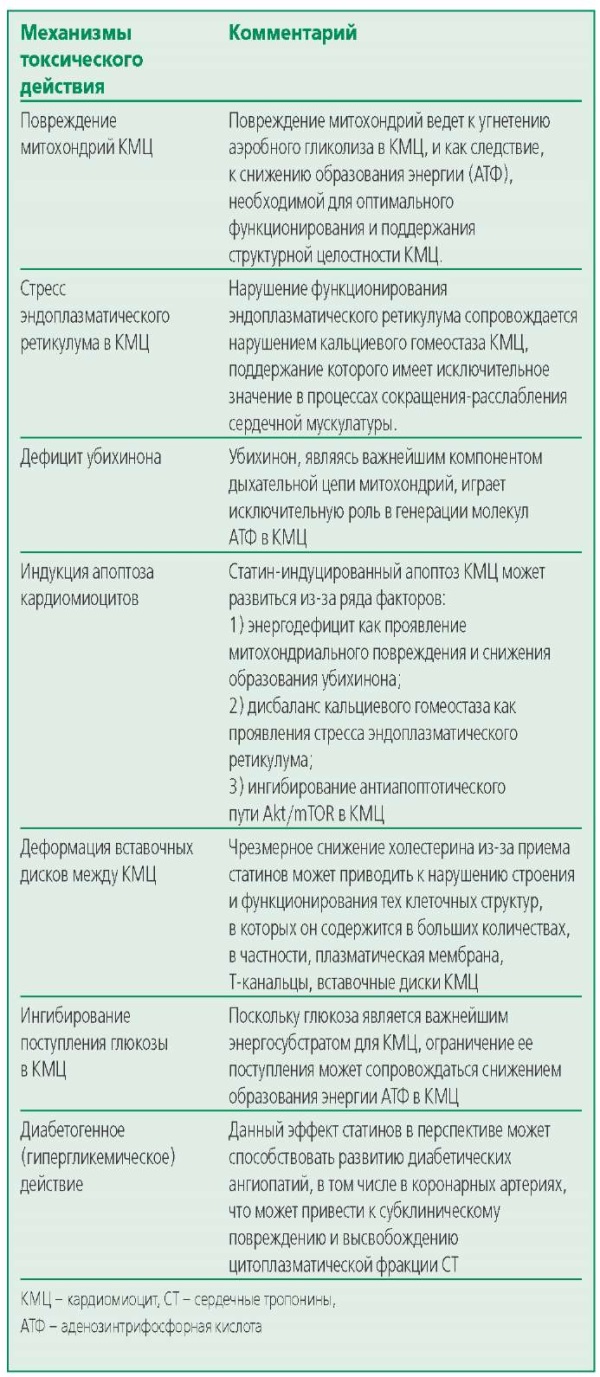
Потенциальные механизмы токсического действия статинов на КМЦ (экспериментальные данные)
Практически с момента своего создания статины демонстрировали выраженный противоатерогенный эффект путем значимого снижения уровней холестерина риска развития и прогрессирования атеросклеротических ССЗ, в связи с чем даже сама мысль о возможном наличии негативных эффектов этих препаратов на миокард казалась крайне невероятной. Однако, усовершенствованные методы лабораторной диагностики, гистологии и молекулярной биологии привнесли ряд новых данных о наличии потенциальных кардиотоксических свойств у статинов [34-38]. J. Godoy и соавт. изучали развитие ультраструктурных изменения в миокарде крыс под действием статинов (аторвастатин и правастатин). При длительном (в течение 7 мес) пероральном введении аторвастатина (но не правастатина) крысам отмечались значительные ультраструктурные нарушения митохондрий: набухание, изменение их размеров, смещение, физическое разъединение друг от друга, которые в нормальных КМЦ все стыкуются между собой с помощью митохондриальных контактов, формируют хондриом по типу трехмерной сети [34]. Весьма примечательно, что подобные ультраструктурные изменения митохондрий также характерны для скелетных мышечных тканей при лечении статинами [39][40], а в сердечной мышце рассматриваются в качестве основного признака метаболических изменений, часто предшествующих развитию сердечной дисфункции [40-42].
При изучении влияние статинов на экспрессию генов в КМЦ оказалось, что аторвастатин, но не правастатин репрессировал гены, отвечающие за поддержание целостности и оптимального функционирования митохондрий. Помимо этого, исследователи обнаружили, что аторвастатин, но не правастатин подавляет передачу внутриклеточных сигналов сердечного Akt/mTOR [34], которые, как было показано ранее, регулируют физиологическую функцию сердца и выживаемость КМЦ [35]. Тем самым поднимается вопрос о том, как длительное ингибирование mTOR при введении аторвастатина [34] повлияет на целостность и выживаемость КМЦ.
Аторвастатин также неблагоприятным образом влияет на эндоплазматический ретикулум, вызывая стресс эндоплазматического ретикулума in vitro и последующий апоптоз КМЦ [34]. В исследовании S. Ghavami и соавт. также сообщалось, что симвастатин индуцирует стресс эндоплазматического ретикулума и апоптоз в фибробластах, локализующихся в предсердиях человека [43].
Y. Zhu и соавт. [37] обнаружили, что вызванное статинами истощение мембранного холестерина в КМЦ приводит к нарушению архитектуры поперечных (Т) – канальцев, которые являются ключевыми структурами для сопряжения процессов сокращения миокарда. Помимо ремоделирования Т-канальцев КМЦ, изучая морфологию миокарда в экспериментальной модели (изолированном перфузируемом по Лангендорфу миокарда), исследователи обнаружили нарушение целостности вставочных дисков (межклеточных связей) между КМЦ.
Статины также могут оказывать влияние на поглощение глюкозы КМЦ, при этом правастатин и розувастатин, в отличие от аторвастатина оказывают менее значимое влияние на этот процесс [36]. Ингибирование аторвастатином поглощения глюкозы КМЦ, может приводить к снижению аэробного метаболизма миокарда, поскольку глюкоза является одним из главных энергоресурсов для миокарда.
И наконец, в качестве последнего потенциального долгосрочного механизма кардиотоксичности статинов по отношению к миокарду можно рассматривать тот факт, что статины повышают риск развития сахарного диабета [44], что впоследствии может повысить риск развития атеросклероза коронарных сосудов и субклинического повреждения миокарда из-за снижения доставки кислорода к КМЦ.
Таким образом, вызванные статинами неблагоприятные миотоксические эффекты могут быть характерны как для скелетной, так и для сердечной мышечной ткани. Различные статины могут иметь разные эффекты на молекулярно-генетическом и клеточном уровнях, индуцируя или подавляя определенные внутриклеточные сигналы, которые могут усиливать благоприятные эффекты на миокард, или напротив их ослаблять и вызывать неблагоприятные изменения. Необходимы дополнительные исследования экспериментального и клинического характера для лучшего понимания плейотропных эффектов статинов и их влиянии на КМЦ. Следует помнить, что некоторые из приведенных выше данных получены в экспериментах на животных и не могут переноситься на человека.
Основные возможные механизмы, потенциально лежащие в основе кардиотоксичности статинов обобщены в табл. 2.
Table 2. Main possible mechanisms of statin cardiotoxicity
Таблица 2. Основные возможные механизмы кардиотоксичности статинов
Гипотетические факторы риска развития кардиотоксичности и повышения концентрации ВЧ СТ при применении статинов
Гипотетически, можно выделить ряд факторов, которые при комбинированном влиянии совместно со статинами могут усилить кардиотоксические свойства последних и/или поспособствовать повышению концентрации ВЧ СТ.
- Сочетанное воздействие биологических и физиологических факторов (физических нагрузок, стрессовых ситуаций, пол, возраст). На сегодняшний день установлено, что ряд физиологических и биологических факторов может способствовать и/или напротив ослаблять повреждение миокарда. Так, например, физические нагрузки [45] и стрессовые ситуации [46] ассоциируются с обратимыми субклиническими повреждениями КМЦ и повышением концентрации ВЧ СТ, поэтому влияние данных факторов может дополнительно способствовать повышению уровней ВЧ СТ. Определенную роль могут сыграть пол, возраст пациентов. Так, у пациентов молодого возраста концентрации ВЧ СТ значимо ниже, чем у пациентов пожилого возраста [14][47], что может свидетельствовать о их более высокой восприимчивости к повреждающему действию ряда факторов, в том числе и статинов. Подобная аналогия прослеживается и с учетом гендерной принадлежности: базовые концентрации ВЧ СТ у мужчин выше, чем у женщин, что, связывают с наличием у последних ряда дополнительных защитных механизмов от кардиотоксических эффектов, обусловленных высоким уровнем эстрогенов (уменьшение оксидативного стресса, вазодилатация коронарных сосудов, антиапоптотические эффекты и др.) [48]. Тем, самым при сочетанном влиянии статинов более устойчивыми к их негативному эффекту, гипотетически, будут пациенты женского пола.
- Наличие сопутствующих заболеваний, оказывающих негативное влияние на КМЦ. Наличие и степень развития сопутствующих многих сердечных и внесердечных нозологий, затрагивающих в процессе патогенеза КМЦ [49], также может считаться вероятным фактором риска более выраженного повреждения и повышения концентрации ВЧ СТ при сочетании с использованием статинов.
- Генетическая детерминация. На сегодняшний день в литературе отсутствуют данные о генетической детерминации увеличения СТ при применении статинов, однако, можно выдвинуть гипотетически оправданные предположения о ее важной роли. Так, наличие генетических полиморфизмов/мутаций в генах, кодирующих информацию об антиоксидантных ферментах или ферментах, ответственных за образование АТФ или ряда важных митохондриальных белков КМЦ (например, убихинона). Так, например, при наличии базового дефицита убихинона [50] у пациентов, принимающих статины (данные препараты вызывают снижение образования этого эссенциального для КМЦ убихинона), риск развития повреждения КМЦ значимо усилится, по сравнению с пациентами, у которых базовый запас убихинона в миокарде нормальный или высокий.
- Аналитические проблемы. Нельзя не упомянуть и возможные аналитические риски, связанные с ложноположительным повышением концентрации ВЧ СТ при применении статинов. Так, риск развития ложноположительного повышения концентрации ВЧ СТ зависит от тест-системы производителя, что было показано в работе J. Schmid и соавт. [28]. Тем самым, некоторые тест-системы могут давать ложноположительное повышение ВЧ СТ из-за повреждения скелетных мышц, которое весьма характерно для препаратов группы статинов.
Таким образом, учитывая противоречивость и недостаточную изученность существующих сведений о кардиотоксичности статинов, мы полагаем, что для подтверждения или исключения кардиотоксических эффектов статинов необходимы дальнейшие исследования с использованием методов экспериментального моделирования: введение лабораторным животных разных статинов с разной дозировкой с последующим исследование сыворотки крови ВЧ методами определения СТ, а также оценки морфологических изменений миокарда на ультраструктурном уровне организации при помощи электронной микроскопии.
Заключение
Таким образом, принимая во внимание имеющиеся на сегодняшний момент сведения, можно предполагать наличие у некоторых статинов кардиотоксических эффектов. Подтверждением тому служат данные о повышении ВЧ СТ-Т у тех пациентов, которые принимают статины, а также экспериментальные работы по изучению кардиотоксических свойств статинов на ультраструктурном и молекулярном уровнях организации. Однако, имеющихся данных на данный момент недостаточно, чтобы окончательно подтвердить или опровергнуть наличие кардиотоксических эффектов у статинов. Тем самым, следует отметить, что польза от применения статинов по показаниям, превышает риски возможной кардиотоксичности данных препаратов. Необходимы дальнейшие исследования для выяснения точной причины повышения ВЧ СТ при применении статинов и подтверждения/опровержения кардиотоксических эффектов статинов.
Relationships and Activities. None.
Отношения и Деятельность. Нет.
Список литературы
1. Сергиенко И.В. История появления статинов. Атеросклероз и Дислипидемии. 2011;1(2):57-66.
2. Дреева З.В., Агеев Ф.Т. История рождения статинов новые перспективы. Медицинский Совет. 2017;(11):202-7. DOI:10.21518/2079-701X-2017-11-202-207.
3. Журавлева М.В., Прокофьев А.Б., Ших Е.В., и др. Ингибиторы PCSK9 у пациентов с атеросклеротическими сердечно-сосудистыми заболеваниями: рекомендации и вопросы обеспечения. Рациональная Фармакотерапия в Кардиологии. 2020;16(4):644-53. DOI:10.20996/1819-6446-2020-08-21.
4. Чаулин А.М., Дупляков Д.В. PCSK-9: современные представления о биологической роли и возможности использования в качестве диагностического маркера сердечно-сосудистых заболеваний. Часть 1. Кардиология: Новости, Мнения, Обучение. 2019;7(2):45-57. DOI:10.24411/2309-1908-2019-12005.
5. Чаулин А.М., Дупляков Д.В. Роль PCSK9 в регуляции транспорта липопротеинов (обзор литературы). Вопросы Биологической, Медицинской и Фармацевтической Химии. 2021;24(1):42- 5. DOI:10.29296/25877313-2021-01-00.
6. Arrieta A, Page TF, Veledar E, Nasir K. Economic Evaluation of PCSK9 Inhibitors in Reducing cardiovascular risk from Health system and private payer perspectives. PLoS One. 2017;12(1):e0169761. DOI:10.1371/journal.pone.0169761.
7. Драпкина О.М., Костюкевич М.В. Метаболический синдром: проблема гепатотоксичности при лечении статинами. Атеросклероз и Дислипидемии. 2011;3(4):45-51.
8. Чаулин АМ. Основные побочные эффекты статинов в клинической практике. Клиническая Практика. 2022;13(2):98-107. DOI:10.17816/clinpract108076
9. Дядык А.И., Куглер Т.Е., Сулиман Ю.В., и др. Побочные эффекты статинов: механизмы развития, диагностика, профилактика и лечение. Архивъ Внутренней Медицины. 2018;8(4):266-76. DOI:10.20514/2226-6704-2018-8-4-266-276.
10. Чаулин А.М., Абашина О.Е., Дупляков Д.В. Высокочувствительные сердечные тропонины (hs-Tn): методы определения основные аналитические характеристики. Кардиоваскулярная Терапия и Профилактика. 2021;20(2):2590. DOI:10.15829/1728-8800-2021-2590.
11. Чаулин А.М., Дупляков Д.В. Биомаркеры острого инфаркта миокарда: диагностическая прогностическая ценность. Часть 1. Клиническая Практика. 2020;11(3):75-84. DOI:10.17816/clinpract34284.
12. Garcia-Osuna A, Gaze D, Grau-Agramunt M, et al. Ultrasensitive quantification of cardiac troponin I by a Single Molecule Counting method: analytical validation and biological features. Clin Chim Acta. 2018;486:224-31. DOI:10.1016/j.cca.2018.08.015.
13. Чаулин А.М., Карслян Л.С., Григорьева Е.В., и др. Особенности метаболизма сердечных тропонинов (обзор литературы). Комплексные Проблемы Сердечно-сосудистых Заболеваний. 2019;8(4):103-15. DOI:10.17802/2306-1278-2019-8-4-103-115.
14. Trupp RJ, Albert G, Ziegler A. Sex-specific 99th percentiles derived from the AACC Universal Sample Bank for the Roche Gen 5 cTnT assay: Comorbidities and statistical methods influence derivation of reference limits. Clin Biochem. 2018;52:173. DOI:10.1016/j.clinbiochem.2017.11.003.
15. Чаулин А.М., Дупляков Д.В. Аналитический обзор современных сведений о физиологических и патохимических механизмах высвобождения из мышечной ткани кардиоспецифических белков, методологии и технологиях их исследования, трактовке результатов. Лабораторная Диагностика. Восточная Европа. 2022;11(1):78-97. DOI:10. 34883/PI.2022.11.1.018.
16. Thygesen K, Alpert JS, Jaffe AS, et al. Fourth universal definition of myocardial infarction (2018). Eur Heart J. 2019;40(3):237-69. DOI:10.1093/eurheartj/ehy462.
17. Чаулин А.М., Дуплякова П.Д., Дупляков Д.В. Циркадные ритмы сердечных тропонинов: механизмы и клиническое значение. Российский Кардиологический Журнал. 2020;25(3S):4061. DOI:10. 15829/1560-4071-2020-4061.
18. Pervan P, Svaguša T, Prkačin I, et al. Urine high sensitive Troponin I measuring in patients with hypertension. Signa Vitae. 2017;13(Suppl 3):62-4. DOI:10.22514/SV133.062017.13.
19. Чаулин А.М., Карслян Л.С., Григорьева Е.В., и др. Клинико-диагностическая ценность кардиомаркеров в биологических жидкостях человека. Кардиология. 2019;59(11):66-75. DOI:10.18087/cardio.2019.11.n414.
20. Чаулин А.М., Дуплякова П.Д., Бикбаева Г.Р., и др. Концентрация высокочувствительного тропонина I в ротовой жидкости у пациентов с острым инфарктом миокарда: пилотное исследование. Российский Кардиологический Журнал. 2020;25(12):3814. DOI:10.15829/1560-4071-2020-3814.
21. Zaninotto M, Padoan A, Mion MM, et al. Short-term biological variation and diurnal rhythm of cardiac troponin I (Access hs-TnI) in healthy subjects. Clin Chim Acta. 2020;504:163-7. DOI:10. 1016/j.cca.2020.02.004.
22. Царева Ю.О., Майскова Е.А., Федотов Э.А., и др. Циркадные ритмы тиреоидных гормонов у пациентов с ишемической болезнью сердца, артериальной гипертонией и фибрилляцией предсердий. Кардиология. 2019;59(3S):23-9. DOI:10.18087/cardio.2506.
23. Ünlü S, Nurkoç SG, Sezenöz B, et al. Impact of statin use on high sensitive troponin T levels with moderate exercise. Acta Cardiol. 2019;74(5):380-5. DOI:10.1080/00015385.2018.1510801.
24. Collet JP, Thiele H, Barbato E, et al.; ESC Scientific Document Group. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J. 2021;42(14):1289-367. DOI:10.1093/eurheartj/ehaa575.
25. Trentini A, Spadaro S, Rosta V, et al. Fast skeletal troponin I, but not the slow isoform, is increased in patients under statin therapy: a pilot study. Biochem Med (Zagreb). 2019;29(1):010703. DOI:10.11613/BM.2019.010703.
26. Eijsvogels TM, Januzzi JL, Taylor BA, et al. Impact of statin use on exercise-induced cardiac troponin elevations. Am J Cardiol. 2014;114(4):624-8. DOI:10.1016/j.amjcard.2014.05.047.
27. Чаулин А. Основные причины и механизмы формирования ложноположительных результатов тропониновых иммунотестов. Лабораторная Диагностика. Восточная Европа. 2022.11(2):132-47. DOI:10.34883/PI.2022.11.2.012.
28. Schmid J, Liesinger L, Birner-Gruenberger R, et al. Elevated Cardiac Troponin T in Patients With Skeletal Myopathies. J Am Coll Cardiol. 2018;71(14):1540-9. DOI:10.1016/j.jacc.2018.01.070.
29. Collinson P, Kiely P. Unexpected Troponin Elevation in a Patient Treated with Atorvastatin. J Appl Lab Med. 2020;5(4):798-801. DOI:10.1093/jalm/jfaa031.
30. Ricchiuti V, Apple FS. RNA expression of cardiac troponin T isoforms in diseased human skeletal muscle. Clin Chem. 1999;45(12):2129-35.
31. Messner B, Baum H, Fischer P, et al. Expression of messenger RNA of the cardiac isoforms of troponin T and I in myopathic skeletal muscle. Am J Clin Pathol. 2000;114(4):544-9.
32. Wens SC, Schaaf GJ, Michels M, et al. Elevated Plasma Cardiac Troponin T Levels Caused by Skeletal Muscle Damage in Pompe Disease. Circ Cardiovasc Genet. 2016;9(1):6-13. DOI:10.1161/CIRCGENETICS.115.001322.
33. Vroemen WHM, de Boer D, Streng AS, et al. Elevated Cardiac Troponin T in Skeletal Myopathies: Skeletal TnT Cross-Reactivity and/or Cardiac TnT Expression? J Am Coll Cardiol. 2018;72(3):347-9. DOI:10.1016/j.jacc.2018.05.017.
34. Godoy JC, Niesman IR, Busija AR, et al. Atorvastatin, but not pravastatin, inhibits cardiac Akt/mTOR signaling and disturbs mitochondrial ultrastructure in cardiac myocytes. FASEB J. 2019;33(1):1209- 25. DOI:10.1096/fj.201800876R.
35. Zhang D, Contu R, Latronico MV, et al. MTORC1 regulates cardiac function and myocyte survival through 4E-BP1 inhibition in mice. J Clin Invest. 2010;120(8):2805-16. DOI:10.1172/JCI43008.
36. Jiang Z, Yu B, Li Y. Effect of Three Statins on Glucose Uptake of Cardiomyocytes and its Mechanism. Med Sci Monit. 2016;22:2825-30. DOI:10.12659/msm.897047.
37. Zhu Y, Zhang C, Chen B, et al. Cholesterol is required for maintaining T-tubule integrity and intercellular connections at intercalated discs in cardiomyocytes. J Mol Cell Cardiol. 2016;97:204-12. DOI:10.1016/j.yjmcc.2016.05.013.
38. Kumazaki M, Ando H, Ushijima K, Fujimura A. Comparative effects of statins on murine cardiac gene expression profiles in normal mice. Eur J Pharmacol. 2013;707(1-3):71-7. DOI:10.1016/j.ejphar.2013.03.022.
39. Kaufmann P, Török M, Zahno A, et al. Toxicity of statins on rat skeletal muscle mitochondria. Cell Mol Life Sci. 2006;63(19-20):2415-25. DOI:10.1007/s00018-006-6235-z.
40. Apostolopoulou M, Corsini A, Roden M. The role of mitochondria in statin-induced myopathy. Eur J Clin Invest. 2015;45(7):745-54. DOI:10.1111/eci.12461.
41. Milner DJ, Mavroidis M, Weisleder N, Capetanaki Y. Desmin cytoskeleton linked to muscle mitochondrial distribution and respiratory function. J Cell Biol. 2000;150(6):1283-98. DOI:10.1083/jcb.150.6.1283.
42. Zemljic-Harpf AE, Ponrartana S, Avalos RT, et al. Heterozygous inactivation of the vinculin gene predisposes to stress-induced cardiomyopathy. Am J Pathol. 2004;165(3):1033-44. DOI:10.1016/S0002-9440(10)63364-0.
43. Ghavami S, Yeganeh B, Stelmack GL, et al. Apoptosis, autophagy and ER stress in mevalonate cascade inhibition-induced cell death of human atrial fibroblasts. Cell Death Dis. 2012;3(6):e330. DOI:10.1038/cddis.2012.61.
44. Драпкина О.М. Статины и риск развития сахарного диабета. Рациональная Фармакотерапия в Кардиологии. 2013;9(4):444-7. DOI:10.20996/1819-6446-2013-9-4-444-447.
45. Чаулин А.М., Дупляков Д.В. Физические нагрузки и кардиомаркеры. Часть 1. Человек. Спорт. Медицина. 2022;22(2):15-28. DOI:10.14529/hsm220202.
46. Lazzarino AI, Hamer M, Gaze D, et al. The association between cortisol response to mental stress and high-sensitivity cardiac troponin T plasma concentration in healthy adults. J Am Coll Cardiol. 2013;62(18):1694-1701. DOI:10.1016/j.jacc.2013.05.070.
47. Gore MO, Seliger SL, Defilippi CR, et al. Age- and sex-dependent upper reference limits for the highsensitivity cardiac troponin T assay. J Am Coll Cardiol. 2014;63(14):1441-8. DOI:10.1016/j.jacc.2013.12.032.
48. Чаулин А.М. Гендерные особенности уровней содержания сердечных тропонинов в сыворотке крови и значимость использования сведений о них в тактике диагностики острого коронарного синдрома (обзор литературы). Лабораторная диагностика. Восточная Европа. 2022;11(3)323-338. DOI:10.34883/PI.2022.11.3.008.
49. Chaulin AM. Elevation Mechanisms and Diagnostic Consideration of Cardiac Troponins under Conditions Not Associated with Myocardial Infarction. Part 1. Life (Basel). 2021;11(9):914. DOI:10. 3390/life11090914.
50. Yubero D, Montero R, Santos-Ocaña C, Salviati L, Navas P, Artuch R. Molecular diagnosis of coenzyme Q10 deficiency: an update. Expert Rev Mol Diagn. 2018;18(6):491-8. DOI:10.1080/14737159.2018.1478290.
Об авторах
А. М. ЧаулинРоссия
Чаулин Алексей Михайлович,
Самара
Д. В. Дупляков
Дупляков Дмитрий Викторович,
Самара
Дополнительные файлы
Рецензия
Для цитирования:
Чаулин А.М., Дупляков Д.В. Статины и высокочувствительные сердечные тропонины: кардиотоксичность или перекрестная реактивность? Рациональная Фармакотерапия в Кардиологии. 2023;19(2):209-216. https://doi.org/10.20996/1819-6446-2023-04-01
For citation:
Chaulin A.M., Duplyakov D.V. Statins and highly sensitive cardiac troponins: cardiotoxicity or cross-reactivity? Rational Pharmacotherapy in Cardiology. 2023;19(2):209-216. (In Russ.) https://doi.org/10.20996/1819-6446-2023-04-01

















































