Перейти к:
Тромбоз сосудистого русла легких при COVID-19: клинико-морфологические параллели
https://doi.org/10.20996/1819-6446-2022-08-01
Аннотация
Цель. Изучить гистологические изменения и особенности тромботического поражения сосудистого русла легких у пациентов, скончавшихся от новой коронавирусной инфекции (COVID-19), оценить связь разных доз антикоагулянтных препаратов и процессов тромбообразования, результатов лечения и динамики ряда клинических и лабораторных показателей этих больных.
Материал и методы. Проведен ретроспективный анализ результатов стационарного лечения пациентов с COVID-19 в сочетании с морфологическим исследованием образцов легочной ткани скончавшихся больных. Изучена динамика и пиковые уровни Д-димера и фибриногена, тяжесть заболевания по шкале SOFA, распространенности пневмонии при компьютерной томографии (КТ), органная дисфункция легких, почек и печени. Оценена связь лечебных, промежуточных и профилактических дозировок антикоагулянтной терапии (АКТ) с течением и исходом заболевания, динамикой лабораторных показателей. Проведено гистологическое исследование сосудистого русла легких [окраска Martius Scarlet Blue (MSB) по Лендруму].
Результаты. В исследование включены 313 пациентов (61 пациент скончался); медиана возраста 60 лет (межквартильный диапазон 51-66 лет). Частота прижизненно подтвержденных тромботических событий (ТС) - 4,8%. Выявлена сильная статистически значимая связь уровня D-димера с тяжестью в 3-4 балла по SOFA, летальным исходом, потребностью в кислородной поддержке, распространенностью поражения при КТ, снижением скорости клубочковой фильтрации, ТС. Летальный исход не наблюдался при нормальных значениях D-димера, наступал в 13% случаев при его повышении до 3 раз, в 48,5% - до 3-6 раз, в 64,6% - при увеличении более чем в 6 раз. Для высокого уровня фибриногена сильная статистически значимая связь прослеживалась с тяжестью по шкале SOFA в 3-4 балла, КТ3 и КТ4 степенях тяжести пневмонии, летальным исходом. Уровни D-димера и фибриногена продемонстрировали слабую корреляцию. Проведение АКТ в разных режимах (профилактическая, промежуточная и лечебная) не показало статистически значимой связи с уровнями D-димера, фибриногена, динамикой изменений при КТ, с общей летальностью. В гистологических препаратах 36 скончавшихся пациентов применена окраска MSB. Оценено 1394 сосуда. У всех 36 больных (100%) в сосудах разного калибра обнаружены тромбы различной давности. В сосудах калибра 3,5-30 мм тромбы встречались в 7%, калибра 0,034-0,84 мм - в 48%, среднего калибра 0,85-3,4 мм - в 45%. Доля тромбов возрастом 0-6 ч, 6-12 ч, 12-18 ч, 18-24 ч, >24 ч составила 12%, 14%, 62%, 5% и 7% соответственно.
Заключение. Тромботические изменения в системе легочной артерии (ЛА) обнаруживались у всех скончавшихся пациентов, они поражали около трети сосудов легочного русла и представляли собой тромбы различной степени зрелости. Тромботические процессы в сосудистом русле легких играют значимую роль в патогенезе и танатогенезе при COVID-19. Критерием прогрессирования тромбоза в системе ЛА при COVID-19 может являться уровень D-димера, нарастание которого коррелировало с тяжестью легочной дисфункции, тромботическими изменениями легких, риском летального исхода и не зависело от характера АКТ.
Для цитирования:
Порембская О.Я., Кравчук В.Н., Гальченко М.И., Деев Р.В., Чесноков М.Ш., Аванесян А.В., Лобастов К.В., Цаплин С.Н., Лаберко Л.А., Ермаков В.С., Пашовкина О.В., Счастливцев И.В., Сайганов С.А. Тромбоз сосудистого русла легких при COVID-19: клинико-морфологические параллели. Рациональная Фармакотерапия в Кардиологии. 2022;18(4):376-384. https://doi.org/10.20996/1819-6446-2022-08-01
For citation:
Porembskaya O.Ya., Kravchuk V.N., Galchenko M.I., Deev R.V., Chesnokov M.Sh., Avanesyan A.V., Lobastov K.V., Tsaplin S.N., Laberko L.A., Ermakov V.S., Pashovkina O.V., Schastlivtsev I.V., Sayganov S.A. Pulmonary Vascular Thrombosis in COVID-19: Clinical and Morphological Parallels. Rational Pharmacotherapy in Cardiology. 2022;18(4):376-384. https://doi.org/10.20996/1819-6446-2022-08-01
Введение
С первых месяцев распространения в мире новой коронавирусной инфекции (COVID-19) стали очевидными особенности клинической картины заболевания с высокой частотой тромботических осложнений, изменениями коагуляционной системы и неоднозначными эффектами антикоагулянтной терапии. Проведенные метаанализы свидетельствовали о высокой частоте развития венозных тромбоэмболических осложнений (ВТЭО), достигающей 17 33,1%, из которых на тромбоз глубоких вен (ТГВ) приходилось до 20%, на тромбоэмболию легочной артерии (ТЭЛА) – до 13% [1][2]. Важной особенностью течения COVID-19 является тромботическое поражение сосудистого русла легких, часто протекающее без симультанного ТГВ (до 58%), что определяет уникальность фенотипа заболевания [3,4].
Клинические проявления ВТЭО сопровождаются изменениями лабораторных показателей, которые рассматриваются как прогностические факторы. Значимым является уровень D-димера, обладающий высокой чувствительностью (91%) в отношении выявления ВТЭО у больных COVID-19 [3]. Повышение D-димера >2000 нг/мл связано с риском тяжелого течения COVID-19 (66%), тромботического события (37,8%), поражения почек (58,3%), летального исхода (47%) [5]. Прогностическая значимость D-димера подчеркивается его использованием в составе шкал Caprini и Improve DD, валидированных для оценки риска развития ВТЭО у пациентов с COVID-19 [6][7].
Течение заболевания с высокой частотой развития ВТЭО породило концепцию тромбопрофилактики при лечении пациентов с COVID-19 и нашло отражение в рекомендациях различных сообществ по назначению антикоагулянтной терапии (АКТ) в качестве базового компонента терапии госпитализированных с COVID19 больных [8][9]. Споры возникли относительно необходимости эскалации дозировок АКТ. Метаанализ показал снижение риска артериальных и венозных тромботических событий при использовании повышенных доз антикоагулянтов [10]. Вместе с тем корреляции между лечебными дозами АКТ и выживаемостью тяжелых пациентов подтверждено не было, и только у больных со среднетяжелым течением болезни повышалась вероятность выписки из стационара без органной поддержки [11-13].
Особенностью проводимых исследований по определению эффективности АКТ при COVID-19 является оценка комбинированной конечной точки, где ВТЭО рассматривается в качестве одного из критериев эффективности терапии [11-13]. Это свидетельствует о сложном патогенезе и танатогенезе COVID-19, в который интегрированы тромботические процессы с особенностями течения и с ограниченным ответом на введение антикоагулянтов [14][15].
Цель исследования – изучить гистологические изменения и особенности тромботического поражения сосудистого русла легких у пациентов, скончавшихся от COVID-19, оценить связь разных доз антикоагулянтных препаратов и процессов тромбообразования, результатов лечения и динамики ряда клинических и лабораторных показателей этих больных.
Материал и методы
Исследование представляет собой комбинацию ретроспективного анализа результатов стационарного лечения пациентов с подтвержденным COVID-19 и морфологического исследования образцов легочной ткани, полученных у скончавшихся больных.
В исследование включены 313 пациентов, находившихся на лечении с подтвержденным диагнозом COVID-19 в мае, октябре 2020 г. и в июле 2021 г. в двух стационарах, перепрофилированных под инфекционные госпитали на время пандемии: ФГБОУ ВО «СЗГМУ им. И.И. Мечникова» клиника имени Петра Великого и ФГБУ «Клиническая больница №1» Управления делами Президента Российской Федерации (Волынская больница) г. Москвы.
Клиническое исследование. Анализ клинических и лабораторных данных и результатов инструментальных исследований произведен на основании содержания историй болезни госпитализированных пациентов с COVID-19 за изучаемый промежуток времени. Анализ лабораторных показателей проводили по пиковым значениям отклонения от нормальных величин. У ряда пациентов были оценены также уровни Д-димера и фибриногена в динамике при мониторинге в течение срока лечения. Диагностику ДВС-синдрома проводили в соответствии с критериями ISTH (>5 баллов) [16].
Лечение пациентов проводили на основании актуальных временных Клинических рекомендаций Министерства Здравоохранения Российской Федерации. Профилактика ВТЭО проводилась с использованием низкомолекулярных гепаринов (НМГ), или в более редких случаях – нефракционированного гепарина (НФГ), в стандартных профилактических, промежуточных либо лечебных дозировках. Выбор дозы препарата был обусловлен тяжестью состояния, наличием факторов риска венозных тромбоэмболических осложнений, вероятностью кровотечения, с учетом действующих рекомендаций по применению антикоагулянтных препаратов. В случае усугубления тяжести состояния пациента переходили к эскалации дозировок АКТ. Профилактическая и лечебная дозы НМГ при подкожном введении соответствовали официальным инструкциям к препаратам, промежуточная доза подразумевала введение 50% или 75% от терапевтической дозы.
Всем пациентам выполняли компьютерную томографию (КТ) органов грудной клетки. В отдельных случаях для анализа были доступны результаты КТ в динамике за период пребывания в стационаре. При подозрении на тромбоэмболию ветвей легочной артерии выполняли контрастную КТ-ангиопульмонографию. Ультразвуковое ангиосканирование вен нижних конечностей проводилось при появлении симптомов ТГВ, либо при поиске источника ТЭЛА в случае, если подобный диагноз был поставлен или заподозрен.
Морфологическое исследование. Аутопсия выполнена всем пациентам, вошедшим в исследование. При аутопсии забирали фрагменты легких с типичными макроскопическими признаками диффузного альвеолярного повреждения. Фрагменты не включали сосуды корня легкого и крупные ветви ЛА. Гистологические препараты аутопсийного материала окрашивались гематоксилином и эозином, и также по Маллори. Для оценки давности тромбоза в препаратах легких использовали тройную окраску для выявления возраста фибрина, основанную на методе Martius Scarlet Blue (MSB) по Лендруму (БиоВитрум, артикул 07-014, ЭргоПродакшн). При данной методике «молодой» фибрин возрастом до 6 ч характеризуется желто-оранжевым окрашиванием, «зрелый» давностью до 24 ч – ярко красным. Для фибрина старше 24 ч, организующегося фибрина с коллагеновыми волокнами типичны голубой и серо-голубой цвета [17]. Все сосуды, обнаруженные в гистологических препаратах легких, ранжировали по их диаметру на 17 классов по S. Singhal [18]. Дополнительного информированного согласия на выполнение гистологических исследований у родственников не подписывали, поскольку все исследования соответствовали этическим стандартам, принятым на территории Российской Федерации.
Статистический анализ. Обработка данных выполнена с помощью языка статистического программирования R (R Language version 4.1, jamovi). Все числовые показатели приведены в виде среднего значения со стандартным отклонением (M±SD) или медианы (Me) с межквартильным диапазоном (25%; 75%), относительных величин с 95% доверительным интервалом (ДИ), рассчитанным по методу Вилсона. Для оценки различий между группами использованы тесты Манна-Уитни-Уилкоксона, Краскела-Уоллиса, для оценки связи в случае номинальных признаков – критерии хи-квадрат для таблиц сопряженности. Для оценки корреляций использована корреляция Спирмена и Кендалла. Для оценки размера эффекта в случае номинальных признаков V Крамера (Cramer’s V) интерпретация соответствует уровням, указанным в статье Dong Kyu Lee [19]. При использовании критерия хи-квадрат уровни D димера могли объединяться в силу малочисленности пациентов в некоторых из групп. Показатель p<0,05 принимался за статистически значимый.
Результаты
Общая характеристика пациентов. Медиана возраста госпитализированных пациентов (n=313) составила 60 (51; 66) лет с более высокой летальностью среди пациентов старше 70 лет (p<0,001). Доля мужчин составила 52,4%, женщин – 47,6%, медиана длительности госпитализации – 13 (11; 16) дней. Медиана индекса массы тела оказалась равной 29 (26; 32) кг/м2 без его корреляции с исходом заболевания (p=0,064). Летальный исход наблюдался в 61 случае (19,5%). Артериальная гипертензия и ишемическая болезнь сердца диагностированы у 62,0% пациентов, хроническая обструктивная болезнь легких или бронхиальная астма – у 28 (8,9%), сахарный диабет – у 50 (16,0%), цереброваскулярная болезнь – у 13 (4,2%), онкологические заболевания – у 13 (4,2%), другие хронические заболевания (хроническая болезнь почек, заболевания желудочно-кишечного тракта, аутоиммунные заболевания) – у 13 (4,2%). Тромботические события были зарегистрированы в 15 (4,8%) случаях и представлены: ТЭЛА (n=6; 40,0% от общего числа ВТЭО), ТГВ (n=3; 20,0%), комбинацией ТГВ и ТЭЛА (n=1; 6,7%), тромбозом поверхностных вен нижних конечностей (n=2; 13,3%), постинъекционным тромбозом вен верхних конечностей (n=1; 6,7%), острым коронарным синдромом (n=2; 13,3%).
Оценка лабораторных показателей
D-димер. Повышение D-димера до 3 раз (≤1500 мкг/л) отмечалось у 37,1% пациентов, в 3-6 раз (>1500 и ≤3000 мкг/л) – в 11,3%, более чем в 6 раз (>3000 мкг/л) в 16,5% случаев. Наблюдалось увеличение доли пациентов с высоким уровнем Dдимера с ростом тяжести по шкале SOFA (Cramer’s V=0,346, p<0,001) (рис. 1). В группе пациентов с тяжестью заболевания 3-4 балла по шкале SOFA доля лиц без повышения уровня D-димера составила 8,7%, c повышением >3000 мкг/л – 43,5%. В случаях легкого течения заболевания, соответствующего 0 баллам по SOFA, те же значения показателя определялись у 37,7% и 3,3% больных соответственно. Выявлена умеренная статистически значимая связь значений D-димера с потребностью в кислородной поддержке (с неинвазивной и инвазивной вентиляцией легких; Сramer’s V=0,44, р<0,001) и с летальным исходом (Сramer’s V=0,6, p<0,001) (рис. 2). Значимой оказалась связь уровня D-димера >1500 мкг/л со скоростью клубочковой фильтрации <60 мл/мин (средняя связь, Сramer’s V=0,258, р=0,002), с высоким уровнем креатинина (средняя связь, Сramer’s V=0,314, р<0,001). Корреляции с уровнем печеночных ферментов (АСТ, АЛТ) выявлено не было. Распространенные изменения паренхимы легких при КТ3 и КТ4 степенях тяжести пневмонии сопровождались устойчивым повышением уровня D-димера: нарастание в пределах >500 и ≤1500 мкг/л до 8%, >3000 мкг/л до 48% (Сramer’s V= 0,413, p<0,001) (см. рис. 1).
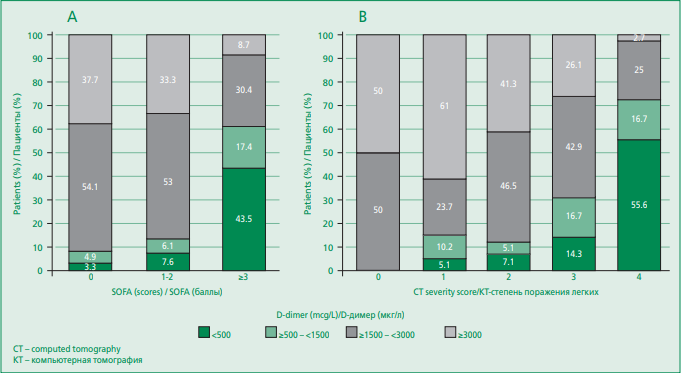
Figure 1. Ratios of D-dimer levels according to SOFA score (A) and CT severity score (B) in patients with COVID-19
Рисунок 1. Соотношения уровней D-димера у пациентов с разной тяжестью заболевания по шкале SOFA (А) и степенью поражения легких по КТ (В)
Выявлена умеренная статистически значимая связь между тромботическими событиями и уровнем D-димера (Сramer’s V=0,321, p<0,001). Доля пациентов с тромбозом возрастает от 0% у пациентов с D-димером<500 мкг/л до 38% при его значении >3000 мкг/л.
Летальный исход не наблюдался ни у одного из больных с нормальным значением D-димера (<500 мкг/л), но наступал в 13% случаев при его повышении до 3 раз, в 48,5% – при его повышении в 3-6 раз и в 64,6% – при увеличении показателя более чем в 6 раз. У умерших больных в 50,8% случаев D-димер превышал 3000 мкг/л, в 26,2% он оказался в пределах >1500 и ≤3000 мкг/л, в 23% случаев соответствовал показателям >500 и ≤1500 мкг/л.
Фибриноген. Уровень фибриногена, превышающий 5 г/л ассоциирован с тяжестью заболевания по шкале SOFA в 3-4 балла (Сramer’s V=0,224, р=0,02), с тяжестью пневмонии (КТ3 и КТ4 степени тяжести пневмонии; Сramer’s V=0,241, р<0,001). Нарастание уровня фибриногена выше 9 г/л статистически значимо связано с исходом заболевания: рост доли летальных исходов, особенно при показателях >4 и ≤5 г/л и >9 г/л относительно нормальных значений (Сramer’s V=0,226, р=0,002). Вместе с тем статистически значимой связи с потребностью в кислороде, скоростью клубочковой фильтрации, уровнем креатинина, активностью АЛТ, АСТ не выявлено. У умерших больных в 26,2% случаев уровень фибриногена был в пределах нормальных значений, в 55,7% варьировал от >4 до ≤9 г/л, превышал 9 г/л в 16,4% случаев, и у одного больного был менее 1 г/л.
По пиковым значениям и по динамике показателей D-димер и фибриноген продемонстрировали слабую, но значимую корреляцию (r=0,241, p<0,001; r=0,204, p<0,001 соответственно).
Изменения свертывающей системы. Ни у одного из пациентов, находившихся на стационарном лечении, не был диагностирован ДВС-синдром. Увеличение протромбинового времени (ПВ) значимо ассоциировалось с риском летального исхода (Сramer’s V=0,437, р<0,001), отмечалось у 17,9% больных. Тромбоцитопения не была характерна для пациентов. Количество тромбоцитов <100х109/л и >50х109/л определялось у 24 больных (7,7%), <50х109/л – в 3 случаях (1%). Связь тромбоцитопении и летального исхода оказалась относительно сильной (Сramer’s V=0,456, р<0,001). Антикоагулянтная терапия. Проведение антикоагулянтной терапии в разных режимах (профилактическая, промежуточная и лечебная) не показало статистически значимой связи с уровнями D-димера (p=0,122), фибриногена (р=0,97), с динамикой изменений при КТ (р=0,12), с общей летальностью (Сramer’s V=0,116, р=0,368) (см. рис. 2). В группе пациентов с летальным исходом не выявлено преобладания какого-либо из использованных режимов АКТ (р=0,39). Больших кровотечений по ISTH на фоне АКТ ни у одного из пациентов зарегистрировано не было.
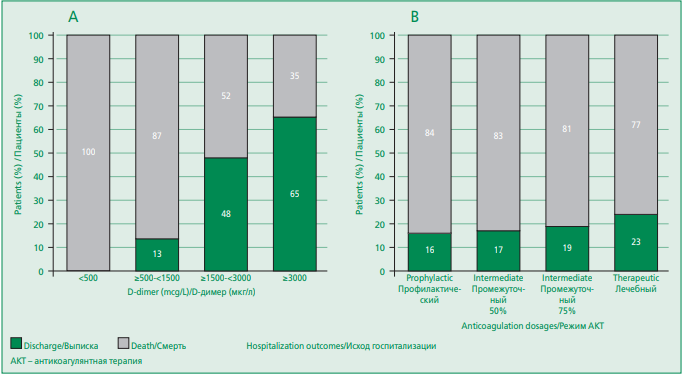
Figure 2. Distribution of hospitalization outcomes with D-dimer levels (A; n=291) and anticoagulant regimens (B; n=307) in patients with COVID-19
Рисунок 2. Соотношение исходов госпитализации с уровнями D-димера (А; n=291) и режимами антикоагулянтной терапии (B; n=307) у больных COVID-19
Данные гистологических исследований. В стенке сосудов легких отмечен ряд изменений: дистрофия и очаговая гибель эндотелия, отек субэндотелиального соединительно-тканного слоя и tunica media, лимфогистиоцитарная инфильтрация.
Гистологическое исследование с применением окраски по MSB выполнено у 36 из 61 пациента (59%). У всех 36 больных (100%) в сосудах легких были обнаружены тромбы различной давности (рис. 3). У 10 из них (27,8%) в исследованных срезах препаратов не было выявлено «зрелых» тромбов давностью более 24 ч. Во всех микропрепаратах 36 больных проанализированы 1394 сосуда в ткани легкого, из которых 29,8±4,48% были тромбированы с окклюзией просвета, или содержали пристеночные тромбы. В сосудах крупного калибра 13-17 порядков (3,5-30 мм) тромбы встречались реже всего (7%). Напротив, в сосудах мелкого калибра 4-7 порядков (0,034-0,84 мм) тромбы обнаруживались наиболее часто (48%). Сосуды среднего калибра 8-12 порядков (0,85-3,4 мм) тромбированы оказались в 45% случаев.
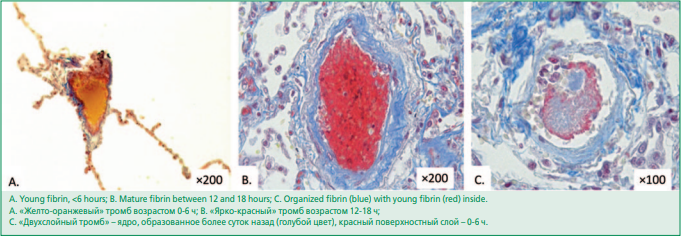
Figure 3. Thrombi of different ages in pulmonary artery branches (MSB staining).
Рисунок 3. Тромбы различной давности образования в просвете легочных сосудов (окраска MSB)
Анализ срока давности образования тромбов, показывает, что доля «молодых» и «зрелых» тромбов возрастом 0-6 ч, 6-12 ч, 12-18 ч, 18-24 ч составляет 12%, 14%, 62% и 5%, соответственно. Тромбы с давностью образования более суток составили всего 7%, что позволяет предположить постепенное нарастание тромбообразования, достигающее наибольшей выраженности в терминальном периоде.
Обсуждение
С первых месяцев пандемии COVID-19 клиницисты столкнулись с особенностями заболевания, которые проявлялись в значительных сдвигах параметров коагуляционной системы с удлинением ПВ, активированного частичного тромбопластинового времени (АЧТВ), повышением уровня D-димера, ассоциированных с неблагоприятным прогнозом заболевания [21]. Однако, если уровни ПВ и АЧТВ все же в ряде случаев сохраняются в пределах нормальных значений, в том числе, у пациентов в палатах интенсивной терапии, то D-димер демонстрирует свойства надежного предиктора тяжести течения COVID-19 [22]. Полученные в проведенном исследовании данные подтверждают корреляцию этого показателя с тяжестью органной дисфункции по баллам SOFA, тяжестью пневмонии по данным КТ, потребностью в кислородной поддержке и нарушением функции почек. Нельзя исключить, что подобная корреляция D-димера и нарастания поражения легких обусловлены прогрессирующим тромбообразованием в сосудистом русле легких [23]. Фибриноген, который продемонстрировал слабую корреляцию с D-димером, оказался ассоциирован лишь с тяжестью состояния больных, но не с морфологическими и функциональными изменениями легких, почек, печени или с тромбозом русла легочной артерии. Данные результаты согласуются с мнением, что при COVID-19 фибриноген в большей степени проявляет свойства острофазного белка, нежели «участника» тромботических процессов [24].
В основе развивающейся гиперкоагуляции при COVID-19 лежит чрезмерная активация системы гемостаза в условиях прогрессирующего иммунотромбоза в сосудах различных бассейнов, которое может являться экстрапульмональной причиной смерти больных [25]. Пусковым механизмом процесса становится формирование протромботического фенотипа сосудистой стенки, активация тромбоцитов и нейтрофилов [26]. По мере прогрессирования COVID-19 тромбоциты и нейтрофилы демонстрируют чрезмерную активацию и, несмотря на истощение многих функций, сохраняют тромбогенный потенциал и многократно рекрутируются для участия в процессе тромбообразования [27][28].
Гистологическими проявлениями активации эндотелия сосудов легочного русла вплоть до его повреждения являются вакуолизация эндотелия, его десквамация, фибриноидный некроз слоев стенки сосуда, а также инфильтрация лейкоцитами, что подтверждают и данные настоящего исследования [29,30]. Изменения наблюдаются как в тромбированных сосудах, так и в тех, где тромб еще не сформировался [14]. Состав образующихся тромбов характерен для иммунотромбоза и включает тромбоциты, нейтрофильно-тромбоцитарные агрегаты, экстрацеллюлярные нейтрофильные ловушки (NETs) и фибрин [29][31]. Прокоагулянтный эффект иммунного компонента тромбоза, лежащий в основе гиперкоагуляции, оказывается столь выраженным, что искажает свойства системы гемостаза и во многом нивелирует эффекты антикоагулянтной терапии [23][32]. У пациентов с COVID-19 на фоне введения НМГ показано сохранение нормальной генерации тромбина in vitro, сопровождающееся гиперкоагуляцией in vivo с высокими концентрациями комплексов тромбин-антитромбин (ТАТ) и плазмин-антиплазмин [23]. При этом анти-Ха активность, отражающая ответ на введение НМГ, не коррелирует с маркерами активации гемостаза, в частности, D-димером и ТАТ [23]. В настоящей работе также не обнаружено корреляции уровня и динамики изменения D-димера с дозами антикоагулянтов.
Следствием иммунотромбоза становится тромботическое поражение сосудов легочного русла, резистентное к антикоагулянтной терапии из-за неконтролируемой гиперкоагуляции [3][14][15][33][34]. Тромботическое поражение бассейна легочной артерии, в том числе, изолированное, охватывает крупные и мелкие ветви легочной артерии (долевые, сегментарные и субсегментарные), а также сосуды микроциркуляторного русла [35][36]. Результаты систематического обзора демонстрируют поражение главной ЛА у 13,5% пациентов, ветвей мелкого и среднего калибра – у 100% [29]. Исходя из результатов настоящей работы, можно утверждать, что в каждом случае тромбированными оказываются порядка половины сосудов легочного русла диаметром менее 3,4 мм. При этом тромбообразование продолжается на фоне проводимой терапии, о чем свидетельствует наличие как «зрелых» тромбов давностью более 24 ч, так и «свежих», образовавшихся менее чем за 6 ч до гибели больного и значительно превалирующих над давними. Выявление в препаратах пристеночных тромбов позволяет предположить, что в одном сосудистом сегменте могут находиться тромбы с фрагментами разной степени зрелости из-за продолжающегося тромбообразования.
Сочетание тромбированных сегментов легочного русла с высокими уровнями D-димера у больных со среднетяжелым и тяжелым течением COVID-19 при отсутствии тромбоза в других сосудистых бассейнах
позволяет говорить о D-димере как о лабораторном признаке прогрессирования тромбообразования в легких. Подтверждением этому факту может являться отсутствие зависимости уровня D-димера от антикоагулянтной терапии, и его корреляция с выраженностью изменений при КТ, тяжестью состояния больных, вклад в которое вносит тромботическое поражение сосудов легких [25].
Резистентное к антикоагулянтной терапии тромбообразование может быть обусловлено также другими процессами, помимо активации иммунного компонента. Снижение перфузии легких за счет деструкции легочной ткани, утолщение стенок сосудов в результате отека и воспаления приводят к формированию мертвых пространств в легких, шунтированию кровотока, что ограничивает действие в этих очагах системных антитромботических и фибринолитических препаратов [14][37]. Кроме того, гипоксия из-за снижения перфузии является условием, усиливающим активацию эндотелия и тромбоцитов, в том числе, посредством секреции фактора, индуцированного гипоксией (HIF), EGR-1 (early growth response-1) [38]. Важную роль в локальной активации и нарушении целостности эндотелия играет также воздействие цитокинов, секретируемых поврежденным легочным эпителием, что по силе воздействия превосходит системные эффекты противодействующих препаратов [39].
Ограничения исследования. Ограничениями исследования являются ретроспективный анализ полученных данных, отсутствие единого протокола обследования для всех больных, секционного протокола, который позволил бы получить более разнообразный материал для гистологического изучения сосудистого русла легких. Однако, благодаря массиву набранных данных, результаты дают наглядное представление о закономерностях развития тромботического процесса в ветвях легочной артерии и микроциркуляторном русле легких. Преодоление ограничений позволит провести более детальное изучение этого процесса и через понимание патогенеза приведет к поиску эффективных средств терапии тромбоза при COVID-19.
Заключение
Тромботические изменения в системе легочной артерии обнаруживаются у всех скончавшихся пациентов, поражают около трети сосудов легочного русла преимущественно мелкого калибра и представляют собой тромбы различной степени зрелости с преобладанием таковых возрастом 12-18 ч. Тромботические процессы в сосудистом русле легких развиваются по нетипичным для венозных тромбоэмболических событий закономерностям, играющим значимую роль в патогенезе и танатогенезе при COVID-19. Критерием прогрессирования тромбоза в системе легочной артерии при COVID-19 может являться уровень D-димера, нарастание которого коррелирует с тяжестью органной дисфункции, морфологическими изменениями легких, риском летального исхода, и не зависит от характера антикоагулянтной терапии.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование. Работа выполнена в рамках Научно-исследовательской работы «Кардио-васкулярные осложнения при COVID-19» (номер государственного учета НИОКТР ААА-А20-120120290057-3) при поддержке ФГБОУ ВО СЗГМУ им.И.И. Мечникова.
Funding. The study was performed with the support of the Mechnikov’s North-Western State Medical University.
Список литературы
1. Malas M, Naazie I, Elsayed N, et al. Thromboembolism risk of COVID-19 is high and associated with a higher risk of mortality: A systematic review and meta-analysis. E clinical medicine. 2020;29:100639. DOI:10.1016/j.eclinm.2020.100639.
2. Jimenez D, Garda-Sanchez A, Rali Pet al. Incidence of VTE and Bleeding Among Hospitalized Patients With Coronavirus Disease 2019. Chest. 2021;159(3):1182-96. DOI:10.1016/j.chest.2020.11.005.
3. Suh Y, Hong H, Ohana M, et al. Pulmonary Embolism and Deep Vein Thrombosis in COVID-19: A Systematic Review and Meta-Analysis. Radiology. 2021;298(2):E70-E80. DOI:10.1148/radiol.2020203557.
4. Moores L. Don't Do Anything! Just Stand There! Chest. 2021;159(3):908-9. DOI:10.1016/j.chest.2020.12.022.
5. Berger J, Kunichoff D, Adhikari S, et al. Prevalence and Outcomes of D-Dimer Elevation in Hospitalized Patients With COVID-19. Arteriosclerosis, Thrombosis, And Vascular Biology. 2020;40(10):2539-47. DOI:10.1161/atvbaha.120.314872.
6. Tsaplin S, Schastlivtsev I, Zhuravlev S, et al. The original and modified Caprini score equally predicts venous thromboembolism in COVID-19 patients. J Vasc Surg Venous Lymphat Disord. 2021;9(6):1371-81.e4. DOI:10.1016/j.jvsv.2021.02.018.
7. Lobastov K, Schastlivtsev I, Tsaplin S, et al. Prediction of Symptomatic Venous Thromboembolism in Covid-19 Patients: A Retrospective Comparison of Caprini, Padua, and IMPROVE-DD Scores. J Vasc Surg Venous Lymphat Disord. 2022;10(2):572-3. DOI:10.1016/j.jvsv.2021.12.062.
8. Thachil J, Tang N, Gando S, et al. ISTH interim guidance on recognition and management of coagulopathy in COVID-19. J Thromb Haemost. 2020;1 8(5):1 023-6. DOI:10.1111/jth.14810.
9. Barnes G, Burnett A, Allen A, et al. Thromboembolism and anticoagulant therapy during the COVID-19 pandemic: interim clinical guidance from the anticoagulation forum. J Thromb Thrombolysis. 2020;50(1):72-81. DOI:10.1007/s11239-020-02138-z.
10. Лобастов К.В., Степанов Е.А., Цаплин С.Н., и др. Эффективность и безопасность повышенных доз антикоагулянтов у пациентов с COVID-19: результаты систематического обзора литературы и метаанализа. Хирург. 2022;(1-2):50-65.
11. Lopes RD, de Barros e Silva PGM, Furtado RHM, et al. Therapeutic versus prophylactic anticoagulation for patients admitted to hospital with COVID-19 and elevated D-dimer concentration (ACTION): an open-label, multicentre, randomised, controlled trial. Lancet. 2021;397(10291):2253-63. DOI:10.1016/S0140-6736(21)01203-4.
12. Sadeghipour P, Talasaz A, Rashidi F, et al. Effect of Intermediate-Dose vs Standard-Dose Prophylactic Anticoagulation on Thrombotic Events, Extracorporeal Membrane Oxygenation Treatment, or Mortality Among Patients With COVID-19 Admitted to the Intensive Care Unit. JAMA. 2021;325(16):1620-30. DOI:10.1001/jama.2021.4152.
13. Lawler PR, Goligher EC, Berger JS, et al. The ATTACC, ACTIV-4a, and REMAP-CAP Investigators. Therapeutic Anticoagulation with Heparin in Noncritically Ill Patients with Covid-19. N Engl J Med. 2021;385(9):790-802. DOI:10.1056/nejmoa2105911.
14. Porembskaya O, Lobastov K, Pashovkina O, et al. Thrombosis of pulmonary vasculature despite anticoagulation and thrombolysis: The findings from seven autopsies. Thromb Upd. 2020;(1):100017. DOI:10.1016/j.tru.2020.100017.
15. Lax S, Skok K, Zechner P, et al. Pulmonary Arterial Thrombosis in COVID-19 With Fatal Outcome. Ann Intern Med. 2020;173(5):350-61. DOI:10.7326/m20-2566.
16. Levi M, Toh C, Thachil J, Watson H. Guidelines for the diagnosis and management of disseminated intravascular coagulation. Br J Haematol. 2009;145(1):24-33. DOI:10.1111/j.1365-2141.2009.07600.x.
17. Lendrum A, Fraser D, Slidders W, Henderson R. Studies on the character and staining of fibrin. J Clin Pathol. 1962;15(5):401-13. DOI:10.1136/jcp.15.5.401.
18. Singhal S, Henderson R, Horsfield K, et al. Morphometry of the Human Pulmonary Arterial Tree. Circ Res. 1973;33(2):190-7. DOI:10.1161/01.res.33.2.190.
19. Lee D. Alternatives to P value: confidence interval and effect size. Korean J Anesthesiol. 2016;69(6):555-62. DOI:10.4097/kjae.2016.69.6.555.
20. Schulman S, Kearon C. Definition of major bleeding in clinical investigations of antihemostatic medicinal products in non-surgical patients. J Thromb Haemost. 2005;3(4):692-4. DOI:10.1111/j.1538-7836.2005.01204.x.
21. Elieh Ali Komi D, Rahimi Y, Asghari R, et al. Investigation of the Molecular Mechanism of Coagulopathy in Severe and Critical Patients With COVID-19. Fron Immunol. 2021;12:762782. DOI:10.3389/fim-mu.2021.762782.
22. Varikasuvu S, Varshney S, Dutt N, et al. D-dimer, disease severity, and deaths (3D-study) in patients with COVID-19: a systematic review and meta-analysis of 100 studies. Sci Rep. 2021;11(1):21888. DOI:10.1038/s41598-021-01462-5.
23. Blasi A, Meijenfeldt F, Adelmeijer J, et al. In vitro hypercoagulability and ongoing in vivo activation of coagulation and fibrinolysis in COVID-19 patients on anticoagulation. J Thromb Haemost. 2020;18(10):2646-53. DOI:10.1111/jth.15043.
24. Martm-Rojas R, Perez-Rus G, Delgado-Pinos V, et al. COVID-19 coagulopathy: An in-depth analysis of the coagulation system. Eur J Haematol. 2020;105(6):741-50. DOI:10.1111/ejh.13501.
25. Milross L, Majo J, Cooper N et al. Post-mortem lung tissue: the fossil record of the pathophysiology and immunopathology of severe COVID-19. Lancet Respir Med. 2022;10(1):95-106. DOI:10.1016/s2213-2600(21)00408-2.
26. Fang X, Wang Y, Xu J, et al. Immunothrombosis in Acute Respiratory Dysfunction of COVID-19. Front Immunol. 2021;12:651545. DOI:10.3389/fimmu.2021.651545.
27. Nicolai L, Leunig A, Brambs S, et al. Immunothrombotic Dysregulation in COVID-19 Pneumonia Is Associated With Respiratory Failure and Coagulopathy. Circulation. 2020;142(12):1176-89. DOI:10.1161/circulationaha.120.048488.
28. Middleton E, He X, Denorme F, et al. Neutrophil extracellular traps contribute to immunothrombosis in COVID-19 acute respiratory distress syndrome. Blood. 2020;136(10):1169-1179. DOI:10.1182/blood.2020007008.
29. Menezes R, Rizwan T, Saad Ali S, et al. Postmortem findings in COVID-19 fatalities: A systematic review of current evidence. Leg Med. 2022;54:102001. DOI:10.1016/j.legalmed.2021.102001.
30. Copin M, Parmentier E, Duburcq T, et al. Time to consider histologic pattern of lung injury to treat critically ill patients with COVID-19 infection. Intensive Care Med. 2020;46(6):1124-6. DOI:10.1007/s00134-020-06057-8.
31. Radermecker C, Detrembleur N, Guiot J, et al. Neutrophil extracellular traps infiltrate the lung airway, interstitial, and vascular compartments in severe COVID-19. J Exp Med. 2020;217(12):e20201012. DOI:10.1084/jem.20201012.
32. Han H, Yang L, Liu R, et al. Prominent changes in blood coagulation of patients with SARS-CoV-2 infection. Clin Chem Lab Med. 2020;58(7):1116-20. DOI:10.1515/cclm-2020-0188.
33. Borczuk A, Salvatore S, Seshan S, et al. COVID-19 pulmonary pathology: a multi-institutional autopsy cohort from Italy and New York City. Mod Pathol. 2020;33(11):2156-2168. DOI:10.1038/s41379-020-00661-1.
34. Romanova E, Vasilyev V, Startseva G, et al. Cause of death based on systematic post-mortem studies in patients with positive SARS-CoV-2 tissue PCR during the COVID-19 pandemic. J Intern Med. 2021;290(3):655-65. DOI:10.1111/joim.13300.
35. Desborough M, Doyle A, Griffiths A, et al. Image-proven thromboembolism in patients with severe COVID-19 in a tertiary critical care unit in the United Kingdom. Thromb Res. 2020;193:1-4. DOI:10.1016/j.thromres.2020.05.049.
36. Yurdaisik I, Demiroz A, Oz A, et al. Postmortem Biopsies of the Lung, Heart, Liver, and Spleen of COVID-19 Patients. Cureus. 2021;13(12):e20734. DOI:10.7759/cureus.20734.
37. Robertson H. Dead space: the physiology of wasted ventilation. Eur Respir J. 2014:45(6):1704-16. DOI:10.1183/09031936.00137614.
38. Porembskaya O, Toropova Y, Tomson V, et al. Pulmonary Artery Thrombosis: A Diagnosis That Strives for Its Independence. Int J Mol Sci. 2020;21(14):5086. DOI:10.3390/ijms21145086.
39. Millar F, Summers C, Griffiths M, et al. The pulmonary endothelium in acute respiratory distress syndrome: insights and therapeutic opportunities. Thorax. 2016;71(5):462-73. DOI:10.1136/tho-raxjnl-2015-207461.
Об авторах
О. Я. ПорембскаяРоссия
Порембская Ольга Ярославна.
Санкт-Петербург.
eLibrary SPIN 9775-1057
В. Н. Кравчук
Россия
Кравчук Вячеслав Николаевич.
Санкт-Петербург.
eLibrary SPIN 4227-2846
М. И. Гальченко
Россия
Гальченко Максим Иванович.
Санкт-Петербург.
eLibrary SPIN 8858-2916
Р. В. Деев
Россия
Деев Роман Вадимович.
Санкт-Петербург.
eLibrary SPIN 2957-1687
М. Ш. Чесноков
Россия
Чесноков Михаил Шакирович.
Санкт-Петербург.
А. В. Аванесян
Россия
Аванесян Альберт Вадимович.
Санкт-Петербург.
eLibrary SPIN 5704-3320
К. В. Лобастов
Россия
Лобастов Кирилл Викторович.
Москва.
eLibrary SPIN 2313-0691
С. Н. Цаплин
Россия
Цаплин Сергей Николаевич.
Москва.
eLibrary SPIN 8827-1385
Л. А. Лаберко
Россия
Лаберко Леонид Александрович.
Москва.
eLibrary SPIN 8941-5729
В. С. Ермаков
Россия
Ермаков Валерий Сергеевич.
Санкт-Петербург.
eLibrary SPIN 9095-3330
О. В. Пашовкина
Россия
Пашовкина Ольга Викторовна.
Москва.
eLibrary SPIN 3448-9764
И. В. Счастливцев
Россия
Счастливцев Илья Вениаминович.
Москва.
eLibrary SPIN 7329-6994
С. А. Сайганов
Россия
Сайганов Сергей Анатольевич.
Санкт-Петербург.
eLibrary SPIN 2174-6400
Рецензия
Для цитирования:
Порембская О.Я., Кравчук В.Н., Гальченко М.И., Деев Р.В., Чесноков М.Ш., Аванесян А.В., Лобастов К.В., Цаплин С.Н., Лаберко Л.А., Ермаков В.С., Пашовкина О.В., Счастливцев И.В., Сайганов С.А. Тромбоз сосудистого русла легких при COVID-19: клинико-морфологические параллели. Рациональная Фармакотерапия в Кардиологии. 2022;18(4):376-384. https://doi.org/10.20996/1819-6446-2022-08-01
For citation:
Porembskaya O.Ya., Kravchuk V.N., Galchenko M.I., Deev R.V., Chesnokov M.Sh., Avanesyan A.V., Lobastov K.V., Tsaplin S.N., Laberko L.A., Ermakov V.S., Pashovkina O.V., Schastlivtsev I.V., Sayganov S.A. Pulmonary Vascular Thrombosis in COVID-19: Clinical and Morphological Parallels. Rational Pharmacotherapy in Cardiology. 2022;18(4):376-384. https://doi.org/10.20996/1819-6446-2022-08-01

















































