Перейти к:
Безопасность и переносимость имплантированных подкожных систем кардиовертеров-дефибрилляторов
https://doi.org/10.20996/1819-6446-2022-08-05
Аннотация
Цель. Изучить безопасность и переносимость подкожной системы кардиовертера-дефибриллятора (П-КВД) после имплантации.
Материал и методы. В исследование включены 33 пациента [медиана возраста 57 (43;62) лет; 84% мужчин) с имплантированными П-КВД. Критерии включения: возраст >18 лет, показания к первичной или вторичной профилактике внезапной сердечной смерти (ВСС). Критерии исключения: показания к имплантации исключительно трансвенозной системы КВД [пациенты с устойчивой мономорфной желудочковой тахикардией (ЖТ), необходимостью в антибрадикардитической или ресинхронизирующей терапии]; больные с шириной комплекса QRS>130 мсек. Всем пациентам проводилось стандартное предоперационное обследование (рутинные анализы крови, рентгенография органов грудной клетки, трансторакальная эхокардиография (чреспищеводная - по показаниям), заполнение опросников качества жизни. На повторном визите через 6 мес после имплантации проводились обследование, интеррогирование устройства, заполнялся опросник качества жизни. Были задокументированы все эпизоды нанесенной шоковой терапии и возникшие осложнения.
Результаты. Медиана фракции выброса левого желудочка составила 30% (26;34), конечного диастолического объема - 215 (185;260) мл, конечного систолического объема - 144 (125;182) мл, продолжительности QRS - 100 (94;108) мсек. По данным суточного мониторирования электрокардиограммы у 42,4% пациентов регистрировались эпизоды неустойчивой ЖТ. Наиболее частыми показаниями для имплантации П-КВД были дилатационная (33%) и ишемическая кардиомиопатии (42%). Первичная профилактика была показана 97% пациентам. Периоперационные осложнения возникли у 2 (6,1%) пациентов. В течение периода наблюдения у 27 (81,8%) пациентов нанесения разрядов не зафиксировано. Адекватные разряды в течение 6 мес были зафиксированы у 2 (6,1%) пациентов. За 6 мес наблюдения отмечен 1 (3,0%) летальный исход по причине осложнения вирусной пневмонией. Повторных госпитализаций по поводу сердечно-сосудистых заболеваний не зарегистрировано. Имплантация подкожной системы КВД не сопровождалась снижением качества жизни.
Заключение. Использование П-КВД даже у пациентов со структурными заболеваниями миокарда, которым не требуется антибрадикардиальная стимуляция, эффективно в предотвращении ВСС. Количество неадекватных разрядов и число осложнений в клинической практике сопоставимо с данными многоцентровых исследований. Имплантация П-КВД не сопровождалась снижением качества жизни. Тщательный отбор кандидатов к имплантации, наряду с современным программированием устройств, является важным параметром для выбора и успеха применения П-КВД.
Ключевые слова
Для цитирования:
Верещагина А.В., Ускач Т.М., Сапельников О.В., Аманатова В.A., Гришин И.Р., Куликов А.А., Костин В.С., Акчурин Р.С. Безопасность и переносимость имплантированных подкожных систем кардиовертеров-дефибрилляторов. Рациональная Фармакотерапия в Кардиологии. 2022;18(4):427-432. https://doi.org/10.20996/1819-6446-2022-08-05
For citation:
Vereshchagina A.V., Uskach T.M., Sapelnikov O.V., Amanatova V.A., Grishin I.R., Kulikov A.A., Kostin V.S., Akchurin R.S. Safety and Tolerability of Implanted Subcutaneous Cardioverter-Defibrillator Systems. Rational Pharmacotherapy in Cardiology. 2022;18(4):427-432. (In Russ.) https://doi.org/10.20996/1819-6446-2022-08-05
Введение
Имплантация кардиовертера-дефибриллятора (КВД) – это наиболее эффективный метод предотвращения внезапной сердечной смерти (ВСС) у пациентов высокого риска [1-3]. С целью предотвращения наиболее грозных осложнений, связанных с имплантацией трансвенозных устройств, в первую очередь таких, как электрод-ассоциированные септические осложнения, была разработана и принята в рутинную клиническую практику подкожная система (П-КВД) [4-6]. П-КВД состоит из генератора импульсов, расположенного над шестым ребром между средней подмышечной и передней подмышечной линиями, и трехполюсного парастернального электрода с проксимальным и дистальным чувствительными электродами, расположенными рядом с мечевидным отростком и местом сочленения рукоятки грудины с телом грудины соответственно. Эффективность П-КВД в отношении фибрилляции желудочков после первого разряда колеблется от 88% до 90,1% и от 98,2% до 100% после 5 разрядов на основе текущих данных [7][8].
За последние годы ряд исследований показал результативность П-КВД, сопоставимую с трансвенозной системой КВД в профилактике ВСС. Так, в мультицентровом исследовании IDE (Investigational Device Exemption), в котором участвовало 330 пациентов, терапия первым разрядом по поводу фибрилляции желудочков (ФЖ) или устойчивой желудочковой тахикардии (ЖТ) оказалось эффективной в 92,1% случаев, однако в ходе исследования была выявлена проблема нанесения неадекватных шоков (13,1%), в дальнейшем проведено перепрограммирование устройства (включена двойная зона терапии), и как результат – уменьшение количества ненадлежащей терапии [9]. По данным регистра Effortless (n=985) в течение 5 лет у 99,5% пациентов наблюдалась успешная конверсия ЖТ или ФЖ, частота немотивированных шоков составила 8,1% [10]. В исследовании PRAETORIAN (n=849; 5 лет наблюдения) впервые напрямую сравнивали трансвенозные и подкожные КВД [11]. Показано, что П-КВД не уступает трансвенозной по количеству осложнений, связанных с устройством, или неадекватных шоков у пациентов [11]. За время наблюдения зарегистрировано 8,1% неадекватных разрядов у пациентов с П-КВД и 6,8% – у пациентов с трансвенозным КВД [11]. Таким образом, в настоящее время клинические исследования подтверждают безопасность и эффективность П КВД, на основании чего были расширены показания к ее имплантации [12][13].
В ходе имплантации П-КВД показано проведение стандартизированного интраоперационного дефибрилляционного тестирования, чтобы подтвердить способность П-КВД воспринимать и конвертировать ФЖ (восстанавливать исходный ритм).
Тестирование производится на операционном столе в завершении имплантации П-КВД. Индукция ФЖ проводится с помощью импульса переменного тока 200 мА с частотой 50 Гц, подаваемого в течение 4 сек. ЧСС обнаружения снижается до минимального значения 170 уд/мин. Энергия первого разряда программируется на 65 Дж. В случае неэффективности первого шока второй разряд автоматически программируется на максимально возможную энергию 80 Дж с обратной полярностью. Если желудочковая аритмия (ФЖ или ЖТ) не будет распознана устройством, или если разряд дефибриллятора, поданный подкожным устройством, не приведет к конверсии в исходный ритм, то такая терапия будет считаться неэффективной, и потребует внешней дефибрилляции. Неэффективное дефибрилляционное тестированиие требует изменения положения подкожного электрода и/или генератора импульсов.
Клинические руководства Европы, США и России определяют показания для имплантации П-КВД в качестве альтернативы трансвенозному устройству у всех кандидатов для имплантации КВД, при отсутствии необходимости кардиостимуляциии антитахикардитической терапии [12-14]. В частности, молодые пациенты с риском внезапной сердечной смерти могут получить максимальную пользу от имплантации П-КВД, так как в этой когорте пациентов можно ожидать нескольких смен устройств в течение жизни. Однако, несмотря на свои преимущества, П-КВД имеет значимые ограничения. Из-за отсутствия возможности стимуляции система не может быть рекомендована пациентам с симптоматической брадикардией. Кроме того, пациентам, которым требуется сердечная ресинхронизирующая терапия, или которым, как ожидается, будет полезна антитахикардическая стимуляция, не рекомендована имплантация П-КВД [13]. Более того, несмотря на усовершенствование первого поколения П-КВД и добавления функций Smart PASS (высокочастотный фильтр, который уменьшает избыточное восприятие зубца Т и миопотенциальных шумов) и SMART Сharge (интеллектуальная зарядка – автоматически увеличивает требование к постоянству ритма на три интервала каждый раз, когда обнаруживается невылеченный эпизод), позволяющие избежать гиперчувствительности Т-волны и тем самым сократить количество ненадлежащей терапии более чем на 40% в сравнении с первым поколением приборов, до сих пор по данным литературы сохраняется проблема нанесения неадекватных разрядов [15].
К началу 2022 г. в мире имплантировано более 88000 П-КВД [16], в России имплантация данных устройств началась только в 2018 г., что обуславливает минимальное количество печатных работ в отечественной литературе. К концу 2021 г. в России имплантировано около 150 устройств.
Цель исследования – изучить безопасность и переносимость П-КВД после имплантации.
Материал и методы
В наблюдательное исследование включались пациенты с имплантированными П-КВД. Критерии включения: возраст >18 лет, наличие показаний к первичной или вторичной профилактике внезапной сердечной смерти. Критерии исключения: показания к имплантации исключительно транасвенозной системы КВД (пациенты с устойчивой мономорфной желудочковой тахикардией, необходимостью в антибрадикардитической или ресинхронизирующей терапии), ширина комплекса QRS>130 мсек.
Всем пациентам проводилось стандартное предоперационное обследование (рутинные анализы крови, рентген органов грудной клетки, трансторакальная эхокардиография [чреспищеводная (ЧП Эхо-КГ) – по показаниям], заполнение опросников качества жизни [Миннесотский опросник жизни с сердечной недостаточностью (MHFLQ), EQ-5D].
Всем пациентам после включения в исследование проводился предимплантационный скрининг. Все системы подкожного КВД были имплантированы под общей анестезией, среднее время имплантации составило 45±15 мин. Всем пациентам интраоперационно было проведено дефибрилляционное тестирование, чтобы подтвердить способность П-КВД воспринимать и конвертировать фибрилляцию желудочков. Предварительно в рамках предоперационой подготовки всем пациентам с фибрилляцией предсердий (ФП) проводится ЧП ЭхоКГ. Если в ходе у пациента при ЧП Эхо-КГ выявлялся тромбоз камер сердца, то дефибрилляционный тест не проводился.
Повторно пациенты были обследованы через 6 мес после имплантации. На визите проводилось также интеррогирование устройства и заполнялся опросник качества жизни. Были задокументированы все эпизоды нанесенной шоковой терапии и возникшие осложнения.
Статистический анализ данных осуществляли с помощью статистического пакета Statistica 10 (StatSoft Inc., США). Качественные величины представлены как абсолютные значения и проценты. Использовались следующие методы статистического анализа: двусторонний F-критерий Фишера, U-критерий Манна-Уитни. Корреляционный анализ проводился с применением рангового критерия Спирмена. Выборочные параметры, приводимые в таблице, представлены в виде медианы (Me) и межквартильного диапазона (25%; 75%). Уровень различий считался статистически значимым при р<0,05, значения 0,05<p<0,10 интерпретировались как тенденция.
Результаты
В исследование включены 33 пациента (84,8% мужчин; медиана возраста 57 (43; 62) лет; табл. 1). Медиана фракции выброса левого желудочка составила 30 (26; 34) %, конечного диастолического объема – 215 (185; 260) мл, конечного систолического объема – 144 (125; 182) мл, продолжительности QRS – 100 (94; 108) мсек. По данным суточного мониторирования ЭКГ по Холтеру у 14 (42,4%) пациентов регистрировались эпизоды неустойчивой ЖТ.
Наиболее частыми показаниями для имплантации П-КВД были ишемическая (42,4%) и дилатационная (ДКМП; 33,3%) кардиомиопатии. Первичная профилактика была показана большинству пациентов (97,0%).
Все пациенты, за исключением больных с каналопатиями, получали оптимальную медикаментозную терапию по поводу хронической сердечной недостаточности минимум 3 мес (табл. 2), пациенты с каналопатиями (удлиненный интервал QT, идиопатическая ФЖ) принимали лечебную дозу бета-адреноблокаторов. На момент включения в исследование все пациенты были в состоянии компенсации основного заболевания.
Table 1. Baseline demographics characteristic of included patients
Таблица 1. Клинико-демографические показатели пациентов, n.

Table 2. Drug therapy in patients with chronic heart failure (n=30)
Таблица 2. Лекарственная терапия пациентов с ХСН (n=30)
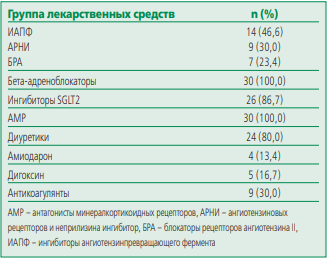
В завершение имплантации П-КВД, пациентам проводился дефибрилляционный тест. У 4 (12,1%) пациентов дефибрилляция не могла быть проведена из-за выявленного тромбоза ушка левого предсердия, по данным ЧП Эхо-КГ. У 27 из 29 пациентов (93,1%) дефибрилляционный тест оказался эффективным с первой попытки, в одном случае потребовалось изменение полярности на обратную для эффективной интраоперационной дефибрилляции. Еще в одном случае время от индукции до нанесения разряда конверсии ФЖ в исходный ритм составило 23 сек при автоматически выбранном векторе, что потребовало изменения вектора восприятия вручную. Сразу же после имплантации в операционной повторно производилась настройка параметров устройства: импеданс подкожного электрода, программировались зоны терапии, при необходимости включался мониторинг ФП. В 21 (63,6%) случаев при автоматической настройке устройством был выбран первичный вектор восприятия. У 9 (27,3%) пациентов оптимальное распознавание подкожного сигнала наблюдалось во вторичном векторе, а у 3 (9,2%) пациентов благоприятным был альтернативный вектор. Всем пациентам проводилось двухзонное программирование. Зона условного разряда была запрограммирована со средней частотой 192 уд/мин (диапазон 180-210 уд/мин), а зона разряда была запрограммирована со средней частотой 222 уд/мин (диапазон 220-240 уд/мин).
Периоперационные осложнения возникли у 2 (6,1%) пациентов. В одном случае на 6-е сут после имплантации П-КВД была выявлена дислокация электрода. При интеррогировании устройства регистрировалась гиперчувствительность миопотенциальных помех, в связи с чем выполнена реимплантация электрода (применена трехинцизионная техника) и проведено успешное интраоперационное дефибрилляционное тестирование. Во втором случае на 5-е сут сформировалась гематома ложа, потребовавшая проведения пункции.
В последующем за 6 мес наблюдения отмечен 1 (3,0%) летальный исход. Причиной смерти стали осложнения вирусной пневмонии. В течение периода наблюдения повторных госпитализаций по поводу сердечно-сосудистых заболеваний не зарегистрировано.
При оценке качества жизни пациентов по Миннесотскому опроснику и EQ-5D отмечено значимое улучшение ее показателей по сравнению с исходным (табл. 3).
Table 3. Changes in the quality of life of patients (n=33)
Таблица 3. Динамика качества жизни пациентов (n=33)

Контрольный визит через 6 мес для оценки эффективности и безопасности П-КВД прошли 32 (96,7%) пациента (табл. 4).
Table 4. Main data obtained for 6 months of follow-up (n=33)
Таблица 4. Основные данные, полученные за 6 мес наблюдения (n=33)
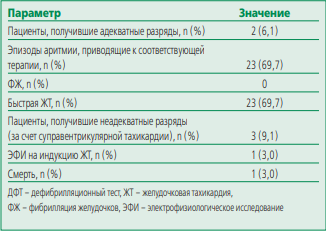
В течение периода наблюдения у 27 пациентов нанесения разрядов не зафиксировано. Адекватные разряды в течение 6 мес были зафиксированы у 2 (6,1%) пациентов, причем, у одного пациента было 13 разрядов по поводу ЖТ. Исходно на протяжении 6-ти мес наблюдения пациента до имплантации желудочковых нарушений ритма не было зарегистрировано. В последующем этому пациенту проведено электрофизиологическое исследование, по результатам которого ЖТ не индуцирована, при контрольном осмотре через 3 мес шоков не зарегистрировано. У второго пациента зарегистрирован 1 эпизод ЖТ с ЧСС 250 уд/мин. У обоих пациентов желудочковая аритмия купировалась первым разрядом. В 3 случаях у пациентов с постоянной формой ФП и запрограммированными шоковыми зонами 200-220 уд/мин зарегистрированы неадекватные шоки (всего 5 разрядов), обусловленные учащением ЧСС до 200 уд/мин (попадали в зону условного разряда). Всем пациентам была произведена коррекция параметров работы устройства – увеличена зона условного разряда до 220 уд/мин, зона разряда – до 240 уд/мин и усилена ритмурежающая терапия.
Также при анализе данных интеррогирования программатора зарегистрировано 10 эпизодов, при которых разряд не был произведен у 6 пациентов. То есть, терапия была прервана согласно алгоритму, когда средняя продолжительность интервала 4 R-R (в мсек) превышает наименьшую зону запрограммированной частоты плюс 40 мсек для 24 интервалов, или подозрительное событие имеет паттерн ЭКГ, не совпадающий с эталонным, и расценивается устройством как мышечный артефакт, другой внешний сигнал или наджелудочковая тахикардия. Что касается прерванных терапий у наших пациентов, то девять эпизодов у пяти пациентов расценены прибором как короткие ЖТ, однако при детальном разборе паттернов ЭКГ зарегистрированные эпизоды являлись тахисистолической формой ФП. Отдельно был проанализирован эпизод мономорфной ЖТ длительностью 4 сек (18 комплексов) который соответствовал алгоритму нанесения разряда, но шок был прерван из-за спонтанного прекращения ЖТ.
Обсуждение
Среди наблюдавшихся пациентов преобладали пациенты с ИБС, второй по численности была группа пациентов с ДКМП. Это несколько необычно, так как классическим показанием к имплантации П-КВД являются пациенты с ГКМП и каналопатиями, потому что пациенты с ИБС, как правило, имеют в анамнезе мономорфные ЖТ, устранимые антитахикардитической стимуляцией, а у пациентов с ДКМП часто имеется значительное расширение QRS и может потребоваться ресинхронизинирующая терапия.
В нашей когорте пациентов было 23 адекватных разряда (по поводу ЖТ) у 6% всех пациентов в течение 6 мес, что свидетельствует о высоком риске ВСС у отобранных пациентов. В исследованиях частота нанесения шоков у П-КВД по показаниям несколько ниже. Так, в регистре EFFORTLESS 5,8% пациентов в первый год и 13,5% в первые пять лет получили адекватную терапию [10]. В исследовании Untouched 5,3% пациентов за 18 мес также получили мотивированные разряды [17]. Неадекватные разряды за 6 мес наблюдения составили 9%, что немного превышает результаты регистра EFFORTLESS (8,3%) [19][20] и исследования MADIT-RIT (4,8%) [18], но сопоставимо с исследованием PRAETORIAN (9,6%) [11]. Все эпизоды аритмий у наших пациентов были прерваны первым шоком, что соответствует литературным данным, которые продемонстрировали высокий коэффициент конверсии (>90%) спонтанно возникающих эпизодов тахикардии [19-21]. Эпизоды мономорфной ЖТ с частотой 200- 250 уд/мин, хотя и не приведшие к потере сознания, были купированы разрядом, и могут считаться адекватной терапией. Пароксизмов ФЖ за 6 мес наблюдения зарегистрировано не было. Все несоответствующие разряды наших пациентов были обусловлены тахиформой ФП, в связи с чем скорректированы шоковые зоны и усилена ритмурежающая терапия. Мы также обратили внимание на то, что неадекватные разряды случились у пациентов с постоянной формой ФП. Такие пациенты требуют более тщательной настройки параметров работы устройства и контроля за ЧСС (в первую очередь, титрация доз бета-адреноблокаторов).
Интересно, что в исследованиях частой причиной неадекватной терапии в основном являлась чрезмерная чувствительность зубца Т [10][15]. Вероятно, отсутствие неадекватных разрядов за счет чрезмерной чувствительности зубца Т в нашем наблюдении обусловлено тем, что всем пациентам изначально проводилось двухзонное программирование, что также описывается в литературе [22]. Общая частота осложнений была довольно низкой, никому из пациентов за 6 мес не потребовалась повторная госпитализация, связанная с имплантацией подкожной системы или обусловленная осложнениями имплантации. Был госпитализирован 1 пациент для проведения электрофизиологического исследования. Помимо технических аспектов системы в исследовании нашего учреждения пациенты с ПКВД описывали равное или даже лучшее качество жизни после имплантации устройства.
Ограничения исследования. Исследование имеет несколько ограничений. Во-первых, подкожные устройства впервые имплантировались в нашем центре, и соответственно хирурги имели меньше опыта работы с П-КВД, чем с трансвенозными КВД, что могло повлиять на клинические результаты. Во-вторых, когорта больных была недостаточно большой, а срок наблюдения (6 мес) слишком ограниченный, чтобы предоставить данные о долгосрочных осложнениях.
Заключение
Использование П-КВД даже у пациентов со структурными заболеваниями миокарда, которым не требуется антибрадикардиальная стимуляция, эффективны в предотвращении ВСС. Количество неадекватных разрядов и число осложнений в клинической практике сопоставимо с данными многоцентровых исследований. Имплантация П-КВД не сопровождалась снижением качества жизни. Тщательный отбор кандидатов к имплантации, наряду с современным программированием устройств, является важным параметром для выбора и успеха использования П-КВД.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование: Исследование проведено при поддержке Национального медицинского исследовательского центра кардиологии.
Funding: The study was performed with the support of the National Medical Research Centre of Cardiology named after academician E.I. Chazov.
Список литературы
1. Moss AJ, Hall WJ, Cannom DS, et. al. Improved Survival with an Implanted Defibrillator in Patients with Coronary Disease at High Risk for Ventricular Arrhythmia. New Engl J Med. 1996;335(26):1933-40. DOI:10.1056/nejm199612263352601.
2. Moss AJ, Zareba W, Hall WJ, et. al. Prophylactic Implantation of a Defibrillator in Patients with Myocardial Infarction and Reduced Ejection Fraction. New Engl J Med. 2002;346(12):877-83. DOI:10.1056/nejmoa013474.
3. Kong MH, Fonarow G C, Peterson ED, et. al. Systematic review of the incidence of sudden cardiac death in the United States. J Am Coll Cardiol. 2011;57(7):794-801. DOI:10.1016/j.jacc.2010.09.064.
4. Kaya E, Rassaf T, Wakili R. Subcutaneous ICD: Current standards and future perspective. Int J Cardiol Heart Vasc. 2019;24:100409. DOI:10.1016/j.ijcha.2019.100409.
5. Honarbakhsh S, Providencia R, Srinivasan N, et al. A propensity matched case-control study comparing efficacy, safety and costs of the subcutaneous vs. transvenous implantable cardioverter defibrillator. Int J Cardiol. 2017;228:280-5. DOI:10.1016/j.ijcard.2016.11.017.
6. Olde Nordkamp LO, Knops R, Bardy G, et. al. Rationale and design of the PRAETORIAN trial: a Prospective, Randomized comparison of subcutaneous and transvenous implantable cardioverterdefibrillator therapy. American heart journal. 2012;163(5):753-760. Doi:10.1016/j.ahj.2012.02.012.
7. Gold S MR, Aasbo JD, El-Chami MF, et al. Subcutaneous implantable cardioverter-defibrillator PostApproval Study: clinical characteristics and perioperative results. Heart Rhythm. 2017;10(14):1456-63. DOI:10.1016/j.hrthm.2017.05.016.
8. Kamp Nicholas J, Al-Khatib Sana M. The subcutaneous implantable cardioverter-defibrillator in review. Am Heart J. 2019;217:131-9. DOI:10.1016/j.ahj.2019.08.010.
9. Weiss R, Knight BP, Gold MR, et. al. Safety and efficacy of a totally subcutaneous implantablecardioverter defibrillator. Circulation. 2013;128(9):944-53. DOI:10.1161/CIRCULATIONAHA.113.003042.
10. Boersma L, Barr C, Knops R, et. al. Implant and Midterm Outcomes of the Subcutaneous Implantable Cardioverter-Defibrillator Registry: The EFFORTLESS Study. J Am Coll Cardiol. 2017;70(7):842-4. DOI:10.1016/j.jacc.2017.06.040.
11. Knops RE, Olde Nordkamp LRA, Delnoy PPHM, et. al. Subcutaneous or Transvenous Defibrillator Therapy Collaborators. New Engl J Med. 2020;383:526-36. DOI:10.1056/NEJMoa1915932.
12. Al-Khatib SM, Stevenson WG, Ackerman MJ, et al. 2017 AHA/ACC/HRS guideline for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. Journal of the American College of Cardiology. 2018;72(2):91-220. DOI:10.1016/j.hrthm.2017.10.035.
13. Priori SG, Blomstrom-LundqvistC, Mazzanti A, et. al. 2015 ESC guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Eur Heart J. 2015;36(41):2793-867. DOI:10.1093/eurheartj/ehv316.
14. Лебедев Д.С., Михайлов Е.Н., Неминущий Н.М., и др. Желудочковые нарушения ритма. Желудочковые тахикардии и внезапная сердечная смерть. Клинические рекомендации 2020. Российский Кардиологический Журнал. 2021;26(7):4600. DOI:10.15829/1560-4071-2021-4600.
15. Larbig R, Bettin M, Motloch LJ, et al. Management of inappropriate shocks/T-wave-oversensing in S-ICD®-patients. Herzschr Elektrophys. 2018;29(1):122-6. DOI:10.1007/s00399-018-0555-1.
16. Rhythm Management Product Performance Report Q3 Edition 2021 [cited 2022 Jan 10]. Available from: https://www.bostonscientific.com/content/dam/bostonscientific/quality/ppr/2021/q3/Q3%202021%20CRM%20Product%20Performance%20Report%20Rev%20B.pdf.
17. Gold MR, Lambiase PD, El-Chami MF, et. al. Primary Results From the Understanding Outcomes With the S-ICD in Primary Prevention Patients With Low Ejection Fraction (UNTOUCHED) Trial. Circulation. 2021;143(1):7-17. DOI:10.1161/CIRCULATIONAHA.120.048728.
18. Moss AJ, Schuger C, Beck CA, et al., for the MADIT-RIT Trial, Investigators Reduction in Inappropriate Therapy and Mortality through ICD Programming. New England Journal of Medicine. 2012;367(24):2275-83. DOI:10.1056/NEJMoa1211107.
19. Lambiase P.D., Barr C., Theuns D.A., et. al. Worldwide experience with a totally subcutaneous implantable defibrillator: early results from the EFFORTLESS S-ICD Registry. Eur Heart J. 2014;35(25):1657-65. DOI:10.1093/eurheartj/ehu112.
20. Burke MC, Gold MR, Knight BP, et. al. Safety and efficacy of the totally subcutaneous implantable defibrillator: 2-year results from a pooled analysis of the IDE Study and EFFORTLESS Registry. Journal of the American College of Cardiology. 2015;65(16):1605-15. DOI:10.1016/j.jacc.2015.02.047.
21. Boersma L, Burke MC, Neuzil P, et. al. Infection and mortality after implantation of a subcutaneous ICD after transvenous ICD extraction. Heart Rhythm. 2016;13(1):157-64. DOI:10.1016/j.hrthm.2015.08.039.
22. Knops RE, Brouwer TF, Barr CS et al. The learning curve associated with the introduction of the subcutaneous implantable defibrillator. Europace. 2016;18(7):1010-5. DOI:10.1093/europace/euv299.
Об авторах
А. В. ВерещагинаРоссия
Верещагина Анна Владимировна.
Москва.
Т. М. Ускач
Россия
Ускач Татьяна Марковна.
Москва.
О. В. Сапельников
Россия
Сапельников Олег Валерьевич.
Москва.
В. A. Аманатова
Россия
Аманатова Валерия Александровна.
Москва.
И. Р. Гришин
Россия
Гришин Игорь Романович.
Москва.
А. А. Куликов
Россия
Куликов Алексей Алексеевич.
Москва.
В. С. Костин
Россия
Костин Владислав Сергеевич.
Москва.
Р. С. Акчурин
Россия
Акчурин Ренат Сулейманович.
Москва.
Рецензия
Для цитирования:
Верещагина А.В., Ускач Т.М., Сапельников О.В., Аманатова В.A., Гришин И.Р., Куликов А.А., Костин В.С., Акчурин Р.С. Безопасность и переносимость имплантированных подкожных систем кардиовертеров-дефибрилляторов. Рациональная Фармакотерапия в Кардиологии. 2022;18(4):427-432. https://doi.org/10.20996/1819-6446-2022-08-05
For citation:
Vereshchagina A.V., Uskach T.M., Sapelnikov O.V., Amanatova V.A., Grishin I.R., Kulikov A.A., Kostin V.S., Akchurin R.S. Safety and Tolerability of Implanted Subcutaneous Cardioverter-Defibrillator Systems. Rational Pharmacotherapy in Cardiology. 2022;18(4):427-432. (In Russ.) https://doi.org/10.20996/1819-6446-2022-08-05

















































