Перейти к:
Профилактика кардиоэмболических осложнений у пациентов с фибрилляцией предсердий: сопоставление эффективности и безопасности эндоваскулярной изоляции ушка левого предсердия и оральных антикоагулянтов
https://doi.org/10.20996/1819-6446-2022-08-09
Аннотация
Цель. Изучить частоту и структуру прогноз-определяющих исходов у пациентов с фибрилляцией предсердий (ФП) в зависимости от метода профилактики кардиоэмболических событий: эндоваскулярной изоляции ушка левого предсердия (УЛП), применении прямых оральных антикоагулянтов (ПОАК) или варфарина.
Материал и методы. В проспективное наблюдательное исследование включали пациентов с ФП и высоким риском кардиоэмболических осложнений, не имеющих противопоказаний к приему антикоагулянтов. Пациентам, которые отказались от длительного приема оральных антикоагулянтов, выполнялась эндоваскулярная изоляция УЛП, остальные пациенты получали ПОАК или варфарин. Период наблюдения составил 3 года. Оценивалась кумулятивная частота комбинированной конечной точки (смерти, кардиоэмболических осложнений и крупных кровотечений по критериям регистра GARFIELD.
Результаты. Было включено 245 пациентов с ФП, из них в группу окклюдера УЛП - 46 пациентов, группу варфарина - 100, группу ПОАК -99. В многофакторном регрессионном анализе было продемонстрировано статистически значимое преимущество окклюдера УЛП в отношении частоты достижения комбинированной конечной точки как перед варфарином (относительный риск [ОР] 3,10, 95% доверительный интервал [ДИ] 1,01-9,54; p=0,049), так и перед ПОАК (ОР 3,44, 95% ДИ 1,15-10,29; p=0,027). Аналогичный результат был получен в отношении смерти от всех причин (ОР 5,24, 95% ДИ 1,12-24,55; p=0,036 и ОР 5,58, 95% ДИ 1,22-25,49; p=0,027, соответственно). Статистически значимых различий по частоте кровотечений между группами не было.
Заключение. В данном наблюдательном исследовании продемонстрировано преимущество имплантации окклюдера УЛП перед ПОАК и варфарином по кумулятивной частоте прогноз-определяющих событий для пациентов с ФП и высоким риском кардиоэмболических осложнений в качестве первой линии терапии. Для подтверждения этих наблюдений требуются рандомизированные исследования.
Ключевые слова
Для цитирования:
Певзнер Д.В., Кострица Н.С., Алиева А.К., Меркулова И.A., Явелов И.С., Меркулов Е.В., Чазова И.Е. Профилактика кардиоэмболических осложнений у пациентов с фибрилляцией предсердий: сопоставление эффективности и безопасности эндоваскулярной изоляции ушка левого предсердия и оральных антикоагулянтов. Рациональная Фармакотерапия в Кардиологии. 2022;18(4):439-448. https://doi.org/10.20996/1819-6446-2022-08-09
For citation:
Pevzner D.V., Kostritca N.S., Alieva A.K., Merkulova I.A., Yavelov I.S., Merkulov E.V., Chazova I.E. Prevention of Cardioembolic Complications in Patients with Atrial Fibrillation: Efficacy and Safety of Left Atrial Appendage Isolation and Oral Anticoagulants. Rational Pharmacotherapy in Cardiology. 2022;18(4):439-448. (In Russ.) https://doi.org/10.20996/1819-6446-2022-08-09
Введение
Фибрилляция предсердий (ФП) занимает доминирующую позицию в структуре нарушений ритма сердца [1]. В 30% случаев причиной ишемического инсульта (ИИ) является ФП, при наличии которой риск развития ИИ увеличивается в 5 раз [2]. ИИ у пациентов с ФП характеризуется тяжелым поражением по шкале тяжести инсульта (National Institutes of Health Stroke Scale, NIHSS) и высокой летальностью [3]. Источником кардиоэмболических осложнений при ФП в 91% случаев является ушко левого предсердия (УЛП) [4]. Именно поэтому профилактика тромбообразования в УЛП является одной из важнейших составляющих лечения пациентов с ФП.
В настоящее время существует медикаментозная и хирургическая профилактика инсульта у пациентов с ФП. Основу медикаментозной профилактики составляют прямые оральные антикоагулянты (ПОАК), а также антагонисты витамина К (варфарин). Согласно актуальным клиническим рекомендациям Европейского общества кардиологов и Американской кардиологической ассоциации первой линией в профилактике кардиоэмболических осложнений являются ПОАК (класс рекомендаций I, уровень доказательности А) [5][6]. Однако в группах пациентов с противопоказаниями к их приему при высоком геморрагическом риске и низкой приверженности терапии возможности использования антикоагулянтов ограничены. Это стимулировало разработку инвазивных методик, позволяющих механически изолировать УЛП.
Одной из малоинвазивных процедур является транскатетерное закрытие УЛП при помощи устройства – окклюдера. В настоящее время для практического использования в Российской Федерации доступны устройства Watchman, Watchman FLX и Amplatzer Amulet. Эти устройства были изучены в рандомизированных контролируемых исследованиях (РКИ) PROTECT-AF и PREVAIL, в которых устройство Watchman сопоставлялось с варфарином, и PRAGUE-17, в котором устройства Amulet, Watchman и Watchman FLX сравнивались с ПОАК. Данные исследования продемонстрировали, что по эффективности имплантация окклюдера УЛП не уступает антикоагулянтной терапии. Показатели безопасности процедуры имплантации окклюдера различаются в данных исследованиях и улучшаются по мере накопления опыта [7-9].
В настоящее время эндоваскулярная изоляция УЛП рекомендована в случае наличия противопоказаний к приему антикоагулянтов [5][6]. По данным экспертного консенсуса по эндоваскулярной изоляции УЛП, данная методика может быть применена также у пациентов, отказавшихся от длительного приема антикоагулянтной терапии [10]. Тем не менее, вопрос о целесообразности имплантации окклюдера в качестве средства первой линии при профилактике кардиоэмболических осложнений у больных с ФП применение этих устройств, как альтернативы антикоагулянтной терапии, остается предметом дискуссии и требует проведения дополнительных исследований с учетом накопленного опыта и совершенствования технологии процедуры.
Цель исследования – изучить частоту и структуру прогноз-определяющих событий в зависимости от выбранного метода профилактики кардиоэмболических осложнений (применение ПОАК, варфарина или эндоваскулярная изоляция УЛП) в рамках трехлетнего проспективного наблюдения пациентов с ФП и высоким риском кардиоэмболических осложнений, не имеющих противопоказаний к приему антикоагулянтов.
Материал и методы
Данная работа представляет собой одноцентровое проспективное наблюдательное исследование, в которое были включены пациенты, госпитализированные или находящиеся на амбулаторном наблюдении с диагнозом ФП в ФГБУ «НМИЦ кардиологии им. академика Е.И. Чазова» Минздрава России в период с 2011 по 2018 гг.
Критерии включения: эпизод ФП длительностью ≥30 сек, зарегистрированный на электрокардиограмме в течение предшествующего года; сумма баллов по шкале CHA2DS2-VASc ≥3 для женщин и ≥2 для мужчин; возраст старше 40 лет; согласие на участие в исследовании; отсутствие противопоказаний к длительному приему антикоагулянтов. Критерии невключения: механические протезы клапанов сердца, митральный стеноз выраженной или умеренной степени, тромбоз УЛП на момент включения, проксимальный тромбоз глубоких вен правой нижней конечности для группы окклюдера.
Все включенные в исследование пациенты (n=245) были разделены на 3 группы в зависимости от метода профилактики кардиоэмболических событий: эндоваскулярная гемодинамическая изоляция УЛП (группа окклюдера УЛП; n=46), медикаментозная профилактика с использованием ПОАК (группа ПОАК; n=99), медикаментозная профилактика с использованием варфарина (группа варфарина; n=100). В группу эндоваскулярной изоляции УЛП включались пациенты, которые не имели противопоказаний к антикоагулянтной терапии, но отказались от постоянного приема этих препаратов. Выбор орального антикоагулянта (ПОАК или варфарин) осуществлялся на усмотрение лечащего врача с учетом мнения пациента.
В случае проведения эндоваскулярной изоляции УЛП использовались окклюзирующие устройства Watchman (Boston Scientific, США) или Amplatzer Amulet (St Jude Medical, США). Выбор устройства осуществлялся на усмотрение оператора в зависимости от анатомических особенностей УЛП и доступности устройства. Подбор размера проводился в соответствии со стандартными рекомендациями производителя. Режим антитромботической терапии в послеоперационном периоде для данной группы пациентов соответствовал рекомендованному протоколу для выбранного устройства с возможностью модификации с учетом кардиоэмболических и геморрагических рисков.
Период наблюдения составил 3 года. Неблагоприятные события регистрировались в период госпитализации, а также на контрольных визитах через 45 дней, 6 мес, 1, 2 и 3 года от момента включения в исследование. В группе окклюдеров УЛП на контрольных визитах проводилась чреспищеводная эхокардиография для оценки пара- и трансокклюдерного потока, девайс-ассоциированного тромбоза, а также других осложнений вмешательства.
В качестве первичной комбинированной конечной точки оценивалась кумулятивная частота развития основных прогноз-определяющих неблагоприятных событий: кардиоэмболические осложнения [ИИ/транзиторная ишемическая атака (ТИА)/системная (артериальная) тромбоэмболия не в сосуды центральной нервной системы (СЭ)], смертность от всех причин и крупные кровотечения по критериям регистра GARFIELD.
В качестве вторичных конечных точек оценивались:
- Комбинированная конечная точка эффективности: кумулятивная частота развития кардиоэмболических событий (ИИ/ТИА/СЭ) и смерти от всех причин;
- Кардиоэмболические события (ИИ/ТИА/СЭ);
- Смертность от всех причин;
- Сердечно-сосудистая смертность;
- Все кровотечения;
- Крупные кровотечения по критериям регистра GARFIELD;
- Геморрагический инсульт;
- Фатальные кровотечения.
К крупным кровотечениям согласно критериям регистра GARFIELD относили фатальные кровотечения, кровотечения клинически значимой локализации, а также характеризующиеся снижением уровня гемоглобина на ≥2 г/дл или потребностью в трансфузии ≥2 доз эритроцитарной массы [11].
Статистический анализ проводился стандартными методами с применением статистической программы SPSS Statistics 26 (IBM, США). Проверка на нормальность распределения количественных показателей проводилась методом Колмогорова-Смирнова с поправкой Лиллиефорса при n>50 или методом Шапиро-Уилка при n<50. Сравнение непараметрических количественных переменных в трех группах проводилось согласно критерию Краскела-Уоллиса. Сравнение дискретных переменных в трех группах проводилось в многопольных таблицах с применением точного критерия Фишера или теста χ2 Пирсона с поправкой на непрерывность. При оценке статистической значимости различий между группами использовалась поправка Бонферрони для множественных сравнений.
Связь метода профилактики кардиоэмболических событий с клиническими исходами оценивалась с помощью критерия log-rank Мантеля-Кокса (попарные сравнения всех трех групп), а также в модели пропорционального риска Кокса с расчетом относительного риска (ОР), скорректированного при многофакторном анализе по клинико-анамнестическим характеристикам, статистически значимо различавшимися между группами. Для выявления дополнительных независимых предикторов неблагоприятных исходов был также выполнен однофакторный анализ с вовлечением всех клинико-анамнестических факторов. Факторы, значимость ассоциации которых с исходом составила p≤0,2, были протестированы в многофакторной регрессионной модели, выполненной методом исключения Вальда.
Статистически значимыми считали различия при значениях р<0,05.
Результаты
Исходные клинико-анамнестические характеристики пациентов в группах представлены в табл. 1. В группе ПОАК 50 (50,5%) пациентов принимали ривароксабан, 30 (30,3%) – дабигатран, 19 (19,2%) – апиксабан.
Table 1. Clinical and anamnestic data of patients included in the study
Таблица 1. Клинико-анамнестические данные включенных в исследование пациентов
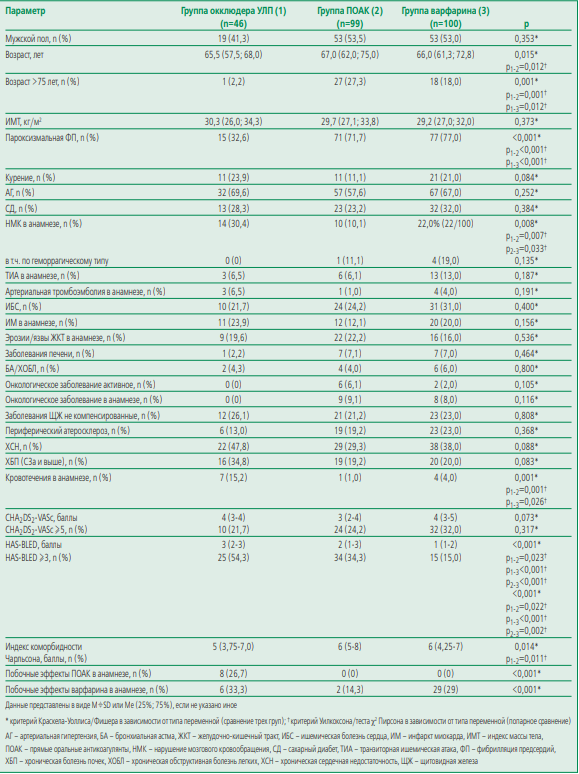
Все пациенты не имели противопоказаний к приему оральных антикоагулянтов, а также не имели между собой статистически значимых различий по полу, индексу массы тела, сопутствующим заболеваниям, сумме баллов по шкале CHA2DS2-VASc. В группе окклюдера было меньше пациентов >75 лет, пациентов с пароксизмальной формой ФП. Также в группе окклюдера пациенты чаще переносили инсульт, причем, по частоте геморрагического инсульта в анамнезе группы статистически значимо не различались. Частота кровотечений в анамнезе была выше в группе окклюдера УЛП. Также данная группа характеризовалась большим количеством пациентов, имеющих ≥3 баллов по шкале HAS-BLED, большей частотой побочных эффектов ПОАК и варфарина в анамнезе, с чем частично и был связан отказ пациентов от приема антикоагулянтов.
Характеристики операции представлены в табл. 2. В 91,3% случаев было имплантировано устройство Watchman, в 8,7% – Amplatzer Amulet. Технический успех составил 97,8%, процедурный – 95,7%. У 6 пациентов непосредственно после операции отмечался параокклюдерный поток крови >5 мм, однако при контроле чреспищеводной эхокардиографии на 45-е сут после процедуры ни у одного пациента значимого параокклюдерного потока крови не отмечалось.
Table 2. Left atrial appendage isolation procedure characteristics and in-hospital complications
Таблица 2. Общая характеристика процедуры эндоваскулярной изоляции УЛП в исследовании и внутригоспитальные осложнения (n=46)
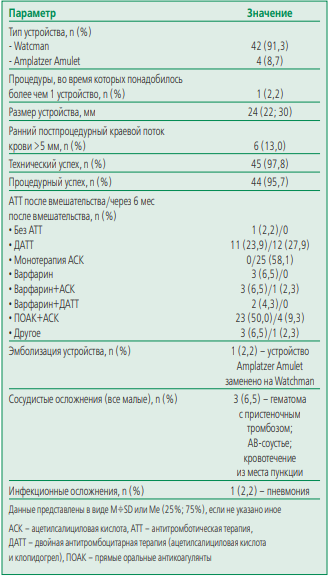
Большинство пациентов после вмешательства получали антитромботическую терапию, более 50% пациентов получали, в том числе, антикоагулянты (ПОАК или варфарин). В дальнейшем большинство пациентов группы окклюдера получали только антиагрегантную терапию, при этом более 50% пациентов – монотерапию ацетилсалициловой кислотой.
Суммарно было зарегистрировано 5 внутригоспитальных осложнений эндоваскулярной изоляции УЛП, летальных исходов не было. Также ни один из случаев тромбоза поверхности устройства не привел к развитию кардиоэмболических осложнений и не потребовал дополнительных вмешательств.
Кумулятивная частота достижения первичной конечной точки была значимо меньше в группе окклюдера по сравнению с группой варфарина (4,9 против 12,4 на 100 пациенто-лет; р=0,048 по критерию log-rank) (табл. 3, рис. 1). Схожая тенденция отмечалась также в группе окклюдера по сравнению с группой ПОАК (4,9 против 7,8 на 100 пациенто-лет; p = 0,061 по критерию log-rank). Учитывая, что исходные группы пациентов значимо отличались по некоторым из исходных клинико-анамнестических факторов, при многофакторном анализе в модели пропорционального риска Кокса был рассчитано стандартизированное ОР с учетом отличий по возрасту, пароксизмальной ФП в анамнезе, острого нарушения мозгового кровообращения в анамнезе, кровотечения в анамнезе, сумме баллов по шкале HAS-BLED, индексу коморбидности Charlson. При этом получено статистически значимое преимущество окклюдера по сравнению с терапией как варфарином [стандартизированное ОР 3,10, 95% доверительный интервал (ДИ) 1,01-9,54; p=0,049], так и ПОАК (стандартизированное ОР 3,44, 95% ДИ 1,15-10,29; p=0,027) в отношении первичной конечной точки.
Table 3. Endpoints frequency during follow-up depending on the cardioembolic events prevention method
Таблица 3. Частота конечных точек за время наблюдения в зависимости от метода профилактики кардиоэмболических событий
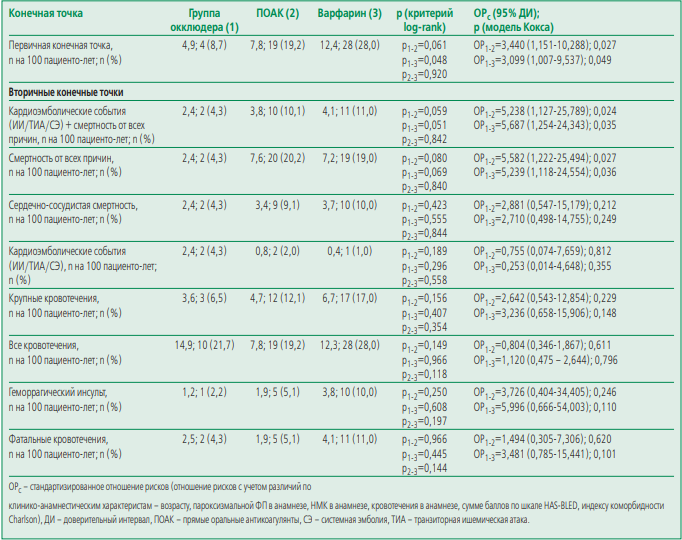
Кумулятивная частота достижения первичной конечной точки не отличалась между группами ПОАК и варфарина как по данным критерия log-rank, так и регрессионном анализе в модели Кокса.
В отношении кумулятивной частоты достижения вторичных конечных точек не было получено статистически значимых различий между группами при применении критерия log-rank. Тем не менее, в группе окклюдера по сравнению с группами варфарина и ПОАК отмечалась тенденция к более низкой частоте достижения комбинированной конечной точки смертности от всех причин и кардиоэмболических событий, а также таких вторичных конечных точек, как смертность от всех причин, сердечно-сосудистая смертность, большие кровотечения, геморрагический инсульт. При стандартизации методом регрессии Кокса было получено статистически значимое преимущество окклюдера в отношении комбинированной конечной точки эффективности (смертность от всех причин и кардиоэмболические события) перед ПОАК (ОР 5,24, 95% ДИ 1,13-25,79; p=0,024) и варфарином (ОР 5,69, 95% ДИ 1,25-24,34; p=0,035), а также смертности от всех причин (ОР 5,58, 95% ДИ 1,22-25,49; p=0,027 и ОР 5,24, 95% ДИ 1,12-24,55; p=0,036 соответственно). В отношении кардиоэмболических осложнений статистически значимых различий между группами получено не было.
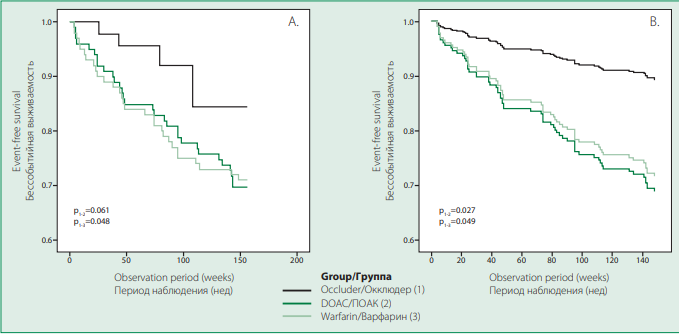
Picture 1. Kaplan-Meier curves: primary endpoint frequency in occluder, DOACs and warfarin groups (A. non-adjusted; B. adjusted for clinical and anamnestic factors)
Рисунок 1. Кривые Каплана-Мейера: частота достижения первичной конечной точки в группах окклюдера, НОАК, варфарина (A. – без коррекции; B. – с коррекцией на клинико-анамнестические факторы)
В группе ПОАК по сравнению с группой варфарина также отмечалась тенденция к меньшей кумулятивной частоте всех кровотечений, при этом по другим конечным точкам каких-либо тенденций к различиям между группами ПОАК и варфарина выявлено не было.
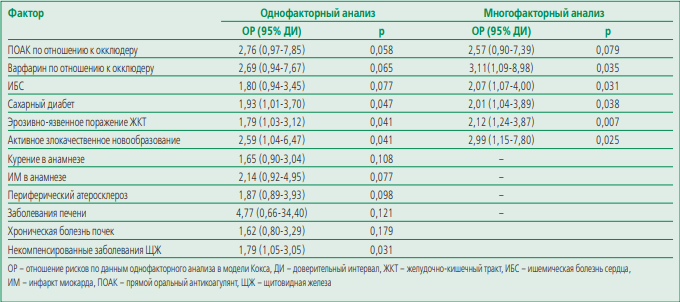
С целью выявления клинико-анамнестических факторов, ассоциированных с повышением частоты достижения первичной конечной точки, нами был проведен дополнительный анализ. С помощью однофакторного анализа методом регрессии Кокса были выявлены факторы, для которых значимость ассоциации с исходом составила p≤0,2 (курение в анамнезе, ишемическая болезнь сердца, инфаркт миокарда в анамнезе, периферический атеросклероз, заболевания печени, хроническая болезнь почек, эрозивно-язвенное поражение желудочно-кишечного тракта, активное злокачественное новообразование, сахарный диабет, некомпенсированные заболевания щитовидной железы). Данные факторы были протестированы в моделях пропорциональных рисков путем регрессии Кокса методом исключения Вальда. Была получена многофакторная модель (табл. 4), включившая в себя отобранные клинико-анамнестические факторы (ишемическая болезнь сердца, сахарный диабет, эрозивно-язвенное поражение желудочно-кишечного тракта, активное злокачественное новообразование) и метод профилактики кардиоэмболических осложнений. Данная модель была статистически значимой (p<0,001), а применение варфарина по сравнению с окклюдером УЛП согласно данной модели являлось статистически значимым и независимым предиктором достижения первичной конечной точки.
Table 4. Adverse outcomes of primary endpoint (cardioembolic events, all-cause mortality, major bleeding) predictors over 3 years follow-up.
Таблица 4. Предикторы совокупности неблагоприятных исходов, входящих в состав первичной конечной точки (кардиоэмболические события, смертность от всех причин, большие кровотечения) за 3 года наблюдения.
Обсуждение
Основная гипотеза нашего исследования была следующая: пациентам с ФП, высокими рисками кардиоэмболических осложнений и отсутствием противопоказаний к антикоагулянтной терапии возможно применение эндоваскулярной изоляции УЛП в качестве первой линии профилактики кардиоэмболических событий при отказе от длительного приема антикоагулянтов.
В настоящий момент эндоваскулярная изоляция УЛП по данным клинических рекомендаций не является первой линией профилактики кардиоэмболических событий у пациентов с ФП без противопоказаний к антикоагулянтной терапии. Основные причины включают потенциально меньшую эффективность окклюдера ввиду возможности образования тромбов на его поверхности, а также возможные осложнения процедуры установки окклюдера.
Как уже было упомянуто, на сегодняшний день опубликованы три крупных РКИ, сравнивающих эффективность и безопасность эндоваскулярного закрытия УЛП и антикоагулянтной терапии: PROTECT-AF, PREVAIL и PRAGUE-17 [7-9][12].
В исследование PROTECT-AF было включено 707 пациентов с ФП и ≥1 баллом по шкале CHADS2, рандомизированных в 2 группы: терапия варфарином и имплантация устройства Watchman. Имплантация окклюдера в данном исследовании характеризовалась относительно низким показателем успешной имплантации (91%) и более высокой частотой нежелательных событий по сравнению с группой варфарина, что было обусловлено преимущественно периоперационными осложнениями [7][12]. Частота достижения первичной конечной точки (кардиоэмболические осложнения+ сердечно-сосудистая смертность) в данном исследовании между группами окклюдера и варфарина значимо не отличалась с некоторой тенденцией к преимуществу окклюдера (2,3 и 3,8 на 100 пациенто-лет в группах окклюдера и варфарина соответственно). При этом в отношении смертности от всех причин и сердечно-сосудистой смертности преимущество окклюдера было статистически значимым. Данное исследование было также подвергнуто обширной критике в связи с включением пациентов относительно низкого ишемического риска (1 балл по шкале CHADS2).
Исследование PREVAIL было проведено, чтобы учесть этот фактор. В него было включено 407 пациентов с ≥2 баллов по шкале CHADS2, которые также были рандомизированы в группы варфарина и имплантации окклюдера Watchman. Частота успешной имплантации устройства была выше по сравнению с PROTECT-AF, и составила 95,1%. Частота серьезных нежелательных событий в первые 7 дней после имплантации устройства составила 4,2%. В данном исследовании имплантация окклюдера была не менее эффективна по сравнению с варфарином в отношении профилактики кардиоэмболических событий. Однако частота ИИ в группе варфарина в этом исследовании была ниже, чем по данным других источников, что оставляло за собой вопросы [8].
Следует отметить, что исследования PROTECT-AF и PREVAIL не включали новые оральные антикоагулянты и более современные по сравнению с Watchman модели окклюдеров, в связи с чем их нельзя считать в
полной степени актуальными в настоящий момент. Кроме того, из-за применения в этих исследованиях шкалы CHADS2, а не CHA2DS2-VASc не представляется возможным корректно сопоставить ишемические риски в данных РКИ и в нашем исследовании, хотя можно предположить, что в PROTECT-AF включены пациенты с относительно низкими ишемическими рисками, что не соответствует общей когорте пациентов с ФП.
Другой особенностью исследования PROTECT-AF является беспрецедентно высокая частота геморрагического инсульта в группе варфарина (1,1%). Среди 38000 пациентов, получавших варфарин в других клинических исследованиях [13-18], данное значение колеблется в пределах 0,36-0,5% [10].
Данные мета-анализа двух описанных исследований продемонстрировали тенденцию к большей частоте развития ИИ в группе Watchman (ОР 1,71; p=0,08), в то же время группа имплантации устройства имела статистически значимое преимущество в отношении смертности от всех причин (ОР 0,73; p=0,035), больших кровотечений, не ассоциированных с процедурой (ОР 0,48; p<0,01), и геморрагического инсульта (ОР 0,20; p<0,01) [19].
В 2020 г. были опубликованы данные рандомизированного исследования PRAGUE-17, в котором эндоваскулярное закрытие УЛП (окклюдером Watchman, Watchman-FLX или Amulet) сравнивалось с ПОАК (в 95% случаев – с апиксабаном) в группе пациентов высокого риска (CHA2DS2-VASc: 4,7±1,5) с ФП [9]. Частота успешной имплантации окклюдера составила в данном исследовании 90,0%. В данной работе окклюдер УЛП был не хуже медикаментозной профилактики ПОАК в отношении первичной конечной точки (кардиоэмболические осложнения+сердечно-сосудистая смертность+кровотечения), частоты кардиоэмболических осложнений, клинически значимых кровотечений и сердечно-сосудистой смертности. При этом эндоваскулярная изоляция УЛП имела тенденцию к преимуществу перед ПОАК в отношении кровотечений, не связанных с процедурой (ОР 0,53; p=0,07).
Следует отметить, что в данное исследование была включена специфическая когорта больных – пациенты с анамнезом кровотечения, потребовавшего вмешательство или госпитализацию, с анамнезом инсульта на фоне приема оральных антикоагулянтов и/или с одновременно высоким CHA2DS2-VASc≥3 и HAS-BLED >2. Таким образом, экстраполировать результаты этого исследования на общую когорту пациентов, которые отказались от приема антикоагулянтов, не представляется возможным. Относительно низкая частота успешной имплантации окклюдера, а также подавляющее преимущество апиксабана в структуре ПОАК контрольной группы пациентов, также являются причинами, по которым результаты данного РКИ недостаточны для формирования четких рекомендаций.
Мета-анализ трех ранее упомянутых РКИ также продемонстрировал, что эндоваскулярная изоляция УЛП сопоставима по эффективности с ОАК в профилактике ИИ/СЭ [20]. При этом установка окклюдера УЛП показала свое превосходство по сравнению с ОАК в частоте геморрагических инсультов (p=0,002), кровотечений, не связанных с процедурой (p=0,0002), а также сердечно-сосудистой смертности (p=0,03) и смертности от всех причин (ОР 0,78, 95% ДИ 0,62- 0,99; p=0,04). Причиной более низкой летальности, по всей видимости, стала меньшая частота геморрагических инсультов и кровотечений, не связанных с операцией. Это преимущество достигалось в основном при сравнении с группой варфарина. В нашем исследовании также было получено преимущество окклюдера в отношении смертности от всех причин, причем, как при сравнении с варфарином, так и при сравнении с ПОАК. Также важным результатом настоящего исследования, не полученным в описанных РКИ и метаанализе, является значимо меньшая кумулятивная частота достижения первичной конечной точки, включающей в себя смертность от всех причин, кардиоэмболические события и все кровотечения, в группе окклюдера. При этом частота кардиоэмболических событий и кровотечений в группе окклюдера в нашем исследовании согласуется с данными литературы [20][21].
Многоцентровой регистр EWOLUTION, хотя не является РКИ, но также должен быть упомянут в данном обсуждении. В него был включен 1021 пациент с ФП. Всем включенным пациентам была выполнена имплантация окклюдера Watchman, при этом противопоказания к приему антикоагулянтов были у 62% пациентов. Частота успешной имплантации была выше по сравнению с описанными РКИ, и составила 98,5%, а серьезные нежелательные события за первые 7 дней после процедуры были зарегистрированы реже: в 2,8% случаев [22]. Такие данные свидетельствуют о повышении эффективности и безопасности процедуры эндоваскулярной изоляции УЛП по мере накопления
данных литературы, общемирового опыта, а также опыта операторов. Высокие показатели успешной имплантации и отсутствие значимых осложнений продемонстрировано также в исследовании Э.Х. Шугушева и соавт. [23] В нашем исследовании частота успешной имплантации составила 95,7%, в 2,2% отмечалась эмболизация устройства, также отмечались малые сосудистые осложнения у 3 пациентов. Данные результаты превосходят результаты большинства крупных РКИ, но несколько уступают регистру EWOLUTION в отношении частоты успешной имплантации окклюдера. Вероятнее всего, это связано с тем, что в наше исследование были включены все пациенты с момента появления процедуры эндоваскулярной изоляции УЛП в НМИЦ кардиологии, а также с тяжестью пациентов [медиана индекса коморбидности Charlson в группе окклюдера в нашем исследовании – 5 (3,75; 7,0)]. Таким образом, в настоящий момент процедура эндоваскулярной изоляции УЛП демонстрирует высокую безопасность, в том числе, в группе пациентов с большим количеством коморбидных патологий.
Учитывая недостаточную представленность устройства Amplatzer Cardiac Plug в крупных РКИ, следует упомянуть многоцентровой регистр, в котором изучалась эффективность и безопасность эндоваскулярной изоляции УЛП с применением данного окклюдера [24]. Успешность процедуры составила 97,3%, серьезные нежелательные события, связанные с процедурой – 5%. В данном регистре отмечалась низкая (1,33%) частота больших кровотечений в группе пациентов окклюдера, не получавших антитромботическую терапию, кроме ацетилсалициловой кислоты (против ожидаемой частоты по шкале HAS-BLED 5,3% и 2,1% – полученной в общей группе пациентов). Таким образом, эндоваскулярная изоляция УЛП при достаточно высокой эффективности профилактики кардиоэмболических осложнений позволяет снизить интенсивность антитромботической терапии, что приводит к уменьшению риска геморрагических осложнений.
В настоящем исследовании значимого преимущества эндоваскулярной изоляции УЛП по сравнению с антикоагулянтной терапией в отношении геморрагических осложнений получено не было, в том числе, при исключении из анализа кровотечений, связанных с вмешательством. Данные результаты могут быть связаны с назначением комбинированной антитромботической терапии у ряда пациентов группы окклюдера. При этом преимущество окклюдера в основном достигается за счет снижения смертности от всех причин, что согласуется с данными упомянутых мета-анализов.
Заключение
В данном исследовании впервые изучена возможность применения эндоваскулярной изоляции УЛП в качестве первой линии профилактики кардиоэмболических событий у пациентов с ФП. Было продемонстрировано преимущество имплантации окклюдера перед ПОАК и варфарином по кумулятивной частоте прогноз-определяющих событий для пациентов с ФП и высоким риском кардиоэмболических осложнений в качестве первой линии терапии. Ограничениями данной работы является меньший объем выборки пациентов по сравнению с рядом других исследований, а также тот факт, что наше исследование является нерандомизированным и одноцентровым. Необходимы дальнейшие рандомизированные контролируемые исследования с целью уточнения места эндоваскулярной изоляции УЛП в профилактике ишемических осложнений у пациентов с фибрилляцией предсердий.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование: Исследование проведено при поддержке Национального медицинского исследовательского центра кардиологии имени академика Е.И. Чазова.
Funding: The study was performed with the support of the National Medical Research Centre of Cardiology named after academician E.I. Chazov.
Список литературы
1. Virani, SS, Alonso A, Benjamin EJ, et al. Heart Disease and Stroke Statistics—2020 Update: A Report From the American Heart Association. Circulation. 2020;141(9):e139-e596. DOI:10.1161/cir.0000000000000757.
2. Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke. 1991;22(8):983-88. DOI:10.1161/01.str.22.8.983.
3. Gabet A, Guenancia C, Duloquin G, Olie V, Bejot Y Ischemic Stroke With Atrial Fibrillation: Characteristics and Time Trends 2006 to 2017 in the Dijon Stroke Registry. Stroke. 2021;52(6):2077-85. DOI:10.1161/STROKEAHA.120.030812.
4. Odell JA, Blackshear JL, Davies E, et al. Thoracoscopic obliteration of the left atrial appendage: Potential for stroke reduction? Ann Thorac Surg. 1962;61(2):565-9. DOI:10.1016/0003-4975(95)00885-3.
5. Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2021;42(5):373-498. DOI:10.1093/eurheartj/ehaa612.
6. January ST, Wann LS, Calkins H, et al. 2019 AHA/ACC/HRS Focused Update of the 2014 AHA/ACC/HRS Guideline for the management of patients with atrial fibrillation. J Am Coll Cardiol. 2019;74(1):104-32. DOI:10.1016/j.jacc.2019.01.011.
7. Holmes DR, Reddy VY, Turi ZG, et al. Percutaneous closure of the left atrial appendage versus warfarin therapy for prevention of stroke in patients with atrial fibrillation: a randomised non-inferiortiy trial. Lancet. 2009;374(9689):534-42. DOI:10.1016/S0140-6736(09)61343-X.
8. Holmes DR Jr, Kar S, Price MJ, et al. Prospective randomized evaluation of the Watchman left atrial appendage closure device in patients with atrial fibrillation versus long-term warfarin therapy: the PREVAIL trial. J Am Coll Cardiol. 2014;64(1):1-12. DOI:10.1016/j.jacc.2014.04.029.
9. Osmancik P, Herman D, Neuzil P, et al. PRAGUE-17 Trial Investigators. Left Atrial Appendage Closure Versus Direct Oral Anticoagulants in High-Risk Patients With Atrial Fibrillation. J Am Coll Cardiol. 2020;75(25):3122-35. DOI:10.1016/j.jacc.2020.04.067.
10. Glikson M, Wolff R, Hindricks G, et al. ESC Scientific Document Group. EHRA/EAPCI expert consensus statement on catheter-based left atrial appendage occlusion - an update. Europace. 2020;22(2):184. DOI:10.1093/europace/euz258.
11. Franco L, Becattini C, Beyer-Westendorf J, et al. Definition of major bleeding: Prognostic classification. J Thromb Haemost. 2020;18(11):2852-60. DOI:10.1111/jth.15048.
12. Reddy VY, Sievert H, Halperin J, et al. PROTECT AF Steering Committee and Investigators. Percutaneous left atrial appendage closure vs warfarin for atrial fibrillation: a randomized clinical trial. J Am Med Assoc. 2014;312(19):1988-98. DOI:10.1001/jama.2014.15192.
13. Connolly SJ, Ezekowitz MD, Yusuf S, et al.; RE-LY Steering Committee Investigators. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med. 2009;361(12):1139-51. DOI:10.1056/NEJMoa0905561.
14. Patel MR, Mahaffey KW, Garg J, et al. ROCKET AF Investigators. Rivaroxaban versus warfarin in non-valvular atrial fibrillation. N Engl J Med. 2011;365(10):883-91. DOI:10.1056/NEJMoa1009638.
15. Granger CB, Alexander JH, McMurray JJ, et al. ARISTOTLE Committees and Investigators. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2011;365(11):981-92. DOI:10.1056/NEJMoa1107039.
16. Giugliano RP, Ruff CT, Braunwald E, et al. ENGAGE AF-TIMI Investigators. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2013;369(22):2093-104. DOI:10.1056/NEJMoa1310907.
17. Connolly S, Pogue J, Hart R, et al. ACTIVE Writing Group of the ACTIVE Investigators. Clopidogrel plus aspirin versus oral anticoagulation for atrial fibrillation in the Atrial fibrillation Clopidogrel Trial with Irbesartan for prevention of Vascular Events (ACTIVE W): a randomised controlled trial. Lancet. 2006;367(9526):1903-12. DOI:10.1016/S0140-6736(06)68845-4.
18. Mant J, Hobbs FD, Fletcher K, et al. BAFTA investigators; Midland Research Practices Network (MidReC). Warfarin versus aspirin for stroke prevention in an elderly community population with atrial fibrillation (the Birmingham Atrial Fibrillation Treatment of the Aged Study, BAFTA): a randomised controlled trial. Lancet. 2007;370(9586):493-503. DOI:10.1016/S0140-6736(07)61233-1.
19. Reddy VY, Doshi SK, Kar S, et al. PREVAIL and PROTECT AF Investigators. 5-Year Outcomes After Left Atrial Appendage Closure: From the PREVAIL and PROTECT AF Trials. J Am Coll Cardiol. 2017;70(24):2964-75. DOI:10.1016/j.jacc.2017.10.021.
20. Давтян К.В., Калемберг А.А., Симонян Г.Ю. Эффективность профилактики ишемического инсульта у пациентов с имплантированным окклюзирующим устройством ушка левого предсердия. Результаты пятилетнего наблюдения. Российский Кардиологический Журнал. 2018;(7):16-20. DOI:10.15829/1560-4071-2018-7-16-20.
21. Turagam MK, Osmancik P, Neuzil P, et al. Left atrial appendage closure versus oral anticoagulants in atrial fibrillation: a meta-analysis of randomized trials. J Am Coll Cardiol. 2020;76(23):2795-7. DOI:10.1016/j.jacc.2020.08.089.
22. Boersma LV, Schmidt B, Betts TR, et al. EWOLUTION investigators. Implant success and safety of left atrial appendage closure with the WATCHMAN device: peri-procedural outcomes from the EWOLUTION registry. Eur Heart J. 2016;37(31):2465-74. DOI:10.1093/eurheartj/ehv730.
23. Шугушев Э.Х., Родионова Л.В., Ганеева О.Н., и др. Непосредственные и отдаленные результаты имплантации окклюдера ушка левого предсердия у больных с фибрилляцией предсердия. Российский Кардиологический Журнал. 2020;(12):28-32. DOI:10.15829/1560-4071-2016-12-28-32.
24. Tzikas A, Shakir S, Gafoor S et al. Left atrial appendage occlusion for stroke prevention in atrial fibrillation: multicentre experience with the AMPLATZER Cardiac Plug. EuroIntervention. 2016;11(10):1170-9. DOI:10.4244/EIJY15M01_06.
Об авторах
Д. В. ПевзнерРоссия
Певзнер Дмитрий Вольфович.
Москва.
eLibrary SPIN 9982-5926
Н. С. Кострица
Россия
Кострица Наталья Сергеевна.
Москва.
eLibrary SPIN 9540-0177
А. К. Алиева
Россия
Алиева Амина Кязымовна.
Москва.
И. A. Меркулова
Россия
Меркулова Ирина Алексеевна.
Москва.
eLibrary SPIN 6169-1588
И. С. Явелов
Россия
Явелов Игорь Семенович.
Москва.
eLibrary SPIN 7248-9323
Е. В. Меркулов
Россия
Меркулов Евгений Владимирович.
Москва.
eLibrary SPIN 1181-7947
И. Е. Чазова
Россия
Чазова Ирина Евгеньевна.
Москва.
eLibrary SPIN 6175-6138
Рецензия
Для цитирования:
Певзнер Д.В., Кострица Н.С., Алиева А.К., Меркулова И.A., Явелов И.С., Меркулов Е.В., Чазова И.Е. Профилактика кардиоэмболических осложнений у пациентов с фибрилляцией предсердий: сопоставление эффективности и безопасности эндоваскулярной изоляции ушка левого предсердия и оральных антикоагулянтов. Рациональная Фармакотерапия в Кардиологии. 2022;18(4):439-448. https://doi.org/10.20996/1819-6446-2022-08-09
For citation:
Pevzner D.V., Kostritca N.S., Alieva A.K., Merkulova I.A., Yavelov I.S., Merkulov E.V., Chazova I.E. Prevention of Cardioembolic Complications in Patients with Atrial Fibrillation: Efficacy and Safety of Left Atrial Appendage Isolation and Oral Anticoagulants. Rational Pharmacotherapy in Cardiology. 2022;18(4):439-448. (In Russ.) https://doi.org/10.20996/1819-6446-2022-08-09

















































