Перейти к:
Нейрегулин-1β, биомаркеры системного воспаления и миокардиального фиброза у больных с хронической сердечной недостаточностью
https://doi.org/10.20996/1819-6446-2022-09-05
Аннотация
Нейрегулин-1β является потенциальным биомаркером хронической сердечной недостаточности (ХСН), механизмы действия которого у больных ХСН до конца не изучены. В ранее выполненных исследованиях описаны кардиопротективные и противовоспалительные эффекты
нейрегулина-1β.
Цель. Определить концентрацию нейрегулина-1β у больных ХСН и изучить ассоциацию нейрегулина-1β с маркерами системного воспаления и миокардиального фиброза, а также с клиническим исходами.
Материалы и методы. В наблюдательное проспективное исследование было включено 86 пациентов с ХСН: c сохраненной фракцией выброса (СНсФВ; n=47) и низкой фракцией выброса (СНнФВ; n=39). Группу здоровых добровольцев (ЗД) составили 40 человек. Всем участникам определялись уровни нейрегулина-1β, биомаркеров системного воспаления [высокочувствительный С-реактивный белок (вчСРБ), интерлейкин-6 (ИЛ-6), sVCAM-1, ST2] и фиброза (MMP-9, Галектин-3, ТГФ-β). Пациенты с ХСН наблюдались в течение 2 лет. Регистрировались сердечно-сосудистая смертность и госпитализации по поводу декомпенсации ХСН.
Результаты. В группах СНсФВ, СНнФВ и ЗД медиана концентрации нейрегулина-1β составила 0,969 (0,348; 1,932) нг/мл, 0,63 (0,348; 1,932) нг/мл и 0,379 (0,195; 0,861) нг/мл соответственно. В группе СНсФВ уровень нейрегулина-1β был значимо выше по сравнению с группой ЗД (р=0,004) и не отличался от такового в группе СНнФВ. У больных ХСН концентрации всех исследуемых биомаркеров системного воспаления (ИЛ-6, sVCAM-1, ТГФ-β и ST2) были значимо выше, чем у ЗД. Концентрации ST-2, ТГФ-β и ИЛ-6 были выше у пациентов с СНнФВ, чем у СНсФВ. Уровни вчСРБ, sVCAM-1, MMP-9 и Галектина-3 между группами пациентов с ХСН не различались. У пациентов с СНсФВ уровень нейрегулина-1β значимо ассоциировался с маркерами системного воспаления: вчСРБ (rs=0,378, p=0,023), ИЛ-6 (rs=0,378, p=0,014) и фиброза: ТГФ-β (rs=0,603, p=0,001). Анализ Каплана-Майера показал, что у пациентов с СНсФВ, но не СНнФВ, имеющих повышенные уровни нейрегулина-1β и ИЛ-6, частота госпитализаций по поводу декомпенсации ХСН была выше, чем у больных с низкими уровнями биомаркеров (logrank test, р=0,046 и р=0,012 соответственно). Многофакторный анализ показал, что ассоциация нейрегулина-1β с исходами оставалась значимой при включении в модель факторов пол, возраст, NTproBNP.
Заключение. У больных СНсФВ концентрация нейрегулина-1β выше, чем у здоровых добровольцев, и сопоставима с таковой в группе СНнФВ. Высокие уровни нейрегулина-1β ассоциируются с маркерами системного воспаления и фиброза у больных СНсФВ. Дальнейшие исследования необходимы для оценки прогностической значимости нейрегулина-1β при СНсФВ.
Ключевые слова
Для цитирования:
Жбанов К.А., Салахеева Е.Ю., Соколова И.Я., Железных Е.А., Зекцер В.Ю., Привалова Е.В., Беленков Ю.Н., Щендрыгина А.А. Нейрегулин-1β, биомаркеры системного воспаления и миокардиального фиброза у больных с хронической сердечной недостаточностью. Рациональная Фармакотерапия в Кардиологии. 2022;18(5):522-529. https://doi.org/10.20996/1819-6446-2022-09-05
For citation:
Zhbanov K.A., Salakheeva E.Yu., Sokolova I.Ya., Zheleznykh E.A., Zektser V.Yu., Privalova E.V., Belenkov Yu.N., Shchendrygina A.A. Neuregulin-1β, Biomarkers of Inflammation and Myocardial Fibrosis in Heart Failure Patients. Rational Pharmacotherapy in Cardiology. 2022;18(5):522-529. https://doi.org/10.20996/1819-6446-2022-09-05
Введение
Высокая заболеваемость и смертность от хронической сердечной недостаточности (ХСН) определяют необходимость дальнейшего совершенствования подходов к диагностике и лечению данного состояния [1]. Нейрегулин-1β является эндотелиальным фактором роста, который вырабатывается эндотелиоцитами коронарных микрососудов в ответ на оксидативный стресс и ишемическое повреждение [2-4]. Нейрегулин-1β активирует рецепторы тирозинкиназы 3 и 4 типов на мембране кардиомиоцитов, фибробластов и эндотелия коронарных сосудов, запуская каскад адаптивных внутриклеточных реакций, что приводит к повышению устойчивости кардиомиоцитов к воздействию оксидативного стресса и апоптозу [2][4][5]. В настоящее время нейрегулин-1β изучается как потенциальный биомаркер сердечной недостаточности. В ряде исследований была продемонстрирована его прогностическая значимость [6][7]. У пациентов с ХСН с низкой фракцией выброса (СНнФВ) изменения уровня нейрегулина-1β отмечены уже на ранних стадиях заболевания [8]. Кроме того, было показано, что введение рекомбинантного нейрегулина-1β пациентам с СНнФВ приводит к улучшению систолической функции левого желудочка (ЛЖ), развитию обратного ремоделирования миокарда [8]. Механизмы кардиопротективного воздействия нейрегулина-1β при ХСН продолжают изучаться.
Значимость субклинического системного воспаления, дисфункции эндотелия коронарных микрососудов и миокардиального фиброза в развитии и прогрессировании ХСН была неоднократно продемонстрирована как у больных СНнФВ, так и у пациентов с ХСН с сохраненной фракцией выброса (СНсФВ) [9][10]. Недавние исследования свидетельствуют о противовоспалительных и антифибротических эффектах нейрегулина-1β [11-16]. Оценка ассоциации между уровнем нейрегулина-1β и маркерами системного воспаления и фиброза у больных ХСН ранее не проводилась.
Цель исследования – определить концентрацию нейрегулина-1β у больных с ХСН и изучить ассоциацию нейрегулина-1β с маркерами системного воспаления и фиброза миокарда, определить ассоциации исследуемых биомаркеров с клиническим исходами.
Материал и методы
Проспективное наблюдательное исследование проведено в соответствии с рекомендациями STROBE (Strengthening the Reporting of Observational Studies in Epidemiology) [17] и принципами Хельсинкской декларации.
В исследование было включено 86 пациентов с ХСН [больные СНсФВ (n=47), пациенты с СНнФВ (n=39)] и здоровые добровольцы (контроль; n=40). Исследование проводилось на базе кардиологического отделения Университетской клинической больницы №1 (Сеченовский Университет) в период с сентября 2019 по июнь 2020 г.
Критерии включения для пациентов с СНсФВ: симптомы ХСН [II-IV функциональный класс (ФК) NYHA]; фракция выброса левого желудочка >50%; уровень мозгового концевого натрийуретического пептида (NTproBNP) >300 пг/мл; наличие структурных изменений сердца по данным эхокардиографии (ЭХО-КГ): гипертрофия левого желудочка – толщина задней стенки ЛЖ≥12 мм и/или увеличение левого предсердия (ЛП), и/или увеличение индекса левого предсердия >34 мл/м2, и/или индекса массы левого желудочка >115 г/м2 для мужчин и 95 г/м2 для женщин [18].
Критерии включения для пациентов с СНнФВ: симптомы ХСН (II-IV ФК NYHA) и фракция выброса левого желудочка <40% по данным ЭХО-КГ [18].
Критерии невключения: острые формы ишемической болезни сердца (ИБС); инсульт в течение 3 мес до начала исследования; хроническая обструктивная болезнь легких 3-4 стадии; тяжелые нарушения функции печени; обострение хронических заболеваний желудочно-кишечного тракта; острая почечная недостаточность; сахарный диабет 1 типа; гипотиреоз или гипертиреоз в стадии декомпенсации; аутоиммунные заболевания; вирусные гепатиты В и С, носительство ВИЧ-инфекции, онкологические заболевания.
В группу здоровых добровольцев включались лица старше 50 лет, у которых отсутствовали сердечно-сосудистые заболевания (ССЗ) и факторы риска ССЗ. Пациенты с ХСН наблюдались в течение 2 лет. Регистрировались число случаев сердечно-сосудистой смертности (ССС) и госпитализации по поводу декомпенсации ХСН.
Клинические данные
Демографические и клинические параметры включали пол, возраст, вес, рост, индекс массы тела (ИМТ), факторы риска ССЗ, ФК по NYHA. Эти данные вместе с сопутствующей патологией регистрировались в индивидуальной электронной карте больного в системе RedCAP.
Биомаркеры
Забор венозной крови пациентов производился в момент включения пациента в исследование. После центрифугирования в течение 20 мин при ускорении 2000 g образцы плазмы крови были заморожены и хранились при температуре -80°C. Оценка концентрации нейрегулина-1β, матричной металлопротеиназы-9 (MMP-9), галектина-3, растворимой молекулы адгезии сосудистого эндотелия 1-го типа (sVCAM-1), трансформирующего фактора роста β (ТГФ-β), стимулирующего фактора роста (ST-2) проводилась методом ИФА с использованием следующих наборов: NRG-1 Duoset ELISA (R&D Systems®, США), коэффициент вариации (CV) внутри серий составлял 6,1%, между анализами – 13,8%; MMP-9 Human ELISA Kit (Invitrogen, Thermo Fisher, США), CV внутри серий – 7,3%, между – 10,2%; Galectin-3 Human ELISA Kit (Invitrogen, Thermo Fisher, США), CV внутри серий – 5,4%, между – 7,5%; VCAM-1 (Soluble) Human ELISA Kit (Invitrogen, Thermo Fisher, США), CV внутри серий – 5,2%, между – 3,1%; TGF beta-1 Human ELISA Kit (Invitrogen, ThermoFisher, США), CV внутри серий – 4,9%, между – 3,2%; Presage® ST2 Assay+Control kit (Critical Diagnostics, США) CV внутри серий – 6,3%, между – 4,8%. Учет результатов анализа проводился на микропланшетном ридере («Luminometer Photometer LMA0Б Beckman Coulter», 450 нм), обработка данных выполнялась с применением алгоритма 5PL.
Концентрации интерлейкина-6 (ИЛ-6) и N-концевого пропептида натрийуретического гормона В-типа (NT-proBNP) определялись методом иммунохимического анализа с использованием наборов ElecsysproBNP II (Roche, Швейцария) и Elecsys IL-6 (Roche, Швейцария) соответственно. Учет результатов производился в автоматическом режиме с помощью анализатора CobaseE 601 (Roche, Швейцария). Количественное определение уровня высокочувствительного С-реактивного белка (вчСРБ) в плазме крови проводили иммунонефелометрическим методом с латексным усилением с помощью автоматического анализатора BN ProSpec производства («Dade-Behring», Германия) при использовании реагента CardioPhasehs CRP (Siemens, США).
Эхокардиографическое исследование
ЭХО-КГ проводилось на аппарате Toshiba Apilo 500 в соответствии с российскими рекомендациями по эхокардиографии [19]. Определялись параметры площади и объемов левого и правого предсердий, конечный систолический и диастолический объем левого желудочка (ЛЖ), его масса. Проводилась индексация объемных показателей на площадь поверхности тела. Определялись толщина стенок ЛЖ, конечный диастолический размер ЛЖ. Фракция выброса ЛЖ оценивалась с применением метода Симпсона. Оценка диастолической функции ЛЖ проводилась с применением методов пульсовой и тканевой допплерографии с последующим расчетом параметра E/е’. Определялось состояние перикарда и клапанного аппарата сердца.
Статистический анализ
Оценка нормальности распределения проводилась с помощью критерия Шапиро-Уилка. При нормальном распределении данные описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD), в противном случае – с помощью медианы (Me) и нижнего и верхнего квартилей (25%; 75%). Качественные показатели представлены в виде абсолютных значений и процентных долей. Для попарных сравнений использованы критерии хи-квадрат или U-критерий Манна-Уитни. Для оценки различий в трех группах при нормальном распределении показателя проводится однофакторный дисперсионный анализ с применением критерия Тьюки или Геймса-Хауэлла. При распределении, отличном от нормального, использован критерий Краскела-Уоллиса. Корреляционный анализ проводился с помощью коэффициента ранговой корреляции Спирмена. Статистически значимыми считали различия при уровне р<0,05. Для сравнения времени наступления событий в подгруппах больных, имеющих высокие и низкие уровни биомаркеров, построены кривые Каплана-Мейера. Для проведения анализа Каплана-Майера в качестве референсных значений для нейрегулина-1β, ИЛ-6, sVCAM-1, MMP-9, ТГФ-β использовалась медиана концентрации данных биомаркеров, полученная в исследуемой когорте пациентов с ХСН. Для вчСРБ референсным значением служили 2 мг/л [20], для ST-2 – 23 нг/мл [21], для галектина-3 – 17,8 нг/мл [22] – значения, прогностическая значимость которых была установлена в ранее проведенных исследованиях. Различия оценивались при помощи logrank теста. Регрессия Кокса применялась для оценки ассоциации между изучаемыми биомаркерами и исходами. Статистическая обработка данных проводилась с использованием пакета статистических программ Statistica 10.0 (Statsoft Inc., США) и GraphPad Prism 8 Software (GraphPad Software Inc., США).
Результаты
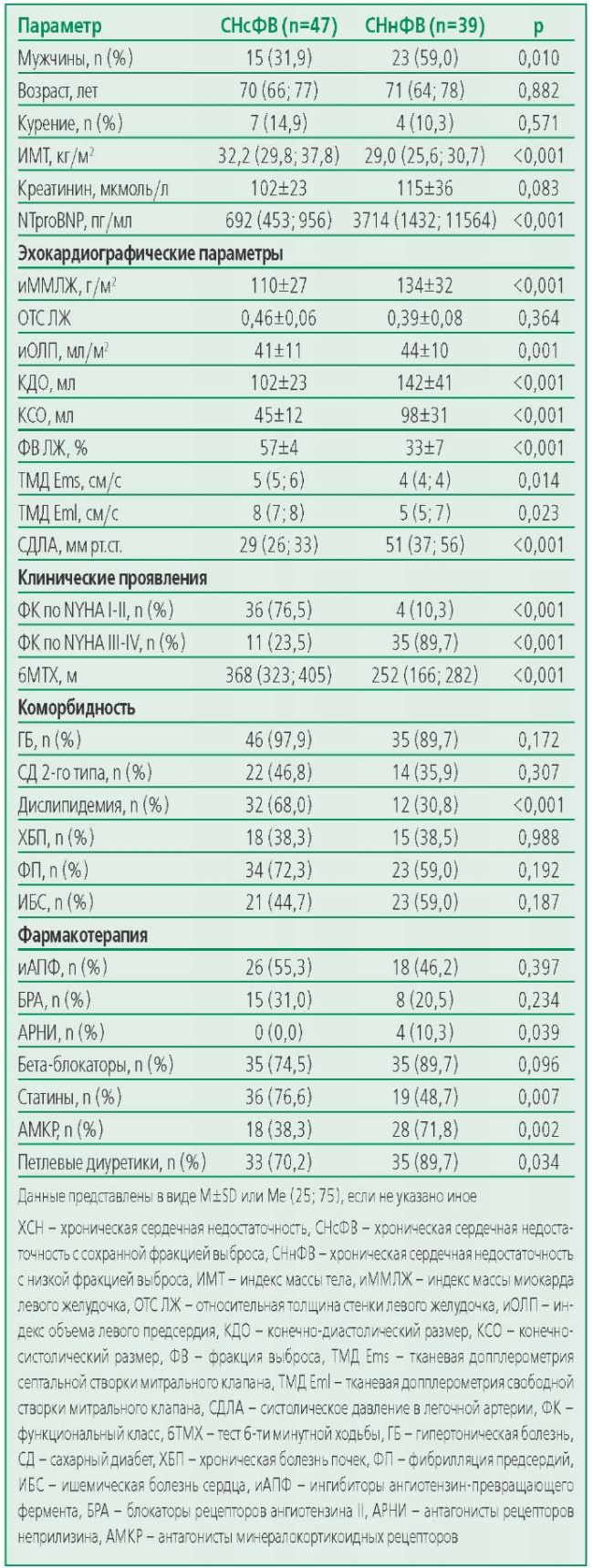
Основные характеристики групп представлены в табл. 1. В группе СНнФВ преобладали мужчины (n=23; 59%), а в группе СНсФВ – женщины (n=32; 68%). Пациенты групп СНнФВ и СНсФВ были сопоставимы по возрасту, наличию сопутствующих заболеваний. Пациенты с СНнФВ чаще, чем больные СНсФВ получали петлевые диуретики и антагонисты минералокортикоидных рецепторов (р=0,034 и р=0,002 соответственно). Различий по частоте назначения ингибиторов ангиотензин-превращающего фермента или блокаторов рецепторов ангиотензина II, бета-адреноблокаторов в группах ХСН не наблюдалось. В группе СНсФВ была выше доля пациентов со II ФК по NYHA. Возраст здоровых добровольцев (n=40; 45% мужчин) составил 56 (53; 61) лет.
Table 1. Clinical and Demographic Characteristics of Patients
Таблица 1. Клинико-демографическая характеристика пациентов
Концентрация нейрегулина-1β в группе СНсФВ значимо не отличалась от таковой в группе с СНнФВ, но была значимо выше, чем в группе контроля (табл. 2). У больных ХСН уровни всех исследуемых биомаркеров системного воспаления (ИЛ-6, sVCAM-1, ТГФ-β и ST2) были значимо выше таковых в контрольной группе. У пациентов с СНнФВ концентрации ST-2, ТГФ-β и ИЛ-6 были значимо выше, чем у больных СНсФВ. При этом, вчСРБ и sVCAM-1 в группах пациентов с ХСН были сопоставимы (p>0,05). Уровни биомаркеров фиброза MMP-9 и галектина-3 не различались между группами СНсФВ и СНнФВ (p>0,05), однако были значительно выше в обеих группах ХСН по сравнению с группой контроля (р<0,01).
Table 2. Concentrations of Neuregulin-1β and Biomarkers of Systemic Inflammation and Fibrosis in the Study Groups
Таблица 2. Концентрации нейрегулина-1β и биомаркеров системного воспаления и фиброза в исследуемых группах
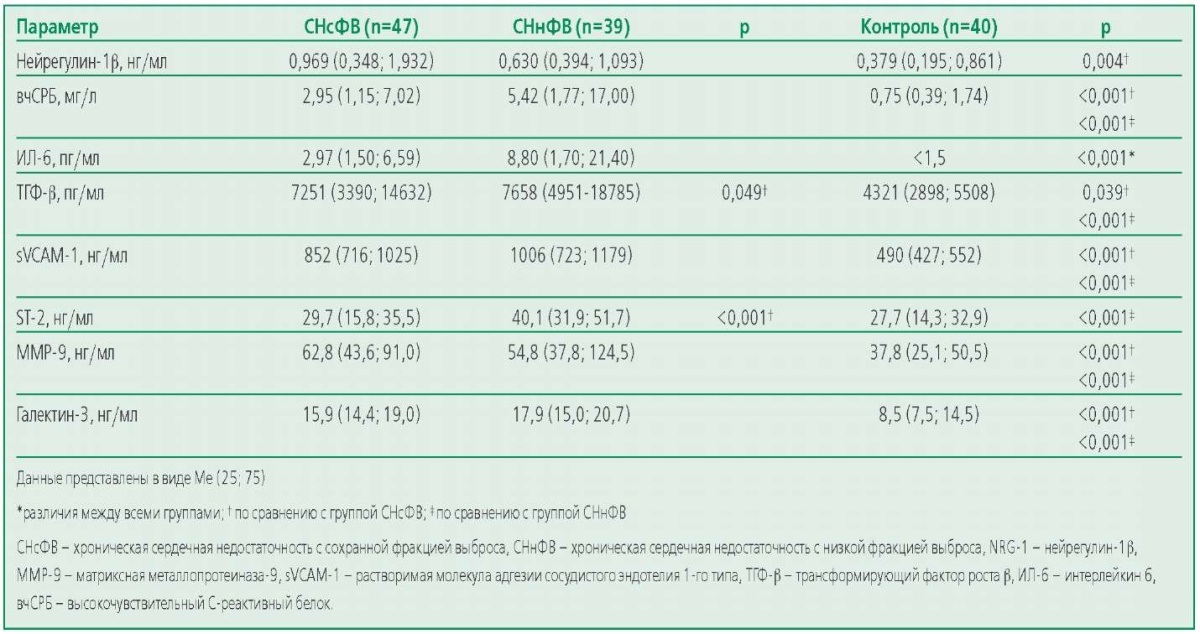
В группе СНнФВ у пациентов ФК III-IV по NYHA по сравнению с NYHA I-II были значимо выше уровни биомаркеров системного воспаления – вчСРБ [ 6 (2; 21) против 1,04 (0,75; 2,57) мг/л; р=0,012], ИЛ-6 [ 10,1 (3,8; 25,5) против <1,50 пг/мл (менее порога определения анализатора); р=0,007], ST-2 [ 41 (32; 53) против 31 (29; 32) нг/мл; р=0,042], тогда как уровень нейрегулина-1β значимо не различался. В группе с СНсФВ различий уровня биомаркеров в зависимости от ФК ХСН не наблюдалось (табл. П1).
В группе СНсФВ отмечена значимая корреляция средней силы между уровнями нейрегулина-1β и биомаркеров системного воспаления (вчСРБ; ИЛ-6) и фиброза (ТГФ-β) (рис. 1). Корреляции уровня нейрегулина-1β с демографическими, лабораторными характеристиками и биомаркерами воспаления и фиброза представлены в табл. П2.
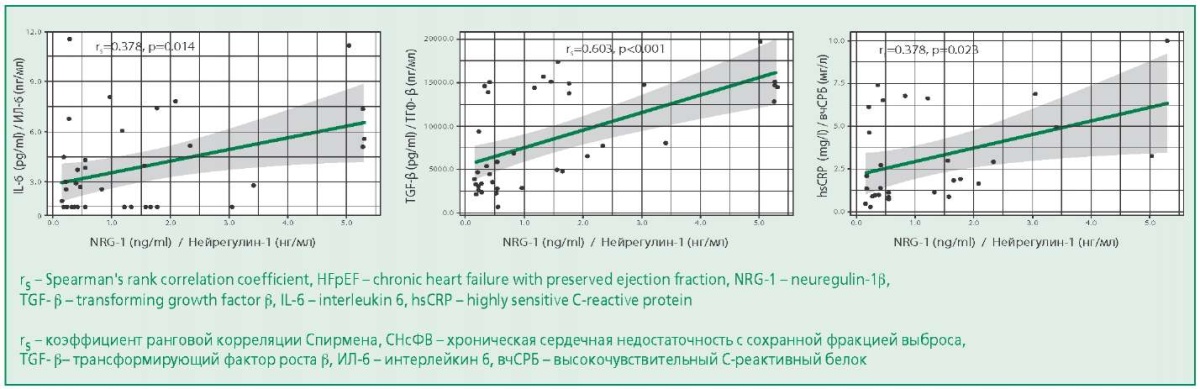
Figure 1. Graphs of Regression Functions Characterizing the Dependence of IL-6, hsCRP, TGF-β levels on NRG-1 level in the HFpEF
Рисунок 1. Графики регрессионных функций, характеризующие зависимость уровней ИЛ-6, вчСРБ, ТГФ-β от концентрации нейрегулина-1β в группе СНсФВ
В группе СНсФВ за период наблюдения длительностью 456 (240; 730) дней зарегистрированы 2 (4%) смерти от ССЗ и 19 (40%) госпитализаций по поводу ХСН. В группе СНнФВ за период наблюдения 407 (98; 730) дней умерли 10 (25%) пациентов и 19 (48%) были госпитализированы по поводу декомпенсации ХСН.
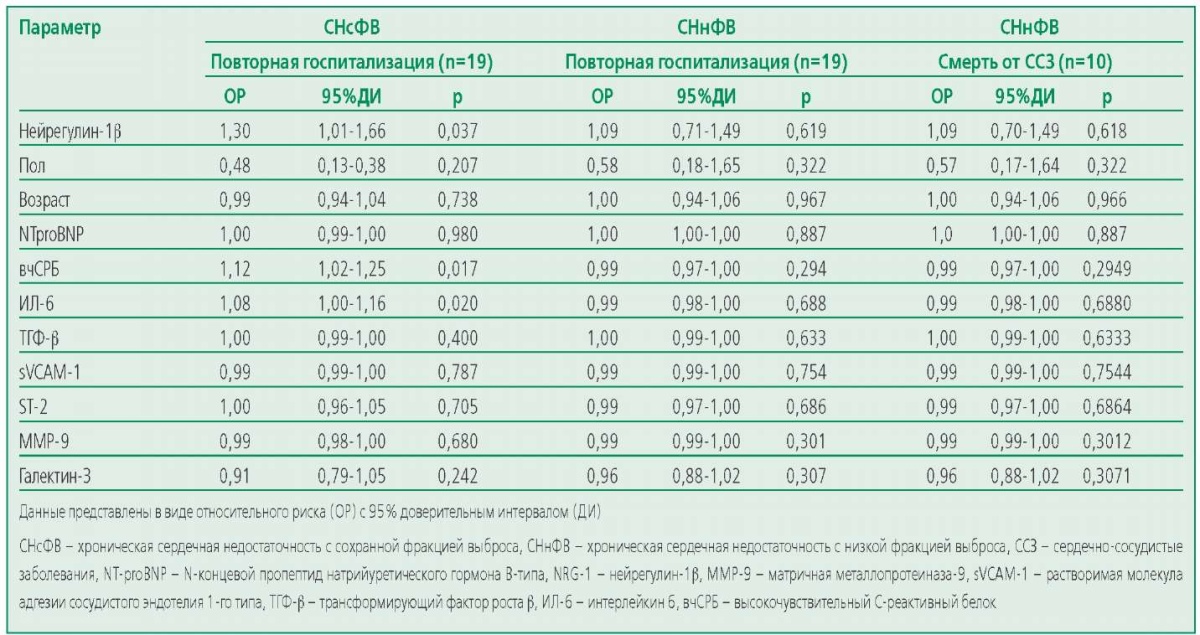
Анализ Каплана-Майера показал, что у пациентов с СНсФВ, имеющих повышенные уровни нейрегулина-1β, частота госпитализаций по поводу декомпенсации ХСН значимо выше, чем у тех, у кого значения биомаркеров оставались низкими (11 повторных госпитализаций против 8; р=0,046). Пациенты с СНсФВ и высоким уровнем ИЛ-6 также имели значимо более высокую частоту регистрируемых исходов (14 повторных госпитализаций против 5 у пациентов с низкой концентрацией (р=0,012) (рис. П1)). Ввиду низкого уровня сердечно-сосудистой смертности в группе пациентов с СНсФВ анализ ассоциации биомаркеров с данным исходом не проводился. В ходе однофакторного регрессионного анализа установлено, что у пациентов с СНсФВ высокие концентрации нейрегулина-1β, ИЛ-6 и вчСРБ ассоциировались с высоким риском госпитализации по поводу ХСН. В группе СНнФВ таких ассоциаций не получено (табл. 3).
Table 3. Characterization of the Factors Influencing the Risk of Hospitalizations and Death from Cardiovascular Diseases in the Study Groups
Таблица 3. Характеристика факторов, влияющих на риск повторных госпитализаций и смерти от ССЗ в исследуемых группах
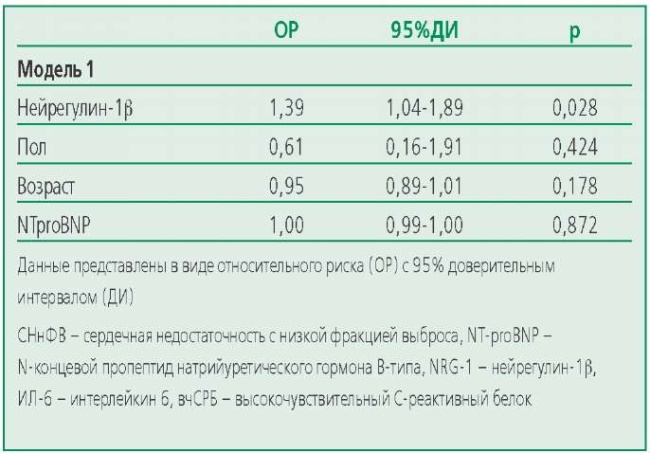
Ассоциация между уровнем нейрегулина-1β и риском госпитализации оставалась значимой после включения в модель пола, возраста, уровня NTproBNP (p=0,028) (табл. 4).
Table 4. Characteristics of the Factors Included in the Risk Assessment Models for Hospitalization in the HFpEF Group
Таблица 4. Характеристика факторов, включенных в модели оценки риска повторных госпитализаций в группе СНсФВ
Обсуждение
В нашем исследовании отмечено, что концентрация нейрегулина-1β была выше у пациентов с СНсФВ, чем у здоровых лиц. При этом уровень биомаркера значимо не отличался в подгруппах ХСН. Также было показано, что у больных СНсФВ нейрегулин-1β значимо коррелировал с маркерами системного воспаления. Установлено, что нейрегулин-1β, вчСРБ и ИЛ-6 ассоциировались c высоким риском развития госпитализаций по поводу ХСН в группе СНсФВ, но не в группе СНнФВ.
Ранее C. Hage и соавт. продемонстрировали, что у пациентов с СНсФВ уровень нейрегулина-1β был значимо выше, чем у пациентов СНнФВ [6]. Вероятно, относительно небольшой размер выборки в нашем исследовании не позволил зафиксировать возможные различия концентраций биомаркера в подгруппах ХСН. Причины различия уровня нейрегулина-1β при СНсФВ и СНнФВ до конца не ясны и продолжают изучаться. Можно предполагать, что высокий уровень нейрегулина-1β у пациентов с СНсФВ характеризует активность адаптивных механизмов, которые способствуют устойчивости кардиомиоцитов к воздействию оксидативного стресса и апоптозу.
Более низкие концентрации нейрегулина-1β у больных СНнФВ могут быть связаны с выраженной дисфункций коронарных микрососудов [23-27], в условиях которой выработка нейрегулина-1β эндотелием прогрессивно снижается. В пользу такого предположения также свидетельствуют данные о снижении экспрессии мРНК, регулирующей синтез нейрегулина-1β, при СНнФВ [28]. Данные предположения требуют проведения дальнейших исследований.
В нашей работе впервые было показано, что у пациентов с СНсФВ имеет место положительная корреляция между нейрегулином-1β и маркерами системного воспаления (вчСРБ, ИЛ-6). Аналогично данным ранее выполненных исследований мы не наблюдали ассоциаций нейрегулина-1 и с такими маркерами фиброза, как ST-2 (p=0,277), галектин-3 (p=0,752), а также с NTproBNP (р=0,545) [6].
Важно подчеркнуть, что в нашем исследовании ИЛ-6 был значимо выше у больных СНнФВ, чем у пациентов с СНсФН. Полученные результаты согласуются с данными ранее выполненных исследований, в которых также была продемонстрирована прогностическая роль ИЛ-6 у данной категории пациентов [29]. Интересно отметить, что у больных СНнФВ уровень маркеров воспаления был значимо выше у пациентов с тяжелой ХСН (ФК III-IV NYHA), в то время как в группе СНсФВ уровни данных маркеров не различались в зависимости от ФК, хотя были значимо выше, чем у здоровых добровольцев. Вероятно, что у больных СНнФН тяжесть состояния определяет выраженность системного воспаления, в то время как у пациентов с СНсФВ системное воспаление имеет место независимо от тяжести ХСН, играя важную роль в развитии и прогрессировании заболевания.
Уровни маркеров фиброза миокарда (MMP-9, галектин-3) были выше у больных с ХСН, чем у ЗД. При этом концентрации данных биомаркеров не различались у пациентов с СНсФВ и СНнФВ, что согласуется с результатами ранее проведенных исследований [30][31].
В ходе оценки ассоциаций исследуемых биомаркеров с риском развития неблагоприятных исходов в нашем исследовании впервые было показано, что в группе больных СНсФВ более высокие концентрации нейрегулина-1β наряду с ИЛ-6 ассоциировались с высоким риском развития повторных госпитализаций по поводу декомпенсации ХСН, в то время как у больных СНнФВ ассоциаций исследуемых биомаркеров с риском смерти от ССЗ и риском повторных госпитализаций получено не было. При этом ассоциации нейрегулина-1β и исходов оставались значимыми даже при коррекции на пол, возраст и уровень NTproBNP.
Важно отметить, что именно высокие концентрации нейрегулина-1 ассоциировались с повышенным риском неблагоприятных исходов. Можно предположить, что система нейрегулина-1 у пациентов с СНсФВ активируется по механизму положительной обратной связи аналогично тому, как это происходит в случае с натрийуретическим пептидом. Эти предположения требуют проведения дальнейших исследований.
Ограничения исследования. Однако, несмотря на новизну полученных данных, необходимо подчеркнуть, что исследование имеет ряд ограничений, в числе которых – относительно небольшая выборка, что ограничивает построение многофакторной прогностической модели для оценки прогностической значимости ряда биомаркеров. Тем не менее, данная работа дополняет наши представления о роли нейрегулина-1β у больных ХСН и формирует предпосылки для проведения дальнейших исследований на большей когорте пациентов с ХСН.
Заключение
У больных СНсФВ концентрация нейрегулина-1β выше, чем у здоровых добровольцев, и сопоставима с таковой в группе СНнФВ. Высокие уровни нейрегулина-1β у больных СНсФВ ассоциируются с маркерами системного воспаления и фиброза, и риском развития госпитализаций по поводу декомпенсации ХСН.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование. Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта №18-515-76002, научного гранта «Роль нейрегулина-1β в развитии и прогрессировании сердечнососудистой патологии: выявление агониста ErbB4 рецептора и приоритетных групп терапии».
Funding. The study was performed with the financial support of the Russian Foundation for Basic Research within the framework of scientific project №18-51576002, scientific grant “The neuregulin-1 pathway in development and progression cardiovascular disease: identification of small molecule ErbB4 agonists and identification of patient populations that could benefit the most”.
Список литературы
1. Groenewegen A, Rutten FH, Mosterd A, Hoes AW. Epidemiology of heart failure. Eur J Heart Fail. 2020;22(8):1342-56. DOI:10.1002/ejhf.1858.
2. Lemmens K, Segers VFM, Demolder M, De Keulenaer GW. Role of neuregulin-1/ErbB2 signaling in endothelium-cardiomyocyte cross-talk. J Biol Chem. 2006;281(28):19469-77. DOI:10.1074/jbc.M600399200.
3. Lemmens K, Doggen K, De Keulenaer GW. Role of neuregulin-1/ErbB signaling in cardiovascular physiology and disease: Implications for therapy of heart failure. Circulation. 2007;116(8):954-60. DOI:10.1161/CIRCULATIONAHA.107.690487.
4. Odiete O, Hill MF, Sawyer DB. Neuregulin in cardiovascular development and disease. Circ Res. 2012;111(10):1376-85. DOI:10.1161/CIRCRESAHA.112.267286.
5. Segers VFM, Brutsaert DL, De Keulenaer GW. Cardiac remodeling: Endothelial cells have more to say than just NO. Front Physiol. 2018;9:382. DOI:10.3389/fphys.2018.00382.
6. Hage C, Wärdell E, Linde C, et al. Circulating neuregulin1-β in heart failure with preserved and reduced left ventricular ejection fraction. ESC Hear Fail. 2020;7(2):445-55. DOI:10.1002/ehf2.12615.
7. Ky B, Kimmel SE, Safa RN, et al. Neuregulin-1β is associated with disease severity and adverse outcomes in chronic heart failure. Circulation. 2009;120(4):310-7. DOI:10.1161/CIRCULATIONAHA.109.856310.
8. De Keulenaer GW, Feyen E, Dugaucquier L, et al. Mechanisms of the Multitasking Endothelial Protein NRG-1 as a Compensatory Factor during Chronic Heart Failure. Circ Hear Fail. 2019;12(10):1-15. DOI:10.1161/CIRCHEARTFAILURE.119.006288.
9. Simmonds SJ, Cuijpers I, Heymans S. Cellular and Molecular Differences between HFpEF and HFrEF: A Step Ahead in an Improved. Cells. 2020;9(1):242. DOI:10.3390/cells9010242.
10. DeBerge M, Shah SJ, Wilsbacher L, Thorp EB. Macrophages in Heart Failure with Reduced versus Preserved Ejection Fraction. Trends Mol Med. 2019;25(4):328-40. DOI:10.1016/j.molmed.2019.01.002.
11. Vermeulen Z, Hervent AS, Dugaucquier L, et al. Inhibitory actions of the NRG-1/ErbB4 pathway in macrophages during tissue fibrosis in the heart, skin, and lung. Am J Physiol - Hear Circ Physiol. 2017;313(5):H934-45. DOI:10.1152/ajpheart.00206.2017.
12. Vandekerckhove L, Vermeulen Z, Liu ZZ, et al. Neuregulin-1 attenua neuregulin-1 attenuates development of nephropathy in a type 1 diabetes mouse model with high cardiovascular risk. Am J Physiol – Endocrinol Metab. 2016;310(7):E495-E504. DOI:10.1152/ajpendo.00432.2015.
13. Xu Z, Jiang J, Ford G, Ford BD. Neuregulin-1 is neuroprotective and attenuates inflammatory responses induced by ischemic stroke. Biochem Biophys Res Commun. 2004;322(2):440-6. DOI:10.1016/j.bbrc.2004.07.149.
14. Wu L, Walas S, Leung W, et al. Neuregulin1-β Decreases IL-1β-Induced Neutrophil Adhesion to Human Brain Microvascular Endothelial Cells. Transl Stroke Res. 2015;6(2):116-24. DOI:10.1007/s12975-014-0347-9.
15. Galindo CL, Kasasbeh E, Murphy A, et al. Anti‐Remodeling and Anti‐Fibrotic Effects of the Neuregulin‐1β Glial Growth Factor 2 in a Large Animal Model of Heart Failure. J Am Heart Assoc. 2014;3(5):1-22. DOI:10.1161/jaha.113.000773.
16. Gupte M, Lal H, Ahmad F, et al. Chronic Neuregulin-1β Treatment Mitigates the Progression of Postmyocardial Infarction Heart Failure in the Setting of Type 1 Diabetes Mellitus by Suppressing Myocardial Apoptosis, Fibrosis, and Key Oxidant-Producing Enzymes. J Card Fail. 2017;23(12):887-99. DOI:10.1016/j.cardfail.2017.08.456.
17. Cuschieri S. The STROBE guidelines. Saudi J Anaesth. 2019;13(5):S31-4. DOI:10.4103/sja.SJA_543_18.
18. Мареев В.Ю., Фомин И.В., Агеев Ф.Т., и др. Клинические Рекомендации ОССН-РКО-РНМОТ. Сердечная Недостаточность: Хроническая (ХСН) и Острая Декомпенсированная (ОДСН). Диагностика, Профилактика и Лечение. Кардиология. 2018;58(6S):8-158. DOI:10.18087/cardio.2475.
19. Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: An update from the American society of echocardiography and the European association of cardiovascular imaging. Eur Heart J Cardiovasc Imaging. 2015;16(3):233-71. DOI:10.1093/ehjci/jev014.
20. Ridker PM, Everett BM, Thuren T, et al. Antiinflammatory Therapy with Canakinumab for Atherosclerotic Disease. N Engl J Med. 2017;377(12):1119-31. DOI:10.1056/nejmoa1707914.
21. Najjar E, Faxén UL, Hage C, et al. ST2 in heart failure with preserved and reduced ejection fraction. Scand Cardiovasc J. 2019;53(1):21-7. DOI:10.1080/14017431.2019.1583363.
22. Meijers WC, Januzzi JL, Defilippi C, et al. Elevated plasma galectin-3 is associated with near-term rehospitalization in heart failure: A pooled analysis of 3 clinical trials. Am Heart J. 2014;167(6):853-60.e4. DOI:10.1016/j.ahj.2014.02.011.
23. Van Heerebeek L, Hamdani N, Falcão-Pires I, et al. Low myocardial protein kinase G activity in heart failure with preserved ejection fraction. Circulation. 2012;126(7):830-9. DOI:10.1161/CIRCULATIONAHA.111.076075.
24. Westermann D, Lindner D, Kasner M, et al. Cardiac inflammation contributes to changes in the extracellular matrix in patients with heart failure and normal ejection fraction. Circ Hear Fail. 2011;4(1):44-52. DOI:10.1161/CIRCHEARTFAILURE.109.931451.
25. Ohtani T, Mohammed SF, Yamamoto K, et al. Diastolic stiffness as assessed by diastolic wall strain is associated with adverse remodelling and poor outcomes in heart failure with preserved ejection fraction. Eur Heart J. 2012;33(14):1742-9. DOI:10.1093/eurheartj/ehs135.
26. Griendling KK, Sorescu D, Ushio-Fukai M. NAD(P)H oxidase: Role in cardiovascular biology and disease. Circ Res. 2000;86(5):494-501. DOI:10.1161/01.RES.86.5.494.
27. Tschöpe C, Bock CT, Kasner M, et al. High prevalence of cardiac parvovirus B19 infection in patients with isolated left ventricular diastolic dysfunction. Circulation. 2005;111(7):879-886. DOI:10.1161/01.CIR.0000155615.68924.B3.
28. Munk M, Memon AA, Goetze JP, Nielsen LB, Nexo E, Sorensen BS. Hypoxia changes the expression of the epidermal growth factor (EGF) system in human hearts and cultured cardiomyocytes. PLoS One. 2012;7(7):1-10. DOI:10.1371/journal.pone.0040243.
29. Markousis-Mavrogenis G, Tromp J, Ouwerkerk W, et al. The clinical significance of interleukin-6 in heart failure: results from the BIOSTAT-CHF study. Eur J Heart Fail. 2019;21(8):965-73. DOI:10.1002/ejhf.1482.
30. Подзолков В. И., Драгомирецкая Н.А., Казадаева А.В., и др. Взаимосвязи активности нейрогормональных систем и параметров внутрисердечной гемодинамики у больных хронической сердечной недостаточностью: фокус на галектин-3. Российский Кардиологический Журнал. 2022;27(4):4957. DOI:10.15829/1560-4071-2022-4957.
31. Мусихина Н.А., Петелина Т.И., Костоусова А.И., и др. Биомаркеры воспаления у перенесших инфаркт миокарда пациентов с сохраненной и незначительно сниженной фракцией выброса левого желудочка, пятилетнее проспективное наблюдение. Российский Кардиологический Журнал. 2020;25(12):3726. DOI:10.15829/1560-4071-2020-3726.
Об авторах
К. А. ЖбановРоссия
Жбанов Константин Александрович
Москва
Е. Ю. Салахеева
Россия
Салахеева Екатерина Юрьевна
Москва
И. Я. Соколова
Россия
Соколова Ирина Яковлевна
Москва
Е. А. Железных
Россия
Железных Елена Анатольевна
Москва
В. Ю. Зекцер
Россия
Зекцер Вита Юрьевна
Москва
Е. В. Привалова
Россия
Привалова Елена Витальевна
Москва
Ю. Н. Беленков
Россия
Беленков Юрий Никитич
Москва
А. А. Щендрыгина
Россия
Щендрыгина Анастасия Александровна
Москва
Дополнительные файлы

|
1. Приложение | |
| Тема | ||
| Тип | Результаты исследования | |
Скачать
(121KB)
|
Метаданные ▾ | |

|
2. Annex | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(98KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Жбанов К.А., Салахеева Е.Ю., Соколова И.Я., Железных Е.А., Зекцер В.Ю., Привалова Е.В., Беленков Ю.Н., Щендрыгина А.А. Нейрегулин-1β, биомаркеры системного воспаления и миокардиального фиброза у больных с хронической сердечной недостаточностью. Рациональная Фармакотерапия в Кардиологии. 2022;18(5):522-529. https://doi.org/10.20996/1819-6446-2022-09-05
For citation:
Zhbanov K.A., Salakheeva E.Yu., Sokolova I.Ya., Zheleznykh E.A., Zektser V.Yu., Privalova E.V., Belenkov Yu.N., Shchendrygina A.A. Neuregulin-1β, Biomarkers of Inflammation and Myocardial Fibrosis in Heart Failure Patients. Rational Pharmacotherapy in Cardiology. 2022;18(5):522-529. https://doi.org/10.20996/1819-6446-2022-09-05

















































