Перейти к:
Гепсидин как регулятор метаболизма железа и медиатор воспаления у больных пожилого и старческого возраста с хронической сердечной недостаточностью и анемией хронических заболеваний
https://doi.org/10.20996/1819-6446-2022-09-03
Аннотация
Цель. Изучить роль гепсидина как регулятора метаболизма железа и медиатора воспаления у больных пожилого и старческого возраста с хронической сердечной недостаточностью (ХСН) и анемией хронических заболеваний (АХЗ).
Материал и методы. У 35 больных ХСН с АХЗ, 35 больных ХСН без анемии и 20 пациентов без ХСН и анемии (контрольная группа) пожилого и старческого возраста исследовали уровни показателей гемограммы, феррокинетики (сывороточное железо, ферритин, трансферрин, эритропоэтин, гепсидин), воспаления [С-реактивный белок (СРБ), интерлейкин-6 (ИЛ-6)] и связи между гепсидином и названными показателями.
Результаты. У пациентов контрольной группы выявлены нормальные уровни гепсидина (9,17±0,97 нг/мл) и единственная значимая связь гепсидина с показателем феррокинетики – сывороточным железом (r(S)=0,480, р=0,032). В группе ХСН без анемии выявлены также нормальные уровни гепсидина (12,01±1,19 нг/мл) и две значимые связи гепсидина с показателями феррокинетики – ферритином [r(S)=0,525, р=0,001] и трансферрином [r(S)=- 0,343, р=0,044]. В группе ХСН с АХЗ выявлены значимо повышенные уровни гепсидина (23,81±3,63 нг/мл) относительно ХСН без анемии (р=0,008) и контрольной группы (р=0,003) и пять значимых корреляций гепсидина с показателями гемограммы – гемоглобином [r (S)=-0,461, р=0,043] и средней концентрацией гемоглобина в эритроците [r(S)=-0,437, р=0,009]; феррокинетики – ферритином [r(S)=0,596, р<0,0001] и трансферрином [r(S) =-0,474, р=0,004]; воспаления – СРБ [r(S)=0,561, p<0,0001].
Заключение. Повышенные уровни гепсидина у больных ХСН с АХЗ и образование связей гепсидина с показателями гемограммы и феррокинетики отражают его роль как регулятора метаболизма железа, а связь с показателем воспаления – его роль как медиатора воспаления, участвующего в развитии АХЗ у больных ХСН пожилого и старческого возраста.
Ключевые слова
Для цитирования:
Соломахина Н.И., Лишута А.С., Дементьева А.В. Гепсидин как регулятор метаболизма железа и медиатор воспаления у больных пожилого и старческого возраста с хронической сердечной недостаточностью и анемией хронических заболеваний. Рациональная Фармакотерапия в Кардиологии. 2022;18(5):553-563. https://doi.org/10.20996/1819-6446-2022-09-03
For citation:
Solomakhina N.I., Lishuta A.S., Dementieva A.V. Hepcidin as a Regulator of Iron Metabolism and Mediator of Inflammation in Patients with Chronic Heart Failure and Anemia of Chronic Diseases of the Elderly and Senile Age. Rational Pharmacotherapy in Cardiology. 2022;18(5):553-563. (In Russ.) https://doi.org/10.20996/1819-6446-2022-09-03
Введение
В последние годы ключевым регулятором метаболизма железа признан гепсидин – небольшой гормоноподобный пептид, открытый C.H. Park и соавт. [1] в 2001 г., который контролирует поступление железа в плазму из энтероцитов и макрофагов посредством деградации клеточного экспортера железа ферропортина, что позволяет избежать как дефицита, так и перегрузки железом [2-7]. Гепсидин секретируется в печени под влиянием провоспалительных цитокинов, преимущественно – интерлейкина-6 (ИЛ-6) [5-10], который выступает в роли триггера развития анемии хронических заболеваний (АХЗ) [4-6][10].
АХЗ – анемия, встречающаяся у пациентов с острой или хронической активацией иммунной системы вследствие различных инфекционных и неинфекционных заболеваний [11]. Другие названия АХЗ в литературе – «анемия воспаления» или «цитокин-индуцированная» анемия, что отражает связь этой анемии с воспалительным процессом, лежащим в ее основе.
Ранее было выявлено уменьшение уровня гепсидина при железодефицитной анемии (ЖДА) [6][9][12], и напротив, значительное повышение уровня гепсидина у больных с воспалительными и аутоиммунными заболеваниями, инфекциями, сепсисом, заболеваниями кишечника, множественной миеломой, ожогами, а также у больных с онкологическими заболеваниями и хроническими заболеваниями почек – то есть заболеваниями, при которых АХЗ развивается наиболее часто [3][4][6][9].
При этом данные литературы по уровню гепсидина у больных хронической сердечной недостаточностью (ХСН), в прогрессировании которой, как известно, системное воспаление играет важную роль [8][13-15], и для которой характерно развитие АХЗ [10], противоречивы. Одни исследователи выявили повышенный уровень гепсидина [16], а другие – пониженный [9][17-19], в одних работах показано, что гепсидин не играет основную роль в патогенезе анемии у больных с ХСН [9][17-19], а в других, напротив, показано, что гепсидин является важным медиатором АХЗ у больных ХСН [4][6][20], так как, являясь белком острой фазы воспаления и одновременно регулятором метаболизма железа, обеспечивает связь между воспалением и возникающей анемией [4][5].
Однако вклад гепсидина в развитие АХЗ у больных с ХСН пожилого и старческого возраста, для которых характерна высокая коморбидность, в том числе, наличие различных хронических воспалительных заболеваний, исследован недостаточно. Неясно, проявляет ли гепсидин у больных ХСН с АХЗ пожилого и старческого возраста свою роль регулятора метаболизма железа и одновременно медиатора воспаления, и если да, то в какой мере [21-23]. АХЗ в этой возрастной группе значительно увеличивает риски сердечно-сосудистых событий и чаще встречается по сравнению с другими анемиями [21], ухудшает прогноз и увеличивает смертность [22][23].
Цель исследования – изучить роль гепсидина как регулятора метаболизма железа и медиатора воспаления у больных пожилого и старческого возраста ХСН с АХЗ.
Материал и методы
В исследование включили 90 пациентов пожилого и старческого возраста (от 74 до 90 лет) с ишемической болезнью сердца: 35 больных ХСН с АХЗ (группа ХСН с АХЗ), 35 больных ХСН без анемии (группа ХСН без анемии) и 20 пациентов без клинических проявлений ХСН и лабораторных признаков анемии (контрольная группа).
Критерии включения. В группы ХСН с АХЗ и ХСН без анемии включали больных, госпитализированных по поводу ХСН III-IV функционального класса (ФК) по NYHA с умеренным нарушением функции почек (креатинин сыворотки ≤180 мкмоль/л) на момент поступления. В группу ХСН без анемии и контрольную группу включали пациентов с уровнем гемоглобина >12 г/дл. В группу ХСН с АХЗ включали больных (как мужчин, так и женщин) с уровнем гемоглобина <12 г/дл, процентом насыщения трансферрина железом (%НТЖ) <20%, как с абсолютным дефицитом железа (уровнем ферритина <100 мкг/л), так и с функциональным дефицитом железа (уровнем ферритина >100 и <300 мкг/л) [24-26] и отсутствием доказанной хронической кровопотери.
Критерии исключения: мегалобластные, гемолитические, апластические анемии, аутоиммунные и онкологические заболевания, первичные заболевания почек.
У всех участников исследовали: показатели гемограммы (гемоглобин [HGB], количество эритроцитов [RBC], средний объем эритроцитов [MCV], среднее содержание гемоглобина в эритроците [MCH], среднюю концентрацию гемоглобина в эритроците [МСНС], цветовой показатель [ЦП]); показатели феррокинетики (сывороточное железо, ферритин, трансферрин, эритропоэтин, гепсидин); показатели воспаления (С-реактивный белок [СРБ], интерлейкин-6 [ИЛ-6]); для оценки тяжести ХСН – уровень N-терминального пропептида мозгового натрийуретического пептида (NTproBNP). % НТЖ рассчитывали по формуле: сывороточное железо (мкмоль/л)×3,98/трансферрин (г/л).
У всех пациентов забор крови осуществлялся натощак. Для оценки гематологических параметров использовали образцы крови, взятой в пробирках с этилендиаминтетрауксусной кислотой. Для остальных исследований использовали сыворотку, полученную путем центрифугирования образцов крови в течение 15 мин при +6°С, 3000 об/мин. СРБ, ферритин и трансферрин исследовали иммунотурбидиметрическим методом на автоматическом анализаторе SAPFIR 400 (Tokyo Boeki Medisys INC, Япония) в соответствии с инструкциями производителя реактивов (DiaSys, Германия). Гепсидин (биологически активную изоформу гепсидин-25), ИЛ-6, эритропоэтин и NT-proBNP исследовали методом иммуноферментного анализа.
Для исследований использовали следующие тестсистемы: «NT-proBNP» (Biomedica Medizinprodukte Gmbh), «Erytropoitin» (EPO) (BIOMERICA), «Human IL6 Platinum ELISA» (Bender Med Systems Gmbh, Vienna, Австрия), «Hepcidin 25 (bioactive) ELISA» (DRG Diagnostics, Marburg, Германия).
Для исключения источника кровопотери у больных ХСН с АХЗ выполняли эзофагогастродуоденоскопию и колоноскопию, а также исследовали кал на скрытую кровь иммунохроматографическим методом в соответствии с инструкциями производителя реактивов (Human, Германия).
Для оценки нарушений кардиогемодинамики всем пациентам выполняли трансторакальную эхокардиографию на ультразвуковом аппарате Aplio 500 (Toshiba, Япония) по стандартному протоколу. Для оценки длительности ХСН, частоты госпитализаций в год по поводу декомпенсаций у больных ХСН с АХЗ и ХСН без анемии анализировали медицинскую документацию (амбулаторные карты, выписки от предыдущих госпитализаций).
Тяжесть ХСН оценивали по классификации NYHA. Тяжесть хронической болезни почек оценивали по классификации KDOQI [27]. Скорость клубочковой фильтрации (СКФ) рассчитывали по формуле CKDEPI. Референсные значения исследуемых показателей определяли в контрольной группе.
Исследование одобрено локальным этическим комитетом Первого МГМУ им. И.М. Сеченова (Сеченовский Университет). Все участники исследования подписали информированное согласие.
Статистическая обработка данных. При статистической обработке данных использовали пакет статистических программ Statistica 8.0 (StatsoftInc., США). Сравнение средних в двух группах проводили при помощи критерия Стьюдента (t). Вероятность случайного различия средних (р) в нескольких группах определяли при помощи однофакторного дисперсионного анализа с применением post-hoc теста Ньюмена-Келлса р (NK). В таблицах приведены средние значения показателей и величины их ошибок (M±SE). Сравнение групп по сумме рангов наблюдений определяли по тесту Манна-Уитни (U). Значимость различия частот встречаемости признаков определяли по точному критерию Фишера (ТКФ) или критерию хи-квадрат (χ²). Различия считались статистически значимыми при р<0,05.
Для оценки роли гепсидина как регулятора метаболизма железа и медиатора воспаления в развитии АХЗ исследовали наличие и силу связей между уровнями гепсидина и уровнями показателей гемограммы, феррокинетики и воспаления в каждой группе пациентов. Затем для каждой группы построили матрицы коэффициентов корреляций, а для визуализации связей – графические диаграммы корреляций. Для оценки степени монотонной связи использовали коэффициент корреляции Спирмена r(S). После определения индивидуальной значимости коэффициентов корреляции (то есть попарно) для определения их групповой значимости в каждой группе больных использовали поправку Бенжимини-Йекутиели для множественных сравнений [28].
Результаты
Сравнительная характеристика больных ХСН c АХЗ и ХСН без анемии
Группы пациентов ХСН с АХЗ и ХСН без анемии были сопоставимы по полу, возрасту, функциональным классам (ФК) ХСН (NYHA), уровням NT-proBNP, фракции выброса (ФВ) и сердечной коморбидности. При этом были выявлены значимые различия по внесердечной коморбидности: частоте сахарного диабета 2 типа, хронической болезни почек (2 и 4 стадий), однако без значимых различий по СКФ. Кроме того, выявлена тенденция к различию частоты встречаемости пневмоний (табл. 1).
Table 1. Clinical and demographic characteristics of groups of patients with chronic heart failure
Таблица 1. Клинико-демографическая характеристика групп пациентов с ХСН
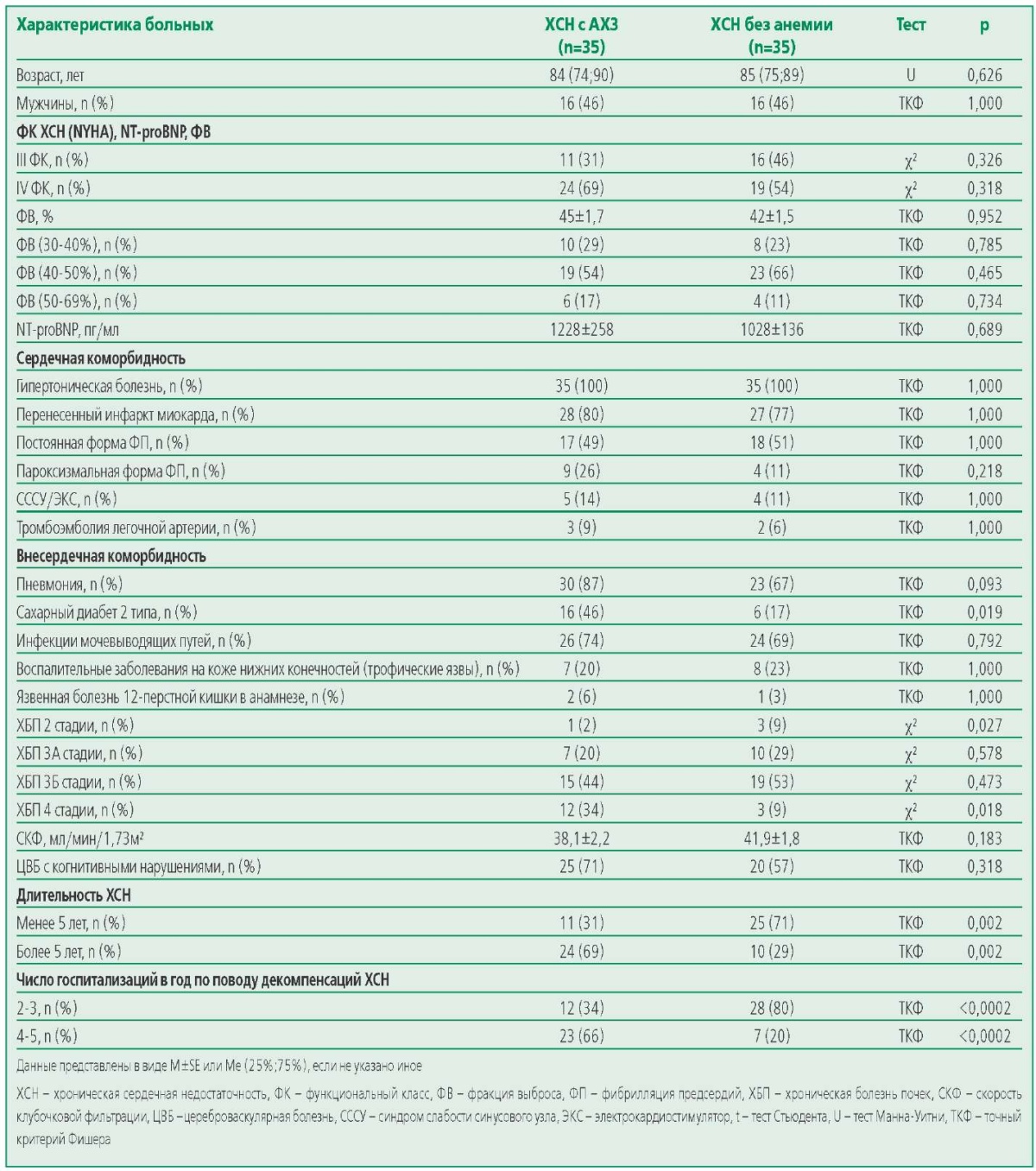
Поскольку сравниваемые группы различались по наличию анемии (ХСН с АХЗ) или ее отсутствию (ХСН без анемии), значимые различия по показателям гемограммы между группами ожидаемы (табл. 2).Также выявлены значимые различия по показателям феррокинетики: сывороточному железу (у больных ХСН с АХЗ меньше, р<0,001), эритропоэтину (у больных ХСН с АХЗ больше, р=0,002) и гепсидину (у больных ХСН с АХЗ больше, р=0,008), однако по уровням ферритина и трансферрина различия были не значимы.
Table 2. Indicators of hemogram, ferrokinetics and inflammation in the studied groups
Таблица 2. Показатели гемограммы, феррокинетики и воспаления в изучаемых группах
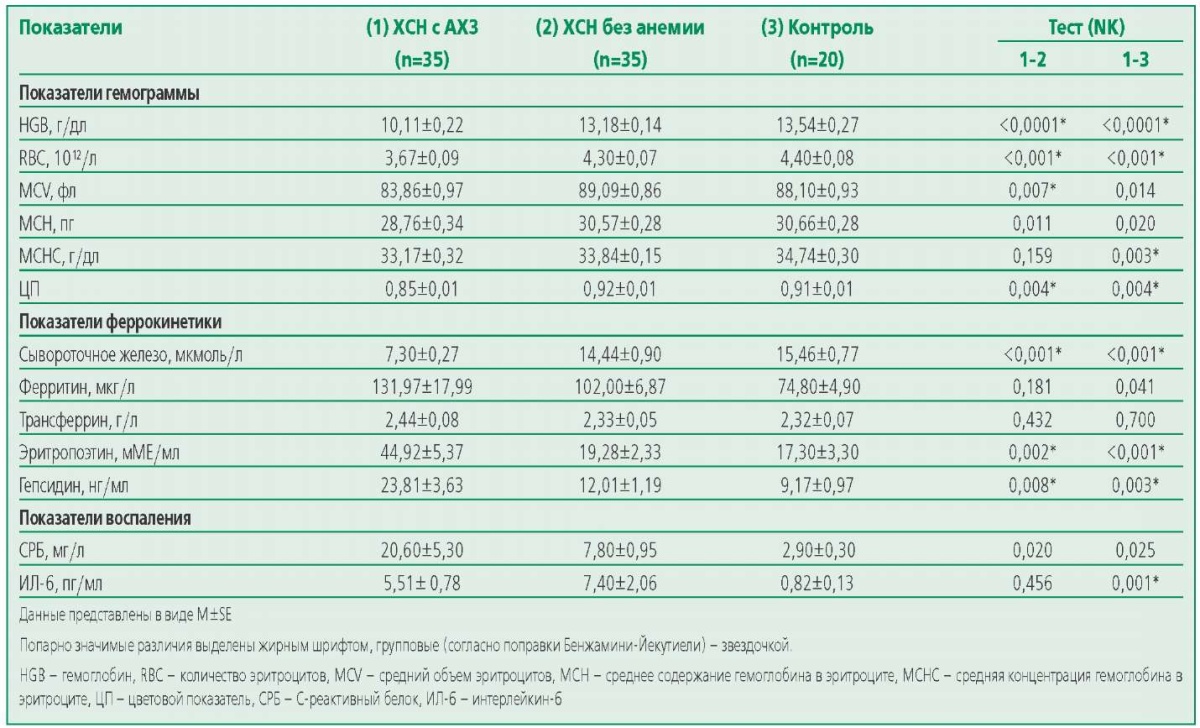
По показателям воспаления значимые различия между сравниваемыми группами выявлены по СРБ (у больных ХСН с АХЗ выше, р=0,020), при этом значимых различий по ИЛ-6 не выявлено (р=0,456). Но у больных ХСН с АХЗ выявлен значимо повышенный уровень ИЛ-6 по сравнению с контрольной группой (р=0,001).
В связи с тем, что значимое повышение уровня гепсидина, так же, как и СРБ, являющихся белками острой фазы воспаления, выявлено только у больных ХСН с АХЗ и не выявлено у больных ХСН без анемии, в то время как на момент госпитализации по ФК ХСН, уровням NT-proBNP, ФВ и сердечной коморбидности группы были сопоставимы, с целью понять причины их повышенного уровня только у больных ХСН с АХЗ были проанализированы частота воспалительных заболеваний, частота госпитализаций в год по поводу декомпенсаций и длительность ХСН. Выявлено, что в группе ХСН с АХЗ большая частота пневмоний (p<0,05), преобладали пациенты с длительностью ХСН более 5 лет (р=0,002) и числом госпитализаций 4-5 раз в год (р=0,0002), и напротив, в группе ХСН без анемии преобладали пациенты с длительностью ХСН менее 5 лет (р=0,02) и числом госпитализаций 2-3 раз год (р=0,0002) (табл. 1).
Корреляционный анализ между показателями гемограммы, феррокинетики и воспаления в контрольной группе
На рис. 1 показано взаимодействие связей у пациентов контрольной группы. Из расположения значимых коэффициентов корреляции видны две основные группы показателей, тесно связанных между собой в одной группе и слабо – между группами. Это показатели гемограммы: триада «MCV-МСН-ЦП» и триада «RBCHGBFe²⁺», все показатели в которых связаны положительными связями, при этом гемоглобин связан с тремя показателями гемограммы.
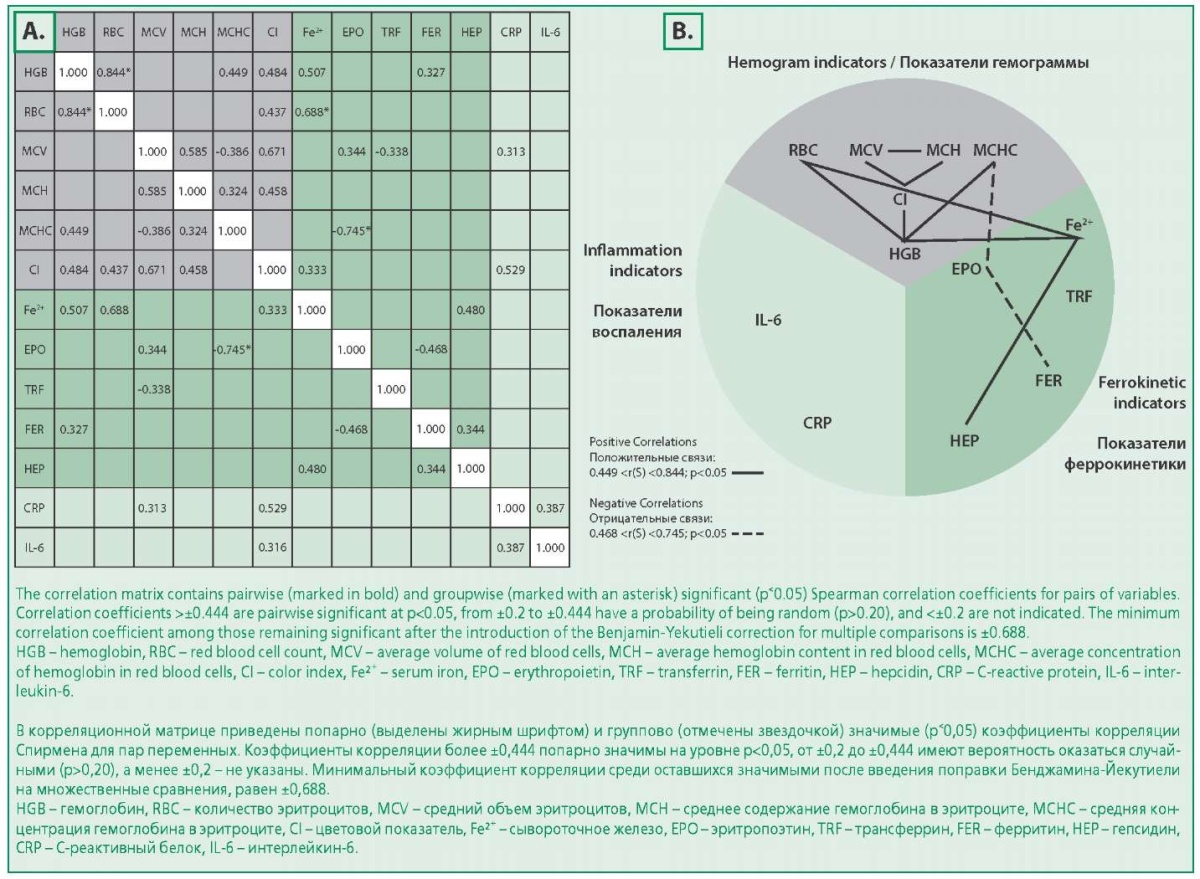
Figure 1. Matrices of correlation coefficients [r(S)] between hepcidin levels and hemogram, ferrokinetics, and inflammation indices in patients of the control group (A) and graphical diagrams of pairwise significant correlations in patients of the control group, demonstrating relationships between hemogram, ferrokinetics, and inflammation indices (B)
Рисунок 1. Матрицы коэффициентов корреляций [r(S)] между уровнями гепсидина и показателями гемограммы, феррокинетики, воспаления у пациентов контрольной группы (A) и графические диаграммы попарно значимых корреляций у пациентов контрольной группы, демонстрирующие связи между показателями гемограммы, феррокинетики и воспаления (B)
Показатели феррокинетики, в отличие от показателей гемограммы, не имеют значимых связей между собой за исключением: ферритина и эритропоэтина, между которыми выявлена отрицательная связь, гепсидина и сывороточного железа, между которыми выявлена положительная связь.
Два показателя гемограммы: HGB и RBC связаны с показателем феррокинетики – сывороточным железом, имея с ним положительные связи.
Обращает на себя внимание факт, что в контрольной группе показатели воспаления не коррелируют ни с одним из показателей феррокинетики, в том числе, с гепсидином, а гепсидин не имеет прямых связей ни с одним из показателей гемограммы, в том числе, с гемоглобином.
Корреляционный анализ между показателями гемограммы, феррокинетики и воспаления в группе ХСН без анемии
На рис. 2 показано взаимодействие связей у больных в группе ХСН без анемии. Из расположения значимых коэффициентов корреляции видны вместо двух групп, как в контрольной группе, два показателя гемограммы: RBC-HGB, между которыми, как и в контрольной группе, сохраняется положительная связь, но утрачиваются связи с остальными показателями гемограммы. При этом сохраняется триада «MCV-МСН-ЦП», показатели которой образуют связи с показателями феррокинетики: положительную с ферритином и отрицательную с трансферрином, которых не было в контрольной группе.
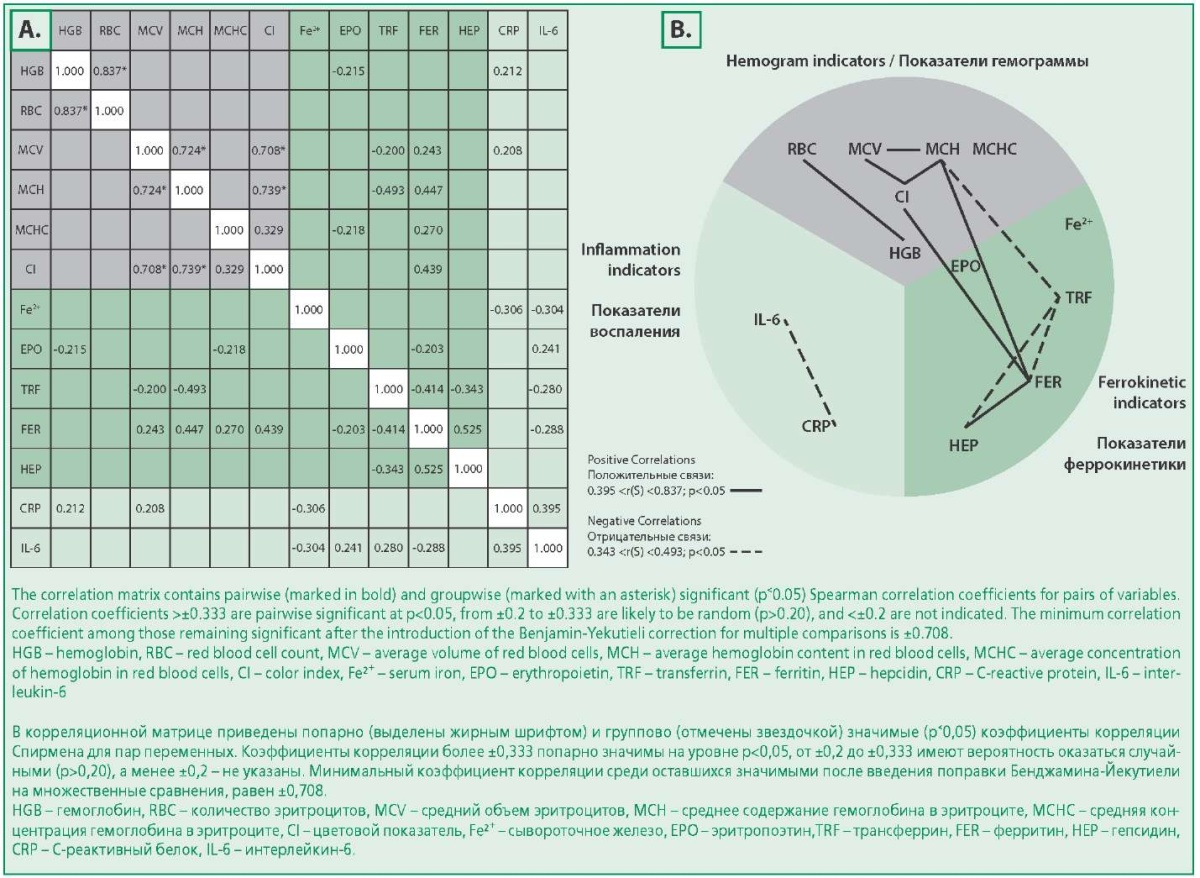
Figure 2. Matrices of correlation coefficients [r(S)] between hepcidin levels and hemogram parameters, ferrokinetics, inflammation in chronic heart failure patients without anemia (A) and graphic diagrams of pairwise significant correlations in the chronic heart failure group without anemia, demonstrating relationships between hemogram, ferrokinetics and inflammation parameters (B)
Рисунок 2. Матрицы коэффициентов корреляций [r(S)] между уровнями гепсидина и показателей гемограммы, феррокинетики, воспаления у больных ХСН без анемии (A) и графические диаграммы попарно значимых корреляций в группе ХСН без анемии, демонстрирующие связи между показателями гемограммы, феррокинетики и воспаления (B)
Одновременно с этим связи между показателями феррокинетики, выявленными в контрольной группе (положительная между гепсидином и сывороточным железом, отрицательная между ферритином и эритропоэтином), утрачиваются. При этом появляются отрицательные связи трансферрина с ферритином и гепсидином, положительная связь ферритина с гепсидином, которых не было в контрольной группе. То есть формируется новая – «воспалительная» триада «ферритин-трансферрин-гепсидин», все показатели которой являются белками острой фазы воспаления, образующие связи с показателями гемограммы.
Также в группе ХСН без АХЗ появляется положительная связь между показателями воспаления: СРБ и ИЛ-6, которой не было в контрольной группе.
Корреляционный анализ между показателями гемограммы, феррокинетики и воспаления в группе ХСН с АХЗ
На рис. 3 показано взаимодействие связей у больных в группе ХСН с АХЗ. Из расположения значимых коэффициентов корреляции видно, что показатели гемограммы – HGB, RBC, MCV, MCH, MCHC и ЦП по-прежнему имеют тесные связи внутри группы, воспалительная триада «ферритин-трансферрин-гепсидин» сохраняется, а связи в ней (положительные между ферритином и гепсидином, отрицательные между трансферрином и ферритином, трансферрином и гепсидином) усиливаются. При этом показатели феррокинетики образуют многочисленные связи с показателями гемограммы и воспаления: образуются значимые корреляции СРБ с ферритином и гепсидином (положительные), трансферрином (отрицательная), а также с ИЛ-6 (положительная), а ИЛ-6 образует положительные связи с ферритином и эритропоэтином. В группе ХСН без АХЗ названные связи слабые, или их не было.
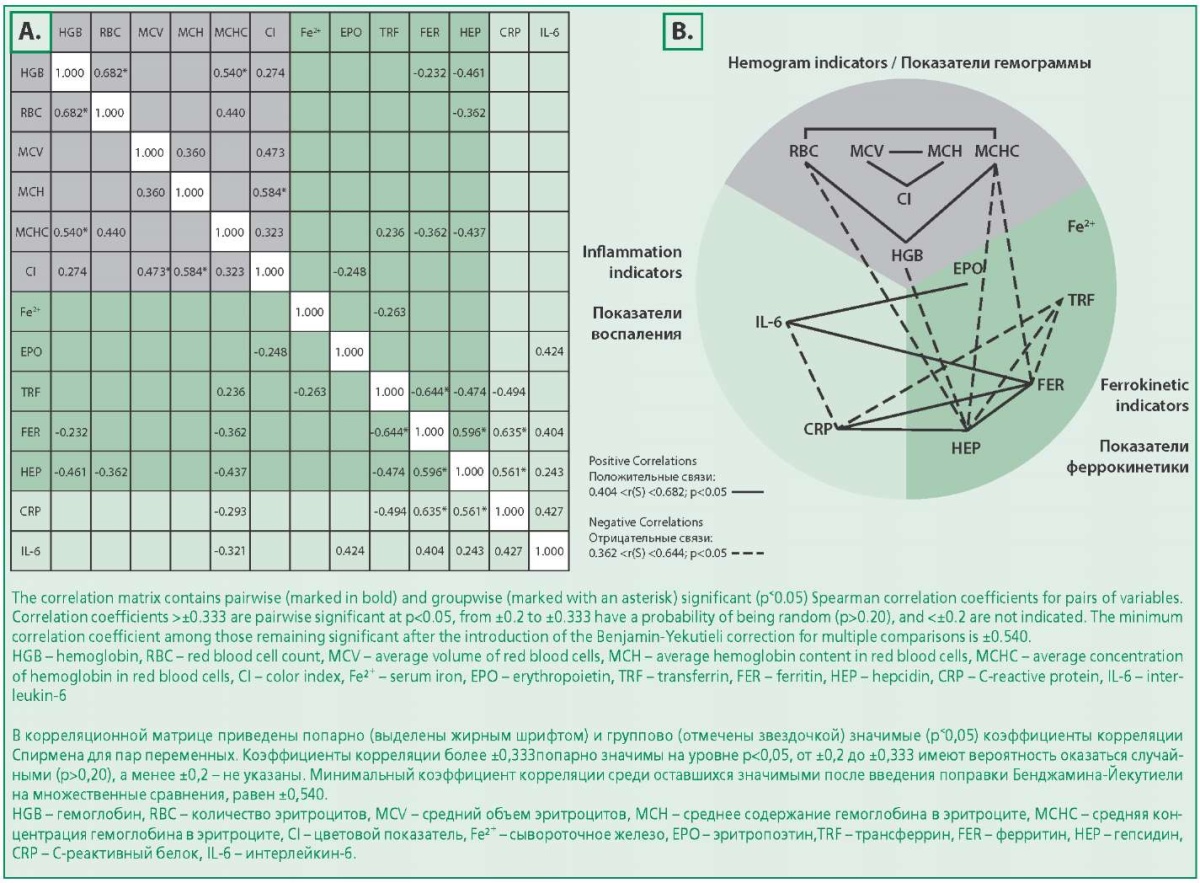
Figure 3. Matrices of correlation coefficients [r(S)] between hepcidin levels and indicators of hemogram, ferrokinetics and inflammation in patients with chronic heart failure with anemia of chronic diseases (A) and graphic diagrams of pairwise significant correlations in the group of chronic heart failure with anemia of chronic diseases, demonstrating links between hemogram, ferrokinetic and inflammation measures (B)
Рисунок 3. Матрицы коэффициентов корреляций [r(S)] между уровнями гепсидина и показателей гемограммы, феррокинетики и воспаления у больных ХСН с АХЗ (A) и графические диаграммы попарно значимых корреляций в группе ХСН с АХЗ, демонстрирующие связи между показателями гемограммы, феррокинетики и воспаления (B)
Обсуждение
По данным литературы в развитии анемии у больных ХСН могут участвовать различные факторы, обуславливающие снижение содержания железа в организме: микрокровопотери вследствие применения антиагрегантов и антикоагулянтов, недостаточное потребление железа с пищей из-за снижения аппетита, мальабсорбция из-за снижения всасываемости слизистой желудочно-кишечного тракта, необходимость повторного забора крови из-за тяжести состояния, гемодилюция, при этом у больных пожилого и старческого возраста вероятна комбинация несколько факторов [6][9][29][30]. Но вклад перечисленных факторов в развитие анемии у больных ХСН с АХЗ не следует считать существенным, так как они имели место и у больных ХСН без анемии, поскольку по тяжести ХСН сравниваемые группы были сопоставимы.
Снижение синтеза эритропоэтина вследствие сниженной перфузии почек при ХСН, как еще один возможный механизм развития АХЗ, также не очевиден, так как у больных ХСН с АХЗ по сравнению с больными ХСН без анемии выявлен значимо повышенный уровень эритропоэтина. Известно, что системная гипоксия, гипотония и активация ренин-ангиотензин-альдостероновой системы, свойственные тяжелой ХСН, могут оказать большее влияние на увеличение синтеза эритропоэтина [12][31], чем сниженная перфузия почек вследствие сниженного сердечного выброса и негативное влияние цитокинов на снижение синтеза эритропоэтина [32]. Увеличение уровня эритропоэтина может быть вызвано и ишемическим повреждением костного мозга вследствие системной гипоксии и нарушении им захвата эритропоэтина [10]. Но, несмотря на повышенные уровни эритропоэтина, компенсации анемии не происходит, что, возможно, объясняется развитием резистентности к эритропоэтину под влиянием цитокинов [16].
Очевидно, основной причиной развития АХЗ у больных ХСН пожилого и старческого возраста следует считать системное воспаление, характерное по данным литературы для ХСН [13-15][33][34], выраженность которого коррелирует с тяжестью ХСН [8][32] и которое вызывает активацию иммунитета и дефицит железа [30]. Сказанное подтверждают выявленные у больных ХСН с АХЗ повышенные уровни провоспалительного цитокина ИЛ-6, а также белков острой фазы воспаления: ферритина, СРБ и гепсидина, и его повышенный уровень отличает АХЗ от ЖДА [6][33]. Nemeth E. и соавт. считают, что даже при очень легких хронических воспалительных состояниях умеренного избытка гепсидина может быть достаточно, чтобы нарушить баланс и привести к дефициту железа и развитию АХЗ [4]. Кроме того, процесс старения сопровождается изменением метаболизма железа и более высокими уровнями гепсидина с параллельным повышением уровней ИЛ-6 и СРБ [35], а выраженное воспаление, как показано K. Suega и G.R. Widiana [36], сопровождается высокими уровнями гепсидина и значимыми корреляциями с маркерами воспаления: СРБ и ИЛ-6.
В связи с тем, что повышенные уровни гепсидина, так же, как и СРБ, были выявлены только у больных ХСН с АХЗ и не выявлены у больных ХСН без анемии, при этом на момент госпитализации по тяжести ХСН сравниваемые группы были сопоставимы, очевидно, определяющим для развития АХЗ у больных ХСН является не тяжесть ХСН на момент госпитализации, а большая длительность ХСН, большая частота госпитализаций по поводу декомпенсаций, а также большая частота пневмоний, что усугубляет воспаление, присущее больным в декомпенсации ХСН [15]. Вероятно, названные причины и приводят к постоянной цитокиновой агрессии, обуславливающей повышенный синтез белков острой фазы воспаления – ферритина, СРБ и гепсидина.
Ранее были показаны связи между дефицитом железа и частотой повторных госпитализаций [37], развитием анемии и декомпенсации ХСН [38], анемией и более длительным пребыванием в стационаре [23]. Арутюнов А. Г. и соавт. показали, что большая частота пневмоний является особенностью российской популяции больных с декомпенсацией ХСН, причем, пневмонии часто вовремя не диагностируются, а наличие их повышает риск повторных госпитализаций на 75% [39].
Поэтому, с учетом большей частоты госпитализаций из-за декомпенсаций, а также большей длительности ХСН, выявленных у больных ХСН с АХЗ, чем у больных ХСН без анемии, следует считать, что больные ХСН с АХЗ, очевидно, постоянно находятся в состоянии хронического воспаления, которое усугубляется при декомпенсации ХСН, а также при развитии пневмоний и других воспалительных заболеваний (мочевой инфекции, трофических язв), и это состояние хронического воспаления, очевидно, сохраняется и в период между госпитализациями, а АХЗ является следствием этого хронического воспалительного процесса. Ранее M. Boulogne и соавт. показали, что воспалительный ответ у больных с декомпенсацией ХСН сохраняется до одного месяца после выписки из стационара, несмотря на нормализацию NT-proBNP [15]. D’Angelo G. и соавт. считают, что если воспаление присутствует в течение многих лет, то постепенно развивается дефицит железа [6].
Выявление повышенных уровней ИЛ-6 у больных ХСН c АХЗ и у больных ХСН без анемии подтверждает хроническую активацию иммунной системы, присущую декомпенсации ХСН [8], независимо от наличия или отсутствия анемии. Поэтому у больных ХСН с АХЗ, так же, как и у больных ХСН без анемии, относительно контрольной группы значимо повышены уровни ферритина, отражающего не только запасы железа в депо, но и являющегося белком острой фазы воспаления. Но выраженность системного воспалительного ответа у больных ХСН с АХЗ, очевидно, больше и длительнее.
Так как синтез гепсидина осуществляется под влиянием преимущественно ИЛ-6 [5-9], остается неясным, почему при повышенном уровне ИЛ-6 в обеих сравниваемых группах уровень гепсидина у больных ХСН без анемии не повышен? Очевидно, это связано с тем, что синтез гепсидина регулируется не только воспалением, но и накоплением железа и активностью эритропоэза [9][16][20]. Также нельзя исключить участие в синтезе гепсидина других провоспалительных цитокинов, в частности, ИЛ-1β, фактора некроза опухоли α, что показано Е.И. Ткаченко и соавт. [40], но это не исследовалось в данной работе.
Нельзя не учитывать и влияние возраста пациентов на развитие анемии как дополнительного фактора, поскольку старение организма связано с низкими уровнями трансферрина и повышенными уровнями ферритина, гепсидина, ИЛ-6 и СРБ [35].
Выявления лишь факта повышенного уровня гепсидина недостаточно для понимания его влияния на все звенья развития АХЗ у больных ХСН пожилого и старческого возраста.
Результаты проведенного рангового корреляционного анализа позволили проанализировать влияние гепсидина на показатели гемограммы, феррокинетики и воспаления в каждой группе больных и оценить его роль не только как регулятора метаболизма железа, но и как медиатора воспаления.
С учетом полученных данных следует считать, что у пациентов контрольной группы, то есть, в отсутствии ХСН и анемии, гепсидин, имея нормальные уровни, реализует свою роль регулятора метаболизма железа через положительную связь с сывороточным железом, и уже через него регулирует уровень гемоглобина, поскольку не имеет прямых связей ни с одним из показателей гемограммы, в том числе – с гемоглобином.
В группе ХСН без анемии гепсидин, имея также нормальные уровни, реализует свою роль регулятора метаболизма железа через положительную связь с ферритином и отрицательную связь с трансферрином. При этом, так как ферритин, трансферрин и гепсидин являются белками острой фазы воспаления, намечается и роль гепсидина как медиатора воспаления, но явной роли медиатора воспаления гепсидин, очевидно, не проявляет, поскольку отсутствуют связи гепсидина с показателями воспаления.
В группе ХСН с АХЗ гепсидин, имея повышенные уровни, образует пять значимых корреляций с показателями гемограммы, феррокинетики и воспаления, что очевидно, отражает роль гепсидина и как регулятора метаболизма железа, поскольку через положительную связь с ферритином увеличивается депо железа, а через отрицательную связь с трансферрином уменьшается транспорт железа, но и как медиатора воспаления, То есть, гепсидин, реагируя на системное воспаление у больных ХСН с АХЗ, становится ключевой фигурой, поскольку на нем замыкаются различные связи, образуя «мостики» между показателями гемограммы, феррокинетики и воспаления.
Ранее связи гепсидина с показателями гемограммы, феррокинетики и воспаления у пациентов с АХЗ исследовались многими авторами [16][36][41]. Так, повышенные уровни гепсидина и отрицательная корреляция гепсидина с гемоглобином выявлена K. Vander Putten и соавт. [16], положительная корреляция гепсидина – с показателем феррокинетики ферритином указана этими же авторами [16], а также K. Suega и G.R. Widiana [36], W.P. den Elzen и соавт. [41].
Однако данные по корреляциям гепсидина с показателями воспаления (СРБ и ИЛ-6) противоречивы. Так, K. Vander Putten и соавт. [16] связь между гепсидином и СРБ не нашли (хотя в исследование не включались пациенты с воспалением, и уровень СРБ был низким), а в исследовании W.P. den Elzen и соавт. [41] связь была найдена, причем, сильная. Аналогичные данные по ИЛ-6: в исследовании K. Suega и G.R. Widiana [36] корреляция найдена, а в исследовании W.P. den Elzen и соавт. [41] – нет, причем, в первом исследовании были пациенты среднего возраста (средний возраст 43 года), а во втором – старческого (средний возраст 85 лет).
Поэтому исследования в этом направлении необходимо продолжать, т. к. исследований, в которых, помимо поиска и анализа связей между уровнями гепсидина и уровнями показателей гемограммы, феррокинетики и воспаления, предпринимались бы попытки проследить образование этих связей и тенденций к их образованию от контрольной группы до ХСН, а потом от ХСН до ХСН с АХЗ, что демонстрируют графические диаграммы корреляций, мы не встретили.
Ограничения исследования. Следует подчеркнуть, что данное исследование, имеющее поисковый характер, ограничено небольшой выборкой и преимущественно пожилым и старческим возрастом обследуемых.
Заключение
С учетом противоречивости данных литературы об уровне гепсидина и его роли у больных ХСН с АХЗ, следует отметить, что полученные данные позволяют охарактеризовать роль гепсидина и как регулятора метаболизма железа, и как медиатора воспаления именно у больных ХСН пожилого и преимущественно старческого возраста (медиана возраста 84 года), с «продвинутыми» стадиями ХСН, длительно болеющих, с низкой приверженностью к лечению (на что указывают частые госпитализации), имевших на момент их включения в исследование не только декомпенсацию ХСН, но и осложнения в виде различных воспалительных заболеваний. Полученные данные также позволяют предполагать, что роль гепсидина как регулятора метаболизма железа и медиатора воспаления может сохраняться до старческого возраста.
Отношения и Деятельность: нет.
Relationships and Activities: none.
Финансирование: Исследование проведено при поддержке Сеченовского Университета.
Funding: The study was performed with the support of the Sechenov University.
Список литературы
1. Park CH, Valore EV, Waring AJ, Ganz T. Hepcidin, a Urinary Antimicrobial Peptide Synthesized in the Liver. J Biol Chem. 2001;276(11):7806-10. DOI:10.1074/jbc.M008922200.
2. Camaschella С. Iron and hepcidin: a story of recycling and balance. Hematology Am Soc Hematol Educ Program. 2013;2013:1-8. DOI:10.1182/asheducation-2013.1.1.
3. Arezes J, Nemeth E. Hepcidin and Iron Disorders: New Biology and Clinical Approaches. Int J Lab Hematol. 2015;37(1):92-8. DOI:10.1111/ijlh.12358.
4. Nemeth E, Valore EV, Territo M, et al. Hepcidin, a putative mediator of anemia of inflammation, is a type II acute-phase protein. Blood. 2003;101(7):2461-3. DOI:10.1182/blood-2002-10-3235.
5. Nemeth E, Rivera S, Gabayan V, et al. IL-6 mediates hypoferremia of inflammation by inducing the synthesis of the iron regulatory hormone hepcidin. J Clin Invest. 2004;113(9):1271-6. DOI:10.1172/JCI20945.
6. D’Angelo G. Role of hepcidin in the pathophysiology and diagnosis of anemia. Blood Res. 2013;48(1):10-5. DOI:10.5045/br.2013.48.1.10.
7. Drakesmith H, Prentice AM. Hepcidin and the iron-infection axis. Science. 2012;338(6108):768-72. DOI:10.1126/science.1224577.
8. Briasoulis A, Androulakis E, Christophides T, Tousoulis D. The Role of Inflammation and Cell Death in the Pathogenesis, Progression and Treatment of Heart Failure. Heart Fail Rev. 2016;21(2):169-76. DOI:10.1007/s10741-016-9533-z.
9. Matsumoto M, Tsujino T, Lee-Kawabata M, et al. Iron Regulatory Hormone Hepcidin Decreases in Chronic Heart Failure Patients With Anemia. Circ J. 2010;74(2):301-6. DOI:10.1253/circj.cj-09-0663.
10. Anand IS, Rector TS. Pathogenesis of Anemia in Heart Failure. Circ Heart Fail. 2014;7(5):699-700. DOI:10.1161/CIRCHEARTFAILURE.114.001645.
11. Weiss G, Goodnough LT. Anemia of chronic disease. N Engl J Med. 2005;352(10):1011-23. DOI:10.1056/NEJMra041809. PMID: 15758012.
12. Leong W, Lönnerdal B. Hepcidin, the Recently Identified Peptide That Appears to Regulate Iron Absorption. J Nutr. 2004;134(1):1-4. DOI:10.1093/jn/134.1.1.
13. Dick SA, Epelman S. Chronic Heart Failure and Inflammation What Do We Really Know? Circ Res. 2016;119(1):159-76. DOI:10.1161/CIRCRESAHA.116.308030.
14. Hage C, Michaëlsson E, Linde C, et al. Inflammatory Biomarkers Predict Heart Failure Severity and Prognosis in Patients With Heart Failure With Preserved Ejection Fraction A Holistic Proteomic Approach. Circ Cardiovasc Genet. 2017;10(1):e001633. DOI:10.1161/CIRCGENETICS.116.001633.
15. Boulognea M, Sadouneb M, Launaybc JM, et al. Inflammation versus mechanical stretch biomarkers over time in acutely decompensated heart failure with reduced ejection fraction. Int J Cardiol. 2017;226:53-59. DOI:10.1016/j.ijcard.2016.10.038.
16. Van der Putten K, Jie KE, Van den Broek D, et al. Hepcidin-25 is a marker of the response rather than resistance to exogenous erythropoietin in chronic kidney disease/chronic heart failure patients. Eur J Heart Fail. 2010;12(9):943-50. DOI:10.1093/eurjhf/hfq099.
17. Divakaran V, Mehta S, Yao D, et al. Hepcidin in anemia of chronic heart failure. Am J Hematol. 2011;86(1):107-9. DOI:10.1002/ajh.21902.
18. Jankowska ЕА, Malyszko J, Ardehali H, et al. Iron status in patients with chronic heart failure. Eur Heart J. 2013;34(11):827-34. DOI:10.1093/eurheartj/ehs377.
19. Подзолков В.И., Драгомирецкая Н.А., Столбова С.К., Русинов И.С. Ассоциации уровней NT-proBNP и гепсидина с клинико-лабораторными параметрами у больных хронической сердечной недостаточностью с разной степенью систолической дисфункции левого желудочка. Кардиоваскулярная Терапия и Профилактика. 2020;19(4):2587. DOI:10.15829/1728-8800-2020-2587.
20. Nemeth E. Targeting the Hepcidin-Ferroportin Axis in the Diagnosis and Treatment of Anemias. Adv Hematol. 2010;2010:750643. DOI:10.1155/2010/750643.
21. Lanser L, Fuchs D, Scharnagl H, et al. Anemia of Chronic Disease in Patients With Cardiovascular Disease. Front Cardiovasc Med. 2021;8:666638. DOI:10.3389/fcvm.2021.666638.
22. Muzzarelli S, Pfisterer M, TIME Investigators. Anemia as Independent Predictor of Major Events in Elderly Patients With Chronic Angina. Am Heart J. 2006;152(5):991-6. DOI:10.1016/j.ahj.2006.06.014.
23. Caughey MC, Avery CL, Ni H, et al. Outcomes of patients with anemia and acute decompensated heart failure with preserved versus reduced ejection fraction (from the ARIC study community surveillance). Am J Cardiol. 2014;114(12):1850-4. DOI:10.1016/j.amjcard.2014.09.024.
24. Muñoz M, García-Erce JA, Remacha AF. Disorders of Iron Metabolism. Part II: Iron Deficiency and Iron Overload. J Clin Pathol. 2011;64(4):287-96. DOI:10.1136/jcp.2010.086991.
25. Cook JD. Diagnosis and Management of Iron-Deficiency Anaemia. Best Pract Res Clin Haematol. 2005;18(2):319-32. DOI:10.1016/j.beha.2004.08.022.
26. Drozd M, Jankowska EA, Banasiak W, Ponikowski P. Iron Therapy in Patients With Heart Failure and Iron Deficiency: Review of Iron Preparations for Practitioners. Am J Cardiovasc Drugs. 2017;17(3):183-201. DOI:10.1007/s40256-016-0211-2.
27. Inker LA, Astor BC, Fox CH, et al. KDOQI US commentary on the 2012 KDIGO clinical practice guideline for the evaluation and management of CKD. Am J Kidney Dis. 2014;63(5):713-35. DOI:10.1053/j.ajkd.2014.01.416.
28. Benjamini Y, Yekutieli D. The control of the false discovery rate in multiple testing under dependency. Annals of Statistics. 29(4):1165-1188. DOI:10.1214/aos/1013699998.
29. Nanas JN, Matsouka C, Karageorgopoulos D, et al. Etiology of Anemia in Patients With Advanced Heart Failure. J Am Coll Cardiol. 2006;48(12):2485-9. DOI:10.1016/j.jacc.2006.08.034.
30. Nairz M, Theurl I, Wolf D, Weiss G. Iron deficiency or anemia of inflammation? Differential diagnosis and mechanisms of anemia of inflammation. Wien Med Wochenschr. 2016;166(13-14):411-423. DOI:10.1007/s10354-016-0505-7.
31. Nagai T, Nishimura K, Honma T, et al., NaDEF investigators. Prognostic Significance of Endogenous Erythropoietin in Long-Term Outcome of Patients With Acute Decompensated Heart Failure. Eur J Heart Fail. 2016;18(7):803-13. DOI:10.1002/ejhf.537.
32. Nicolas G, Viatte L, Bennoun M, et al. Hepcidin, a new iron regulatory peptide. Blood Cells Mol Dis. 2002;29(3):327-35. DOI:10.1006/bcmd.2002.0573.
33. Wendy PJ, den Elzen, Anton JM, et al. Plasma hepcidin levels and anemia in old age. The Leiden 85-Plus Study. Haematologica. 2013;98(3):448-54. DOI:10.3324/haematol.2012.068825.
34. Cowie MR, Wood DA, Coats AJ, et al. Survival of Patients With a New Diagnosis of Heart Failure: A Population Based Study. Heart. 2000;83(5):505-10. DOI:10.1136/heart.83.5.505.
35. Picca A, Mankowski RT, Kamenov G, et al. Advanced Age Is Associated with Iron Dyshomeostasis and Mitochondrial DNA Damage in Human Skeletal Muscle. Cells. 2019;8(12):1525. DOI:10.3390/cells8121525.
36. Suega K, Widiana GR. Predicting hepcidin level using inflammation markers and iron indicators in patients with anemia of chronic disease. Hematol Transfus Cell Ther. 2019;41(4):342-348. DOI:10.1016/j.htct.2019.03.011.
37. Núñez J, Comín-Colet J, Miñana G, et al. Iron deficiency and risk of early readmission following a hospitalization for acute heart failure. Eur J Heart Fail. 2016;18(7):881. DOI:10.1002/ejhf.588.
38. Ларина В.Н., Барт Б.Я., Балабанова Э.Л. Анемический синдром у больных с хронической сердечной недостаточностью. Российский Кардиологический Журнал. 2010;(3):34-40.
39. Арутюнов А.Г., Рылова А.К., Арутюнов Г.П. Регистр госпитализированных больных декомпенсацией кровообращения (Павловский регистр). Сообщение 1. Современная клиническая характеристика пациента с декомпенсацией кровообращения. Клинические фенотипы больных. Сердечная Недостаточность. 2014;82(1):23-32.
40. Ткаченко Е.И., Боровкова Н.Ю., Буянова М.В., Боровков Н.Н. Цитокин-индуцированное воспаление при анемии у больных хронической сердечной недостаточностью. Клиническая медицина. 2020;98(2):122-9. DOI:10.30629/0023-2149-2020-98-2-122-129.
41. den ElzenWP, deCraen AJ, Wiegerinck ET, et al. Plasma hepcidin levels and anemia in old age. The Leiden 85-Plus Study. Haematologica. 2013;98(3):448-54. DOI:10.3324/haematol.2012.068825.
Об авторах
Н. И. СоломахинаРоссия
Соломахина Нина Иосифовна
Москва
А. С. Лишута
Россия
Лишута Алексей Сергеевич
eLibrary SPIN4365-4788
Москва
А. В. Дементьева
Россия
Дементьева Анна Викторовна
Москва
Рецензия
Для цитирования:
Соломахина Н.И., Лишута А.С., Дементьева А.В. Гепсидин как регулятор метаболизма железа и медиатор воспаления у больных пожилого и старческого возраста с хронической сердечной недостаточностью и анемией хронических заболеваний. Рациональная Фармакотерапия в Кардиологии. 2022;18(5):553-563. https://doi.org/10.20996/1819-6446-2022-09-03
For citation:
Solomakhina N.I., Lishuta A.S., Dementieva A.V. Hepcidin as a Regulator of Iron Metabolism and Mediator of Inflammation in Patients with Chronic Heart Failure and Anemia of Chronic Diseases of the Elderly and Senile Age. Rational Pharmacotherapy in Cardiology. 2022;18(5):553-563. (In Russ.) https://doi.org/10.20996/1819-6446-2022-09-03

















































