Перейти к:
Вазотоксические эффекты противоопухолевой терапии: обзор современных данных
https://doi.org/10.20996/1819-6446-2023-03-03
Аннотация
Сердечно-сосудистые и онкологические заболевания занимают лидирующие позиции среди причин смертности взрослого населения в мире. Несмотря на доказанную эффективность, противоопухолевые препараты могут вызывать тяжелые осложнения со стороны сердечно-сосудистой системы. В последнее время появляются данные о возможных вазотоксических эффектах химиопрепаратов, которые могут проявляться прогрессированием артериальной гипертонии и атеросклероза, развитием ишемии миокарда и острого коронарного синдрома, формированием венозного и артериального тромбоза. Ключевым механизмом развития вазотоксичности является дисфункция эндотелия, также противоопухолевые препараты могут влиять на процессы тромбообразования. В обзоре представлены результаты 12 отобранных наблюдательных ретро- и проспективных исследований с участием онкологических пациентов, получающих потенциально вазотоксическую терапию. Представлены данные о частоте возникновения и возможностях профилактики вазотоксичности.
Ключевые слова
Для цитирования:
Васюк Ю.А., Шупенина Е.Ю., Носова А.Г., Новосел Е.О., Выжигин Д.А. Вазотоксические эффекты противоопухолевой терапии: обзор современных данных. Рациональная Фармакотерапия в Кардиологии. 2023;19(2):203-208. https://doi.org/10.20996/1819-6446-2023-03-03
For citation:
Vasyuk Yu.A., Shupenina E.Y., Nosova A.G., Novosel E.O., Vyzhigin D.A. Vasotoxic Effects of Anticancer Therapy: a Review of Current Data. Rational Pharmacotherapy in Cardiology. 2023;19(2):203-208. (In Russ.) https://doi.org/10.20996/1819-6446-2023-03-03
Введение
Сердечно-сосудистые и онкологические заболевания уже многие годы остаются лидирующими причинами смертности среди взрослого населения в мире. Согласно статистическим данным Всемирной организации здравоохранения ежегодно от сердечно-сосудистой патологии погибает около 18 млн. человек, от онкозаболеваний более 9 млн. [1]. Несмотря на доказанную эффективность, химиотерапевтические препараты могут вызывать тяжелые осложнения со стороны сердечно-сосудистой системы, такие как систолическая дисфункция левого желудочка, кардиомиопатии, перикардит, нарушения ритма и проводимости. В последнее время появляются данные о потенциальных вазотоксических эффектах противоопухолевых препаратов, что проявляется прогрессированием артериальной гипертонии (АГ), ишемической болезни сердца (ИБС) и заболеваний периферических артерий, развитием микроваскулярной и вазоспастической стенокардии, формированием венозного или артериального тромбоза [2].
Одним из ключевых механизмов развития вазотоксичности химиопрепаратов является эндотелиальная дисфункция – нарушение синтеза эндотелиальных факторов, приводящее к дисбалансу вазоконстрикторной и вазодилатирующей регуляции сосуда, нарушению сосудистого тонуса. В ряде исследований показано, что фторпиримидины и препараты платины подавляют активность эндотелиальной синтазы оксида азота (NO), в результате чего активируется вазоконстрикция в сочетании с прямым повреждением эндотелиоцитов продуктами распада и избыточным высвобождением эндотелина-1 (ET-1) и других факторов [1][3-5].
Повреждая клеточные митохондрии, антрациклины нарушают энергетические процессы в эндотелиоцитах, подавляют их функции и ускоряют процесс апоптоза. Это приводит к потере вазорелаксантных эффектов и подавлению противовоспалительных и сосудистых репаративных функций, что может служить стимулом для инициирования и дальнейшего прогрессирования атеросклероза [6][7].
Ингибирование циркулирующего фактора роста эндотелия сосудов (VEGF) моноклональными антителами и блокирование рецепторов VEGF используется для лечения большого количества онкологических заболеваний, включая рак почки, щитовидной железы, гепатоцелюллярный рак. Однако химиопрепараты, обладающие такими свойствами, ассоциированы с широким спектром сосудистых осложнений, таких как АГ, инфаркт миокарда, острые венозные и артериальные тромбозы [8]. Ингибиторы VEGF подавляют синтез NO и простагландина I2, обладающего вазодилатирующими свойствами, стимулируют образование ET1, что приводит к развитию дисфункции эндотелия (ДЭ), повышению общего периферического сопротивления сосудов и, как следствие, прогрессированию АГ [9-12]. По данным исследований повышение артериального давления (АД) выявляется у 80% онкологических пациентов, получающих данную терапию [13]. Некоторые ингибиторы тирозинкиназы (нилотиниб) активируют процессы периваскулярного фиброза, оказывают проатерогенное действие, способствуя развитию бессимптомной периферической артериальной окклюзионной болезни (ПАОБ) нижних конечностей [14-16].
У онкологических пациентов, получающих полихимиотерапию (ПХТ), эндотелиальная дисфункция, как правило, сопровождается повреждением сосудистой стенки, замедлением кровотока и гиперкоагуляцией, что в конечном счете приводит к развитию протромботического состояния, варьирующего от бессимптомного изменения лабораторных тестов до массивного венозного и артериального тромбоза [17]. Важная роль в развитии тромбоза при опухолевых заболеваниях принадлежит гиперактивации тромбоцитов. Основными способами взаимодействия опухолевой клетки с системой гемостаза является выработка особых молекул, обладающих прокоагулянтной и фибринолитической активностью, таких как тканевой фактор и раковый прокоагулянт, продукция провоспалительных цитокинов, снижение синтеза естественных антикоагулянтов (протеина С и антитромбина III). Факторами риска венозного тромбоэмболизма (ВТЭ) у онкологических пациентов являются: первичная локализация опухоли (чаще поджелудочная железа, головной мозг, желудок, почки, легкие, лимфома, миеломная болезнь), факторы, связанные с пациентом (пожилой и старческий возраст, женский пол, этническая принадлежность, коморбидность, предшествующие тромбозы и тромбоэмболии). Не меньшее влияние оказывают факторы, связанные с противоопухолевым лечением: недавнее хирургическое вмешательство, текущая госпитализация, проведение ПХТ, гормональной терапии, использование препаратов, стимулирующих эритропоэз, гемотрансфузии, наличие катетера в центральной вене. Назначение ПХТ сопровождается 6-7 кратным увеличением риска ВТЭ. Среди противоопухолевых препаратов наибольшее влияние на процессы тромбообразования оказывают ингибиторы VEGF (бевацизумаб), ингибиторы тирозинкиназы (нилотиниб, сунитиниб), алкилирующие агенты (цисплатин) [18-21].
В отличие от ВТЭ данные о развитии артериального тромбоза у онкологических пациентов немногочисленны. Точные механизмы ассоциированного с раком артериального тромбоза остаются неясными, однако ведущая роль в развитии протромботического состояния отводится нарушениям активации и агрегации тромбоцитов, индуцированным опухолевыми клетками. Артериальный тромбоз часто возникает у пациентов с атеросклерозом, может развиваться в любых сосудистых бассейнах, что приводит к развитию инфаркта миокарда, ишемическому инсульту, острой ишемии конечностей. В последнее время все больше данных указывает и на спонтанный артериальноый тромбоз без выраженного атеросклеротического процесса. Противоопухолевая терапия на основе платины (цисплатин), ингибиторов VEGF (бевацизумаб), ингибиторы тирозинкиназы (сорафениб/ сунитиниб/ пазопаниб), также связана с повышенной частотой артериального тромбоза [22-23].
Несмотря на проведенные исследования, механизмы развития вазотоксичности противоопухолевых препаратов остаются до конца неизученными. Данные о частоте возникновения и возможности профилактики у онкологических пациентов таких осложнений химиотерапии, как инфаркт миокарда, острое нарушение мозгового кровообращения, острая ишемия нижних конечностей, АГ, противоречивы и немногочисленны. В связи с этим целью данного обзора являлся анализ результатов исследований, проведенных с 2017 г. по настоящее время, с участием онкологических больных, получающих предположительно вазотоксическую химиотерапию.
Методы поиска данных
Поиск проводился в базах данных PUBMED, MEDLINE, Web of Science, E-library, clinicaltrials.gov. Ключевыми словами для поиска являлись: онкологический больной, вазотоксичность, эндотелиальная дисфункция, ВТЭ, артериальный тромбоз, химиотерапия, алкилирующие агенты, антиметаболиты, ингибиторы тирозинкиназы, VEGF. С целью получения современных данных поиск был ограничен последними 5 годами. В обзор включались исследования с участием не менее 30 онкологических пациентов, периодом наблюдения не менее 6 мес, с назначением моно- или ПХТ. При написании обзора использовался стандарт PRISMA 2020.
Результаты
Первоначальный поиск выявил 119 работ, 54 из них соответствовали теме, но являлись описанием клинического случая с участием одного пациента (рис. 1). Полностью всем критериям отбора удовлетворяло 12 исследований (табл. 1). В окончательный анализ вошли результаты наблюдения 142 164 онкологических пациентов, 140 025 кардиологических больных, сопоставимых по возрасту и сопутствующей кардиальной патологии, 25 здоровых добровольцев.
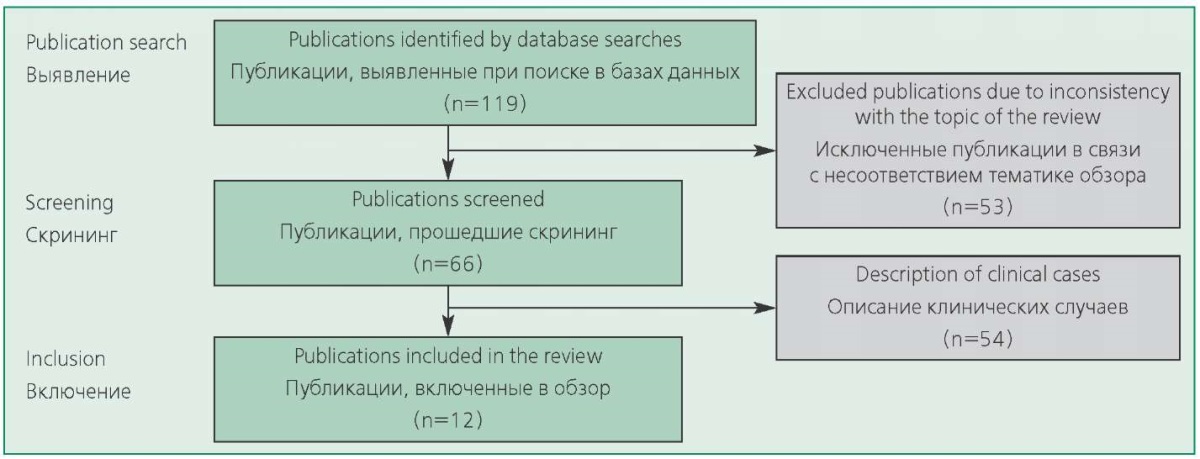
Figure 1. Scheme for selecting studies for a review
Рисунок 1. Схема отбора исследований в обзор
Table 1. Eligible Studies
Таблица 1. Исследования, удовлетворявшие критериям отбора
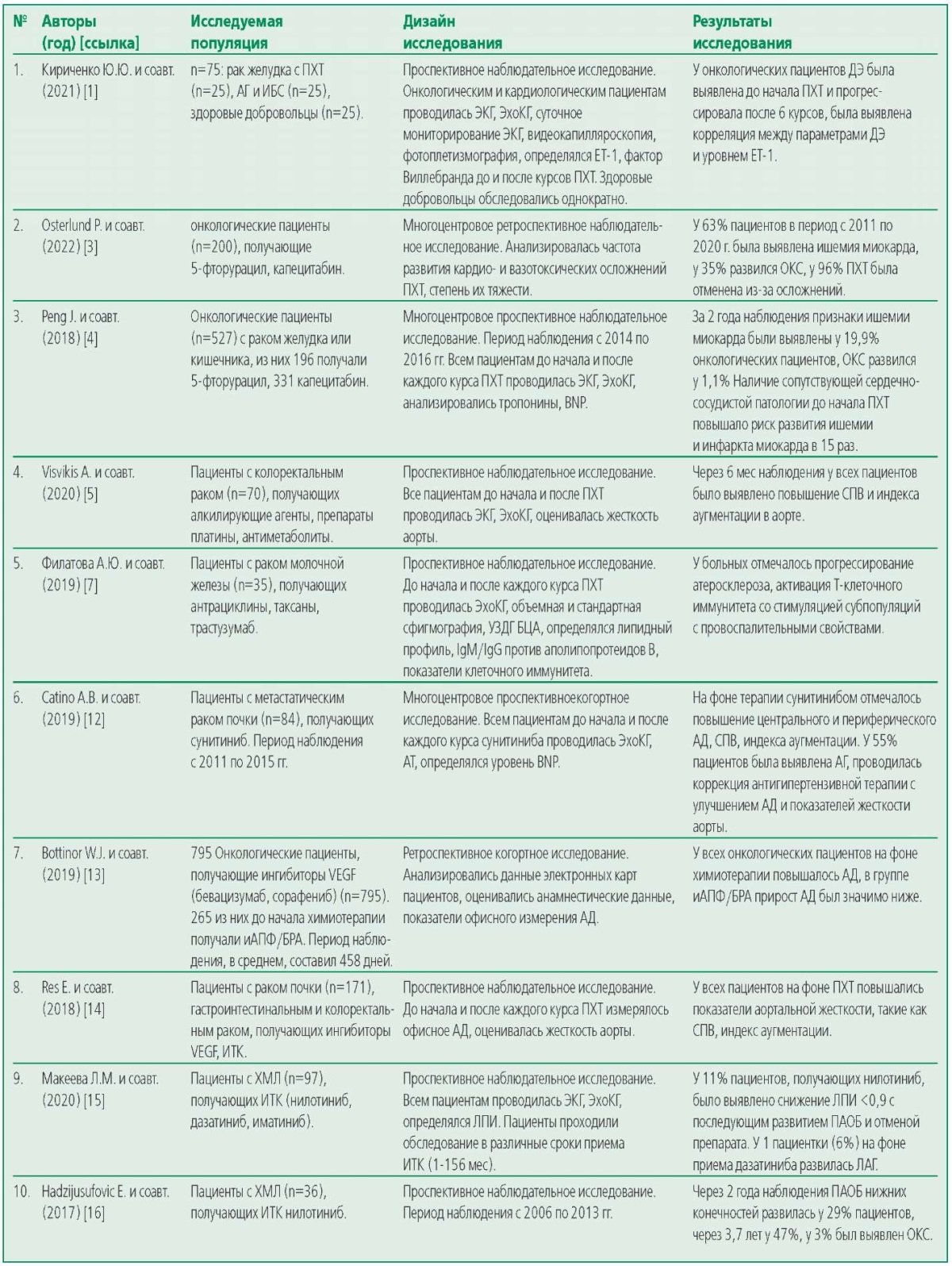
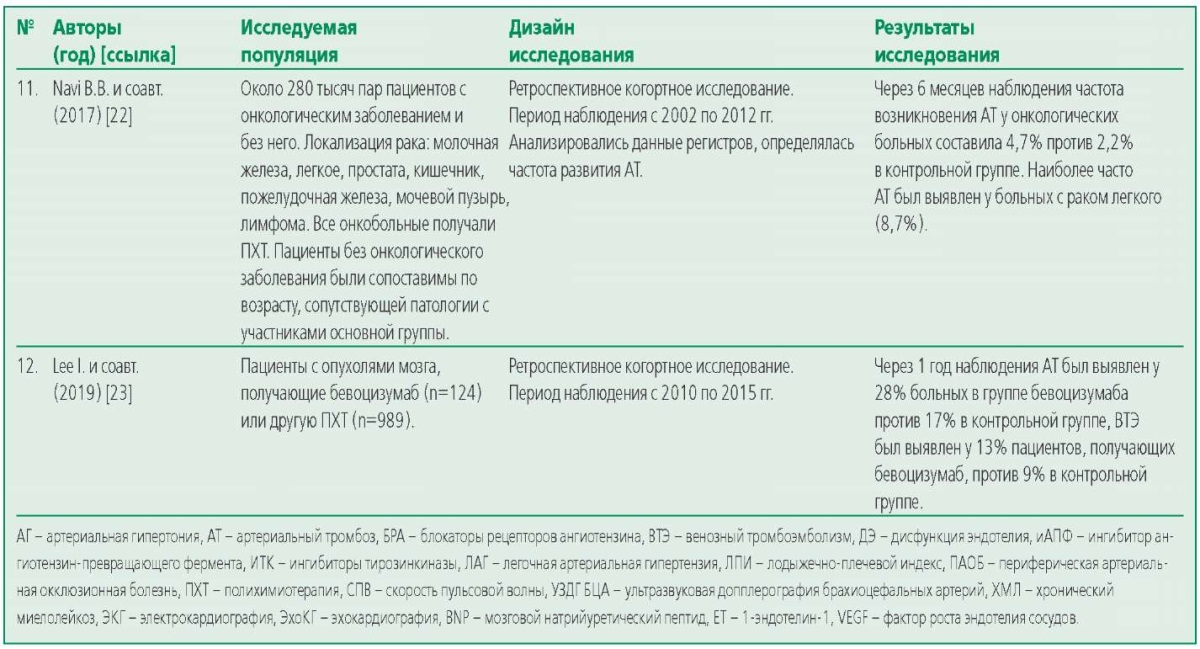
При анализе полученных данных обращал на себя внимание наблюдательный характер отобранных исследований, 4 из них являлись ретроспективными. Ретроспективное наблюдение позволяет анализировать данные большого количества пациентов. Так в работе B. Navi и соавт. были использованы медицинские карты 279 917 пар онкологических и кардиологических пациентов, сопоставимых по возрасту и сопутствующей патологии, из регистра SEER (Surveillance, Epidemiology, End Results) и базы данных Medicare (США) [22]. Через 6 мес наблюдения частота артериального тромбоза у онкологических пациентов, получавших ПХТ, составила 4,7% (95% доверительный интервал (ДИ) 4,6-4,8) против 2,2% (95% ДИ 2,1-2,2) у кардиологических. Инфаркт миокарда развился у 2,0% (95% ДИ 1,92,0) в основной группе против 0,7% (95% ДИ 0,60,7) в контрольной, острое нарушение мозгового кровообращения – у 3,0% (95% ДИ 2,9-3,1) против 1,6% (95% ДИ 1,6-1,7), соответственно. Наиболее часто артериальный тромбоз регистрировался у больных раком легкого, получавших алкилирующие агенты, антиметаболиты, антрациклины, в 8,3% (95% ДИ 8,0-8,5) случаев. Авторы исследования связывают более высокую частоту развития острых сердечно-сосудистых состояний с влиянием онкологического процесса и ПХТ на эндотелиальную функцию сосудов и процессы тромбообразования [22].
В ретроспективном исследовании W. Bottinor и соавт., единственном из отобранных, анализировалась не только частота возникновения вазотоксического эффекта противоопухолевых препаратов, но и возможность его профилактики с использованием кардипротективной терапии [13]. Были проанализированы данные 795 онкологических пациентов, получавших ингибиторы VEGF, из них 296 пациентов высокого сердечно-сосудистого риска до начала химиотерапии принимали препараты, влияющие на ренин-ангиотензин-альдостероновую систему. Уже через 6 недель наблюдения прирост систолического АД у онкологических пациентов, профилактически принимавших ингибиторы ангиотензин-превращающего фермента (иАПФ)/блокаторы рецепторов ангиотензина (БРА)/антагонисты альдостерона/прямые ингибиторы ренина, был существенно меньше, чем у больных контрольной группы: 2,46 мм рт.ст. (95% ДИ 0,7-4,2) против 4,56 мм рт.ст. (95% ДИ 3,5-5,6; p=0,034). В дальнейшем, эта тенденция сохранилась. Авторы исследования предполагают, что назначение кардиопротективной терапии до начала противоопухолевого лечения снижает вазотоксические эффекты ингибиторов VEGF [13].
В ретроспективном исследовании I. Lee и соавт. оценивалось влияние ингибитора VEGF бевоцизумаба на частоту развития артериального тромбоза у пациентов с опухолями мозга. В сравнении с химиопрепаратами других классов, бевоцизумаб способствовал более частому развитию артериального тромбоза: 28% в группе больных, получавших бевоцизумаб, против 17% пациентов, получавших другие препараты [23].
Вазотоксическое воздействие 5-фторурацила и капецитабина было проанализировано в многоцентровом ретроспективном исследовании P. Osterlund и соавт. с участием 200 пациентов с раком желудка или кишечника [3]. У 63% участников на фоне химиотерапии были выявлены признаки ишемии миокарда, у 35% развился острый коронарный синдром (ОКС), подавляющему большинству пациентов (96%) была проведена коррекция противоопухолевого лечения в связи с развившейся кардио- и вазотоксичностью. Авторы связывают возникшие осложнения противоопухолевого лечения с токсическим действием препаратов на функцию эндотелия коронарных артерий [3].
Существенно меньшие показатели частоты возникновения ишемии миокарда и ОКС у онкологических пациентов на фоне приема 5-фторурацила и капецитабина были получены в проспективном исследовании J. Peng и соавт. Из 196 участников ишемия миокарда и ОКС развились у 19,9% и 1,1% соответственно, что возможно связано с разным подходом к диагностике данных осложнений [4].
В проспективных исследованиях A. Visvikis и соавт. [5], A. Catino и соавт. [12], E. Res и соавт. [14] было проанализировано влияние препаратов платины, антиметаболитов и ингибиторов тирозинкиназы на жесткость аорты при длительном лечении пациентов с колоректальным раком, метастатическим и первичным поражением почки. Во всех исследованиях отмечалось повышение скорости пульсовой волны (СПВ), аортального индекса аугментации, центрального и периферического АД, что потребовало назначения антигипертензивной терапии.
Существенно разные данные о частоте возникновения ПАОБ нижних конечностей у больных с хроническим миелолейкозом (ХМЛ), принимавших ингибиторы тирозинкиназы (нилотиниб) были получены в проспективных исследованиях Л.М. Макеевой и соавт. [15] и E. Hadzijusufovic и соавт. [16]. В первом случае снижение лодыжечно-плечевого индекса (ЛПИ) <0,9 и развитие ПАОБ было выявлено у 11% пациентов, во втором случае при более длительном наблюдении (2 года) ПАОБ нижних конечностей развилась у 29% больных ХМЛ, а через 3,7 лет — у 47%. Авторы обоих исследований предполагают, что ишемия нижних конечностей возникла вследствие ДЭ и прогрессирования атеросклероза.
В небольшом проспективном исследовании А.Ю. Филатовой и соавт. было показано, что механизмом развития атеросклероза у 35 пациенток с раком молочной железы на фоне терапии антрациклинами, таксанами и трастузумабом является не только ДЭ, но и повышенная активность субпопуляции Т-лимфоцитов с провоспалительными свойствами. Авторы исследования предполагают, что нарушения клеточного иммунитета связаны с провоспалительным влиянием опухоли и ПХТ [7].
Заключение
Большинство противоопухолевых препаратов, используемых для лечения онкологических заболеваний, имеют кардио- и вазотоксические эффекты. Целью данного обзора являлся анализ современных данных о частоте возникновения и возможности профилактики таких сосудистых осложнений химиотерапии, как АГ, ишемия миокарда, ОКС, венозный и артериальный тромбозы, ПАОБ нижних конечностей. Проведенный анализ показал, что все отобранные исследования являлись наблюдательными. Как правило, ретроспективные исследования основывались на большей выборке онкологических пациентов, чем проспективные, что может быть причиной существенного расхождения данных о частоте возникновения вазотоксических осложнений. Только в одном из отобранных исследований оценивалась профилактика вазотоксического эффекта противоопухолевого лечения, что является одним из перспективных направлений для дальнейшего изучения, так как предполагается, что детальное исследование вазотоксических эффектов противоопухолевого лечения позволит расширить спектр кардиопротективной терапии.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Список литературы
1. Кириченко Ю.Ю., Ильгисонис И.С., Иванова Т.В. и др. Кардиоваскулотоксические проявления противоопухолевой терапии: влияние на ремоделирование миокарда и сосудистого русла. Кардиоваскулярная Терапия и Профилактика. 2021;20(7):2923. DOI:10.15829/1728- 8800-2021-2923.
2. Lyon AR, Lopez-Fernandez T, Couch SM, et al. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). Eur Heart J. 2022;23(10):e333-e465. DOI:10.1093/eurheartj/ehac244.
3. Osterlund P, Kinos S, Pfeiffer P, et.al. Continuation of fluoropyrimidine treatment with S-1 after cardiotoxicity on capecitabine- or 5-fluorouracil-based therapy in patients with solid tumours: a multicentre retrospective observational cohort study. ESMO Open. 2022;7(3):100427. DOI:10.1016/j.esmoop.2022.100427.
4. Peng J, Dong C, Wang C, et.al. Cardiotoxicity of 5-fluorouracil and capecitabine in Chinese patients: a prospective study. Cancer Commun. 2018;38(1):22. DOI:10.1186/s40880-018-0292-1.
5. Visvikis A, Kyvelou SM, Pietri P, et.al. Cardiotoxic Profile and Arterial Stiffness of Adjuvant Chemotherapy for Colorectal Cancer. Cancer Manag Res. 2020;12:1175-85. DOI:10.2147/CMAR.S223032.
6. Campia U, Moslehi JJ, Amiri-Kordestani R, et al. Cardio-Oncology: Vascular and Metabolic Perspectives. Circulation. 2019;139(13):e579-e602. DOI:10.1161/CIR.0000000000000641.
7. Филатова А.Ю., Виценя М.В., Потехина А.В., и др. Атеросклероз брахиоцефальных артерий и артериальная жесткость у больных раком молочной железы. Кардиология. 2019;59(1S):43-52.
8. Shah CP, Mareb JS. Cardiotoxicity due to targeted anticancer agents: a growing challenge. Ther Adv Cardiovasc Dis. 2019;13:1753944719843435. DOI:10.1177/1753944719843435.
9. Touyz RM, Herrmann SMS, Herrmann J. Vascular toxicities with VEGF inhibitor therapies–focus on hypertension and arterial thrombotic events. J Am Soc Hypertens. 2018;12(6):409-25. DOI:10.1016/j.jash.2018.03.008.
10. Li M, Kroetz DL. Bevacizumab-Induced Hypertension: Clinical Presentation and Molecular Understanding. Pharmacol Ther. 2018;182:152-60. DOI:10.1016/j.pharmthera.2017.08.012.
11. Cohen JB, Geara AS, Hogan JJ, et al. Hypertension in Cancer Patients and Survivors Epidemiology, Diagnosis, and Management. JACC Cardio Oncol. 2019;1(2):238-51. DOI:10.1016/j.jaccao.2019. 11.009.
12. Catino AB, Hubbard RA, Chirinos JA, et al. Longitudinal assessment of vascular function with sunitinib in patients with metastatic renal cell carcinoma. Circ Heart Fail. 2018;11(3):e 004408. DOI:10.1161/CIRCHEARTFAILURE.117.004408.
13. Bottinor WJ, Shuey MM, Manouchehri A, et al. Renin-Angiotensin-Aldosterone System Modulates Blood Pressure Response During Vascular Endothelial Growth Factor Receptor Inhibition. JACC Cardi Oncol. 2019;1(1):14-23. DOI:10.1016/j.jaccao.2019.07.002.
14. Res E, Kyvelou SM, Vlachopoulos C, et al. Metastatic malignancies and the effect on arterial stiffness and blood pressure levels: the possible role of chemotherapy. Onco Targets Ther. 2018:11:6785-93. DOI:10.2147/OTT.S156318.
15. Макеева Л.М., Емелина Е.И., Быкова А.В. и др. Сравнительный анализ нарушений сердечно-сосудистой системы у пациентов с хроническим миелолейкозом на фоне лечения ингибиторами тирозинкиназы. Клиническая Онкогематология. 2020;13(1):104-11. DOI:10.21320/2500-2139-2020-13-1-104-111.
16. Hadzijusufovic E, Albrecht-Schgoer K, Huber K, et al. Nilotinib-induced vasculopathy: identification of vascular endothelial cells as a primary target site. Leukemia. 2017;31(11):2388-97. DOI:10.1038/leu.2017.245.
17. Kim AS, Khorana AA, McCrae KR. Mechanisms and biomarkers of cancer-associated thrombosis. Transl Res. 2020;225:33-53. DOI:10.1016/j.trsl.2020.06.012.
18. Плохова Е. В., Дундуа Д. П. Проблема тромбоза у пациентов со злокачественными заболеваниями. Кардиология. 2018;58(S9):19-28. DOI:10.18087/cardio.2523.
19. Chang HM, Okwuosa TM, Scarabelli T, et al. Cardiovascular Complications of Cancer Therapy. Journal of the American College of Cardiology. 2017;70(20):2552-65. DOI:10.1016/j.jacc.2017. 09.1095.
20. Matsumura C, Chisaki Y, Sakimoto S, et al. Evaluation of thromboembolic events in cancer patients receiving bevacizumab according to the Japanese Adverse Drug Event Report database. J Oncol Pharm Pract. 2018;24(1):22-7. DOI:10.1177/1078155216679025.
21. Васюк Ю.А., Гендлин Г.Е., Емелина Е.И. и др. Согласованное мнение российских экспертов по профилактике, диагностике и лечению сердечно-сосудистой токсичности противоопухолевой терапии. Российский Кардиологический Журнал 2021;26(9): 4703. DOI:10.15829/1560-4071-2021-4703.
22. Navi BB, Reiner AS, Kamel H, et al. Risk of arterial thromboembolism in patients with cancer. J Am Coll Cardiol. 2017;70(8):926-38. DOI:10.1016/j.jacc.2017.06.047.
23. Lee I, Adimadhyam S, Nutescu EA, et al. Bevacizumab Use and the Risk of Arterial and Venous Thromboembolism in Patients with High-Grade Gliomas: A Nested Case-Control Study. Pharmacotherapy. 2019;39(9):921-8. DOI:10.1002/phar.2310.
Об авторах
Ю. А. ВасюкРоссия
Васюк Юрий Александрович,
Москва
Е. Ю. Шупенина
Россия
Шупенина Елена Юрьевна,
Москва
А. Г. Носова
Россия
Носова Анастасия Геннадьевна,
Москва
Е. О. Новосел
Россия
Новосел Евгения Олеговна,
Москва
Д. А. Выжигин
Россия
Выжигин Дмитрий Александрович,
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Васюк Ю.А., Шупенина Е.Ю., Носова А.Г., Новосел Е.О., Выжигин Д.А. Вазотоксические эффекты противоопухолевой терапии: обзор современных данных. Рациональная Фармакотерапия в Кардиологии. 2023;19(2):203-208. https://doi.org/10.20996/1819-6446-2023-03-03
For citation:
Vasyuk Yu.A., Shupenina E.Y., Nosova A.G., Novosel E.O., Vyzhigin D.A. Vasotoxic Effects of Anticancer Therapy: a Review of Current Data. Rational Pharmacotherapy in Cardiology. 2023;19(2):203-208. (In Russ.) https://doi.org/10.20996/1819-6446-2023-03-03

















































