Перейти к:
Эффективность антиаритмических препаратов IС класса и катетерных методов изоляции устьев легочных вен у больных с пароксизмальной формой фибрилляции предсердий без структурной патологии сердца (одноцентровое исследование)
https://doi.org/10.20996/1819-6446-2023-03-09
Аннотация
Цель. Изучить эффективность и безопасность антиаритмических препаратов (ААП) IC класса и катетерных методов изоляции устьев легочных вен (КИ ЛВ) у пациентов с пароксизмальной формой фибрилляции предсердий (ФП) без структурной патологии сердца.
Материал и методы. В исследование было включено 122 пациента (44 мужчины, 78 женщин, средний возраст 63 [55;68] лет) c симптомными пароксизмами ФП. Пациенты разделены на группу приема лаппаконитина гидробромида (группа ЛГ; n=26), группу пропафенона (группа П; n=25), группу диэтиламинопропионилэтоксикарбониламинофенотиазина гидрохлорида (группа ДГ; n=23), группу радиочастотной катетерной изоляции (РЧА; n=24) и группу криобаллонной изоляции (КБИ; n=24). Первичной промежуточной и конечной точкой в исследовании являлся рецидив ФП в течение 6 и 12 мес от начала терапии ААП, а в группах катетерной изоляции устьев легочных вен (КИ ЛВ) – в течение 6 и 12 мес после окончания «слепого» периода. В группах приема ААП дополнительно оценивалась комбинированная конечная точка: сумма частоты рецидивирования ФП в течение 6 мес и частоты побочных эффектов, требующих отмены препарата.
Результаты. В течение 6 мес наблюдения рецидивы ФП наблюдались у 13 (50%) пациентов группы ЛГ, 11 (44%) пациентов группы П и 13 (56,5%) пациентов группы ДГ. Различие в частоте рецидивов ФП между группами было статистически незначимо (р=0,687). Побочные эффекты, потребовавшие отмены препарата, наблюдались в группе ЛГ у 2 (7,7%) пациентов, в группе П – у 3 (12%) и в группе ДГ – у 3 (13%) пациентов (р=0,801). Частота достижения комбинированной конечной точки (рецидив ФП и развитие побочных эффектов, требующих отмены ААП) между группами была незначимой (р=0,581) и составила 57,7%, 56%, 69,5% соответственно в группах ЛГ, П и ДГ. Эффективность КИ ЛВ была выше, чем ААТ IC класса: 77% против 39% с учетом отмены ААП из-за побочных эффектов (p<0,001). При этом значимых различий в эффективности РЧА и КБИ не выявлено: рецидивы ФП в течение 6 мес после окончания «слепого периода» отмечены в группе РЧА в 29% случаев, в группе КБИ – в 16,7% случаев (р=0,247). Суммарная эффективность КИ ЛВ через 12 мес составила 69% против 38% в группах ААП (p<0,001).
Заключение. Начиная подбор терапии ААП IС класса у больных с пароксизмальной формой ФП при отсутствии структурной патологии, несмотря на приемлемую безопасность, необходимо учитывать, что вне зависимости от первично назначенного препарата в течение 1 года профилактики рецидивов удается достичь менее, чем у половины пациентов. КИ ЛВ в этой группе пациентов может рассматриваться как метод первого выбора, либо быть рекомендована при неэффективности одного антиаритмического препарата I класса.
Ключевые слова
Для цитирования:
Царегородцев Д.А., Халикова М.А., Васюков С.С., Берая М.М., Седов А.В. Эффективность антиаритмических препаратов IС класса и катетерных методов изоляции устьев легочных вен у больных с пароксизмальной формой фибрилляции предсердий без структурной патологии сердца (одноцентровое исследование). Рациональная Фармакотерапия в Кардиологии. 2023;19(2):151-159. https://doi.org/10.20996/1819-6446-2023-03-09
For citation:
Tsaregorodtsev D.A., Khalikova M.A., Vasyukov S.S., Beraya M.M., Sedov A.V. Effectiveness of Class IC Antiarrhythmics in Patients with Paroxysmal Form of Atrial Fibrillation in Absence of Structural Heart Disease. Rational Pharmacotherapy in Cardiology. 2023;19(2):151-159. (In Russ.) https://doi.org/10.20996/1819-6446-2023-03-09
Введение
Фибрилляция предсердий (ФП) является одним из самых распространенных нарушений ритма сердца, чья клиническая значимость обусловлена увеличением риска инсульта, смертности, ухудшением качества жизни [1][2]. Выбор тактики контроля ритма у пациентов с ФП имеет такие преимущества, как уменьшение выраженности симптомов, повышение толерантности к физическим нагрузкам, предотвращение ремоделирования предсердий [3]. У пациентов без структурной патологии сердца в качестве первой линии терапии пароксизмальной формы ФП рекомендуется использование антиаритмических препаратов (ААП) IC класса, соталола [4][5] либо выполнение катетерной изоляции устьев легочных вен (КИ ЛВ). Таким образом, спектр современных возможностей довольно широк, но предпочтение у конкретного пациента, должно быть отдано максимально эффективному ААП или отказу от антиаритмической терапии (ААТ) в пользу КИ ЛВ. Однако в случае выбора препарата для начала терапии приходится учитывать: (1) ограниченность данных по эффективности отдельных ААП I класса и по сравнительной эффективности этих препаратов, (2) особенность спектра доступных ААП IС класса в Российской Федерации по сравнению со странами Европы и Америки, что не позволяет в полной мере перенести результаты зарубежных исследований на отечественную клиническую практику. ААП IC класса в России представлены лаппаконитина гидробромидом (ЛГ), пропафеноном (П), диэтиламинопропионилэтоксикарбониламинофенотиазина гидрохлоридом (ДГ). Работы по оценке эффективности и безопасности П в основном датированы началом 1990-2000-х гг. [6-8]. В этих исследованиях эффективность препарата в сроки 6-12 мес составила 30-60% [6-8]. Два другие препарата изучались в немногочисленных отечественных исследованиях [9-11], часть которых включала и больных со структурной патологией сердца. ДГ продемонстрировал свою эффективность в 57-90% случаев при сроках наблюдения от 3 до 12 мес, а ДГ – 33-60% [9-13]. Тем не менее, выбор первого ААП целиком зависит от субъективных предпочтений врача. Кроме того, в настоящее время у пациентов с ФП широкое распространение получили методы КИ ЛВ [4][5], продемонстрировавшие более высокую эффективность в профилактике рецидивов ФП по сравнению с ААТ [14-17]. В связи с этим современная постановка вопроса о начале противорецидивной терапии ФП у больных без структурной патологии, безусловно, не может не учитывать и возможности КИ ЛВ.
Цель исследования – изучить эффективность и безопасность ААП IС класса и КИ ЛВ у пациентов с пароксизмальной формой ФП без структурной патологии сердца.
Материал и методы
С сентября 2019 г. по октябрь 2021 г. в открытое нерандомизированное исследование было включено 122 пациента [ 44 мужчины, 78 женщин, медиана возраста 63 (55; 68) лет] с симптомными пароксизмами ФП. Протокол исследования одобрен локальным этическим комитетом Сеченовского Университета.
Критерии включения: ФП в виде симптомных пароксизмов, возникающих не реже 1 раза в 3 мес на протяжении как минимум последних 6 мес; возраст 18 лет и старше, письменное информированное согласие пациента на участие в исследовании. Критерии исключения: наличие структурной патологии сердца: ишемической болезни сердца (ИБС), пороков сердца, кардиомиопатии любого генеза, инфильтративных поражений сердца (амилоидоз, саркоидоз), гипертрофия левого желудочка любого генеза более 13 мм, систолическая дисфункция левого желудочка, каналопатии, наличие дополнительных предсердно-желудочковых соединений, пароксизмы устойчивой желудочковой тахикардии, атриовентрикулярная блокада II и III степени без имплантированного электрокардиостимулятора, ранее выполненные любые хирургические и малоинвазивные вмешательства на сердце, уровень гемоглобина крови <110 г/л, аутоиммунные заболевания, тиреотоксикоз, беременность, кормление грудью, отказ от участия в исследовании.
Всем пациентам проводилось обследование на базе Университетской клинической больницы №1 (Сеченовский Университет), где с помощью инструментальных и лабораторных методов исключалась структурная патология сердца и некардиальные причины ФП. Всем больным помимо сбора жалоб и анамнеза проводились общий и биохимический анализы крови, определение тиреотропного гормона в крови, выполнялись эхокардиографическое исследование и суточное мониторирование электрокардиограммы (ЭКГ). У лиц с факторами риска развития ИБС дополнительно исключали ишемию миокарда: с помощью нагрузочных тестов у 11 (9%) пациентов, мультиспиральной компьютерной томографии коронарных артерий у 53 (43,4%), коронарографии у 19 (15,6%) человек. При включении в исследование допускалось наличие гипертонической болезни с толщиной стенки левого желудочка ≤13 мм. Пациентам проводилась профилактика тромбоэмболических осложнений ФП в соответствии с действующими рекомендациями [4][5].
Пациенты разделены на группы в зависимости от принимаемого ААП или типа КИ ЛВ. В группы приема ААП IC класса включались пациенты как с отсутствием предшествующего опыта приема препаратов данной группы, так и ранее принимавших какой-либо ААП IC класса. Пациентам группы 1 (n=26) назначен ЛГ в дозе 50-100 мг/сут, группы 2 (n=25) – П 450-600 мг/сут, группы 3 (n=23) – ДГ 150 мг/сут. Группы КИ ЛВ включали пациентов с неэффективностью как минимум одного ААП в анамнезе при выборе пациентом хирургического лечения – радиочастотной катетерной изоляции (РЧА; группа 4, n=24) или криобаллонной изоляции (КБИ; группа 5, n=24). Выбор метода воздействия осуществлялся на основании данных мультиспиральной компьютерной томографии левого предсердия и ЛВ. Пациентам с общим коллектором левых ЛВ (n=7) выполнялась РЧА, остальные пациенты распределены в группы КИ случайным образом. С целью профилактики ранних рецидивов ФП после КИ ЛВ в течение первых 2 мес («слепой период») 38 (79,2%) пациентов получали ААТ (табл. 1). После выписки из стационара наблюдение за больными осуществлялось в амбулаторном режиме. В каждой группе было применено 2 вида планового контроля эффективности терапии. При первом способе контроля через 2, 6 и 12 мес после включения в исследование пациенты осуществляли плановые контрольные визиты в клинику с регистрацией ЭКГ и проведением суточного мониторирования ЭКГ. При втором способе контроля дополнительно к плановым визитам в клинику больные еженедельно самостоятельно регистрировали ЭКГ в амбулаторных условиях с помощью портативного кардиомонитора (ПКМ) ECG Dongle (Нордавинд, Россия) по методике, описанной нами ранее [18]. Различие в частоте применения двух способов наблюдения между изучаемыми группами была статистически незначимой.
Table 1. Initial clinical characteristics in groups with different treatment strategy
Таблица 1. Сравнительная характеристика пациентов в группах с различной тактикой лечения при включении в исследование
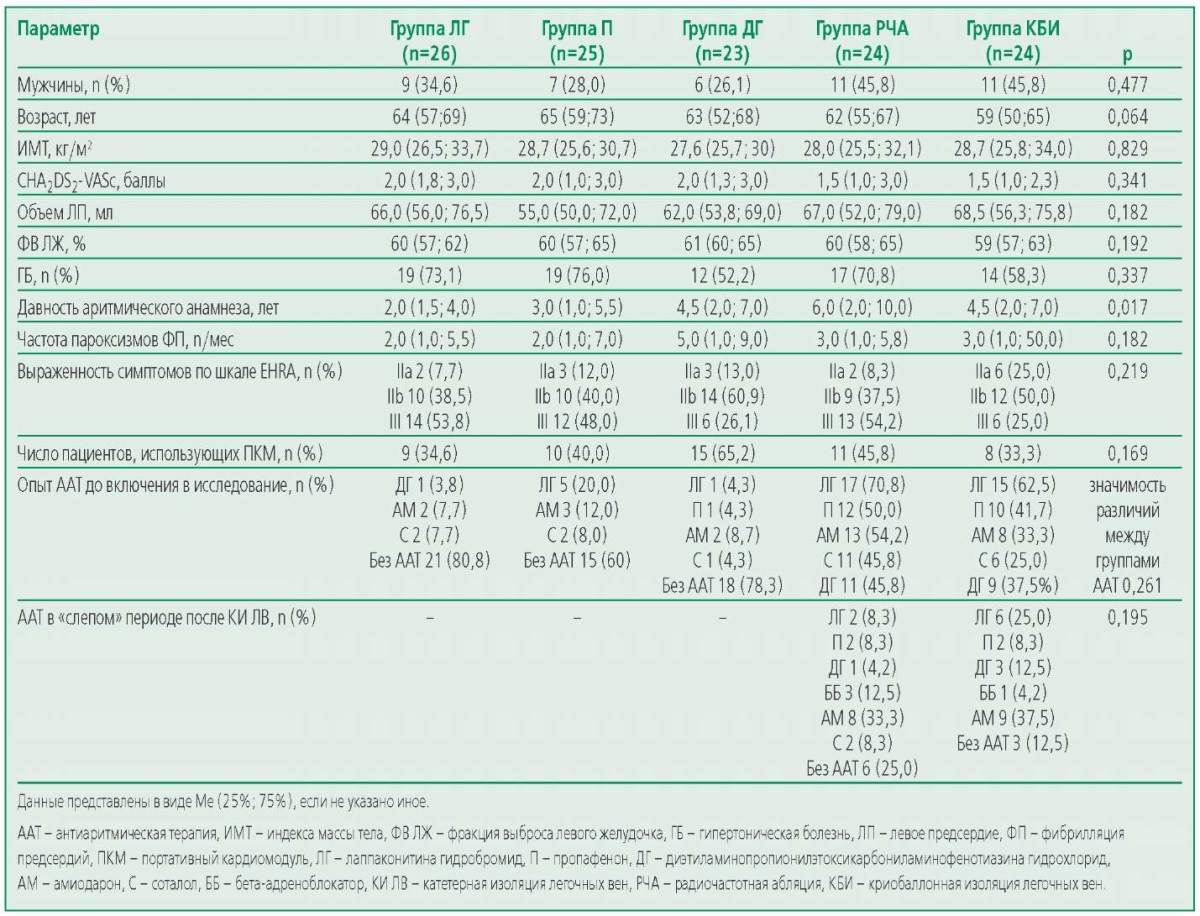
Кроме того, всем пациентам в случае возникновения симптомов, подозрительных на ФП, была рекомендована регистрация ЭКГ амбулаторно либо выездными бригадами скорой медицинской помощи (СМП) или в поликлинике по месту жительства, либо с помощью ПКМ с дальнейшей внеочередной консультацией в нашем центре в случае подтверждения рецидива ФП. При регистрации пароксизма ФП способ купирования, как правило, определялся врачами первого контакта (чаще всего врачами выездной бригады СМП). Все группы были сопоставимы по основным демографическим и клиническим характеристикам за исключением меньшей давности анамнеза ФП у больных из группы ЛГ по сравнению с группами РЧА (p=0,005) и КБИ (p=0,021), а также доли пациентов с предшествующей ААТ (см. табл. 1). При сравнении давности аритмического анамнеза среди пациентов в группах медикаментозной терапии статистически значимой разницы получено не было.
Период наблюдения для пациентов из групп ААТ составил 12 мес от момента включения в исследование, для пациентов из групп КИ ЛВ – 12 мес от окончания «слепого периода» и отмены ААП. У пациентов, принимавших в «слепом» периоде амиодарон, период наблюдения начинался спустя 2 мес после отмены этого препарата.
Первичными промежуточной и конечной точкой в исследовании являлся рецидив ФП в течение 6 и 12 мес от начала ААТ, а в группах КИ ЛВ – в течение 6 и 12 мес после окончания «слепого» периода. Рецидивом ФП считался пароксизм ФП продолжительностью не менее 30 с, зарегистрированный на ЭКГ [4][5]. В группах ААТ дополнительно оценивалась комбинированная конечная точка: сумма частоты рецидивов ФП в течение 6 мес и частоты побочных эффектов, требующих отмены препарата.
Статистическую обработку данных осуществляли с помощью программного обеспечения SPSS 23.0 (SPSS Inc., США). Данные представлены в виде медианы (Me) и межквартильного диапазона (25%; 75%) или процент от общего числа пациентов. Статистическая значимость различий между группами оценивали с помощью непараметрических методов: критериев Манна-Уитни и Краскела-Уоллиса, критерия χ2. Вероятность р<0,05 считали достаточной для вывода о значимости различий между вариационными рядами. Различия в отсутствии рецидивов ФП оценивали по методу Каплана-Мейера. Риск оценивали с помощью расчета отношения шансов и величины относительного риска.
Результаты
В течение 6 мес наблюдения различие в частоте рецидивов ФП, а также частоте возникновения побочных эффектов, потребовавших отмены препарата, между группами было статистически незначимым (табл. 2). В большинстве случаев побочные эффекты были представлены головокружением, слабостью, диплопией, покраснением лица. Проаритмический эффект (появление новой аритмии – ранее незарегистрированного атипичного трепетания предсердий) был отмечен у 2 пациентов на фоне приема ДГ (8,7% от числа пациентов, принимавших препарат). Различие по частоте достижения комбинированной конечной точки (рецидив ФП и развитие побочных эффектов, требующих отмены ААП) между группами было незначимым. Расхождение кривых свободы от рецидивов ФП в группах ЛГ, П и ДГ также было незначимым (р=0,249, рис. 1).
Table 2. Treatment results in groups with each class Ic antiarrhythmic drug
Таблица 2. Результаты терапии в группах с различными ААП IC класса

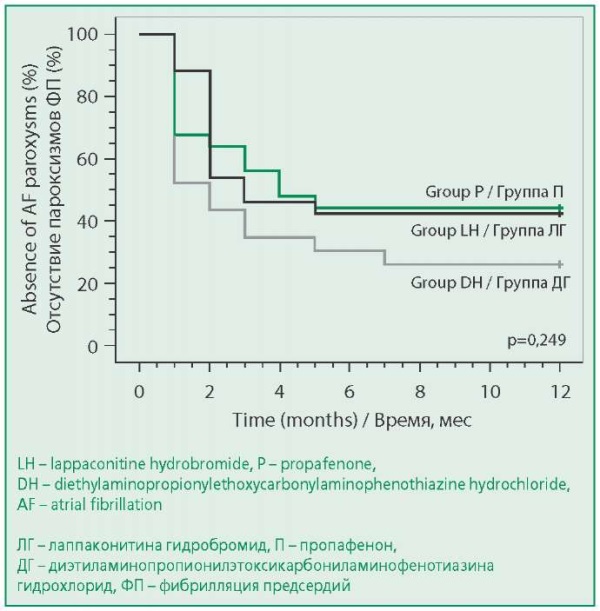
Figure 1. Kaplan-Meier Estimates of Freedom from AF recurrence in LH, P and DH groups in 12-months follow-up (Log-rank test)
Рисунок 1. Свобода от рецидивов ФП в группах ЛГ, П и ДГ в течение 12 мес от начала терапии (кривые Каплана-Майера, статистический критерий Лог-ранг).
Эффективность КИ ЛВ была выше, чем ААТ IC класса: 77% против 39% с учетом отмены ААТ из-за побочных эффектов (p<0,001). При этом значимых различий в эффективности РЧА и КБИ не выявлено (табл. 3).
Table 3. Comparison of AF recurrence frequencies in 6 and 12 months follow-up in RFA and cryoablation groups
Таблица 3. Сравнение частоты рецидивов ФП в течение 6 и 12 мес в группах РЧА и КБИ

В течение последующих 6 мес наблюдения (то есть через 12 мес от момента начала оценки эффективности) из 29 пациентов, принимавших ААТ, лишь у одного больного (3,4%) из группы ДГ наблюдался рецидив ФП. У всех больных в группах ЛГ и П сохранялся синусовый ритм (табл. 2). Суммарная эффективность ААП через 12 мес составила 38%. Случаев отмены препаратов из-за новых побочных эффектов не наблюдалось.
В группе РЧА в эти же сроки новых рецидивов ФП не отмечено, однако в группе КБИ такие случаи документированы у 4 пациентов. Таким образом, суммарная частота рецидивирования ФП в группе КИ составила 10,8%. Тем не менее, через 12 мес наблюдения эффективность КИ составила 69% и по-прежнему была значимо выше, чем в группе ААТ (p<0,001, табл. 4, рис. 2). Использование КИ ЛВ позволило снизить вероятность рецидива ФП в 4,2 раза [отношение шансов 4,2; 95% доверительный интервал 1,9-9,2; p<0,001] по сравнению с ААТ.
Table 4. Comparison of AADs` and CA`s treatment efficacy
Таблица 4. Сравнение эффективности терапии в группах ААТ и КИ ЛВ

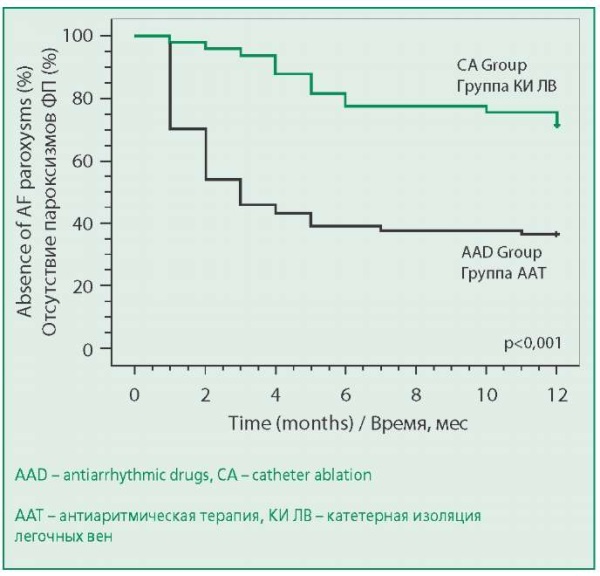
Figure 2. Kaplan-Meier Estimates of Freedom from AF recurrence in AAD treatment and CA groups groups in 12-months follow-up (Log-rank test)
Рисунок 2. Свобода от рецидивов ФП в группах ААТ и КИ ЛВ в течение 12 мес от начала терапии, в группах КИ ЛВ в течение 12 мес от окончания слепого периода (кривые Каплана-Майера, статистический критерий Лог-ранг)
Обсуждение
ААП являются доступным методом контроля ритма у больных с ФП [4][5]. Эффективность, которую продемонстрировали ААП IC класса в нашем исследовании, в целом сопоставима с результатами, полученными другими авторами в 1990-х – начале 2000-х гг. Вместе с тем нельзя не отметить, что на полученные результаты влияют методы и критерии оценки эффективности ААТ, сроки наблюдения за больными, исходные характеристики пациентов. Так в работах E.M. Antman и соавт. [19], C.R. Sharon [20] и S.H. Lee и соавт. [21] эффективность П в лечении пациентов с пароксизмами ФП составила 30-39% при использовании дополнительных методов контроля в виде различных вариантов амбулаторных регистраторов ЭКГ [19-21]. В нашем исследовании у части пациентов дополнительно к стандартным методам наблюдения использован ПКМ. Однако анализ, опубликованный нами ранее, продемонстрировал, что хотя подобный метод контроля и приводил к значимому снижению частоты вызовов СМП и частоты госпитализаций, но эффективность лечения оказалась сопоставимой в группах ПКМ и традиционного наблюдения [18]. В целом, мы расцениваем наши критерии эффективности терапии как достаточно строгие: хотя рецидивом ФП считался лишь пароксизм, зарегистрированный на ЭКГ, тем не менее любая устойчивая ФП в нашем исследовании являлась конечной точкой и свидетельствовала о неэффективности ААП. В клинической практике, учитывая трудности в достижении стойкого синусового ритма, даже существенное урежение и укорочение приступов (уменьшение так называемого, бремени или нагрузки ФП) или облегчение их переносимости может быть отнесено к успеху терапии [10][22-24]. При сравнении результатов различных исследований необходимо также сопоставлять исходную частоту пароксизмов с выбранным сроком наблюдения, учитывая возможную спонтанную вариабельность частоты рецидивирования ФП. Так в работу S.H. Lee и соавт. [21] включались пациенты с пароксизмами ФП, возникающими не реже 1 раз в неделю. При этом П оказался эффективен в 38% случаев, тогда как исследования, базирующиеся на оценке удержания синусового ритма после медикаментозной или электрической кардиоверсии в сроки 6-9 мес, часто не учитывающие исходную частоту рецидицирования ФП, традиционно демонстрируют большую эффективность: 45-60% [6-8]. В таких ситуациях нередким критерием сравнения эффективности ААП являются такие показатели как «период удержания синусового ритма» [20] или «среднее время до первого приступа» [9], на которые достаточно трудно ориентироваться при попытке использования результатов исследований в практической деятельности.
Важнейшей особенностью нашего исследования явилось строгое исключение структурной патологии сердца. Как это ни парадоксально, именно у больных без структурной патологии сердца, целевой когорты для ААП IC класса, их эффективность и безопасность изучены недостаточно. В большинство исследований по применению ААП IC класса при ФП включались пациенты, страдающие ИБС или другой структурной патологией сердца. Так в исследованиях E.M. Antman и соавт. [19] и C.R. Sharon [20] часть больных страдала ИБС, хронической сердечной недостаточностью, пороками сердца, в исследовании S.H. Lee и соавт. [21] – ИБС и кардиомиопатиями. В исследовании ПРОМЕТЕЙ в группе П у 15% пациентов была диагностирована ИБС, у 16% – дилатационная кардиомиопатия. В исследовании С.Ф. Соколова и соавт. [9] часть больных имела ИБС, пороки сердца. Основной опасностью при применении ААП IC класса у больных со структурной патологией сердца является риск развития желудочковых аритмий. В работах С.Ф. Соколова и соавт. [9], S.H. Lee и соавт. [21] и ПРОМЕТЕЙ [6] значимых проаритмических эффектов ААП IС класса зарегистрировано не было, однако S.C. Reimold и соавт. [20] и E.M. Antman и соавт. [19] доложили о единичных эпизодах устойчивой желудочковой тахикардии на фоне терапии П. Наше исследование демонстрирует, что исключение структурной патологии сердца позволяет безопасно применять ААП IC: в течение 12 мес наблюдения мы не выявили желудочковых аритмий, а два случаях предсердных аритмий были представлены атипичным ТП, вероятно, обусловленным трансформацией ФП на фоне приема Э.
Второй особенностью представленной работы является прямое сравнение трех ААП IC класса. Как правило, в большинстве из опубликованных ранее исследований один из ААП IC класса сравнивали с амиодароном в виде моно [6-9] или комбинированной терапии [10]. В настоящее время при ФП у больных без структурной патологии сердца амиодарон занимает несколько иную нишу и рекомендован в случае неэффективности ААП IC класса или соталола при отказе от проведения КИ ЛВ [4][5]. Прямое сравнение эффективности ЛГ и ДГ проведено во второй фазе частично-рандомизированного исследования С.Ф. Соколова и соавт. [9]. Проводилось сравнение эффективности ЛГ и ДГ у пациентов с симптомной ФП с частотой рецидивирования пароксизмов не менее 1 раза в неделю либо более редкими пароксизмами при их затяжном характере (>24 ч). В данном исследовании ЛГ продемонстрировал очень высокую эффективность (90,9%) по сравнению с ДГ (42,1%). В нашем исследовании эффективность обоих препаратов была существенно ниже, и различия в пользу ЛГ были незначимыми (42% против 26%). Вероятно, это связано с различным периодом наблюдения за пациентами: 3 мес в исследовании С.Ф. Соколова и соавт. и 12 мес в нашем исследовании. Мы не выявили ААП IC, имеющий явные преимущества с точки зрения эффективности и безопасности. Возможно, это связано с ограниченностью выборки пациентов в нашем исследовании. Можно предположить, что при увеличении мощности исследования разница в эффективности ДГ по сравнению с ЛГ и П может получить статистическую значимость. В большинстве ранее опубликованных исследований группы того или иного ААП IC класса включали от 15 [22] до 64 [8] пациентов, чаще около 50 больных [20]. Исключением могут являться работы E.M. Antman и соавт. [19], F. Bellandi и соавт. [7] и исследование ПРОМЕТЕЙ [6], где группы пациентов, принимавших П составляли 109, 102 и 218, соответственно. Возможно, проведение более крупных сравнительных исследований ААП IС класса с четким исключением структурной патологии сердца позволит выявить «золотой стандарт» для начала ААТ.
Еще одной особенностью нашего исследования явилось сравнение эффективности ААП со стандартом эффективности, которым в данном случае выступила КИ ЛВ. В нашем исследовании все пациенты из группы КИ ЛВ имели предшествовавший опыт приема ААП (не только ААП IC класса) в отличие от группы ААТ, где ААП до включения в исследование назначалась 27% пациентам. Группы ААТ и КИ ЛВ расценивались нами как сопоставимые в связи с тем, что в настоящее время отсутствуют данные о влиянии предшествовавшей ААТ на эффективность КИ ЛВ. Однако необходимо учитывать результаты исследования MANTRA-PAF [25], согласно которым эффективность РЧА в группе отсроченной изоляции ЛВ оказалась ниже, чем в группе РЧА как терапии первой линии. Тем не менее, в нашем исследовании эффективность КИ ЛВ оказалась значимо выше эффективности ААТ, несмотря на несколько большую длительной анамнеза ФП в группах КИ ЛВ. Впрочем, необходимо отметить, что различия по длительности анамнеза ФП наблюдались лишь между группами РЧА/КБИ и ЛГ, группы П и ДЭ по длительности анамнеза ФП были сопоставимы с группами КИ ЛВ.
Большинство крупных исследований по сравнению эффективности ААП и КИ ЛВ продемонстрировало более высокую эффективность последней. Причем в ряде сравнений использовался весь спектр доступных ААП, включая амиодарон. Так в многоцентровом рандомизированном исследовании CABANA (Catheter Ablation Versus Antiarrhythmic Drug Therapy for Atrial Fibrillation) доля пациентов с отсутствием рецидивов ФП через 12 мес в группе КИ ЛВ составила 62%, что было значимо больше, чем в группе ААТ, в которой положительный эффект достигнут только в 40% случаев [16][23]. По данным исследования APAF (Radiofrequency Catheter Ablation and Antiarrhythmic Drug Therapy) доля пациентов с отсутствием рецидивов ФП через 12 мес в группе ААТ и в группе РЧА составили 32% и 88% [15]. В недавно опубликованном рандомизированном исследовании J.G. Andrade и соавт. [26] сопоставлялись результаты ААТ (флекаинид, пропафенон, соталол, дронедарон) и КБИ. За 36 мес наблюдения с помощью имплантированных петлевых рекордеров пароксизмы предсердной тахиаритмии были зарегистрированы у 56,5% пациентов в группе КБИ и у 77,2% в группе ААТ. Схожие результаты получены и в отечественных исследованиях по сравнению эффективности РЧА и ААТ [27][28]. Так в работе А.А. Симонян и соавт., включавшей 92 пациента, увеличение бремени ФП на 30% и более, по данным имплантированного кардиомонитора, на фоне терапии ААП IC, II и III классов (пропафенон, соталолол, бета-адреноблокаторы или амиодарон) в течение 24 мес наблюдалось у 58,7%, тогда как в группе РЧА – лишь у 21,7% [28]. Обращает на себя внимание, что в данной работе использован весь спектр ААП, а также иной критерий оценки эффективности лечения по сравнению с нашим исследованием. В исследовании С.И. Селюцкого и соавт. [27], проводилось сравнение результатов медикаментозной терапии и РЧА у больных с пароксизмальной и персистирующей формой ФП у 130 больных, преимущественно со структурной патологией сердца, хронической сердечной недостаточностью и снижением фракции выброса левого желудочка менее 50%. Через 12 мес наблюдения устойчивый синусовый ритм регистрировался у 75% пациентов в группе РЧА и у 40% больных в группе медикаментозной терапии. Вместе с тем, в группе консервативной терапии основной акцент сделан на лечение хронической сердечной недостаточности, а ААП IC или III класса получали лишь 23% пациентов.
В целом, результаты как российских, так и зарубежных исследований свидетельствуют в пользу КИ ЛВ. Именно поэтому в настоящее время у больных с пароксизмальной ФП, особенно при отсутствии структурной патологии сердца, КИ ЛВ можно считать неким стандартом эффективного лечения, и оценка результатов ААТ в профилактике рецидивов данной аритмии должна проводится с учетом возможностей интервенционного подхода. Полученные нами результаты сопоставимы с ранее опубликованными данными: КИ ЛВ почти в 2 раза чаще приводила к достижению эффекта по сравнению с ААТ. Необходимо подчеркнуть, что при более длительном наблюдении эффективность КИ ЛВ, как, впрочем, и ААП, снижается: в исследовании RAAFT-2 [14] эффективность ААТ (пропафенон, флекаинид, соталол, дофетилид, амиодарон) и РЧА через 24 мес от окончания слепого периода составила 27,9% и 45,5%, соответственно; в исследовании APAF через 4 года – 12,1% и 72,7% соответственно [15]. Дальнейшее снижение эффективности обоих методов при пятилетнем наблюдении лечения продемонстрировано и исследовании CABANA [23].
В нашем исследовании не выявлено преимуществ какой-либо методики КИ ЛВ, что соответствует данным других авторов. В исследовании Ю.Л. Шевченко и соавт. [29] через 1 год рецидивы ФП отсутствовали у 66% в группе РЧА и в 67% в группе КБИ ЛВ. В исследовании CIRCA-DOSE [30] при помощи имплантированных кардиомониторов сравнивалась частота регистрации не только пароксизмов ФП, но и любых предсердных тахиаритмий у пациентов после РЧА и 2 методик КБИ (4- и 2-минутной): доля пациентов, у которых отсутствовали пароксизмы любых предсердных тахиаритмий через 12 мес составила 53,9%, 52,2% и 51,7%, а симптомных предсердных тахиаритмий – 79,1%, 78,2% и 73,3%, соответственно.
Ограничения исследования
К ограничениям нашей работы, помимо указанного выше нерандомизированного харакрера исследования и небольшого числа больных в группах, можно отнести отсутствие применения комбинированной ААТ.
Заключение
Начиная подбор терапии ААП IС класса у больных с пароксизмальной формой ФП при отсутствии структурной патологии, несмотря на приемлемую безопасность, необходимо учитывать, что вне зависимости от первично назначенного препарата в течение 1 года профилактики рецидивов удается достичь менее, чем у половины пациентов. Необходимо проведение более крупных исследований для выявления ААП, наиболее оптимального для начала терапии у пациентов с пароксизмальной формой ФП. КИ ЛВ, демонстрирующая значимо более высокую эффективность, в этой группе пациентов может рассматриваться как метод первого выбора, либо быть рекомендована при неэффективности одного ААП IС класса.
Отношения и Деятельность. Нет. Исследование проведено при поддержке Первого МГМУ им. И.М. Сеченова (Сеченовский Университет)
Relationships and Activities. None. The study was performed with the support of the I.M. Sechenov First Moscow State Medical University (Sechenov University).
Список литературы
1. Kornej J, Börschel CS, Benjamin EJ, Schnabel RB. Epidemiology of Atrial Fibrillation in the 21st Century: Novel Methods and New Insights. Circ Res. 2020;127(1):4-20. DOI:10.1161/CIRCRESAHA.120.316340.
2. Go AS, Hylek EM, Phillips KA, et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and Risk Factors in Atrial Fibrillation (ATRIA) study. JAMA. 2001;285(18):2370-5. DOI:10.1001/jama.285.18.2370.
3. AFFIRM First Antiarrhythmic Drug Substudy Investigators. Maintenance of sinus rhythm in patients with atrial fibrillation: an AFFIRM substudy of the first antiarrhythmic drug. J Am Coll Cardiol. 2003;42(1):20-9. DOI:10.1016/s0735-1097(03)00559-x.
4. Аракелян М. Г., Бокерия Л. А., Васильева Е. Ю. и др. Фибрилляция и трепетание предсердий. Клинические рекомендации 2020. Российский Кардиологический Журнал. 2021;26(7):4594. DOI:10.15829/1560-4071- 2021-4594.
5. Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS) Eur. Heart J. 2020;42(40):373-498. DOI:10.1093/eurheartj/ehaa612.
6. Фомина И.Г., Тарзиманова А.И., Ветлужский А.В. и др. Пропафенон при восстановлении и сохранении синусового ритма у больных с персистирующей формой фибрилляции предсердий: новые результаты исследования "ПРОМЕТЕЙ". Consilium Medicum. 2006;8(11):82-5.
7. Bellandi F, Simonetti I, Leoncini M, et al. Long-term efficacy and safety of propafenone and sotalol for the maintenance of sinus rhythm after conversion of recurrent symptomatic atrial fibrillation. Am J Cardiol. 2001;88(6):640-5. DOI:10.1016/s0002-9149(01)01806-9.
8. Kochiadakis GE, Marketou ME, Igoumenidis NE, et al. Amiodarone, sotalol, or propafenone in atrial fibrillation: which is preferred to maintain normal sinus rhythm? Pacing Clin Electrophysiol. 2000;23(11):1883-7. DOI:10.1111/j.1540-8159.2000.tb07044.x.
9. Соколов С.A., Бомонина Е.В. Сравнительная эффективность и безопасность аллапинина, этацизина и амиодарона и выбор оптимальной антиаритмической терапии по контролю ритма при пароксизмальной мерцательной аритмии. Кардиология. 2015;3(6):65-75.
10. Павлов Е.Г., Чапурных А.В., Соловьев О.В. Применение этацизина в комбинированной терапии рецидивирующей фибрилляции предсердий. Кардиология и Сердечно-сосудистая Хирургия. 2010;3(1):64-70.
11. Сычев О.С., Романова Е.Н., Срибная О.В. Результаты клинического исследования “Оценка эффективности и безопасности препарата этацизина у больных с нарушениями ритма без выраженной органической ̆ патологии сердца”. Аритмология. ̆ 2016;3(19):3-10.
12. Лозинскии Л.Г., Замотаев И.П., ̆ Керимова Р.Е., Ракова Н.А. Результаты лечения пароксизмальной мерцательной ̆ аритмии эта ̆ - цизином. Кардиология. 1989;29(7):37-40.
13. Абдалла А, Мазур Н.А., Яворская Н.В. и др. Эффективность комбинаций антиаритмических препаратов у больных с пароксизмальной̆ формой̆ мерцательной̆ аритмии. Терапевтический Архив. 1992;64(4):51-4.
14. Morillo CA, Verma A, Connolly SJ, et al.; RAAFT-2 Investigators. Radiofrequency ablation vs antiarrhythmic drugs as first-line treatment of paroxysmal atrial fibrillation (RAAFT-2): a randomized trial. JAMA. 2014;311(7):692-700. DOI:10.1001/jama.2014.467.
15. Pappone C, Vicedomini G, Augello G, et al. Radiofrequency catheter ablation and antiarrhythmic drug therapy: a prospective, randomized, 4-year follow-up trial: the APAF study. Circ Arrhythm Electrophysiol. 2011;4(6):808-14. DOI:10.1161/CIRCEP.111.966408.
16. Packer DL, Mark DB, Robb RA, et al, CABANA Investigators. Effect of Catheter Ablation vs Antiarrhythmic Drug Therapy on Mortality, Stroke, Bleeding, and Cardiac Arrest Among Patients With Atrial Fibrillation: The CABANA Randomized Clinical Trial. JAMA. 2019;321(13):1261-74. DOI:10.1001/jama.2019.0693.
17. Blomström-Lundqvist C, Gizurarson S, Schwieler J, et al. Effect of Catheter Ablation vs Antiarrhythmic Medication on Quality of Life in Patients With Atrial Fibrillation: The CAPTAF Randomized Clinical Trial. JAMA. 2019;321(11):1059-1068. DOI:10.1001/jama.2019.0335.
18. Халикова М.А., Царегородцев Д.А., Берая М.М. и др. Преимущества применения портативного кардиомонитора в амбулаторном наблюдении за пациентами с пароксизмальной формой фибрилляции предсердии. Кардиоваскулярная Терапия и Про ̆ - филактика. 2022;21(6):3225. DOI:10.15829/1728-8800-2022-3225.
19. Antman EM, Beamer AD, Cantillon C, et al. Therapy of refractory symptomatic atrial fibrillation and flutter: a care staged approach with new antiarrhythmic drugs. J Am Coll Cardiol. 1990;15(3):698- 707. DOI:10.1016/0735-1097(90)90649-a.
20. Reimold SC, Cantillon CO, Friedman PL, Antman EM. Propafenone versus sotalol for suppression of recurrent symptomatic atrial fibrillation. Am J Cardiol. 1993;71(7):558-63. DOI:10.1016/0002-9149(93)90511-a.
21. Lee SH, Chen SA, Tai CT, et al. Comparisons of oral propafenone and sotalol as an initial treatment in patients with symptomatic paroxysmal atrial fibrillation. Am J Cardiol. 1997;79(7):905-8. DOI:10.1016/s0002-9149(97)00025-8.
22. Скибицкий В.В., Кудряшов Е.А. и др. Изучение эффективности пропафенона при пароксизмальной фибрилляции предсердий. Российский Кардиологический Журнал. 2004;(6):68-70.
23. Poole JE, Bahnson TD, Monahan KH, et al.; CABANA Investigators and ECG Rhythm Core Lab. Recurrence of Atrial Fibrillation After Catheter Ablation or Antiarrhythmic Drug Therapy in the CABANA Trial. J Am Coll Cardiol. 2020;75(25):3105-18. DOI:10.1016/j.jacc.2020.04.065.
24. Kirchhof P, Benussi S, Kotecha D, et al, ESC Scientific Document Group. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J. 2016;37(38):2893- 962. DOI:10.1093/eurheartj/ehw210.
25. Andrade JG, Deyell MW, Macle L, et al.; EARLY-AF Investigators. Progression of Atrial Fibrillation after Cryoablation or Drug Therapy. N Engl J Med. 2023;388(2):105-16. DOI:10.1056/NEJMoa2212540.
26. Селюцкии С.И., Савина Н.М., Чапурных А.В. Оценка эффективности радиочастотнои ̆ аблации ̆ и повторнои кардиоверсии в сочетании с антиаритмическои ̆ терапиеи ̆ в поддержании устои ̆ чй - вого синусового ритма у пациентов с фибрилляциеи предсердии ̆ и сердечнои ̆ недостаточностью. ̆ Кардиология. 2020;60(8):90-7. DOI:10.18087/cardio.2020.8.n916.
27. [Симонян А.А., Колесников В.Н., Виленскии Л.И., и др. Оценка прогрессирования фибрилляции предсердии ̆ после катетернои ̆ ̆ аблации и антиаритмическои терапии у пациентов с пароксизмальнои ̆ формои ̆ фибрилляции ̆ предсердии: рандомизированное контролируемое исследование. Патология Кровообращения ̆ и Кардиохирургия. 2016;20(3):72-81. DOI:10.21688/1681-3472-2016-3-72-81.
28. Шевченко Ю.Л., Башилов С.А., Свешников А.В., и др. Изоляция легочных вен с использованием катетерной радиочастотной (close-протокол) и криобаллонной абляции у пациентов с пароксизмальной формой фибрилляции предсердий. Вестник Национального Медико-хирургического Центра им. Н.И. Пирогова. 2019;14(3):13-21. DOI:10.25881/BPNMSC.2019.53.39.002.
29. Andrade JG, Deyell MW, Verma A, et al. The Cryoballoon vs Irrigated Radiofrequency Catheter Ablation (CIRCA-DOSE) Study Results in Context. Arrhythm Electrophysiol Rev. 2020;9(1):34-9. DOI:10.15420/aer.2019.13.
30. Nielsen JC, Johannessen A, Raatikainen P, et al.; MANTRA-PAF Investigators. Long-term efficacy of catheter ablation as first-line therapy for paroxysmal atrial fibrillation: 5-year outcome in a randomised clinical trial. Heart. 2017;103(5):368-76. DOI:10.1136/heartjnl-2016-309781.
Об авторах
Д. А. ЦарегородцевРоссия
Царегородцев Дмитрий Александрович,
Москва
М. А. Халикова
Россия
Халикова Манижа Абдухалиловна,
Москва
С. С. Васюков
Россия
Васюков Сергей Сергеевич,
Москва
М. М. Берая
Россия
Берая Мака Мурмановна,
Москва
А. В. Седов
Россия
Седов Алексей Всеволодович,
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Царегородцев Д.А., Халикова М.А., Васюков С.С., Берая М.М., Седов А.В. Эффективность антиаритмических препаратов IС класса и катетерных методов изоляции устьев легочных вен у больных с пароксизмальной формой фибрилляции предсердий без структурной патологии сердца (одноцентровое исследование). Рациональная Фармакотерапия в Кардиологии. 2023;19(2):151-159. https://doi.org/10.20996/1819-6446-2023-03-09
For citation:
Tsaregorodtsev D.A., Khalikova M.A., Vasyukov S.S., Beraya M.M., Sedov A.V. Effectiveness of Class IC Antiarrhythmics in Patients with Paroxysmal Form of Atrial Fibrillation in Absence of Structural Heart Disease. Rational Pharmacotherapy in Cardiology. 2023;19(2):151-159. (In Russ.) https://doi.org/10.20996/1819-6446-2023-03-09

















































