Перейти к:
Оценка маркеров фиброза, как потенциального метода диагностики необструктивного поражения коронарных артерий у больных стабильной ишемической болезнью сердца
https://doi.org/10.20996/1819-6446-2022-11-01
Аннотация
Цель. Изучить уровни маркеров фиброза у пациентов со стабильной ишемической болезнью сердца (ИБС) и различными вариантами поражения коронарных артерий (КА) (обструктивное и необструктивное), выявить возможные различия для диагностики степени обструкции коронарного русла.
Материал и методы. В обсервационное исследование были включены три группы пациентов: с необструктивной (основная группа, стеноз КА <50%; n=20) и обструктивной (группа сравнения, гемодинамически значимый стеноз КА по результатам коронарографии; n=20) ИБС и здоровые добровольцы (контрольная группа, n=40). Уровни трансформирующего фактора роста бета 1 (TGF-β1) и матриксной металлопротеиназы 9 (MMP-9) измеряли в плазме крови с помощью иммуноферментного анализа. По результатам эхокардиографии все пациенты, включенные в исследование, были разделены на четыре группы в зависимости от типа ремоделирования миокарда.
Результаты. Уровни TGF-β1 были значимо выше у пациентов с обструктивной ИБС (p=0,008), чем у пациентов с необструктивной ИБС и у здоровых добровольцев (p <0,001). Значимых различий между основной и контрольной группами не было (р <0,05). Статистически значимые различия уровней TGF-β1 в зависимости от типа ремоделирования левого желудочка отсутствовали (p=0,139). Максимальный уровень ММР-9 был в группе с обструктивным поражением коронарного русла и значимо отличался от основной группы (p <0,001) и группы контроля (p=0,04).
Заключение. Максимальные уровни TGF-β1 и MMP-9 были выявлены в группе с обструктивным поражением КА. Уровни этих биомаркеров в основной группе статистически отличались от значений, полученных в группе контроля. Таким образом, учитывая патогенез развития необструктивной ИБС, использование маркеров фиброза TGF-β1 и MMP-9 может являться перспективным для диагностики выраженности обструкции КА.
Ключевые слова
Для цитирования:
Пахтусов Н.Н., Юсупова А.О., Жбанов К.А., Щендрыгина А.А., Привалова Е.В., Беленков Ю.Н. Оценка маркеров фиброза, как потенциального метода диагностики необструктивного поражения коронарных артерий у больных стабильной ишемической болезнью сердца. Рациональная Фармакотерапия в Кардиологии. 2022;18(6):630-637. https://doi.org/10.20996/1819-6446-2022-11-01
For citation:
Pakhtusov N.N., Yusupova A.O., Zhbanov K.A., Shchedrygina A.A., Privalova E.V., Belenkov Yu.N. Evaluation of Fibrosis Markers as a Potential Method for Diagnosing Non-Obstructive Coronary Artery Disease in Patients with Stable Coronary Artery Disease. Rational Pharmacotherapy in Cardiology. 2022;18(6):630-637. (In Russ.) https://doi.org/10.20996/1819-6446-2022-11-01
Введение
Сердечно-сосудистые заболевания (ССЗ) являются одной из основных причин смертности во всем мире [1]. Распространенность ишемической болезни сердца (ИБС), значительные экономические затраты и связанный с этим риск инвазивных вмешательств требуют разработки новых алгоритмов ее диагностики и лечения.
Проект «Геном человека», завершившийся в 2003 г., позволил по новому взглянуть на патогенез заболеваний [2]. Так, полногеномные ассоциативные исследования (GWAS) выявили связь между ИБС и полиморфизмами генов, кодирующих сигнальный путь трансформирующего фактора роста-β (TGF-β) [3]. Сбой передачи сигнала в этом сигнальном пути типичен для многих заболеваний человека. Все этапы и задействованные биомолекулы хорошо изучены, однако до сих пор неясно, что вызывает различные многочисленные биологические эффекты при его активации [4].
TGF-β1 – один из 33 известных полипептидов семейства TGF-β человека [5]. Белки семейства TGF-β играют важную роль в контроле пролиферации и дифференцировки клеток, заживлении ран и активации иммунной системы, а также участвуют в патофизиологии ССЗ и злокачественных новообразований. Одним из активаторов TGF-β1 является металлопротеиназа 9 [6]. В настоящее время выявлена ассоциация между сигнальным путем TGF-β и интерлейкином-6 (ИЛ-6). Так, ИЛ-6 активирует продукцию белков TGF-β сердечными фибробластами [7], процессы фиброгенеза и в конечном итоге приводит к ремоделированию сердца [8].
Наименее изученными являются больные с необструктивным поражением коронарных артерий (ноИБС), у которых имеются типичная стенокардия, инструментально верифицированные признаки ишемии миокарда (стресс-эхокардиография, сцинтиграфия миокарда и стресс-магнитно-резонансная томография) и отсутствуют гемодинамически значимые стенозы (стеноз<50%) коронарных артерий (КА). По результатам коронароангиографии (КАГ) в эту категорию относят пациентов с интактными КА (стеноз отсутствует), легкими (<30%) и умеренными (≥30% и <50%) атеросклеротическими поражениями. Распространенность ноИБС может достигать 20% при остром и 50% при хроническом коронарных синдромах [9]. Хотя у этих пациентов нет значимого атеросклероза КА, у них также развиваются неблагоприятные сердечнососудистые события, в частности, инфаркт миокарда (ИМ) без обструкции КА (ИМбоКА). Частота ИМбоКА у пациентов с этой формой ИБС колеблется от 2,2 до 21,8% [10]. Как правило, ИМбоКА возникает преимущественно у пациентов женского пола, более молодого возраста, с меньшей вероятностью выявления сахарного диабета, артериальной гипертензии, дислипидемии, что свидетельствует о ведущей роли в патогенезе неатеросклеротических поражения КА таких факторов, как инсулинорезистентность, воспаление и психосоциальные аспекты [11].
Цель исследования – изучить уровни маркеров фиброза у пациентов со стабильной ИБС и различными вариантами поражения КА (обструктивное и необструктивное), а также выявить возможные различия для диагностики степени обструкции коронарного русла.
Материал и методы
Проводимое обсервационное исследование одобрено локальным этическим комитетом в соответствии с Хельсинкской декларацией. В исследовании участвовало три группы: больные с необструктивной ИБС составили основную группу (n=20), с обструктивной ИБС – группу сравнения (n=20), и здоровые добровольцы – контрольную группу (n=40). Критерии включения в основную группу: инструментально подтвержденная ишемия миокарда, отсутствие выраженного стеноза КА (<50%) по данным КАГ, отсутствие реваскуляризации миокарда в анамнезе (шунтирование КА, баллонная ангиопластика и/или стентирование КА). В группу сравнения вошли пациенты с обструктивной ИБС по результатам КАГ и реваскуляризацией миокарда (в анамнезе у 50% из них). Критерии исключения: острый коронарный синдром, хроническая сердечная недостаточность (III-IV ФК по NYHA), гемодинамически значимые пороки сердца, инсульт в течение 6 мес, предшествующих исследованию, хроническая болезнь почек со скоростью клубочковой фильтрации <30 мл/мин, заболевания перикарда, аутоиммунные и онкологические заболевания. В контрольную группу вошли здоровые добровольцы без хронических заболеваний (рис. 1). Клинико-демографические данные представлены в табл. 1.
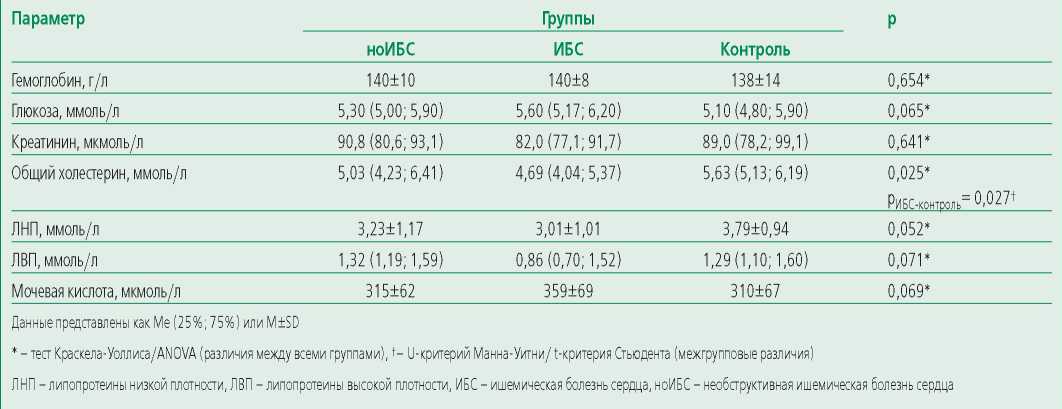
Всем больным проводилось стандартное лабораторно-инструментальное обследование: клинический анализ крови (гематологический анализатор XP 300, производителя Sysmex®), биохимический анализ крови [общий холестерин (ОХС), липопротеины низкой (ЛНП) и высокой плотности (ЛВП) колориметрическим методом, с помощью реагентов ADVIA® Chemistry Cholesterol Reagent, ADVIA® Chemistry Direct LDL Cholesterol Reagents, ADVIA® Chemistry Direct HDL Cholesterol Reagents, мочевая кислота (колориметрическим методом, с помощью реагента ADVIA® Chemistry Uric Acid Reagents), креатинин (кинетическим методом (метод Яффе) с помощью реагента ADVIA® Chemistry Creatinine Reagents), глюкоза венозной плазмы натощак (гексокиназным методом с помощью реагента ADVIA® Chemistry Glucose Hexokinase II Reagents)], суточное мониторирование артериального давления (БиПиЛАБ, Россия), холтеровское мониторирование (medilogAR®, Shiller, Швейцария), Эхокардиография (Vivid 7, GE Healthcare, США), рентгеновское исследование органов грудной клетки (УнивеРС-МТ, Россия), велоэргометрия (ERG 911 S/L, Shiller, Швейцария) и КАГ (Siemens Artis Zee, производитель Siemens Healthineers GmbH, Германия). Все диагнозы установлены на основании актуальных российских рекомендаций с учетом данных анамнеза пациентов. Участники контрольной группы медикаментозную терапию не получали, поэтому уровни общего холестерина значимо различались между больными с ИБС и группой контроля (табл. 2).
Образцы крови после центрифугирования были заморожены в криопробирках при температуре -80°C. Для оценки уровней TGF-β1 и MMP-9 использовали иммуноферментный анализ (ИФА) (набор реагентов для иммуноферментного анализа TGF-β1 человека BMS249-4: Invitrogen, США; коэффициент вариации 4,9% и 3,2%; MMP9 Human ELISA Kit, Invitrogen, США, коэффициент вариации 10,2% и 7,3%).
Для дополнительной оценки степени выраженности фиброза проводилось определение типа ремоделирования миокарда. По результатам эхокардиографии все пациенты, включенные в исследование, были разделены на четыре группы по типу ремоделирования миокарда [12] с учетом индекса массы миокарда левого желудочка (ЛЖ) и относительной толщины его стенки. В зависимости от результатов расчетов были сформированы следующие группы пациентов: пациенты с нормальной геометрией сердца, концентрическим ремоделированием, концентрической и эксцентрической гипертрофией ЛЖ.
Статистический анализ проводился с помощью SPSS 23 (IBM, США). Для оценки значимости различий полученных данных был проведен апостериорный анализ с использованием программы G*Powerver 3.1.9.6 (Германия) [13]. Нормальное распределение количественных параметров оценивали с помощью критерия Шапиро-Уилка (n<50) или Колмогорова-Смирнова (n>50). В случае ненормального распределения мы описывали данные с использованием медианы (Me) и нижнего и верхнего квартилей (25%; 75%). Категориальные данные были описаны с абсолютными значениями и процентами. Две группы сравнивали по количественному показателю с ненормальным распределением с помощью U-критерия Манна-Уитни. Три и более группы сравнивали по количественному показателю с ненормальным распределением с помощью теста Краскела-Уоллиса; апостериорные сравнения были сделаны с помощью критерия Данна, с поправкой Бонферрони. Процентные значения сравнивались при анализе кросс-таблиц по нескольким полям с использованием критерия хи-квадрат Пирсона. Диагностическую значимость количественных признаков в прогнозе исхода определяли с помощью анализа ROC-кривой. Точка отсечки в разделяющем значении качественного признака рассчитывалась по наибольшему значению индекса Юдена.
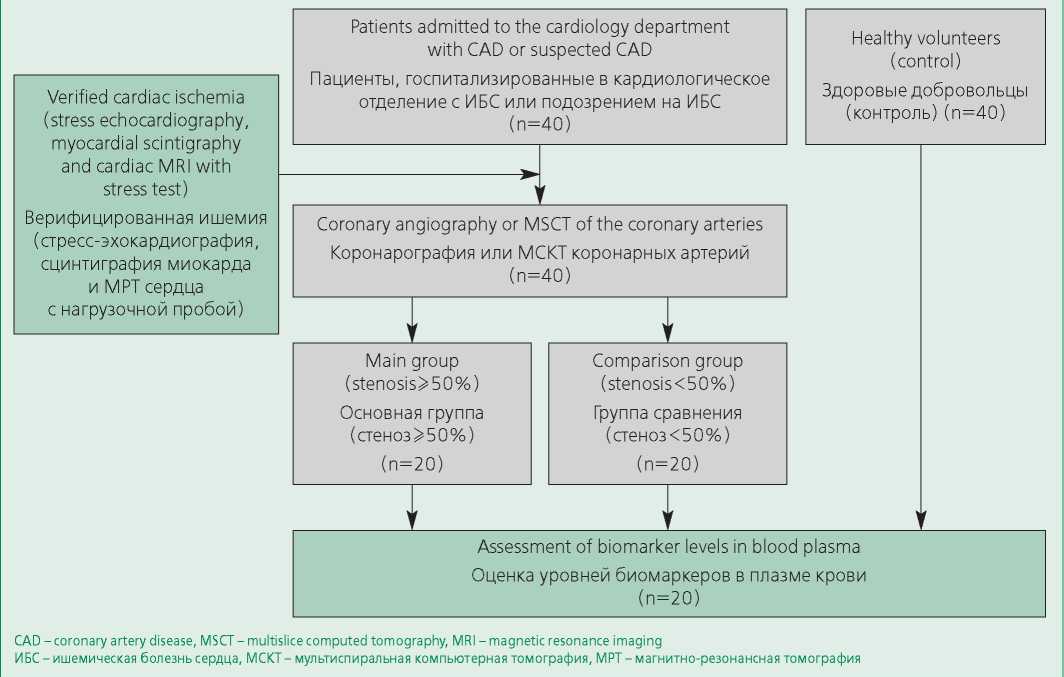
Figure 1. Study Design
Рисунок 1. Дизайн исследования
Table 1. Clinical and demographic characteristics of patients
Таблица 1. Клинико-демографическая характеристика пациентов
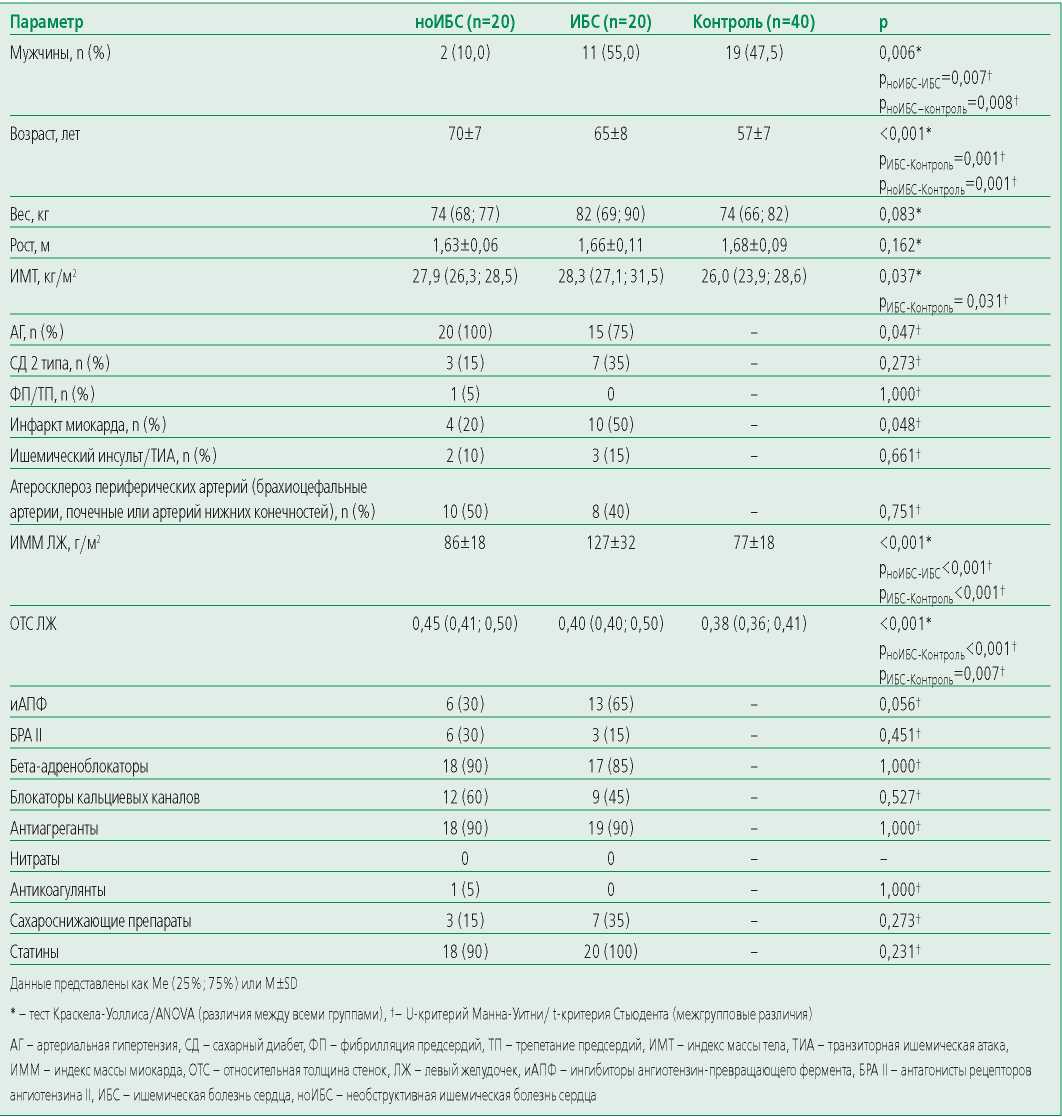
Table 2. Laboratory data in groups
Таблица 2. Лабораторные данные в группах
Результаты
Результаты ИФА показали, что уровни TGF-β1 были значимо выше у больных с обструктивной ИБС (р=0,008), нежели у больных с необструктивной ИБС и контрольной группой (р<0,001). Значимых различий между основной и контрольной группами не выявлено (рис. 2).
Построенная ROC-кривая отображает вероятность наличия необструктивной ИБС среди пациентов с верифицированной ИБС в зависимости от уровня TGF-β1 (рис. 3). Площадь под ROC-кривой составила 0,753±0,078 при 95% доверительном интервале 0,599-0,906. Модель статистически значима (р=0,007). Пороговое значение уровня TGF-β1, соответствующее максимальному значению индекса Юдена, составило 20269 пг/мл. Необструктивная ИБС прогнозировалась, когда уровень TGF-β1 был ниже или равен этому значению. Чувствительность и специфичность модели составили 89,5% и 70,0% соответственно.
Также сравнивали уровни TGF-β1 в зависимости от типа ремоделирования левого желудочка. Значимых различий (р=0,069) между группами выявлено не было, но следует подчеркнуть, что у пациентов с нормальной геометрией левого желудочка уровень TGFβ1 был минимальным. Необходимо отметить, что больных с эксцентрической гипертрофией в основной группе (с необструктивной ИБС) не было. Кроме того, в этой группе было больше пациентов с нормальной геометрией сердца, чем в группе сравнения (с обструктивной ИБС) (рис. 4).
Различались и уровни ММП-9, у пациентов с обструктивной ИБС он был максимальным, основная группа значимо отличалась от группы сравнения и контроля (рис. 5)
Зависимость уровня ММР-9 от TGF-β1 (рис. 6) оценивали методом линейной регрессии, учитывались такие показатели, как пол, возраст и ИМТ. Полученная регрессионная модель характеризовалась коэффициентом корреляции r=0,719, что соответствует высокой корреляции по шкале Чеддока. Модель была статистически значимой (p<0,001).
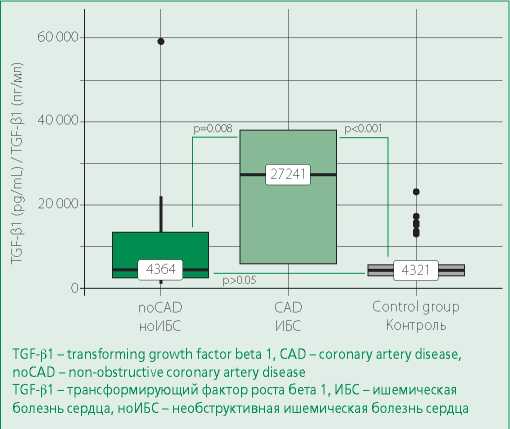
Figure 2. TGF-β1 levels in groups
Рисунок 2. Уровни TGF-β1 в группах

Figure 3. Probability of having a non-obstructive lesion from the level of TGF-β1 in patients with verified coronary artery disease
Рисунок 3. Вероятность наличия необструктивного поражения от уровня TGF-β1 у больных с верифицированной ИБС
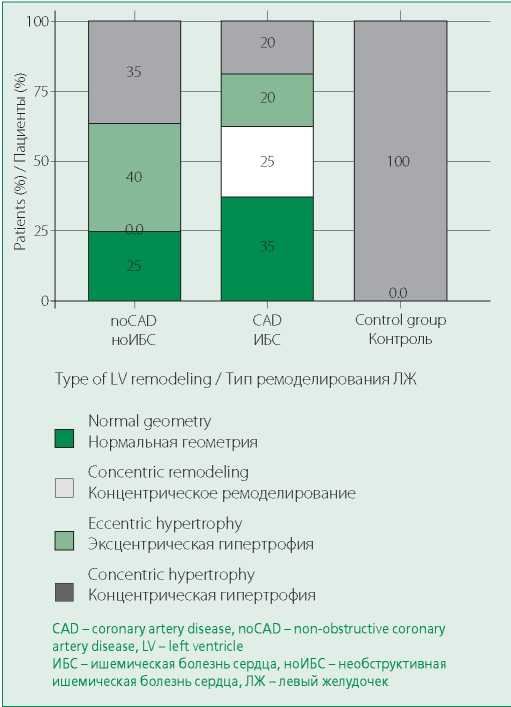
Figure 4. Type of left ventricular myocardial remodeling depending on the group
Рисунок 4. Тип ремоделирования миокарда ЛЖ в зависимости от группы
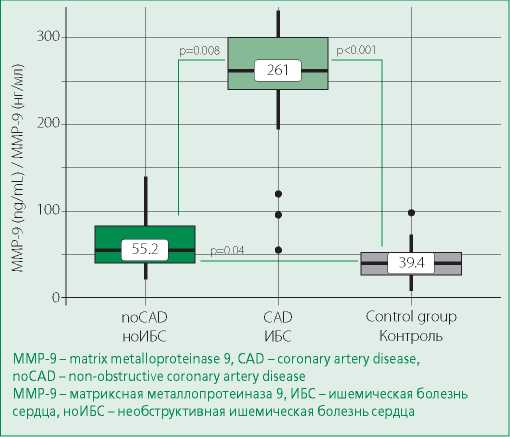
Figure 5. MMP-9 levels in groups
Рисунок 5. Уровень MMP-9 в группах
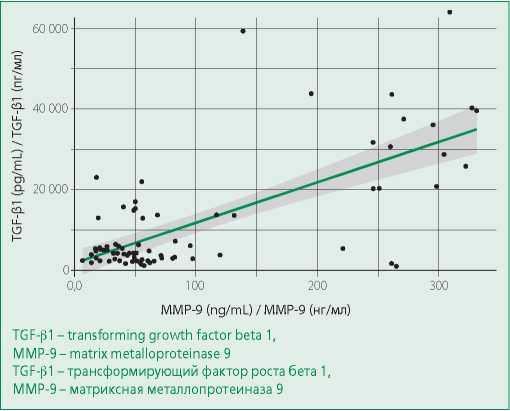
Figure 6. Plot of the regression function characterizing the dependence of TGF-β1 on MMP-9
Рисунок 6. График регрессионной функции, характеризующий зависимость TGF-β1 от MMP-9
Обсуждение
Имеются противоречивые данные об уровне белков, участвующих в сигнальном пути TGF-β у пациентов с обструктивной ИБС [14-16]. Изучение пенистых клеток в атеросклеротических бляшках у больных атеросклерозом свидетельствует об активации этого сигнального пути и повышении экспрессии белка TGF-β1 макрофагами в стенке артерий [17]. С другой стороны, имеются данные и о защитном действии TGF-β1 [18,19], поскольку эффекты активации сигнального пути TGFβ зависят от типа клеток и стадии атеросклероза [3]. Кардиопротекция может быть обеспечена ингибированием фактора некроза опухоли-α и активных форм кислорода [20].
ММР-9 был выбран в качестве одного из активаторов TGF-β. Уровни ММР-9 у здоровых добровольцев и пациентов с необструктивной ИБС различались, что также могло косвенно свидетельствовать об активации TGF-β1 в стенках КА. Анализ представленной ROCкривой был использован для оценки вероятности наличия гемодинамически незначимого стеноза у больных с верифицированной ИБС по уровням активации процессов фиброза и ремоделирования миокарда за счет повышения концентрации TGF-β1. Однако эта модель не включает такие факторы, как пол, возраст и сопутствующие заболевания. TGF-β1 является одним из основных стимуляторов процесса развития фиброза тканей [21], его экспрессия приводит к гипертрофии и ремоделированию сердца [22]. Анализ зависимости между данными эхокардиографии и биологическими маркерами показал наиболее высокие уровни TGFβ1 и MMP-9 у больных с эксцентрической гипертрофией миокарда ЛЖ. Этот тип ремоделирования наблюдался только у больных с гемодинамически значимым стенозом КА. Эксцентрическая гипертрофия ЛЖ возникает в результате перегрузки давлением и ишемии миокарда, что объясняет высокие уровни TGF-β1 в группе с обструкцией коронарного русла [23], это может быть обусловлено активацией сигнального пути TGF-β [24,25].
Полученные данные могут свидетельствовать об активации TGF-β1 и MMP-9 у пациентов с обструктивной ИБС, что указывает на активацию процессов фиброза. В основной группе таких изменений не выявлено, учитывая различия в уровнях биомаркеров, вероятнее всего, изменения в сосудистой стенке у пациентов с необструктивным поражением КА начинаются с активации воспаления. Теория воспаления в патогенезе ССЗ обсуждается уже много лет. Ежегодно проводятся масштабные исследования, подтверждающие гипотезу о роли воспаления в патогенезе ИБС. В исследовании CANTOS (Canakinumab Antiinflammatory Thrombosis Outcomes Study) показано, что интерлейкины (в частности, интерлейкин-1β) играют важную роль в патогенезе ИБС [26]. Исследования с колхицином COLCOT (Colchicine Cardiovascular Outcomes Trial) и LoDoCo 2 (Low Dose Colchicine 2) также подтверждают воспалительную теорию атеросклероза [27]. На животных моделях необструктивной ИБС описана активация высвобождения лептина, резистина, ИЛ-6 и фактора некроза опухоли-α [28]. Таким образом, предполагается, что необходимы лизаты тканей КА для верификации наличия воспаления в стенках сосудов у больных с ИБС и гемодинамически незначимым стенозом, что требует проведения инвазивных процедур. Применение нового метода – коронарной компьютерной томографической ангиографии (ККА) у больных с гемодинамически незначимым стенозом позволило визуализировать воспаление в стенках эпикардиальных артерий сердца путем анализа измененного сигнала от периваскулярной жировой ткани [29].
Ограничения исследования. Исследование имеет некоторые ограничения. Во-первых, для более точных выводов требуется больше пациентов с необструктивной ИБС. Во-вторых, достаточно сложно подобрать однородные по возрасту группы контроля и пациентов. В российской популяции трудно найти здоровых лиц без сердечно-сосудистых заболеваний сопоставимого возраста с пациентами. Кроме того, на уровень TGFβ1 в группе больных ИБС может влиять артериальная гипертензия и гипертрофическое ремоделирование, вызванное перегрузкой объемом.
Заключение
В исследовании представлены данные об уровне TGF-β1 и ММР-9 у пациентов с обструктивной и необструктивной формами ИБС. Выявлены значимые различия между исследуемой группой (ноИБС) и группой сравнения (обструктивной ИБС), однако различия со здоровыми добровольцами обнаружены только для ММР-9. TGF-β1 и ММР-9 ассоциированы с коронарным атеросклерозом. Матриксные металлопротеиназы в будущем могут стать терапевтической мишенью, а также биомаркером в диагностике ИБС. В настоящее время применяют препараты с механизмом действия, основанным на ингибировании TGF-β. Вероятно, в будущем разработают новые препараты, блокирующие этот сигнальный путь, которые будут рекомендованы пациентам с различными типами ИБС.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование. Исследование выполнено при финансовой поддержке Российского научного фонда в виде научного проекта № 22-15-00424, научного гранта «Роль активации сигнального каскада WNT, процессов его эпигенетической регуляции и иммуноопосредованного воспаления в прогрессировании атеросклероза и возможности влияния на него методом терапевтического неоангиогенеза у пациентов со стабильной ишемической болезнью сердца».
Funding. The study was financially supported by the Russian Science Foundation in the form of scientific project No. 22-15-00424, scientific grant "The role of activation of the WNT signaling cascade, the processes of its epigenetic regulation and immune-mediated inflammation in the progression of atherosclerosis and the possibility of influencing it by therapeutic neoangiogenesis in patients with stable ischemic heart disease."
Список литературы
1. The top 10 causes of death [cited 2022 Jan 12]. Available from: https://www.who.int/newsroom/fact-sheets/detail/the-top-10-causes-of-death.
2. Gibbs RA. The Human Genome Project changed everything. Nat Rev Genet. 2020;21(10):575-6. DOI:10.1038/s41576-020-0275-3.
3. Low EL, Baker AH, Bradshaw AC. TGFβ smooth muscle cells and coronary artery disease: a review. Cell Signal. 2019;53:90-101. DOI:10.1016/j.cellsig.2018.09.004
4. Hata A, Chen YG. TGF-β signaling from receptors to smads. Cold Spring Harb Perspect Biol. 2016;8(9):a022061. DOI:10.1101/cshperspect.a022061.
5. Morikawa M, Derynck R, Miyazono K. TGF-β and the TGF-β family: Context-dependent roles in cell and tissue physiology. Cold Spring Harb Perspect Biol. 2016;8(5):a021873. DOI:10.1101/cshperspect.a021873.
6. Dobaczewski M, Chen W, Frangogiannis NG. Transforming growth factor (TGF)-β signaling in cardiac remodeling. J Mol Cell Cardiol. 2011;51(4):600-6. DOI:10.1016/j.yjmcc.2010.10.033.
7. Wang JH, Zhao L, Pan X, et al. Hypoxia-stimulated cardiac fibroblast production of IL-6 promotes myocardial fibrosis via the TGF-β1 signaling pathway. Lab Investig [Internet]. 2016;96(8):839-52. DOI:10.1038/labinvest.2016.65.
8. Hu HH, Chen DQ, Wang YN, et al. New insights into TGF-β/Smad signaling in tissue fibrosis. Chem Biol Interact. 2018;292:76-83. DOI:10.1016/j.cbi.2018.07.008.
9. Knuuti J, Wijns W, Achenbach S, et al. 2019 ESC guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020;41(3):407-77. DOI:10.1093/eurheartj/ehz425.
10. Jespersen L, Hvelplund A, Abildstrøm SZ, et al. Stable angina pectoris with no obstructive coronary artery disease is associated with increased risks of major adverse cardiovascular events. Eur Heart J. 2012;33(6):734-44. DOI:10.1093/eurheartj/ehr331.
11. Safdar B, Spatz ES, Dreyer RP, et al. Presentation, clinical profile, and prognosis of young patients with myocardial infarction with nonobstructive coronary arteries (MINOCA): Results from the VIRGO study. J Am Heart Assoc. 2018;7(13):e009174. DOI:10.1161/JAHA.118.009174.
12. Faul F, Erdfelder E, Buchner A, Lang AG. Statistical power analyses using G*Power 3.1: Tests for correlation and regression analyses. Behav Res Methods. 2009;41(4):1149-60. DOI:10.3758/BRM.41.4.1149.
13. Lang RM, Bierig M, Devereux RB, et al. Recommendations for chamber quantification. Eur J Echocardiogr. 2006;7(2):79-108. DOI:10.1016/j.euje.2005.12.014.
14. Grainger DJ, Kemp PR, Metcalfe JC, et al. The serum concentration of active transforming growth factor-beta is severely depressed in advanced atherosclerosis. Nat Med. 1995;1(1):74-9. DOI:10.1038/nm0195-74.
15. Erren M, Reinecke H, Junker R, et al. Systemic inflammatory parameters in patients with atherosclerosis of the coronary and peripheral arteries. Arterioscler Thromb Vasc Biol. 1999;19(10):2355-63. DOI:10.1161/01.atv.19.10.2355.
16. Wang XL, Liu SX, Wilcken DEL. Circulating transforming growth factor beta1 and coronary artery disease. Cardiovasc Res. 1997;34(2):404-10. DOI:10.1016/s0008-6363(97)00033-3.
17. van Dijk RA, Engels CC, Schaapherder AF, et al. Visualizing TGF-β and BMP signaling in human atherosclerosis: a histological evaluation based on Smad activation. Histol Histopathol. 2012;27(3):387- 96. DOI:10.14670/HH-27.387.
18. Grainger DJ. TGF-beta and atherosclerosis in man. Cardiovasc Res. 2007;74(2):213-22. DOI:10.1016/j.cardiores.2007.02.022.
19. Rodríguez-Vita J, Sánchez-Galán E, Santamaría B, et al. Essential role of TGF-β/Smad pathway on statin dependent vascular smooth muscle cell regulation. PLoS One. 2008;3(12):e3959. DOI:10.1371/journal.pone.0003959.
20. Lefer AM, Tsao P, Aoki N, Palladino MA. Mediation of cardioprotection by transforming growth factor-beta. Science.1990;249(4964):61-4. DOI:10.1126/science.2164258.
21. Border WA, Noble NA. Transformation growth factor β in tissue fibrosis. N Engl J Med. 1994;331(19):153-8. DOI:10.1056/NEJM199411103311907.
22. Kuwahara F, Kai H, Tokuda K, et al. Transforming growth factor-β function blocking prevents myocardial fibrosis and diastolic dysfunction in pressure-overloaded rats. Circulation. 2002;106(1):130- 5. DOI:10.1161/01.CIR.0000020689.12472.E0.
23. Li JM, Brooks G. Differential protein expression and subcellular distribution of TGFβ1, β2, and β3 in cardiomyocytes during pressure overload-induced hypertrophy. J Mol Cell Cardiol. 1997;29(8):2213- 24. DOI:10.1006/jmcc.1997.0457.
24. Bujak M, Ren G, Kweon HJ, et al. Essential role of Smad3 in infarct healing and in the pathogenesis of cardiac remodeling. Circulation. 2007;116(19):2127-38. DOI:10.1161/CIRCULATIONAHA.107.704197.
25. Xia Y, Lee K, Li N, D. et al. Characterization of the inflammatory and fibrotic response in a mouse model of cardiac pressure overload. Histochem Cell Biol. 2009;131(4):471-81. DOI:10.1007/s00418-008-0541-5.
26. Ali M, Girgis S, Hassan A, et al. Inflammation and coronary artery disease: From pathophysiology to Canakinumab Anti-Inflammatory Thrombosis Outcomes Study (CANTOS). Coron Artery Dis. 2018;29(5):429-37. DOI:10.1097/MCA.0000000000000625.
27. Nidorf SM, Fiolet ATL, Eikelboom JW, et al. The effect of low-dose colchicine in patients with stable coronary artery disease: The LoDoCo2 trial rationale, design, and baseline characteristics. Am Heart J. 2019;218:46-56. DOI:10.1016/j.ahj.2019.09.011.
28. Bagi Z, Feher A, Cassuto J, Microvascular responsiveness in obesity: Implications for therapeutic intervention. Br J Pharmacol. 2012;165(3):544-60. DOI:10.1111/j.1476-5381.2011.01606.x.
29. Pasqualetto MC, Tuttolomondo D, Cutruzzolà A, et al. Human coronary inflammation by computed tomography: Relationship with coronary microvascular dysfunction. Int J Cardiol. 2021;336:8-13. DOI:10.1016/j.ijcard.2021.05.040.
Об авторах
Н. Н. ПахтусовРоссия
Пахтусов Николай Николаевич
Москва
А. О. Юсупова
Россия
Юсупова Альфия Оскаровна
Москва
К. А. Жбанов
Россия
Жбанов Константин Александрович
Москва
А. А. Щендрыгина
Россия
Щендрыгина Анастасия Александровна
Москва
Е. В. Привалова
Россия
Привалова Елена Витальевна
Москва
Ю. Н. Беленков
Россия
Беленков Юрий Никитич
Москва
Рецензия
Для цитирования:
Пахтусов Н.Н., Юсупова А.О., Жбанов К.А., Щендрыгина А.А., Привалова Е.В., Беленков Ю.Н. Оценка маркеров фиброза, как потенциального метода диагностики необструктивного поражения коронарных артерий у больных стабильной ишемической болезнью сердца. Рациональная Фармакотерапия в Кардиологии. 2022;18(6):630-637. https://doi.org/10.20996/1819-6446-2022-11-01
For citation:
Pakhtusov N.N., Yusupova A.O., Zhbanov K.A., Shchedrygina A.A., Privalova E.V., Belenkov Yu.N. Evaluation of Fibrosis Markers as a Potential Method for Diagnosing Non-Obstructive Coronary Artery Disease in Patients with Stable Coronary Artery Disease. Rational Pharmacotherapy in Cardiology. 2022;18(6):630-637. (In Russ.) https://doi.org/10.20996/1819-6446-2022-11-01

















































