Перейти к:
Натрийурез как способ оценки эффективности диуретической терапии острой декомпенсированной сердечной недостаточности: данные пилотного исследования
https://doi.org/10.20996/1819-6446-2022-12-13
Аннотация
Цель. Проанализировать клиническое значение уровня натрия в разовом анализе мочи, полученном через 2 ч после введения первой дозы петлевого диуретика, у пациентов с острой декомпенсацией хронической сердечной недостаточности (ОДСН).
Материал и методы. Обсервационное исследование проведено на базе скоропомощной больницы. Оценивались концентрация натрия в анализе мочи, полученном через 2 ч после внутривенного введения первой дозы петлевого диуретика, и натрийурез за первые сутки госпитализации. За первичную конечную точку было принято развитие резистентности к диуретикам (необходимость увеличения суточной дозы фуросемида более чем в 2 раза по сравнению с исходной или же добавления другого класса диуретических препаратов).
Результаты. Было включено 25 пациентов с ОДСН (средний возраст 69,0±14,8 лет; 16 (64%) мужчин). Средняя фракция выброса левого желудочка (ФВЛЖ) равнялась 49,0±13,5%. Медиана уровня N‐концевого фрагмента мозгового натрийуретический пептида (NT-proBNP) составила 3416 (2128; 5781) пг/мл. Средняя концентрация натрия в анализе мочи, полученном через 2 ч от начала лечения, равнялась 100,6±41,0 ммоль/л, а концентрация натрия мочи за первые сутки – 102,2±39,0 ммоль/л. Спустя 2 часа от начала лечения концентрация натрия в разовом анализе мочи была менее 50 ммоль/л у 5 (20%) пациентов. При дальнейшем наблюдении олигоанурия (определяемая как диурез <400 мл в течение 24 ч) развилась у 2 них. Олигоанурии не было выявлено среди пациентов, у которых концентрация натрия была >50 ммоль/л. Необходимость эскалации (любого увеличения дозы петлевого диуретика и/или добавления другого класса диуретических препаратов) возникла у 7 (28%) пациентов; при этом у 5 (20%) из них нами было диагностировано развитие резистентности к диуретикам. Резистентность к диуретикам чаще встречалась среди пациентов с концентрацией натрия в разовом анализе мочи, полученном через 2 ч от начала введения фуросемида, менее 50 ммоль/л (p=0,037); при разделении набранной популяции пациентов на подгруппы с концентрацией натрия в разовом анализе мочи ≥50 ммоль/л и <50 ммоль/л не было выявлено значимого различия в необходимости любой эскалации диуретической терапии [3 (60%) против 4 (20%), р=0,07].
Заключение. Резистентность к диуретикам чаще встречается среди пациентов с концентрацией натрия в разовом анализе мочи, полученном через 2 ч после введения первой дозы фуросемида, <50 ммоль/л. Оценка натрийуреза позволяет уже в начале лечения выявить недостаточную эффективность диуретической терапии.
Ключевые слова
Для цитирования:
Чарая К.В., Щекочихин Д.Ю., Тарасенко С.Н., Ананичева Н.А., Советова С.А., Соболева Т.В., Дикур О.Н., Боренштейн А.И., Андреев Д.А. Натрийурез как способ оценки эффективности диуретической терапии острой декомпенсированной сердечной недостаточности: данные пилотного исследования. Рациональная Фармакотерапия в Кардиологии. 2022;18(6):656-661. https://doi.org/10.20996/1819-6446-2022-12-13
For citation:
Charaya K.V., Shchekochikhin D.Yu., Tarasenko S.N., Ananicheva N.A., Sovetova S.A., Soboleva T.V., Dikur O.N., Borenstein A.I., Andreev D.A. Natriuresis as a Way to Assess the Effectiveness of Diuretic Therapy for Acute Decompensated Heart Failure: Data from a Pilot Study. Rational Pharmacotherapy in Cardiology. 2022;18(6):656-661. (In Russ.) https://doi.org/10.20996/1819-6446-2022-12-13
Введение
Острая декомпенсация хронической сердечной недостаточности (ОДСН) является одной из ведущих причин госпитализаций и характеризуется неблагоприятным прогнозом [1]. У большинства пациентов клиническая манифестация ОДСН проявляется симптомами перегрузки объемом [2], что определяет достижение эуволемии как основную цель лечения ОДСН [3].
История применения петлевых диуретиков началась в 60-х гг. XX века, и с тех пор данная группа препаратов остается краеугольным камнем лечения перегрузки объемом при сердечной недостаточности (СН) [4]. Европейским обществом кардиологов (ЕОК) был предложен алгоритм, определяющий начальную дозу петлевого диуретика [5], однако общепринятая схема дозирования до сих пор отсутствует [6]. Распространенной проблемой остается оценка эффективности диуретической терапии [7], поскольку применяемые в клинической практике методы признаны неспецифичными и слабо коррелируют друг с другом [8]. Раннее выявление резистентности к диуретикам и своевременная коррекция доз могли бы улучшить прогноз у пациентов с ОДСН [9].
Прямая корреляция экскреции натрия и эффективности диуретической терапии была продемонстрирована ранее в ряде исследований [10-12]. В недавно опубликованных рекомендациях ЕОК в качестве одной из целей диуретической терапии предложена концентрация натрия в анализе мочи, полученном через 2 ч после внутривенного введения первой дозы петлевого диуретика. Концентрация натрия 50 ммоль/л была признана пороговой для определения адекватности ответа на проводимую терапию [13].
До сих пор не проведено проспективных исследований, подтверждающих целесообразность внедрения данного протокола в клиническую практику [8].
Цель исследования – определить клиническое значение уровня натрия в разовом анализе мочи, полученном через 2 ч после введения первой дозы петлевого диуретика, у пациентов с ОДСН.
Материал и методы
Открытое обсервационное исследование проведено на базе скоропомощной больницы. Протокол исследования одобрен локальным этическим комитетом Сеченовского Университета (выписка № 33-20).
Пациенты
Исследование включало пациентов старше 18 лет, госпитализированных с диагнозом ОДСН и нуждающихся во внутривенном введении петлевых диуретиков. Диагноз ОДСН ставился на основании актуальных рекомендации [5].
Критерии включения: госпитализация по поводу ОДСН с по крайней мере одним признаком перегрузки объемом (периферическим отеком, асцитом или плевральным выпотом); использование ≥ 40 мг фуросемида или эквивалентной дозы другого петлевого диуретика в течение >1 мес до настоящей госпитализации; N‐концевой фрагмент мозгового натрийуретического пептида (NT-proBNP) >1000 пг/л.
Критерии исключения: кардиогенный шок (снижение систолического давления (САД) <90 мм рт.ст., среднее артериальное давление <65 мм рт.ст. в течение более 30 мин или необходимость в вазопрессорах для поддержания систолического давления ≥90 мм рт. ст.; признаки критической гипоперфузии органов – измененный психический статус, холодные, мраморные кожные покровы, снижение темпа диуреза менее 30 мл/час, уровень лактата крови >2,0 ммоль/л); заместительная почечная терапия или ультрафильтрация; использование внутривенных инотропных препаратов (допамина, добутамина, левосимендана, милринона или адреналина); скорость клубочковой фильтрации (СКФ CKD EPI) <30 мл/мин [14].
Протокол исследования
Скрининг и включение в исследование проводились в течение первых 2 ч госпитализации. Пациенты включались в исследование после подписания добровольного информированного согласия.
Первую внутривенную дозу фуросемида пациенты получали после опорожнения мочевого пузыря путем самостоятельного мочеиспускания. Основой лечения пациентов, согласно актуальным клиническим рекомендациями [5], являлось внутривенное введение петлевых диуретиков, однако режим и дозировки препаратов оставались на усмотрение лечащего врача. С момента введения первой дозы фуросемида начинался сбор суточной мочи. Через 2 ч у пациентов также брался разовый анализ мочи.
По истечении 24 ч от начала лечения сбор суточной мочи прекращался и после измерения объема суточного диуреза из всего объема суточной мочи брался образец в объеме 30 мл.
В собранных образцах мочи (разовом, полученном через 2 ч от начала терапии, и среднесуточном) проводился биохимический анализ с целью оценки концентрации натрия. Моча поступала в местную клиническую лабораторию в день взятия образца. Концентрация натрия определялась с помощью ионоселективного электрода в течение двух часов с момента поступления анализов в лабораторию.
За время наблюдения оценивались динамика веса пациентов (вес измерялся при поступлении, затем каждое утро натощак), объема суточного диуреза, клинического состояния (наличие хрипов в легких при аускультации, периферических отеков, плеврального выпота, набухания яремных вен, гепатомегалии) и биохимических показателей крови (уровень сывороточного креатинина, мочевины, калия, натрия, хлора).
В качестве первичной конечной точки были приняты случаи развития резистентности к диуретикам (необходимость увеличения суточной дозы петлевых диуретиков более чем в 2 раза по сравнению с исходной или же добавления другого класса диуретических препаратов [15]). Начальной считалась суточная доза петлевых диуретиков, используемая в первые сутки госпитализации.
Статистический анализ
Нормальность распределения определяли с помощью критерия Шапиро-Уилка. Переменные с нормальным распределением описывались средним значением и стандартным отклонением (M±SD). Переменные с ненормальным распределением описывались медианой (Me) и межквартильным диапазоном (25%; 75%) и сравнивались при помощи непараметрических тестов. Для сравнения групп по количественным переменным использовался t-критерий Стьюдента (при условии нормального распределения) или критерий Манна-Уитни (при ненормальном распределении). Категориальные переменные были представлены в виде абсолютных и относительных значений, для их сравнения, в зависимости от ситуации, использовались критерий хи-квадрат или точный критерий Фишера. Для определения связи между концентрацией натрия мочи и объемом диуреза использованы многомерная и логистическая регрессионная модель, непараметрический метод ранговой корреляции Спирмена. Вычисления проводили с использованием программного обеспечения SPSS Statistics 24 (IBM, США). Различия считались достоверными при значениях p<0,05.
Результаты
В исследование было включено 25 пациентов с ОДСН (Табл. 1П; приложение). Средний возраст пациентов составил 69,0±14,8 лет, 16 (64%) из них были мужчины. По данным эхокардиографии (ЭХОКГ) средняя фракция выброса левого желудочка (ФВ ЛЖ) равнялась 49,0±13,5 %, у 15 (60%) пациентов ФВЛЖ была сохранна. Ишемический генез СН отмечался у 11 (44%) пациентов. Средняя СКФ равнялась 62±21 ммоль/л, медиана уровня NT-proBNP – 3416 (2128; 5781) пг/мл.
Дозы петлевых диуретиков, принимаемые пациентами в течение месяца до настоящей госпитализации, равнялись 40 (40; 65) мг (Табл. 2П; приложение); в течение первых двух часов с момента поступления в среднем пациентам было назначено 113,6±36,4 мг фуросемида внутривенно. Средняя концентрация натрия в разовом анализе, полученном через 2 ч от начала лечения, равнялась 100,6±41,0 ммоль / л; концентрация натрия мочи за первые сутки составила 102,2±39,0 ммоль/л.
В первые сутки госпитализации пациентам не назначались тиазидные и тиазидоподобные диуретики, ингибиторы карбоангидразы, ангиотензиновых рецепторов и неприлизина ингибиторы (АРНИ), натрийуретические дозы антагонистов минералокортикоидных рецепторов и ингибиторы натрий-глюкозного котранспортера 2-го типа.
Нами была выявлена сильная положительная корреляция концентрации натрия в разовом анализе мочи с объемом диуретического ответа за первые сутки (r=0,72; р<0,01;) (рис. 1) и концентрацией натрия мочи за первые сутки госпитализации (r=0,85; р<0,01;) (рис. 2).
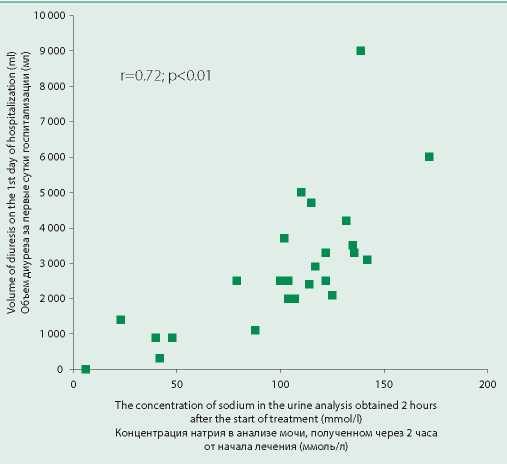
Figure 1. Correlation of sodium concentration in urine analysis obtained 2 hours after administration of the first dose of loop diuretic with the volume of diuresis during on the first day of hospitalization
Рисунок 1. Корреляция концентрации натрия в анализе мочи, полученном через 2 ч от введения первой дозы петлевого диуретика, с объемом диуреза за первые сутки госпитализации
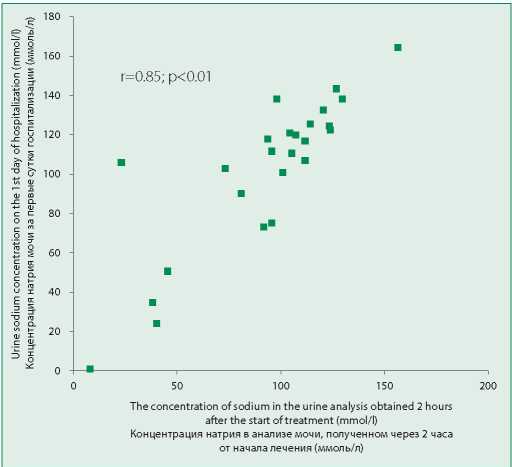
Figure 2. Correlation of sodium concentration in urine analysis obtained 2 hours after administration of the first dose of loop diuretic with urine sodium concentration for the first day of hospitalization
Рисунок 2. Корреляция концентрации натрия в анализе мочи, полученном через 2 часа от введения первой дозы петлевого диуретика, с концентрацией натрия мочи за первые сутки госпитализации
Спустя 2 ч от начала лечения концентрация натрия в разовом анализе мочи была <50 ммоль/л у 5 (20%) пациентов. При дальнейшем наблюдении олигоанурия (определяемая как диурез <400 мл в течение 24 ч [16]) развилась у 2 из них. Олигоанурии не было выявлено среди пациентов с концентрацией натрия ≥50 ммоль/л.
Необходимость эскалации (любого увеличения дозы петлевого диуретика и/или добавления другого класса диуретических препаратов) возникла у 7 (28%) пациентов; при этом у 5 (20%) из них нами было диагностировано развитие резистентности к диуретикам. У 2 из описанных пациентов (Пациенты 13 и 16) добавление ацетазоламида было связано с сопутствующим синдромом обструктивного апноэ сна, в связи с чем коррекция лечения не была расценена как проявление резистентности к диуретикам.
У 4 (16%) дозы фуросемида были уменьшены (Пациенты 6, 9, 22, 23). Резистентность к диуретикам чаще встречалась среди пациентов с концентрацией натрия в разовом анализе мочи <50 ммоль/л [ 3 (60%) против 2 (10%), p=0,038]; при разделении набранной популяции пациентов на подгруппы с концентрацией натрия в разовом анализе мочи ≥50 ммоль/л и <50 ммоль/л не было выявлено значимой разницы в необходимости любой эскалации диуретической терапии [ 3 (60%) портив 4 (20%), р=0,07]. Относительный риск (ОР) возникновения резистентности к диуретикам среди пациентов с концентрацией натрия мочи <50 ммоль/л составил 6,000 (1,343; 26,809).
Обсуждение
В перечисленных нами клинических примерах показана связь экскреции натрия с эффективностью диуретической терапии ОДСН.
Впервые роль натрия мочи была продемонстрирована D. Singh и соавт. [17], в исследовании которого концентрация натрия <50 ммоль/л в суточной моче у пациентов с ОДСН была связана со сниженным ответом на диуретики.
Полученные результаты поставили вопрос о возможности использования концентрации натрия мочи как ранний маркер эффективности диуретической терапии. Testani J.M и соавт. [18] было показано, что концентрация натрия <60 ммоль/л в разовой порции мочи, полученной через 2 ч после введения первой внутривенной дозы фуросемида, может быть предиктором недостаточного диуретического ответа в течение 6 часов от начала лечения. В дальнейшем корреляция концентрации натрия с объемом диуреза была подтверждена в ряде клинических исследований [19]. Руководствуясь перечисленными результатами, ЕОК добавило концентрацию натрия в анализе мочи, полученном через 2 ч после начала лечения, в недавно опубликованные рекомендации [5].
При лечении ОДСН исключительно важно, чтобы начальная доза диуретика оказалась эффективной. Известно, что для успешного лечения необходим как можно более ранний регресс застойных явлений, неотъемлемым условием которого является адекватный ответ на диуретическую терапию [20]. Так, в одном исследовании [21] было показано, что ответ на диуретики за первые 6 ч лечения имеет не меньшее прогностическое значение, чем за 48 ч. Однако доступные в настоящее время качественные и количественные методы плохо коррелируют друг с другом [7][22] и не позволяют провести раннюю (в течение нескольких часов) оценку эффективности лечения [3][7].
Концентрация натрия в первом анализе мочи, полученном через 2 ч от начала лечения, определяла ответ на диуретическую терапию и в нашем исследовании. Об этом говорит высокая положительная корреляция концентрации натрия с объемом диуреза за первые сутки госпитализации (r=0,72; р<0,01). Таким образом, мы показали, что уже через 2 ч после введения первой дозы петлевого диуретика можно судить об эффективности лечения и проводить коррекцию терапии.
Натрий определяет объем внеклеточной жидкости, а СН в целом характеризуется увеличением его реабсорбции в почках. Соответственно, именно экскреция натрия является целью лечения перегрузки объемом при СН [20,23]. В исследовании ROSE-AHF (Renal Optimization Strategies Evaluation in Acute Heart Failure) прогноз пациентов после выписки определялся натрийурезом, а не объемом диуреза [24]. Косвенным свидетельством определяющей роли именно натрийуреза являются результаты применения препаратов из группы антагонистов антидиуретического гормона, или ваптанов, при ОДСН. В многочисленных исследованиях не было продемонстрировано, что ваптаны улучшают прогноз при ОДСН, несмотря на значимое увеличение объема диуреза [25]. В нашем исследовании концентрация натрия в анализе мочи, полученном через 2 ч от начала лечения, коррелировала как с концентрацией натрия мочи за первые сутки госпитализации, так и с соответствующим объемом диуреза, что ещё раз подчеркивает целесообразность её использования с целью прогноза эффективности лечения.
Даже при подборе адекватной начальной дозы петлевого диуретика могут возникнуть сложности, связанные с индивидуальными особенностями ответа пациента на проводимую терапию. Уменьшение ответа на диуретики, возникшее в процессе лечения, может быть следствием так называемого феномена ускользания, в результате которого объем диуреза уменьшается, несмотря на адекватный режим диуретической терапии и персистирование застойных явлений [23]. Резистентность к диуретикам является распространенной проблемой и характеризуется неблагоприятным прогнозом [15]. Пациент, госпитализированный в связи с ОДСН, должен быть выписан без застойных явлений [3], недостаточный регресс которых связан с худшим прогнозом и увеличением смертности от всех причин. Однако известно, что 20-30% пациентов выписываются с остаточным застоем [26]. В настоящее время отсутствуют инструменты, позволяющие осуществлять раннее (в течение первых часов) выявление резистентности к диуретикам [9]. В нашем исследовании резистентность (определяемая как необходимость увеличения суточной дозы петлевых диуретиков более чем в 2 раза по сравнению с исходной или же необходимость добавления другого класса диуретических препаратов [15]) к диуретикам чаще встречалась среди пациентов с концентрацией натрия в образце мочи, полученном через 2 часа от начала лечения, <50 ммоль/л. ОР, равный 6,0, также говорит более высокой вероятности развития резистентности к лечению с подгруппе пациентов с концентрацией натрия мочи <50 ммоль/л. Таким образом, простой анализ дает возможность проводить своевременную коррекцию проводимой терапии.
Ограничения исследования. Небольшое число пациентов ограничивает мощность исследования. Поскольку в исследование не включались пациенты c СКФ<30 мл/мин, а также требующие внутривенного применения инотропных и сосудорасширяющих препаратов, результаты не могут быть применены к общей популяции пациентов с ОДСН. Участники не были ослеплены. Нами не учитывались другие факторы, способные повлиять на концентрацию натрия мочи (например, принимаемые амбулаторно лекарственные препараты и особенности диеты пациентов). Включенные в исследование пациенты не получали терапию в условиях отделения реанимации и интенсивной терапии, что также ограничивает возможность применения наших результатов к общей популяции пациентов с ОДСН. Набранная популяция имеет некоторые специфические особенности, связанные с амбулаторным этапом лечения (несмотря на то, что у 6 пациентов ФВ ЛЖ была <40%, ни один из них не принимал АРНИ). Также стоит подчеркнуть отсутствие пациентов с имплантируемыми кардиовертерами-дефибрилляторами и кардиоресинхронизирующей терапией. У нас нет данных о динамике веса пациентов за время госпитализации, так как это не входило в задачи исследования.
Из-за отсутствия стандартизированного протокола лечения решение о дозировках и режимах назначения диуретических препаратов было оставлено на усмотрение лечащего врача, что также могло повлиять на полученные результаты.
Заключение
Резистентность к диуретикам чаще встречалась среди пациентов с концентрацией натрия в разовом анализе мочи, полученном через 2 ч после введения первой дозы фуросемида, <50 ммоль/л. Оценку натрийуреза является легко воспроизводимым, недорогим и простым в интерпретации методом, позволяющим уже в начале лечения выявить сниженный ответ на диуретики. Для подтверждения наших данных необходимы дальнейшие исследования натрийуреза на более широкой выборке пациентов с ОДСН.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование. Исследование проведено при поддержке Сеченовского Университета.
Funding. The study was performed with the support of the Sechenov University.
Благодарности. Мы выражаем благодарность за возможность публикации полученных результатов коллективу авторов международного многоцентрового исследования ENACT‐HF (The Efficacy of a Standardized Diuretic Protocol in Acute Heart Failure), в рамках которого была выполнена работа.
Acknowledgment. We are grateful for the opportunity to publish the results to the team of authors of the international multicenter study ENACT‐HF (The Effectiveness of a Standardized Diuretic Protocol in Acute Heart Failure), within which the work was carried out.
Список литературы
1. Savarese G, Lund LH. Global Public Health Burden of Heart Failure. Card Fail Rev. 2017;3(1):7-11. DOI:10.15420/cfr.2016:25:2.
2. Rubio-Gracia J, Demissei BG, Ter Maaten JM, et al. Prevalence, predictors and clinical outcome of residual congestion in acute decompensated heart failure. Int J Cardiol. 2018;1(258):185-91. DOI:10.1016/j.ijcard.2018.01.067.
3. Galluzzo A, Frea S, Boretto P, et al. Spot urinary sodium in acute decompensation of advanced heart failure and dilutional hyponatremia: insights from DRAIN trial. Clin Res Cardiol. 2020;109(10):1251- 9. DOI:10.1007/s00392-020-01617-w.
4. Ter Maaten JM, Damman K. Down the road from challenges in acute heart failure trials. Eur J Heart Fail. 2019;21(11):1423-5. DOI:10.1002/ejhf.1571.
5. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599-726. DOI:10.1093/eurheartj/ehab368.
6. Verbrugge FH, Damman K, Tang WHW. Diuretics in cardiorenal syndrome: what's new? Intensive Care Med. 2018;44(3):359-62. DOI:10.1007/s00134-017-4834-9.
7. Verbrugge FH. Editor's Choice-Diuretic resistance in acute heart failure. Eur Heart J Acute Cardiovasc Care. 2018;7(4):379-89. DOI:10.1177/2048872618768488.
8. Dauw J, Lelonek M, Zegri-Reiriz I, et al. Rationale and Design of the Efficacy of a Standardized Diuretic Protocol in Acute Heart Failure Study. ESC Heart Fail. 2021;8(6):4685-92. DOI:10.1002/ehf2.13666.
9. Cunningham JW, Sun JL, Mc Causland FR, et al. Lower urine sodium predicts longer length of stay in acute heart failure patients: Insights from the ROSE AHF trial. Clin Cardiol. 2020;43(1):43-9. DOI:10.1002/clc.23286.
10. Damman K, Ter Maaten JM, Coster JE, et al. Clinical importance of urinary sodium excretion in acute heart failure. Eur J Heart Fail. 2020;22(8):1438-47. DOI:10.1002/ejhf.1753.
11. Tersalvi G, Dauw J, Gasperetti A, et al. The value of urinary sodium assessment in acute heart failure. Eur Heart J Acute Cardiovasc Care. 2021;10(2):216-23. DOI:10.1093/ehjacc/zuaa006.
12. Ellison DH, Felker GM. Diuretic Treatment in Heart Failure [published correction appears in N Engl J Med. 2018 Feb 1;378(5):492]. N Engl J Med. 2017;377(20):1964-1975. DOI:10.1056/NEJMra1703100
13. Mullens W, Damman K, Harjola VP, et al. The use of diuretics in heart failure with congestion - a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2019;21(2):137-55. DOI:10.1002/ejhf.1369.
14. Levey AS, Stevens LA, Schmid CH, et al. A new equation to estimate glomerular filtration rate [published correction appears in Ann Intern Med. 2011 Sep 20;155(6):408]. Ann Intern Med 2009;150(9):604-612. DOI:10.7326/0003-4819-150-9-200905050-00006.
15. Vaduganathan M, Kumar V, Voors AA, Butler J. Unsolved challenges in diuretic therapy for acute heart failure: a focus on diuretic response. Expert Rev Cardiovasc Ther. 2015;13(10):1075-8. DOI:10.1586/14779072.2015.1087313.
16. Howitt SH, Oakley J, Caiado C, et al. A Novel Patient-Specific Model for Predicting Severe Oliguria; Development and Comparison With Kidney Disease: Improving Global Outcomes Acute Kidney Injury Classification. Crit Care Med. 2020;48(1):e18-e25. DOI:10.1097/CCM.0000000000004074.
17. Singh D, Shrestha K, Testani JM, et al. Insufficient natriuretic response to continuous intravenous furosemide is associated with poor long-term outcomes in acute decompensated heart failure. J Card Fail. 2014;20(6):392-9. DOI:10.1016/j.cardfail.2014.03.006.
18. Testani JM, Hanberg JS, Cheng S, et al. Rapid and Highly Accurate Prediction of Poor Loop Diuretic Natriuretic Response in Patients With Heart Failure. Circ Heart Fail. 2016;9(1):e002370. DOI:10.1161/CIRCHEARTFAILURE.115.002370.
19. Biegus J, Zymliński R, Sokolski M, et al. Serial assessment of spot urine sodium predicts effectiveness of decongestion and outcome in patients with acute heart failure. Eur J Heart Fail. 2019;21(5):624- 33. DOI:10.1002/ejhf.1428.
20. Verbrugge FH. Utility of Urine Biomarkers and Electrolytes for the Management of Heart Failure. Curr Heart Fail Rep. 2019;16(6):240-9. DOI:10.1007/s11897-019-00444-z.
21. Kuroda S, Damman K, Ter Maaten JM, et al. Very Early Diuretic Response After Admission for Acute Heart Failure. J Card Fail. 2019;25(1):12-9. DOI:10.1016/j.cardfail.2018.09.004.
22. Кобалава Ж.Д., Кохан Л.В., Сафарова А.Ф., и др. Современные инструментальные возможности выявления и мониторирования бессимптомного застоя у пациентов с сердечной недостаточностью. Российский Кардиологический Журнал. 2021;(1):186- 92.
23. Verbrugge FH, Dupont M, Steels P, et al. The kidney in congestive heart failure: 'are natriuresis, sodium, and diuretics really the good, the bad and the ugly?'. Eur J Heart Fail. 2014;16(2):133-42. DOI:10.1002/ejhf.35.
24. Hodson DZ, Griffin M, Mahoney D, et al. Natriuretic Response Is Highly Variable and Associated With 6-Month Survival: Insights From the ROSE-AHF Trial. JACC Heart Fail. 2019;7(5):383-91. DOI:10.1016/j.jchf.2019.01.007.
25. Verbrugge FH. Decongestion: more than meets the eye! Eur J Heart Fail. 2016;18(2):192-4. DOI:10.1002/ejhf.475.
26. Rubio-Gracia J, Demissei BG, Ter Maaten JM, et al. Prevalence, predictors and clinical outcome of residual congestion in acute decompensated heart failure. Int J Cardiol. 2018;258:185-91. DOI:10.1016/j.ijcard.2018.01.067.
Об авторах
К. В. ЧараяРоссия
Чарая Кристина Вахтанговна
Москва
Д. Ю. Щекочихин
Россия
Щекочихин Дмитрий Юрьевич
Москва
С. Н. Тарасенко
Россия
Тарасенко Светлана Николаевна
Москва
Н. А. Ананичева
Россия
Ананичева Наталия Александровна
Москва
С. А. Советова
Россия
Советова Софья Андреевна
Москва
Т. В. Соболева
Россия
Соболева Татьяна Владимировна
Москва
О. Н. Дикур
Россия
Дикур Оксана Николаевна
Москва
А. И. Боренштейн
Россия
Боренштейн Александра Ильинична
Москва
Д. А. Андреев
Россия
Андреев Денис Анатольевич
Москва
Рецензия
Для цитирования:
Чарая К.В., Щекочихин Д.Ю., Тарасенко С.Н., Ананичева Н.А., Советова С.А., Соболева Т.В., Дикур О.Н., Боренштейн А.И., Андреев Д.А. Натрийурез как способ оценки эффективности диуретической терапии острой декомпенсированной сердечной недостаточности: данные пилотного исследования. Рациональная Фармакотерапия в Кардиологии. 2022;18(6):656-661. https://doi.org/10.20996/1819-6446-2022-12-13
For citation:
Charaya K.V., Shchekochikhin D.Yu., Tarasenko S.N., Ananicheva N.A., Sovetova S.A., Soboleva T.V., Dikur O.N., Borenstein A.I., Andreev D.A. Natriuresis as a Way to Assess the Effectiveness of Diuretic Therapy for Acute Decompensated Heart Failure: Data from a Pilot Study. Rational Pharmacotherapy in Cardiology. 2022;18(6):656-661. (In Russ.) https://doi.org/10.20996/1819-6446-2022-12-13

















































