Перейти к:
Острый коронарный синдром у пациентов, перенесших чрескожное коронарное вмешательство: современное состояние проблемы и данные клинической практики
https://doi.org/10.20996/1819-6446-2022-12-04
Аннотация
Цель. Изучить распространенность, клинические и эндоваскулярные предикторы, причины и сроки развития острого коронарного синдрома (ОКС) у пациентов, переносивших ранее чрескожное коронарное вмешательство (ЧКВ), а также клинические особенности заболевания и показатели липидного спектра.
Материал и методы. В исследование включено 768 пациентов, последовательно госпитализированных с 01.01.2019 по 01.01.2020 в Региональный сосудистый центр по поводу ОКС, перенесших ранее ургентную коронароангиографию (КАГ)
Результаты. В исследуемую группу вошли 768 пациентов, которым была выполнена ургентная КАГ по поводу ОКС, из них ранее переносили ЧКВ 90 человек (11,7%). Преобладали мужчины (66,7%), средний возраст 62 года. ОКС в течение года после коронарного стентирования развился у 25,5% пациентов, среднее время от ЧКВ до ОКС – 43 месяца. Преобладал вариант ОКС без элевации ST (80%). Результаты ретроспективного анализа первого ЧКВ продемонстрировали, что в 89,7% случаев выполнено вмешательство по срочным показаниям, 77,8% пациентов установлены голометаллические стенты. 67,1% больных имплантирован 1 стент, средний диаметр 3,2 мм, средняя длина 22 мм. В 12% случаев была выполнена тромбоаспирация, в 25% – предилатация и в 41,3% случае – NC постдилатация. Осложнения ЧКВ выявлены у 9% пациентов. Рентгеноморфологическим субстратом ОКС при повторной КАГ в 7,8% случаев оказался тромбоз стента, в 35,6% – значимый рестеноз. Повторное стентирование по поводу ОКС было выполнено 64,4% пациентов, из которых 74,6% имплантирован 1 стент; средний диаметр 3,4 мм, средняя длина – 24,0 мм. В 39,8% проведена бифуркационная пластика, в 6,9% – вмешательство на стволе левой коронарной артерии. В 52,9% случаев выполнена предилатация, в 41,2% – тромбоаспирация и в 86,7% случаев – NC постдилатация стентированного сегмента. Осложнения ЧКВ развились у 10%. Кроме того, у 99% пациентов при повторном ОКС выявлена значимая дислипидемия. Средний уровень холестерина составил 4,91 ммоль/л, средний уровень липопротеидов низкой плотности – 2,94 ммоль/л.
Заключение. Пациенты с предустановленными стентами составляют 12% среди всех больных с ОКС в клинической практике Регионального сосудистого центра. Наиболее распространенным эндоваскулярным предиктором развития повторного атеротромботического события является имплантация голометаллических стентов. Среди клинических причин неэффективности вторичной профилактики следует отметить недостижение целевых показателей липидного спектра.
Ключевые слова
Для цитирования:
Егорова И.С., Везикова Н.Н. Острый коронарный синдром у пациентов, перенесших чрескожное коронарное вмешательство: современное состояние проблемы и данные клинической практики. Рациональная Фармакотерапия в Кардиологии. 2022;18(6):669-675. https://doi.org/10.20996/1819-6446-2022-12-04
For citation:
Egorova I.S., Vezikova N.N. Acute Coronary Syndrome after Percutaneous Coronary Intervention: State of the Problem and Clinical Practice Data. Rational Pharmacotherapy in Cardiology. 2022;18(6):669-675. (In Russ.) https://doi.org/10.20996/1819-6446-2022-12-04
Введение
Актуальность болезней системы кровообращения (БСК) очевидна и определяется лидирующими показателями смертности взрослого населения как в Российской Федерации (РФ), так и в Европейском регионе. В нашей стране сердечно-сосудистые заболевания возглавляют структуру смертности и составляют 46,3% среди всех причин [1]. Несмотря на положительную тенденцию снижения данного показателя в последние годы, коэффициент смертности от БСК остается одним из самых высоких в Европе [2].
Одной из важнейших форм, приводящих к инвалидизации и смерти пациентов, является острый коронарный синдром (ОКС). В РФ регистрируется около 520 тыс. случаев ОКС в год. При этом отмечается тенденция к увеличению числа пациентов с этой патологией. Так, по данным Минздрава РФ с 2012 по 2017 г. заболеваемость ОИМ возросла с 130,6 до 135,3 случая на 100 тыс. населения [2]. Следует отметить, что лечение БСК связано со значительными затратами со стороны государства: в 2009 г. прямые затраты, связанные с лечением ОКС, составили 20, 9 млрд рублей, а непрямые – 53,5 млрд рублей [1]. Эти цифры убедительно демонстрируют социально-экономический ущерб, который вносит данная патология в масштабах страны.
В то же время привлечение значительных экономических и медицинских ресурсов, направленных на лечение пациентов с ОКС, позволяет оптимизировать тактику ведения при БСК и улучшить прогноз [2]. В частности, широкое внедрение современных методов своевременной реперфузии позволило снизить показатели госпитальной летальности. Однако наряду с непосредственным клиническим успехом наблюдается рост числа пациентов, переносивших сосудистые катастрофы и подвергшихся оперативным вмешательствам в коронарном бассейне [3], что определяет необходимость оценки отдаленных результатов лечения и рисков развития повторных событий с целью повышения эффективности вторичной профилактики. В то же время данные реальной российской клинической практики, позволяющие оценить клинические особенности течения заболевания у пациентов, ранее подвергшихся коронарной интервенции, в настоящее время ограничены, что обуславливает высокую актуальность проведенного исследования.
В РФ ежегодно выполняется свыше 200 тыс. стентирований, из которых на долю коронарных вмешательств приходится около 30%. Объемы коронарной интервенции, а следовательно, и когорта пациентов с имплантированными стентами ежегодно увеличиваются. Это определяет необходимость изучения особенностей клинического течения ишемической болезни сердца у пациентов, перенесших чрескожное коронарное вмешательство (ЧКВ), рисков развития в зоне стентирования осложнений, в том числе поздних, с целью оптимизации дальнейшего ведения и подбора эффективной персонифицированной медикаментозной терапии.
Известно, что в течение первого года после эндоваскулярной реваскуляризации миокарда риск тромбоза стента достигает 1%, а в последующем он снижается и составляет 0,2-0,4% в год. Частота развития значимых рестенозов в среднем около 5%, однако, по данным некоторых регистров, после имплантации стентов с лекарственным покрытием новых поколений она может достигать 10% [4], вероятно, вследствие активизации процессов неоатеросклероза [5].
Таким образом, учитывая ежегодные объемы вмешательств, формируется большая группа пациентов с клинически значимыми осложнениями зоны стентирования, которые, в свою очередь, ассоциированы с высоким риском развития инфаркта миокарда и смерти [6].
Предикторы рестенозов и тромбозов стентов изучены в различных исследованиях. К ним относят особенности ЧКВ (имплантация >2 стентов, протяженная длинна металлокаркаса, применение голометаллических стентов), клинические данные (возраст старше 50 лет, женский пол, уровень гемоглобина, креатинина), а также объем фармакотерапии [7][8].
В клинической практике большинство из этих факторов являются весьма распространенными и зачастую немодифицируемыми, что обуславливает необходимость выделения категорий риска с целью оптимизации и персонификации последующего ведения таких пациентов для предотвращения повторных атеротромботических событий. Несмотря на очевидные преимущества имплантации стентов с лекарственным покрытием новых поколений, в реальной практике нашей страны нередко по-прежнему преобладает имплантация голометаллических стентов, что делает проблему осложнений зоны стентирования особенной актуальной.
В то же время известные клинические и эндоваскулярные предикторы риска повторных атеротромботических событий встречаются нередко, однако их наличие приводит к развитию осложнений не у всех пациентов. Вследствие этого, помимо рутинных клинико-хирургических предикторов, активно изучаются дополнительные факторы риска развития осложнений в зоне стентирования с целью повышения прогностической ценности риск-стратификации. Так, продемонстрирована взаимосвязь между повышенным уровнем высокочувствительного С-реактивного белка с развитием рестеноза стента [9], и таких факторов, как уровень гемоглобина, креатинина, низкая фракция выброса левого желудочка и остаточная реактивность тромбоцитов и повторными атеротромботическими событиями [10], что можно дополнительно учитывать при персонифицированной оценке риска.
Цель исследования – изучить распространенность, клинические и эндоваскулярные предикторы, причины и сроки развития ОКС у пациентов, переносивших ранее чрескожное коронарное вмешательство (ЧКВ), а также клинические особенности заболевания и показатели липидного спектра.
Материал и методы
В исследование включено 768 пациентов, последовательно госпитализированных с 01.01.2019 г. по 01.01.2020 г. в Региональный сосудистый центр по поводу ОКС, перенесших ургентную коронароангиографию (КАГ). Диагноз ОКС выставлялся на основании стандартных диагностических критериев [11].
Все пациенты подписали добровольное информированное согласие на участие в исследовании. Протокол исследования был оформлен локальным этическим комитетом.
Была определена группа пациентов, ранее переносивших стентирование, проведен анализ рентгенанатомии коронарного русла и особенностей ЧКВ, сроков развития повторного атеротромботического события, распространенность коморбидной патологии и показателей липидного спектра.
Статистический анализ проводился при помощи программы Statistica 10 (Statsoft Inc., США). Для качественных переменных определяли абсолютное число наблюдений и частоты, сопоставление которых проводилось с помощью непараметрического метода хиквадрат. Статистически значимый уровень отличия определяли как р<0,05.
Результаты
Из включенных в исследование 768 пациентов (66,7% мужчин; средний возраст 62±11,5 года) ранее переносили ЧКВ 90 (11,7%) человек. ОКС в течение года после ЧКВ развился у 23 (25,5%) пациентов, среднее время от ЧКВ до повторного ОКС в исследуемой группе составило 43±38,5 мес. Инфаркт миокарда с подъемом ST развился у 18 (20%) пациентов, без элевации ST – у 72 (80%). Ранее инфаркт миокарда перенесли 48 (53,3%) пациентов, стенокардию имели 23 (25,5%) больных, сахарный диабет – 15 (16,7%), фибрилляцию предсердий – 11 (12,2%), онкологические заболевания – 5 (5,6%), бронхиальная астма была у 2 пациентов (2,2%), саркоидоз – 1 (1,1%).
Оценка особенностей первого ЧКВ
Ретроспективный анализ данных предшествовавшего ЧКВ выявил преобладание вмешательств по срочным показаниям (89,7%), тогда как плановое ЧКВ было выполнено 10,3% пациентов. Большинству больных были имплантированы голометаллические стенты (77,8%), стенты с лекарственным покрытием – только 8,9% пациентов, в 4,4% случаев одномоментно были установлены оба типа. 8 пациентам стентирование проведено в других клиниках, в связи с чем вид предустановленного стента на момент повторного вмешательства был неизвестен.
Стентирование передней нисходящей артерии выполнено в 46,7% случаев, огибающей артерии – 22,7%, правой коронарной артерии – 25,3%, 2 пациентам выполнено стентирование более чем в 1 бассейне, у 1 пациента выполнено ЧКВ на стволе левой коронарной артерии и у 1 – стентирование интермедиарной артерии. Количественная оценка имплантированных стентов продемонстрировала, что 67,1% пациентов установлен 1 стент, в трети случаев (32,9%) потребовалась установка не менее 2 стентов (максимально 4); среднее количество стентов на пациента – 1,4. Результаты анализа размерных параметров предустановленного металлокаркаса оказались следующими: средний диаметр оставил 3,2 мм, средняя протяженность – 22 мм.
Среди особенностей ЧКВ следует отметить, что в 12% случаев была выполнена тромбоаспирация, в 25% – предилатация и в 41,3% случае – постдилатация некомплаентным баллоном высокого давления (NC). Осложнения ЧКВ развивались нечасто: в 8% вмешательств выявлена диссекция коронарной артерии, и у 1 пациента отмечена дистальная эмболизация с развитием синдрома no-reflow.
Особенности повторного ЧКВ
При повторной госпитализации пациентов по поводу ОКС актуальной представлялась оценка состояния предустановленного металлокаркаса. По результатам КАГ установлено, что в исследуемой группе у 7 больных (7,8%) развился тромбоз ранее предустановленного стента, у 32 пациентов (35,6%) – значимый рестеноз, в остальных случаях (56,6%) рентгенморфологическим субстратом было поражение denovo.
Повторное стентирование по поводу ОКС было выполнено 64,4% пациентов, из которых 74,6% имплантирован 1 стент, 25,4% – 2 и более. Следует отметить, что в 25% случаев повторное ЧКВ не проводилось (чаще всего, вследствие верификации многососудистого поражения коронарного русла по результатам КАГ); в 8% выполнена только баллонная ангиопластика (БАП) без имплантации стента. Средний диаметр стента составил 3,41 мм, средняя длина – 23,96 мм.
Из особенностей ЧКВ следует отметить, что в 39,8% случаев проведена бифуркационная пластика, в 6,9% – вмешательство на стволе левой коронарной артерии. В 52,9% вмешательств оператором выполнена предилатация, в 41,2% – тромбоаспирация, и в 86,7% случаев – NC постдилатация стентированного сегмента. Среди осложнений ЧКВ у 6,7% пациентов выявлена диссекция коронарной артерии, у 3,3% констатирован феномен no-reflow.
Анализ особенностей первого и повторного эндоваскулярных вмешательств продемонстрировал, что при повторной интервенции большинству больных имплантирован 1 стент, а операторы значимо чаще прибегали к таким техническим манипуляциям, как тромбоаспирация, предилатация и постдилатация. По частоте непосредственных осложнений манипуляции (диссецкия, дистальная эмболизация) значимых различий выявлено не было. Результаты сравнения особенностей первого и повторного ЧКВ представлены на рис. 1.
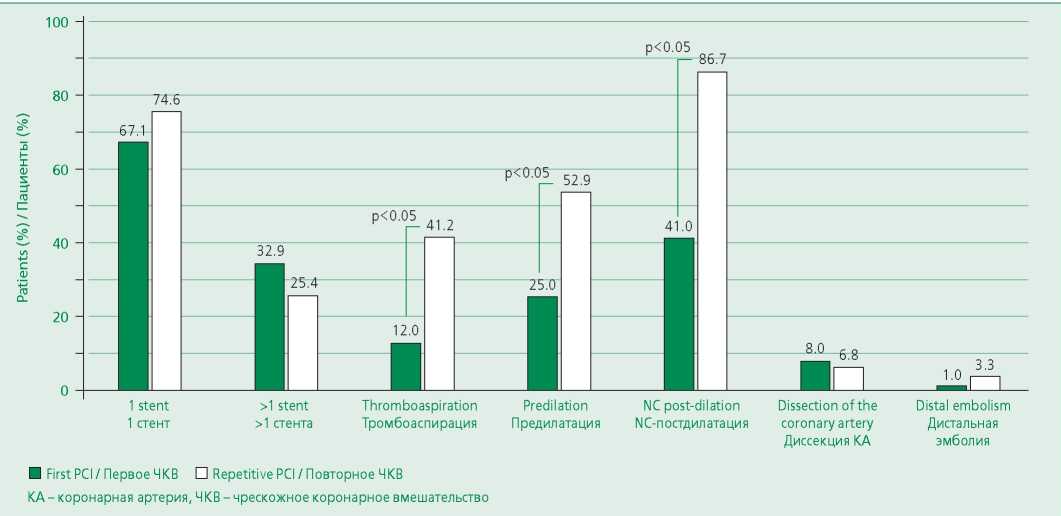
Figure 1. Features of the first and repeated percutaneous coronary intervention (n=90)
Рисунок 1. Особенности первого и повторного ЧКВ (n=90)
Показатели липидного спектра
Учитывая явные ангиографические критерии прогрессии коронарного атеросклероза у большинства пациентов исследуемой группы, проведена оценка показателей липидного спектра, которая продемонстрировала следующие результаты: средний уровень общего холестерина (ОХС) составил 4,91±1,43 ммоль/л, липопротеидов низкой плотности (ЛНП) – 2,94±1,19 ммоль/л, липопротеидов высокой плотности (ЛВП) – 1,18±0,40 ммоль/л, триглицеридов (ТГ) – 1,8±0,96 ммоль/л. Целевой уровень липидного спектра имел лишь 1 пациент, еще у 7 (7,8%) пациентов выявлен уровень ОХС<4,0 ммоль/л, у 4 (4,4%) пациентов – уровень ЛНП<1,4 ммоль/л. При этом 81,8% больных принимали статины на амбулаторном этапе.
Обсуждение
Наращивание объемов инвазивных манипуляций с целью улучшения непосредственных результатов лечения ОКС приводит к неуклонному росту количества пациентов с имплантированными стентами [3][12]. Эта когорта больных представляет особый интерес из-за очень высокого риска развития повторных атеротромботических событий и необходимости проведения максимально эффективной вторичной профилактики с целью улучшения прогноза. Кроме того, пациенты с предустановленными стентами в случае развития ОКС представляют более сложную группу как с позиции выбора оптимальной терапевтической тактики, так и при проведении повторного ЧКВ.
По результатам нашего исследования в реальной клинической практике Регионального сосудистого центра пациенты с предустановленным коронарными стентами составляют около 12% среди всех больных с ОКС, при этом в данной группе значительно чаще развивается ОКС без подъема сегмента ST (80%), что необходимо учитывать при диагностике.
Следует отметить, что для пациентов с ОКС и стентированием в анамнезе характерна полиморбидность. Среди коморбидных состояний чаще встречались сахарный диабет (16,7%) и фибрилляция предсердий (12,2%), 53% пациентов ранее перенесли инфаркт миокарда, 25% страдали стенокардией напряжения. Важно помнить, что полиморбидность не только определяет больший объем терапии и повышает некардиальные риски, но ассоциирована с увеличением продолжительности лечения и более высокой госпитальной летальностью (5-13,9% против 2,6-9,1%) при ОКС [13]. Но, несмотря на это, по данным ряда исследований пациентам со значимой коморбидной патологией реже выполняются процедуры реваскуляризации миокарда (9-14% против 39-42%) [13].
Особенности ЧКВ в реальной клинической практикe
Своевременная реперфузия и реваскуляризация миокарда являются одним из важных факторов, ассоциированных с улучшением как непосредственного, так и отдаленного прогноза при ОКС, что учитывают в реальной клинической практике при определении тактики ведения пациентов [14][15], а также при рискестратификации в ряде современных шкал. В частности, в шкале «Рекорд-6», невыполнение ЧКВ расценивается как фактор, ассоциированный с повышением риска 6-месячной летальности [16].
В то же время имплантация стента в коронарные артерии может привести к развитию специфических осложнений непосредственно во время манипуляции (диссекция, перфорация, дистальная эмболизация и др.), а также в отдаленном периоде (рестенозы и тромбозы стента) [17][18]. Следует понимать, что особенности первого ЧКВ во многом определяют дальнейшее состояние коронарного русла и могут привести к развитию отдаленных последствий, в том числе, атеротромботических эпизодов. Выделяют эндоваскулярные предикторы, определяющие повышенный риск рестенозов и/или тромбозов стентов, к ним относят протяженную длину металлокаркаса, тип устройства, имплантацию более 1 стента, развитие интраоперационных диссекций и пр. [10][19][20]. Среди анатомических предикторов клинически значимого прогрессирования коронарного атеросклероза в первую очередь выделяют многососудистое поражение коронарного русла [20][21].
В нашем исследовании при первом ЧКВ чаще устанавливали голометаллические стенты (77,8%), вмешательства преимущественно (90%) проводились по срочным показаниям. При этом в подавляющем большинстве случаев (95%) было выполнено однососудистое стентирование, в 67% был установлен 1 стент. Осложнения манипуляции были выявлены у 9% пациентов, наиболее частым из них (8%) оказалась неокклюзирующая диссекция коронарной артерии. Таким образом, одним из самых распространенных эндоваскулярных предикторов отдаленных последствий ЧКВ в реальной практике является имплантация голометаллических стентов.
ОКС у стентированных пациентов чаще протекает в варианте без стойкого подъема сегмента ST (80%), что важно учитывать при клинической диагностике. По данным повторной КАГ рентгенанатомическим субстратом развития атеротромботического события у 43,4% было поражение в зоне предустановленного металлокаркаса (рестеноз или тромбоз), что соответствует результатам других исследований [18], тогда как у 56,6% пациентов клинико-определяющим оказалось поражение de novo. При выполнении ЧКВ в 75% случаев имплантирован 1 стент, при этом размеры стентов оказались несколько большими в сравнении с первым ЧКВ.
Безусловно, повторное вмешательство в коронарном бассейне зачастую технически более сложно и нередко требует применения ряда специфических манипуляций [15]. Это отражают и данные нашего исследования, по результатам которого при повторном ЧКВ операторы значимо чаще выполняли тромбоаспирацию, предилатацию и NC-постилатацию. Однако, несмотря на технические сложности, частота непосредственных осложнений манипуляции оказалась сопоставимой (9,0% против 10,1%, р˃0,05).
Параметры липидного спектра у пациентов с ОКС, перенесших стентирование
Развитие ОКС у пациента, переносившего стентирование, свидетельствует о неэффективности вторичной профилактики, основные принципы которой базируются на коррекции модифицируемых факторов риска, поскольку они обуславливают до 60% смертности от БСК [2]. Роль дислипидемии в прогрессировании атеросклероза и развитии атеротромботических событий определена в крупных исследованиях, и в настоящее время не вызывает сомнений. Современные данные доказательной медицины уверенно демонстрируют позитивный эффект снижения общего холестерина и ЛНП в улучшении прогноза [22]. Это отражают клиническиe рекомендации, в современных версиях которых указываются все более жесткие цели коррекции дислипидемии у пациентов с сердечнососудистыми заболеваниями. Так, в настоящее время рекомендованный уровень ОХС для пациента с симптомным атеросклерозом составляет <4,0 ммоль/л, ЛНП<1,4 ммоль/л (либо снижение ˃50% от исходного) [1]. Кроме того, выделена важная категория пациентов, имеющих экстремальный риск развития сердечно-сосудистых осложнений, у которых следует достигать целевого уровня ЛНП <1,0 ммоль/л [23]. В нашем исследовании у 25% пациентов ОКС развился в течение года после стентирования, что соответствует критериям экстремального риска.
При этом в исследуемой группе уровень ОХС составил 4,91 ммоль/л, ЛНП – 2,94 ммоль/л, а целевые уровни липидного спектра были достигнуты лишь у 1 пациента. Полученные данные сопоставимы с результатами других российских исследований. Так, по данным Д.А. Швец с соавт. средний уровень ОХС у пациентов с осложненной ишемической болезнью сердца составил 5,4% [14].
Оптимальная медикаментозная терапия у пациентов с ишемической болезнью сердца позволяет снизить риск повторных атеротромботических событий и улучшить прогноз [24]. Следует отметить, что в исследуемой группе 81,8% больных принимали статины на амбулаторном этапе, что сопоставимо с оценкой приверженности в других регионах [25,26]. Недостижение целевых параметров липидного спектра в клинической практике связано, в первую очередь, с применением недостаточных доз статинов, использованием препаратов с невысокой гиполипидемической активностью и/или генерических производных [14], тогда как применение статинов высокой мощности в безтитрационной схеме позволяет достичь целевых уровней общего ХС и ЛПНП через 12 мес у 73,9% и 56,3% пациентов [27].
Ограничения исследования. Ограничением работы является ее описательный характер, а также участие только одного сосудистого центра.
Заключение
Исследование демонстрирует особенности течения ишемической болезни сердца, клинические и эндоваскулярные причины неэффективности вторичной профилактики у пациентов с ОКС, переносивших ранее коронарное стентирование. У четверти больных ОКС развивается в течение года после ЧКВ. Следует учитывать, что в реальной клинической практике пациенты с предустановленными стентами составляют около 12% среди всех больных с ОКС, направляемых на КАГ, при этом у четверти больных атеротромботическое событие развивается в течение года. Согласно ангиографическим данным в 56,6% случаев причиной развития ОКС является поражение de novo. Среди эндоваскулярных предикторов отдаленных последствий наиболее распространенным является имплантация голометаллических стентов. Еще одной значимой причиной развития повторного атеротромботического события можно считать недостижение целевых показателей липидного спектра, что требует дальнейших усилий по оптимизации вторичной профилактики.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование: Исследование выполнено при финансовой поддержке Министерства науки и высшего образования Российской Федерации в рамках Соглашения № 075-15-2021-665
Funding: This research was financially supported by the Ministry of Science and Higher Education of the Russian Federation Theme № 075-15-2021-665.
Список литературы
1. Острый коронарный синдром без подъема сегмента ST электрокардиограммы. Клинические рекомендации. [цитировано 18.07.2020]. Доступно из: https://scardio.ru/content/Guidelines/2020/Clinic_rekom_OKS_bST-unlocked.pdf.
2. Бойцов С.А., Демкина А.Е., Ощепкова Е.В. с соавт. Достижения и проблемы практической кардиологии в России на современном этапе. Кардиология. 2019;59(3):53-9]. DOI:10.18087/cardio.2019.3.10242.
3. Эрлих А.Д. Изменения в лечении пациентов с острым коронарным синдромом без подъема сегмента ST в клинической практике за последние несколько лет (данные серии российских регистров РЕКОРД). Кардиология. 2018;58(12):13- 21. DOI:10.18087/cardio.2018.12.10189.
4. Byrne RA, Joner M, Kastrati A. Stent thrombosis and restenosis: what have we learned and where are we going? The Andreas Grüntzig Lecture ESC 2014. Eur Heart J. 2015;36(47):3320-31. DOI:10.1093/eurheartj/ehv511.
5. Borovac JA, D'Amario D, Niccoli G. Neoatherosclerosis and Late Thrombosis After Percutaneous Coronary Intervention: Translational Cardiology and Comparative Medicine from Bench to Bedside. Yale J Biol Med. 2017;90(3):463-70.
6. Thayssen P, Jensen LO, Lassen JF, et al. Euro Intervention. The risk and prognostic impact of definite stent thrombosis or in-stent restenosis after coronary stent implantation. EuroIntervention. 2012;8(5):591-8. DOI:10.4244/EIJV8I5A91.
7. Tang L, Cui QW, Liu DP, et al. The number of stents was an independent risk of stent restenosis in patients undergoing percutaneous coronary intervention. Medicine (Baltimore). 2019;98(50):e18312. DOI:10.1097/MD.0000000000018312.
8. Borovac JA, D'Amario D, Vergallo R, et al. Neoatherosclerosis after drug-eluting stent implantation: a novel clinical and therapeutic challenge. Eur Heart J Cardiovasc Pharmacother. 2019;5(2):105-16. DOI:10.1093/ehjcvp/pvy036.
9. Филатова А.Ю., Шлевкова Г.В., Потехина А.В. c соавт. Прогностическая значимость динамики содержания высокочувствительного С-реактивного белка в крови после планового коронарного стентирования в отношении развития рестеноза стента. Кардиология. 2020;60(7):64-71. DOI:10.18087/cardio.2020.7.n1030.
10. Мансурова Д.А., Каражанова Л.К. Независимые предикторы сердечно-сосудистых осложнений у пациентов с острым коронарным синдромом после чрескожного коронарного вмешательства на госпитальном этапе. Кардиология. 2018;58(12):22-9. DOI:10.18087/cardio.2018.12.10205.
11. Ibanez B, James S, Agewall S, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J. 2018;39(2):119-77. DOI:10.1093/eurheartj/ehx393.
12. Эрлих А.Д. Как за последние несколько лет изменилось лечение пациентов с острым коронарным синдромом с подъемом сегмента ST в клинической практике (данные серии российских регистров «РЕКОРД»). Кардиология. 2018;58(7):23- 31. DOI:10.18087/cardio.2018.7.10140.
13. Breen K, Finnegan L, Vuckovic K, et al. Multimorbidity in Patients With Acute Coronary Syndrome Is Associated With Greater Mortality, Higher Readmission Rates, and Increased Length of Stay: A Systematic Review. J Cardiovasc Nurs. 2020;35(6):E99-110. DOI:10.1097/JCN.0000000000000748.
14. Швец Д.А., Поветкин С.В., Карасёв А.Ю., и др. Оценка эффективности лечения больных после перенесенного острого коронарного синдрома. Российский Кардиологический Журнал. 2020;25(2):9-18. DOI:10.15829/1560-4071-2020-2-3405.
15. Karjalainen PP, Niemelä M, Laine M, et al. Usefulness of Post-coronary Dilation to Prevent Recurrent Myocardial Infarction in Patients Treated With Percutaneous Coronary Intervention for Acute Coronary Syndrome (from the BASE ACS Trial). Am J Cardiol. 2017;119(3):345-50. DOI:10.1016/j.amjcard.2016.09.057.
16. Эрлих А.Д. Новая шкала прогнозирования смертельных исходов через 6 месяцев после острого коронарного синдрома. Российский Кардиологический Журнал. 2020;25(2):3416. DOI:10.15829/1560-4071-2020-2-3416.
17. Ciofani JL, Allahwala UK, Scarsini R, et al. No-reflow phenomenon in ST-segment elevation myocardial infarction: still the Achilles' heel of the interventionalist. Future Cardiol. 2020;17(2):383-97. DOI:10.2217/fca-2020-0077.
18. Порханов В.А., Космачева Е.Д., Крюберг Л.К., и др. Трехлетний опыт эндоваскуляного лечения острого коронарного синдрома в круглосуточном режиме. Кардиология. 2011;51(11):22-7.
19. Коротаева Е.С., Королева Л.Ю., Носов В.П., и др. Многофакторное прогнозирование развития тромбоза стента у пациентов с острым коронарным синдромом после чрескожного коронарного вмешательства на фоне двойной антитромбоцитарной терапии. Кардиология. 2019;59(11):5-13. DOI:10.18087/cardio.2019.11.n343.
20. Эрлих А.Д. Связь степени поражения коронарного русла и особенностей стентирования с краткосрочными и отдаленными исходами у пациентов с острым коронарным синдромом (данные регистра РЕ-КОРД-3). Кардиология. 2018;58(5):5-12. DOI:10.18087/cardio.2018.5.10109.
21. Gimbel ME, Willemsen LM, Daggelders MC, et al. Long-term follow-up after bypass surgery or coronary stenting in elderly with multivessel disease. Neth Heart J. 2020;28(9):467-477. DOI:10.1007/s12471-020-01415-z.
22. Xie G, Sun Yi, Kyaw PK, et al. Six-month adherence to Statin use and subsequent risk of major adverse cardiovascular events (MACE) in patients discharged with acute coronary syndromes. Lipids Health Dis. 2017;16(1):155. DOI:10.1186/s12944-017-0544-0.
23. Mach F, Baigen C, Catapano AL, et al. 2019 ESC/EAS guidelines for the management of dyslipidaemias: Lipid modification to reduce cardiovascular risk. Atherosclerosis. 2019;290:140-205. DOI:10.1016/j.atherosclerosis.2019.08.014.
24. Latifi AN, Akram A, Dengle S, et al. Use of Guideline-Directed Medical Therapy in Patients With STElevation Myocardial Infarction. Cureus. 2020;12(7):e9398. DOI:10.7759/cureus.9398.
25. Кузьмина Н.М., Максимов Н.И. Приверженность к медикаментозному лечению у пациентов, перенесших острый коронарный синдром и чрескожное коронарное вмешательство. Кардиология. 2019;59(1):36-8. DOI:10.18087/cardio.2019.1.10223.
26. Хаишева Л.А., Глова С.Е., Суроедов В.А., и др. Оценка медикаментозной терапии и приверженности к ней у пациентов после острого коронарного синдрома в реальной клинической практике (результаты годового наблюдения). Рациональная Фармакотерапия в Кардиологии. 2018;14(6):852-7. DOI:10.20996/1819-6446-2018-14-6-852-857.
27. Небиеридзе Д.В., Ахмеджанов Н.М., Давиташвили С.А., и др. Изучение возможности оптимизации алгоритма терапии статинами в амбулаторной практике. Рациональная Фармакотерапия в Кардиологии. 2020;16(4):528-35]. DOI:10.20996/1819-6446-2020-08-04.
Об авторах
И. С. ЕгороваРоссия
Егорова Инга Сергеевна
Петрозаводск
Н. Н. Везикова
Россия
Везикова Наталья Николаевна
Петрозаводск
Рецензия
Для цитирования:
Егорова И.С., Везикова Н.Н. Острый коронарный синдром у пациентов, перенесших чрескожное коронарное вмешательство: современное состояние проблемы и данные клинической практики. Рациональная Фармакотерапия в Кардиологии. 2022;18(6):669-675. https://doi.org/10.20996/1819-6446-2022-12-04
For citation:
Egorova I.S., Vezikova N.N. Acute Coronary Syndrome after Percutaneous Coronary Intervention: State of the Problem and Clinical Practice Data. Rational Pharmacotherapy in Cardiology. 2022;18(6):669-675. (In Russ.) https://doi.org/10.20996/1819-6446-2022-12-04

















































