Перейти к:
Клинический случай дифференциальной диагностики причин тяжелого поражения клапанного аппарата сердца (артериит Такаясу, инфекционный эндокардит и миксоматозная дегенерация) и роль гистологического и ПЦР-исследования
https://doi.org/10.20996/1819-6446-2022-12-06
Аннотация
Поражение аортального клапана является частой патологией, однако причины могут быть крайне разнообразны – от дегенеративных, врожденных и инфекционных заболеваний до аутоиммунной патологии. Представлено редкое наблюдение молодой пациентки с артериитом Такаясу и тяжелым поражением сердца в рамках миксоматозной дегенерации створок аортального и митрального клапанов с возможным развитием инфекционного эндокардита (ИЭ) обоих клапанов, осложненного фистулой, перфорацией клапанов и рецидивирующей острой декомпенсацией сердечной недостаточности. Комплексное патогистологическое и ПЦР-исследование тканей клапанов имели решающее значение для дифференциальной диагностики клапанных поражений, определив ведущую причину развития структурной патологии сердца. По мнению авторов в данном клиническом наблюдении наличие артериита Такаясу играло косвенную роль, способствовав развитию иммуносупрессивного состояния для развития бактериемии.
Ключевые слова
Для цитирования:
Писарюк А.С., Котова Е.О., Агеев П.В., Моисеева А.Ю., Поваляев Н.М., Домонова Э.А., Сильвейстрова О.Ю., Цимбалист Н.С., Бабухина Ю.И., Мерай И.А., Кахкцян П.В., Мешков А.Д., Сафарова А.Ф., Кобалава Ж.Д. Клинический случай дифференциальной диагностики причин тяжелого поражения клапанного аппарата сердца (артериит Такаясу, инфекционный эндокардит и миксоматозная дегенерация) и роль гистологического и ПЦР-исследования. Рациональная Фармакотерапия в Кардиологии. 2022;18(6):676-683. https://doi.org/10.20996/1819-6446-2022-12-06
For citation:
Pisaryuk A.S., Kotova E.O., Ageev P.V., Moiseeva A.Yu., Povalyaev N.M., Domonova E.A., Silveistrova O.Yu., Tsimbalist N.S., Babukhina J.I., Meray I.A., Kakhktsyan P.V., Meshkov A.D., Safarova A.F., Kobalava Zh.D. A Case Report of Differential Diagnosis of Causes of Severe Valvular Heart Disease (Takayasu's Arteritis, Infective Endocarditis and Myxomatous Degeneration) with the Key Role of Histological and PCR Examination. Rational Pharmacotherapy in Cardiology. 2022;18(6):676-683. (In Russ.) https://doi.org/10.20996/1819-6446-2022-12-06
Введение
Артериит Такаясу (АТ) представляет собой воспалительное заболевание неизвестной этиологии, поражающее аорту, ее ветви и легочные артерии. Вовлекая корень аорты и клапаны сердца, артериит может приводить к развитию аортальной регургитации. Возможные причины недостаточности аортального клапана (АК) включают: расширение корня аорты, рецидивирующее воспаление и формирование порока АК. В литературе описаны случаи, где АТ может быть ошибочно диагностирован как инфекционный эндокардит (ИЭ) [1]. Также АТ с длительной иммуносупрессивной терапией может быть предрасполагающим фактором для ИЭ [2]. Нам не встретилось ни одного описанного случая сочетания ИЭ и АТ.
ИЭ остается серьезным заболеванием с высоким уровнем летальности, способным приводить к тяжелому повреждению клапанов сердца [3][4]. Несмотря на снижение в развитых странах таких факторов риска, как хронические ревматические и врожденные некорригированные заболевания сердца, возрастает количество ИЭ, связанного с применением внутрисердечных устройств, оказанием медицинской помощи и гемодиализом, а также на фоне приобретенных изменений клапанов сердца [3][4]. Среди последних к развитию ИЭ наиболее часто предрасполагает кальциноз створок клапана, несколько реже – миксоматозная дегенерация створок клапана [3][4].
Цель публикации – представить клиническое наблюдение пациентки с АТ и вероятно перенесенным ИЭ на фоне дегенеративного порока сердца с демонстрацией роли гистологического и ПЦР-исследований в дифференциальной диагностике генеза поражения клапанов.
Клинический случай
Женщина 22 лет, азиатка, без вредных привычек. В 16 лет впервые выявлено отсутствие пульса на левой руке без дальнейшего дообследования и лечения (рис. 1). В феврале 2019 г. (21 год) перенесла острый тонзиллит, получала антибактериальную терапию (АБТ; амоксициллин/клавуланат калия 875/125 мг 2 р/сут). В мае 2019 г. появилась субфебрильная лихорадка, жалобы на затрудненное болезненное мочеиспускание (в моче рост Klebsiella spp.), получала АБТ (ципрофлоксацин 1000 мг/сут). С начала июня 2019 г. стали беспокоить одышка и кашель, снижение толерантности к физической нагрузке. При компьютерной томографии (КТ) органов грудной клетки патологических изменений не выявлено, при эхокардиографии (ЭхоКГ) диагностирован надрыв правой коронарной створки АК с тяжелой аортальной регургитацией. От предложенного оперативного лечения пациентка отказалась. В июле 2019 г. при повторной ЭхоКГ помимо отрыва правой коронарной створки АК выявлена умеренная недостаточность митрального клапана (МК), дилатация левых отделов сердца и правого предсердия, легочная гипертензия, плевральный и перикардиальный выпот. При ультразвуковом исследовании экстракраниальных отделов брахиоцефальных артерий отмечено значительное увеличение толщины комплекса интима-медиа с сужением просвета общей сонной артерии с обеих сторон, подключичной артерии слева. При исследовании крови имелись признаки умеренной воспалительной реакции (лейкоциты 7,0×109/л, С-реактивный белок 18,8 мг/л, СОЭ 25 мм/ч) и анемия легкой степени (гемоглобин 111 г/л). Биохимический анализ крови, коагулограмма и анализы мочи были без особенностей.
Основной диагностической концепцией тогда стало поражение клапанного аппарата сердца в рамках АТ IIa анатомического типа с развитием сердечной недостаточности. Ей были назначены: метотрексат 10 мг/нед, фолиевая кислота 3 мг/нед, преднизолон 25 мг/сут, карведилол 6,25 мг/сут, ацетилсалициловая кислота 75 мг/сут, торасемид 5 мг/сут, спиронолактон 25 мг/сут. На фоне проводимой терапии отмечалась положительная динамика: уменьшилась одышка, увеличилась толерантность к физическим нагрузкам. Далее доза преднизолона была снижена вплоть до полной отмены.
С декабря 2019 г. возобновление симптомов сердечной недостаточности с прогрессированием, в связи с чем в начале января 2020 г. пациентка была госпитализирована с жалобами на тяжелую одышку при минимальной физической нагрузке, увеличение в объеме живота, отеки нижних конечностей.
При осмотре: состояние тяжелое, кожные покровы и видимые слизистые бледные с желтоватым оттенком, положение – ортопноэ, отеки симметричные на уровне стоп и голеней (2+). Притупление перкуторного звука с обеих сторон ниже 6-7 ребра. При аускультации дыхание жесткое, диффузные влажные незвучные мелкопузырчатые хрипы в нижних отделах легких. ЧДД 29 в мин. SpO2 90% при дыхании атмосферным воздухом. Границы сердца расширены влево, выслушивается систолический шум на верхушке с проведением в подмышечную область и диастолический шум над аортой. Пульс 120 уд/мин, ритмичный, слева практически не определяется. АД 96/62 мм рт.ст. Живот увеличен в объеме за счет асцита. Размеры печени по Курлову 12/3×11×9 см.
При исследовании крови отмечались отсутствие признаков воспаления (лейкоциты 4,5×109/л, С-реактивный белок 4,5 мг/л, СОЭ 10 мм/ч), признаки гипокоагуляции [протромбиновое время 24,1 сек (в норме 9,4-12,5), протромбиновый индекс 35% ( в норме 70-140), МНО 2,17 МЕ/мл (в норме 0,9-1,3)], анемия легкой степени тяжести (гемоглобин 101 г/л), повышение уровня D-димера [ 447 нг/мл (в норме 0- 250)], гипербилирубинемия [общий билирубин 44 мкмоль/л (в норме 3-21), прямой билирубин 23 мкмоль/л (в норме 0-3,4)], гипоальбуминемия [ 30 г/л (в норме 35-52)], лабильная фильтрационная функция почек [креатинин сыворотки 50-79 мкмоль/л (в норме 45-84), скорость клубочковой фильтрации CKD-EPI 132-91,85 мл/мин (в норме 90-140)].
Электрокардиограмма: отклонение электрической оси сердца вправо, синусовая тахикардия с ЧСС 120 уд/мин, сегмент ST на изолинии. ЭхоКГ: фракция выброса левого желудочка 54%, образование на створке АК 1,2×2,0 см (рис. 2), тяжелая недостаточность АК, фистула между корнем аорты и выходным трактом правого желудочка (см. рис. 2), перфорация передней створки МК, тяжелая недостаточность МК (см. рис. 2). Расширение левого и правого предсердия, умеренная недостаточность трикуспидального клапана, легочная гипертензия 2 степени, жидкость в обеих плевральных полостях.
Триплексное сканирование магистральных сосудов головы и шеи: концентрическое утолщение комплекса интима-медиа левой общей сонной артерии с гемодинамически значимым ускорением линейной скорости кровотока (рис. 3), стеноз дистального отдела левой подключичной артерии, признаки венозной дисциркуляции внутренней яремной вены. При КТ-ангиографии аорты с магистральными ветвями выявлены аналогичные изменения (рис. 4). Активность АТ составила 1 балл по шкале BVAS, что не требовало проведения специфического лечения перед проведением кардиохирургического вмешательства.
Проведено лечение: оксигенотерапия, фуросемид 40 мг/сут внутривенно, спиронолактон 25 мг/сут, эноксапарин натрия 4000 анти-Ха МЕ/0,4 мл/сут подкожно, железа сульфат 150 мг/сут. На фоне терапии отмечена положительная динамика в виде регресса симптомов и признаков сердечной недостаточности.
На 4-е сутки пациентка переведена в кардиохирургический стационар, где выполнено оперативное лечение клапанного порока сердца и интраоперационно впервые выявлены миксоматозно измененные створки АК и МК, подтверждена фистула между корнем аорты и выходным трактом правого желудочка, перфорация створки МК без признаков активного инфекционного процесса. Проведена многокомпонентная реконструкция МК с транслокацией хорд и аннулопластикой на опорном кольце, протезирование АК механическим протезом Карбоникс № 22 супрааннулярно, пластика трикуспидального клапана по de Vega в условиях искусственного кровообращения, гипотермии и фармакохолодовой кристаллоидной кардиоплегии. Послеоперационный период протекал без осложнений с проведением АБТ (цефтриаксон 2 г/сут 8 дней в стационаре и цефиксим 400 мг/сут 7 дней амбулаторно).
При микробиологическом исследовании измельченной ткани АК и МК роста микроорганизмов не выявлено. Однако параллельное ПЦР-исследование ткани клапана позволило выявить Staphylococcus aureus (MSSA). При гистологическом и микроскопическом исследовании клапана: в створке клапана, состоящей из зрелой соединительной ткани и фибробластов, поверхность которой выстлана эндотелиальными клетками, выявлены базофильные участки поверхности клапана, где на эндотелиальных клетках обнаружены микроорганизмы (Грам+). В толще клапана также отмечено скопление микроорганизмов (Грам+) с выраженной базофилией, вокруг которых имелись миксоматозные изменения соединительной ткани клапана. В аорте отмечено расслоение области интимы и медии и внутримышечного слоя. В области расслоения в мышечном слое также выявлены скопления микроорганизмов и миксоматозные изменения соединительной ткани. В стенке аорты имелись vasa vasorum без выраженного воспалительного инфильтрата (рис. 5).
Таким образом, по результатам проведенных исследований не вызывало сомнения наличие АТ без вовлечения клапанов сердца (подтверждено клинически и инструментально, без гистологических признаков активного процесса), также выявлены миксоматозная дегенерация створок АК и МК со скоплениями бактерий без признаков активной инфекции, что было расценено как возможный перенесенный ИЭ [визуализированы микроорганизмы при исследовании тканей иссеченных клапанов и двумя независимыми методами идентифицирован этиологический агент бактериальной природы – микроскопическим (Грам+) и при ПЦРисследовании (Staphylococcus aureus MSSA), без гистологических признаков воспалительного процесса]. Клинические критерии Дюка для диагностики ИЭ не использовались, так как у пациентки не наблюдалось активного заболевания [3][4].
Через 2,5 года после проведенного хирургического лечения при сборе катамнеза состояние пациентки удовлетворительное, симптомов сердечной недостаточности нет, эпизодов повышения температуры не было, по данным ЭхоКГ функция клапанов не нарушена. Пациентка постоянно принимает варфарин, наблюдается у ревматолога, получает лефлуномид 20 мг/сут в качестве иммуносупрессивной терапии по поводу АТ.
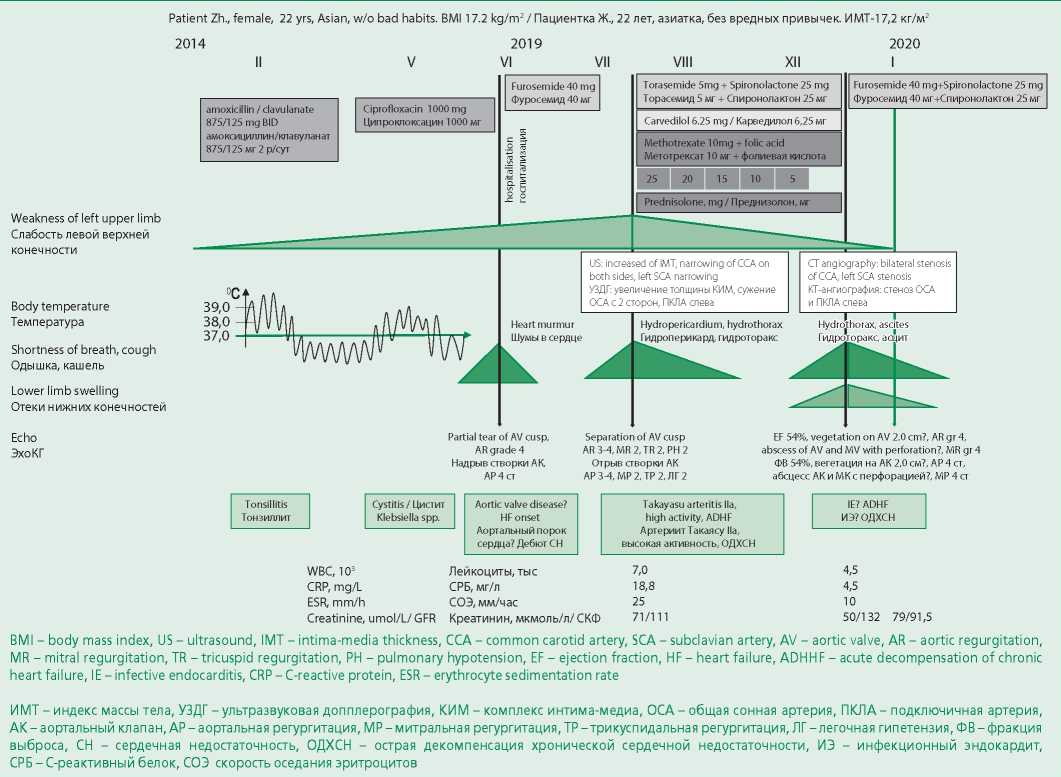
Figure 1. Medical history of the patient
Рисунок 1. Анамнез заболевания пациентки
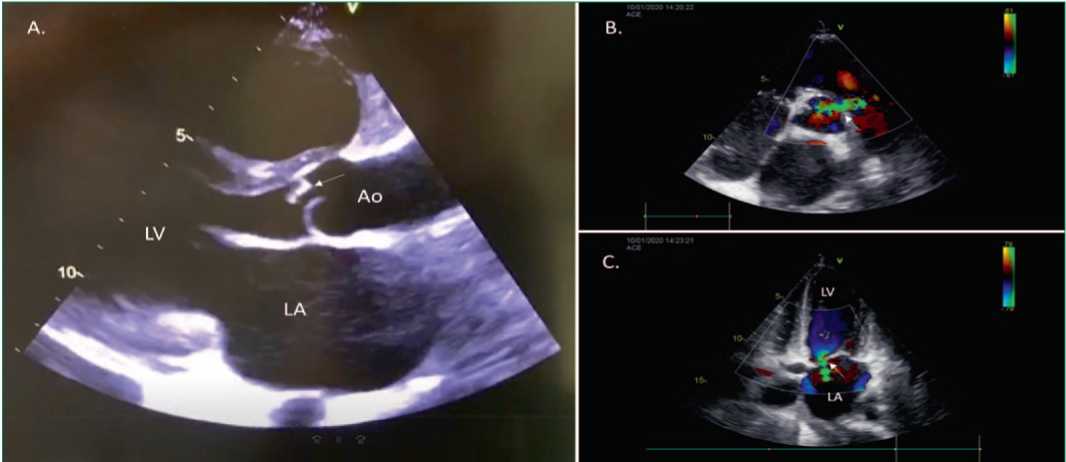
Figure 2. Echocardiography of the patient.
Рисунок 2. Эхокардиография пациентки.
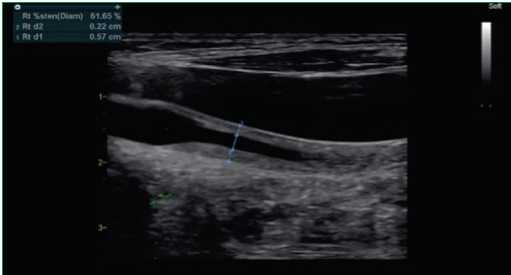
Figure 3. Concentric thickening of the intima-media complex of the left common carotid artery
Рисунок 3. Концентрическое утолщение комплекса интима-медиа левой общей сонной артерии
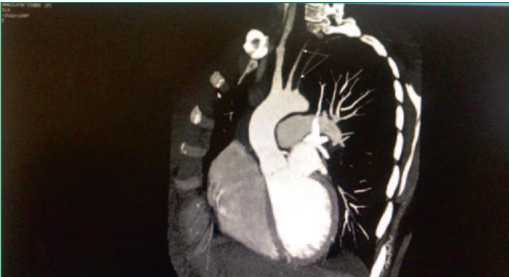
Figure 4. CT angiography: stenosis of the left common carotid and subclavian arteries (arrows)
Рисунок 4. КТ-ангиография: стеноз общей сонной и подключичной артерий слева (стрелки)
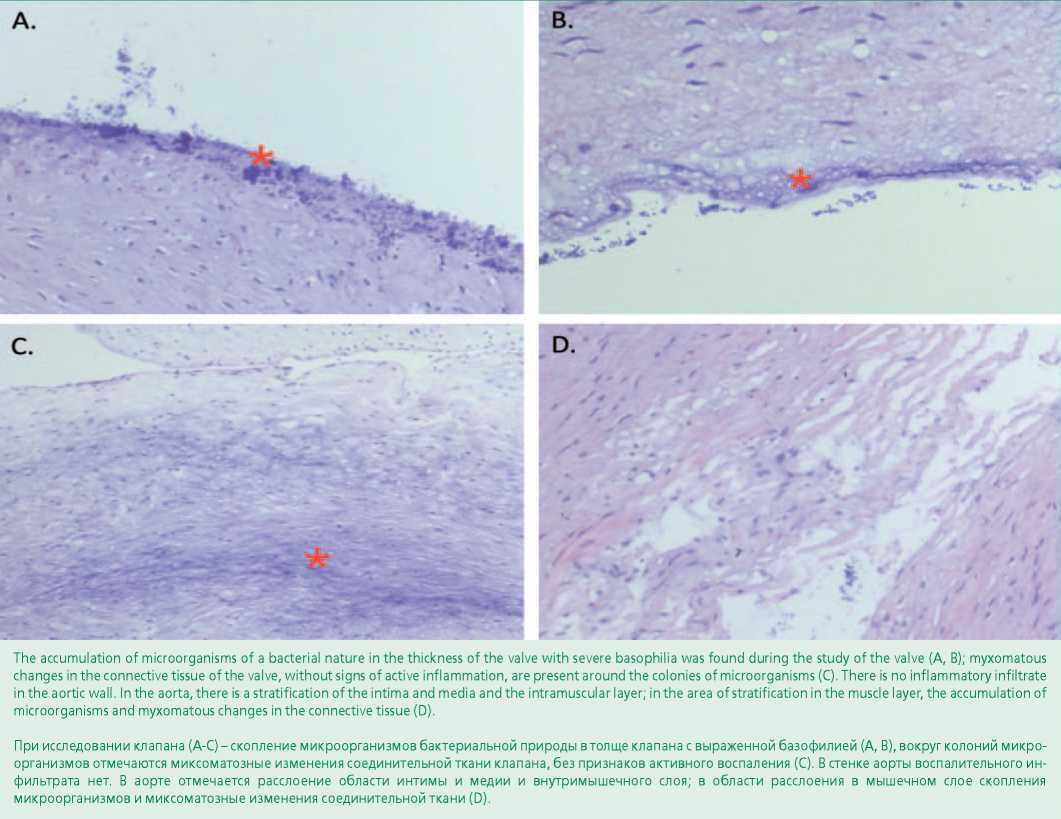
Figure 5. Aortic valve tissue (micrograph; hematoxylin-eosin stain, ×200).
Рисунок 5. Ткань аортального клапан (микрофотография; окраска гематоксилин-эозином, ×200)
Обсуждение
Представленное клиническое наблюдение в первую очередь демонстрирует трудности дифференциально-диагностического поиска по определению возможных механизмов поражения клапанного аппарата. На разных этапах течения болезни обсуждались гетерогенные причины повреждения клапанов: (1) артериит Такаясу – предположение формирования относительной аортальной регургитации в рамках расширения корня аорты в исходе рецидивирующего воспаления аорты и ткани АК (не нашло подтверждения); (2) инфекционный эндокардит – наличие специфичных изменений при ЭхоКГ, предрасполагающих факторов и, в качестве неблагоприятного фона для развития, – иммуносупрессивная терапия (обсуждается, как возможная причина такого выраженного поражения клапанов); (3) болезни соединительной ткани, например миксоматозная дегенерация створок клапанов – тяжелое сочетанное поражение АК и МК, сопровождающееся повреждением хордального аппарата (диагноз подтвержден).
АТ – это хронический, идиопатический и гранулематозный васкулит, поражающий крупные артерии, преимущественно аорту и ее проксимальные ветви. Этиология и предрасполагающие факторы этого заболевания неизвестны, но исследования показали вовлечение иммунологического ответа, запускающего подмножество Т- и В-лимфоцитов и макрофагов, приводящих к острому воспалению и некрозу стенок сосудов с развитием стеноза и аневризм [5]. АТ часто встречается у молодых женщин репродуктивного возраста, особенно в азиатской популяции, с соотношением женщин и мужчин от 4:1 до 9:1 [6], что подтверждено в представленном клиническом наблюдении с выявлением АТ IIа типа. При АТ наиболее часто встречаемым клапанным осложнением является аортальная регургитация (20-44,8%) [2], другие клапаны поражаются реже –частота митральной регургитации (МР) составляет лишь 3% [7]. Аортальная регургитация при АТ связана с повреждением АК, расширением восходящей аорты и аортального кольца. Генетические исследования показали, что HLA-B*52:01 был связан с аортальной регургитацией, а rs6871626 в IL12B связаны с ее развитием и тяжестью [8]. При этом никаких литературных данных о деструктивном поражении клапанов при АТ нет, а также данных о частоте надрывов и отрывов створок АК нам также не встретилось. Аортальная регургитация увеличивает риск как сердечной недостаточности, так и нежелательных явлений у таких пациентов, и требует хирургического лечения.
Основными клиническими симптомами АТ являются слабость, лихорадка, артралгии, артериальная гипертония, перемежающаяся хромота верхних или нижних конечностей, заболевания сердца (сердечная недостаточность, клапанная или ишемическая болезнь сердца) и нарушение функции почек [9], часть из которых были отчетливо представлены в клиническом наблюдении. На данный момент в клинической практике при постановке диагноза используют критерии Американской коллегии ревматологов (1990), у данной пациентки присутствовало более трех критериев, что позволяло поставить диагноз АТ с высокой специфичностью и чувствительностью. Лабораторные же данные, как правило, неспецифичны. Лечение активного заболевания в первую очередь основывается на глюкокортикостероидах (ГКС) [10][11], что также с успехом было проведено пациентке с достижением полной ремиссии по АТ.
АТ может быть ошибочно диагностирован как ИЭ из-за схожих клинических симптомов (сердечный шум, лихорадка) в активную фазу заболевания [1]. Более того сам АТ может являться предрасполагающим фактором для ИЭ [2]. В представленном наблюдении тяжесть поражения АК с сочетанным вовлечением МК и трикуспидального клапана, а также грубыми структурными изменениями (фистула, перфорация АК и МК) не могли быть полностью объяснены наличием АТ, в связи с чем, обсуждался вклад иного заболевания, например ИЭ в поражение сердца. Особенностью данного представления является то, что ИЭ и АТ, по мнению авторов, могли протекать одновременно. В первую очередь, следует обсуждать предрасполагающие факторы для развития ИЭ, такие как иммуносупрессия на фоне приема метотрексата и ГКС, которые, по-видимому, и определили не только развитие ИЭ, вероятнее всего на одном из этапов лечения обострения АТ, но и тяжесть поражения клапанного аппарата.
ИЭ – заболевание с высоким уровнем летальности, способное привести к тяжелому повреждению клапанов сердца [3][4]. Среди предрасполагающих факторов развития современного ИЭ в развитых странах на первое место выходят дегенеративные заболевания клапанов сердца, значительно реже встречаются врожденные некорригированные пороки и хроническая ревматическая болезнь [3,4]. Для подтверждения диагноза ИЭ применяются клинические и патологоанатомические критерии Дюка [3,4], однако в данном клиническом примере у пациентки отсутствовали клинические и лабораторные признаки активного инфекционного процесса, в крови не выявлялся рост микроорганизмов, поэтому использование клинических критериев было невозможно, речь шла только о возможных последствиях перенесенного ИЭ и в таких случаях для подтверждения диагноза может иметь значение патогистологическое исследование тканей иссеченного клапана, позволяющее обнаруживать воспалительную инфильтрацию, оценивать ее клеточный состав, наличие мукоидной дегенерации, отложение фибрина и скопление микроорганизмов [12]. Следует отметить, что для подтверждения диагноза и активности АТ патогистологическое исследование биопсийного материала также имеет важное значение, однако при этом может наблюдаться несоответствие между клинико-лабораторной ремиссией АТ и воспалительными изменениями в артериальной стенке [13].
Тяжелые гемодинамически и клинически значимые изменения клапанного аппарата сердца пациентки определили необходимость оперативного лечения с последующим выполнением патогистологического, микробиологического и ПЦР-исследования тканей. На основании патогистологического исследования установлено, что ведущей причиной поражения клапанов у данной пациентки была миксоматозная дегенерация АК и МК, без признаков поражения АК аортоартериитом. Кроме того, в ткани обоих клапанов были обнаружены бактерии, обсуждалась их возможная роль в формировании свища корня аорты-правого желудочка и перфорации передней створки МК. Все это в совокупности стало причиной сердечной недостаточности. Таким образом, только гистологическое исследование помогло установить генез поражения клапанов. Наличие миксоматозной дегенерации тканей клапанов сомнения не вызывало, учитывая отсутствие специфических маркеров активного воспаления вокруг скоплений бактерий в ткани клапана, авторы пришли к выводу, что пациентка могла перенести ИЭ на каком-то этапе болезни без признаков активности на момент операции, в связи с чем точной этиологической причины при микробиологическом исследовании ни в крови, ни в тканях резецированного клапана установить не удалось, несмотря на определяющееся скопление бактерий микроскопическим методом.
Учитывая полученные данные, обсуждалась правильная стратегия лечения. Активность АТ считалась низкой, поэтому иммуносупрессивная терапия не проводилась. Что касается полного курса АБТ, который показан всем пациентам с активным ИЭ, в данном случае его назначение вызывало много вопросов. С одной стороны, пациентка ни на одном этапе болезни не получала адекватного курса АБТ, с другой стороны на момент операции не было никаких показаний для назначения курса АБТ – ни клинических, ни лабораторных, ни гистологических. Авторами было решено не назначать полный курс АБТ для лечения ИЭ.
Серии зарубежных публикаций подтверждают диагностическую ценность ПЦР-исследования тканей иссеченного клапана сердца в этиологической диагностике ИЭ [14]. Однако в ряде случаев наличие генетического материала (нуклеиновых кислот) бактерий в тканях клапанов без клинических, лабораторных или ЭхоКГпризнаков активного ИЭ свидетельствует не только о персистенции жизнеспособных бактерий, но и позволяет ретроспективно определить наличие перенесенной инфекции [15]. Поэтому выявление Staphylococcus aureus (MSSA) при ПЦР-исследовании в представленном клиническом наблюдении не противоречит концепции о перенесенном ИЭ, но демонстрирует возможности ретроспективного точного определения этиологической принадлежности возбудителя и может указывать на связь такого агрессивного поражения клапанов с ИЭ.
Среди основных терапевтических проблем клинического случая можно выделить: своевременность направления на оперативное лечение пациентки с тяжелым многоклапанным пороком; особенности оперативного лечения на фоне АТ, зависящие от активности болезни; опасность назначения иммуносупрессивной терапии при дегенеративно измененных клапанах.
Пациентка перенесла протезирование АК механическим протезом, при этом хирургическое лечение у пациентов с активным АТ является сложным из-за необходимости манипулировать рыхлыми и воспаленными тканями, что может способствовать развитию паравальвулярной фистулы и других осложнений. В связи с указанным выше, лечение пациентов должно быть комплексным – адекватная противовоспалительная терапия, достижение стадии морфологической ремиссии и только затем – реконструктивное вмешательство, что было полностью реализовано в представленном клиническом наблюдении и хирургическое вмешательство было выполнено только после достижения полной ремиссии АТ. Кроме поражения АК в представленном наблюдении трудность ведения пациентки обусловлена наличием тяжелой митральной регургитации, как исхода возможно перенесенного ИЭ миксоматозно измененного МК с формированием перфорации створки, и умеренной ТР, как последствия вовлечения правых отделов сердца на фоне быстро прогрессирующих изменений левых камер. Пациентке помимо протезирования АК механическим протезом выполнена реконструкция МК и пластика трикуспидального клапана, с учетом индивидуальных анатомических возможностей.
Таким образом, у пациентки 22-летнего возраста с не вызывающим сомнения АТ имело место тяжелое поражение сердца в рамках исходной миксоматозной дегенерации створок АК и МК, вероятно осложненных присоединением ИЭ с дальнейшим тяжелейшим поражением клапанов (фистула, перфорация), приведшим к рецидивирующей острой декомпенсации сердечной недостаточности с успешной хирургической коррекцией. Вклад АТ в поражение клапанного аппарата сердца вероятно обусловлен не прямым воздействием на АК, а формированием иммуносупрессивного фона. Временные рамки возможного ИЭ определить крайне сложно. Можно предположить, что пациентка перенесла его на фоне применения метотрексата и ГКС (симптомы заболевания не проявлялись в связи с иммуносупрессией). Однако наиболее тяжелые поражения клапанного аппарата у пациентки возникли уже после отмены ГКС. Тем не менее, это могла быть длительная вялотекущая инфекция, которая была элиминирована после отмены иммуносупрессивной терапии, но привела к тяжелому поражению клапанов сердца за короткий промежуток с момента отмены ГКС и до декомпенсации сердечной недостаточности. Наиболее полную картину поражения сердца можно было установить только при комплексном патогистологическом и ПЦР-исследовании тканей резецированных клапанов.
Заключение
Поражение АК не относится к редким явлениям, однако причины могут быть крайне разнообразными, от часто встречающихся двустворчатого АК и дегенеративных заболеваний, до поражения в рамках системных аутоиммунных заболеваний. АТ может поражать корень аорты и аортальный клапан, в связи с чем выяснение природы поражения клапанов обычно является сложной диагностической задачей. Описан редкий случай возможного одновременного протекания ИЭ и АТ на фоне миксоматозной дегенерации клапанов. Комплексное патогистологическое и ПЦР-исследование тканей имели наибольшее значение для дифференциальной диагностики клапанных поражений, определив ведущую причину для развития структурной патологии сердца в рамках миксоматозной дегенерации и возможного ИЭ, в то время как наличие АТ играло косвенную роль, но явно ведущую, обусловив развитие иммуносупрессивного состояния для развития бактериемии. Данный комплексный подход позволил приблизиться к пониманию причины поражения сердца и выбрать оптимальную стратегию лечения с успешным исходом.
Отношение и Деятельность. Нет.
Relationships and Activities. None.
Финансирование. Работа выполнена при поддержке гранта Российского научного фонда (проект № 22-75-10012) с использованием биоматериала человека, собранного и сохраняемого в рамках научной программы. Оборудование для сбора, хранения и транспортировки биоматериала человека, оборудование для обследования пациентов приобретено за счет средств Программы стратегического академического лидерства РУДН.
Funding. The work was supported by a grant from the Russian Science Foundation (project no. 22-75- 10012) using human biomaterial collected and preserved as part of a scientific program. Equipment for the collection, storage and transportation of human biomaterial, equipment for examining patients was purchased at the expense of the Strategic Academic Leadership Program of RUDN University
Список литературы
1. Alcelik A, Karacay S, Hakyemez IN, et al. Takayasu arteritis initially mimicking infective endocarditis. Mediterr J Hematol Infect Dis. 2011;3(1):e2011040. DOI:10.4084/MJHID.2011.040.
2. Zhang Y, Yang K, Meng X, et al. Cardiac Valve Involvement in Takayasu Arteritis Is Common: A Retrospective Study of 1,069 Patients Over 25 Years. Am J Med Sci. 2018;356(4):357-64. DOI:10.1016/j.amjms.2018.06.021.
3. Habib G, Lancellotti P, Antunes MJ, et al. 2015 ESC guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J. 2015;36(44):3075-128. DOI:10.1093/eurheartj/ehv319.
4. Infective endocarditis and infection of intracardiac devices. Clinical guidelines (2021) [cited 2022 Jan 09]. Available from: https://scardio.ru/content/Guidelines/2020/KP_Inf_Endokardit-unlocked.pdf (In Russ.)
5. Espinoza JL, Ai S, Matsumura I. New Insights on the Pathogenesis of Takayasu Arteritis: Revisiting the Microbial Theory. Pathogens. 2018;7(3):73. DOI:10.3390/pathogens7030073.
6. Watanabe Y, Miyata T, Tanemoto K. Current Clinical Features of New Patients With Takayasu Arteritis Observed From Cross-Country Research in Japan: Age and Sex Specificity. Circulation. 2015;132(18):1701-9. DOI:10.1161/CIRCULATIONAHA.114.012547.
7. Goksedef D, Omeroglu SN, Ipek G. Coronary artery and mitral valve surgery in Takayasu's arteritis: a case report. Ann Thorac Cardiovasc Surg. 2012;18(1):68-70. DOI:10.5761/atcs.cr.10.01646.
8. Terao C, Yoshifuji H, Kimura A, et al. Two susceptibility loci to Takayasu arteritis reveal a synergistic role of the IL12B and HLA-B regions in a Japanese population. Am J Hum Genet. 2013;93(2):289-97. DOI:10.1016/j.ajhg.2013.05.024.
9. Park MC, Lee SW, Park YB, et al. Clinical characteristics and outcomes of Takayasu's arteritis: analysis of 108 patients using standardized criteria for diagnosis, activity assessment, and angiographic classification. Scand J Rheumatol. 2005;34(4):284-92. DOI:10.1080/03009740510026526.
10. Soto ME, Espinola N, Flores-Suarez LF, Reyes PA. Takayasu arteritis: clinical features in 110 Mexican Mestizo patients and cardiovascular impact on survival and prognosis. Clin Exp Rheumatol. 2008;26(3):9-15.
11. Comarmond C, Biard L, Lambert M, et al. Long-Term Outcomes and Prognostic Factors of Complications in Takayasu Arteritis: A Multicenter Study of 318 Patients. Circulation. 2017;136(12):1114-22. DOI:10.1161/CIRCULATIONAHA.116.027094.
12. Ely D, Tan CD, Rodriguez ER, et al. Histological Findings in Infective Endocarditis. Open Forum Infectious Diseases. 2016;3(suppl 1):1111. DOI:10.1093/ofid/ofw172.814.
13. Hellmich B, Agueda A, Monti S, et al. 2018 Update of the EULAR recommendations for the management of large vessel vasculitis. Ann Rheum Dis. 2020;79(1):19-30. DOI:10.1136/annrheumdis-2019-215672.
14. Halavaara M, Martelius T, Järvinen A, et al. Impact of pre-operative antimicrobial treatment on microbiological findings from endocardial specimens in infective endocarditis. Eur J Clin Microbiol Infect Dis. 2019;38(3):497-503. DOI:10.1007/s10096-018-03451-5.
15. Rovery C, Greub G, Lepidi H, et al. PCR detection of bacteria on cardiac valves of patients with treated bacterial endocarditis. J Clin Microbiol. 2005;43(1):163-7. DOI:10.1128/JCM.43.1.163-167.2005.
Об авторах
А. С. ПисарюкРоссия
Писарюк Александра Сергеевна
Москва
eLibrarySPIN5602-1059
Е. О. Котова
Россия
Котова Елизавета Олеговна
Москва
eLibrary SPIN 6397-6480
П. В. Агеев
Россия
Агеев Петр Валерьевич
Москва
eLibrary SPIN 3771-1738
А. Ю. Моисеева
Россия
Моисеева Александра Юрьевна
Москва
eLibrary SPIN 1121-0207
Н. М. Поваляев
Россия
Поваляев Никита Михайлович
Москва
eLibrary SPIN 7336-6461
Э. А. Домонова
Россия
Домонова Эльвира Алексеевна
Москва
eLibrary SPIN 1781-8807
О. Ю. Сильвейстрова
Россия
Сильвейстрова Ольга Юрьевна
Москва
eLibrary SPIN 8943-4356
Н. С. Цимбалист
Россия
Цимбалист Наталья Сергеевна
Москва
eLibrary SPIN 3998-4149
Ю. И. Бабухина
Россия
Бабухина Юлия Игоревна
Москва
eLibrary SPIN 2000-2010
И. А. Мерай
Россия
Мерай Имад Ахмадович
Москва
eLibrary SPIN 4477-7559
П. В. Кахкцян
Россия
Кахкцян Павел Вараздатович
Москва
eLibrary SPIN 9092-1870
А. Д. Мешков
Россия
Мешков Алексей Дмитриевич
Российский геронтологический научно-клинический центр, лаборатория заболеваний костно-мышечной системы
Москва
eLibrarySPIN1646-1011
А. Ф. Сафарова
Россия
Сафарова Айтен Фуадовна
Москва
eLibrary SPIN 2661-6501
Ж. Д. Кобалава
Россия
Кобалава Жанна Давидовна
Москва
eLibrary SPIN 9828-5409
Рецензия
Для цитирования:
Писарюк А.С., Котова Е.О., Агеев П.В., Моисеева А.Ю., Поваляев Н.М., Домонова Э.А., Сильвейстрова О.Ю., Цимбалист Н.С., Бабухина Ю.И., Мерай И.А., Кахкцян П.В., Мешков А.Д., Сафарова А.Ф., Кобалава Ж.Д. Клинический случай дифференциальной диагностики причин тяжелого поражения клапанного аппарата сердца (артериит Такаясу, инфекционный эндокардит и миксоматозная дегенерация) и роль гистологического и ПЦР-исследования. Рациональная Фармакотерапия в Кардиологии. 2022;18(6):676-683. https://doi.org/10.20996/1819-6446-2022-12-06
For citation:
Pisaryuk A.S., Kotova E.O., Ageev P.V., Moiseeva A.Yu., Povalyaev N.M., Domonova E.A., Silveistrova O.Yu., Tsimbalist N.S., Babukhina J.I., Meray I.A., Kakhktsyan P.V., Meshkov A.D., Safarova A.F., Kobalava Zh.D. A Case Report of Differential Diagnosis of Causes of Severe Valvular Heart Disease (Takayasu's Arteritis, Infective Endocarditis and Myxomatous Degeneration) with the Key Role of Histological and PCR Examination. Rational Pharmacotherapy in Cardiology. 2022;18(6):676-683. (In Russ.) https://doi.org/10.20996/1819-6446-2022-12-06

















































