Перейти к:
Антитромботическая терапия у пациентов с пароксизмальной формой фибрилляции предсердий после катетерного лечения
https://doi.org/10.20996/1819-6446-2023-03-07
Аннотация
Цель. Изучить эффективность и безопасность антитромботической терапии у пациентов с пароксизмальной формой фибрилляции предсердий (ФП) в течение 36 мес после интервенционного лечения.
Материал и методы. В наблюдательное исследование включены 592 пациента (283 мужчины), которым было проведено катетерное лечение ФП, в возрасте от 26 до 86 лет (медиана возраста составила 61,0 [55;67]) с пароксизмальной формой ФП, пролеченных в отделении хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции НИИ кардиологии Томского национального исследовательского медицинского центра с 01.01.2017 г. по 31.12.2019 г. Все пациенты были разделены на 2 группы: первую составили больные с эффективной аблацией ФП, вторую – с неэффективной. В ходе наблюдения через 12, 24 и 36 мес учитывались жалобы пациентов, документированные рецидивы ФП, приверженность назначенному лечению, неблагоприятные клинические события.
Результаты. У больных с пароксизмальной формой ФП эффективность проведенного катетерного лечения составила 73,1% через 12 мес наблюдения, 69,3 % – через 24 месяца, 71,6% - через 36 месяцев. Анализ полученных в ходе нашего исследования данных, показал, что за период наблюдения 36 месяцев частота возникновения инсультов по ишемическому типу на фоне приема антикоагулянтной терапии и эффективного катетерного лечения пароксизмальной ФП статистически значимо меньше, чем у больных с неуспешной аблацией (0,3% (n=1) и 3,7% (n=4) соответственно), даже несмотря на тот факт, что не все пациенты из первой группы получали назначенное медикаментозное лечение.
Заключение. Применение антикоагулянтной терапии у пациентов с пароксизмальной ФП после интервенционного лечения является безопасным, так как инвазивная стратегия в сочетании с антикоагулянтной терапией не увеличивают риск возникновения больших и малых кровотечений. В случае эффективного вмешательства позволяет статистически значимо снизить риск развития ишемического инсульта и практически полностью исключить вероятность возникновения других тромбоэмболических осложнений.
Для цитирования:
Эшматов О.Р., Хлынин М.С., Баталов Р.Е., Арчаков Е.А., Кистенева И.В. Антитромботическая терапия у пациентов с пароксизмальной формой фибрилляции предсердий после катетерного лечения. Рациональная Фармакотерапия в Кардиологии. 2023;19(2):160-166. https://doi.org/10.20996/1819-6446-2023-03-07
For citation:
Eshmatov O.R., Khlynin M.S., Batalov R.E., Archakov E.A., Kisteneva I.V. Antithrombotic Therapy in Patients with Paroxysmal Atrial Fibrillation after Catheter Treatment. Rational Pharmacotherapy in Cardiology. 2023;19(2):160-166. (In Russ.) https://doi.org/10.20996/1819-6446-2023-03-07
Введение
Ишемический инсульт и системная эмболия являются основными, но потенциально предотвратимыми осложнениями фибрилляции предсердий (ФП), приводящими к тяжелой заболеваемости, инвалидизации и смертности. В связи с этим в настоящее время, согласно современным рекомендациям, назначение антитромботической терапии (АТТ) с использованием антагонистов витамина К (АВК) или прямых пероральных антикоагулянтов (ПОАК), является обязательным для профилактики инсульта при ФП [1][2]. Катетерная аблация – это многообещающий интервенционный метод лечения ФП с общей эффективностью, варьирующей от 45% до 95% [3][4]. Возможность прекращения АТТ после успешной процедуры является одним из потенциальных преимуществ аблации ФП. Однако безопасность данной стратегии еще не была продемонстрирована в крупных рандомизированных исследованиях. Согласно двум недавним консенсусным документам экспертов терапию ПОАК после вмешательства необходимо продолжать на неопределенный срок, по крайней мере, у больных с высоким риском тромбоэмболических осложнений (ТЭО) [3][4]. Тем не менее, несмотря на данные рекомендации, продолжение приема ПОАК после однозначно успешной процедуры катетерного лечения ФП по-прежнему вызывает споры, и некоторые крупные медицинские центры по всему миру проводят политику отмены ПОАК даже у пациентов с высоким риском ТЭО (17% из 42 центров по всему миру, опрошенных при недавнем анкетировании) [5].
Цель исследования – изучить эффективность и безопасность АТТ у пациентов с пароксизмальной формой ФП в течение 36 мес после интервенционного лечения.
Материал и методы
В проспективное исследование включено 592 больных (283 мужчины, 47,8%) возрасте от 26 до 86 лет [ медиана возраста 61 (55;67) лет] с пароксизмальной ФП, проходивших лечение в отделении хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции НИИ кардиологии Томского национального исследовательского медицинского центра (ТНИМЦ) с 01.01.2017 г. по 31.12.2019 г. Критерии включения: возраст старше 18 лет, проведенное катетерное лечение пароксизмальной ФП. Данное одноцентровое когортное наблюдательное исследование выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации, одобрено этическим комитетом НИИ Кардиологии ТНИМЦ. Каждый больной подписывал информированное согласие на участие в исследовании.
При анализе историй болезни проводилась интерпретация жалоб пациентов и анамнеза, далее оценивались результаты лабораторных и инструментальных методов исследования.
На момент госпитализации 103 пациента (17,4%) не получали АТТ, имея различный риск ТЭО по шкале CHA2DS2-VASc, HAS-BLED (табл. 1). Ацетилсалициловую кислоту (АСК) принимали 52 (8,7%) больных, варфарин – 127 (21,5%; только у 19 пациентов было достигнуто целевое значение МНО), ПОАК – 310 (52,3%) больных. У всех больных оценивались риски развития ТЭО, кровотечений, симптомов, связанных с ФП по шкалам CHA2DS2-VASc, HAS-BLED, EHRA.
Table 1. CHA2DS2-VASc, HAS-BLED scores in patients who did not take antithrombotic therapy during hospitalization (n=103)
Таблица 1. Оценка по шкалам CHA2DS2-VASc, HAS-BLED у пациентов, не принимавших АТТ при госпитализации (n=103)

Всем больным перед интервенционным лечением была проведена чреспищеводная эхокардиография на аппарате Philips Invisor (Philips, Голландия) для оценки наличия тромботических образований в полостях сердца. Далее в условиях рентгеноперационной всем пациентам были проведены радиочастотная аблация (РЧА) или криобаллонная изоляция (КБИ) легочных вен (ЛВ). КБИ ЛВ выполнена у 51 (8,6%) пациентов, РЧА – у 410 (69,3%), РЧА, дополненная линейными аблациями по задней стенке, крыше левого предсердия и митральному истмусу – у 131 (22,1%) больных. В раннем послеоперационном периоде зарегистрированы следующие осложнения: у 1 (0,2%) больного артериовенозная фистула, у 5 (0,8%) – ложная аневризма бедренной артерии, у 3 (0,5%) – гемоперикард, потребовавший перикардиоцентеза и эвакуации крови, из них в 1 (0,2%) случае потребовалась экстренное кардиохирургическое вмешательство, а в другом – переливание свежезамороженной плазмы.
При выписке пациентам была назначена ААТ и АТТ в соответствии с актуальными рекомендациями [11] (табл. 2).
Table 2. Antiarrhythmic and antithrombotic therapy upon admission and discharge of patients from the hospital (n=103)
Таблица 2. Антиаритмическая и АТТ при поступлении и при выписке пациентов из стационара (n=103)

В соответствии с целью исследования пациенты были разделены на 2 группы: первую составили больные с эффективной аблацией ФП, вторую – с неэффективной. Через 12, 24, 36 мес после выписки из стационара устанавливался контакт с пациентами, очный визит в случае проживания пациента в городе Томск или близлежащих населенных пунктах, при невозможности совершить визит в клинику проводилось телефонное интервьюирование на контрольных точках. В ходе контрольного опроса учитывались жалобы на приступы учащенного неритмичного сердцебиения, документированный рецидив аритмии, приверженность назначенному лечению, неблагоприятные клинические события в виде ТЭО, кровотечений, а также госпитализаций по поводу сердечно-сосудистых событий или по любым другим причинам.
Эффективным интервенционное лечение считалось при отсутствии у пациентов жалоб на приступы аритмичного учащенного сердцебиения и перебоев в работе сердца, а также на всех ЭКГ и протоколах суточного мониторирования ЭКГ, выполненных в течение 36 мес после вмешательства, не было документировано пароксизмов ФП. В случае неэффективности интервенционного лечения выполнялись повторные процедуры РЧА.
Пациенты, которым было проведено повторное интервенционное лечение по поводу рецидива ФП через 12, 24, 36 мес с положительным эффектом, переходили в группу с успешной аблацией, также больные из группы с эффективным катетерным лечением при возникновении пароксизмов ФП попадали в группу с неэффективным лечением.
Конечными точками эффективности определены сердечно-сосудистая смерть, инфаркт миокарда (ИМ), острого нарушения мозгового кровообращения (ОНМК) по ишемическому типу и другие ТЭО, тромбоз полостей сердца и вен нижних конечностей. Конечными точками безопасности были кровотечения, которые определялись как большие и малые согласно принятой классификации [6].
Статистический анализ
Обработку и графическое представление данных осуществляли с помощью компьютерных программ Statistica 12.0 (StatSoft, США). Результаты анализа непрерывных величин представлены в виде среднего и стандартной ошибки (M±SE). Значения качественных признаков представлены в виде наблюдаемых частот и процентов. Для сравнения средних использовали Ткритерий Стьюдента. Для сравнения качественных признаков использовали критерий χ2 Пирсона для четырехпольных таблиц сопряженности. При наличии малых частот (более 5, но менее 10) использовали поправку Йейтса на непрерывность. При частотах меньше 5 использовали точный метод Фишера. Для анализа изменений в связанных выборках использовали критерий Кочрена. Критический уровень значимости (p) при проверке нулевой гипотезы принимали равный 0,05.
Результаты
Через 12, 24 и 36 мес установлен контакт с 402 (67,9%) пациентами из 592 включенных в исследование, с остальными пациентами был утерян контакт по разным причинам.
Пациенты с неэффективным КИ ЛВ имели значимо бо́льшую оценку по шкале CHA2DS2-VASc группы с эффективной КИ ЛВ, при оценке по шкале HAS-BLED, группы значимо не различались (табл. 3).
Table 3. CHA2DS2-VASc and HAS-BLED scores depending on the effectiveness of catheter treatment
Таблица 3. Оценка по шкалам CHA2DS2-VASc и HAS-BLED в зависимости от эффективности катетерного лечения
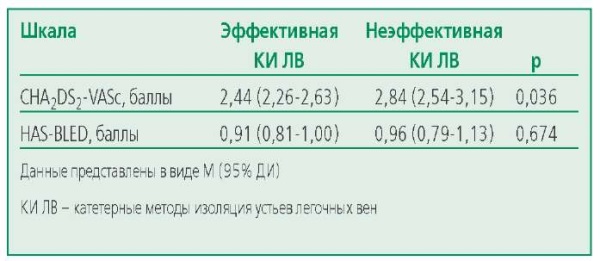
Подгруппа с эффективным интервенционным лечением через 12 мес включала 294 (73,1%) пациента. У 1 (0,03%) пациента диагностировано ОНМК по ишемическому типу, у 6 (2,0%) – кровотечение (табл. 4). В подгруппе с неэффективной аблацией через 12 мес было 108 (26,9%) пациентов. У 4 (3,7%) больных документирован летальный исход, причиной которого послужило ОНМК по ишемическому типу. У 3 (2,8%) пациентов выявлено кровотечение. Повторные РЧА ФП в течение первого года наблюдения проведены у 31 (7,7%) пациента, из них в 11 (10,2%) случаях после вмешательства зарегистрировано носовое кровотечение [ варфарин, у 5 (4,6%) при не целевом МНО, у 6 (5,5%) при целевом МНО].
Table 4. Adverse events in patients with atrial fibrillation during follow-up
Таблица 4. Осложнения у пациентов с ФП за время наблюдения

Через 24 мес подгруппа с эффективным катетерным лечением составляла 276 (68,6%) пациентов. ТЭО не зарегистрированы. В 2 (0,7%) случаях выявлены носовые кровотечения (см. табл. 4). В подгруппе с неэффективной аблацией через 24 мес было 122 (30,7%) пациента. Ни у кого из данной подгруппы нежелательных явлений отмечено не было. Повторные РЧА ФП в течение второго года наблюдения проведены в 17 (4,3%) случаях, после повторного вмешательства нежелательные явления не выявляли.
Через 36 мес подгруппа с эффективным интервенционным лечением составляла 285 (70,9%) пациентов. ТЭО не было. В 4 (1,4%) случаях выявлено кровотечение. Подгруппа с неуспешной аблацией включала 113 (28,1%) больных. Зарегистрирован 1 (0,8%) летальный исход, в 3 (2,7%) случаях выявлено кровотечение (см. табл. 4). Повторные РЧА ФП в течение третьего года наблюдения проводились у 9 (2,3%) пациентов, после повторного вмешательства зарегистрированы: в 1 (0,8%) случае острый инфаркт миокарда (прием апиксабана), в 1 (0,8%) – ректальное кровотечение (прием апиксабана) на фоне обострения хронического геморроя и в 1 (0,8%) – десневое кровотечения (прием дабигатрана). Подробное описание проводимой ААТ и АТТ представлено в табл. 5. На контрольных точка 12, 24, 36 мес некоторые пациенты самостоятельно отказывались от приема АТТ.
Table 5. Antiarrhythmic and antithrombotic therapy received by patients throughout the entire observation period
Таблица 5. Антиаритмическая и АТТ, получаемая пациентами на протяжении всего периода наблюдения

Обсуждение
Повышение риска ТЭО и прогрессирование сердечной недостаточности – основное клиническое значение ФП. К настоящему времени доказано, что ФП ассоциируется с повышением риска развития ОНМК по ишемическому типу более чем в 5 раз по сравнению с лицами с синусовым ритмом, которое с одинаковой частотой регистрируется у пациентов как с бессимптомным, так и симптомным течением аритмии [7][8]. В связи с этим антикоагулянтная терапия является первоочередным и обязательным компонентом лечения данных больных вне зависимости от формы ФП и основывается на оценке риска тромбоэмболических осложнений по шкале CHA2DS2-VASc [8][9]. Стратегия контроля ритма включает в себя антиаритмические препараты, интервенционные и хирургические методы лечения ФП. В нашей работе выбор способа интервенционного лечения зависел от возраста пациента, продолжительности анамнеза аритмии, размера левого предсердия по данным ультразвукового исследования, наличия аблаций в анамнезе. Инвазивная эндокардиальная тактика является более эффективным методом лечения в плане поддержания синусового ритма и уменьшения симптомов аритмии, улучшения качества жизни, нежели антиаритмическая терапия [10-12].
Радиочастотная изоляция ЛВ избавляет от ФП до 80% пациентов с ее пароксизмальной формой, в связи с чем считается «золотым стандартом» интервенционного лечения данной аритмии [13][14]. В нашей работе у больных с пароксизмальной ФП эффективность проведенного интервенционного лечения составила 73,1% через 12 мес наблюдения (n=294), 69,3% (n=276) – через 24 мес, 71,6% (n=285) – 36 мес, что в целом соответствует современным литературным данным. При этом повторные процедуры были выполнены 57 (14,1%) пациентам.
Анализ полученных в ходе нашего исследования данных, показал, что за период наблюдения в 36 мес частота возникновения ОНМК по ишемическому типу на фоне приема АТТ и эффективного катетерного лечения пароксизмальной ФП значимо ниже, чем у больных с неуспешной аблацией (0,3% и 3,7% соответственно), даже несмотря на то, что не все пациенты из первой группы получали назначенное медикаментозное лечение. У больных с пароксизмальной формой ФП и успешной аблацией за весь период наблюдения только в 1 случае было диагностировано ОНМК по ишемическому типу на фоне приема АСК. Других ТЭО и летальных исходов не было. При неэффективном интервенционном лечении ОНМК, малые кровотечения, также как и летальные исходы, встречались значимо чаще (см. рис. 1).

Figure 1. Adverse events in patients with paroxysmal atrial fibrillation after catheter treatment for 36 months of follow-up
Рисунок 1. Нежелательные явления у больных с пароксизмальной ФП после катетерного лечения за 36 мес наблюдения
Данный факт еще раз свидетельствует о более благоприятном прогнозе стратегии контроля ритма, чем контроля частоты в плане развития инсультов у пациентов с пароксизмальной ФП, даже несмотря на проводимую антикоагулянтную терапию. Частота возникновения ОНМК в таких клинических исследованиях как RE-LY, ROCKET-AF и ARISTOTLE составляла от 1,11% до 2,2% в год в зависимости от принимаемого антикоагулянта [15-18]. В нашей работе у пациентов с эффективным катетерным лечением данный показатель составил 0,3% за 3 года наблюдения, что еще раз свидетельствует о необходимости сохранения синусового ритма.
Таким образом, согласно нашим данным, можно сделать вывод, что сохранение синусового ритма с помощью проведения интервенционного лечения пароксизмальной формы ФП дополнительно позволяет существенно снизить риск развития ОНМК по ишемическому типу и других ТЭО, чем только антикоагулянтная терапия, при этом инвазивная стратегия не увеличивает риск возникновения различных кровотечений у данной категории пациентов.
Ограничение исследования
Особенности дизайна исследования, ретроспективный характер деления на группы не позволяют в полной мере охватить все потенциально влияющие факторы. Также за период наблюдения часть бессимптомно протекающих пароксизмов ФП могли остаться незарегистрированными с учетом особенностей методов наблюдения пациентов.
Заключение
Процедура РЧА/КБИ у пациентов с пароксизмальной формой ФП в отдаленном периоде показала эффективность в 71,6%. Применение антикоагулянтной терапии у пациентов с пароксизмальной ФП после интервенционного лечения является безопасным, так как инвазивная стратегия в сочетании с АТТ не увеличивают риск возникновения больших и малых кровотечений. В случае эффективного вмешательства позволяют статистически значимо снизить риск развития ишемического инсульта и практически полностью исключить вероятность возникновения других ТЭО.
Отношения и Деятельность. Нет. Исследование проведено при поддержке НИИ Кардиологии ТНИМЦ.
Relationships and Activities. None. The study was performed with the support of the Cardiology Research Institute of Tomsk National Research Medical Center.
Список литературы
1. Fuster V, Rydén LE, Cannom DS, et al. ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation–executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelinesand the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Revise the 2001 Guidelines for the Management of Patients With Atrial Fibrillation). J Am Coll Cardiol. 2006;48(4):854-906. DOI:10.1016/j.jacc.2006.07.009.
2. Singer DE, Albers GW, Dalen JE, et al. Antithrombotic therapy in atrial fibrillation: American College of Chest Physicians evidence - based clinical practice guidelines (8th Edition). Chest. 2008;133(6 Suppl):546S-92S. DOI:10.1378/chest.08-0678.
3. ¬¬3. Natale A, Raviele A, Arentz T, et al. Venice Chart international consensus document on atrial fibrillation ablation. J Cardiovasc Electrophysiol. 2007;18(5):560-80. DOI:10.1111/j.1540-8167.2007.00816.x.
4. Calkins H, Brugada J, Packer DL, et al. HRS/EHRA/ECAS expert Consensus Statement on catheter and surgical ablation of atrial fibrillation: recommendations for personnel, policy, procedures and followup. A report of the Heart Rhythm Society (HRS) Task Force on catheter and surgical ablation of atrial fibrillation. Heart Rhythm. 2007;4(6):816-61. DOI:10.1016/j.hrthm.2007.04.005.
5. Prystowsky EN, Themistoclakis S, Brachmann J, et al. Anticoagulation issues. In: Natale A, Raviele A, eds. Atrial Fibrillation Ablation: The State of the art based on the Venicechart International Consensus Document. Malden: Blackwell; 2007. P. 41-50.
6. Kakkar AK, Mueller I, Bassand JP, et al. International longitudinal registry of patients with atrial fibrillation at risk of stroke: Global Anticoagulant Registry in the FIELD (GARFIELD). Am Heart J. 2012;163(1):13-19.e1. DOI:10.1016/j.ahj.2011.09.011.
7. Själander S, Holmqvist F, Smith JG, et al. Assessment of use vs discontinuation of oral anticoagulation after pulmonary vein isolation in patients with atrial fibrillation. JAMA Cardiol. 2017;2(2):146-52. DOI:10.1001/jamacardio.2016.4179.
8. Lauritzen DJ, Vodstrup HJ, Christensen TD, et al. Discontinuation of anticoagulants after successful surgical ablation of atrial fibrillation. J Card Surg. 2020;35(9):2216-23. DOI:10.1111/jocs.14719.
9. Wann LS, Curtis AB, January CT, et al. 2011 ACCF/AHA/HRS focused update on the management of patients with atrial fibrillation (Updating the 2006 Guideline): a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Heart Rhythm. 2011;8(1):157-76. DOI:10.1016/j.hrthm.2010.11.047.
10. Арчаков Е.А., Баталов Р.Е., Усенков С.Ю., и др. Случай применения неинвазивной топической диагностики с успешной аблацией при персистирующей фибрилляции предсердий. Российский Кардиологический Журнал. 2019;24(7):91-5. DOI:10.15829/1560-4071-2019-7-91-95.
11. Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021;42(5):373-498. DOI:10.1093/eurheartj/ehaa612.
12. Ревишвили А.Ш., Бойцов С.А., Давтян К.В., и др. Диагностика и лечение фибрилляции предсердий. В: Клинические рекомендации по проведению электрофизиологических исследований, катетерной абляциии и применению имплантируемых антиаритмических устройств. М.: МАКС Пресс; 2017. С. 463-597.
13. Calkins H, Reynolds MR, Spector P, et al. Treatment of atrial fibrillation with antiarrhythmic drugs or radiofrequency ablation: two systematic literature reviews and meta-analyses. Circ Arrhythm Electrophysiol. 2009;2(4):349-61. DOI:10.1161/CIRCEP.108.824789.
14. Pappone C, Rosanio S, Oreto G, et al. Circumferential radiofrequency ablation of pulmonary vein ostia: A new anatomic approach for curing atrial fibrillation. Circulation. 2000;102(21):2619-28. DOI:10.1161/01.cir.102.21.2619.
15. Granger CB, Alexander JH, McMurray JJ, et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2011;365(11):981-92. DOI:10.1056/NEJMoa1107039.
16. Patel MR, Mahaffey KW, Garg J, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med. 2011;365(10):883-91. DOI:10.1056/NEJMoa1009638.
17. Киргизова М. А., Баталов Р. Е., Татарский Б. А., Фибрилляция предсердий и артериальная гипертензия: современное представление о патогенезе, диагностике и лечении. Сибирский Медицинский Журнал. 2019;34(3):13-20. DOI 10.29001/2073-8552-2019-34-3-13-20.
18. Эшматов О.Р., Баталов Р.Е., Арчаков Е.А., и др. Эффективность и безопасность антикоагулянтной терапии у пациентов с различными формами фибрилляции предсердий после интервенционного лечения. Результаты трехлетнего наблюдения. Кардиология. 2022;62(8):19-26. DOI:10.18087/cardio.2022.8.n2046.
Об авторах
О. Р. ЭшматовРоссия
Эшматов Отабек Рахимжанович,
Томск
М. С. Хлынин
Россия
Хлынин Михаил Сергеевич,
Томск
Р. Е. Баталов
Россия
Баталов Роман Ефимович,
Томск
Е. А. Арчаков
Россия
Арчаков Евгений Александрович,
Томск
И. В. Кистенева
Россия
Кистенева Ирина Валерьевна,
Томск
Дополнительные файлы
Рецензия
Для цитирования:
Эшматов О.Р., Хлынин М.С., Баталов Р.Е., Арчаков Е.А., Кистенева И.В. Антитромботическая терапия у пациентов с пароксизмальной формой фибрилляции предсердий после катетерного лечения. Рациональная Фармакотерапия в Кардиологии. 2023;19(2):160-166. https://doi.org/10.20996/1819-6446-2023-03-07
For citation:
Eshmatov O.R., Khlynin M.S., Batalov R.E., Archakov E.A., Kisteneva I.V. Antithrombotic Therapy in Patients with Paroxysmal Atrial Fibrillation after Catheter Treatment. Rational Pharmacotherapy in Cardiology. 2023;19(2):160-166. (In Russ.) https://doi.org/10.20996/1819-6446-2023-03-07

















































