Перейти к:
Кишечная микробиота и сердечно-сосудистые заболевания: механизмы влияния и возможности коррекции
https://doi.org/10.20996/1819-6446-2023-01-03
Аннотация
Термин «микробиота» используется для обозначения характерного микробного сообщества, занимающего определенную среду обитания с установленными физико-химическими свойствами и формированием специфических экологических ниш. Микробиота кишечника взрослого человека разнообразна и в основном состоит из бактерий филумов Bacteroidetes и Firmicutes. Связь между микробиотой кишечника и сердечно-сосудистыми заболеваниями (ССЗ) активно обсуждается. Быстрый прогресс в этой области объясняется развитием методов секвенирования нового поколения и использованием в экспериментах мышей со стерильным кишечником. Публикуется все больше данных, о влиянии микробиоты на развитие и течение гипертонической болезни, ишемической болезни сердца (ИБС), гипертрофии миокарда, хронической сердечной недостаточности (ХСН) и фибрилляции предсердий (ФП). В качестве инструментов коррекции структуры микробиоты кишечника макроорганизма успешно применяются диетотерапия, антибактериальные препараты, про- и пребиотики. Появляются данные о положительном влиянии методов коррекции кишечной микробиоты на течение заболеваний сердечно-сосудистой системы. Коррекция микробиоты кишечника в эксперименте на крысах с окклюзией коронарного кровотока демонстрирует значимое уменьшение площади некротизированного участка. При исследовании с участием больных, страдающих ХСН, выявлено значимое снижение уровня мочевой кислоты, высокочувствительного С-реактивного белка и креатинина. Помимо структурных и лабораторных изменений у больных ССЗ при модификации микробиоты кишечника, выявлено также влияние на течение артериальной гипертензии. Коррекция микробиоты кишечника благотворно сказывается на течении ФП. Предполагаем, что дальнейшее активное изучение вопросов влияния и взаимодействия микробиоты кишечника и макроорганизма могут в обозримом будущем внести значительные коррективы в подходы к лечению таких больных.
Ключевые слова
Для цитирования:
Горбенко А.В., Скирденко Ю.П., Андреев К.А., Федорин М.М., Николаев Н.А., Ливзан М.А. Кишечная микробиота и сердечно-сосудистые заболевания: механизмы влияния и возможности коррекции. Рациональная Фармакотерапия в Кардиологии. 2023;19(1):58-64. https://doi.org/10.20996/1819-6446-2023-01-03
For citation:
Gorbenko A.V., Skirdenko Y.P., Andreev K.A., Fedorin M.M., Nikolaev N.A., Livzan M.A. Microbiota and Cardiovascular Diseases: Mechanisms of Influence and Correction Possibilities. Rational Pharmacotherapy in Cardiology. 2023;19(1):58-64. (In Russ.) https://doi.org/10.20996/1819-6446-2023-01-03
Введение
Связь между микробиотой кишечника и здоровьем человека является широко обсуждаемой. Быстрый прогресс в этой области объясняется появлением новых поколений методов секвенирования и использованием в экспериментах мышей со стерильным кишечником [1][2].
Известно, что состав кишечной микробиоты меняется параллельно взрослению и может варьироваться в зависимости от достаточно большого количества факторов [3]. Внедрение в практику научных исследований методов полногеномного секвенирования позволило составить микробный профиль и исследовать роль кишечной микробиоты в здоровье человека. Установлено, что микробиота взрослого человека включает в основном бактерии филумов Bacteroidetes и Firmicutes [4]. Проект Meta HIT (Metagenomics of the Human Intestinal Tract) показал, что в основное бактериальное ядро кишечника входит 57 наиболее распространенных видов, встречающихся у 90% индивидуумов исследованной когорты с охватом в геноме более 1% [5].
На сегодняшний день микробиоте кишечника вменяют непосредственное участие в развитии и прогрессировании таких заболеваний как синдром раздраженного кишечника, воспалительные заболевания кишечника, целиакия, неалкогольная жировая болезнь печени, новообразования желудочно-кишечного тракта [6], сахарный диабет, ожирение и другие [7][8]. Однако в последние годы пристальное внимание стала привлекать роль микробиоты в развитии и течении сердечно-сосудистых заболеваний (ССЗ). Несмотря на очевидные успехи в снижении бремени ССЗ за счет модификации классических факторов риска, на сегодняшний день распространенность этих заболеваний остается на очень высоком уровне, что свидетельствует о наличии других, недостаточно изученных факторов [9]. В медицинском сообществе имеется ряд научных трудов, демонстрирующих участие микробиоты кишечника в развитии сердечно-сосудистых патологий (табл. 1).
Table 1. Key clinical reports demonstrating the involvement of the gut microbiota in cardiovascular pathologies
Таблица 1. Основные клинические сообщения, демонстрирующие участие микробиоты кишечника в сердечно-сосудистых патологиях
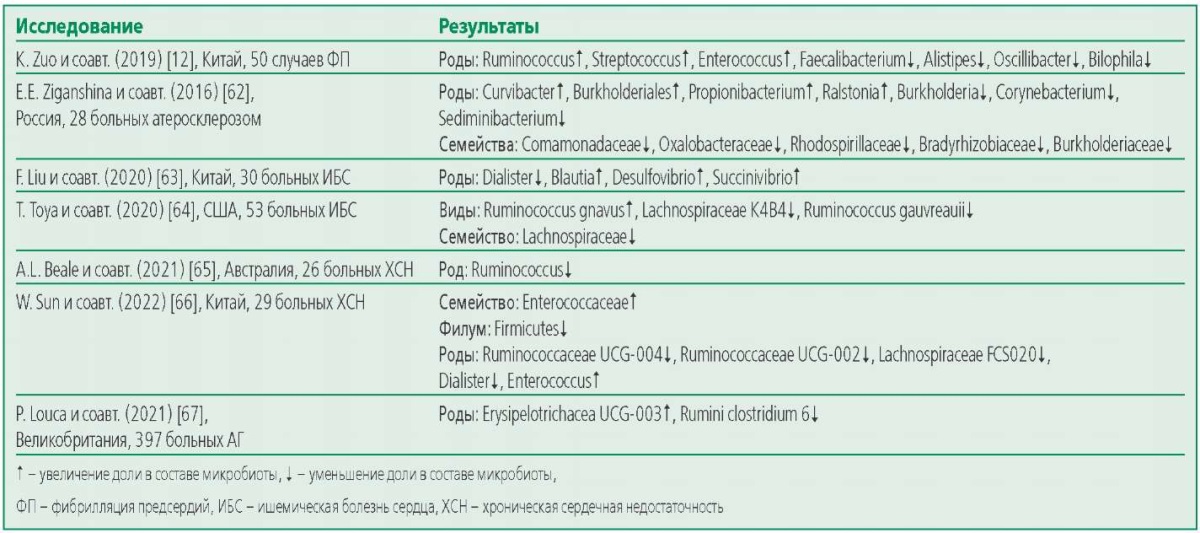
У больных ишемической болезнью сердца (ИБС) было выявлено значимое преобладание в составе микробиоты филума Firmicutes и недостаток Bacteroidetes по сравнению с группой контроля [10]. Микробиота пациентов с тяжелой формой хронической сердечной недостаточности (ХСН) характеризовалось преобладанием таких патогенных родов бактерий как Campylobacter, Shigella и Salmonella [11]. При изучении микробного состава кишечника больных фибрилляцией предсердий (ФП), было выявлено значимое преобладание доли таких родов прокариот Streptococcus, Enterococcus, Blautia, Dorea, Veillonella и Eubacterium. Также обнаружено, что у пациентов с ФП снижено содержание 14 метаболитов, включая холевую, олеиновую, линолевую и α-линоленовую кислоты [12]. Показано, что длительность течения ФП также оказывает влияние на состав кишечной микробиоты. Так, пациенты, страдающие персистирующей формой ФП более года, характеризуются снижением представительства родов Butyricicoccus и Paraprevotella и повышением Blautia, Dorea и Coprococcus в составе кишечной микрофлоры. Тогда как между пациентами с персистирующей и пароксизмальной формами ФП значимых различий в составе микробиоты не выявлено [13].
В качестве одного из возможных механизмов негативной связи микробиоты с ССЗ рассматривается её влияние на деконъюгацию и экскрецию желчных кислот. Метаболизм желчных кислот микробиотой повышает разнообразие пула желчных кислот. Отличные от исходных, метаболизированные желчные кислоты обладают разным сродством с фарнезоидным X-рецептором (FXR) и рецептора желчных кислот, связанного с G-белком Takeda, принимающих непосредственное участие в регуляции метаболизма липидов хозяина [14][15]. Триметиламин, продуцируемый специфической микробиотой и триметиламиноксид (ТМАО – Trimethylamine N-oxide), синтезируемый в печени, могут способствовать повышению риска развития атеросклероза и ССЗ посредством механизмов, включающих метаболизм липидов и системное воспаление [15], либо могут являться биомаркерами, отражающими уровень риска ССЗ поскольку известно, что ТМАО модулирует экспрессию микроРНК, связанных с сердечно-сосудистыми заболеваниями, и что такая модуляция влияет на их гены-мишени [16]. Так, например. выявлена значимая положительная корреляция между TMAO и мозговым натрийуретическим пептидом, при этом высокие уровни ТМАО связаны с увеличением 5-летней смертности пациентов с ХСН [11].
Результаты этих и других исследований показывают взаимосвязь между кишечной микробиотой и рядом ССЗ, что логично должно быть продолжено в изучение возможных способов влияния на течение заболеваний ССЗ через модификацию состояния микробиоты.
Методы коррекции микробиоты кишечника
К основным методам модификации микробиоты кишечника можно отнести антибиотикотерапию, про, пре- и синбиотическую терапию, коррекцию диеты и трансплантацию фекальной микробиоты. К наиболее разработанным подходам модулирования микробиоты в настоящее время относят про- и пребиотическую коррекцию и управление диетой.
Пробиотики и пребиотики
Согласно определению Всемирной организации здравоохранения, пробиотики — это «живые микроорганизмы, которые при введении в адекватных количествах приносят пользу здоровью хозяина» [17]. В состав пробиотиков чаще всего включают бактерии родов: Bifidobacterium, Saccharomyces boulardii, Streptococcus, Enterococcus, Lactobacillus, Lactococcus, Leuconostoc и Pediococcus [18].
К пребиотикам относятся кислотоустойчивые вещества, избирательно ферментируемые микробиотой, и способные таким образом влиять на структуру и активность микроорганизмов, связанных со здоровьем и благополучием макроорганизма [19-21].
В настоящее время пребиотиками, отвечающими всем этим критериям, являются фруктоолигосахариды, галактоолигосахариды, лактулоза и неперевариваемые углеводы. К последним относят большие полисахариды (инулин, резистентные крахмалы, целлюлоза, гемицеллюлоза, пектины и камеди), и некоторые неперевариваемые олигосахариды. Большинство пребиотиков, включая фруктоолигосахариды и инулин, метаболизируются бифидобактериями и стимулируют рост их колоний, что благотворно влияет на гомеостаз клеток кишечника и подавляет рост патогенных бактерий [22-24].
Имеется достаточное количество убедительных данных о положительном эффекте применения пробиотиков и пребиотиков при лечении заболеваний печени (неалкогольная жировая болезнь печени), желудочно-кишечного тракта (воспалительные заболевания кишечника, синдром раздраженного кишечника), хронической болезни почек [25-29].
Несколько исследований показали, что в контексте лечения больных ССЗ пробиотики и пребиотики способны улучшать липидный профиль, приводя к снижению сывороточного уровня холестерина липопротеинов низкой плотности (ЛНП), общего холестерина и триглицеридов или увеличению холестерина липопротеинов высокой плотности. В исследованиях с использованием Lactobacillus acidophilus, было обнаружено более значительное снижение уровня холестерина ЛНП [30-32]. Введение некоторых пробиотиков может стимулировать образование короткоцепочечных жирных кислот (КЦЖК), которые изменяют секрецию инкретиновых гормонов и ослабляют синтез холестерина [33]. Вышеописанные эффекты демонстрируют положительную роль и обосновывают возможность применения пробиотиков и пребиотиков в терапевтической и профилактической схемах при ССЗ.
Диета
Влияние составов диеты и микробиоты кишечника является взаимным. Исследования образцов фекалий кишечной микробиоты на животных и людях показали, что у здоровых субъектов сбалансированная диета может обеспечить формирование хорошей микробной флоры, где содержание всех видов бактерий живет в системе контроля и взаимного баланса [34]. Если баланс нарушается, кишечная микробиота может измениться по типу, качеству и структуре [35]. Так, когда наблюдается снижение соотношения между филумами Firmicutes и Bacteroidetes, преобладает представители, продуцирующие ТМАО, а не КЦЖК. Это состояние типично для модели «западной» диеты [36]. В то время как средиземноморская диета характеризуется высоким содержанием пищевых волокон, а также полифенолов, которые могут оказывать пребиотическое действие на определенные штаммы [37]. КЦЖК представляют собой алифатические органические кислоты, наиболее распространенными из них являются ацетат, пропионат и бутират [38-41]. Высокий уровень КЦЖК ассоциирован со снижением частоты развития сердечно-сосудистых заболеваний, в первую очередь посредством влияния на липидный спектр, снижая содержание холестерина ЛНП [42][43].
Использование в эксперименте с мышами грамположительных бактерий рода Roseburia, производящих в качестве КЦЖК преимущественно бутират, демонстрирует ассоциацию с меньшим размером атеросклеротических бляшек в аорте. Взаимосвязь именно с бутиратом была подтверждена на группе сравнения с применением перорального бутирата, без вмешательства в структуру микробиоты. Добавление Roseburiai ntestinalis в сочетании со средиземноморской диетой демонстрирует прирост содержания бутирата в 4 раза в просвете кишечника, но не в крови [44]. Вероятно, механизм обратной связи бутирата с атеросклерозом косвенный. Бутират, выступая в качестве самого предпочтительного источника энергии для колоноцитов, снижает проницаемость стенки толстой кишки, что ассоциировано со снижением циркулирующих липополисахаридов и провоспалительных цитокинов, а также положительным образом отражается на инсулинорезистентности макроорганизма [43].
За счет высокой продукции КЦЖК (в частности бутирата) микробиотой, характерной для лиц, придерживающихся средиземноморской диеты, по-видимому, реализуются защитные эффекты в отношении заболеваемости ССЗ [45].
Влияние коррекции микробиоты кишечника на течение ССЗ
В исследованиях на крысах с артериальной гипертензией была выявлена связь с изменением микробиоты кишечника. Помимо этого, было обнаружено значимое снижение среднего артериального давления при лечение данной группы антибиотиком широкого спектра действия (миноциклин) [46].
Применение мультиштаммового пробиотика в качестве дополнительной терапии у пациентов с ИБС в течение 28 дней не оказало значимого влияния на обмен липидов, уровень ТМАО и состав фекальной микрофлоры. Последовательное применение рифаксимина и пробиотика продемонстрировало благоприятное воздействие на такие факторы, как обмен липидов (снижение уровня общего холестерина, ЛНП, липопротеинов очень низкой плотности, триглицеридов), однако не повлияло на концентрацию ТМАО и состав кишечной микрофлоры [47].
Пионерами в области изучения влияния антибактериальной терапии у пациентов с острым коронарным синдромом (ОКС) являются ученые из Лондона. В 2002 г. в своей работе они представили результаты сравнения частоты фатальных сердечно-сосудистых событий у пациентов с ОКС в течение 1 года [48]. В качестве групп сравнения исследователи выделили две группы пациентов, получающих эрадикационную терапию в отношении Helicobacter pylori и Chlamydia pneumoniae. Частота достижения конечной точки (смерть и повторная госпитализация с ОКС) в группах с антибактериальной терапией была ниже на 36% по сравнению с группой плацебо. При этом эффективность эрадикации целевых микроорганизмом не влияла на частоту достижения конечных точек [48].
В 2012 г. исследователи из США выявили существенную роль модификации кишечной микробиоты в отношении объема некроза миокарда при экспери ментальной окклюзии коронарного кровотока у крыс. Средняя площадь участка инфаркта миокарда в группе животных, получавших ванкомицин с питьевой водой, была меньше на 27% по сравнению с группой контроля. В группе крыс, с применением в качестве модификатора кишечной микробиоты пробиотика, средний размер некротизированного участка миокарда был на 29% меньше, чем в группе контроля. Применение в группах сравнения перорального ванкомицина и пробиотика также сопровождалось снижением концентрации циркулирующего лептина и лучшим восстановлением механической функции сердца у крыс. При этом кардиопротекторный эффект ванкомицина носит косвенный характер, так как данный препарат минимально всасывается в кровоток и при прямом введении в коронарный кровоток не влиял на тяжесть инфаркта миокарда [49].
Немногим позднее K. McCafferty и соавт., воспроизвели описанное выше исследование, однако на этот раз в фокусе внимания была функция почек. В результате было выявлено снижение уровня лептина в группе крыс. Постишемическая функция почек оценивалась при измерении сывороточного уровня: мочевины, креатинина, фосфатов и АСТ. Статистически значимых различий в уровне лабораторных показателей биохимического анализа между сравниваемыми группами выявлено не было. Исследователи пришли к выводу, что протективный эффект модификации микробиоты кишечника, опосредованный снижением уровня сывороточного лептина, имеет тканеспецифический характер, и в настоящее время ограничивается миокардом [50].
Исследование, проводимое T. Tang и соавт. на мышах, показало связь микробиоты кишечника с восстановлением функции миокарда после перевязки левой передней нисходящей коронарной артерии. В эксперименте доказано, что микробиота кишечника, измененная с помощью приема нескольких плохо всасывающихся антибиотиков, увеличила степень постинфарктного ремоделирования миокарда, частоту разрывов миокарда и смертельных исходов. При этом восстановление микробиоты кишечника с помощью трансплантации кала от доноров значительно улучшило показатели выживаемости, что позволило предположить вовлечение микробиоты кишечника в процесс управления ранним ремоделированием миокарда. Предположительно благоприятное влияние микробиоты кишечника опосредовано эффектами КЦЖК, ответственных за процесс привлечения миелоидных клеток к миокарду. Так, диетические добавки с включением КЦЖК, как и внутривенная инфузия моноцитарных клеток линии RAW264.7, используемая через 1 день после развития инфаркта миокарда, нивелирует неблагоприятное влияние антибиотиков на смертность и частоту разрывов желудочка. Диета с включением КЦЖК была также связана с повышением уровня миелоидных клеток в сердце мышей, получавших антибиотики [51].
Ученые из Китая исследовали микробиоту кишечника и влияние ее модификации на течение гипертрофии миокарда у крыс. Формирование условий для развития гипертрофии миокарда и дисбиоза кишечника создавались путем помещения в гипобарические камеры, имитирующие условия высокогорья. Крысы, находящиеся в условиях высокогорья, характеризовались значительным увеличением размеров сердца и сердечного индекса. При этом модификация микробиоты кишечника (использовались пре-, про- или синбиотики) значимо снижала выраженность гипертрофии миокарда [52].
Bartolomaeus H. и соавт. в 2019 г., исследуя влияние КЦКЖ (припионата) на гипертоническое повреждение сердца и атеросклероз в мышиных моделях дикого типа и с дефицитом аполипопротеина Е, показали уменьшение степени гипертрофии, фиброза, сосудистой дисфункции и гипертонии в обеих моделях. В мышиной модели с дефицитом аполипопротеина Е значительно уменьшилась область атеросклеротического поражения аорты [53]. Ученые из Бразилии провели пилотное рандомизированное плацебо контролируемое исследование, в котором изучалось влияние пробиотической терапии на течение ХСН [54]. В исследование было включено 20 пациентов с фракцией выброса <50%. В результате исследования группа пациентов с коррекцией микробиоты кишечника продемонстрировала значимое снижение уровня С-реактивного белка, общего холестерина и мочевой кислоты, объем левого предсердия значимо снизился, а фракция выброса улучшилась [54].
Помимо структурных и лабораторных изменений у больных ССЗ при модификации микробиоты кишечника, выявлено также влияние на уровень артериального давления (АД). Ученые из Китая выявили не только взаимосвязь между гипертонической болезнью и определенным составом микробиоты кишечника, а также в эксперименте выявили влияние микробиоты на АД. При трансплантации кала стерильным мышам от доноров с артериальной гипертензией у испытуемых наблюдалось повышение АД. Авторы исследования выдвинули предположение о том, что определенный состав микробиоты кишечника может являться не следствием повышенного АД, а одной из причин [55].
Ученые из Харбинского университета изучали взаимосвязь между колонизацией Bacteroides fragilis кишечника макроорганизма и развитием ФП, связанной со старческим кардиосклерозом на модели крыс [55].
Выяснилось, что пероральное введение добавок, со держащих Bacteroides fragilis, было ассоциировано со значимым увеличением содержания Т-супрессорных клеток и ослаблением системного воспаления. Это в свою очередь предотвращало структурное ремоделирование предсердий и развитие ФП, за счет ослабления процессов фиброза и апоптоза кардиоцитов предсердий [55]. Также на модели животных было показано, что ТМАО усугубляет вегетативную активность и способствует высвобождению воспалительных цитокинов у особей с ФП [56]. Эти эффекты могут подавляться пробиотиками. Тем не менее, на сегодняшний день недостаточно исследований, в которых оценивали эффект модуляции кишечной микробиоты на ФП.
Полифенолы, как потенциальные корректоры биомаркеров риска ССЗ
Как было описано выше, ТМАО представляет собой метаболит кишечной микробиоты, который, тесно связан с ССЗ, в основном увеличивая риск развития атеросклероза. В настоящее время не лицензированы никакие фармакологические подходы для снижения уровней ТМАО. Однако, определено [57], что уровень ТМАО в плазме у мышей значительно снижался после введения гераниина (полифенол эллагитаннин, впервые обнаруженный в герани). При этом, преобладающей кишечной микрофлорой у мышей, получавших гераниин, были представители филумов Bacteroides (65,3%) и Firmicutes (30,6%). После лечения гераниином уровни интерлейкинов (IL)1β и 6 и фактора некроза опухоли α в плазме у мышей были значительно снижены, а уровни IL-10 значительно повышены. Установленные факты позволяют предполагать, что полифенолы могут быть перспективным эффективным средством против сердечно-сосудистых заболеваний, а микробиота кишечника — потенциальной мишенью для снижения риска атеросклероза.
В доклинических условиях [58] и в клиническом исследовании [59] проверили способность нутрицевтического препарата на основе полифенолов виноградных выжимок снижать как уровни ТМАО в сыворотке, так и биомаркеры, связанные с окислительным стрессом (n=213). После длительного лечения препаратом на основе полифенолов виноградных выжимок наблюдали значительное снижение уровня ТМАО, окисленных ЛНП и активные формы кислорода. Столь многообещающие результаты позволяют рассматривать полифенолы как эффективную нутрицевтическую стратегию для профилактики атеросклероза.
Позитивное влияние полифенолов винограда установлено и в отношении сосудов головного мозга вследствие ишемически-реперфузионного повреждения [60]. Концентрат полифенолов винограда при употреблении в качестве нутрицевтика эффективно снижает уровень ТМАО и индуцировал дилатацию артериол. Эти результаты расширяют нутрицевтический потенциал полифенолов.
Полифенолы ежевики, особенно антоцианы обладают способностью влиять на уровень ТМАО, липидный профиль сыворотки и маркеры воспаления у крыс, получавших рацион с высоким содержанием жиров и холина [61]. Сывороточные уровни ТМАО, общего холестерина и холестерина ЛНП и уровень триметиламина в слепой кишке были значительно ниже при использовании полифенолов. Экстракт ежевики снижал экспрессию мРНК провоспалительных генов, включая ядерный фактор-κB (NF-κB), IL-1β, IL-6 и циклооксигеназу-2. Эти результаты свидетельствуют о том, что потребление полифенолов может уменьшить степень гиперхолестеринемии, вызванную чрезмерным содержанием холина в диете, за счет снижения повышенных уровней триметиламина слепой кишки и ТМАО в сыворотке у крыс.
Таким образом, растительные диеты с повышенным содержанием полифенолов, становятся все более перспективными, т.к. появляются клинические данные, свидетельствующие о том, что полифенолы могут использоваться для профилактики, а в некоторых случаях и для лечения ССЗ через посредство кишечного микробиома.
Заключение
Изучение роли микробиоты кишечника, как модифицируемого фактора риска развития и неблагоприятного течения ССЗ в настоящее время активно продвигается. Она становится одной из ключевых целей пациентоориентированной медицины, являясь как основой решений, корригирующих течение и улучшаю щих прогноз исходов различных заболеваний, так и представляя собой потенциальную мишень, воздействуя на которую с помощью лекарственных средств, диетических изменений, использования пре-, про- или синбиотиков, биотерапевтических и иных продуктов и способов, можно добиваться улучшения результатов лечения. На сегодняшний день наиболее активно обсуждаются механизмы влияния метаболитов микробиоты на макроорганизм. Выполнено достаточно большое количество исследований, демонстрирующих особенности структурного, количественного и качественного состава микробиоты у больных ССЗ, в том числе и ФП. Ряд исследований демонстрируют корреляцию между модификацией микробного составом кишечной флоры человека и течением ИБС, ХСН и гипертрофии миокарда. Однако вопросы выраженности влияния микробиоты кишечника на течения большинства ССЗ, как и проблема эффективности коррекции состава микробиоты, пока остаются открытыми и требующими обоснования.
Relationships and Activities. None.
Отношения и Деятельность. Нет.
Финансирование. Работа подготовлена в рамках гранта Президента РФ для государственной поддержки молодых российских ученых – кандидатов и докторов наук (внутренний номер МК-1231.2022.3) (соглашение № 075-15-2022-502 от 4 мая 2022 года) «Разработка технологии здоровьесбережения на основе выявления и контроля факторов риска фибрилляции предсердий, ассоциированных с состоянием кишечной микробиоты».
Список литературы
1. Mardis ER. Next-generation DNA sequencing methods. Annual review of genomics and human genetics. 2008;9:387-402. DOI:10.1146/ANNUREV.GENOM.9.081307.164359.
2. Bhattarai Y, Kashyap PC. Germ-Free Mice Model for Studying Host-Microbial Interactions. Methods Mol Biol. 2016;1438:123-35. DOI:10.1007/978-1-4939-3661-8_8.
3. Avershina E, Lundgård K, Sekelja M, et al. Transition from infant-to adult-like gut microbiota. Environ Microbiol. 2016;18(7):2226-36. DOI:10.1111/1462-2920.13248.
4. Eckburg PB, Bik EM, Bernstein CN, et al. Microbiology: Diversity of the human intestinal microbial flora. Science. 2005;308(5728):1635-8. DOI:10.1126/SCIENCE.1110591.
5. Qin J, Li R, Raes J, et al. A human gut microbial gene catalogue established by metagenomic sequencing. Nature. 2010;464(7285):59-65. DOI:10.1038/nature08821.
6. Nagao-Kitamoto H, Kitamoto S, Kuffa P, Kamada N. Pathogenic role of the gut microbiota in gastrointestinal diseases. Intest Res. 2016;14(2):127. DOI:10.5217/IR.2016.14.2.127.
7. Everard A, Cani PD. Diabetes, obesity and gut microbiota. Best Practice & Research Clinical Gastroenterology. 2013;27(1):73-83. DOI:10.1016/J.BPG.2013.03.007.
8. Gurung M, Li Z, You H, et al. Role of gut microbiota in type 2 diabetes pathophysiology. EBioMedicine. 2020;51:102590. DOI:10.1016/j.ebiom.2019.11.051.
9. Tang WHW, Bäckhed F, Landmesser U, Hazen SL. Intestinal Microbiota in Cardiovascular Health and Disease: JACC State-of-the-Art Review. J Am Coll Cardiol. 2019;73(16):2089-105. DOI:10.1016/J.JACC.2019.03.024.
10. Cui L, Zhao T, Hu H, Zhang W, Hua X. Association Study of Gut Flora in Coronary Heart Disease through High-Throughput Sequencing. Bio Med Res Int. 2017;2017:3796359. DOI:10.1155/2017/3796359.
11. Pasini E, Aquilani R, Testa C, et al. Pathogenic Gut Flora in Patients With Chronic Heart Failure. JACC: Heart Failure. 2016;4(3):220-7. DOI:10.1016/J.JCHF.2015.10.009.
12. Zuo K, Li J, Li K, et al. Disordered gut microbiota and alterations in metabolic patterns are associated with atrial fibrillation. Giga Science. 2019;8(6):1-17. DOI:10.1093/GIGASCIENCE/GIZ058.
13. Zuo K, Li J, Wang P, et al. Duration of Persistent Atrial Fibrillation Is Associated with Alterations in Human Gut Microbiota and Metabolic Phenotypes. mSystems. 2019;4(6). DOI:10.1128/MSYSTEMS.00422-19.
14. Sayin SI, Wahlström A, Felin J, et al. Gut Microbiota Regulates Bile Acid Metabolism by Reducing the Levels of Tauro-beta-muricholic Acid, a Naturally Occurring FXR Antagonist. Cell Metab. 2013;17(2):225-35. DOI:10.1016/J.CMET.2013.01.003.
15. Schoeler M, Caesar R. Dietary lipids, gut microbiota and lipid metabolism. Rev Endocr Metab Disord. 2019;20(4):461-72. DOI:10.1007/S11154-019-09512-0.
16. Díez-ricote L, Ruiz-Valderrey P, Micó V, et al. Trimethylamine n-Oxide (TMAO) Modulates the Expression of Cardiovascular Disease-Related microRNAs and Their Targets. Int J Mol Sci. 2021;22(20):11145. DOI:10.3390/IJMS222011145.
17. Hill C, Guarner F, Reid G, et al. The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat Rev Gastroenterol Hepatol. 2014;11(8):506-14. DOI:10.1038/nrgastro.2014.66.
18. Ивашкин В.Т., Маев И.В., Абдулганиева Д.И., и др. Практические рекомендации Научного сообщества по содействию клиническому изучению микробиома человека (НСОИМ) и Российской гастроэнтерологической ассоциации (РГА) по применению пробиотиков для лечения и профилактики заболеваний гастроэнтерологического профиля у взрослых. Российский Журнал Гастроэнтерологии, Гепатологии, Колопроктологии. 2020;30(2):76-89. DOI:10.22416/1382-4376-2020-30-2-76-89.
19. Gibson GR, Probert HM, Loo J Van, et al. Dietary modulation of the human colonic microbiota: updating the concept of prebiotics. Nutr Res Rev. 2004;17(2):259-75. DOI:10.1079/NRR200479.
20. Gibson GR, Roberfroid MB. Dietary Modulation of the Human Colonic Microbiota: Introducing the Concept of Prebiotics. J Nutr. 1995;125(6):1401-12. DOI:10.1093/JN/125.6.1401.
21. Roberfroid M. Prebiotics: The Concept Revisited. J Nutr. 2007;137(3):830S-7S. DOI:10.1093/JN/137.3.830S.
22. Niness KR. Inulin and Oligofructose: What Are They? J Nutr. 1999;129(7):1402S-6S. DOI:10.1093/JN/129.7.1402S.
23. Tomasik PJ, Tomasik P. Probiotics and Prebiotics. Cereal Chemistry. 2003;80(2):113-7. DOI:10.1094/CCHEM.2003.80.2.113.
24. Gargari BP, Dehghan P, Aliasgharzadeh A, Jafar-Abadi MA. Effects of High Performance Inulin Supplementation on Glycemic Control and Antioxidant Status in Women with Type 2 Diabetes. Diabetes Metab J. 2013;37(2):140-8. DOI:10.4093/DMJ.2013.37.2.140.
25. Miller LE, Ouwehand AC, Ibarra A. Effects of probiotic-containing products on stool frequency and intestinal transit in constipated adults: systematic review and meta-analysis of randomized controlled trials. Ann Gastroenterol. 2017;30(6):629. DOI:10.20524/AOG.2017.0192.
26. Asha MZ, Khalil SFH. Efficacy and Safety of Probiotics, Prebiotics and Synbiotics in the Treatment of Irritable Bowel Syndrome: A systematic review and meta-analysis. Sultan Qaboos Univ Med J. 2020;20(1):e13. DOI:10.18295/SQUMJ.2020.20.01.003.
27. Derwa Y, Gracie DJ, Hamlin PJ, Ford AC. Systematic review with meta-analysis: the efficacy of probiotics in inflammatory bowel disease. Aliment Pharmacol Ther. 2017;46(4):389-400. DOI:10.1111/apt.14203.
28. Ganji-Arjenaki M, Rafieian-Kopaei M. Probiotics are a good choice in remission of inflammatory bowel diseases: A meta analysis and systematic review. J Cel Physiol. 2018;233(3):2091-103. DOI:10.1002/JCP.25911.
29. Oka A, Sartor RB. Microbial-Based and Microbial-Targeted Therapies for Inflammatory Bowel Diseases. Dig Dis Sci. 2020;65(3):757-88. DOI:10.1007/S10620-020-06090-Z/FIGURES/1.
30. Naruszewicz M, Johansson ML, Zapolska-Downar D, Bukowska H. Effect of Lactobacillus plantarum 299v on cardiovascular disease risk factors in smokers. Am J Clin Nutr. 2002;76(6):1249-55. DOI:10.1093/AJCN/76.6.1249.
31. Sun J, Buys N. Effects of probiotics consumption on lowering lipids and CVD risk factors: A systematic review and meta-analysis of randomized controlled trials. Ann Med. 2015;47(6):430-40. DOI:10.3109/07853890.2015.1071872.
32. Qin J, Li Y, Cai Z, et al. A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature. 2012; 490(7418):55-60. DOI:10.1038/nature11450.
33. Ryan PM, Ross RP, Fitzgerald GF, et al. Functional food addressing heart health: Do we have to target the gut microbiota? Curr Opin Clin Nutr Metab Care. 2015;18(6):566-71. DOI:10.1097/MCO.0000000000000224.
34. Flint HJ, Scott KP, Louis P, Duncan SH. The role of the gut microbiota in nutrition and health. Nat Rev Gastroenterol Hepatol. 2012;9(10):577-89. DOI:10.1038/nrgastro.2012.156.
35. Zhu Y, Michelle Luo T, Jobin C, Young HA. Gut microbiota and probiotics in colon tumorigenesis. Cancer Lett. 2011;309(2):119-27. DOI:10.1016/J.CANLET.2011.06.004.
36. Merra G, Noce A, Marrone G, et al. Influence of Mediterranean Diet on Human Gut Microbiota. Nutrients. 2020;13(1):7. DOI:10.3390/NU13010007.
37. Di Renzo L, Cioccoloni G, Falco S, et al. Influence of FTO rs9939609 and Mediterranean diet on body composition and weight loss: A randomized clinical trial NCT01890070 NCT. J Transl Med. 2018;16(1):1-12. DOI:10.1186/S12967-018-1680-7.
38. den Besten G, Van Eunen K, Groen AK, et al. The role of short-chain fatty acids in the interplay between diet, gut microbiota, and host energy metabolism. J Lipid Res. 2013;54(9):2325-40. DOI:10.1194/JLR.R036012.
39. Galisteo M, Duarte J, Zarzuelo A. Effects of dietary fibers on disturbances clustered in the metabolic syndrome. J Nutr Biochem. 2008;19(2):71-84. DOI:10.1016/J.JNUTBIO.2007.02.009.
40. Furuta GT, Turner JR, Taylor CT, et al. Hypoxia-Inducible Factor 1–Dependent Induction of Intestinal Trefoil Factor Protects Barrier Function during Hypoxia. J Exp Med. 2001;193(9):1027-34. DOI:10.1084/JEM.193.9.1027.
41. Martin-Gallausiaux C, Marinelli L, Blottière HM, et al. SCFA: mechanisms and functional importance in the gut. Proc Nutr Soc. 2021;80(1):37-49. DOI:10.1017/S0029665120006916.
42. Slavin J. Fiber and prebiotics: mechanisms and health benefits. Nutrients. 2013;5(4):1417-35. DOI:10.3390/nu5041417.
43. Astudillo AA, Mayrovitz HN. The Gut Microbiome and Cardiovascular Disease. Cureus. 2021;13(4). DOI:10.7759/CUREUS.14519.
44. Kasahara K, Krautkramer KA, Org E, et al. Interactions between Roseburia intestinalis and diet modulate atherogenesis in a murine model. Nat Microbiol. 2018;3(12):1461-71. DOI:10.1038/s41564-018-0272-x.
45. Nogal A, Valdes AM, Menni C. The role of short-chain fatty acids in the interplay between gut microbiota and diet in cardio-metabolic health. Gut Microbes. 2021;13(1):1-24. DOI:10.1080/19490976.2021.1897212.
46. Yang T, Santisteban MM, Rodriguez V, et al. Gut microbiota dysbiosis is linked to hypertension. Hypertension. 2015;65(6):1331. DOI:10.1161/HYPERTENSIONAHA.115.05315.
47. Кашух Е.А., Полуэктова Е.А., Кудрявцева А.В., и др. Влияние рифаксимина и мультиштаммового пробиотика на кишечный микробиом и показатели сердечно-сосудистого риска у пациентов с ишемической болезнью сердца. Российский Журнал Гастроэнтерологии, Гепатологии, Колопроктологии. 2019;29(4):38-49. DOI:10.22416/1382-4376-2019-29-4-38-49.
48. Stone AFM, Mendall MA, Kaski JC, et al. Effect of Treatment for Chlamydia pneumoniae and Helicobacter pylori on Markers of Inflammation and Cardiac Events in Patients With Acute Coronary Syndromes. Circulation. 2002;106(10):1219-23. DOI:10.1161/01.CIR.0000027820.66786.CF.
49. Lam V, Su J, Koprowski S, et al. Intestinal microbiota determine severity of myocardial infarction in rats. The FASEB J. 2012;26(4):1727-35. DOI:10.1096/FJ.11-197921.
50. McCafferty K, Byrne C, Yaqoob M, et al. Intestinal Microbiota Determine Severity of Myocardial Infarction in Rats. FASEB J. 2012;26(11):4388-88. DOI:10.1096/FJ.12-1102LTR.
51. Tang TWH, Chen HC, Chen CY, et al. Loss of Gut Microbiota Alters Immune System Composition and Cripples Postinfarction Cardiac Repair. Circulation. 2019;139(5):647-59. DOI:10.1161/CIRCULATIONAHA.118.035235.
52. Hu Y, Pan Z, Huang Z, et al. Gut Microbiome-Targeted Modulations Regulate Metabolic Profiles and Alleviate Altitude-Related Cardiac Hypertrophy in Rats. Microbiol Spectr. 2022;10(1) :e0105321. DOI:10.1128/spectrum.01053-21.
53. Bartolomaeus H, Balogh A, Yakoub M, et al. Short-Chain Fatty Acid Propionate Protects From Hypertensive Cardiovascular Damage. Circulation. 2019;139(11):1407-21. DOI:10.1161/CIRCULATIONAHA.118.036652.
54. Costanza AC, Moscavitch SD, Faria Neto HCC, Mesquita ET. Probiotic therapy with Saccharomyces boulardii for heart failure patients: A randomized, double-blind, placebo-controlled pilot trial. Int J Cardiol. 2015;179:348-50. DOI:10.1016/J.IJCARD.2014.11.034.
55. Tabata T, Yamashita T, Hosomi K, et al. Gut microbial composition in patients with atrial fibrillation: effects of diet and drugs. Heart Vessels. 2021;36(1):105-14. DOI:10.1007/S00380-020-01669-Y.
56. Yu L, Meng G, Huang B, et al. A potential relationship between gut microbes and atrial fibrillation: Trimethylamine N-oxide, a gut microbe-derived metabolite, facilitates the progression of atrial fibrillation. Int J Cardiol. 2018;255:92-8. DOI:10.1016/J.IJCARD.2017.11.071.
57. Lin K, Wang X, Li J, et al. Anti-atherosclerotic effects of geraniin through the gut microbiota-dependent trimethylamine N-oxide (TMAO) pathway in mice. Phytomedicine. 2022; 101:154104. DOI:10.1016/J.PHYMED.2022.154104.
58. Lama S, Monda V, Rizzo MR, et al. Cardioprotective Effects of Taurisolo® in Cardiomyoblast H9c2 Cells under High-Glucose and Trimethylamine N-Oxide Treatment via de Novo Sphingolipid Synthesis. Oxid Med Cell Longev. 2020;2020:2961406. DOI:10.1155/2020/2961406.
59. Annunziata G, Ciampaglia R, Maisto M, et al. Taurisolo®, a grape pomace polyphenol nutraceutical reducing the levels of serum biomarkers associated with atherosclerosis. Front Cardiovasc Med. 2021;8:732. DOI:10.3389/FCVM.2021.697272/BIBTEX.
60. Lapi D, Stornaiuolo M, Sabatino L, et al. The Pomace Extract Taurisolo Protects Rat Brain From Ischemia-Reperfusion Injury. Front Cell Neurosci. 2020;14:3. DOI:10.3389/FNCEL.2020.00003/ BIBTEX.
61. Lim T, Ryu J, Lee K, et al. Protective Effects of Black Raspberry (Rubus occidentalis) Extract against Hypercholesterolemia and Hepatic Inflammation in Rats Fed High-Fat and High-Choline Diets. Nutrients. 2020;12(8):2448. DOI:10.3390/NU12082448.
62. Ziganshina EE, Sharifullina DM, Lozhkin AP, et al. Bacterial Communities Associated with Atherosclerotic Plaques from Russian Individuals with Atherosclerosis. PloS One. 2016;11(10):e0164836. DOI:10.1371/journal.pone.0164836.
63. Liu F, Fan C, Zhang L, et al. Alterations of Gut Microbiome in Tibetan Patients With Coronary Heart Disease. Front Cell Infect Microbiol. 2020;10:373. DOI:10.3389/fcimb.2020.00373.
64. Toya T, Corban MT, Marrietta E, et al. Coronary artery disease is associated with an altered gut microbiome composition. PLoS One. 2020;15(1):e0227147. DOI:10.1371/journal.pone.0227147.
65. Beale AL, O’Donnell JA, Nakai ME, et al. The Gut Microbiome of Heart Failure With Preserved Ejection Fraction. J Am Heart Assoc. 2021;10(13):e020654. DOI:10.1161/JAHA.120.020654.
66. Sun W, Du D, Fu T, et al. Alterations of the Gut Microbiota in Patients With Severe Chronic Heart Failure. Front Microbiol. 2021;12:813289. DOI:10.3389/FMICB.2021.813289.
67. Louca P, Nogal A, Wells PM, et al. Gut microbiome diversity and composition is associated with hypertension in women. J Hypertens. 2021;39(9):1810-6. DOI:10.1097/HJH.0000000000002878.
68. Zuo K, Li J, Li K, et al. Disordered gut microbiota and alterations in metabolic patterns are associated with atrial fibrillation. Giga Science. 2019;8(6):1-17. DOI:10.1093/GIGASCIENCE/GIZ058.
69. Zhang Y, Sun D, Zhao X, et al. Bacteroides fragilis prevents aging-related atrial fibrillation in rats via regulatory T cells-mediated regulation of inflammation. Pharmacol Res. 2022;177:106141. DOI:10.1016/J.PHRS.2022.106141.
Об авторах
А. В. ГорбенкоРоссия
Горбенко Александр Васильевич.
Омск
Ю. П. Скирденко
Россия
Скирденко Юлия Петровна.
Омск
К. А. Андреев
Россия
Андреев Кирилл Андреевич.
Омск
М. М. Федорин
Россия
Федорин Максим Михайлович.
Омск
Н. А. Николаев
Россия
Николаев Николай Анатольевич.
Омск
М. А. Ливзан
Россия
Ливзан Мария Анатольевна.
Омск
Рецензия
Для цитирования:
Горбенко А.В., Скирденко Ю.П., Андреев К.А., Федорин М.М., Николаев Н.А., Ливзан М.А. Кишечная микробиота и сердечно-сосудистые заболевания: механизмы влияния и возможности коррекции. Рациональная Фармакотерапия в Кардиологии. 2023;19(1):58-64. https://doi.org/10.20996/1819-6446-2023-01-03
For citation:
Gorbenko A.V., Skirdenko Y.P., Andreev K.A., Fedorin M.M., Nikolaev N.A., Livzan M.A. Microbiota and Cardiovascular Diseases: Mechanisms of Influence and Correction Possibilities. Rational Pharmacotherapy in Cardiology. 2023;19(1):58-64. (In Russ.) https://doi.org/10.20996/1819-6446-2023-01-03

















































