Перейти к:
Активность воспаления у больных c ишемической болезнью сердца и необструктивным поражением коронарных артерий
https://doi.org/10.20996/1819-6446-2023-01-09
Аннотация
Цель. Изучить уровни провоспалительных биомаркеров у пациентов с ишемической болезнью сердца (ИБС) и гемодинамически незначимыми стенозами коронарных артерий (КА), выявить возможные различия для диагностики степени обструкции коронарного русла.
Материал и методы. В обсервационное исследование были включены две группы пациентов: с необструктивной (основная группа, стеноз КА<50%; n=30) и обструктивной (группа сравнения, гемодинамически значимый стеноз КА по результатам коронарографии; n=30) ИБС. Уровни интерлейкина-1β (ИЛ-1β) и интерлейкина 6 (ИЛ-6) измеряли в плазме крови с помощью иммуноферментного анализа.
Результаты. Уровень ИЛ-6 были значимо выше у пациентов с обструктивной ИБС (p=0,006), чем у пациентов с необструктивной ИБС. Значимых различий в уровне ИЛ-1β в обеих группах выявлено не было (p=0,482). При построении ROC-кривой пороговое значение ИЛ-6 составило 26,060 пг/мл. При уровне ИЛ-6 меньше данной величины диагностировалась ИБС с гемодинамически незначимыми стенозами КА.
Заключение. Результаты данного исследования подтверждают, что у пациентов с различными вариантами поражения КА имеются различия в активности процесса воспаления в артериальной стенке. ИЛ-6 был выше в группе с обструктивным поражением, а уровни ИЛ-1β не различались между группами. Таким образом можно предположить, что гемодинамически значимая обструкция КА развивается вследствие высокоактивного воспаления сосудистой стенки. Учитывая наличие доказанной биологической основы и имеющихся данных эффективности моноклональных антител к ИЛ-1β, нельзя исключить их возможную пользу и у когорты пациентов с ИБС и гемодинамически незначимыми стенозами.
Ключевые слова
Для цитирования:
Пахтусов Н.Н., Юсупова А.О., Лишута А.С., Слепова О.A., Привалова Е.В., Беленков Ю.Н. Активность воспаления у больных c ишемической болезнью сердца и необструктивным поражением коронарных артерий. Рациональная Фармакотерапия в Кардиологии. 2023;19(1):26-33. https://doi.org/10.20996/1819-6446-2023-01-09
For citation:
Pakhtusov N.N., Yusupova A.O., Lishuta A.S., Slepova O.A., Privalova E.V., Belenkov Yu.N. Inflammatory Activity in Patients with Obstructive and Non-obstructive Coronary Artery Disease. Rational Pharmacotherapy in Cardiology. 2023;19(1):26-33. (In Russ.) https://doi.org/10.20996/1819-6446-2023-01-09
Введение
Согласно последним данным, сердечно-сосудистые заболевания, и, в частности ишемическая болезнь сердца (ИБС), являются ведущей причиной смертности населения во всем мире [1]. Несмотря на современные достижения медицины ИБС остается широко распространённым заболеванием с высокой летальностью, что требует значительных финансовых затрат со стороны государства и определяет необходимость разработки новых подходов для стратификации пациентов в зависимости от тяжести течения заболевания, определения его прогноза и подбора оптимальных методов терапии.
В настоящее время фармакологическая терапия и различные методы реваскуляризации миокарда смогли ослабить бремя сердечно-сосудистых заболеваний (ССЗ), однако, к сожалению, у определенной доли пациентов не удается предотвратить развитие сердечно-сосудистых катастроф. Одним из инновационных направлений, на которое возлагали большие надежды, является клеточная терапия и введение ростовых факторов. Хотя в различных клинических испытаниях сообщалось о многообещающих преимуществах терапии стволовыми клетками, до сих пор остается неясным точный механизм действия и мало изучены осложнения и отдаленные последствия их применения [2]. Кроме того, ограниченное приживление, низкая выживаемость, сложности мониторинга состояния стволовых клеток являются определенными препятствиями для их клинического применения [3][4]. Таким образом, в настоящее время клеточная терапия не рекомендована для лечения ССЗ и ИБС, в частности. Что касается интервенционного лечения, то эффективность оперативных вмешательств может достигать 50%, но отмечается ее резкое снижение при наличии многососудистого поражения коронарных артерий (КА). Необходимо отметить, что при стабильной ИБС чрескожное коронарное вмешательство не продемонстрировало улучшения прогноза (по данным метаанализа) [5]. Основным недостатком и лимитирующим фактором эндоваскулярных методов терапии является рестенозирование. Кроме того, проведение реваскуляризации миокарда невозможно у больных ИБС с дистальным типом поражения коронарного русла, которое часто встречается при сахарном диабете или микроваскулярной стенокардией.
Известно, что в патогенезе атеросклеротического поражения стенок артерий процессы воспаления играют существенную роль. Начальным звеном, запускающим сердечно-сосудистый континуум, является дисфункция эндотелия. На первом этапе формирования атеросклероза возникает избыточная адгезия моноцитов и их миграция в субэндотелиальный слой, где они дифференцируются в тканевые макрофаги. Поглощая модифицированные липопротеиновые частицы, эти макрофаги превращаются в пенистые клетки, из которых впоследствии формируется ядро атеросклеротической бляшки. Из активированных макрофагов высвобождаются провоспалительные цитокины, активные формы кислорода и матриксные металлопротеиназы, что приводит к усилению местного воспалительного ответа и дестабилизации атеросклеротической бляшки [6][7].
Интерлейкин-1β (ИЛ-1β) представляет собой мощный провоспалительный цитокин, имеющий решающее значение для активации защитных реакций организма в ответ на инфекции и повреждение [8]. Стимуляция гладкомышечных клеток (ГМК) и других типов клеток с помощью ИЛ-1 приводит к выработке другого цитокина, интерлейкина-6 (ИЛ-6). Генетические исследования человека подтверждают причинно-следственную связь ИЛ-6 и ИБС [9][10]. Эта пара медиаторов оказывает бесчисленное множество эффектов на защитные возможности организма и задействована в патогенезе широкого спектра заболеваний. Клинические исследования демонстрируют, что модуляция воспаления может предотвращать развитие клинических осложнений атеросклероза. Таким образом, таргетная терапия, направленная на медиаторы воспаления, может быть новым многообещающим способом профилактики прогрессирования и лечения атеросклероза, в том числе и ИБС.
Несмотря на первоначальные неоднозначные результаты исследований, использование противовоспалительных препаратов у пациентов с ИБС послужило отправной точкой для проведения дальнейших работ [11]. И, опираясь на результаты исследования CANTOS (Canakinumab Antiinflammatory Thrombosis Outcomes Study), можно рассматривать канакинумаб (моноклональное антитело к ИЛ-1β) в качестве принципиально новой группы препаратов для противовоспалительной терапии пациентов с ИБС [12].
Благодаря широкому внедрению в клиническую практику визуализирующих методов диагностики ИБС наблюдается постоянный и прогрессирующий рост пациентов с необструктивным поражением КА. Например, по результатам исследования, проведенного L. Jespersen и соавт., из 11223 пациентов со стабильной ИБС приблизительно 15% имели необструктивное поражение коронарного русла [16]. Установлено, что отсутствие гемодинамически значимых стенозов КА не означает благоприятного течения заболевания. На основании небольших исследований, в которых изучали больных с необструктивной ИБС, можно предположить наличие у них повышенного риска развития неблагоприятных сердечно-сосудистых событий [13], частой госпитализации (в 3-4 раза выше) [14] и, следовательно, более высоких медицинских затрат для данной когорты пациентов [15].
Сложности ранней диагностики ИБС, которая протекает с необструктивным поражением КА, в том числе и при интактных КА (микроваскулярная или вазоспастическая стенокардия), подбора терапии, оценки прогноза течения заболевания и предотвращения развития сердечно-сосудистых катастроф требуют проведения исследований, направленных на изучение фундаментальных аспектов патогенеза ИБС с гемодинамически незначимым поражением коронарного русла, что в будущем может послужить основой для возможного использования противоспалительной терапии и у данной категории пациентов. Изучение уровня экспрессии провоспалительных цитокинов имеет огромный потенциал для их будущего применения в клинической практике в качестве биомаркеров и терапевтических мишеней при ИБС, в том числе и для разработки таргетной персонифицированной терапии.
Цель исследования – изучить уровни провоспалительных биомаркеров у пациентов с ИБС и гемодинамически незначимыми стенозами КА, выявить возможные различия для диагностики степени обструкции коронарного русла.
Материал и методы
Обсервационное поперечное исследование проводилось в соответствии с Хельсинкской декларацией. В исследование были включены 60 пациентов с ИБС, из них 30 пациентов по данным коронароангиографии/мультиспиральной компьютерной томографии КА с внутривенным контрастированием имели гемодинамически незначимые стенозы (<50%), либо неизмененные КА, но при этом у всех пациентов была клиническая картина стенокардии и доказано с помощью инструментальных методов диагностики наличие ишемии миокарда. Другие 30 пациентов имели обструктивную ИБС и/или реваскуляризацию КА в анамнезе. Все пациенты проходили стационарное обследование и лечение в отделении кардиологии №1 Университетской клинической больницы №1 (Сеченовский Университет). Проведение исследования было одобрено локальным этическим комитетом Сеченовского Университета. Участники исследования были детально проинформированы обо всех целях и задачах исследования и методах его проведения. Критерии исключения: острый коронарный синдром, хроническая сердечная недостаточность (III-IV функциональный класс по NYHA), гемодинамически значимые пороки сердца, инсульт в течении предшествующих 6 мес, хроническая болезнь почек со скоростью клубочковой фильтрации <30 мл/мин, заболевания перикарда, аутоиммунные и онкологические заболевания, а также сахарный диабет (рис. 1).
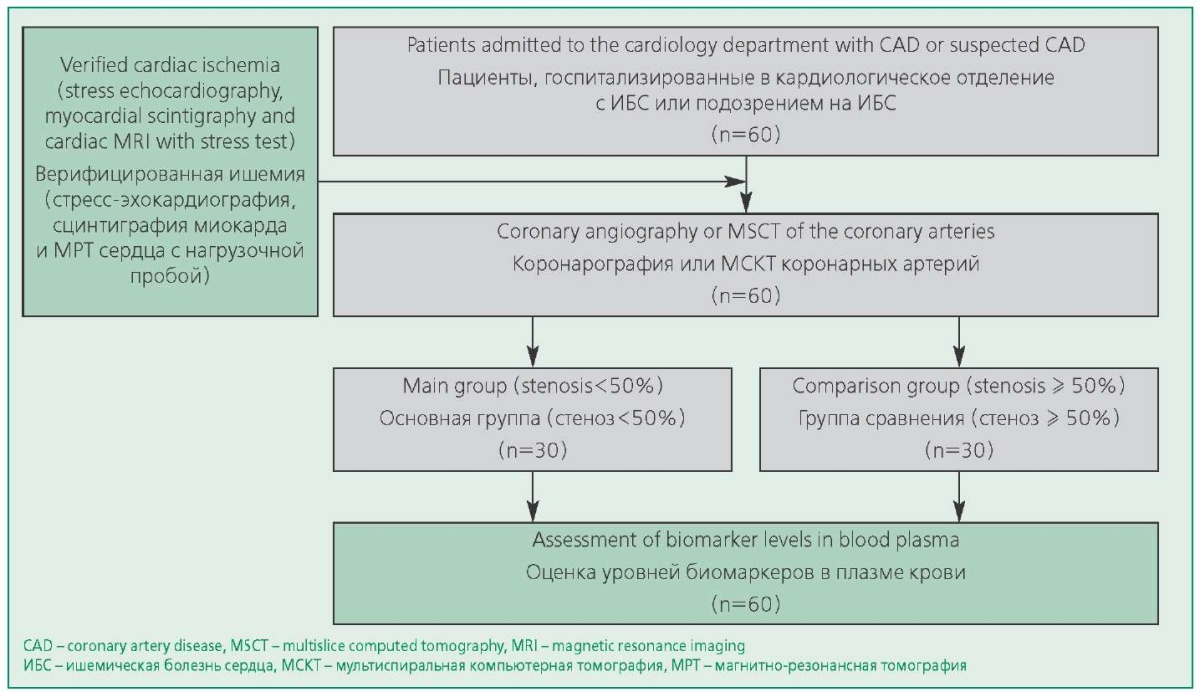
Figure 1. Study Design
Рисунок 1. Дизайн исследования
Всем участникам проводились следующие лабораторные исследования: общеклинический анализ для скринингового исключения анемии, различных гематологических патологий, острого системного воспалительного ответа (гематологический анализатор XP 300, производителя Sysmex®, Япония). Биохимический анализ крови: общий холестерин (ОХС), липопротеины низкой (ЛНП) и высокой плотности (ЛВП) определяли колориметрическим методом, с помощью реагентов «ADVIA® Chemistry Cholesterol Reagent», «ADVIA® Chemistry Direct LDL Cholesterol Reagents», «ADVIA® Chemistry Direct HDL Cholesterol Reagents»), мочевая кислота (колориметрический метод, с помощью реагента «ADVIA® Chemistry Uric Acid Reagents»), креатинин (кинетический метод (метод Яффе) с помощью реагента «ADVIA® Chemistry Creatinine Reagents»), глюкоза венозной плазмы натощак (гексокиназный метод с помощью реагента «ADVIA® Chemistry Glucose Hexokinase II Reagents»). Инструментальное обследование включало в себя суточное мониторирование ЭКГ (medilogAR®,Shiller, Швейцария), рентгеновское исследование органов грудной клетки (УнивеРС-МТ, Россия), велоэргометрию (ERG 911 S/L, Shiller, Швейцария) и КАГ (Siemens Artis Zee, Siemens Healthineers GmbH, Германия). Все диагнозы установлены на основании актуальных российских рекомендаций с учетом данных анамнеза пациентов.
Определение уровня ИЛ-1βи ИЛ-6 проводилось с использованием иммуноферментного анализа (ИФА) на ИФА анализаторе Adaltis Personal Lab (Италия) с помощью набора Enzyme-Linked Immunosorbent Assay Kit For Interleukin 1 Beta (Cloud-Clone Corp., США) и Enzyme-Linked Immunosorbent Assay Kit For Interleukin 6 (Cloud-Clone Corp., США). Коэффициент вариации (CV) у наборов составил 10% и 12% соответственно. Использовалась плазма крови после центрифугирования. Центрифугирование образцов проводилось в течение 20 мин с ЭДТА К3 в качестве антикоагулянта. Образцы были заморожены в криопробирках при температуре -80°С.
Статистический анализ проводился с использованием программы StatTech v. 3.0.6 (Статтех, Россия). Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро-Уилка (при числе исследуемых менее 50) или критерия Колмогорова-Смирнова (при числе исследуемых более 50). Показатели с ненормальным распределением подвергались логистической нормализации. Количественные показатели, имеющие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95% доверительного интервала (95% ДИ). В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1; Q3). Сравнение двух групп по количественному показателю, имеющему нормальное распределение, при условии равенства дисперсий выполнялось с помощью t-критерия Стьюдента. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна-Уитни. Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода применялся метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определялось по наивысшему значению индекса Юдена.
Используя программу G*Power ver.3.1.9.6 (Германия) [16], было рассчитано, что размер выборки при уровне значимости α=0,05 и мощности 1-β=0,8 может составить 30 человек в группе. Вводные данные (SD, mean) получены из статей в открытом доступе [17][18], в представленных публикациях похожий дизайн и исследуемая патология. После получения собственных результатов был проведен апостериорный анализ мощности.
Результаты
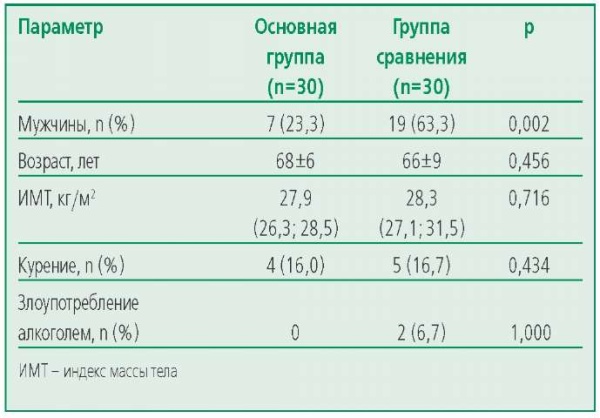
В соответствии с критериями включения в исследование были отобраны 60 пациентов, из которых 30 имели ИБС без обструктивного поражения КА (ноИБС) и составили основную группу, и 30 пациентов с обструктивным типом поражения коронарного русла (группа сравнения). Обе группы пациентов были полностью сопоставимы по ведущим клиническим и демографическим показателям: возрасту, индекс массы тела (ИМТ), площади поверхности тела, статусу курения. Необходимо отметить, что в основной группе преобладали женщины (табл. 1).
Table 1. Demographic characteristics of patients
Таблица 1. Демографическая характеристика пациентов
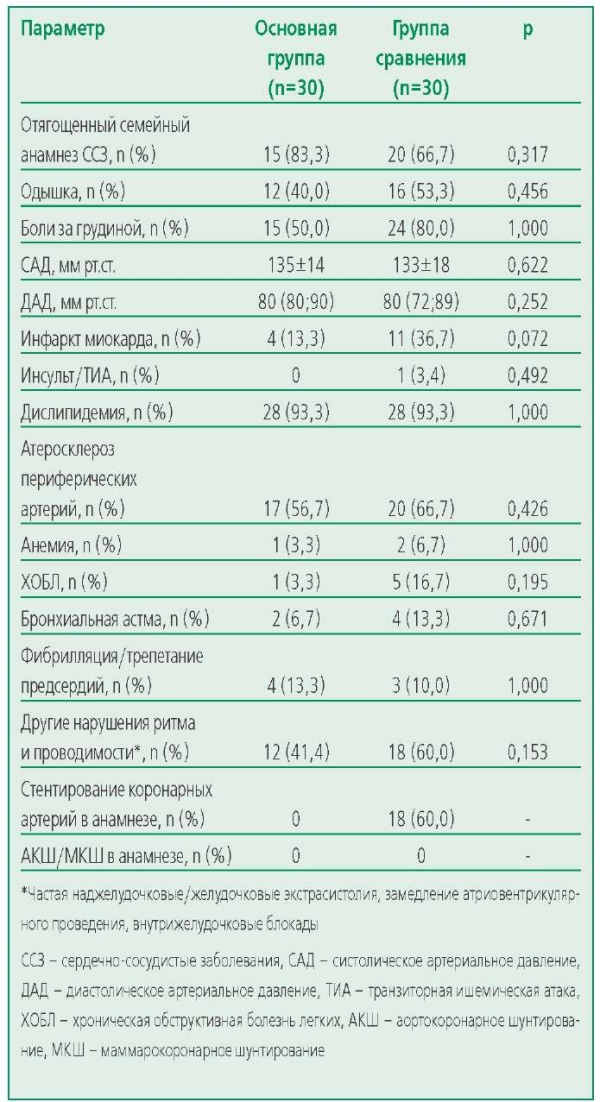
Пациенты обеих групп также были сопоставимы по таким клиническим характеристикам, как частота жалоб на одышку, боли в области сердца и по наличию другой (кроме ИБС) кардиологической патологии и сопутствующих заболеваний (табл. 2).
Table 2. Clinical characteristics of patients
Таблица 2. Клиническая характеристика пациентов
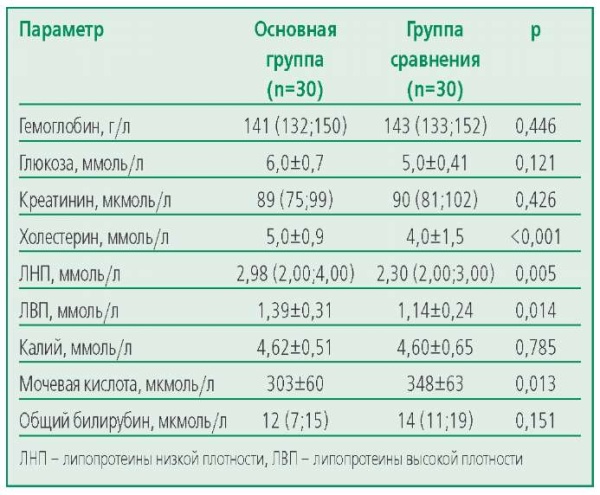
Проведена сравнительная оценка стандартных лабораторных параметров в обеих группах. По данным лабораторного обследования, у больных различались показатели липидограммы (ОХС, ЛНП, ЛВП). Выявлено, что у пациентов с ноИБС уровень общего холестерина, ЛНП, ЛВП был значимо выше (р<0,001), что можно объяснить назначением более высоких доз статинов и, следовательно, лучшим контролем показателей липидного спектра у пациентов с гемодинамически значимыми стенозами. Уровень мочевой кислоты был выше в группе с обструктивной ИБС (р=0,013). Других статистически значимых различий по клинико-лабораторным показателям выявлено не было (табл. 3).
Table 3. Laboratory parameters of patients of the studied groups
Таблица 3. Лабораторные показатели пациентов изучаемых групп
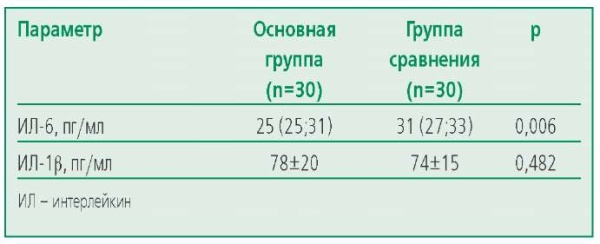
При оценке уровня ИЛ-6 обнаружены статистически значимые различия в его уровне между изучаемыми группами (табл. 4). При сравнении уровней ИЛ-1β не удалось выявить статистически значимых различий между группами.
Table 4. Levels of interleukins 6 and 1β in patients of the studied groups
Таблица 4. Уровни интерлейкинов 6 и 1β у пациентов изучаемых групп
Для оценки диагностической возможности уровня ИЛ-6 была построена ROC-кривая (рис. 2).
Площадь под ROC-кривой составила 0,706 ± 0,067 с 95% ДИ: 0,574–0,837. Полученная модель была статистически значимой (p=0,006).
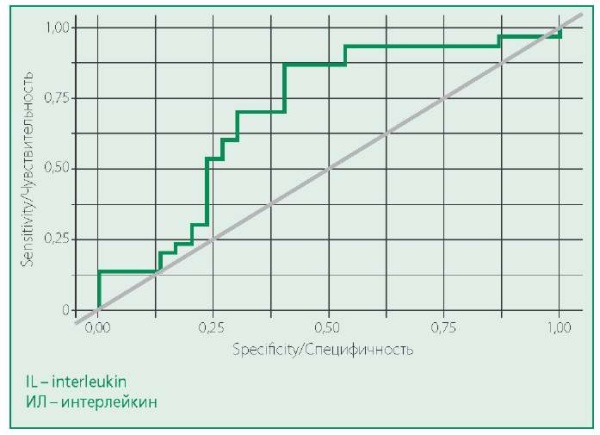
Figure 2. ROC-curve characterizing probability of having an obstructive lesion from the level of IL-6 in patients with verified coronary artery disease
Рисунок 2. ROC-кривая, характеризующая зависимость вероятности обструктивной ИБС от уровня ИЛ-6
Пороговое значение показателя ИЛ-6 в точке cutoff, которому соответствовало наивысшее значение индекса Юдена, составило 26,06 пг/мл. При уровне ИЛ-6 выше данной величины диагностировалась ИБС с гемодинамически значимыми стенозами КА. Чувствительность и специфичность модели составили 86,7% и 60,0%, соответственно (рис. 3).
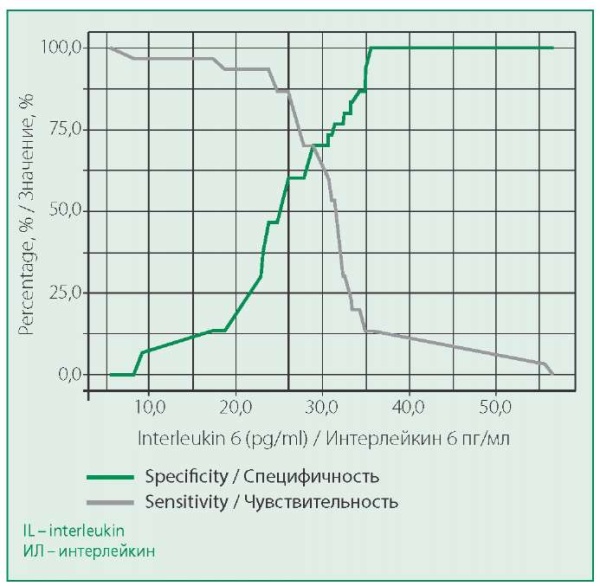
Figure 3. Sensitivity and specificity analysis of the model depending on the threshold values of IL-6
Рисунок 3. Анализ чувствительности и специфичности модели в зависимости от пороговых значений ИЛ-6
Обсуждение
Понимание природы ИБС, ее патогенетических механизмов постоянно меняется с развитием новых диагностических методик и проведением фундаментальных исследований [19]. Растущее число пациентов, страдающих стенокардией, но при этом не имеющих гемодинамически значимых стенозов КА, привело к постепенному признанию того, что при диагностике и лечении пациентов с ИБС следует учитывать наличие аномалии всего коронарного кровообращения, включая микроциркуляцию. В настоящее время имеются убедительные экспериментальные, клинические и эпидемиологические доказательства тесной связи между воспалением, атеросклерозом и сердечно-сосудистыми исходами сердечно-сосудистых заболеваний [20]. Так, например, недавно описана взаимосвязь острых инфекций и инфаркта миокарда [21]. Риск инфаркта миокарда оставался постоянным вне зависимости от этиологических факторов и места заражения инфекционными заболеваниями. Исходя из этого возможно предположить, что системная воспалительная реакция является основным связующим звеном этой цепи.
Повышенная активность воспаления в атероматозных бляшках может быть возможным патогенетическим механизмом развития значимых стенозов КА у пациентов с ИБС. Открытие антител протеинконвертазы субтилизин-кексина типа 9 (PCSK9) доказало, что экстремально низкие уровни холестерина ЛНП достижимы, однако, при дальнейшем исследовании сердечно-сосудистых исходов с использованием ингибиторов PCSK9 (FOURIER) [22] выяснилось, что несмотря на целевые уровни ЛНП у значительного числа пациентов повторялись сердечно-сосудистые события или прогрессировал атеросклероз КА по данным внутрисосудистого ультразвукового исследования. Таким образом, можно сделать вывод, что существует дополнительный механизм в патогенезе ИБС, который может способствовать развитию неблагоприятных исходов.
Одним из интерлейкинов, изученным в данной работе, является ИЛ-6, который был выбран не случайно. Доказана роль данного цитокина как одного из звеньев в биологической основе патогенеза ИБС [23][24]. По данным систематического обзора и мета-анализа [25], а также исследования STABILITY (Stabilization of Atherosclerotic Plaque by Initiation of Darapladib Therapy) Trial [26], уровень данного провоспалительного цитокина связан с неблагоприятными сердечно-сосудистыми событиями. В другом систематическом обзоре и метаанализе было показано, что мутация ИЛ-6-174 G/C ассоциирована с повышенными уровнями ИЛ-6 и наличием ИБС [27]. По нашим данным уровень ИЛ-6 был выше в группе с гемодинамически значимыми стенозами, в отличие от пациентов с необструктивным поражением КА. Mohammad-Rezae M. и соавт. в своей работе сравнили уровни ИЛ-6, ИЛ-32 и фактора некроза опухоли α (ФНО-α) у пациентов ноИБС и ИБС. По их результатам уровни данных провоспалительных цитокинов и ЛНП могут быть предикторами возникновения обструктивной ИБС [28].
Сигнальный путь ИЛ-1 представляет собой основную цель для иммунной модуляции, потому что активность ИЛ-1β не ограничивается врожденными иммунными клетками, но является неотъемлемым компонентом адаптивных ответов организма [8]. В представленной работе был оценен уровень ИЛ-1β в группах с обструктивным и необструктивным поражением КА. Хотя статистически значимых различий между группами выявлено не было, можно предположить, что полученные результаты будет служить обоснованием для возможного использования антител к ИЛ-1β и у пациентов с ноИБС. В исследовании S. Enayati и соавт. оценивалась экспрессия гена ИЛ-1β у пациентов с обструктивным и необструктивным поражением КА. В данной работе были выявлены значимые различия в экспрессии гена ИЛ-1β между группами, однако уровни ФНО-α и интерферона γ не различались.Тяжесть клинической симптоматики у пациентов с гемодинамически незначимыми стенозами зависела от активности воспаления [29]. В целом, исследование CANTOS [12] изменило отношение к воспалению в кардиологии: теперь стало совершенно ясно, что воспаление больше нельзя рассматривать просто как сопутствующий ответ на повреждение тканей. Перспективным представляется развитие новой стратегии лечения ИБС для дальнейшего снижения риска сердечно-сосудистых осложнений.
Ограничения исследования. К ограничивающим факторам данного исследования следует выделить небольшой размер исследуемых групп и отсутствие группы контроля из здоровых добровольцев для определения референсных уровней провоспалительных цитокинов.
Заключение
Результаты данного исследования подтверждают наличие активного воспаления в стенке артерий у пациентов с ИБС и различными типами поражения коронарного русла. Учитывая наличие доказанной биологической основы и имеющихся данных эффективности моноклональных антител к ИЛ-1β, нельзя исключить их возможную пользу и у когорты пациентов с ИБС и гемодинамически незначимыми стенозами. Механизм влияния противовоспалительной терапии и возможности неинвазивной диагностики должен быть детально изучен.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование. Исследование выполнено при финансовой поддержке Российского научного фонда в виде научного проекта № 22-15-00424, научного гранта «Роль активации сигнального каскада WNT, процессов его эпигенетической регуляции и иммуноопосредованного воспаления в прогрессировании атеросклероза и возможности влияния на него методом терапевтического неоангиогенеза у пациентов со стабильной ишемической болезнью сердца».
Funding. The study was financially supported by the Russian Science Foundation in the form of scientific project No. 22-15-00424, scientific grant "The role of activation of the WNT signaling cascade, the processes of its epigenetic regulation and immune-mediated inflammation in the progression of atherosclerosis and the possibility of influencing it by therapeutic neoangiogenesis in patients with stable ischemic heart disease".
Список литературы
1. Tsao CW, Aday AW, Almarzooq ZI, et al. Heart Disease and Stroke Statistics-2022 Update: A Report From the American Heart Association. Circulation. 2022;145(8):e153-e639. DOI:10.1161/CIR.0000000000001052.
2. Payab M, Abedi M, Foroughi Heravani N et al. Brown adipose tissue transplantation as a novel alternative to obesity treatment: a systematic review. Int J Obes (London). 2021;45(1):109-21. DOI:10.1038/s41366-020-0616-5.
3. Liu C, Han D, Liang P, Li Y, Cao F. The Current Dilemma and Breakthrough of Stem Cell Therapy in Ischemic Heart Disease. Front Cell Dev Biol. 2021;9:636136. DOI:10.3389/fcell.2021.636136.
4. Müller P, Lemcke H, David R. Stem Cell Therapy in Heart Diseases - Cell Types, Mechanisms and Improvement Strategies. Cell Physiol Biochem. 2018;48(6):2607-55. DOI:10.1159/000492704.
5. Chacko L, P Howard J, Rajkumar C, et al. Effects of Percutaneous Coronary Intervention on Death and Myocardial Infarction Stratified by Stable and Unstable Coronary Artery Disease: A Meta-Analysis of Randomized Controlled Trials. Circ Cardiovasc Qual Outcomes. 2020;13(2):e006363. DOI:10.1161/CIRCOUTCOMES.119.006363.
6. Soehnlein O, Libby P. Targeting inflammation in atherosclerosis - from experimental insights to the clinic. Nat Rev Drug Discov. 2021;20(8):589-610. DOI:10.1038/s41573-021-00198-1.
7. Cochain C, Zernecke A. Macrophages in vascular inflammation and atherosclerosis. Pflugers Arch. 2017;469(3-4):485-99. DOI:10.1007/s00424-017-1941-y.
8. Dinarello CA. Biologic basis for interleukin-1 in disease. Blood. 1996;87(6):2095-147. PMID:8630372.
9. IL6R Genetics Consortium Emerging Risk Factors Collaboration; Sarwar N, Butterworth AS, Freitag DFet al. Interleukin-6 receptor pathways in coronary heart disease: a collaborative meta-analysis of 82 studies. Lancet. 2012;379(9822):1205-13. DOI:10.1016/S0140-6736(11)61931-4.
10. Interleukin-6 Receptor Mendelian Randomisation Analysis (IL6R MR) Consortium; Swerdlow DI, Holmes MV, Kuchenbaecker KB, et al. The interleukin-6 receptor as a target for prevention of coronary heart disease: a mendelian randomisation analysis. Lancet. 2012;379(9822):1214-24. DOI:10.1016/S0140-6736(12)60110-X.
11. Nidorf SM, Eikelboom JW, Budgeon CA, Thompson PL. Low-dose colchicine for secondary prevention of cardiovascular disease. J Am Coll Cardiol. 2013;61(4):404-10. DOI:10.1016/j.jacc.2012.10.027.
12. Ridker PM, Everett BM, Thuren T, et al. CANTOS Trial Group. Antiinflammatory Therapy with Canakinumab for Atherosclerotic Disease. N Engl J Med. 2017;377(12):1119-31. DOI:10.1056/NEJMoa1707914.
13. Radico F, Zimarino M, Fulgenzi F, et al. Determinants of long-term clinical outcomes in patients with angina but without obstructive coronary artery disease: a systematic review and meta-analysis. Eur Heart J. 2018;39(23):2135-46. DOI 10.1093/eurheartj/ehy185.
14. Jespersen L, Abildstrom SZ, Hvelplund A, et al. Burden of hospital admission and repeat angiography in angina pectoris patients with and without coronary artery disease: a registry-based cohort study. PLoS One. 2014;9(4):e93170. DOI:10.1371/journal.pone.0093170.
15. Shaw LJ, Merz CN, Pepine CJ, et al.; Women's Ischemia Syndrome Evaluation (WISE) Investigators. The economic burden of angina in women with suspected ischemic heart disease: results from the National Institutes of Health--National Heart, Lung, and Blood Institute--sponsored Women's Ischemia Syndrome Evaluation. Circulation. 2006;114(9):894-904. DOI:10.1161/CIRCULATIONAHA.105.609990.
16. Faul F, Erdfelder E, Buchner A, Lang AG. Statistical power analyses using G*Power 3.1: tests for correlation and regression analyses. Behav Res Methods. 2009;41(4):1149-60. DOI:10.3758/BRM.41.4.1149.
17. Mohammad-Rezaei M, Ahmadi R, Rafiei A, et al. Serum levels of IL-32 in patients with coronary artery disease and its relationship with the serum levels of IL-6 and TNF-α. Mol Biol Rep. 2021;48(5):4263-71. DOI:10.1007/s11033-021-06441-7.
18. Ma W, Shen D, Liu J, et al. Statin Function as an Anti-inflammation Therapy for Depression in Patients With Coronary Artery Disease by Downregulating Interleukin-1β. J Cardiovasc Pharmacol. 2016;67(2):129-35. DOI:10.1097/FJC.0000000000000323.
19. Benjamin EJ, Muntner P, Alonso A, Virani SS, et al.; American Heart Association Council on Epidemiology and Prevention Statistics Committee and Stroke Statistics Subcommittee. Heart Disease and Stroke Statistics-2019 Update: A Report From the American Heart Association. Circulation. 2019;139(10):e56-e528. DOI:10.1161/CIR.0000000000000659.
20. Koenig W. Inflammation Revisited: Atherosclerosis in The Post-CANTOS Era. Eur Cardiol. 2017;12(2):89-91. DOI:10.15420/ecr.2017:18:1.
21. Musher DM, Abers MS, Corrales-Medina VF. Acute Infection and Myocardial Infarction. N Engl J Med. 2019;380(2):171-6. DOI:10.1056/NEJMra1808137.
22. Sabatine MS, Giugliano RP, Keech AC, et al.; FOURIER Steering Committee and Investigators. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med. 2017;376(18):1713-22. DOI:10.1056/NEJMoa1615664.
23. Schuett H, Luchtefeld M, Grothusen C, et al. How much is too much? Interleukin-6 and its signalling in atherosclerosis. Thromb Haemost. 2009;102(2):215-22. DOI:10.1160/TH09-05-0297.
24. Schieffer B, Selle T, Hilfiker A, et al. Impact of interleukin-6 on plaque development and morphology in experimental atherosclerosis. Circulation. 2004;110(22):3493-500. DOI:10.1161/01.CIR.0000148135.08582.97.
25. Niu W, Liu Y, Qi Y, et al. Association of interleukin-6 circulating levels with coronary artery disease: a meta-analysis implementing mendelian randomization approach. Int J Cardiol. 2012;157(2):243-52. DOI:10.1016/j.ijcard.2011.12.098.
26. Held C, White HD, Stewart RAH, et al.; STABILITY Investigators. Inflammatory Biomarkers Interleukin-6 and C-Reactive Protein and Outcomes in Stable Coronary Heart Disease: Experiences From the STABILITY (Stabilization of Atherosclerotic Plaque by Initiation of Darapladib Therapy) Trial. J Am Heart Assoc. 2017;6(10):e005077. DOI:10.1161/JAHA.116.005077.
27. Rai H, Colleran R, Cassese S, et al. Association of interleukin 6 -174 G/C polymorphism with coronary artery disease and circulating IL-6 levels: a systematic review and meta-analysis. Inflamm Res. 2021;70(10-12):1075-87. DOI:10.1007/s00011-021-01505-7.
28. Mohammad-Rezaei M, Ahmadi R, Rafiei A, et al. Serum levels of IL-32 in patients with coronary artery disease and its relationship with the serum levels of IL-6 and TNF-α. Mol Biol Rep. 2021;48(5):4263-71. DOI:10.1007/s11033-021-06441-7.
29. Enayati S, Seifirad S, Amiri P, et al. Interleukin-1 beta, interferon-gamma, and tumor necrosis factor-alpha gene expression in peripheral blood mononuclear cells of patients with coronary artery disease. ARYA Atheroscler. 2015;11(5):267-74.
Об авторах
Н. Н. ПахтусовРоссия
Пахтусов Николай Николаевич.
Москва
А. О. Юсупова
Россия
Юсупова Альфия Оскаровна.
Москва
А. С. Лишута
Россия
Лишута Алексей Сергеевич.
Москва
О. A. Слепова
Россия
Слепова Ольга Александровна.
Москва
Е. В. Привалова
Россия
Привалова Елена Витальевна.
Москва
Ю. Н. Беленков
Россия
Беленков Юрий Никитич.
Москва
Рецензия
Для цитирования:
Пахтусов Н.Н., Юсупова А.О., Лишута А.С., Слепова О.A., Привалова Е.В., Беленков Ю.Н. Активность воспаления у больных c ишемической болезнью сердца и необструктивным поражением коронарных артерий. Рациональная Фармакотерапия в Кардиологии. 2023;19(1):26-33. https://doi.org/10.20996/1819-6446-2023-01-09
For citation:
Pakhtusov N.N., Yusupova A.O., Lishuta A.S., Slepova O.A., Privalova E.V., Belenkov Yu.N. Inflammatory Activity in Patients with Obstructive and Non-obstructive Coronary Artery Disease. Rational Pharmacotherapy in Cardiology. 2023;19(1):26-33. (In Russ.) https://doi.org/10.20996/1819-6446-2023-01-09

















































