Перейти к:
Особенности течения хронической сердечной недостаточности у пациентов с фибрилляцией предсердий: роль эндоваскулярной изоляции ушка левого предсердия
https://doi.org/10.20996/1819-6446-2023-2934
EDN: NKPQMO
Аннотация
Цель: оценка связи эндоваскулярной изоляции УЛП с течением ХСН у пациентов с ФП в отдаленном периоде.
Материалы и методы: в проспективное когортное исследование включались пациенты с ФП, ХСН и высоким риском тромбоэмболических осложнений, части из которых была выполнена имплантация окклюдера УЛП, остальным – проводилась стандартная профилактика кардиоэмболических осложнений. Сравнение частоты конечных точек неблагоприятного течения ХСН (декомпенсации ХСН, госпитализации, связанные с ХСН, увеличение функциональный класс ХСН) проводилось методом регрессионного анализа с помощью критерия log-rank. Для выявления независимых предикторов достижения конечных точек проводился однофакторный анализ методом регрессии Кокса с вовлечением всех клинико-анамнестических факторов. Далее проводился многофакторный анализ, отбор предикторов в котором проводился методом исключения Вальда из тех факторов, для которых значение р в однофакторном анализе было менее 0,2. Каждый из факторов был статистически значимым независимым предиктором конечной точки, общая значимость модели составила р <0,001
Результаты. В исследование были включены 139 пациентов (55 пациентов в группу окклюдера, 84 — в группу контроля), период наблюдения составил 3 года. Преимущественно у пациентов в исследовании была диагностирована ХСН с сохранной фракцией выброса левого желудочка (93,5% случаев) I-III функционального класса. В обеих группах за время наблюдения уровень BNP статистически значимо увеличился. Несмотря на наличие исходных различий между группами, через 1-3 года после начала исследования различий между группами не отмечалось, что может свидетельствовать о тенденции к меньшему росту уровня BNP в группе окклюдера. Частота достижения всех конечных точек была сходной в обеих группах, статистически значимых различий выявлено не было. При многофакторном анализе были выявлены статистически значимые предикторы декомпенсации ХСН в исследуемой когорте: объём левого предсердия, уровень BNP, функционального класса ХСН.
Заключение. Не было выявлено негативного влияния эндоваскулярной окклюзии УЛП на течение ХСН у пациентов с ФП. Кроме того, был выявлен ряд предикторов декомпенсации ХСН в данной когорте пациентов.
Ключевые слова
Для цитирования:
Певзнер Д.В., Кострица Н.С., Меркулова И.А., Дорогун О.Б., Комаров А.Л., Явелов И.С. Особенности течения хронической сердечной недостаточности у пациентов с фибрилляцией предсердий: роль эндоваскулярной изоляции ушка левого предсердия. Рациональная Фармакотерапия в Кардиологии. 2023;19(4):350-358. https://doi.org/10.20996/1819-6446-2023-2934. EDN: NKPQMO
For citation:
Pevzner D.V., Kostritca N.S., Merkulova I.A., Dorogun O.B., Komarov A.L., Yavelov I.S. Clinical features of heart failure in patients with atrial fibrillation: the role of the endovascular left atrial appendage closure. Rational Pharmacotherapy in Cardiology. 2023;19(4):350-358. (In Russ.) https://doi.org/10.20996/1819-6446-2023-2934. EDN: NKPQMO
Введение
Фибрилляция предсердий (ФП) — самое распространенное нарушение ритма сердца как в популяции, так и среди пациентов с хронической сердечной недостаточностью (ХСН) [1]. В когорте больных ХСН частота встречаемости данной аритмии возрастает с 4,2% у больных с I функциональным классом (ФК) по классификации NYHA (New York Heart Association) до 49,8% с IV ФК по классификации NYHA [2].
Частое сочетание этих заболеваний объясняется общими факторами риска и взаимосвязанными патофизиологическими процессами [3]. Так, ХСН увеличивает риск возникновения ФП ввиду повышения давления и растяжения камер предсердий, а также развития фиброза. Ремоделирование миокарда приводит к развитию нарушений проводимости и возникновению триггерной активности. ФП способствует развитию или усугублению течения ХСН из-за снижения сердечного выброса вследствие нерегулярного ритма с потерей адекватной систолы предсердий и высокой частоты сокращений желудочков [3].
Кроме того, в исследовании A. M. Chamberlain и соавт. было продемонстрировано, что присоединение ФП к ранее имеющейся ХСН увеличивает риск смерти примерно в 2 раза, а риск смерти при развитии ХСН de novo на фоне ФП увеличивается на 29% [4].
Согласно действующим клиническим рекомендациям, для профилактики кардиоэмболических осложнений и снижения риска смерти пациентам с ФП показано применение антикоагулянтной терапии антагонистами витамина К или прямыми оральными антикоагулянтами (ПОАК). В качестве альтернативной стратегии при наличии абсолютных противопоказаний или отказе пациентов от приема антикоагулянтов может применяться эндоваскулярная изоляция ушка левого предсердия (УЛП) с использованием окклюзирующих устройств [5]. Данная методика в настоящий момент успешно применяется в том числе у пациентов с ФП и ХСН. Однако УЛП является важным образованием, участвующим в регуляции гомеостаза путем выработки мозговых натрийуретических пептидов (BNP). В литературе влияние изоляции УЛП на их выработку и течение сердечной недостаточности изучено мало, а недостатки существующих исследований — малые объемы выборки и недостаточная длительность наблюдения [6].
Таким образом, цель нашего исследования — оценка связи имплантации окклюдера УЛП с течением ХСН у пациентов с ФП в отдаленном периоде.
Материал и методы
В проспективное одноцентровое когортное исследование с 2011 по 2018 годы было включено 139 пациентов с неклапанной формой ФП, высоким риском кардиоэмболических осложнений по шкале CHA2DS2-VASc и ХСН. Критериями невключения в исследование были возраст младше 18 лет и наличие тромбоза УЛП.
Диагноз ХСН был установлен при поступлении и ретроспективно уточнялся в соответствии с клиническими рекомендациями Европейского кардиологического общества 2021 года: сочетание симптомов и/или признаков сердечной недостаточности с объективным доказательством наличия кардиальной дисфункции (эхокардиографические критерии и уровень BNP > 35 пг/мл) [6]. Лечение ХСН проводилось согласно рекомендациям, актуальным на момент включения пациентов в исследование. Пациенты были разделены на две группы: в первой (группа окклюдера, n=55) с целью профилактики кардиоэмболических осложнений была выполнена эндоваскулярная изоляция УЛП; во второй (группа контроля, n=84) установка окклюдера УЛП не выполнялась, а в качестве профилактики кардиоэмболических осложнений пациенты получали терапию ПОАК (n=35) или варфарином (n=36). Часть пациентов (n=13) группы контроля не получала профилактику кардиоэмболических осложнений в связи с наличием абсолютных противопоказаний и отказом от имплантации окклюдера УЛП. Абсолютными противопоказаниями к антикоагулянтной терапии были следующие: активные крупные кровотечения, сопутствующие заболевания, сопровождающиеся высоким риском кровотечений (например, тромбоцитопения <50*10^9/л, тяжелая анемия <70 г/л на этапе обследования), или недавние кровотечения высокого риска (например, внутричерепное кровотечение), а также скорость клубочковой фильтрации менее 15 мл/мин/1,73м2. Выбор тактики лечения определялся лечащим врачом с учетом мнения пациента. В ряде случаев выбор в пользу установки окклюдера УЛП осуществлялся в связи с наличием абсолютных противовопоказаний к антикоагулянтной терапии при наличии высокого риска кардиоэмболический осложнений, в ряде случаев — в связи с наличием относительных противопоказаний и отказом пациента от длительной антикоагулянтной терапии. В случае проведения эндоваскулярной окклюзии УЛП использовались окклюзирующие устройства Watchman (Boston Scientific, США) или Amplatzer Amulet (St Jude Medical, США).
Период наблюдения составил 3 года. Для оценки влияния имплантации окклюдера УЛП на течение ХСН оценивались следующие конечные точки:
- частота декомпенсации ХСН,
- частота госпитализации, связанной с декомпенсацией ХСН,
- прогрессирование ХСН в виде увеличения ФК по классификации NYHA.
Также оценивалась динамика уровня BNP во всех контрольных точках и изменение фракции выброса левого желудочка (ФВ ЛЖ) через 3 года после начала исследования. С целью общей характеристики эндоваскулярной изоляции УЛП у пациентов с ХСН регистрировались также такие показатели, как технический и процедурный успех вмешательства, летальность и частота кардиоэмболических событий за 3 года наблюдения. Под техническим успехом подразумевалось сочетание изоляции УЛП, отсутствия осложнений, связанных с устройством, отсутствия параокклюдерного потока более 5 мм по результатам цветового допплеровского исследования, под процедурным — сочетание технического успеха с отсутствием осложнений, связанных с процедурой.
Всем пациентам в момент включения в исследование проводилось стандартное обследование, включавшее исследования для диагностики и определения тяжести ХСН: эхокардиография (ЭхоКГ), определение уровня мозгового натрийуретического пептида (BNP), а также оценку стандартных факторов риска сердечно-сосудистых осложнений. Все конечные точки регистрировались на следующих визитах: 45 дней, 6 месяцев, 1 год, 2 года и 3 года от момента включения в исследование, а также при внеплановых госпитализациях. Декомпенсация ХСН определялась, как внезапное нарастание или возникновение одышки, сопровождавшееся признаками застоя крови по большому и/или малому кругу кровообращения (повышение центрального венозного давления, признаки отёка лёгких и/или нарастания периферических отёков). Любая госпитализация в связи с данными симптомами регистрировалась, как связанная с декомпенсацией ХСН. Прогрессирование ХСН регистрировалось при увеличении значения ФК по классификации NYHA хотя бы на одно значение при плановом осмотре или при госпитализации по поводу ХСН.
Статистический анализ проводился с применением статистической программы SPSS Statistics 26 (IBM, США). Проверка на нормальность распределения количественных показателей проводилась методом Колмогорова-Смирнова с поправкой Лиллиефорса при n>50 или методом Шапиро-Уилка при n<50. Сравнение непараметрических количественных переменных между группах проводилось согласно критерию Манна-Уитни. Сравнение дискретных переменных проводилось применением точного критерия Фишера или теста χ2 Пирсона с поправкой на непрерывность. Сравнение зависимых количественных переменных проводилось при помощи критерия Уилкоксона.
Для оценки различий между группой окклюдера и группой контроля в отношении вероятности достижения конечных точек, отражающих неблагоприятное течение ХСН, применялся критерий log-rank Мантеля-Кокса. Для выявления независимых предикторов достижения конечных точек неблагоприятного течения ХСН у пациентов с ФП применялся анализ методом регрессии Кокса. Предварительно был выполнен однофакторный анализ с вовлечением всех клинико-анамнестических факторов. Факторы, значимость ассоциации которых с исходом составила p≤0,2, были протестированы в многофакторной регрессионном модели, выполненной методом исключения Вальда. Статистически значимыми считали различия при значениях двустороннего р<0,05.
Результаты
Общая клинико-анамнестическая характеристика пациентов в зависимости от способа профилактики кардиоэмболических осложнений (группа окклюдера УЛП и группа контроля) представлена в табл. 1. В группе окклюдера успех имплантации устройства был достигнут у 100% пациентов, технический успех — у 98,2% пациентов, процедурный успех — у 90,9% пациентов. Наличие осложнений, связанных с процедурой (преимущественно малые кровотечения), не повлияло на дальнейшую тактику ведения пациентов. В течение 3 лет наблюдения общая летальность в группе окклюдера составила 10,9%, в группе контроля — 25,0%. Частота кардиоэмболических осложнений за 3 года составила 5,4% в группе окклюдера и 7,1% в группе контроля.
При анализе исходных клинико-анамнестических характеристик группа окклюдера и группа контроля были сопоставимы по большинству параметров. Тем не менее, обращает на себя внимание наличие статистически значимых различий между группами по ряду таких потенциальных факторов риска прогрессирования ХСН, как возраст и непароксизмальная форма ФП. При этом пациенты группы окклюдера оказались моложе, чем в группе контроля, но непароксизмальная форма ФП в группе окклюдера регистрировалась чаще. Также следует отметить, что в группе окклюдера исходный уровень BNP был значимо выше несмотря на то, что в группе контроля большая доля пациентов имела III ФК ХСН по NYHA. Пациентов с исходным IV ФК в исследовании не было. Большинство пациентов обеих групп получали терапию ингибиторами ангиотензин-превращающего фермента или антагонистами рецепторов ангиотензина, при этом в группе окклюдера большая часть пациентов получала бета-блокаторы на момент выписки из стационара по сравнению с пациентами, которым не проводилась эндоваскулярная окклюзия УЛП.
У большинства пациентов обеих групп на момент включения в исследование диагностировалась ХСН с сохранной или промежуточной фракцией выброса. В группе окклюдера отмечался больший объём ЛП. Более детальный анализ исходных эхокардиографических данных представлен в табл. 2.
Для того, чтобы определить влияние имплантации окклюдера УЛП на частоту конечных точек, отражающих неблагоприятное течение ХСН (кумулятивная частота декомпенсации ХСН, госпитализаций по поводу ХСН, повышения ФК по NYHA), был проведен анализ методом log-rank критерия Мантеля-Кокса. При этом частота достижения всех конечных точек была сходной в обеих группах, статистически значимых различий выявлено не было (рис. 1), значение р>0,05. Кумулятивная частота декомпенсации ХСН за 3 года наблюдения составила 15,2 на 100 пациенто-лет (27%) в группе окклюдера и 16,9 на 100 пациенто-лет (35%) в группе контроля. Кумулятивная частота госпитализаций по поводу ХСН и повышения ФК составила 13,2 и 20 на 100 пациенто-лет соответственно для группы окклюдера и 13,1 и 24 на 100 пациенто-лет для группы контроля.
Помимо описанных выше конечных точек, оценивалась динамика уровня BNP и изменение ФВЛЖ в группе окклюдера и группе контроля. При анализе динамики уровня BNP обращает на себя внимание однонаправленное изменение концентрации данного маркера у пациентов обеих групп: статистически значимое снижение в начале наблюдения (р<0,001 по критерию Уилкоксона в обеих группах) с последующим повышением (рис. 2). При этом следует отметить, что если при включении в исследование уровень BNP в группе окклюдера был значимо выше (352,5 [ 193,9;569,1] против 164,5 [ 123,8;307,8], p<0,001), то в дальнейшем данные различия были нивелированы и уже через год после начала исследования уровень BNP был сопоставим в обеих группах (367,2 [ 247,4;611,5] в группе окклюдера против 354,1 [ 260,0;466,2] в группе контроля, р=0,294). Отсутствие статистически значимых различий по данному показателю было зарегистрировано также через 2 и через 3 года наблюдения (р=0,988 и 0,677 соответственно). Таким образом, можно говорить о тенденции к менее выраженному росту уровня BNP в группе окклюдера по сравнению с группой контроля.
При анализе ФВЛЖ не было получено статистически значимых различий как между группой окклюдера и группой контроля в начале наблюдения (60% [ 45;64] и 55% [ 50;60] соответственно, р=0,152), так и через 3 года (49% [ 43;55] и 50% [ 46;59], p=0,394) соответственно (рис. 3). При этом обращает на себя внимание тенденция к снижению ФВЛЖ за время наблюдения как в группе окклюдера, так и в группе контроля (статистически не значимая, р=0,067 и 0,264 соответственно).
Для того, чтобы выявить предикторы декомпенсации ХСН у пациентов исследуемой когорты среди исходных клинико-анамнестических факторов был проведён однофакторный анализ методом регрессии Кокса, в котором были отобраны факторы, для которых значение р составило менее 0,2: мужской пол, курение, ишемическая болезнь сердца, чрескожное коронарное вмешательство в анамнезе, индекс коморбидности Чарльсона, уровень BNP, ФВЛЖ, ФК ХСН по NYHA, систолическое давление в легочной артерии, диастолическая дисфункция, объём левого предсердия, конечно-диастолический размер левого желудочка, приём антагонистов минералокортикоидных рецепторов и петлевых диуретиков на момент выписки. При этом статистически значимыми предикторами в однофакторном анализе были объём левого предсердия, уровень BNP, ФК ХСН по NYHA, чрескожное коронарное вмешательство в анамнезе (табл. 3).
Также был выполнен многофакторный анализ методом регрессии Кокса, в котором отбор предикторов проводился методом исключения Вальда из тех факторов, для которых значение р в однофакторном анализе было менее 0,2. В итоговую многофакторную модель вошли следующие факторы: объём левого предсердия, уровень BNP, ФК ХСН. Каждый из указанных факторов был статистически значимым независимым предиктором конечной точки.
Таблица 1. Клинико-анамнестические данные пациентов группы окклюдера и группы контроля
|
Параметр |
Группа окклюдера УЛП (n=55) |
Группа контроля (n=84) |
р |
|
Возраст, лет |
66 [ 59;70] |
72 [ 64;76] |
<0,001 |
|
Возраст старше 70 лет, n (٪) |
14 (25,5) |
52 (61,9) |
<0,001 |
|
Пол (мужчины), n (٪) |
25 (45,5) |
42 (50,0) |
0,608 |
|
ИМТ, кг/м2 |
31,4 [ 26,1;34,3] |
30,2 [ 28,1;32,5] |
0,717 |
|
Ожирение, n (٪) |
32 (58,2) |
47 (56,0) |
0,862 |
|
Курение, n (٪) |
9 (16,4) |
17 (20,2) |
0,659 |
|
Непароксизмальная ФП, n (٪) |
37 (67,3) |
40 (47,6) |
0,025 |
|
АГ, n (٪) |
35 (63,6) |
54 (64,3) |
>0,999 |
|
ИБС, n (٪) |
17 (30,9) |
39 (46,4) |
0,079 |
|
ИМ, n (٪) |
11 (20,0) |
26 (31,0) |
0,174 |
|
СД, n (٪) |
14 (25,5) |
25 (29,9) |
0,700 |
|
АКШ, n (٪) |
3 (5,5) |
4 (4,8) |
>0,999 |
|
ЧКВ, n (٪) |
11 (20,0) |
25 (29,8) |
0,268 |
|
Онкология, n (٪) |
0 |
4 (4,8) |
0,152 |
|
Заболевания щитовидной железы некомпенсированные*, n (٪) |
12 (21,8) |
11 (13,1) |
0,243 |
|
Индекс коморбидности Чарльсона, балл |
6 [ 4;7] |
5 [ 3;8] |
0,371 |
|
CHA2DS2-VASc, балл |
4 (ИКР: 3-5) |
4 [ 3;5] |
0,678 |
|
HAS-BLED, балл |
3 (ИКР: 2-3) |
3 [ 2;3] |
0,543 |
|
Уровень BNP, пг/мл |
352,5 [ 193,9;569,1] |
164,5 [ 123,8;307,8] |
<0,001 |
|
ХСНнФВ, n (٪) |
6 (10,9) |
3,6٪ (3/84) |
0,155 |
|
Функциональный класс ХСН, n (٪) |
I — 15 (27,3) II — 35 (63,6) III — 5 (9,1) |
I — 5 (6,0) II — 59 (70,2) III — 20 (23,8) |
0,001 |
|
Препараты: Бета-блокаторы, n (٪) иАПФ, n (٪) АРА, n (٪) АМКР, n (٪) Петлевые диуретики, n (٪) |
49 (89,1) 29 (52,7) 16 (29,1) 16 (29,1) 37 (67,3) |
60 (71,4) 57 (67,9) 20 (23,8) 36 (42,9) 60 (71,4) |
0,019 0,078 0,554 0,110 0,706 |
|
Данные представлены в виде Me (25٪; 75٪), если не указано иное *не достигнуты целевые значения АГ — артериальная гипертензия, АКШ — аорто-коронарное шунтирование, АМКР — антагонисты минералокортикоидных рецепторов, иАПФ — ингибиторы ангиотензин-превращающего фермента, ИБС — ишемическая болезнь сердца, ИМ — инфаркт миокарда, ИМТ — индекс массы тела, СД — сахарный диабет, ФП — фибрилляция предсердий, ХСНнФВ — хроническая сердечная недостаточность с низкой фракцией выброса левого желудочка, ЧКВ — чрескожное коронарное вмешательство. |
|||
Таблица 2. Эхокардиографические данные пациентов группы окклюдера и группы контроля на момент включения в исследование
|
Параметр |
Группа окклюдера (n=55) |
Группа контроля (n=84) |
р |
|
ФВ ЛЖ, ٪ |
60 [ 45;64] |
55 [ 50;60] |
0,152 |
|
СДЛА, мм рт.ст. |
32 [ 27;40] |
33 [ 25;40] |
0,544 |
|
Диастолическая дисфункция, n (٪) |
Нет — 37 (67,3) 1 тип — 11 (20,0) 2 тип — 6 (10,9) 3 тип — 1 (1,8) |
Нет — 56 (66,7) 1 тип — 21 (25,0) 2 тип — 4 (4,8) 3 тип — 3 (3,6) |
0,482 |
|
Объём ЛП, мл |
98 [ 80;103] |
90 [ 66;100] |
0,032 |
|
КДР ЛЖ, см |
5,4 [ 5,1;6,1] |
5,5 [ 5,2;5,8] |
0,753 |
|
Данные представлены в виде Me (25٪; 75٪), если не указано иное КДР ЛЖ — конечно-диастолический размер левого желудочка, ЛП — левое предсердие, СДЛА — систолическое давление в легочной артерии, ФВ ЛЖ — фракция выброса левого желудочка |
|||
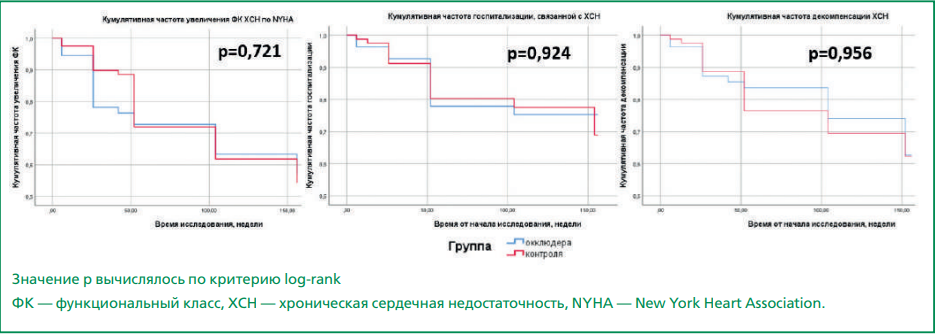
Рисунок 1. Сравнение групп окклюдера УЛП и контроля по конечным точкам (частота декомпенсации ХСН, госпитализации, связанные с ХСН, увеличение ФК ХСН по NYHA)
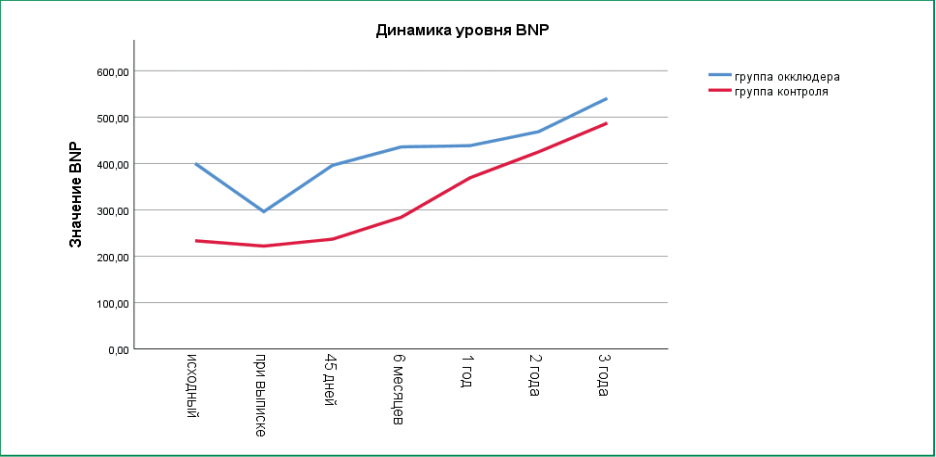
Рисунок 2. Изменение уровня BNP за время наблюдения в группах окклюдера УЛП и контроля
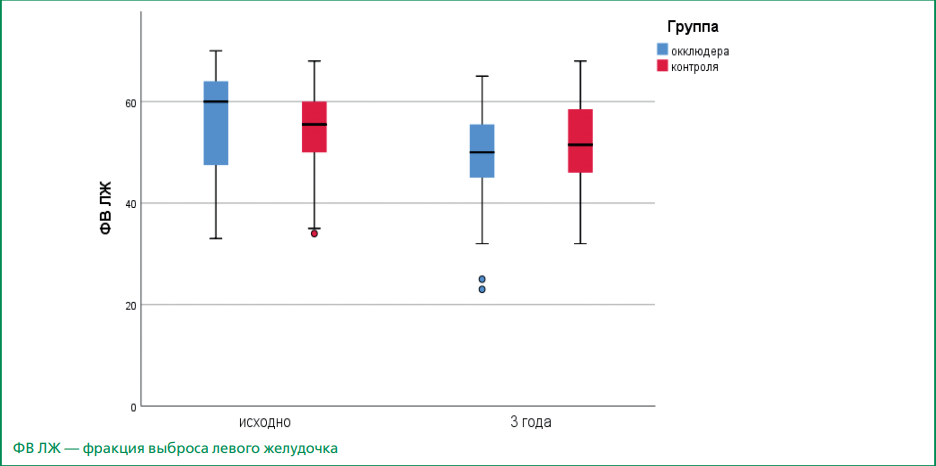
Рисунок 3. Изменение ФВ ЛЖ через 3 года после начала наблюдения в группах окклюдера УЛП и контроля
Таблица 3. Независимые предикторы декомпенсации ХСН у пациентов с ФП в настоящем исследовании
|
Предиктор |
Однофакторный анализ |
Многофакторный анализ* |
||||
|
ОР |
95٪ ДИ |
р |
ОР |
95٪ ДИ |
р |
|
|
Объём ЛП** |
1,015 |
1,007-1,024 |
<0,001 |
1,014 |
1,004-1,023 |
0,004 |
|
Исходный уровень BNP** |
1,003 |
1,002-1,004 |
<0,001 |
1,002 |
1,001-1,003 |
0,002 |
|
ФК ХСН*** |
1,965 |
1,147-3,366 |
0,014 |
2,086 |
1,142-3,811 |
0,017 |
|
ЧКВ в анамнезе |
2,050 |
1,118-3,760 |
0,020 |
|||
|
* — отбор предикторов для многофакторного регрессионного анализа проводился методом исключения Вальда среди факторов, для которых значение р по данным однофакторного анализа составило менее 0,2; ** — для повышения на среднеквадратичное отклонение; *** — для повышения на 1 ДИ — доверительный интервал, ЛП — левое предсердия, ОР — отношение рисков, ФК ХСН — функциональный класс хронической сердечной недостаточности, ЧКВ — чрескожное коронарное вмешательство |
||||||
Обсуждение
ФП и ХСН связаны между собой общими факторами риска, единством патофизиологических механизмов, а также двунаправленным увеличением риска и усугублением течения [7]. По данным метаанализа, наличие ФП повышает риск развития ХСН в 6 раз [8]. Один из краеугольных камней в терапии пациентов с ФП — профилактика тромбоэмболических осложнений. Одной из перспективных методик, в особенности при наличии противопоказаний к антикоагулянтной терапии, является эндоваскулярная окклюзия УЛП. Можно предположить, что у пациентов с ХСН при выраженной систолической и диастолической дисфункции, повышении конечно-диастолического давления в левом желудочке и левом предсердии может происходить более выраженное нарушение кровотока в УЛП и, соответственно, повышаться риск образования тромбов. Данный патофизиологический механизм находит подтверждение в ограниченных клинических данных [9]. Таким образом, эндоваскулярная изоляция УЛП может быть особенно актуальной у таких пациентов.
С другой стороны, поскольку известно, что УЛП является одним из источников BNP [10], нельзя исключить негативное влияние изоляции УЛП на течение ХСН за счет уменьшения выраженности диуретического, натрийуретического и гипотензивного действия BNP [11]. В настоящий момент данный аспект применения окклюдеров УЛП остается практически не изученным. Наиболее крупные рандомизированные исследования — PROTECT-AF и PREVAIL, посвященные эндоваскулярной изоляции УЛП и продемонстрировавшие высокую эффективность и безопасность данной процедуры, включали в том числе пациентов с ХСН (23,4% в исследовании PREVAIL). Тем не менее, связь установки окклюдеров УЛП с дальнейшим течением ХСН в обоих исследованиях прицельно не изучалась [12][13]. Исследование D-Y. Kim и соавт., включило 98 пациентов, которым была выполнена окклюзия УЛП [14]. Авторами показано, что данная процедура может повышать вероятность развития ХСН за счет изменений гемодинамический параметров УЛП. В данном исследовании наличие предшествующей ХСН, отношение Е/е’, большая масса миокарда левого желудочка и меньшая продольная деформация левого предсердия были независимыми предикторами госпитализации по поводу ХСН у пациентов после эндоваскулярной окклюзии УЛП [14].
Наше исследование демонстрирует высокие показатели технического и процедурного успеха имплантации окклюдера УЛП у пациентов с ХСН, а также высокую эффективность в виде низкой частоты тромбоэмболических событий. Эффективность и безопасность эндоваскулярной изоляции УЛП у пациентов с ХСН была также изучена в небольшом исследовании M. Szymala и соавт., в которое было включено 80 пациентов с ХСН II-III ФК, неклапанной формой фибрилляции предсердий и высоким риском кардиоэмболических осложнений [15]. В исследование включались как пациенты с низкой ФВ ЛЖ (n=19, средний уровень NT-proBNP 2048±3312 пг/мл (548,8-7863), так и с промежуточной и сохранной ФВ ЛЖ (n=61, средний уровень NT-proBNP 580±1210,6 пг/мл (5-3062). Таким образом, в данной работе процедура проводилась пациентам с достаточно выраженной ХСН (отмечается большая доля пациентов с низкой ФВЛЖ и III ФК по NYHA по сравнению с нашим исследованием). При этом были получены высокие значения клинической эффективности, под которой понималось отсутствие кардиоэмболических осложнений в течение 6 месяцев после процедуры: 100% в группе пациентов с низкой ФВЛЖ и 98,4% в группе пациентов с промежуточной и сохранной ФВЛЖ. Тем не менее, в данном исследовании также не оценивалось дальнейшее течение ХСН, динамика уровня BNP и ФВЛЖ. В нашем исследовании было получено снижение уровня BNP как в группе окклюдера, так и в группе контроля в начале исследования, что, вероятнее всего, было связано с назначением оптимальной терапии ХСН во время госпитализации. Аналогичные результаты были получены в исследовании I. Cruz-Gonzalez и соавт., у 37 пациентов с ФП и ХСН, которым были установлены окклюдера УЛП [7]. Значимое снижение уровня BNP отмечалось через 45-60 дней после процедуры (с 759,9 до 636,9 пг/мл, р=0,004). В нашем исследовании уровень BNP в дальнейшем значимо повысился в обеих группах, но меньше в группе окклюдера, что может быть связано с уменьшением продукции BNP из-за окклюзии УЛП. Тем не менее, данный факт не оказал какого-либо значимого влияния на другие параметры, отражающие течение ХСН: не было получено значимых различий в уровне ФВЛЖ между группой окклюдера и группой контроля через 3 года наблюдения, а также в кумулятивной частоте конечных точек, отражающих неблагоприятное течение ХСН: декомпенсация ХСН, госпитализация по поводу ХСН, повышение ФК ХСН по NYHA [7]. Отличие результатов нашего исследования от исследования Kim D-Y и соавт. [14] может быть связано с тем, что в наше исследование были включены только пациенты с уже диагностированной ХСН, таким образом, не рассматривалась вероятность развития ХСН de novo.
Интерес представляет также выявление предикторов декомпенсации ХСН у пациентов с ФП и ХСН, в то числе после выполнения эндоваскулярной изоляции УЛП. Данных аспект также мало освещен в литературе. Известно, что уровень BNP/NT-proBNP является предиктором декомпенсации ХСН [16]. Также в качестве предикторов выделяют низкую ФВЛЖ, острый коронарный синдром, гипонатриемию, возраст пациентов [17, 18]. Тем не менее, указанные исследования касаются общей когорты пациентов с ХСН и учитывают преимущественно декомпенсацию в течение 30 дней от начала исследования. Учитывая, что частота декомпенсации ХСН не различалась между группами, поиск предикторов в нашем исследовании проводился в общей группе. Было получено, что объём ЛП, исходный уровень BNP и ФК ХСН по NYHA независимо связаны с большей частотой декомпенсации ХСН.
Таким образом, наше исследование впервые продемонстрировало отсутствие влияния эндоваскулярной окклюзии УЛП на течение ХСН у пациентов с ФП. Кроме того, был выявлен ряд предикторов декомпенсации ХСН в данной когорте пациентов.
Ограничения исследования
К ограничениям данного исследования следует отнести небольшой объём выборки, отсутствие рандомизации, представление опыта одного центра, а также отсутствие детальной оценки гемодинамических характеристик левого предсердия. Дальнейшие исследования должны быть направлены на подтверждение или опровержение полученных нами результатов, а также изучение влияния эндоваскулярной изоляции УЛП на вероятность развития ХСН de novo.
Заключение
Продемонстрирована высокая эффективность эндоваскулярной изоляции УЛП у пациентов с ХСН. При этом не выявлено негативного влияния окклюзии УЛП на течение ХСН. Также были выявлены предикторы декомпенсации ХСН у пациентов с ФП: объём левого предсердия, исходный уровень BNP, ФК ХСН.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование. Исследование проведено при поддержке ФГБУ Национальный медицинский исследовательский центр кардиологии имени академика Е. И. Чазова Министерства здравоохранения Российской Федерации.
Funding. The study was performed with the support of Federal State Budgetary Institution National Medical Research Centre of Cardiology named after academician E. I. Chazov of the Ministry of Health of the Russian Federation.
Список литературы
1. Reddy YNV, Borlaug BA, Gersh BJ. Management of Atrial Fibrillation Across the Spectrum of Heart Failure With Preserved and Reduced Ejection Fraction. Circulation. 2022;146(4):339-57. DOI:10.1161/CIRCULATIONAHA.122.057444.
2. Karnik AA, Gopal DM, Ko D, et al. Epidemiology of Atrial Fibrillation and Heart Failure. Cardiol Clin. 2019;37(2):119-29. DOI:10.1016/j.ccl.2019.01.001.
3. Ariyaratnam JP, Lau DH, Sanders P, Kalman JM. Atrial Fibrillation and Heart Failure. Card Electrophysiol Clin. 2021;13(1):47-62. DOI:10.1016/j.ccep.2020.11.004.
4. Chamberlain AM, Redfield MM, Alonso A, et al. Atrial Fibrillation and Mortality in Heart Failure: A Community Study. Circ Heart Fail. 2011;4(6):740-6. DOI:10.1161/ CIRCHEARTFAILURE.111.962688.
5. Аракелян М. Г., Бокерия Л.А., Васильева Е.Ю., и др. Фибрилляция и трепетание предсердий. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(7):4594. DOI:10.15829/1560-4071-2021-4594.
6. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599- 726. DOI:10.1093/eurheartj/ehab368.
7. Cruz-Gonzalez I, Palazuelos Molinero J, Valenzuela M, et al. Brain natriuretic peptide levels variation after left atrial appendage occlusion: BNP and Left Atrial Appendage Occlusion. Catheter Cardiovasc Interv. 2016;87(1):E39-43. DOI:10.1002/ccd.25985.
8. Odutayo A, Wong CX, Hsiao AJ, et al. Atrial fibrillation and risks of cardiovascular disease, renal disease, and death: systematic review and meta-analysis. BMJ. 2016;354:i4482. DOI:10.1136/bmj.i4482.
9. Vigna C, Russo A, De Rito V, et al. Frequency of left atrial thrombi by transesophageal echocardiography in idiopathic and in ischemic dilated cardiomyopathy. Am J Cardiol. 1992;70(18):1500-1. DOI:10.1016/0002- 9149(92)90310-U.
10. Wiese S, Breyer T, Dragu A, et al. Gene Expression of Brain Natriuretic Peptide in Isolated Atrial and Ventricular Human Myocardium: Influence of Angiotensin II and Diastolic Fiber Length. Circulation. 2000;102(25):3074-9. DOI:10.1161/01. CIR.102.25.3074.
11. Brunner-La Rocca HP, Kaye DM, Woods RL, et al. Effects of intravenous brain natriuretic peptide on regional sympathetic activity in patients with chronic heart failure as compared with healthy control subjects. J Am Coll Cardiol. 2001;37(5):1221-7. DOI:10.1016/S0735-1097(01)01172-X.
12. Fountain RB, Holmes DR, Chandrasekaran K, et al. The PROTECT AF (WATCHMAN Left Atrial Appendage System for Embolic PROTECTion in Patients with Atrial Fibrillation) Trial. Am Heart J. 2006;151(5):956-61. DOI:10.1016/j.ahj.2006.02.005.
13. Holmes DR, Kar S, Price MJ, et al. Prospective Randomized Evaluation of the Watchman Left Atrial Appendage Closure Device in Patients With Atrial Fibrillation Versus Long-Term Warfarin Therapy. J Am Coll Cardiol. 2014;64(1):1- 12. DOI:10.1016/j.jacc.2014.04.029.
14. Kim D-Y, Kim M, Seo J, et al. Predictors of Subsequent Heart Failure After Left Atrial Appendage Closure. Circ J. 2022;86(7):1129-1136. DOI:10.1253/circj.CJ-21- 0642.
15. Szymala M, Streb W, Mitrega K, et al. Percutaneous left atrial appendage occlusion procedures in patients with heart failure. Kardiol Pol.2017;75(9):868- 876. DOI:10.5603/KP.a2017.0115.
16. Gorriz Magana J, Abad Romero R, Nieto Ibanez D, et al. Predictors of Acute Heart Failure Decompensation at 30 days After Discharge. Results from a Multidisciplinary Heart Failure unit. Eur Heart J. 2021;42. DOI:10.1093/ eurheartj/ehab724.1042.
17. Sarteschi C, Viera De Souza W, Medeiros C, et al. Predictors of Post-Discharge 30-Day Hospital Readmission in Decompensated Heart Failure Patients. Int J Cardiovasc Sci. 2020; 33(2):175-184. DOI:10.36660/ijcs.20180088
18. Baldasseroni S, Virciglio S, Herbst A, et al. Predictors of 1-year outcome in very old patients managed in a Heart Failure Unit after an acute decompensation. Eur Geriatr Med. 2022;13(6):1417-24. DOI:10.1007/s41999-022-00679-5.
Об авторах
Д. В. ПевзнерРоссия
Певзнер Дмитрий Вольфович - руководитель отдела неотложной кардиологии
Москва
Н. С. Кострица
Россия
Кострица Наталья Сергеевна
Москва
И. А. Меркулова
Россия
Меркулова Ирина Алексеевна
Москва
О. Б. Дорогун
Россия
Дорогун Олег Борисович
Москва
А. Л. Комаров
Россия
Комаров Андрей Леонидович - ведущий научный сотрудник отдела атеротромбоза
Москва
И. С. Явелов
Россия
Явелов Игорь Семенович- руководитель отдела фундаментальных и клинических проблем тромбоза при неинфекционных заболеваниях, заместитель председателя секции "Неотложная кардиология" РКО, д.м.н., профессор
Москва
Рецензия
Для цитирования:
Певзнер Д.В., Кострица Н.С., Меркулова И.А., Дорогун О.Б., Комаров А.Л., Явелов И.С. Особенности течения хронической сердечной недостаточности у пациентов с фибрилляцией предсердий: роль эндоваскулярной изоляции ушка левого предсердия. Рациональная Фармакотерапия в Кардиологии. 2023;19(4):350-358. https://doi.org/10.20996/1819-6446-2023-2934. EDN: NKPQMO
For citation:
Pevzner D.V., Kostritca N.S., Merkulova I.A., Dorogun O.B., Komarov A.L., Yavelov I.S. Clinical features of heart failure in patients with atrial fibrillation: the role of the endovascular left atrial appendage closure. Rational Pharmacotherapy in Cardiology. 2023;19(4):350-358. (In Russ.) https://doi.org/10.20996/1819-6446-2023-2934. EDN: NKPQMO

















































