Перейти к:
Использование биомаркеров в прогнозировании смертности от осложнений сердечно-сосудистых заболеваний у пациентов с хронической сердечной недостаточностью и имплантированным кардиовертером-дефибриллятором
https://doi.org/10.20996/1819-6446-2023-2938
EDN: YUSZMT
Аннотация
Цель: изучение роли биомаркеров крови в прогнозировании наступления смерти вследствие острой декомпенсации сердечной недостаточности (ОДСН) у больных хронической сердечной недостаточностью со сниженной фракцией выброса (ХСНнФВ) в течение года после имплантации кардиовертера-дефибриллятора (ИКД).
Материал и методы. В одноцентровое наблюдательное исследование было включено 319 больных ХСНнФВ (мужчины 83%, ХСН 3 функционального класса [ФК] - 74%, ХСН ФК 4 – 7%), подвергнувшиеся проспективному наблюдению в течение 1 года после имплантации ИКД. Проведено изучение оригинальной панели современных биомаркеров (электролиты крови, С-реактивный белок, креатинин, растворимый стимулирующий фактор роста (sST-2), мозговой натрийуретический пептид (NT-proBNP), галектин-3), позволяющих оценить основные механизмы патогенеза ХСН. На основании концентрации креатинина крови проводился расчет скорости клубочковой фильтрации (СКФ) по формуле CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration).
Результаты. В ходе однолетнего наблюдения первичная конечная точка была зарегистрирована у 35 больных (11%). При однофакторной логистической регрессии выделено 3 биомаркера с наибольшим прогностическим потенциалом (р<0,01), связанных с возникновением исследуемой конечной точки. Концентрация калия крови и NT-proBNP, величина СКФ (CKD-EPI) вошли в состав многофакторной прогностической модели с диагностической эффективностью составила 66% (чувствительность 66%, специфичность 68%). Было показано, что риск смерти по причине ОДСН повышался в раза в 2 раза (ОШ=2,4; 95% ДИ: 1,14-4,88; р=0,018) при СКФ <60 мл/мин/1,73 м2 и возрастал почти в 3 раза (ОШ=2,6; 95% ДИ: 1,05-6,66; р=0,035) при концентрации NT-proBNP >2000 пг/мл.
Заключение. Исследование бимаркеров крови является перспективным и востребованным для прогноза неблагоприятных исходов ХСН. Согласно полученным данным, факторы «СКФ <60 мл/мин/1,73 м2» и «NT-proBNP >2000 пг/мл» могут иметь значение для определения вероятности однолетней летальности по причине ОДСН.
Ключевые слова
Для цитирования:
Илов Н.Н., Петрова О.В., Твердохлебова Д.К., Каримов И.Р., Нечепуренко А.А., Бойцов С.А. Использование биомаркеров в прогнозировании смертности от осложнений сердечно-сосудистых заболеваний у пациентов с хронической сердечной недостаточностью и имплантированным кардиовертером-дефибриллятором. Рациональная Фармакотерапия в Кардиологии. 2023;19(4):359-366. https://doi.org/10.20996/1819-6446-2023-2938. EDN: YUSZMT
For citation:
Ilov N.N., Petrova O.V., Tverdokhlebova D.K., Karimov I.R., Nechepurenko A.A., Boytsov S.A. Biomarkers in predicting mortality from cardiovascular events in patients with heart failure and an implanted cardioverter-defibrillator. Rational Pharmacotherapy in Cardiology. 2023;19(4):359-366. (In Russ.) https://doi.org/10.20996/1819-6446-2023-2938. EDN: YUSZMT
Введение
Пристальное внимание специалистов к проблеме оценки прогноза у больных хронической сердечной недостаточностью со сниженной фракцией выброса (ХСНнФВ) объясняется необходимостью проведения стратификации рисков, лежащей в основе персонифицированного подхода к лечению. Современными требованиями к оценке рисков неблагоприятных событий являются максимальная индивидуализация и точность. Создание прогностических систем на основании этих принципов позволит определить наиболее уязвимых в отношении достижения конечной точки пациентов, для которых или оправдана тактика по интенсификации терапевтических вмешательств или, наоборот, диапазон интервенционного лечения должен быть ограничен.
Больные ХСН с фракцией выброса левого желудочка (ФВ ЛЖ) ≤35% имеют высокий риск внезапной сердечной смерти (ВСС) и по этой причине даже при отсутствии анамнестических указаний на ранее возникавшие желудочковые тахиаритмии имеют 1 класс показаний для постановки имплантируемого кардиовертера-дефибриллятора (ИКД). Вместе с тем, действующие рекомендации указывают на отсутствие такой необходимости (3 класс показаний) при высоком риске смерти в течение ближайшего года наблюдения [1]. При этом рутинных инструментов оценки такого риска не предлагается, что ставит клинициста перед непростым выбором, часто основанным только на личном клиническом опыте.
Имеющиеся данные позволяют предположить, что концентрации биомаркеров крови могут оказаться полезными при проведении оценки индивидуального риска, в том числе для прогноза летального исхода больных ХСНнФВ. На сегодняшний день к наиболее достоверным маркерам риска наступления летального исхода у пациентов этой когорты относят растворимый стимулирующий фактор роста (sST-2) [2], мозговой натрийуретический пептид (и N-терминальный фрагмент мозгового натрийуретического пептида, NT-proBNP) [3], галектин-3 [4], маркеры почечной дисфункции [5].
Несмотря на значительное число исследовательских работ, посвященных изучению прогностического потенциала биомаркеров, налицо ряд проблем, ограничивающих применение опубликованных данных в реальной клинической практике. Так, чаще всего в качестве конечной точки наблюдений используют сердечно-сосудистую летальность, не позволяющую структурировать причины наступления смерти. Имеются существенные различия в оценке концентраций биомаркеров (пороговые значения, сроки оценки, используемые тест-системы). На результаты исследований оказывает влияние и гетерогенность включенных больных ХСНнФВ, связанная с появлением новых классов лекарственных препаратов, внедрением современных методов интервенционного лечения ХСН. Несомненно, каждый из вышеперечисленных факторов подчеркивает важность продолжения исследований в этом направлении.
Цель исследования – изучение роли биомаркеров крови в прогнозировании наступления смерти от осложнений сердечно-сосудистых заболеваний (ССЗ) у больных ХСНнФВ в течение года после имплантации ИКД.
Материал и методы
Данное исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен локальным этическим комитетом ФГБОУ ВО Астраханского ГМУ Минздрава России (Протокол № 3 заседания ЛЭК от 30.12.2021г), представлен в публичном регистре clinicaltrials.gov (NCT05539898). Все пациенты, подвергнутые наблюдению, подписывали информированное согласие на участие в исследовании.
Отбор больных
В качестве критериев включения в исследование выступали действующие показания к имплантации ИКД с целью первичной профилактики ВСС [6]: ХСН III-IV функционального класса по классификации Нью-Йоркской кардиологической ассоциации (New York Heart Association, NYHA) с ФВ ЛЖ ≤35%. Большинство пациентов с ХСН IV функционального класса, при отсутствии показаний к проведению сердечной ресинхронизирующей терапии, находились в листе ожидания на трансплантацию сердца.
В исследование не включались пациенты с гипертрофической кардиомиопатией, аритмогенной дисплазией правого желудочка, верифицированными наследственными каналопатиями, наличием показаний к кардиохирургическому вмешательству (реваскуляризации, коррекции клапанной недостаточности).
После проверки на соответствие критериям включения/исключения в исследование было включено 319 пациентов, которым в период с 2012 по 2020 гг. в качестве средства первичной профилактики ВСС был имплантирован ИКД. При выраженных нарушениях внутрижелудочковой проводимости имплантировали ИКД с функцией сердечной ресинхронизирующей терапии (СРТ-Д) – 190 пациентов (60%), остальным больным был имплантирован двухкамерный ИКД (рис. 1).
Определение концентрации биомаркеров крови
Для определения концентрации биомаркеров проводили взятие крови натощак из локтевой вены методом венопункции в специальную стерильную вакуумную систему “BD Vacutainer®” с активатором свертывания. Полученные образцы крови инкубировали при комнатной температуре 30-45 мин, после чего в течение 15 мин центрифугировали при 3000 об/мин. Полученную сыворотку декантировали в одноразовые пластиковые пробирки, замораживали и хранили при 40ºС. Лабораторные исследования проводили на иммунохемилюминесцентном анализаторе «Cobas е411» (Roche Diagnostics, Германия) и анализаторе «Cobas c311» (Roche Diagnostica, Германия).
Включенным в исследование больным определяли уровни электролитов крови (калия, магния, натрия, кальция) и С-реактивного белка (СРБ). Определяли уровень креатинина в сыворотке крови, который в дальнейшем использовался для расчета скорости клубочковой фильтрации (СКФ) по формуле CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration).
Части больных определяли концентрации NT-proBNP, sST-2 и галектина-3. Для количественного измерения концентрации sST-2 в сыворотке крови использовали набор «Presage® ST2 Assay Kit» (Critical Diagnostics, США), основанный на «сэндвич» иммуноферментном анализе в микропланшетном формате. Определение концентрации галектина-3 выполняли методом твердофазного конкурентного иммуноферментного анализа с использованием тест-системы «Human Galectin-3 ELISA Kit» (RayBiotech Inc., США). Измерение оптических плотностей, построение калибровочных графиков, оценку и учет результатов количественного содержания всех определяемых показателей проводили с помощью микропланшетного ридера «Multiskan FC» (Финляндия).
Оценку и интерпретацию результатов лабораторных исследований осуществляли с помощью референтных интервалов, указанных в инструкции к наборам реактивов.
Послеоперационное наблюдение
Включенные в исследование пациенты наблюдались в течение года кардиологами центра, в котором была проведена имплантация (визиты в клинику через 3, 6, 12 мес). При декомпенсации ХСН пациент внепланово выходил на связь с врачом-исследователем, коррекция терапии и оценка клинического статуса проводилась совместно с кардиологами по месту жительства. В качестве первичной конечной точки оценивали наступление смерти от осложнений ССЗ. Учитывая наличие ИКД и ранее проведенную полную реваскуляризацию миокарда, наиболее вероятно причиной сердечно-сосудистой смерти выступала острая декомпенсация сердечной недостаточности (ОДСН). Информация о возникновении конечной точки поступала из медицинской документации и при опросе родственников.
Статистический анализ
Статистическая обработка данных проведена с использованием методов параметрического и непараметрического анализа. Накопление, корректировка, систематизация исходной информации и визуализация полученных результатов проводилась в электронных таблицах Microsoft Office Excel 2010. Статистический анализ и визуализация результатов осуществлялись с использованием программ IBM SPSS Statistics 23 и Jamovi (версия 2.3.28.0). Протокол статистического анализа был подробно описан авторами ранее [7]
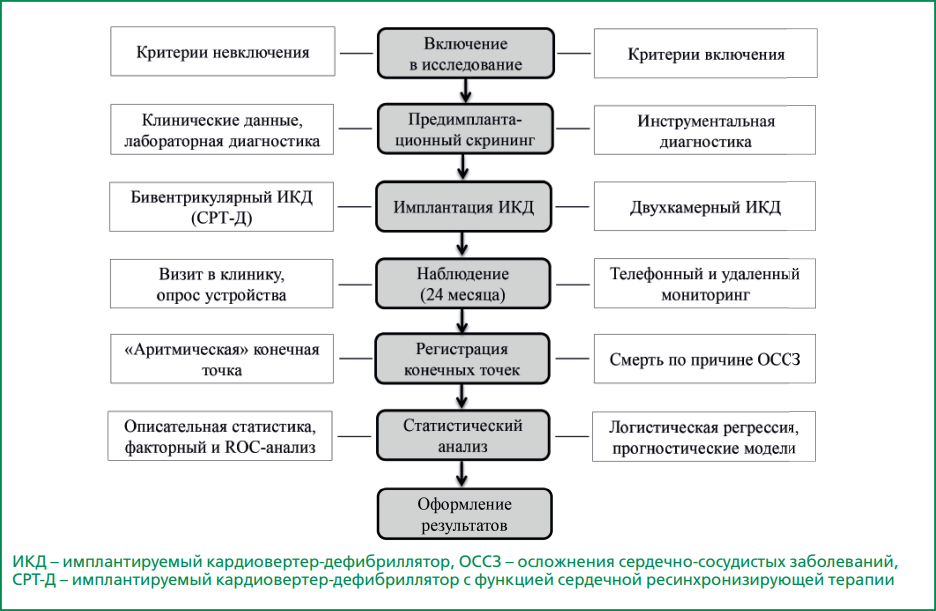
Рисунок 1. Поточная диаграмма процесса (flow chart), отражающая дизайн исследования.
Таблица 1. Клинико-демографическая характеристика пациентов, включенных в исследование
|
Параметр |
Все больные (n=319) |
Выжившие (n=284) |
Умершие (n=35) |
p2-3 |
|
1 |
2 |
3 |
||
|
Возраст, лет |
57 (51-63) |
58 (51-63) |
55 (50-59) |
0,074 |
|
Мужской пол, n (٪) |
265 (83) |
237 (84) |
28 (80) |
0,607 |
|
ИМТ, кг/м2 |
28,7 (25,4-32,5) |
28,7 (25,4-32,3) |
28,4 (25-29,7) |
0,166 |
|
ИБС, n (٪) |
160 (50) |
143 (50) |
17 (49) |
0,842 |
|
ПИКС из числа больных ИБС, n (٪) |
118 (37) |
105 (37) |
13 (37) |
0,996 |
|
ДКМП, n (٪) |
159 (50) |
141 (50) |
18 (51) |
0,913 |
|
ХСН 3 ФК, n (٪) |
233 (74) |
205 (73) |
28 (80) |
0,356 |
|
ХСН 4 ФК, n (٪) |
22 (7) |
18 (6) |
4 (11) |
0,268 |
|
АГ в анамнезе, n (٪) |
180 (56) |
168 (59) |
12 (34) |
0,005 |
|
Сахарный диабет, n (٪) |
61 (19) |
51 (18) |
10 (29) |
0,132 |
|
Ожирение в анамнезе |
119 (37) |
115 (41) |
4 (11) |
0,001 |
|
Мозговой инсульт, n (٪) |
20 (6) |
16 (6) |
4 (11) |
0,182 |
|
ХБП, n (٪) |
139 (46) |
125 (47) |
14 (40) |
0,447 |
|
Анемия, n (٪) |
21 (8) |
19 (8) |
2 (6) |
0.681 |
|
ФП (пароксизмальная/персистирующая форма), n (٪) |
90 (28) |
81 (29) |
9 (26) |
0,728 |
|
ФП (постоянная форма), n (٪) |
26 (8) |
22 (8) |
4 (11) |
0,461 |
|
ЖТнеуст, n (٪) |
43 (14) |
37 (13) |
6 (17) |
0,501 |
|
САД, мм рт. ст. |
120 (110-130) |
120 (110-130) |
110 (100-130) |
0,025 |
|
ДАД, мм рт. ст. |
80 (70-80) |
80 (70-80) |
70 (60-83) |
0,281 |
|
ЧСС, уд/мин. |
78 (68-88) |
78 (68-88) |
80 (67-90) |
0,896 |
|
ФВ ЛЖ по Simpson, ٪ |
29 (24-33) |
29 (25-33) |
27 (20-32) |
0,043 |
|
Хирургические вмешательства на сердце: |
||||
|
Реваскуляризация (коронарное шунтирование либо чрескожное коронарное вмешательство), n (٪) |
134 (43) |
120 (43) |
14 (40) |
0,747 |
|
Коррекция клапанной недостаточности, n (٪) |
62 (20) |
54 (19) |
8 (23) |
0,616 |
|
Пластика ЛЖ, n (٪) |
29 (9) |
24 (9) |
5 (14) |
0,270 |
|
Получаемая медикаментозная терапия: |
||||
|
Бета-адреноблокаторы, n (٪) |
319 (100) |
284 (100) |
35 (100) |
- |
|
иАПФ/БРА, n (٪) |
208 (65) |
189 (66) |
19 (54) |
0,212 |
|
АРНИ, n (٪) |
111 (35) |
95 (34) |
16 (46) |
0,151 |
|
Антагонисты минералокортикоидов, n (٪) |
283 (89) |
250 (88) |
33 (94) |
0,270 |
|
Петлевые диуретики, n (٪) |
311 (98) |
277 (98) |
34 (97) |
0,889 |
|
иНГКТ-2, n (٪) |
52 (16) |
43 (15) |
9 (26) |
0,110 |
|
Соталол, n (٪) |
38 (12) |
36 (13) |
2 (6) |
0,230 |
|
Амиодарон, n (٪) |
85 (27) |
74 (26) |
11 (31) |
0,498 |
|
Имплантированный ИКД: |
||||
|
ИКД с функцией сердечной ресинхронизирующей терапии, n (٪) |
190 (60) |
170 (60) |
20 (57) |
0,757 |
|
Двухкамерный ИКД, n (٪) |
129 (40) |
114 (40) |
15 (43) |
0,814 |
|
Данные представлены в виде Me (Q1-Q3), если не указано иное. Представлена медикаментозная терапия, актуальная на момент включения в исследование. ИМТ – индекс массы тела, ИБС – ишемическая болезнь сердца, ПИКС – постинфарктный кардиосклероз, ДКМП – дилатационная кардиомиопатия, АГ – артериальная гипертензия, ХБП – хроническая болезнь почек, ФП – фибрилляция предсердий, ЖТнеуст – неустойчивые пробежки желудочковых тахиаритмий, САД – систолическое артериальное давление, ДАД – диастолическое артериальное давление, ЧСС – частота сердечных сокращений, ФВ ЛЖ – фракция выброса левого желудочка, иАПФ – ингибиторы ангиотензин-превращающего фермента, БРА – блокаторы рецепторов ангиотензина II, АРНИ – ангиотензиновых рецепторов и неприлизина ингибитор, иНГКТ-2 – ингибиторы натрий-глюкозного котранспортера 2-го типа, ИКД – имплантированный кардиовертер-дефибриллятор. |
||||
Таблица 2. Исследуемые биомаркеры в группах сравнения
|
Параметр |
Все больные (n=384) |
Выжившие (n=284) |
Умершие (n=35) |
p2-3 |
|
1 |
2 |
3 |
||
|
Кальций, ммоль/л |
2,2 (2,1-2,3) |
2,2 (2,1-2,3) |
2,3 (2,2-2,3) |
0,103 |
|
Магний, ммоль/л |
0,8 (0,7-0,9) |
0,8 (0,7-0,9) |
0,8 (0,7-0,9) |
0,585 |
|
Калий, ммоль/л |
4,4 (4,2-4,8) |
4,4 (4,1-4,7) |
4,5 (4,2-5,1) |
0,049 |
|
Натрий, ммоль/л |
138 (135-141) |
139 (135-141) |
136 (135-141) |
0,194 |
|
СРБ, мг/л |
7 (4-11) |
7 (4-11) |
6 (2-9) |
0,224 |
|
Галектин-3, нг/мл |
12,7 (11,6-13,9) |
12,8 (11,6-14) |
12,6 (11,9-12,9) |
0,495 |
|
sST2, нг/мл |
28,8 (18,2-57,7) |
28,9 (18,4-56,9) |
27,7 (14,9-67) |
0,789 |
|
NT-proBNP, пг/мл |
2686 (1379-5303) |
2307 (1253-4122) |
4559 (2456-6255) |
0,003 |
|
СКФ (CKD EPI), мл/мин/1,73 м2 |
67 (58-76) |
68 (60-78) |
61 (54-69) |
0,007 |
|
СРБ – С-реактивный белок, sST-2 – растворимый стимулирующий фактор роста, NT-proBNP – мозговой натрийуретический пептид. |
||||
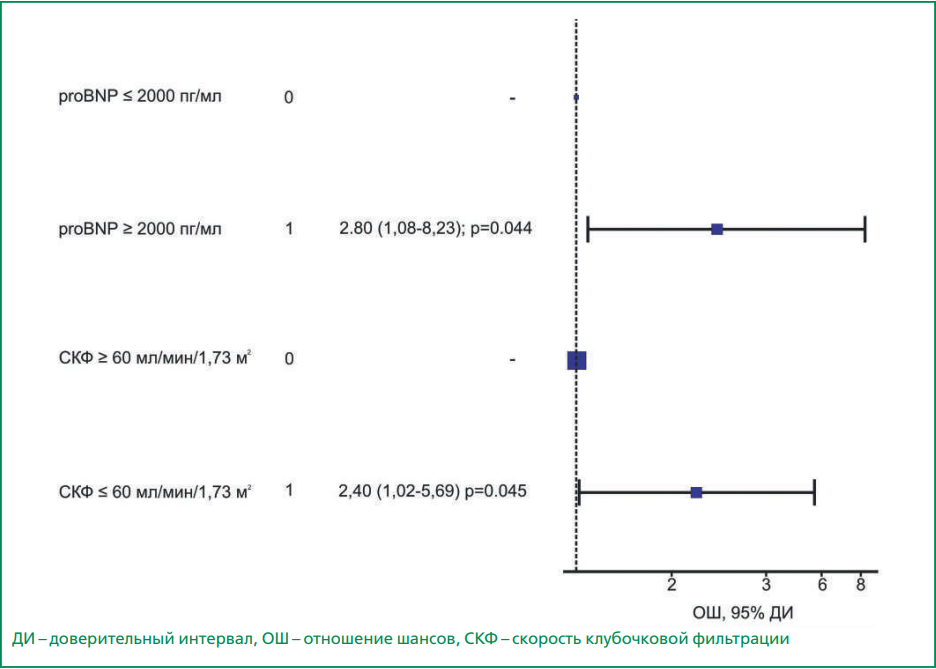
Рисунок 2. График отношения шансов (многофакторный анализ) возникновения конечной точки (смерть от осложнений сердечно-сосудистых заболеваний) в зависимости от регистрации бинарных факторов.
Результаты
Летальный исход был зарегистрирован у 42 включенных в исследование больных (13%). Доминировала смерть от осложнений ССЗ, которая была зарегистрирована у 35 больных (11%). Некардиальные причины смерти были связаны с прогрессированием онкологического заболевания (n=2), развитием острой хирургической патологии (n=2) либо возникновением несчастного случая (n=3).
Сформированные в зависимости от достижения конечной точки группы оказались сопоставимы по большинству клинико-демографических характеристик. Были выявлены статистические различия по наличию в анамнезе ожирения и артериальной гипертензии, а также по величине ФВ ЛЖ (табл. 1).
Группы различались по уровню калия, концентрации NT-proBNP и величине СКФ (CKD EPI; табл. 2).
С использованием метода бинарной логистической регрессии были разработаны прогностические модели, позволяющие определять вероятность наступления сердечно-сосудистой смерти вследствие у больных ХСНнФВ на основании исследуемых биомаркеров.
Лучшая прогностическая модель была описана следующим уравнением (1):
р = 1/(1+e-z)×100%
z = -4,276 + 0,0001*ХNT-proBNP - 0,026*XСКФ + 0,945*Xкалий (1)
где р – вероятность наступления сердечно-сосудистой смерти, ХNT-proBNP – концентрация NT-proBNP, XСКФ – СКФ, рассчитанная по формуле CKD-EPI, Xкалий – концентрация калия, е – математическая константа, приблизительно равная 2,71828.
Исходя из значения коэффициента детерминации Найджелкерка 23,9% дисперсии зависимой переменной (вероятности наступления сердечно-сосудистой смерти) объясняется дисперсией изучаемых факторов.
Площадь под ROC-кривой, соответствующей взаимосвязи прогноза возникновения первичной конечной точки и значения регрессионной функции, составила 0,753±0,048 [95% доверительный интервал (ДИ) 0,659-0,848; р<0,0001].
Пороговое значение функции (1) в точке cut-off составило 0,27. Значения равные или превышающие данное значение соответствовали прогнозу возникновения смерти от осложнений ССЗ в течение ближайшего года. После корректировки порога классификации, исходя из результатов анализа ROC-кривой, диагностическая эффективность полученной прогностической модели составила 68% (чувствительность 60% специфичность 71%).
Для определения критических значений выявленных количественных предикторов (p<0,05) проведен ROC-анализ. Было обнаружено, что при СКФ <60 мл/мин/1,73 м2 риск смерти от осложнений ССЗ в течение года после имплантации ИКД повышался в 2,64 раза (отношение шансов (ОШ) 2,64; 95% ДИ 1,28-5,46; р=0,007). В случае увеличения концентрации NT-proBNP >2000 пг/мл риск того же исхода возрастал в 3,32 раза (ОШ 3,32; 95% ДИ 1,26-8,73; р=0,012). Прогностическое значение этих факторов доказано результатами многофакторного анализа (рис. 2).
Обсуждение
Полученные результаты продемонстрировали, что около 10% больных ХСНнФВ умирают по причинам, связанным с ССЗ, в ближайший год после имплантации ИКД, несмотря на получение оптимальной медикаментозной терапии, интервенционного лечения ХСН (кардиоресинхронизирующей терапии при наличии показаний) и регулярного наблюдения у кардиолога. В ходе проведенного исследования изучена оригинальная панель современных биомаркеров, позволяющих оценить основные механизмы патогенеза ХСН, с целью определения их роли в стратификации однолетнего риска сердечно-сосудистой смерти больных ХСНнФВ.
Наши данные свидетельствуют о том, что этот неблагоприятный исход можно было прогнозировать до проведения имплантации ИКД, на основании оценки функции почек и принимая во внимание уровень NT-proBNP. Оба биомаркера часто включаются в список предикторов изучаемой конечной точки. Так, составленная согласно результатам исследования PARADIGM-HF (Prospective Comparison of ARNI With ACEI to Determine Impact on Global Mortality and Morbidity in Heart Failure), прогностическая система включала логарифм концентрации NT-proBNP (ОШ 1,61; 95% ДИ 1,41-1,84; p<0,001), в то время как фактор «уровень СКФ до 60 мл/мин/1,73 м2» продемонстрировал свою предиктивную способность только при однофакторном анализе (ОШ 0,96; <0,001) [8].
Выявленный нами более высокий уровень калия крови в группе умерших больных, вероятно, выступает в качестве маркера, а не медиатора риска сердечно-сосудистой смерти. К похожим выводам пришли J. P. Ferreira и соавт., описавшие тесные корреляции между гипер- и гипокалиемией и вероятностью любой смерти, включая смерть при ОДСН [9]. Мы считаем, что полученные данные следует связывать с прогрессированием почечной дисфункции, одним из признаков которой считается гиперкалиемия. При этом важно отметить, что в целом медиана и 50% межквартильный диапазон концентраций этого биомаркера находились в референсном интервале нормальных значений (до 5,1 ммоль/л). Все вышеперечисленное в сочетании с полученным критическим уровнем статистической значимости (р=0,049) требует переосмысления значения концентраций калия крови для прогноза исследуемого неблагоприятного события с учетом результатов будущих исследований.
Ранее были описаны взаимосвязи между повышением давления в правом предсердии и наличием почечной дисфункции [10], снижением СКФ и повышенным центральным венозным давлением [11]. Клиническая оценка вклада патологии почек в негативные исходы у больных ХСН привела к формированию концепции хронического кардиоренального синдрома – состояния, при котором зачастую невозможно установить причинно-следственные связи между ХСН и хронической болезнью почек (ХБП), и оба синдрома оказывают негативное влияние на обоюдное течение [12]. Согласно клинико-демографическим данным пациентов, подвергшихся наблюдению, частота ХБП в группах умерших и выживших больных значимо не различалась (р=0,631). Между тем было выявлено двукратное повышение риска сердечно-сосудистой смерти при снижении СКФ <60 мл/мин/1,73 м2. Считается, что этот диапазон биомаркера соответствует потере 50% массы действующих нефронов, результатом чего может быть повышение вероятности госпитализаций, связанных с ОДСН, на 11%, увеличение риска смерти на 17% [13].
На сегодняшний день определение уровня натрийуретических пептидов входит в алгоритмы диагностики, представленные в действующих клинических рекомендациях [14]. Концентрация биомаркеров увеличивается в прямой зависимости от выраженности симптомов ХСН, а также ассоциируется с повышенным риском сердечно-сосудистой смерти и вероятности госпитализации по причине ОДСН [15]. Большинство исследователей признает отсутствие общепринятого отрезного значения концентрации NT-proBNP, обладающего оптимальным соотношением чувствительности и специфичности в отношении прогноза смерти, связанной с ОДСН. Так, отечественные авторы обнаружили максимальный риск смерти от сердечно-сосудистых осложнений и повторной декомпенсации сердечной недостаточности в течение года у пациентов, с концентрацией NT-proBNP при выписке из стационара ≥1696 пг/мл [2]. Однако стоит заметить, что биомаркер, отражая реакцию организма на «гемодинамический» (перегрузка давлением или объемом) миокардиальный стресс, может повышаться и по внекардиальным причинам, включая ХБП [16].
Стоит отметить, что в нашем исследовании не было выявлено статистически значимых ассоциаций между концентрацией sST-2 и галектина-3 в крови больных ХСНнФВ и летальным исходом, зарегистрированным в ходе однолетнего наблюдения. В то же время В. Н. Протасов и соавт. [2] показали, что риск достижения конечных точек (включая смерть от ОДСН) при длительном наблюдении больного после перенесенной декомпенсации ХСН был статистически значимо выше при наличии у пациента отрезных значений концентрации sST2 ≥37,8 нг/мл (относительный риск 4,31; 95% ДИ 2,34-7,93; p<0,0001). Более того, использование этого предиктора повышало диагностическую ценность моделей, имеющих в своем составе дополнительные биомаркеры [2].
Известно, что галектин-3 принимает участие в воспалении, атерогенезе, реакциях иммунного ответа, функционирует в составе ряда сигнальных систем, ассоциированных с ремоделированием сердца при ХСН. В исследования CARE-HF была изучена связь галектина-3 с прогнозом у пациентов с ХСН III–IV ФК по NYHA, имеющих признаки систолической дисфункции ЛЖ и диссинхронию миокарда, диагностированные при эхокардиографии. Концентрация галектина-3 в плазме крови измерялась при включении и через 3 и 18 мес наблюдения. Как следует из результатов исследования, начальная концентрация галектина-3 имеет прямую связь с показателями смертности и госпитализации по причине декомпенсации ХСН. Концентрация галектина-3 плазмы крови >30 нг/мл в 3 раза повышала риск наступления конечных точек: смерти и госпитализации по причине ХСН (ОШ 2,98%; 95% ДИ 1,65-7,1; р=0,001) [4]. Между тем, имеются результаты, подвергающие сомнению подобный прогностический потенциал галектина-3 [2][17].
Появление в последние годы большого числа новых биомаркеров крови, потенциально имеющих точки клинического приложения, значительно расширяет возможности в стратификации рисков у больных ХСН [18]. Анализ существующей по проблеме литературы формирует принятую многими исследователями концепцию многофакторного («мультимаркерного») подхода к прогнозу, в том числе, летального исхода, осуществляемого с использованием различных наборов биомаркеров, что полностью согласуется с полученными нами данными.
Ограничение исследования
К ограничениям проведенного исследования можно отнести одноцентровый характер. Больные, включенные в исследование, соответствовали критериям отбора, регламентируемым действующими клиническими рекомендациями. Соответственно, части больных ХСНнФВ имплантация кардиовертера-дефибриллятора могла быть не выполнена ввиду предполагаемой продолжительности жизни менее 1 года. Установление точного механизма смерти вне стационара по объективным причинам было затруднено. Небольшое значение коэффициента детерминации Найджелкерка может быть связано с необходимостью включения в прогностическую модель дополнительных факторов, имеющих прогностический потенциал применимо к исследуемому исходу.
Заключение
Исследование биомаркеров крови является перспективным и востребованным для прогноза неблагоприятных исходов ХСН. Согласно полученным данным, факторы «СКФ <60 мл/мин/1,73 м2» и «NT-proBNP>2000 пг/мл» могут иметь значение для определения вероятности однолетней летальности от осложнений ССЗ.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование. Исследование проведено при поддержке ФГБУ Национальный медицинский исследовательский центр кардиологии имени академика Е. И. Чазова Министерства здравоохранения Российской Федерации.
Funding. The study was performed with the support of E. I. Chazov National Medical Research Centre of Cardiology of the Ministry of Health of the Russian Federation
Список литературы
1. Лебедев Д.С., Михайлов Е.Н., Неминущий Н.М., и др. Желудочковые нарушения ритма. Желудочковые тахикардии и внезапная сердечная смерть. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(7):4600. DOI:10.15829/1560-4071-2021-4600.
2. Протасов В.Н., Нарусов О.Ю., Скворцов А.А., и др. Многомаркерный подход в стратификации риска у больных с декомпенсированной сердечной недостаточностью. Кардиология. 2019;59(1S):53-64. DOI:10.18087/cardio.2637.
3. Gürgöze MT, van Vark LC, Baart SJ, et al. Multimarker Analysis of Serially Measured GDF15, NT-proBNP, ST2, GAL-3, cTnI, Creatinine, and Prognosis in Acute Heart Failure. Circ Hear Fail 2023;16(1):e009526. DOI:10.1161/CIRCHEARTFAILURE.122.009526.
4. Lopez‐Andrès N, Rossignol P, Iraqi W, et al. Association of galectin‐3 and fibrosis markers with long‐term cardiovascular outcomes in patients with heart failure, left ventricular dysfunction, and dyssynchrony: insights from the CARE‐HF (Cardiac Resynchronization in Heart Failure) trial. Eur J Heart Fail. 2012;14(1):74-81. DOI:10.1093/eurjhf/hfr151.
5. Chicco D, Jurman G.Machine learning can predict survival of patients with heart failure from serum creatinine and ejection fraction alone. BMC Med Inform Decis Mak. 2020;20(1):16. DOI:10.1186/s12911-020-1023-5.
6. Шляхто Е.В., Арутюнов Г.П., Беленков Ю.Н., и др. Национальные рекомендации по определению риска и профилактике внезапной сердечной смерти (2-е издание). М.: МеДпрактИка-М; 2018.
7. Илов Н.Н., Стомпель Д.Р., Бойцов С.А., и др. Перспективы использования результатов трансторакальной эхокардиографии для прогнозирования желудочковых тахиаритмий у больных неишемической кардиомиопатией. Рациональная Фармакотерапия в Кардиологии. 2022;18(3):251-60. DOI:10.20996/1819-6446-2022- 06-01.
8. Shen L, Claggett BL, Jhund PS, et al. Development and external validation of prognostic models to predict sudden and pump-failure death in patients with HFrEF from PARADIGMHF and ATMOSPHERE. Clin Res Cardiol. 2021;110(8):1334-49. DOI:10.1007/s00392-021- 01888-x.
9. Ferreira JP, Mogensen UM, Jhund PS, et al. Serum potassium in the PARADIGM‐HF trial. Eur J Heart Fail. 2020;22(11):2056-64. DOI:10.1002/ejhf.1987.
10. Mullens W, Abrahams Z, Skouri HN, et al. Elevated Intra-Abdominal Pressure in Acute Decompensated Heart Failure. J Am Coll Cardiol. 2008;51(3):300-6. DOI:10.1016/j. jacc.2007.09.043.
11. Damman K, van Deursen VM, Navis G, et al. Increased Central Venous Pressure Is Associated With Impaired Renal Function and Mortality in a Broad Spectrum of Patients With Cardiovascular Disease. J Am Coll Cardiol. 2009;53(7):582-8. DOI:10.1016/j. jacc.2008.08.080.
12. Шутов А.М., Серов В.А. Кардиоренальный и ренокардиальный синдромы. Нефрология. 2009;13(4):59-63. DOI:10.24884/1561- 6274-2009-13-4-59-63.
13. Lawson CA, Testani JM, Mamas M, et al. Chronic kidney disease, worsening renal function and outcomes in a heart failure community setting: A UK national study. Int J Cardiol. 2018;267:120-7. DOI:10.1016/j.ijcard.2018.04.090.
14. Российское кардиологическое общество. Хроническая сердечная недостаточность. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4083]. DOI:10.15829/1560- 4071-2020-4083.
15. Rørth R, Jhund PS, Yilmaz MB, et al. Comparison of BNP and NT-proBNP in Patients With Heart Failure and Reduced Ejection Fraction. Circ Hear Fail. 2020;13(2):e006541. DOI:10.1161/CIRCHEARTFAILURE.119.006541.
16. Ларина В.Н., Лунев В.И. Значение биомаркеров в диагностике и прогнозировании сердечной недостаточности в старшем возрасте. Архивъ внутренней медицины. 2021;11(2):98-110. DOI:10.20514/2226-6704-2021-11-2-98-110.
17. McDowell K, Campbell R, Simpson J, et al. Incremental prognostic value of biomarkers in PARADIGM‐HF. Eur J Heart Fail. 2023;25(8):1406-14. DOI:10.1002/ejhf.2887.
18. Meijers WC, Bayes‐Genis A, Mebazaa A, et al. Circulating heart failure biomarkers beyond natriuretic peptides: review from the Biomarker Study Group of the Heart Failure Association, European Society of Cardiology. Eur J Heart Fail. 2021;23(10):1610-32. DOI:10.1002/ejhf.2346.
Об авторах
Н. Н. ИловРоссия
Илов Николай Николаевич - доцент кафедры сердечно-сосудистой хирургии, к.м.н., врач-сердечно-сосудистый хирург отделения хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции
Астрахань
О. В. Петрова
Россия
Петрова Ольга Владимировна - заведующая клинико-диагностической лабораторией - врач клинической лабораторной диагностики
Астрахань
Д. К. Твердохлебова
Россия
Твердохлебова Диана Камильевна - врач клинической лабораторной диагностики
Астрахань
И. Р. Каримов
Россия
Каримов Ильфат Рамилевич - клинический ординатор кафедры сердечно-сосудистой хирургии
Астрахань
А. А. Нечепуренко
Россия
Нечепуренко Анатолий Анатольевич - заведующий отделением хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции, к.м.н.
Астрахань
С. А. Бойцов
Россия
Бойцов Сергей Анатольевич - генеральный директор ФГБУ «НМИЦ Кардиологии» Минздрава России, академик РАН, профессор, д.м.н.
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Илов Н.Н., Петрова О.В., Твердохлебова Д.К., Каримов И.Р., Нечепуренко А.А., Бойцов С.А. Использование биомаркеров в прогнозировании смертности от осложнений сердечно-сосудистых заболеваний у пациентов с хронической сердечной недостаточностью и имплантированным кардиовертером-дефибриллятором. Рациональная Фармакотерапия в Кардиологии. 2023;19(4):359-366. https://doi.org/10.20996/1819-6446-2023-2938. EDN: YUSZMT
For citation:
Ilov N.N., Petrova O.V., Tverdokhlebova D.K., Karimov I.R., Nechepurenko A.A., Boytsov S.A. Biomarkers in predicting mortality from cardiovascular events in patients with heart failure and an implanted cardioverter-defibrillator. Rational Pharmacotherapy in Cardiology. 2023;19(4):359-366. (In Russ.) https://doi.org/10.20996/1819-6446-2023-2938. EDN: YUSZMT

















































