Перейти к:
Влияние полиморфизмов генов CYP3A4/5, ABCB1 на остаточную равновесную концентрацию апиксабана и развитие кровотечений у пациентов с неклапанной фибрилляцией предсердий и тромбозом глубоких вен
https://doi.org/10.20996/1819-6446-2024-2941
Аннотация
Цель. Изучение влияния полиморфных маркеров генов CYP3A4*22 (c.522-191C>T, rs35599367), CYP3A5*3 (c.219-237A>G, rs776746), ABCB1 rs1045642 (c.3435T>C) и rs4148738 (c.2692-2236C>T) на плазменную концентрацию апиксабана, на изменение протромбинового времени (ПВ), активированного частичного тромбопластинового времени (АЧТВ) и развитие кровотечений у пациентов, принимающих апиксабан.
Материал и методы. В исследование включены 108 пациентов с неклапанной фибрилляцией предсердий (ФП) и тромбозом глубоких вен (ТГВ), получающих апиксабан в терапевтических дозах. Генотипирование осуществляли методом полимеразной цепной реакции в режиме реального времени. Измерение концентраций апиксабана проводилось с помощью масс-спектрометра с ионизацией электроспреем в режиме положительной ионизации. Поскольку суточная доза апиксабана была различной (5, 10 и 20 мг в сутки), остаточная равновесная концентрация (Сmin,ss) апиксабана была скорректирована относительно суточной дозы лекарственного средства (Сmin,ss/D). Показатели ПВ и АЧТВ определялись с помощью автоматического анализатора-коагулометра Destiny Max (Tcoag, Ирландия). Статистическая обработка проводилась в программе SPSS Statistics 20.0.
Результаты. У пациентов с генотипом СТ ABCB1 (rs4148738) C>T значение Сmin,ss /D, было выше, чем у пациентов с генотипом TT (6,23 [4;13] против 5,77 [4;17] p=0,018). Не было обнаружено статистически значимых ассоциаций между носительством полиморфизмов генов CYP3A4*22 (rs35599367) C>T, CYP3A5*3 A>G, ABCB1 (rs1045642) C>T и значением Сmin,ss/D апиксабана. Также не было обнаружено статистически значимого влияния носительства полиморфизмов rs35599367, rs776746, rs4148738, rs4148642 и вышеуказанных генов на риски развития геморрагических осложнений. Однако, было установлено влияние полиморфизма ABCB1 (rs1045642) C>T на значение ПВ (у носителей генотипа TT ABCB1 (rs1045642) C>T значение ПВ было статистически значимо выше, чем у генотипа CT (17,0 [40;112] против 14,9 [35;132]), p=0,044).
Заключение. Было обнаружено, что у пациентов с генотипом СТ ABCB1 (rs4148738) C>T значение Сmin,ss /D, было выше, чем у пациентов с генотипом TT. При этом носительство полиморфизмов генов CYP3A4*22 (rs35599367) C>T, CYP3A5*3 A>G, ABCB1 (rs1045642) C>T не влияло на фармакокинетику апиксабана и риски развития кровотечений. Также выявлено влияние полиморфизма гена ABCB1 (rs1045642) C>T на значение ПВ.
Ключевые слова
Для цитирования:
Федина Л.В., Сычев И.Н., Мирзаев К.Б., Варданян А.В., Глаголев С.В., Качанова А.А., Бочков П.О., Шевченко Р.В., Тучкова С.Н., Сычев И.В., Абдуллаев Ш.П., Сычев Д.А. Влияние полиморфизмов генов CYP3A4/5, ABCB1 на остаточную равновесную концентрацию апиксабана и развитие кровотечений у пациентов с неклапанной фибрилляцией предсердий и тромбозом глубоких вен. Рациональная Фармакотерапия в Кардиологии. 2024;20(1):19-26. https://doi.org/10.20996/1819-6446-2024-2941
For citation:
Fedina l.V., Sychev i.N., Mirzaev K.V., Vardanyan A.V., Glagolev S.V., Kachanova A.A., Bochkov P.O., Shevchenko R.V., Tuchkova S.N., Sychev I.V., Abdullaev S.P., Sychev D.A. Effect of CYP3A4/5, ABCB1 gene polymorphisms on the residual equilibrium concentration of apixaban and bleeding in patients with non-valvular atrial fibrillation and deep vein thrombosis. Rational Pharmacotherapy in Cardiology. 2024;20(1):19-26. (In Russ.) https://doi.org/10.20996/1819-6446-2024-2941
Введение
С момента своего появления в клинической практике прямые пероральные антикоагулянты (ПОАК), способные блокировать отдельные и специфические этапы коагуляционного каскада, в частности тромбин (фактор IIa) или фактор Стюарта (Ха), в значительной степени заменили варфарин в качестве основного перорального антикоагулянта для предотвращения тромбоэмболических осложнений [1]. Хотя варфарин остается самым часто применяемым пероральным антикоагулянтом, объемы его назначений сократились более чем на 50% (с ~30 млн в 2011 г. до 14,6 млн в 2019 г.) [2]. Эта ситуация во многом обусловлена ростом использования ривароксабана (8,7 млн в 2019 г.) и апиксабана (14 млн в 2019 г.) и ожидается, что эта тенденция сохранится, так как по сравнению с варфарином ПОАК имеют множество преимуществ, включая быстрое начало действия, отсутствие взаимодействий с пищей, меньшее количество лекарственных взаимодействий, предсказуемую фармакокинетику и фармакодинамику [2-4].
Кроме того, завершенные рандомизированные исследования III фазы у пациентов с неклапанной фибрилляцией предсердий (ФП), тромбозом глубоких вен (ТГВ) и легочной эмболией показали, что ПОАК были столь же эффективными, а в некоторых случаях и превосходили варфарин по общему профилю безопасности, постоянно снижая частоту клинически значимых кровотечений [5-7]. Последующий метаанализ подтвердил эти выводы и показал, что ПОАК ассоциируются со значительным общим относительным снижением риска крупных кровотечений на 39% [8]. Но несмотря на многочисленные преимущества, кровотечения и тромбоэмболические события остаются серьезной проблемой при использовании ПОАК [9, 10]. К примеру, риск больших кровотечений во время лечения ПОАК оценивается в 2-3% в год, риск внутричерепного кровоизлияния оценивается примерно в 0,1-0,5% в год, а риск большого желудочно-кишечного кровотечения в 1-1,5% [11].
В основном апиксабан метаболизируется до неактивных метаболитов семейством цитохромов P450 в печени CYP3A4/5, с незначительным вкладом других изоферментов CYP1A2, CYP2C8, CYP2C9, CYP2C19 и CYP2J2 [12]. Кроме того все, ПОАК в том числе и апиксабан, являются субстратами P-гликопротеина (кодируется геном ABCB1) [13]. Этот мембранный белок транспортирует многие лекарственные средства [14]. Следовательно, генетические полиморфизмы CYP3A4/5, CYP2J2, ABCB1 и ABCG2 могут влиять на функционирование этих изоферментов и изменять фармакокинетику апиксабана, что влияет на безопасность и эффективность антикоагулянтной терапии [11].
Например, одно исследование выявило связь между интронным вариантом rs4148738 гена ABCB1, кодирующим P-gp, и увеличением пиковой концентрации апиксабана [15]. В другом исследовании варианты 1236C>T (rs1128503), 2677G>T (rs2032582) и 3435C>T (rs1045642) гена ABCB1 не влияли на соотношение концентрация/доза апиксабана [16]. Что касается CYP3A, то носительство генотипов CYP3A5*1/*3 или *3/*3 ассоциировалось с увеличением соотношения концентрация/доза апиксабана по сравнению с CYP3A5*1/*1 [16][17].
На сегодняшний день недостаточно исследований, посвященных изучению влияния этих полиморфных вариантов на эффективность или безопасность терапии апиксабаном, к тому результаты этих исследований довольно противоречивы [18].
Необходимо дополнительно изучить влияние генетических факторов на фармакокинетику апиксабана для более эффективной и безопасной антикоагулянтной терапии на основе такой клинико-фармакологической технологии персонализированной медицины, как фармакогенетическое тестирование. Поэтому целью нашего исследования стало изучение влияния полиморфных маркеров генов CYP3A4*22 (c.522-191C>T, rs35599367), CYP3A5*3 (c.219-237A>G, rs776746), ABCB1 rs1045642 (c.3435T>C) и rs4148738 (c.2692-2236C>T) на плазменную концентрацию апиксабана, на изменение протромбинового времени (ПВ), активированного частичного тромбопластинового времени (АЧТВ) и развитие кровотечений у пациентов, принимающих апиксабан.
Материал и методы
Дизайн исследования и популяция пациентов
В открытое проспективное обсервационное исследование было включено 108 пациентов, получающих апиксабан в терапевтических дозах с неклапанной ФП и ТГВ. В исследовании принимали участие пациенты, госпитализированные в ГКБ им. С. С. Юдина и ГКБ им. С. П. Боткина. Критерии включения: подтверждённый диагноз неклапанной ФП (отсутствие искусственных клапанов сердца); подтверждённый диагноз ТГВ; подтверждённый диагноз тромбоэмболии лёгочной артерии и приём апиксабана в рекомендованных дозах. Критериями невключения были: повышенная чувствительность к апиксабану или вспомогательным компонентам препарата; подтверждённый диагноз клапанной ФП (наличие искусственных клапанов сердца или митрального стеноза); нарушение функции почек с клиренсом креатинина менее 15 мл/мин или процедура диализа; тяжёлая печеночная недостаточность класс В, С по Чайлд-Пью; геморрагический синдром, активное внутреннее кровотечение, внутричерепное кровоизлияние; врождённый дефицит лактазы, непереносимость лактозы, глюкозо-галактозная мальабсорбция; возраст до 18 лет; беременность или период грудного вскармливания. Все пациенты получали апиксабан (в дозах 2,5 мг 2 раза в сутки, 5 мг 2 раза в сутки, 10 мг 2 раза в сутки) в соответствии с инструкцией по применению препарата. Информированное согласие было получено от всех участников, включенных в исследование. Исследование было одобрено заседанием локального этического комитета ФГБОУ ДПО РМАНПО Российской медицинской академией непрерывного профессионального образования Минздрава России (Протокол № 12 от 20 октября 2021 г.) и проводилось в соответствии с Хельсинкской декларацией.
Определение концентрации апиксабана в плазме
Для определения концентрации препарата выполнялось взятие венозной крови в вакуумные пробирки с антикоагулянтом ЭДТА-К3 Improvacuter (Guangzhou Improve Medical Instruments Co.Ltd, Китай) емкостью 6 мл на 4-7 сутки приема апиксабана. С целью получения плазмы образцы крови центрифугировались при 3000 об./мин в течении 15 минут. Выделенная плазма аликвотировалась в пробирки типа "Эппендорф" и замораживалась при температуре -70 °C до момента проведения анализа.
Концентрацию апиксабана в плазме определяли методом хроматографии с масс-спектрометрической детекцией на высокоэффективном жидкостном хроматографе Agilent G1978B Multimode Sourse for 6410 Triple Quade LC/MS (Agilent Technologies, Inc., USA, 2008).
Количественное определение апиксабана в образцах плазмы крови человека методом высокоэффективной жидкостной хроматографии — тандемной масс-спектрометрии основано на извлечении аналита из плазмы путем осаждения белков плазмы крови ацетонитрилом с последующим их определением с помощью ВЭЖХ-МС/МС системы. Поскольку суточная доза апиксабана была различной (5, 10 и 20 мг в сутки), остаточная равновесная концентрация (Сmin,ss) апиксабана была скорректирована относительно суточной дозы лекарственного средства (Сmin,ss/D).
Определение полиморфизмов генов
На базе научно-исследовательского института молекулярной и персонализированной медицины ФГБОУ ДПО РМАНПО Минздрава России проводилось выделение ДНК из цельной венозной крови с помощью набора реагентов "S-Сорб" (ООО "Синтол", Россия).
Затем, методом полимеразной цепной реакции в реальном времени на ДНК-амплификаторе CFX96 Touch™ Real-Time PCR Detection System (Bio-Rad Laboratories, Inc.; USA), с использованием коммерческих наборов реактивов ("Синтол", Россия; "Thermo Fisher Scientific", США) производилось генотипирование полиморфизмов CYP3A4*22 (rs35599367) C>T, CYP3A5*3 A>G, ABCB1 (rs4148738) C>T, ABCB1 (rs1045642) C>T. Для отбора генов-кандидатов в исследование использовали данные по фармакокинетике и фармакодинамике из инструкции по применению препарата и базы данных PharmGKB1.
Определение ПВ и АЧТВ
Оценка фармакодинамики апиксабана производилась посредством определения ПВ и АЧТВ. Взятие венозной крови осуществлялось перед очередным приёмом апиксабана на 4-7 сутки от начала приёма препарата с использованием вакуумных пробирок VACUTEST® (KIMA, Италия) c K3ЭДТА. Показатели ПВ и АЧТВ определялись с помощью автоматического анализатора-коагулометра Destiny Max (Tcoag, Ирландия).
Статистическая обработка данных
Статистическая обработка проводилась с помощью пакета программ SPSS Statistics 20.0. Характер распределения данных оценивали с помощью критерия Шапиро-Уилка. Для сравнения количественных переменных между группами применялись непараметрические критерии (Манна-Уитни, Крускала-Уоллеса). Средние значения представлены в результатах как медиана и квартили — Me [Q1; Q3]. Частоту категориальных переменных сравнивали между собой при помощи критерия Хи-квадрат Пирсона или точного критерия Фишера. Для коррекции множественных сравнений вводилась поправка Бонферрони. Расчет соответствия распределения генотипов закону Харди-Вайнберга был выполнен при помощи онлайн-калькулятора [19]. Результаты с p<0,05 считали статистически значимыми.
Результаты
Общая характеристика пациентов, включенных в исследование, представлена в табл. 1. Количество пациентов мужского пола составило 51,9%, а медиана возраста — 70,0 [ 60;79] лет. Число пациентов, принимающих апиксабан в дозе 2,5 мг 2 раза в сутки составило 13,9%, а в дозе 5 мг 2 раза в сутки и 10 мг 2 раза в сутки — 43,5% и 42,6% соответственно.
Распределение частот аллелей трех генов соответствовало равновесию Харди-Вайнберга при значении р>0,05 (табл. 2).
При оценке сопоставимости сравниваемых групп пациентов, статистически значимые различия по клиническим и лабораторным факторам, которые могли повлиять на основные и вторичные исходы, были получены для пациентов с ABCB1 (rs4148738) C>T, которые являлись носителями аллельного варианта CС, у них исходно был выше уровень гемоглобина, по сравнению с пациентами носителями генотипа СT (134 [ 123;154] против 130 [ 117;145]) p=0,046. Также у пациентов с аллельным вариантом TT по полиморфному маркеру ABCB1 (rs4148738) C>T в 3 раза реже встречалась анемия 22,5% против 70,0% p=0,007. Пациенты с генотипом CC ABCB1 (rs1045642) C>T имели исходно более высокий уровень тромбоцитов (247 [ 228;291] против 197 [ 165;239]) p=0,030, а также в два раза чаще в анамнезе имели острое нарушение мозгового кровообращения (ОНМК)/транзиторную ишемическую атаку 25,0% против 50,0% p=0,032.
Влияние полиморфизма генов на концентрацию в плазме
Всего в этом исследовании было исследовано 4 однонуклеотидных полиморфизма (SNP), включая ABCB1 (2 SNP), CYP3A4/5 (2 SNP). При анализе Краскела-Уоллиса была обнаружена ассоциация между носительством генотипа ABCB1 (rs4148738) C>T и Сmin,ss /D апиксабана p=0,018 (табл. 3). У пациентов с генотипом СТ ABCB1 (rs4148738) C>T значение Сmin,ss /D, было выше, чем у пациентов с генотипом TT (6,23 [ 4;13] против 5,77 [ 4;17]). Не было установлено, что полиморфизмы генов CYP3A4*22 (rs35599367) C>T, CYP3A5*3 A>G, ABCB1 (rs1045642) C>T оказывают значимое влияние на Сmin,ss /D апиксабана (см. табл. 3).
Влияние полиморфизма генов на значения АЧТВ и ПВ
Пациенты с полиморфизмом гена CYP3A4*22 (rs35599367) C>T были разделены на две группы: СС n=8 (95,4%) и СТ n=17 (4,6%), носителей ТТ в выборке обнаружено не было. При анализе Манна-Уитни не было обнаружено статистически значимых ассоциаций между носительством полиморфизма и значениями АЧТВ и ПВ (табл. 4).
Пациенты с полиморфизмом гена CYP3A5*3 A>G также были разделены на две группы: AG n=8 (9,3%) и GG n=17 (90,7%). В данном случае при анализе не было обнаружено статистически значимых ассоциаций между носительством полиморфизма и значениями АЧТВ и ПВ (см. табл. 4).
Пациенты с полиморфизмами генов ABCB1 (rs1045738) C>T и ABCB1 (rs1045642) C>T были разделены на три группы. У носителей генотипа TT ABCB1 (rs1045642) C>T значение ПВ была статистически значимо выше, чем у генотипа CT (17,0 [ 40;112] против 14,9 [ 35;132]) p=0,044 (см. табл. 4). При этом не было обнаружено статистически значимых ассоциаций между носительством полиморфизма ABCB1 (rs4148738) C>T и значениями АЧТВ и ПВ (см. табл. 4).
Влияние полиморфизмов генов на возникновение кровотечений у пациентов с ФП и ТГВ
За время наблюдения в общей сложности было зафиксировано 36 геморрагических событий. Все кровотечения были неспровоцированными. Наиболее часто у пациентов регистрировалась гематурия (61%). Структура геморрагических осложнений представлена на рис. 1.
Нами были проанализированы пациенты с геморрагическими событиями на предмет носительства полиморфизмов генов CYP3A4/5 и ABCB1. Статистически значимого влияния носительства полиморфизмов rs35599367, rs776746, rs4148738 и rs4148642 вышеуказанных генов на риск развития геморрагических осложнений выявлено не было (табл. 5).
Таблица 1. Клинико-демографические характеристики пациентов с ФП и ТГВ
|
Показатель |
Характеристика пациентов, включенных в исследование |
|
Возраст, в годах |
70,0 [ 60;79] |
|
Mужчины, n (%) |
56 (51,9) |
|
Женщины, n (%) |
52 (48,1) |
|
СКФ, мл/мин/1,73 м2 |
63,39 [ 45;93] |
|
HAS-BLED, баллы |
2 [ 2;3] |
|
Гемоглобин, г/л |
126,6 [ 113;141] |
|
Тромбоциты, 10*9/л |
227,0 [ 178;295] |
|
Протромбиновое время, с |
16,2 [ 13;19] |
|
АЧТВ, с |
30,2 [ 27;34] |
|
ФП, n (٪) |
54 (50) |
|
ТГВ, n (٪) |
54 (50) |
|
Индекс массы тела, кг/м2 |
28,15 [ 26;32] |
|
Ишемическая болезнь сердца, n (٪) |
69 (63,9) |
|
ОНМК в анамнезе, n (٪) |
8 (7,4) |
|
Артериальная гипертензия, n (٪) |
78 (72,2) |
|
Сахарный диабет, n (٪) |
31 (28,7) |
|
Хроническая сердечная недостаточность, n (٪) |
61 (56,5) |
|
Анемия, n (٪) |
40 (37,0) |
|
Доза апиксабана: 2,5 мг 2 раза в сутки, n (٪) 5 мг 2 раза в сутки, n (٪) 10 мг 2 раза в сутки, n (٪) |
15 (13,9) 47 (43,5) 46 (42,6) |
|
Сmin,ss, нг/мл |
76,7 [ 49;128] |
|
Сmin,ss /D, нг/мл/мг |
5,82 [ 3;12] |
|
Данные указаны в виде Me [ 25٪;75٪]. СКФ — скорость клубочковой фильтрации, ФП — |
|
Таблица 2. Распределение частот генотипов изученных полиморфных вариантов с результатами анализа на соответствие распределению по Харди-Вайнбергу
|
Полиморфизм гена |
Генотип |
n |
% |
Chi-Square |
P |
|
CYP3A4*22 (rs35599367) C>T |
CC CT |
103 5 |
95,4 4,6 |
0,06 |
0,97 |
|
CYP3A5*3 A>G |
GG AG |
98 10 |
90,7 9,3 |
0,25 |
0,88 |
|
ABCB1 (rs4148738) C>T |
CC CT TT |
20 55 33 |
18,5 50,9 30,6 |
0,12 |
0,94 |
|
ABCB1 (rs1045642) C>T |
CC CT TT |
19 25 64 |
17,6 23,1 59,3 |
20,89 |
0,000029 |
Таблица 3. Ассоциация носительства полиморфизмов генов CYP3A4/5 и ABCB1 с равновесной концентрацией апиксабана
|
Однонуклеотидный полиморфизм (SNP) |
Генотип |
Сmin,ss /D, нг/мл/мг Me [ 25٪;75٪] |
P |
||
|
CYP3A4*22 (rs35599367) C>T |
CC (n=103) CT (n=5) |
5,87 [ 4;12] 4,5 [ 2;14] |
0,497 |
||
|
CYP3A5*3 A>G |
AG (n=10) GG (n=98) |
6,89 [ 5;15] 5,60 [ 3;12] |
0,261 |
||
|
ABCB1 (rs4148738) C>T |
CC (n=20) CT (n=55) TT (n=33) |
5,42 [ 3;9] 6,23 [ 4;13] 5,77 [ 4;17] |
P1-2 |
Р1-3 |
P2-3 |
|
0,759 |
0,595 |
0,018* |
|||
|
ABCB1 (rs1045642) C>T |
CC (n=19) CT (n=64) TT (n=25) |
5,77 [ 2;7] 6,17 [ 3;13] 5,67 [ 3;11] |
P1-2 |
Р1-3 |
P2-3 |
|
0,736 |
0,731 |
0,661 |
|||
Таблица 4. Ассоциация носительства полиморфизмов генов CYP3A4/5 и ABCB1 со значениями АЧТВ и ПВ
|
Однонуклеотидный полиморфизм (SNP) |
Генотип |
АЧТВ |
ПВ |
P |
||
|
CYP3A4*22 (rs35599367) C>T |
CC (n=103) CT (n=5) |
30,2 [ 27;34] 31,2 [ 26;32] |
16,2 [ 13;19] 16,7 [ 13;24] |
0,720 0,715 |
||
|
CYP3A5*3 (rs776746) A>G |
AG (n=10) GG (n=98) |
30,1 [ 25;33] 30,2 [ 27;34] |
15,1 [ 13;26] 16,2 [ 14;18] |
0,458 0,845 |
||
|
ABCB1 (rs4148738) C>T |
CC (n=20) CT (n=55) TT (n=33) |
30,1 [ 27;35] 30,1 [ 27;33] 31,5 [ 27;34] |
16,6 [ 14;18] 16,0 [ 13;18] 15,9 [ 14;20] |
P1-2 |
Р1-3 |
P2-3 |
|
0,654 |
0,811 |
0,336 |
||||
|
0,730 |
0,862 |
0,482 |
||||
|
ABCB1 (rs1045642) C>T |
CC (n=19) CT (n=64) TT (n=25) |
31,3 [ 48;123] 30,2 [ 52;137] 29,7 [ 46;127] |
14,9 [ 24;67] 14,9 [ 35;132] 17,0 [ 40;112] |
P1-2 |
Р1-3 |
P2-3 |
|
0,770 |
0,652 |
0,964 |
||||
|
0,198 |
0,434 |
0,044* |
||||
|
Данные указаны в виде Me [ 25٪;75٪]. |
||||||
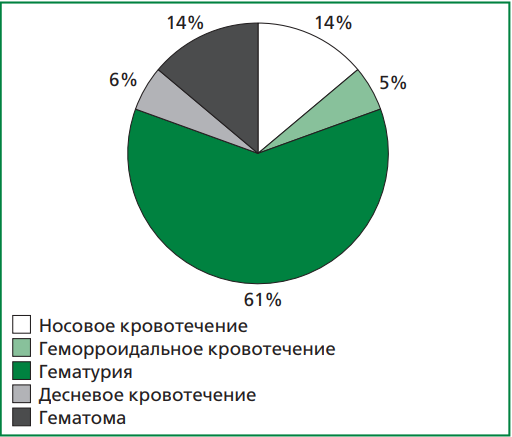
Рисунок 1. Структура геморрагических осложнений
Таблица 5. Влияние полиморфизмов генов CYP3A4/5 и ABCB1 на частоту развития геморрагических осложнений
|
Однонуклеотидный полиморфизм (SNP) |
Генотип |
Без кровотечений (n = 72) |
С кровотечением (n = 36) |
P |
|
CYP3A4*22 (rs35599367) C>T |
CC (n=103) |
68 (66,0٪) |
35 (34,0٪) |
0,517 |
|
CT (n=5) |
4 (80,0٪) |
1 (20,0٪) |
||
|
CYP3A5*3 (rs776746) A>G |
AG (n=10) |
6 (60,0٪) |
4 (40,0٪) |
0,639 |
|
GG (n=98) |
66 (67,3٪) |
32 (32,7٪) |
||
|
ABCB1 (rs4148738) C>T |
CC (n=20) |
16 (80,0٪) |
4 (20,0٪) |
0,336 |
|
CT (n=55) |
34 (61,8٪) |
21 (38,2٪) |
||
|
TT (n=33) |
22 (66,7٪) |
11 (33,3٪) |
||
|
ABCB1 (rs1045642) C>T |
CC (n=19) |
14 (73,7٪) |
5 (26,3٪) |
0,309 |
|
CT (n=64) |
39 (60,9٪) |
25 (39,1٪) |
||
|
TT (n=25) |
19 (76,0٪) |
6 (24,0٪) |
Обсуждение
Персонализация терапии ПОАК, в том числе апиксабаном, является ведущей задачей для обеспечения эффективности и безопасности применения этих препаратов [20]. Важную роль в вариабельности фармакокинетики играют полиморфизмы генов ферментов биотрансформации (СУР3А4/5) а также белков-переносчиков (P-gp) [21].
Ген ABCB1 кодирует эффлюксный насос P-gp, а все ПОАК являются субстратами P-gp. Поэтому ABCB1 является наиболее часто исследуемым геном для оценки взаимосвязи носительства конкретных аллельных вариантов с риском нежелательных лекарственных реакций на фоне терапии ПОАК, и прежде всего — кровотечений [2]. Предыдущие небольшие исследования показали, что минорный аллель ABCB1 rs4148738 был связан с более низкими пиковыми концентрациями апиксабана и более низким риском кровотечений у пациентов, получающих антикоагулянтную терапию апиксабаном [15][22][23]. Однако, эти результаты не подтвердились в более крупном исследовании, в котором проанализировали данные пациентов, участвовавших в третьей фазе крупного клинического исследования апиксабана [11]. В нашем исследовании обнаружено, что у пациентов с генотипом СТ ABCB1 (rs4148738) C>T значение Сmin,ss /D, было выше, чем у пациентов носителей гомозиготы TT, что скорее похоже на результаты, полученные C. Dimatteo и соавт. [15].
Из полиморфизмов генов, кодирующих ферменты биотрансформации CYP3A4/5, наиболее изучена роль нефункционального аллеля G (rs776746) гена CYP3A5. В то же время у гетерозиготных носителей (генотип AG) метаболизм апиксабана умеренно снижен из-за носительства одного нефункционального аллеля G, а у гетерозиготных носителей (CYP3A5 * 3, генотип GG) изофермент CYP3A5 не экспрессируется. Это является фактором риска развития нежелательных реакций (в частности, кровотечений) при приеме апиксабана [16]. S. Ueshima и соавт. обнаружили, что пациенты с ФП и гомозиготным генотипом TT (rs77674) гена CYP3A5 могли иметь пониженные концентрации апиксабана в крови по сравнению с пациентами с генотипами CC и CT. Следовательно, носительство аллеля Т может быть связано с повышенным клиренсом апиксабана [16]. Однако это исследование проводилось в азиатской популяции пациентов, что не позволяет экстраполировать результаты на другие этнические группы. В другом, более крупном исследовании, в котором проанализировали данные пациентов, участвовавших в третьей фазе клинического исследования апиксабана (ARISTOTLE) [11] авторы не повторили результаты исследования S. Ueshima и соавт. [16]. Эти расхождения, вероятно, можно объяснить с более надежными оценками воздействия апиксабана, большим размером выборки и достаточной мощностью исследованием. В другом небольшом российском исследовании А. В. Крюкова и соавт. не было найдено статистически значимых ассоциаций между фармакокинетикой апиксабана и полиморфизмом гена CYP3A5 rs776746 [24]. Результаты нашего исследования показали, что полиморфизмы генов CYP3A4*22 (rs35599367) C>T, CYP3A5*3 A>G не влияли на фармакокинетику апиксабана и риски развития геморрагических осложнений, что согласуется с результатами исследований, процитированных выше. Тем не менее дозирование апиксабана следует проводить с осторожностью и мониторировать нежелательные побочные реакций у пациентов, не экспрессирующих CYP3A5 (гомозиготных носителей нефункциональных аллелей).
При отсутствии возможности измерения активности Ха-фактора и равновесных концентраций ПОАК, доступной опцией для оценки безопасности и эффективности применения ПОАК в условиях стационара может быть измерение АЧТВ и ПВ [20]. Дабигатран может в большей степени удлинять АЧТВ, ривароксабан — ПВ [25]. В терапевтических дозах апиксабан вызывает небольшое удлинение АЧТВ и ПВ, но имеет высокую степень вариабельности [25]. Однако существует умеренная корреляция между концентрацией ПОАК и наблюдаемым изменением гемостаза. В нашем исследовании мы оценили влияние полиморфизмов генов CYP3A4*22 (c.522-191C>T, rs35599367), CYP3A5*3 (c.219-237A>G, rs776746), ABCB1 rs1045642 (c.3435T>C) и rs4148738 (c.2692-2236C>T) на показатели АЧТВ и ПВ и установили, что у носителей гомозиготного генотипа TT ABCB1 (rs1045642) C>T значение ПВ было статистически значимо выше, чем у генотипа CT p=0,044, что может быть важным для клинической практики с учетом невысокой стоимости данного анализа.
Следует отметить, что выявлено несоответствие распространенности генотипов полиморфного варианта ABCB1 (rs1045642) C>T равновесию Харди-Вайнберга, что ограничивает практическую значимость результатов. Но полученные результаты, тем не менее, следует считать важными при сравнении с последующими исследованиями.
Заключение
В нашем исследовании полиморфный вариант ABCB1 (rs4148738) C>T значимо ассоциировался со значением Сmin,ss/D. При этом мы не обнаружили статистически значимых ассоциаций между носительством полиморфизмов генов CYP3A4*22 (rs35599367) C>T, CYP3A5*3 A>G, ABCB1 (rs1045642) C>T и значением Сmin,ss/D апиксабана. Также мы не обнаружили статистически значимого влияния носительства полиморфизмов rs35599367, rs776746, rs4148738 и rs4148642 вышеуказанных генов на риски развития геморрагических осложнений. Однако, было установлено влияние полиморфизма ABCB1 (rs1045642) C>T на значение ПВ.
Для оптимизации клинической эффективности и максимальной безопасности современной антикоагулянтной терапии необходим системный индивидуальный подход на основе фармакокинетических исследований и фармакогенетического тестирования, которые позволят прогнозировать и профилактировать развитие геморрагических осложнений у пациентов, принимающих ПОАК, поэтому необходимы дальнейшие исследования в этой области.
Отношение и Деятельность. Нет.
Relationships and Activities. None.
Финансирование исследования: Работа выполнена при поддержке гранта Российского научного фонда 22-15-00251 №122060600001-4, "Персонализированное применение прямых пероральных антикоагулянтов на основе фармакогеномного подхода". Авторы не имеют других соответствующих связей или финансового участия с какой-либо организацией или предприятием, имеющим финансовый интерес или финансовый конфликт с предметом или материалами, обсуждаемыми в рукописи, кроме тех, которые были раскрыты.
Funding: This work was supported by Russian Science Foundation grant 22-15-00251 №122060600001-4, "Personalized Use of Direct Oral Anticoagulants Based on a Pharmacogenomic Approach". The authors have no other relevant affiliations or financial involvement with any organization or enterprise that has a financial interest or financial conflict with the subject matter or materials discussed in the manuscript, other than those disclosed.
1 PharmGKB. Available from: https://www.pharmgkb.org/.
Список литературы
1. Chaudhary R, Sharma T, Garg J, et al. Direct oral anticoagulants: a review on the current role and scope of reversal agents. J Thromb Thrombolysis. 2020;49(2):271-286. DOI:10.1007/s11239-019-01954-2
2. Thompson LE, Davis BH, Narayan R, et al. Personalizing Direct Oral Anticoagulant Therapy for a Diverse Population: Role of Race, Kidney Function, Drug Interactions, and Pharmacogenetics. Clin Pharmacol Ther. 2023;113(3):585-599. DOI:10.1002/cpt.2714.
3. Bounameaux H, Reber G. New oral antithrombotics: a need for laboratory monitoring. Against. J Thromb Haemost. 2010;8(4):627-630. DOI:10.1111/j.1538-7836.2010.03759.x.
4. Barnes GD, Lucas E, Alexander GC, Goldberger ZD. National Trends in Ambulatory Oral Anticoagulant Use. Am J Med. 2015;128(12):1300-5.e2. DOI:10.1016/j.amjmed.2015.05.044.
5. Connolly SJ, Ezekowitz MD, Yusuf S, et al; RE-LY Steering Committee and Investigators. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med. 2009;361(12):1139-51. DOI:10.1056/NEJMoa0905561.
6. Patel MR, Mahaffey KW, Garg J, et al; ROCKET AF Investigators. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med. 2011;365(10):883- 91. DOI:10.1056/NEJMoa1009638.
7. Granger CB, Alexander JH, McMurray JJ, et al; ARISTOTLE Committees and Investigators. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2011;365(11):981-92. DOI:10.1056/NEJMoa1107039.
8. van Es N, Coppens M, Schulman S, et al. Direct oral anticoagulants compared with vitamin K antagonists for acute venous thromboembolism: evidence from phase 3 trials. Blood. 2014;124(12):1968-1975. DOI:10.1182/blood-2014-04-571232.
9. Geller AI, Shehab N, Lovegrove MC, et al. Emergency Visits for Oral Anticoagulant Bleeding. J Gen Intern Med. 2020;35(1):371-373. DOI:10.1007/s11606-019-05391-y.
10. Shehab N, Lovegrove MC, Geller AI, et al. US Emergency Department Visits for Outpatient Adverse Drug Events, 2013-2014. JAMA. 2016;316(20):2115–2125. DOI:10.1001/jama.2016.16201.
11. Attelind S, Hallberg P, Wadelius M, et al. Genetic determinants of apixaban plasma levels and their relationship to bleeding and thromboembolic events. Front Genet. 2022;13:982955. DOI:10.3389/fgene.2022.982955.
12. Foerster KI, Hermann S, Mikus G, Haefeli WE. Drug-Drug Interactions with Direct Oral Anticoagulants. Clin Pharmacokinet. 2020;59(8):967-980. DOI:10.1007/s40262-020-00879-x.
13. Ahmed S, Zhou Z, Zhou J, Chen SQ. Pharmacogenomics of Drug Metabolizing Enzymes and Transporters: Relevance to Precision Medicine. Genomics Proteomics Bioinformatics. 2016;14(5):298-313. DOI:10.1016/j.gpb.2016.03.008.
14. Byon W, Garonzik S, Boyd RA, Frost CE. Apixaban: A Clinical Pharmacokinetic and Pharmacodynamic Review. Clin Pharmacokinet. 2019;58(10):1265-1279. DOI:10.1007/s40262-019-00775-z.
15. Dimatteo C, D’Andrea G, Vecchione G, et al. ABCB1 SNP rs4148738 modulation of apixaban interindividual variability. Thromb Res. 2016;145:24-26. DOI:10.1016/j.thromres.2016.07.005.
16. Ueshima S, Hira D, Fujii R, et al. Impact of ABCB1, ABCG2, and CYP3A5 polymorphisms on plasma trough concentrations of apixaban in Japanese patients with atrial fibrillation. Pharmacogenet Genomics. 2017;27(9):329-336. DOI:10.1097/FPC.0000000000000294.
17. Sherry ST, Ward MH, Kholodov M, et al. dbSNP: the NCBI database of genetic variation. Nucleic Acids Res. 2001;29(1):308-311. DOI:10.1097/FPC.0000000000000294.
18. Wu T, Wu S, Li L, et al. The impact of ABCB1, CYP3A4/5 and ABCG2 gene polymorphisms on rivaroxaban trough concentrations and bleeding events in patients with non-valvular atrial fibrillation. Hum Genomics. 2023;17(1):59. DOI:10.1186/s40246-023-00506-3.
19. Rodriguez S, Gaunt TR, Day INM. Hardy-Weinberg equilibrium testing of biological ascertainment for Mendelian randomization studies. Am J Epidemiol. 2009;169(4):505-514. DOI:10.1093/aje/kwn359.
20. Сычев И.Н., Федина Л.В., Осипов А.С., et al. Влияние полиморфизмов генов CYP3A4*22 (rs35599367) C > T, CYP3A5*3 (rs776746) A > G, ABCB1 (rs4148738) C > T и ABCB1 (rs1045642) C > T на антикоагулянтное действие апиксабана: результаты пилотного исследования. Медицинский Совет. 2021;(4):41-46. DOI:10.21518/2079-701X-2021-4-41-46.
21. Raymond J, Imbert L, Cousin T, et al. Pharmacogenetics of Direct Oral Anticoagulants: A Systematic Review. J Pers Med. 2021;11(1):37. DOI:10.3390/jpm11010037.
22. Lähteenmäki J, Vuorinen AL, Pajula J, et al. Pharmacogenetics of Bleeding and Thromboembolic Events in Direct Oral Anticoagulant Users. Clin Pharmacol Ther. 2021;110(3):768-776. DOI:10.1002/cpt.2316.
23. Shou W, Wang D, Zhang K, et al. Gene-wide characterization of common quantitative trait loci for ABCB1 mRNA expression in normal liver tissues in the Chinese population. PLoS One. 2012;7:e46295. DOI:10.1371/journal.pone.0046295.
24. Kryukov AV, Sychev DA, Andreev DA, et al. Influence of ABCB1 and CYP3A5 gene polymorphisms on pharmacokinetics of apixaban in patients with atrial fibrillation and acute stroke. Pharmgenomics Pers Med. 2018;11:43-49. DOI:10.2147/PGPM.S157111.
25. Conway SE, Hwang AY, Ponte CD, et al. Laboratory and Clinical Monitoring of Direct Acting Oral Anticoagulants: What Clinicians Need to Know. Pharmacotherapy 2017;37(2):236-248. DOI:10.1002/phar.1884.
Об авторах
Л. В. ФединаРоссия
Федина Людмила Владимировна, аспирант кафедры клинической фармакологии и терапии имени академика Б.Е. Вотчала
Баррикадная ул., 2/1, строение 1, Москва, 125993
И. Н. Сычев
Россия
Сычев Игорь Николаевич
Баррикадная ул., 2/1, строение 1, Москва, 125993
К. Б. Мирзаев
Россия
Мирзаев Карин Бадавиевич
Баррикадная ул., 2/1, строение 1, Москва, 125993
А. В. Варданян
Россия
Варданян Аршак Варданович
Баррикадная ул., 2/1, строение 1, Москва, 125993
С. В. Глаголев
Россия
Глаголев Сергей Владимирович
Рахмановский пер., д. 3, Москва, 127994
А. А. Качанова
Россия
Качанова Анастасия Алексеевна
Баррикадная ул., 2/1, строение 1, Москва, 125993
П. О. Бочков
Россия
Бочков Павел Олегович
Баррикадная ул., 2/1, строение 1, Москва, 125993
Р. В. Шевченко
Россия
Шевченко Роман Владимирович
Баррикадная ул., 2/1, строение 1, Москва, 125993
С. Н. Тучкова
Тучкова Светлана Николаевна
Баррикадная ул., 2/1, строение 1, Москва, 125993
И. В. Сычев
Россия
Сычев Иван Витальевич
Саранск
Ш. П. Абдуллаев
Россия
Абдуллаев Шерзод Пардабоевич
Баррикадная ул., 2/1, строение 1, Москва, 125993
Д. А. Сычев
Россия
Сычев Дмитрий Алексеевич
Баррикадная ул., 2/1, строение 1, Москва, 125993
Дополнительные файлы
Рецензия
Для цитирования:
Федина Л.В., Сычев И.Н., Мирзаев К.Б., Варданян А.В., Глаголев С.В., Качанова А.А., Бочков П.О., Шевченко Р.В., Тучкова С.Н., Сычев И.В., Абдуллаев Ш.П., Сычев Д.А. Влияние полиморфизмов генов CYP3A4/5, ABCB1 на остаточную равновесную концентрацию апиксабана и развитие кровотечений у пациентов с неклапанной фибрилляцией предсердий и тромбозом глубоких вен. Рациональная Фармакотерапия в Кардиологии. 2024;20(1):19-26. https://doi.org/10.20996/1819-6446-2024-2941
For citation:
Fedina l.V., Sychev i.N., Mirzaev K.V., Vardanyan A.V., Glagolev S.V., Kachanova A.A., Bochkov P.O., Shevchenko R.V., Tuchkova S.N., Sychev I.V., Abdullaev S.P., Sychev D.A. Effect of CYP3A4/5, ABCB1 gene polymorphisms on the residual equilibrium concentration of apixaban and bleeding in patients with non-valvular atrial fibrillation and deep vein thrombosis. Rational Pharmacotherapy in Cardiology. 2024;20(1):19-26. (In Russ.) https://doi.org/10.20996/1819-6446-2024-2941

















































