Перейти к:
Динамика биомаркеров дисфункции и повреждения миокарда на фоне химиотерапии множественной миеломы: трудности интерпретации лабораторных данных
https://doi.org/10.20996/1819-6446-2023-2955
EDN: XWEDYY
Аннотация
Цель. Изучение динамики уровней кардиальных биомаркеров — N-концевого фрагмента мозгового натрийуретического пептида (NT-prоBNP) и высокочувствительного тропонина I (hsTnI) — у пациентов с впервые установленной множественной миеломой (ММ) на фоне программного лечения с использованием бортезомиба (режим VCd).
Материал и методы. В проспективное пилотное исследование включены больные с впервые установленным диагнозом ММ (n=30), которым была запланирована курсовая химиотерапия (ХТ) с включением ингибитора протеасом (бортезомиб). Всем пациентам проведены стандартное лабораторное (клинический анализ крови, биохимическое исследование с электрофорезом белков сыворотки крови), инструментальное (электрокардиография, эхокардиографическое исследование) обследование, а также определен уровень специфических лабораторных маркеров дисфункции (NT-prоBNP) и повреждения (hsTnI) миокарда непосредственно перед лечением, после 3 и 6 курсов ХТ.
Результаты. Средний возраст больных с ММ составил 63,8±10 лет, несколько превалировали мужчины (n=17, 56,7%). У исследуемых пациентов исходно отмечался повышенный уровень NT-proBNP (316 [75,9; 602,6] пг/мл); на фоне терапии выявлено его снижение до 144,0 [102,3; 294,0] пг/мл после 3 курсов, до 109,2 [59,9; 344,5] пг/мл после 6 курсов ХТ. В дебюте онкогематологического заболевания средние значения hsTnI составили 0,06 [0,03; 0,49] нг/ мл, а на фоне 3 и 6 курсов ХТ — 0,02 [0,01-0,68] и 0,65 [0,02; 1,51] нг/мл соответственно, при норме менее 0,1 нг/мл (динамика для обоих маркеров не достигла уровня статистической значимости). Клинических и/или лабораторных признаков хронической сердечной недостаточности, ишемии, других некардиальных причин повышения уровня NT-proBNP в данной выборке больных не наблюдалось. При многофакторном регрессионном анализе выявлены следующие статистически значимые факторы, влияющие на исходный уровень hsTnI: парапротеин, гемоглобин и скорость оседания эритроцитов (СОЭ). Полученная регрессионная модель характеризовалась коэффициентом корреляции r=0,702, что соответствует высокой силе взаимосвязи (p<0,001).
Заключение. Наличие ММ с учетом патогенетических особенностей заболевания (в частности, парапротеинемии), может являться причиной трудности оценки уровней NT-proBNP и hsTnI в исследуемой группе пациентов до начала специфического лечения. Недостоверная оценка данных серологических маркеров до начала ХТ может способствовать неверной стратификации исходного кардиоваскулотоксического риска и затруднять выбор тактики ведения кардиологом/кардиоонкологом.
Ключевые слова
Для цитирования:
Фомина Е.В., Кардовская С.А., Буданова Д.А., Маркин П.А., Апполонова С.А., Лишута А.С., Беленков Ю.Н., Ильгисонис И.С. Динамика биомаркеров дисфункции и повреждения миокарда на фоне химиотерапии множественной миеломы: трудности интерпретации лабораторных данных. Рациональная Фармакотерапия в Кардиологии. 2023;19(5):425-434. https://doi.org/10.20996/1819-6446-2023-2955. EDN: XWEDYY
For citation:
Fomina E.V., Kardovskaya S.A., Budanova D.A., Markin P.A., Appolonova S.A., Lishuta A.S., Belenkov Yu.N., Ilgisonis I.S. Changes of myocardial dysfunction and injury biomarkers over chemotherapy for multiple myeloma: difficulties in laboratory data interpretation. Rational Pharmacotherapy in Cardiology. 2023;19(5):425-434. (In Russ.) https://doi.org/10.20996/1819-6446-2023-2955. EDN: XWEDYY
Введение
За последние два десятилетия достигнуты существенные успехи в разработке и внедрении в клиническую практику новых лекарственных агентов, позволяющих значительно расширить терапевтические возможности для пациентов со злокачественными новообразованиями, улучшить их отдаленный прогноз и качество жизни [1]. Выживаемость онкологических пациентов определяется не только клинико-биологической вариабельностью опухоли, стадией заболевания, глубиной и полнотой ответа на терапию, но и наличием коморбидности, в первую очередь, патологии сердечно-сосудистой системы (ССС). Предотвращение кардиоваскулярных осложнений противоопухолевой терапии, их своевременное выявление и лечение — предпосылки для возникновения на стыке двух дисциплин самостоятельного научно-клинического направления — кардиоонкологии. Представленные в 2022 году первые клинические рекомендации Европейского общества кардиологов (ЕОК) по кардиоонкологии четко формулируют критерии диагностики, клиническую значимость, степень тяжести основных видов кардиоваскулярной токсичности: миокардиальная дисфункция, ассоциированная с противоопухолевой терапией; миокардит, индуцированный терапией ингибиторами иммунных контрольных точек; сосудистая токсичность; артериальная гипертензия; нарушения ритма/проводимости [2].
Широко используемые кардиоспецифические маркеры дисфункции [мозговой натрийуретический пептид (BNP), N-концевого фрагмента мозгового натрийуретического пептида (NT-proBNP)] и повреждения (тропонины I, T) миокарда нашли свое применение и в отношении кардиоонкологических пациентов. Помимо стандартных клинико-инструментальных подходов (анамнез, оценка факторов риска сердечно-сосудистых заболеваний, физикальное обследование, 12-канальная электрокардиография, трансторакальное эхокардиографическое исследование (ЭхоКГ) указанные биомаркеры рекомендованы для оценки исходного кардиоонкологического риска, ранней диагностики и мониторинга кардиоваскулярных токсических эффектов, включая субклиническое повреждение миокарда, и также могут рассматриваться как предикторы неблагоприятного прогноза при отдельных злокачественных новообразованиях [2-4].
Множественная миелома (ММ) является вторым по распространенности онкогематологическим заболеванием в общемировой популяции [5-6]. Основа патогенеза ММ — инфильтрация костного мозга клональными плазматическими клетками, секретирующими патологический белок — парапротеин (М-протеин), что является ключевой особенностью данной нозологии. Наряду с электролитными нарушениями и анемией, парапротеинемия представляется одним из важных факторов повреждающего механизма ММ в отношении ССС. Циркуляция в сыворотке крови большого количества патологических иммуноглобулинов приводит не только к нарушению межбелковых взаимодействий, но и к синдрому повышенной вязкости, который характеризуется триадой признаков: геморрагический синдром, нарушения со стороны органа зрения и неврологические дефициты [7-8]. В отдельных случаях гипервискозный синдром может приводить к жизнеугрожающим событиям, например, тромбозам, в т.ч. в коронарном русле, или критической ишемии органов и тканей, что в свою очередь повышает сердечно-сосудистый риск больных.
Бортезомиб является первым таргетным противоопухолевым препаратом из группы ингибиторов протеасом, применение которого в комплексных схемах терапии позволило значительно повлиять на эффективность лечения и исходы пациентов с ММ [9-12]. Частота нежелательных явлений со стороны ССС при применении данного агента может достигать 17% [13]. Основными механизмами являются: ингибирование убиквитин-протеасомной системы в кардиомиоцитах и клетках эндотелия с последующим их апоптозом [14]; активация сигнального пути ядерного фактора энхансера гена κ-легкой цепи активированных В-клеток (nuclear factor κ-light chain-enhancer of activated B cells, NF-κB) в кардиальных фибробластах с развитием их гипертрофии, диастолической дисфункции миокарда; уменьшение синтеза эндотелиального релаксирующего фактора оксида азота (NO), гиперактивация процессов оксидативного стресса, развитие эндотелиальной дисфункции [15-16].
Принимая во внимание все вышесказанное, изучение динамики биомаркеров дисфункции и повреждения миокарда, как рекомендованных индикаторов кардиоваскулярной токсичности, у пациентов с ММ на фоне противоопухолевой терапии с включением бортезомиба представляется целесообразным для понимания механизмов его кардиотоксического действия, особенно субклинических изменений. Это также позволит оценить вклад самого парапротеинемического гемобластоза в изменение состояния ССС у данной коморбидной когорты больных, правильно интерпретировать получаемые лабораторные результаты в условиях нарушения межбелковых взаимодействий в сыворотке крови, успешно разрабатывать и применять методы мониторинга и предупреждения развития кардиоваскулярной токсичности.
Цель исследования — изучить динамику уровней кардиальных биомаркеров — NT-prоBNP и высокочувствительного тропонина I (hsTnI) — у пациентов с впервые установленной ММ на фоне программного лечения с использованием бортезомиба.
Материал и методы
В наблюдательное исследование были включены 30 пациентов с впервые установленным диагнозом ММ в возрасте 50-75 лет, которым было запланировано проведение химиотерапии (ХТ) первой линии по протоколу VCd (бортезомиб, циклофосфамид, дексаметазон). Диагноз ММ был верифицирован согласно "Клиническим рекомендациям по диагностике и лечению множественной миеломы" Минздрава России 2020 года [17]. Критерии невключения: гистологически и/или иммуногистохимически подтвержденный амилоидоз или критерии, позволяющие предполагать наличие амилоидоза сердца (согласованное мнение рабочей группы ЕОК по изучению заболеваний миокарда и перикарда по диагностике и лечению амилоидоза сердца 2021 года [18]); наличие другого онкологического заболевания в анамнезе и проведение ХТ и/или лучевой терапии; острое сердечно-с осудистое событие в течение 3 месяцев до включения в исследование; хроническая сердечная недостаточность любого гемодинамического фенотипа (клинические рекомендации Минздрава России "Хроническая сердечная недостаточность" 2020 года); декомпенсация имеющейся сопутствующей патологии. Пациенты проходили обследование и лечение на базе отделения гематологии Университетской клинической больницы №1 Сеченовского Университета.
Дизайн исследования представлен на рис. 1. Перед началом курсового лечения всем пациентам проводилась стратификация риска кардиоваскулярной токсичности ХТ, согласно актуальным на момент проведения исследования согласительным документам по кардиоонкологии [2][19-20]. Контрольное обследование проводилось до 1-го, после 3-го и 6-го курсов ХТ (непосредственно перед индукцией ремиссии, по прошествии половины запланированного лечения и по ее завершению); включало в себя клинический анализ крови с подсчетом лейкоцитарной формулы, стандартное биохимическое исследование, иммуноэлектрофорез белков сыворотки крови и суточной мочи, определение концентрации β2-микроглобулина, 12-канальную электрокардиографию, трансторакальную ЭхоКГ, исследование уровней кардиальных биомаркеров методом иммуноферментного анализа:
- определение концентрации NT-proBNP ("Вектор Бест", Россия; референсный диапазон согласно инструкции коммерческого набора 0-200 пг/мг); норма для диагностики хронической сердечной недостаточности, согласно рекомендациям ЕОК — 0-125 пг/мл [21]);
- определение концентрации hsTnI ("Вектор-Б ест", Россия; референсный диапазон согласно инструкции коммерческого набора 0-0,1 нг/мл).
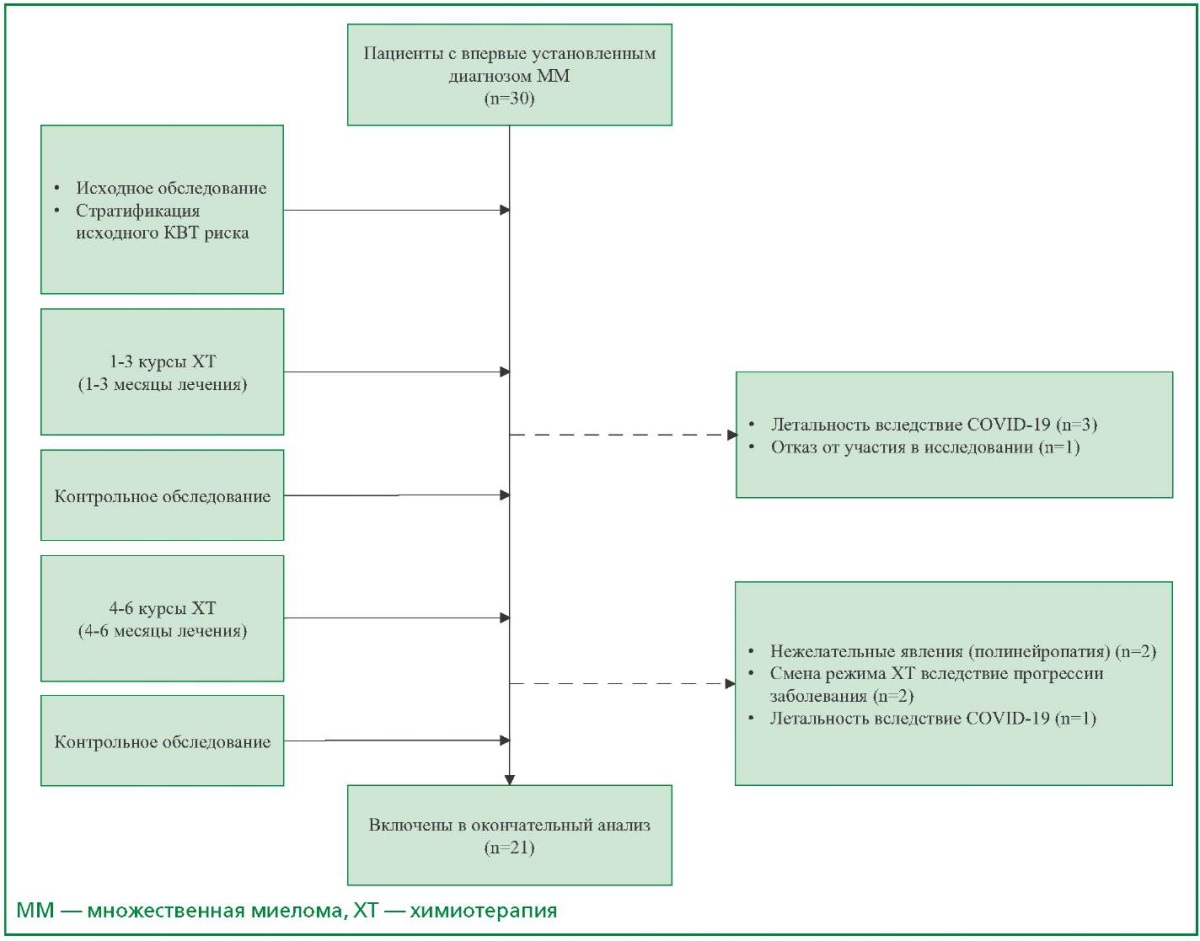
Рисунок 1. Дизайн исследования
Все пациенты подписали информированное добровольное согласие на участие в исследовании, протокол которого соответствовал принципам Хельсинкской декларации и был одобрен локальным этическим комитетом Сеченовского Университета.
Перед началом специфической противоопухолевой терапии всем пациентам проводилась стратификация риска развития кардиоваскулярной токсичности для больных, которым запланирована полихимиотерапия с включением ингибитора протеасом, согласно актуальным клиническим рекомендациям по кардиоонкологии [2]. Более половины пациентов относились к низкому или промежуточному риску, что не потребовало назначения кардиальной терапии de novo или коррекции уже проводимого лечения.
Статистическая обработка была проведена с использованием программного пакета SPSS Statistics 23 (IBM, США), проверка полученных данных произведена с помощью программы StatTech v.3.0.5. Анализ включал в себя описательную и статистическую части. Качественные показатели представлены в виде процентов. Для определения вида распределения количественных признаков был использован критерий Шапиро-Уилка. В случае нормального распределения данные представлены в виде среднего значения и стандартного отклонения (M±SD). При неправильном распределении данных результаты представлялись в виде медианы и значений 25- и 75-го процентилей [Me (Lq; Uq)]. Статистическая значимость динамики показателей связанных групп оценивалась с помощью критериев Фишера и Фридмана, проверка производилась с помощью критерия Вилкоксона для парных измерений. Корреляционный анализ выполнялся для выявления взаимосвязи изучаемых количественных признаков. Сила и направление связи оценивалась с использованием коэффициента корреляции Спирмена. Статистически значимыми различия считали при р<0,05.
Результаты
Основные клинико-д емографические характеристики пациентов с ММ представлены в табл. 1. Средний возраст включенных в исследование пациентов составил 63,8±10,0 лет. По половому составу незначительно превалировали лица мужского пола.
Динамика основных лабораторных показателей представлена в табл. 2.
Таблица 1. Клинико-анамнестическая характеристика пациентов
|
Параметр |
Пациенты (n=30) |
|
Средний возраст, лет |
63,8±10,0 |
|
Пол Мужской, n (%) Женский, n (%) |
17 (56,7) 13 (43,3) |
|
ИМТ, кг/м² |
25,1 (22,1;28,1) |
|
Отягощенная наследственность по ССЗ, n (%) |
23 (76,7) |
|
Курение, n (%) |
9 (30,0) |
|
АГ, n (%) •1 стадия •2 стадия •3 стадия |
20 (66,7) 3 (10,0) 8 (26,7) 9 (30,0) |
|
ИБС, n (%) |
4 (13,3) |
|
ИМ в анамнезе, n (%) |
3 (10,0) |
|
СД 2 типа, n (%) |
7 (23,3) |
|
Пароксизмальная форма ФП/ТП, n (%) |
0 (0) |
|
ЧСС, уд. в мин |
73,5±10,9 |
|
САД, мм рт.ст. |
128 (120;138) |
|
ДАД, мм рт.ст. |
79 (70;85) |
|
Кардиальная терапия, n (%) •β-АБ •иАПФ •тиазидные диуретики •статины •антиагреганты •БМКК •БРА |
18 (60,0) 15 (50,0) 8 (26,7) 8 (26,7) 5 (16,7) 4 (13,3) 1 (6,7) |
|
Кардио- и васкулотоксический риск, n (%) •низкий •промежуточный •высокий •очень высокий |
3 (10,0) 14 (46,7) 7 (23,3) 6 (20,0) |
Данные представлены как Me (25%; 75%) или M±SD, если не указано иное
АГ — артериальная гипертензия,
БМКК — блокаторы медленных кальциевых каналов,
БРА — блокаторы рецепторов ангиотензина II,
ДАД — диастолическое артериальное давление,
иАПФ — ингибиторы ангиотензинпревращающего фермента,
ИБС — ишемическая болезнь сердца,
ИМ — инфаркт миокарда,
ИМТ — индекс массы тела,
САД — систолическое артериальное давление,
СД — сахарный диабет,
СС3 — сердечно-сосудистые заболевания,
ТП –трепетание предсердий,
ФП — фибрилляция предсердий,
ЧСС — частота сердечных сокращений,
β-АБ — бета-адреноблокаторы
Таблица 2. Динамика изучаемых лабораторных показателей,
кардиоспецифических маркеров и параметров ЭхоКГ
у пациентов с ММ на фоне лечения
|
Показатель |
До ХТ (n=30) |
Через 3 курса ХТ (n=26) |
Через 6 курсов ХТ (n=21) |
p |
p |
|
Основные лабораторные показатели |
|||||
|
Гемоглобин, г/л (N 115-160) |
117,6 (99; 125) |
124 (114; 130) |
137 (125; 143) |
p=0,006 |
p2-1 = 0,045 |
|
Общий белок, г/л (N 57,0-82,0) |
91,0 (65,5; 105,5) |
68,3 (62,8; 75,5) |
63,5 (61; 76) |
p=0,004 |
p2-1 = 0,005 |
|
Парапротеин, г/л (N 0) |
29,3 (8,2; 43,8) |
0 (0; 19) |
0 (0; 0) |
p=0,001 |
p2-1 = 0,006 |
|
Глюкоза крови, ммоль/л (N 4,1-5,9) |
6,0 (5,6; 6,7) |
5,4 (5,1; 6,7) |
5,7 (5,4; 5,9) |
p=0,163 |
p2-1 = 0,005 |
|
Креатинин, мкмоль/л (N 80-115) |
94,2 (80,7; 117,3) |
78,9 (72,5; 115,7) |
82,0 (72,9; 90,0) |
p=0,156 |
p2-1 = 0,616 |
|
СКФ (CKD-EPI), мл/мин/1,73 м² |
66,1 (49,1; 70,9) |
65,3 (48,3; 81,2) |
63,1 (58,2; 83,4) |
p=0,368 |
p2-1 = 0,647 |
|
Калий, ммоль/л (N 3,5-5,1) |
4,5 (4,3; 4,9) |
4,6 (4,3; 4,9) |
4,8 (4,3; 5,4) |
p=0,543 |
p2-1 = 0,965 |
|
Кальций общий, ммоль/л (N 2,1-2,55) |
2,3 (2,1; 2,5) |
2,21 (2,2; 2,3) |
2,3 (2,2; 2,4) |
p=0,236 |
p2-1 = 0,234 |
|
СОЭ (N 1-20) |
43 (15; 66) |
17 (10; 35) |
20 (12; 33) |
p=0,459 |
p2-1 = 0,163 |
|
Кардиоспецифические маркеры |
|||||
|
NT-proBNP, пг/мл (N 0-200) |
316,0 (75,9; 602,6) |
144,0 (102,3; 294,0) |
109,2 (59,9; 344,5) |
p=0,638 |
p2-1 = 0,321 |
|
hsTnI, нг/мл (N 0-0,1) |
0,06 (0,03; 0,49) |
0,02 (0,01; 0,68) |
0,65 (0,02; 1,51) |
р=0,768 |
p2-1 = 0,753 |
|
Показатели трансторакальной ЭхоКГ |
|||||
|
ФВ ЛЖ, % (N > 55) |
63,12±6,02 |
61,50±4,46 |
59,57±5,09 |
p=0,280 |
p2-1 = 0,706 |
|
Е/А (N 1,0-1,5) |
1,00 (0,9; 1,17) |
1,00 (0,71; 1,37) |
0,75 (0,62; 0,92) |
p=0,321 |
p2-1 = 0,859 |
|
E/e’ (N < 8) |
8,1 (6,2; 11,7) |
9,9 (6,9; 11,3) |
8,4 (6,9; 10,8) |
p=0,453 |
p2-1 = 0,987 |
|
ИО ЛП, мл/м² (N < 34) |
30,4 (26,7; 35,2) |
33,0 (30,1; 35,3) |
29,3 (27,1; 36,7) |
p=0,232 |
p2-1 = 0,084 |
|
КДР ЛЖ, см (N < 5,2) |
4,5 (4,1; 4,9) |
4,3 (4,1; 4,6) |
4,4 (4,3; 4,7) |
p=0,395 |
p2-1 = 0,246 |
|
ИММ ЛЖ, г/м² (N 72-94) |
94 (84; 103) |
101 (88; 105) |
90 (75; 102) |
p=0,455 |
p2-1 = 0,632 |
Данные представлены как Me (25%; 75%) или M±SD
ИММ — индекс массы миокарда,
ИО ЛП — индекс объема левого предсердия,
КДР — конечный диастолический размер,
ЛЖ — левый желудочек,
СКФ — скорость клубочковой фильтрации,
СОЭ — скорость оседания эритроцитов,
ФВ — фракция выброса,
ХТ — химиотерапия,
hsTnI — высокочувствительный тропонин I,
NT-proBNP — N-концевой фрагмент мозгового натрийуретического пептида
У пациентов с ММ исходный уровень NT-proBNP превышал верхнюю границу нормы, как согласно критериям диагностики сердечной недостаточности, так и по установленным производителем используемого набора реактивов референсным значениям.
Концентрация hsTnI в дебюте заболевания находилась в референсных границах, в то время как спустя 6 курсов ХТ она превышала верхнюю границу нормы более, чем в 6 раз. Тем не менее, выявленные изменения были статистически незначимыми (см. табл. 2).
При оценке основных морфофункциональных параметров сердца статистически значимых изменений продемонстрировано не было. Обращает внимание постепенное снижение на фоне ХТ средних значений фракции выброса левого желудочка (ФВ ЛЖ), не выходящих при этом за пределы референсного диапазона и в отсутствие клинических признаков хронической сердечной недостаточности.
Проведение 6 курсов ХТ у исследуемой группы пациентов ассоциировалось с развитием нежелательных сердечно-сосудистых явлений (нестабильность артериального давления, тахикардия, дислипидемия), что потребовало коррекции кардиопротективной терапии. Статически значимо к окончанию исследования увеличилось количество пациентов, принимающих ингибиторы ангиотензинпревращающего фермента (иАПФ), бета-адреноблокаторы (β-АБ), статины, блокаторы медленных кальциевых каналов (БМКК) (табл. 3).
Таблица 3. Изменения кардиальной терапии у пациентов с ММ на фоне ХТ
|
Препараты |
До ХТ (n=30) |
После 3 курсов ХТ (n=26) |
После 6 курсов ХТ (n=21) |
p (кФ) |
|
β-АБ, n (%) |
18 (60) |
18 (69,2) |
20 (95,2) |
0,041 |
|
иАПФ, n (%) |
15 (50) |
19 (73,1) |
20 (95,2) |
0,027 |
|
Тиазидные диуретики, n (%) |
8 (26,7) |
8 (30,8) |
8 (26,7) |
0,765 |
|
Статины, n (%) |
8 (26,7) |
18 (69,3) |
20 (95,2) |
0,039 |
|
Антиагреганты, n (%) |
5 (16,7) |
5 (19,2) |
5 (23,8) |
0,453 |
|
БМКК, n (%) |
4 (13,3) |
3 (11,5) |
4 (19,1) |
0,046 |
|
БРА, n (%) |
2 (6,7) |
6 (23,1) |
1 (4,8) |
0,797 |
БМКК — блокаторы медленных кальциевых каналов,
БРА — блокаторы рецепторов ангиотензина II,
иАПФ — ингибиторы ангиотензинпревращающего фермента,
β-АБ — бета-адреноблокаторы
При проведении корреляционного анализа выявлены значимые взаимосвязи обратного характера между уровнями hsTnI и СОЭ, парапротеина, гемоглобина (рис. 2). Статистически значимых корреляционных взаимосвязей для NT-proBNP с данными лабораторными показателями выявлено не было. При этом была изучена взаимосвязь уровня NTproBNP и β2-микроглобулина, но она показала слабый прямой характер (r=124; p=0,624), не являясь статистически значимой.
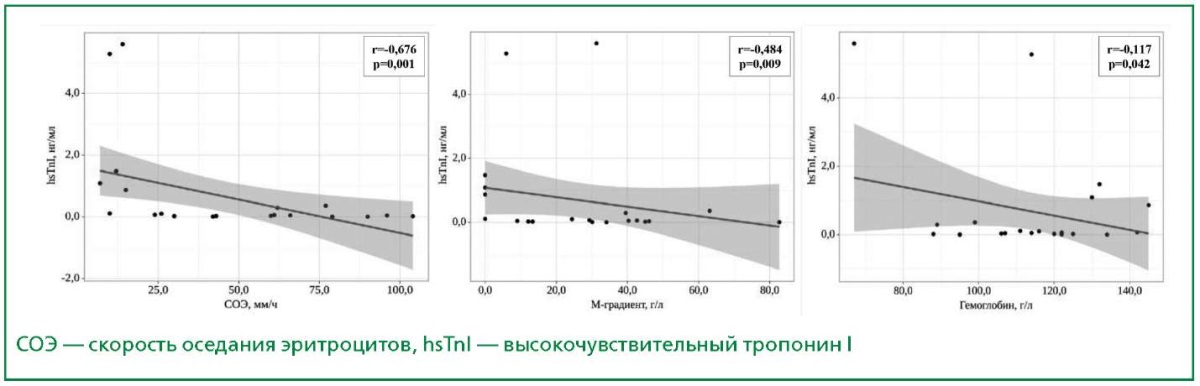
Рисунок 2. Взаимосвязь уровня hsThI
и основных лабораторных показателей
у пациентов с ММ
В многофакторную регрессионную модель в качестве факторов, определяющих исходное значение уровня hsTnI у исследуемых больных, были включены уровень гемоглобина, парапротеина и скорости оседания эритроцитов (СОЭ). Полученная регрессионная модель характеризовалась коэффициентом корреляции r=0,702, что соответствует высокой силе взаимосвязи (p<0,001) (табл. 4). Данная модель была применима к 59,7% пациентов, включенных в наблюдение на момент установления диагноза.
Таблица 4. Взаимосвязь основных лабораторных критериев ММ
и исходного уровня hsTnI
|
Показатель |
B |
Стандартная ошибка |
t |
p |
|
Intercept |
8,027 |
1,841 |
4,360 |
<0,001 |
|
Парапротеин, г/л |
-0,011 |
0,013 |
-0,799 |
0,032 |
|
Гемоглобин, г/л |
-0,050 |
0,014 |
-3,547 |
0,002 |
|
СОЭ, мм/час |
-0,028 |
0,010 |
-2,881 |
0,008 |
СОЭ — скорость оседания эритроцитов,
B — коэффициент регрессии
Обсуждение
В представленном исследовании была проведена оценка динамики рекомендованных маркеров кардио- и васкулотоксичности (NT-prоBNP, hsTnI) у пациентов с впервые диагностированной ММ до лечения, после 3 и 6 курсов ХТ с включением ингибитора протеасом первого поколения бортезомиба. Кроме того, для оценки влияния ММ на состояние ССС и на развитие субклинической кардиотоксичности применяемого режима ХТ, до проведения противоопухолевой терапии исследованы корреляционные взаимосвязи исследуемых биомаркеров с основными лабораторными критериями ММ.
Выявленные статистически значимые изменения уровней гемоглобина, общего белка и парапротеина являются ожидаемым отражением эффективности терапии ММ и объясняются элиминацией клональных плазматических клеток.
У 50% исследуемых пациентов в дебюте ММ средний уровень NT-proBNP превышал верхнюю границу нормы (200 пг/мл согласно инструкции коммерческого набора). При этом клинических или инструментальных признаков сердечной недостаточности, фибрилляции предсердий, ожирения выявлено не было; статистически значимой взаимосвязи исходного уровня NT-proBNP и риска кардиоваскулярной токсичности также установлено не было. Критериев асимптомной дисфункции миокарда, как проявления кардиотоксичности, также достигнуто не было (умеренная степень — de novo снижение ФВ ЛЖ ≥10% до ФВ ЛЖ 40-49% или de novo снижение ФВ ЛЖ <10% до ФВ ЛЖ 40-49% и либо de novo относительное снижение GLS >15% от исходного, либо de novo повышение биомаркеров; тяжелая степень — de novo снижение ФВ ЛЖ <40%) [2].
Одной из причин повышения концентрации NTproBNP в исследуемой когорте больных можно было предположить развитие хронической почечной недостаточности или миеломной нефропатии, однако данная гипотеза не нашла своего подтверждения, поскольку по данным проведенных лабораторно-инструментальных исследований значимого повреждения почек у пациентов с ММ не наблюдалось. Выявленная прямая корреляционная взаимосвязь уровня NT-proBNP и β2-микроглобулина, который помимо отражения фильтрационной способности почек служит также показателем активности ММ, обладает слабой силой.
Согласно клиническим рекомендациям по диагностике и лечению острой и хронической сердечной недостаточности ЕОК 2021 года, наличие паранеопластического синдрома рассматривается в качестве одной из некардиальных причин повышения уровня NT-proBNP [21]. С учетом полученных в ходе настоящего исследования данных, после 6 курсов ХТ отмечалась тенденция к уменьшению среднего уровня NT-proBNP почти в 3 раза. Принимая во внимание вышеупомянутые причины, наличие онкогематологического заболевания может объяснить повышение уровня данного биомаркера.
Уменьшение степени гиперпротеинемии за счет редукции парапротеина ожидаемо приводит к улучшению реологических свойс тв крови за счет регресса гипервискозного синдрома, который, в свою очередь, характеризуется как геморрагическими, так и тромботическими осложнениями в периферических сосудах, включая уровень микроциркуляции [22]. Данный факт также подчеркивает влияние парапротеинемического гемобластоза на полученные в рамках настоящего исследования результаты динамики уровня NT-proBNP, что может ставить под сомнение правомерность использования данного биомаркера как надежного критерия стратификации риска кардиоваскулярной токсичности и развития субклинической кардиотоксичности у пациентов с ММ.
С другой стороны, динамика уровня NT-proBNP могла быть обусловлена и изменением кардиальной терапии. При появлении на фоне проводимого режима ХТ (бортезомиб, циклофосфамид, глюкокортикоиды) нежелательных явлений со стороны ССС пациентам проводилась коррекция лечения, назначались препараты с потенциальным кардиопротективным действием.
Зарубежными коллегами предпринимались попытки оценить динамику уровня NT-proBNP у пациентов с ММ. Группа канадских ученых под руководством V. H. Jimenez-Zepeda ретроспективно проанализировала данные 216 пациентов с ММ: 87 кандидатов и 126 некандидатов на проведение трансплантации аутологичных гемопоэтических стволовых клеток [23]. Пациенты с AL-амилоидозом исключались из исследования. Выявлено, что медиана общей выживаемости у пациентов с NT-proBNP ≥300 нг/л была значимо меньше (45,9 мес.) в сравнении с группой больных с уровнем NT-proBNP <300 нг/л, в которой она не была достигнута (p=0,0001). При проведении однофакторного и многофакторного анализа установлено, что для пациентов с ММ, которые не являются кандидатами на трансплантацию аутологичных гемопоэтических стволовых клеток, возраст старше 80 лет и уровень NTproBNP выше 800 нг/л являлись независимыми прогностическими факторами неблагоприятного исхода.
R. F. Cornell и соавт. изучали нежелательные явления со стороны ССС на фоне терапии ингибиторами протеасом у пациентов с рецидивирующей ММ (проспективное исследование, n=95, из которых n=65 карфилзомиб, n=30 бортезомиб) [24]. Кардиоваскулярные осложнения возникли у 51% и 17% больных, получавших карфилзомиб и бортезомиб, соответственно. Пациенты в группе терапии карфилзомибом с исходным уровнем BNP ≥100 пг/мл и NT-proBNP ≥125 пг/мл имели статистически значимо более высокий риск возникновения сердечно-сосудистых осложнений (отношение шансов 10,8; p<0,001). Повышение уровней натрийуретических пептидов в процессе 1-го курса терапии карфилзомибом значимо ассоциировалось с более высоким риском развития сердечно-сосудистых событий (отношение шансов 36,0; p<0,001).
Исходно среднее значение исследуемого маркера повреждения миокарда hsTnI у пациентов с ММ не превышало референсных значений. При детальном субанализе выявлено, что уровень hsTnI превышал норму у 13 пациентов (43,3%), из которых у 7 больных имело место нарушение функции почек и еще у 2 больных — нарушение функции почек и инфаркт миокарда в анамнезе. На фоне 3 курсов ХТ отмечалась тенденция к снижению уровня данного биомаркера, тогда как после завершения лечения уровень hsTnI превышал исходные значения более, чем в 10 раз.
Согласно полученным нами данным на фоне первых индукционных курсов ХТ у пациентов с ММ отмечалось закономерное снижение уровня парапротеина и, как следствие, относительная нормализация белкового состава крови. Однако уже к завершающему этапу специфической терапии, вероятно, могло иметь место непосредственно субклиническое кардиотоксическое действие применяемого режима VCd, что могло способствовать увеличению средних значений hsTnI у данной когорты пациентов.
К настоящему моменту описаны несколько случаев ложного повышения уровня кардиальных тропонинов у пациентов с ММ. Причинами данного явления могут рассматриваться циркуляция гетерофильных антител, аутоантител или макротропонина. Последний является комплексом из парапротеина и тропонина I или T; встречается не только у пациентов с ММ, но также после вакцинации против COVID-19 или непосредственно перенесенной инфекции SARS-CoV-2. С целью снижения рисков получения ложноположительных результатов уровня сердечных тропонинов, авторы приведенных исследований рекомендуют добавление полиэтиленгликоля к сыворотке пациента, что позволяет связать иммуноглобулин и высвободить молекулы тропонина для более точной интерпретации [25-27].
Результаты проведенного нами многофакторного анализа, возможно, открывают возможность использования hsTnI, как одного из маркеров кардиотоксического действия ХТ у пациентов с нарушением белковых соотношений в сыворотке крови. Это подчеркивается тенденцией к повышению уровня данного серологического биомаркера на фоне эффективной терапии ММ с учетом снижения уровня патологического парапротеина и восстановления уровня гемоглобина, как одних из основных показателей ответа данных онкогематологических пациентов на противоопухолевую терапию. Таким образом, можно предполагать, что значения концентрации маркера повреждения миокарда hsTnI исходно были ниже у пациентов с более распространенной стадией онкогематологического заболевания, затрудняющее достоверную оценку состояния миокарда у пациентов с ММ.
Таким образом, результаты представленного исследования формируют новую проблему кардиоонкологии: трудности интерпретации уровней рекомендованных маркеров кардиотоксичности (NT-proBNP, hsTnI) у пациентов с ММ как с целью стратификации риска кардиоваскулярной токсичности, так и для мониторинга субклинической кардиоваскулярной токсичности противоопухолевой терапии. Патогенетически данная нозология сопровождается анемией, нарушениями белкового состава крови (парапротеинемия) и межбелковых взаимодействий, что может влиять на кинетику исследуемых биомолекул. В ходе проведенного исследования 6 курсов ХТ по программе VCd у пациентов с ММ не привели к развитию кардиотоксичности согласно актуальным клиническим рекомендациям [2]. Будущие научные фундаментальные и прикладные исследования в этой области должны быть нацелены на поиск чувствительных и специфичных, но при этом доступных в рутинной клинической практике биомаркеров кардиоваскулярной токсичности ХТ именно для больных парапротеинемическими гемобластозами.
Ограничения исследования
Малая выборка и репрезентативность пациентов; возраст больных, наличие сердечно-сосудистой коморбидности.
Заключение
Полученные авторами результаты подчеркивают необходимость более детального изучения воздействия как самого онкогематологического заболевания, так и потенциальной кардиоваскулярной токсичности противоопухолевой терапии на состояние ССС. Динамика уровней NT-proBNP и hsTnI на фоне лечения подтверждает гипотезу о том, что данные кардиоспецифические маркеры могут характеризовать не только наличие структурно-функциональных изменений миокарда, но также отражать влияние непосредственного опухолевого процесса у больных ММ. С учетом наличия парапротеинемии затруднена трактовка получаемых значений рекомендованных маркеров кардиотоксичности у пациентов с ММ, что требует поиска новых предикторов развития кардиоваскулярных осложнений, связанных со специфическим лечением.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование. Исследование выполнено при финансовой поддержке Российского научного фонда (РНФ) в рамках гранта №22-25-00208 "Изучение экспрессии циркулирующих микроРНК-126 и микроРНК-203, ассоциированных биомолекулярных взаимодействий и сердечно-сосудистого ремоделирования в патогенезе кардиоваскулотоксичности ингибиторов протеасом".
Funding. The study was performed with the financial support of the Russian Science Foundation under the scientific project No. 22-25-00208, scientific grant "Assessment of circulating microRNA-126 and microRNA-203 expression, associated biomolecular interactions and cardiovascular remodeling in the pathogenesis of cardiovasculotoxicity of proteasome inhibitors".
Список литературы
1. Firkins J, Hansen L, Driessnack M, Dieckmann N. Quality of life in "chronic" cancer survivors: a meta-analysis. J Cancer Surviv. 2020;14(4):504-517. DOI:10.1007/s11764-020-00869-9.
2. Lyon AR, López-Fernández T, Couch LS, et al.; ESC Scientific Document Group. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). Eur Heart J. 2022;43(41):4229-361. DOI:10.1093/eurheartj/ehac244.
3. Chovanec J Jr, Chovanec J Sr, Chovanec M, Mego M. Levels of NTproBNP in patients with cancer. Oncol Lett. 2023;26(1):280. DOI:10.3892/ol.2023.13866.
4. Finke D, Romann SW, Heckmann MB, et al. High-sensitivity cardiac troponin T determines all-cause mortality in cancer patients: a single-centre cohort study. ESC Heart Fail. 2021;8(5):3709-19. DOI:10.1002/ehf2.13515.
5. Каприн А. Д., Старинский В. В., Шахзадова А. О. Злокачественные новообразования в России в 2020 году (заболеваемость и смертность). М.: МНИОИ им. П. А. Герцена — филиал ФГБУ "НМИЦ радиологии" Минздрава России: 2021.
6. Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71(3):209-49. DOI:10.3322/caac.21660.
7. Debureaux PE, Harel S, Parquet N, et al. Prognosis of hyperviscosity syndrome in newly diagnosed multiple myeloma in modern-era therapy: A real-life study. Front Immunol. 2022;13:1069360. DOI:10.3389/fimmu.2022.1069360.
8. Gansevoort RT, Correa-Rotter R, Hemmelgarn BR, et al. Chronic kidney disease and cardiovascular risk: epidemiology, mechanisms, and prevention. Lancet. 2013;382(9889):339-52. DOI:10.1016/s0140-6736(13)60595-4.
9. Oakervee HE, Popat R, Curry N, et al. PAD combination therapy (PS-341/ bortezomib, doxorubicin and dexamethasone) for previously untreated patients with multiple myeloma. Br J Haematol. 2005;129(6):755-62. DOI:10.1111/j.1365-2141.2005.05519.x.
10. Jagannath S, Durie BG, Wolf J, et al. Bortezomib therapy alone and in combination with dexamethasone for previously untreated symptomatic multiple myeloma. Br J Haematol. 2005;129(6):776-83. DOI:10.1111/j.1365-2141.2005.05540.x.
11. San Miguel JF, Schlag R, Khuageva NK, et al. Bortezomib plus melphalan and prednisone for initial treatment of multiple myeloma. N Engl J Med. 2008;359(9):906-17. DOI:10.1056/NEJMoa0801479.
12. Reeder CB, Reece DE, Kukreti V, et al. Cyclophosphamide, bortezomib and dexamethasone induction for newly diagnosed multiple myeloma: high response rates in a phase II clinical trial. Leukemia. 2009;23(7):1337-41. DOI:10.1038/leu.2009.26.
13. Wu P, Oren O, Gertz MA, Yang EH. Proteasome Inhibitor-Related Cardiotoxicity: Mechanisms, Diagnosis, and Management. Curr Oncol Rep. 2020;22(7):66. DOI:10.1007/s11912-020-00931-w.
14. Barac YD, Emrich F, Krutzwakd-Josefson E, et al. The ubiquitin-proteasome system: A potential therapeutic target for heart failure. J Heart Lung Transplant. 2017;36(7):708-14. DOI:10.1016/j.healun.2017.02.012.
15. Gordon JW, Shaw JA, Kirshenbaum LA. Multiple facets of NF-κB in the heart: to be or not to NF-κB. Circ Res. 2011;108(9):1122-32. DOI:10.1161/CIRCRESAHA.110.226928.
16. Wei Q, Xia Y. Proteasome inhibition down-regulates endothelial nitric-oxide synthase phosphorylation and function. J Biol Chem. 2006;281(31):21652-9. DOI:10.1074/jbc.M602105200.
17. Менделеева Л. П., Вотякова О. М., Рехтина И. Г., и др. Множественная миелома. Клинические рекомендации. Современная Онкология. 2020;22(4):6-28. DOI:10.26442/18151434.2020.4.200457.
18. Garcia-Pavia P, Rapezzi C, Adler Y, et al. Diagnosis and treatment of cardiac amyloidosis: a position statement of the ESC Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2021;42(16):1554-68. DOI:10.1093/eurheartj/ehab072.
19. Zamorano JL, Lancellotti P, Rodriguez Muñoz D, et al.; ESC Scientific Document Group. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC). Eur Heart J. 2016;37(36):2768-801. DOI:10.1093/eurheartj/ehw211.
20. Васюк Ю. А., Гендлин Г. Е., Емелина Е. И., и др. Согласованное мнение Российских экспертов по профилактике, диагностике и лечению сердечно-сосудистой токсичности противоопухолевой терапии. Российский Кардиологический Журнал. 2021;26(9):4703. DOI:10.15829/1560-4071-2021-4703.
21. McDonagh TA, Metra M, Adamo M, et al.; ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599-726. DOI:10.1093/eurheartj/ehab368.
22. Gertz MA. Acute hyperviscosity: syndromes and management. Blood. 2018;132(13):1379-85. DOI:10.1182/blood-2018-06-846816.
23. Jimenez-Zepeda VH, Lee H, Tay J, et al. N-Terminal pro-brain natriuretic peptide (NTproBNP) in patients with symptomatic multiple myeloma: report from a single institution. Ann Hematol. 2021;100(10):2521-7. DOI:10.1007/s00277-021-04591-z.
24. Cornell RF, Ky B, Weiss BM, et al. Prospective Study of Cardiac Events During Proteasome Inhibitor Therapy for Relapsed Multiple Myeloma. J Clin Oncol. 2019;37(22):1946-55. doi:10.1200/JCO.19.00231.
25. Bajwa O, Hassen G, Fishbein J, et al. False Elevation of Troponin in a Case of Multiple Myeloma. Cureus. 2023;15(1):e34186. DOI:10.7759/cureus.34186.
26. Domanski O, Maréchaux S, Forzy G, Lemahieu JM. An unexpected rise in cardiac troponin I in a patient with multiple myeloma. BMJ Case Rep. 2012;2012:bcr2012006222. DOI:10.1136/bcr-2012-006222.
27. Bularga A, Oskoui E, Fujisawa T, et al. Macrotroponin complex as a cause for cardiac troponin increase after COVID-19 vaccination and infection. Clin Chem. 2022;68(8):1015-9. DOI:10.1093/clinchem/hvac100.
Об авторах
Е. В. ФоминаРоссия
Фомина Елизавета Васильевна - аспирант кафедры Госпитальной терапии №1 Института клинической медицины им. Н.В. Склифосовского.
Москва
С. А. Кардовская
Россия
Кардовская Сабина Александровна - аспирант кафедры Госпитальной терапии №1 Института клинической медицины им. Н.В. Склифосовского.
Москва
Д. А. Буданова
Россия
Буданова Дарья Александровна - кандидат медицинских наук, врач-гематолог Университетской клинической больницы №1.
Москва
П. А. Маркин
Россия
Маркин Павел Александрович - кандидат фармацевтических наук, старший научный сотрудник Научно-исследовательского центра мирового уровня «Цифровой биодизайн и персонализированное здравоохранение».
Москва
С. А. Апполонова
Россия
Апполонова Светлана Александровна - кандидат химических наук, доцент Кафедры промышленной фармации Института профессионального образования, заведующий Лабораторией фармакокинетики и метаболомного анализа Института фармации и трансляционной медицины и биотехнологии.
Москва
А. С. Лишута
Россия
Лишута Алексей Сергеевич - кандидат медицинских наук, профессор кафедры Госпитальной терапии №1 Института клинической медицины им. Н.В. Склифосовского.
Москва
Ю. Н. Беленков
Россия
Беленков Юрий Никитич - доктор медицинских наук, профессор, академик РАН, заведующий кафедрой Госпитальной терапии №1 Института клинической медицины им. Н.В. Склифосовского.
Москва
И. С. Ильгисонис
Россия
Ильгисонис Ирина Сергеевна - кандидат медицинских наук, профессор кафедры Госпитальной терапии №1 Института клинической медицины им. Н.В. Склифосовского.
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Фомина Е.В., Кардовская С.А., Буданова Д.А., Маркин П.А., Апполонова С.А., Лишута А.С., Беленков Ю.Н., Ильгисонис И.С. Динамика биомаркеров дисфункции и повреждения миокарда на фоне химиотерапии множественной миеломы: трудности интерпретации лабораторных данных. Рациональная Фармакотерапия в Кардиологии. 2023;19(5):425-434. https://doi.org/10.20996/1819-6446-2023-2955. EDN: XWEDYY
For citation:
Fomina E.V., Kardovskaya S.A., Budanova D.A., Markin P.A., Appolonova S.A., Lishuta A.S., Belenkov Yu.N., Ilgisonis I.S. Changes of myocardial dysfunction and injury biomarkers over chemotherapy for multiple myeloma: difficulties in laboratory data interpretation. Rational Pharmacotherapy in Cardiology. 2023;19(5):425-434. (In Russ.) https://doi.org/10.20996/1819-6446-2023-2955. EDN: XWEDYY

















































