Перейти к:
Госпитальные исходы инфаркта миокарда у пациентов, постоянно получающих прямые пероральные антикоагулянты
https://doi.org/10.20996/1819-6446-2023-2962
EDN: FXCKDI
Аннотация
Цель. Оценить клиническое течение инфаркта миокарда (ИМ) и его госпитальные исходы у пациентов, получающих постоянную терапию прямыми пероральными антикоагулянтами (ПОАК).
Материал и методы. В анализ включены данные 390 пациентов (средний возраст 64,1±12,8 лет), получивших лечение по поводу ИМ. Большинство составляли мужчины 61,5% (n=240). Всем больным выполнялся стандартный объем диагностических и лечебных мероприятий в соответствии с действующими клиническими рекомендациями, включая коронароангиографию и чрескожные коронарные вмешательства по показаниям. Проанализированы клинико-анамнестические данные, результаты лабораторных исследований (в т.ч. уровень С-реактивного белка, тропонина I, гемостазиограмма). Изучено клиническое течение ИМ в госпитальном периоде, летальность и частота развития осложнений.
Результаты. Пациенты были разделены на две группы, в основную группу вошёл 41 пациент с постоянным приемом ПОАК, а в контрольную группу — 349 пациентов, не получающих ПОАК. Пациенты 65 лет и старше составляли 68,3% (n=28) основной группы (р=0,0033), среди них отмечалась большая доля лиц, перенесших нарушения мозгового кровообращения и венозные тромбозы (р<0,01). Фибрилляция предсердий (ФП) ранее диагностирована у 75,6% (n=31) больных основной группы (р<0,0001). ИМ с подъемом ST (ИМпST) зарегистрирован в 39,0% (n=16) случаев в основной группе, и в 47,3% (n=165) случаев — в контрольной (p=0,3161). 85,4% (n=35) пациентов основной группы относились к категории высокого госпитального риска по шкале GRACE 1.0, тогда как в контрольной группе 50,4% (n=176) (p<0,0001). По выраженности явлений недостаточности кровообращения обе группы значимо не различались (р=0,1549). Возврат сегмента ST к изолинии на электрокардиограмме при поступлении в стационар регистрировался у 43,8% (n=7) пациентов основной группы и у 18,1% (n=30) группы контроля (р=0,0238). По тяжести поражения коронарного русла и характеру антеградного кровотока в инфаркт-связанной артерии больные обеих групп оказались сопоставимы (р>0,05). Предшествующий прием ПОАК не оказывал значимого влияния на частоту развития желудочно-кишечных кровотечений в госпитальном периоде — отношение шансов (ОШ) 3,96 (95% доверительный интервал (ДИ) 0,76–20,66), а также на уровень летальности ОШ 1,47 (95% ДИ 0,37–5,85).
Заключение. У пациентов с ИМ, получающих постоянную терапии ПОАК, статистически значимо чаще регистрировался возврат сегмента ST к изолинии при поступлении в стационар, по сравнению с пациентами не получавшими ПОАК. Прием ПОАК не оказывал значимого влияния на летальность и частоту развития осложнений в госпитальном периоде течения ИМ.
Для цитирования:
Чащин М.Г., Горшков А.Ю., Драпкина О.М. Госпитальные исходы инфаркта миокарда у пациентов, постоянно получающих прямые пероральные антикоагулянты. Рациональная Фармакотерапия в Кардиологии. 2023;19(5):452-460. https://doi.org/10.20996/1819-6446-2023-2962. EDN: FXCKDI
For citation:
Chashchin M.G., Gorshkov A.Yu., Drapkina O.M. Inhospital outcomes of myocardial infarction in patients receiving direct oral anticoagulants. Rational Pharmacotherapy in Cardiology. 2023;19(5):452-460. (In Russ.) https://doi.org/10.20996/1819-6446-2023-2962. EDN: FXCKDI
Введение
Согласно данным Всемирной организации здравоохранения, ишемическая болезнь сердца (ИБС) остается одной из ведущих причин смерти населения развитых и развивающихся стран [1]. Несмотря на широкое применение ингибиторов агрегации тромбоцитов для профилактики тромботических осложнений, риск развития инфаркта миокарда (ИМ) по-прежнему остается высоким [2].
В остром периоде ИМ происходит нарушение коагуляционного гомеостаза, которое сопровождается тромбозом коронарных артерий [3]. Это может привести к неполной обструкции или окклюзии просвета сосуда, прекращению кровотока в инфаркт-ответственной артерии (ИОА), ишемии миокарда в зоне кровоснабжения ИОА, а с течением непродолжительного времени — к его гибели [4].
Литературные данные указывают на то, что пациенты с ИМ без полной окклюзии ИОА характеризуются меньшей зоной ишемии и некроза миокарда и как следствие, менее тяжелым течением в остром и подостром периоде, меньшим риском развития осложнений и более благоприятными ближайшими и отдаленными исходами [5][6]. Патогенетически это может быть обусловлено как относительной сохранностью антеградного кровотока, так и выраженностью внутрисистемных и межсистемных коллатералей.
Внедрение тромболизиса, развитие сети региональных сосудистых центров с возможностью экстренного эндоваскулярного лечения, оптимизация маршрутизации больных ИМ позволили существенно сократить сроки реперфузии ИОА и улучшить прогнозы, однако проблема продолжительности окклюзии ИОА и объема пораженного миокарда остается актуальной [7].
Оптимистичные данные современных клинических исследований, позволяют рассматривать возможность включения препаратов группы пероральных антикоагулянтов (ПОАК) в схему антитромботической терапии у пациентов с ИБС, представляющих категорию высокого риска атеротромботических осложнений [8][9].
Предположение об эффективности комбинированной терапии ПОАК и дезагрегантами основано на одновременном воздействии на различные звенья гемостаза, что потенциально позволяет улучшить контроль за процессами свертывания крови и тромбообразования. ПОАК блокируют синтез или функцию факторов свертывания крови, таких как тромбин, факторы II, VII, IX, X и XI, что способствует замедлению скорости образования сгустка [10]. Воздействуя на звенья коагуляционного каскада, ПОАК приводят к угнетению превращения фибриногена в фибрин-мономер и к подавлению тромбинопосредованной агрегации тромбоцитов [11]. Действие дезагрегантов, в свою очередь, также направлено на ингибирование активности тромбоцитов. Совместный эффект определяется в более эффективном подавлении агрегации тромбоцитов и формировании сгустка.
Несмотря на ожидаемые позитивные антитромботические эффекты совместного применения ПОАК и дезагрегантов, данная комбинация повышает риск геморрагических осложнений, что существенно ограничивает как возможность применения комбинации, так и применение ПОАК в терапевтических дозировках [12][13]. В настоящее время рекомендованная доза ривароксабана в комбинированной терапии с ацетилсалициловой кислотой (АСК) для пациентов со стабильной ИБС и/или клинически значимым атеросклерозом периферических артерий, характеризующихся высоким риском ишемических осложнений, составляет 2,5 мг [14][15]. Данная комбинация продемонстрировала свою относительную безопасность и эффективность в ряде крупных клинических исследований как у пациентов со стабильной ИБС, так и среди пациентов с острым коронарным синдромом (ОКС).
В последние годы число публикаций, описывающих высокую эффективность ПОАК в профилактике сердечно-сосудистых событий, существенно выросло, что указывает на большой интерес к проблеме [12][14-16], однако данные о влиянии постоянного приема ПОАК на тяжесть клинического течения ИМ в остром периоде по-прежнему ограничены. Предполагается, что прием ПОАК может улучшить прогноз пациентов с ИМ не только за счет блокирования механизмов коагуляции, но и за счет улучшения реологических свойств крови и микроциркуляции в миокарде, противовоспалительного эффекта [17][18]. Таким образом, дальнейшее проведение исследований необходимо для более глубокого понимания влияния терапии ПОАК на течение ИМ и оптимизации антитромботических стратегий.
В условиях нестабильности атеросклеротической бляшки, разрыва ее покрышки, комбинированная терапия ПОАК и антиагрегантами потенциально может способствовать более медленному тромбообразованию и формированию более рыхлого сгустка [19]. Дегенерация структуры тромба и сдвиг коагуляционного гомеостаза в сторону гипокоагуляции может сопровождаться снижением частоты окклюзий просвета коронарных артерий тромботическими массами и увеличению частоты случаев спонтанных реперфузий, что потенциально может быть ассоциировано с более благоприятным течением ИМ. Изучение данной гипотезы легло в основу проведенного исследования.
Цель нашего исследования — изучение клинического течения ИМ и его госпитальных исходов у пациентов, получающих постоянную терапию ПОАК.
Материал и методы
Из госпитального регистра регионального сосудистого центра Городской клинической больницы им. В. П. Демихова г. Москвы были отобраны данные пациентов, получивших лечение по поводу ИМ в период с июля 2020 по март 2021 гг. Сведения о течении госпитального периода, результатах лабораторных и инструментальных исследований анализировались на основании информации, представленной в электронной медицинской карте Единой медицинской информационно-аналитической системы. Критерии включения: диагноз ИМ, верифицированный клинически и по данным лабораторных и инструментальных исследований; наличие архивных данных о проведенной коронароангиографии (КАГ); полнота данных электронной истории болезни.
Критерии невключения: острое повреждение мио карда, опосредованное проведением эндоваскулярного, хирургического вмешательства или явившееся осложнением иных методов лечения; смерть на догоспитальном этапе или до поступления в рентгеноперационную; отсутствие лабораторных данных об уровне тропонина I в крови и его динамике; хронические воспалительные заболевания в анамнезе, в т.ч. аутоиммунные; признаки внебольничной пневмонии, вне зависимости от этиологии; наличие гнойных ран и инфекций мягких тканей; верифицированные ранее злокачественные онкологические заболевания; анемия средней и тяжелой степени; признаки острой респираторной вирусной инфекции, а также наличие клинических или лабораторных данных, указывающих на острый период COVID-19 на момент поступления в стационар или выявившиеся в течение периода госпитализации.
Для последующего ретроспективного анализа отобраны данные 390 пациентов, соответствующих критериями включения. Протокол исследования одобрен независимым этическим комитетом ФГБУ "НМИЦ ТПМ" Минздрава России №05-02/21 от 03.06.2021 г. Всем пациентам проводился объем диагностических и лечебных мероприятии в соответствии с актуальными клиническими рекомендациями по ведению пациентов с ОКС с подъемом сегмента ST и без подъема сегмента ST Минздрава РФ [20]. Оценивались клинико-анамнестические данные больных, результаты лабораторных исследований (общий анализ крови, биохимический анализ крови, в т.ч. уровень С-реактивного белка, тропонина I в динамике, коагулограмма, исследование титра антител IgM/IgG к SARS-CoV-2 полуколичественным методом, исследование методом полимеразной цепной реакции (ПЦР) мазка из рото- и носоглотки SARS-CoV-2), результаты инструментальных методов исследования (электрокардиография (ЭКГ), эхокардиография (ЭхоКГ), КАГ). Изучено клиническое течение в госпитальном периоде, летальность и частота развития осложнений.
Статистический анализ данных выполнялся при помощи программ Excel 2016 ("Microsoft", США) и JMP Pro 17 ("SAS", США). Для оценки соответствия распределения непрерывных данных использовался критерий Колмогорова-Смирнова с коррекцией Лиллиефорса. Показатели с нормальным распределением или близкому к нему описывались средним и стандартным отклонением ("M±SD"), в ином случае — в виде медианы и интерквартильного размаха ("Me [Q25%; Q75%]"). Качественные признаки представлены в виде долей и частот выявления признака (%). Значимость различий между группами по количественным данным оценивалась с помощью U-критерия Манна-Уитни, для качественных показателей — χ2 Пирсона и точного критерия Фишера. Для оценки влияния факторов на исход применялась модель бинарной логистической регрессии с определением отношения шансов (ОШ) и 95% доверительного интервала (ДИ). При проверке статистических гипотез, уровень значимости был зафиксирован на уровне ошибки первого рода равной 0,05.
Результаты
Средний возраст пациентов составил 64,1±12,8 лет. Большинство больных составляли мужчины 61,5% (n=240). Доля больных с повторным ИМ — 31,0% (n=121), артериальной гипертензией (АГ) — 74,6 (n=291), сахарным диабетом (СД) 2 типа — 30,0% (n=113). АСК получали 26,9% (n=105), ПОАК — 10,5% (n=41) больных.
В зависимости от получаемой терапии пациенты были разделены на две группы, в основную группу вошел 41 пациент, находящейся на постоянной терапии ПОАК, а в контрольную группу — 349 пациентов, не принимавших ПОАК.
В табл. 1 представлены клинико-анамнестические характеристики пациентов в изучаемых группах. Подавляющее большинство составляли лица мужского пола. Пациенты основной группы были старше, 68,3% (n=28) составляли больные 65 лет и старше (р=0,0033). Среди пациентов основной группы отмечалась большая доля лиц, которым ранее проводилось аортокоронарное шунтирование, с перенесенным острым нарушением мозгового кровообращения (ОНМК), а также с венозными тромбозами в анамнезе (р<0,01). Фибрилляция предсердий (ФП) отмечалась у 75,6% (n=31) больных основной группы (р<0,0001), среди них постоянная форма в 19,3% (n=6) случаев.
Таблица 1. Клинико-анамнестическая характеристика пациентов с ИМ
|
Показатель |
Основная группа (n=41) |
Контрольная группа (n=349) |
p |
|
Мужской пол, n (%) |
25 (61,0) |
215 (61,6) |
0,9376 |
|
Возраст, лет |
73,0 [ 62,0; 82,0] |
63,0 [ 56,0; 71,0] |
<0,0001 |
|
Возраст ≥65 лет, n (%) |
28 (68,3) |
154 (44,1) |
0,0033 |
|
ИМТ, кг/м² |
29,0 [ 28,0; 31,0] |
30,0 [ 27,0; 34,0] |
0,1045 |
|
Индекс коморбидности Charlson |
3,0 [ 2,0; 4,0] |
3,0 [ 2,0; 4,0] |
0,1395 |
|
Стенокардия напряжения в анамнезе, n (%) |
36 (87,8) |
266 (76,2) |
0,0931 |
|
ПИКС, n (%) |
14 (34,1) |
107 (30,7) |
0,6479 |
|
ЧКВ в анамнез, n (%) |
7 (17,1) |
50 (14,3) |
0,6377 |
|
АКШ, n (%) |
3 (7,3) |
5 (1,4) |
0,0119 |
|
Наследственность, n (%) |
7 (17,1) |
61 (17,5) |
0,9484 |
|
Сахарный диабет, n (%) |
9 (22,0) |
104 (29,8) |
0,2947 |
|
Гипертоническая болезнь, n (%) |
32 (78,0) |
259 (74,2) |
0,5933 |
|
ОНМК, n (%) |
16 (39,0) |
34 (9,7) |
<0,0001 |
|
Венозные тромбозы, n (%) |
6 (14,6) |
11 (3,2) |
0,0007 |
|
ФП, n (%) |
31 (75,6) |
45 (12,9) |
<0,0001 |
|
Постоянная форма ФП, n (%) |
4 (12,9) |
6 (13,3) |
1,0 |
|
COVID-19 в анамнезе, n (%) |
12 (29,3) |
154 (44,1) |
0,0687 |
Данные представлены как медиана и межквартильный интервал — Ме [ Q25; Q75],
если не указано иное
АКШ — аортокоронарное шунтирование,
ИМТ — индекс массы тела,
ОНМК — острое нарушение мозгового кровообращения,
ПИКС — постинфарктный кардиосклероз,
ФП — фибрилляция предсердий,
ЧКВ — чрескожное коронарное вмешательство,
COVID-19 — COronaVIrus Disease 2019
На рис. 1 представлена частота приема различных ПОАК. Практически половина больных (48,8% (n=20)) получала ривароксабан в дозировках 15 и 20 мг в сутки (15% (n=3) и 85% (n=17), соответственно), а четверть — варфарин (24,4% (n=10)), при этом 8 пациентов амбулаторно не контролировали величину международного нормализованного отношения (МНО), 1 пациент проводил самостоятельный контроль МНО с помощью портативного коагулометра и лишь у 1 пациента имелись записи о регулярном контроле МНО в поликлинике по месту жительства в сроки, установленные лечащим врачом.
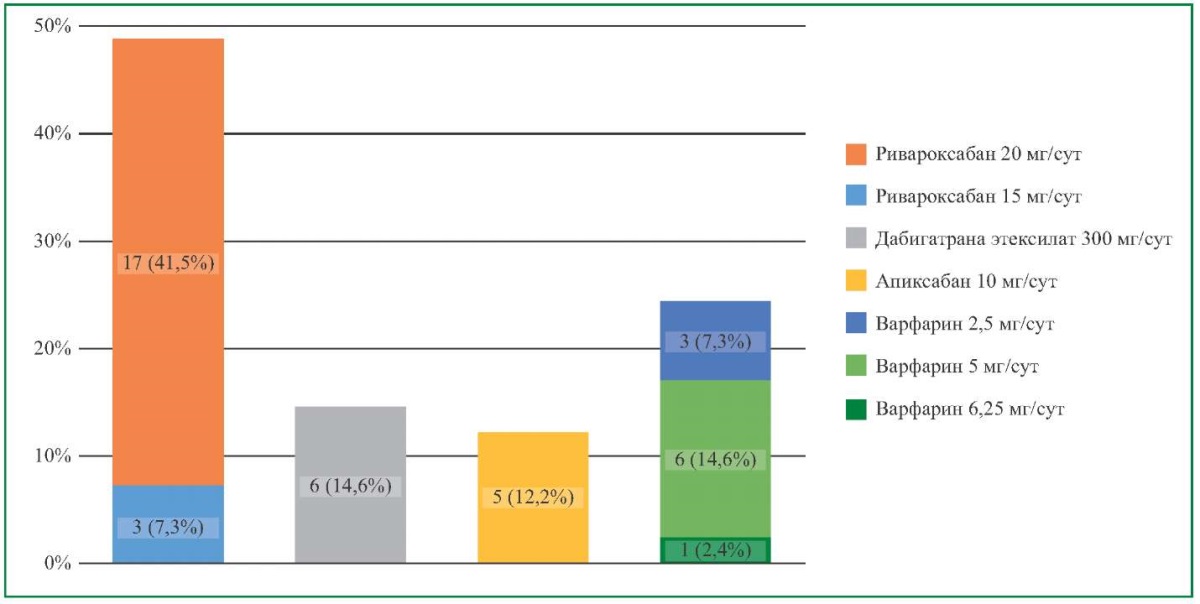
Рисунок 1. Получаемые прямые пероральные антикоагулянты
Пациенты основной группы значимо чаще принимали антиаритмические препараты (14,6% vs 0,9%, p<0,0001) и несколько реже статины (7,3% vs 19,5%), однако статистическая значимость межгрупповых различий не достигнута (р=0,0562). По частоте применения основных групп лекарственных препаратов в период, предшествующий настоящей госпитализации (табл. 2), обе группы статистически значимо между собой не различались (р>0,05).
Таблица 2. Медикаментозная терапия до развития ИМ у больных
|
Показатель |
Основная группа (n=41) |
Контрольная группа (n=349) |
p |
|
Ацетилсалициловая кислота, n (%) |
8 (19,5) |
97 (27,8) |
0,2581 |
|
иАПФ, n (%) |
8 (19,5) |
80 (22,9) |
0,6212 |
|
БРА, n (%) |
6 (14,6) |
40 (11,5) |
0,5513 |
|
Антагонисты кальция, n (%) |
3 (7,3) |
31 (8,9) |
0,7368 |
|
Бета-блокаторы, n (%) |
11 (26,8) |
63 (18,1) |
0,1751 |
|
Нитраты, n (%) |
4 (9,8) |
36 (10,3) |
0,9111 |
|
Статины, n (%) |
3 (7,3) |
68 (19,5) |
0,0562 |
|
Антагонисты альдостерона, n (%) |
1 (2,4) |
23 (6,6) |
0,2954 |
|
Антиаритмические препараты, n (%) |
6 (14,6) |
3 (0,9) |
<0,0001 |
БРА — блокаторы рецепторов ангиотензина-II,
иАПФ — ингибиторы ангиотензинпревращающего фермента
У большинства пациентов диагностирован инфаркт миокарда без подъема сегмента ST (ИМбпST, табл. 3). В основной группе инфаркт миокарда с подъемом сегмента ST (ИМпST) регистрировался в 39,0% (n=16) случаев, тогда как в контрольной группе — в 47,3% (n=165), однако различия оказались статистически не значимыми (p=0,3161). В обеих группах преобладали больные с передней локализацией ИМ (p=0,0546). По временным интервалам от появления первых симптомов ишемии миокарда до госпитализации в стационар и до выполнения КАГ обе группы между собой сопоставимы (р=0,5695).
Таблица 3. Сроки развития и локализация ИМ и данные объективного обследования пациентов с ИМ
|
Показатель |
Основная группа (n=41) |
Контрольная группа (n=349) |
p |
|
ИМпST, n (%) |
16 (39,0) |
165 (47,3) |
0,3161 |
|
ИМбпST, n (%) |
25 (61,0) |
184 (52,7) |
|
|
Передняя локализация, n (%) |
25 (61,0) |
172 (49,3) |
0,0546 |
|
Нижняя локализация, n (%) |
8 (19,5) |
133 (38,1) |
|
|
Боковая локализация, n (%) |
8 (19,5) |
44 (12,6) |
|
|
Время от первого контакта до госпитализации, мин |
44,0 [ 37,0; 66,0] |
61,00 [ 38,0; 85,50] |
0,1587 |
|
Время от появления симптомов до КАГ, мин |
240,0 [ 195,0; 360,0] |
240,0 [ 150,0; 330,0] |
0,5695 |
|
САД, мм рт.ст. |
131,0 [ 112,0; 150,0] |
135,0 [ 122,0; 148,0] |
0,4649 |
|
ДАД, мм рт.ст. |
74,0 [ 67,0; 90,0] |
80,0 [ 73,0; 90,0] |
0,1706 |
|
ЧСС, уд/мин |
82,0 [ 72,0; 96,0] |
76,0 [ 67,0; 90,0] |
0,0352 |
|
SpO2, % |
96,0 [ 94,0; 97,0] |
97,0 [ 96,0; 98,0] |
0,0629 |
|
Killip I, n (%) |
25 (61,0) |
263 (75,4) |
0,1549 |
|
Killip II, n (%) |
9 (22,0) |
51 (14,6) |
|
|
Killip III, n (%) |
4 (9,8) |
26 (7,4) |
|
|
Killip IV, n (%) |
3 (7,3) |
9 (2,6) |
|
|
Низкий риск (GRACE), n (%) |
0 (0,0) |
45 (12,9) |
<0,0001 |
|
Средний риск (GRACE), n (%) |
6 (14,6) |
128 (36,7) |
|
|
Высокий риск (GRACE), n (%) |
35 (85,4) |
176 (50,4) |
Данные представлены как медиана и межквартильный интервал — Ме [ Q25; Q75],
если не указано иное
ДАД — диастолическое артериальное давление,
ИМбпST — инфаркт миокарда без подъема сегмента ST,
ИМпST — инфаркт миокарда с подъемом сегмента ST,
КАГ — коронароангиография,
САД — систолическое артериальное давление,
ЧСС — частота сердечных сокращений
Выраженность явлений острой сердечной недостаточности Killip I-II наблюдалась у подавляющего большинства больных в обеих группах (р=0,1549, см. табл. 3). Пациенты основной группы статистически значимо чаще относились к категории высокого госпитальной риска в соответствии со шкалой GRACE 1.0 по сравнению с пациентами контрольной группы (85,4% (n=35) и 50,4% (n=176), p<0,0001).
В табл. 4 представлены данные инструментальных методов обследования. Возврат сегмента ST к изо линии на ЭКГ при поступлении в стационар значимо чаще регистрировался у пациентов основной группы (р=0,0238). Эпизоды полной АВ-блокады выявлялись у 12,2% (n=5) больных основной группы, что статистически значимо чаще, по сравнению с контрольной группой — 3,7% (n=12) (р=0,0240). По данным ЭхоКГ, объему поражения коронарного русла, частоте выполнения чрескожного коронарного вмешательства (ЧКВ) изучаемые группы были сопоставимы (р>0,05). Феномен no/slow reflow отмечался у 4,3% (n=17) пациентов, значимых различий между группами не выявлено (р=0,3268).
Таблица 4. Данные инструментального обследования пациентов с ИМ
|
Показатель |
Основная группа (n=41) |
Контрольная группа (n=349) |
p |
|
ЭКГ |
|||
|
Резолюция сегмента ST на ЭКГ при поступлении в стационар*, n (%) |
7 (43,8) |
30 (18,1) |
0,0238 |
|
Преходящая АВ блокада 3 ст, n (%) |
5 (12,2) |
12 (3,7) |
0,0240 |
|
Пароксизм ФП, n (%) |
7 (17,1) |
28 (8,0) |
0,0765 |
|
ФЖ на ДГЭ, n (%) |
3 (7,3) |
12 (3,7) |
0,2014 |
|
Частая ЖЭС, n (%) |
1 (2,4) |
18 (5,2) |
0,7068 |
|
ЭхоКГ |
|||
|
Нормокинез, n (%) |
4 (10,8) |
45 (13,3) |
0,1506 |
|
Гипокинез, n (%) |
13 (35,1) |
146 (43,2) |
|
|
Акинез, n (%) |
14 (37,8) |
126 (37,3) |
|
|
Дискинез, n (%) |
6 (16,2) |
21 (6,2) |
|
|
ФВ ЛЖ, % |
46,0 [ 36,5; 55,0] |
49,0 [ 43,0; 55,0] |
0,1624 |
|
КАГ |
|||
|
TIMI 0-1, n (%) |
16 (39,0) |
166 (47,6) |
0,2998 |
|
TIMI 2-3, n (%) |
25 (61,0) |
183 (52,4) |
|
|
Правый тип КК, n (%) |
29 (70,7) |
245 (70,2) |
0,0998 |
|
Многососудистое поражение, n (%) |
13 (31,7) |
122 (35,0) |
0,6791 |
|
Стентирование ИОА, n (%) |
38 (92,7) |
336 (96,3) |
0,2727 |
|
ЧКВ на других сосудах, n (%) |
2 (4,9) |
39 (11,2) |
0,2137 |
|
Феномен no/slow reflow, n (%) |
3 (7,3) |
14 (4,0) |
0,3268 |
|
SyntaxScore, баллов |
11,5 [ 8,5; 30,0] |
16,0 [ 9,5; 28,0] |
0,7589 |
* — для пациентов с ИМпST (n=16 в основной группе, n=165 в контрольной группе)
Данные представлены как медиана и межквартильный интервал — Ме [ Q25; Q75],
если не указано иное
АВ — атривеонтрикулярная,
ДГЭ — догоспитальный этап,
ЖЭС — желудочковая экстрасистолия,
ИОА — инфаркт-ответственная артерия,
КАГ — коронароангиография,
КК — коронарный кровоток,
ФВ ЛЖ — фракция выброса левого желудочка,
ФЖ — фибрилляция желудочков,
ФП — фибрилляция предсердий,
ЧКВ — чрескожное коронарное вмешательство,
ЭКГ — электрокардиография,
ЭхоКГ — эхокардиография
По результатам лабораторных исследований, у пациентов основной группы отмечался меньший уровень эритроцитов, более низкая концентрация гемоглобина, холестерина по сравнению с пациентами контрольной группы (p<0,05) (табл. 5). Уровень креатинина плазмы, величина протромбинового времени и МНО оказались значимо выше в основной группе (p<0,05). Значение МНО у пациентов получающих варфарин составило 2,1 [ 1,7; 2,9], 7 пациентов из 10 достигли целевых значений (МНО 2-3), у 1 больного значение МНО составило 4,8 и потребовало временного прекращения приема варфарина.
Таблица 5. Результаты лабораторных исследований у пациентов с ИМ
|
Показатель |
Основная группа (n=41) |
Контрольная группа (n=349) |
p |
|
Общий и биохимический анализ крови |
|||
|
Эритроциты, 10¹²/л |
4,3 [ 3,5; 4,6] |
4,7 [ 4,3; 5,0] |
0,0002 |
|
Гемоглобин, г/л |
132,0 [ 111,0; 144,0] |
139,5 [ 127,3; 151,0] |
0,0015 |
|
Лейкоциты, 10⁹/л |
8,70 [ 7,8; 10,5] |
9,45 [ 7,7; 11,9] |
0,4416 |
|
Тромбоциты ,10⁹/л |
235,0 [ 202,0; 263,0] |
250,5 [ 207,5; 296,8] |
0,0536 |
|
Креатинин, мкмоль/л |
102,4 [ 94,1; 124,5] |
92,0 [ 77,8; 106,1] |
0,0015 |
|
Общий холестерин, ммоль/л |
4,5 [ 3,7; 5,0] |
5,0 [ 4,0; 6,1] |
0,0261 |
|
Калий, ммоль/л |
4,4 [ 4,1; 4,8] |
4,2 [ 3,9; 4,6] |
0,1239 |
|
CРБ, мг/л |
15,4 [ 5,9; 20,9] |
15,0 [ 5,0; 42,5] |
0,7308 |
|
Тропонин I, нг/мл |
2,4 [ 0,9; 9,1] |
4,1 [ 1,7; 10,4] |
0,2646 |
|
Коагулограмма |
|||
|
АЧТВ, сек |
28,2 [ 25,5; 36,5] |
25,8 [ 22,1; 29,2] |
0,0748 |
|
Протромбиновое время, сек |
14,7 [ 13,1; 16,6] |
12,9 [ 12,0; 14,1] |
0,0089 |
|
МНО |
1,4 [ 1,2; 1,5] |
1,2 [ 1,1; 1,3] |
0,0063 |
|
Фибриноген, г/л |
5,04 [ 4,1; 6,0] |
3,4 [ 2,4; 5,0] |
0,5170 |
Данные представлены как медиана и межквартильный интервал — Ме [ Q25; Q75],
если не указано иное
АЧТВ — активированное частичное тромбопластиновое время,
СРБ — с-реактивный белок,
МНО — международное нормализованное отношение
Все пациенты основной группы на госпитальном этапе получали тройную антитромботическую терапию: АСК, клопидогрел и ПОАК. Пациенты контрольной группы получали двойную антитромбоцитарную терапию: АСК, ингибитор P2Y12 (прасугрел или тикагрелор и в двух случаях клопидогрел).
Средняя продолжительность госпитализации составила 8,0 [ 6,0; 9,0] дней для пациентов обеих групп (табл. 6). Пароксизмы ФП значимо чаще наблюдались в основной группе пациентов, по сравнению с контрольной (p=0,0032). В основной группе зарегистрировано 7,3% (n=3) случаев желудочно-кишечных кровотечения (ЖКК) на фоне обострения язвенной болезни желудка, тогда как в контрольной группе — 1,7% (n=6), ОШ 4,5 (95% ДИ 1,09–18,78; p=0,038). Общая летальность составила 6,7% (n=26), из которых 12,2% (n=5) в основной группе и 6,0% (n=21) в контрольной (p=0,1336). В основной группе не зарегистрировано ни одного случая тромбоза стента, в группе контроля отмечался 1 случай острого и 1 случай подострого тромбоза ранее имплантированного стента (р=0,6270).
Таблица 6. Госпитальные исходы и осложнения у пациентов с ИМ
|
Показатель |
Основная группа (n=41) |
Контрольная группа (n=349) |
p |
|
Длительность госпитализации, дни |
9,0 [ 7,0; 10,0] |
8,0 [ 5,0; 9,0] |
0,0731 |
|
Пароксизм ФП, n (%) |
7 (17,1) |
14 (4,0) |
0,0032 |
|
Тромбоз стента, n (%) |
0 (0,0) |
2 (0,6) |
0,6270 |
|
ОНМК, n (%) |
1 (2,4) |
4 (1,1) |
0,4864 |
|
ЖКК, n (%) |
3 (7,3) |
6 (1,7) |
0,0579 |
|
Летальный исход, n (%) |
5 (12,2) |
21 (6,0) |
0,1336 |
Данные представлены как медиана и межквартильный интервал — Ме [ Q25; Q75],
если не указано иное
ЖКК — желудочно-кишечное кровотечение,
ФП — фибрилляция предсердий,
ОНМК — острое нарушение мозгового кровообращения
В результате многофакторного анализа с поправкой на пол, возраст, индекс массы тела, тип ИМ, наличие СД, тяжесть острой сердечной недостаточности, степень поражения коронарного русла, значимости, в качестве независимого предиктора исхода, факт постоянного приема ПОАК не продемонстрировал — ОШ 1,47 (95% ДИ 0,37–5,85; p=0,5110). Аналогичные результаты получены и при оценке шансов развития ЖКК — ОШ 3,96 (95% ДИ 0,76– 20,66; p=0,6120).
Обсуждение
В результате выполненного анализа не удалось выявить значимого влияния постоянного приема ПОАК на клиническое течение ИМ. Пациенты основной и контрольной группы оказались сопоставимы как по типу ИМ, так и по изученным характеристикам антеградного кровотока в ИОА.
Важно отметить, что все пациенты с ИМ, в соответствии с клиническими рекомендациями, в остром периоде получали инфузию нефракционированного гепарина или инъекции низкомолекулярных гепаринов, а после проведения ЧКВ — тройную антитромботическую терапию в составе АСК, ингибитора P2Y12 и привычного ПОАК в рекомендованной лечебной дозировке [21][22].
Пациенты изучаемой нами когорты, в целом оказались более отягощенными по факторам риска в сравнении с пациентами московского регистра ОКС [23]. Около 30% пациентов имели СД, переносили ранее ИМ и отмечали клинические проявления предшествующей стенокардии напряжения, что существенно чаще показателей, представленных в регистре. Группа пациентов, постоянно получавших ПОАК была значимо старше, треть из них переносили ранее ИМ, чаще отмечались ОНМК, имели более выраженный коморбидный фон; подавляющее большинство больных составляли пациенты с ФП и тромбозами, что и являлось фактором, определившим постоянный прием ПОАК.
Наиболее частым ПОАК, назначенным в изученной когорте больных, был ривароксабан, что, по всей видимости, связано с его относительно высокой популярностью среди врачебного сообщества, доказанной эффективностью и безопасностью [24]. Также обращает на себя внимание значительная доля больных, получающих варфарин (практически четверть пациентов принимали антагонист витамина К). Однако ни один из них не имел данных, указывающих на наличие объективных противопоказаний к приему ПОАК. Учитывая ретроспективный дизайн исследования, установить обоснованность назначения варфарина в каждом конкретном случае не представлялось возможным, однако одной из вероятных причин, может быть экономический аспект. Данные ранее опубликованных отчетов указывают, что несмотря на повышение доступности ПОАК в льготной сети, применение варфарина до сих пор остается на достаточно высоком уровне [16][25].
В группе ПОАК основная доля пациентов получала бета-блокаторы, в то время как амиодарон и соталол принимали лишь небольшое число больных. Также обращает на себя внимание низкая частота приема статинов в целом, несмотря на высокую коморбидность и частоту ишемических событий в анамнезе [26].
Основной контингент включенных пациентов характеризовался высоким расчетным госпитальным риском по шкале GRACE 1.0, что в т.ч. обусловлено критериями включения в исследования (верифицированный ИМ, наличие стенозирующего атеросклеротического поражения по данным КАГ), а также особенностями и сроками маршрутизации пациентов более высокого риска в ангиографическую лабораторию. Так, пациенты низкого и среднего риска, у которых по каким-либо причинам не выполнялась КАГ, в выборку не вошли.
Более низкий уровень эритроцитов и гемоглобина в группе, находившейся на терапии ПОАК, косвенно может являться следствием побочных эффектов, обусловленных приемом ПОАК. Однако важно отметить, что средние значения, не выходили за пределы референтного интервала.
По результатам КАГ, у пациентов, получающих ПОАК реже наблюдалась окклюзия ИОА, по сравнению с теми, кто не принимал ПОАК, однако несмотря на это группы были сопоставимы по тяжести клинического течения, выраженности нарушений сократительной функции миокарда, летальности.
Между тем, можно отметить тенденцию к несколько более высокой частоте ЖКК в госпитальном периоде (7,3%) у пациентов, получавших ПОАК, по сравнению с пациентами, не получавшими ПОАК (1,7%), которая имеет объективные основания достичь статистической значимости при увеличении объема выборки.
ПОАК продолжают набирать популярность в качестве эффективного и безопасного дополнения к стандартной антитромбоцитарной терапии у пациентов с ИБС высокого коронарного риска для профилактики сосудистых осложнений. Анализ эффективности приема ПОАК у пациентов с острой коронарной патологией представляется перспективным направлением для будущих исследований.
Ограничение исследования
Небольшой объем выборки и ретроспективный дизайн, который не позволял получить ряд важных данных о применении ПОАК, таких как длительность приема препаратов, их дозировка, регулярность, частота малых и больших кровотечений и пр., что, несомненно, играет существенную роль при оценке эффективности проводимой терапии.
Заключение
В результате проведенного исследования установлено, что у пациентов с ИМ, находящихся на постоянной терапии ПОАК, значимо чаще регистрировался возврат сегмента ST к изолинии при поступлении в стационар, однако, несмотря на более старший возраст, и более высокий риск по шкале GRACE 1.0, летальность и частота развития осложнений в госпитальном периоде сопоставима с группой больных, не получавших ПОАК.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование. Исследование проведено при поддержке Национального медицинского исследовательского центра терапии и профилактической медицины.
Funding. The study was performed with the support of National Research Center for Therapy and Preventive Medicine.
Список литературы
1. Шальнова С. А., Драпкина О. М., Куценко В. А., и др. Инфаркт миокарда в популяции некоторых регионов России и его прогностическое значение. Российский кардиологический журнал. 2022;27(6):4952. DOI:10.15829/1560-4071-2022-4952.
2. Рягина В. А., Матрёнин К. И., Щуров Д. Г., Тепцова Т. С. Фармакоэкономический анализ применения антитромботической терапии у пациентов с острым коронарным синдромом, а также у пациентов с фибрилляцией предсердий, подвергшихся чрескожному коронарному вмешательству. Фармакоэкономика. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(4):407-417. DOI:10.17749/2070-4909/farmakoekonomika.2022.156.
3. Горбачева Н. С., Веселовская Н.Г, Николаева М. Г., и др. Новые факторы риска острого инфаркта миокарда у мужчин молодого возраста. Кардиология: Новости Мнения Обучение. 2022;10:42-9. DOI:10.33029/2309-1908-2022-10-3-42-49.
4. Еремкина Т. Я., Сычев И. В., Рыжов А. В., и др. Патогенетические механизмы развития инфаркта миокарда без обструктивного атеросклероза коронарных артерий: современный взгляд на проблему. Современные Проблемы Науки и Образования. 2020; 150:1. DOI:10.17513/spno.29918.
5. Aslanger EK. Beyond the ST-segment in Occlusion Myocardial Infarction (OMI): Diagnosing the OMI-nous. Turkish J Emerg Med. 2023;23:1-4. DOI:10.4103/2452-2473.357333.
6. Помозова Т. П., Лыков Ю. В., Комарова И. С., и др. Клинико-лабораторные особенности первичного острого инфаркта миокарда у пациентов с обструктивным и необструктивным коронарным атеросклерозом. Кардиология. 2019;59(10S):41-51. DOI:10.18087/cardio.2640.
7. Kontsevaya AV, Bates K, Schirmer H, et al. Management of patients with acute ST-segment elevation myocardial infarction in Russian hospitals adheres to international guidelines. Open Heart. 2020;7. DOI:10.1136/openhrt-2019-001134.
8. Кашталап В. В., Барбараш О. Л. Актуальные проблемы антитромботической терапии при остром коронарном синдроме. Медицинский совет. 2017;12:82-88. DOI:10.21518/2079-701X-2017-12-82-88.
9. Соловьева М. В., Болдуева С. А. Антитромботическая терапия и ее влияние на прогноз у больных с фибрилляцией предсердий, перенесших инфаркт миокарда. Данные многолетнего наблюдения. CardioСоматика. 2021;12(3):158-165. DOI:10.17816/22217185.2021.3.201044.
10. Reagan WJ, Brooks MB, Grozovsky R, et al. To Clot or Not to Clot: Deepening Our Understanding of Alterations in the Hemostatic System. Toxicol Pathol. 2022;50(7):890-4. DOI:10.1177/01926233221125172.
11. Margetić S, Goreta SŠ, Ćelap I, et al. Direct oral anticoagulants (DOACs): From the laboratory point of view. Acta Pharm. 2022;72:459-82. DOI:10.2478/acph-2022-0034.
12. Wang W, Huang Q, Pan D, et al. The optimal duration of triple antithrombotic therapy in patients with atrial fibrillation and acute coronary syndrome or undergoing percutaneous coronary intervention: A network meta-analysis of randomized clinical trials. Int J Cardiol. 2022;357:33-8. DOI:10.1016/j.ijcard.2022.03.047.
13. Haller PM, Sulzgruber P, Kaufmann C, et al. Bleeding and ischaemic outcomes in patients treated with dual or triple antithrombotic therapy: systematic review and meta-analysis. Eur Hear J Cardiovasc Pharmacother. 2019;5:226-36. DOI:10.1093/EHJCVP/PVZ021.
14. Fanaroff AC, Hasselblad V, Roe MT, et al. Antithrombotic Agents for Secondary Prevention after Acute Coronary Syndromes: A Systematic Review and Network Meta-Analysis. Int J Cardiol. 2017;241:87. DOI:10.1016/J.IJCARD.2017.03.046.
15. Liu J, Fan M, Zhao J, et al. Efficacy and safety of antithrombotic regimens after coronary intervention in patients on oral anticoagulation: Traditional and Bayesian meta-analysis of clinical trials. Int J Cardiol. 2016;205:89-96. DOI:10.1016/j.ijcard.2015.12.005.
16. Панченко Е. П. Осталось ли место для варфарина после появления прямых оральных антикоагулянтов? Атеротромбоз. 2022;12(2):32-42. DOI:10.21518/2307-1109-2022-12-2-32-42.
17. Nakase T, Moroi J, Ishikawa T. Anti‐inflammatory and antiplatelet effects of non‐vitamin K antagonist oral anticoagulants in acute phase of ischemic stroke patients. Clin Transl Med. 2018;7:2-7. DOI:10.1186/s40169-017-0179-9.
18. Borst O, Münzer P, Alnaggar N, et al. Inhibitory mechanisms of very low-dose rivaroxaban in non-ST-elevation myocardial infarction. Blood Adv. 2018;2:715-30. DOI:10.1182/bloodadvances.2017013573.
19. Ghattas A, Shantsila E, Lip GYH. Antithrombotic therapy after percutaneous coronary intervention in anticoagulated patients: A fine balance between thrombosis and bleeding. Ther Adv Cardiovasc Dis. 2011;5:5-9. DOI:10.1177/1753944710397225.
20. Клинические рекомендации 2020. Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы. Российский Кардиологический Журнал. 2020;51(11):251-310. DOI:10.15829/29/1560-4071-2020-4103.
21. Явелов И. С. Парентеральные антикоагулянты в лечении острого коронарного синдрома: что говорят современные клинические рекомендации. Атеротромбоз. 2022;12(1):46-58. DOI:10.21518/2307-1109-2022-12-1-46-58
22. Барбараш О. Л., Дупляков Д. В., Затейщиков Д. А. и др. Острый коронарный синдром без подъема сегмента ST электрокардиограммы. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(4):4449. DOI:10.15829/1560-4071-2021-4449.
23. Эрлих А. Д. Первый московский регистр острого коронарного синдрома: результаты 6-месячного наблюдения. Неотложная кардиология. 2014;(2):3-9.
24. Turpie AGG. Advances in oral anticoagulation treatment: The safety and efficacy of rivaroxaban in the prevention and treatment of thromboembolism. Ther Adv Hematol. 2012;3:309-23. doi:10.1177/2040620712453067.
25. Тавлуева Е. В., Савкова О. Н., Зернова Е. В. и др. Частота использования пероральных антикоагулянтов в реальной клинической практике у пациентов, госпитализированных с острым ишемическим инсультом. Российский кардиологический журнал. 2022;27(12):5149. DOI:10.15829/1560-4071-2022-5149.
26. Жаркова Е. Д., Марцевич С. Ю., Лукина Ю. В. и др. Оценка качества медикаментозной терапии у пациентов со стабильно протекающей ишемической болезнью сердца в рамках второго этапа исследования ALIGN. Рациональная Фармакотерапия в Кардиологии. 2022;18(3):306-310. DOI:10.20996/1819-6446-2022-06-12.
Об авторах
М. Г. ЧащинРоссия
Чащин Михаил Георгиевич – кандидат медицинских наук, научный сотрудник отдела фундаментальных и прикладных аспектов ожирения.
Москва
А. Ю. Горшков
Россия
Горшков Александр Юрьевич - кандидат медицинских наук, руководитель лаборатории микроциркуляции и регионарного кровообращения.
Москва
О. М. Драпкина
Россия
Драпкина Оксана Михайловна - профессор, доктор медицинских наук, академик РАН, директор ФГБУ НМИЦ ТПМ Минздрава России.
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Чащин М.Г., Горшков А.Ю., Драпкина О.М. Госпитальные исходы инфаркта миокарда у пациентов, постоянно получающих прямые пероральные антикоагулянты. Рациональная Фармакотерапия в Кардиологии. 2023;19(5):452-460. https://doi.org/10.20996/1819-6446-2023-2962. EDN: FXCKDI
For citation:
Chashchin M.G., Gorshkov A.Yu., Drapkina O.M. Inhospital outcomes of myocardial infarction in patients receiving direct oral anticoagulants. Rational Pharmacotherapy in Cardiology. 2023;19(5):452-460. (In Russ.) https://doi.org/10.20996/1819-6446-2023-2962. EDN: FXCKDI

















































