Перейти к:
Композиционный состав тела и функциональная активность у мужчин с хронической сердечной недостаточностью
https://doi.org/10.20996/1819-6446-2023-2975
EDN: EQDNAW
Аннотация
Цель. Оценить компоненты состава тела и показатели функциональной активности (ФА) у мужчин с хронической сердечной недостаточностью (ХСН) различного генеза в зависимости от стадии, функционального класса (ФК) и эхокардиографических характеристик заболевания.
Материал и методы. В исследование включены 100 мужчин в возрасте 23-70 лет. Основную группу составили 60 мужчин с ХСН, контрольную группу — 40 мужчин без ХСН. Количественное определение состава тела (жировой, безжировой и костной массы тела), проводилось методом двухэнергетической рентгеновской абсорбциометрии (dual-energy X-ray absorptiometry, DXA). Оценка ФА проводилась с помощью динамометрии кистевого жима, краткой батареи тестов физической активности (The Short Physical Performance Battery, SPPB), теста "6-минутой ходьбы" (ТШХ), теста "Встань и иди".
Результаты. В группе ХСН обнаружено значимое снижение общей костной массы, костной массы туловища и конечностей, общей мышечной массы, мышечной массы туловища и конечностей, индекса аппендикулярной скелетной мускулатуры (АСМИ), а также показателей ФА по мере нарастания ФК ХСН. Количество жировой массы не различалось у лиц с разным ФК и стадией ХСН. ФК ХСН был независимым фактором снижения общей костной массы (b=-301,9, р=0,015), общей мышечной массы (b=-1903, р=0,03), костной массы конечностей (b=-147,6, р=0,013) и аппендикулярной мышечной массы (АММ) (b=-1903, р=0,001). Общая костная масса (b=-2,637, р=0,02) и АММ (b=-3,512, р=0,01) независимо связаны со стадией ХСН по ВасиленкоСтражеско; АММ также имела независимую связь с фракцией выброса левого желудочка (ФВ ЛЖ) (b=0,274, р=0,03). Средние показатели состава тела не различались между основной и контрольной группами, тогда как показатели кистевой динамометрии, ТШХ, SPPB и теста "Встань и иди" были значимо хуже в группе ХСН. ФК ХСН по NYHA, стадия ХСН, ФВ ЛЖ, конечно-диастолический объем левого желудочка (КДО ЛЖ) и систолическое давление в легочной артерии (СДЛА) вносили независимый вклад в снижение показателей ФА у мужчин с ХСН.
Заключение. У пациентов с ХСН отмечено ухудшение костно-мышечных параметров в зависимости от ФК ХСН, стадии заболевания и ФВ ЛЖ, без значимых различий в сравнении с группой контроля. Не было выявлено связи жировой массы с наличием заболевания, его клиническими и эхокардиографическими характеристиками. Средние показатели мышечной силы и тестов ФА снижены у мужчин с ХСН по сравнению с контрольной группой и зависели от ФК и стадии ХСН, ФВ ЛЖ, КДО ЛЖ и СДЛА.
Ключевые слова
Для цитирования:
Скрипникова И.А., Яралиева Э.К., Мясников Р.П., Куликова О.В., Новиков В.Е., Косматова О.В., Выгодин В.А., Драпкина О.М. Композиционный состав тела и функциональная активность у мужчин с хронической сердечной недостаточностью. Рациональная Фармакотерапия в Кардиологии. 2023;19(6):557-564. https://doi.org/10.20996/1819-6446-2023-2975. EDN: EQDNAW
For citation:
Skripnikova I.A., Yaralieva E.K., Myasnikov R.P., Kulikova O.V., Novikov V.E., Kosmatova O.V., Vygodin V.A., Drapkina O.M. Body composition and functional activity in men with heart failure. Rational Pharmacotherapy in Cardiology. 2023;19(6):557-564. (In Russ.) https://doi.org/10.20996/1819-6446-2023-2975. EDN: EQDNAW
Введение
Хроническая сердечная недостаточность (ХСН) представляет собой сложный синдром, который сопровождается активацией нейрогормонов, провоспалительным состоянием, метаболическими нарушениями, преобладанием катаболических процессов, что в значительной степени влияет на состав тела [1][2]. Накопленные данные свидетельствуют о том, что патофизиология симптомов при ХСН обусловлена сложным взаимодействием сердечно-сосудистой системы, жировой и скелетно-мышечной ткани. При этом разнонаправленные изменения в составе тела в виде ожирения, саркопении, саркопенического ожирения, кахексии имеют высокую распространенность у пациентов с ХСН [3].
Потеря мышечной массы, силы и функциональных возможностей могут приводить к повышенной вероятности падений и связанных с ними переломов, развитию синдрома хрупкости, снижению физической работоспособности и качества жизни [4]. Непереносимость физических нагрузок — ключевой симптом при ХСН, который обусловлен не только нарушением гемодинамики, но и изменениями в скелетной мускулатуре [5]. Было показано, что патология скелетных мышц при ХСН характеризуется количественными и качественными изменениями, включая биохимические, гистологические и функциональные нарушения [6]. Несмотря на это, мышечная ткань у пациентов с ХСН мало изучалась в клинических исследованиях.
Ожирение повышает вероятность развития ХСН, являясь основным независимым фактором риска развития сердечно-сосудистых заболеваний [7]. В Фремингемском исследовании было показано, что риск развития ХСН увеличивался на 5% у мужчин и на 7% у женщин при каждом повышении индекса массы тела (ИМТ) на 1 кг/м2 [8]. В то же время лица с ХСН с избыточной массой тела и ожирением имеют лучший прогноз [9]. Данное наблюдение названо парадоксом ожирения [10]. Несмотря на консенсус в отношении того, что потеря веса, особенно до низкого ИМТ, является признаком неблагоприятного исхода при ХСН, защитная роль ожирения не до конца ясна, поскольку ожирение также является фактором, способствующим непереносимости физических нагрузок. Кроме того, у больных ХСН с ожирением возможно снижение мышечной массы и силы, что описывается термином "саркопеническое ожирение". Распространенность саркопенического ожирения среди мужчин с ХСН составила 18,5% [11]. В недавнем исследовании также отмечена связь жировой ткани с показателями функциональной активности (ФА) [12]. У госпитализированных пожилых лиц с ХСН и изменениями в составе тела ФА была хуже всего в группе пациентов с саркопеническим ожирением, которое также является независимым предиктором смертности от всех причин (отношение шансов, ОШ 2,48; 95% ДИ 1,22–5,04; р=0,012) [13].
На поздних стадиях ХСН изменения в составе тела могут прогрессировать до сердечной кахексии, которая связана с крайне неблагоприятным прогнозом [14]. Распространенность сердечной кахексии среди пациентов с ХСН варьирует от 10 до 39% в зависимости от стадии заболевания и дизайна исследования [14].
Таким образом, особенности состава тела и понимание перекрестных взаимодействий между компонентами состава тела при ХСН позволят разработать комплекс мер, направленных на улучшение качества жизни, предотвращение последующей инвалидизации и, возможно, летальных исходов у пациентов с ХСН.
Цель исследования — оценить показатели состава тела и ФА у мужчин с ХСН различного генеза в зависимости от тяжести и функционального класса заболевания.
Материал и методы
Исследование проведено в Национальном медицинском исследовательском центре терапии и профилактической медицины Минздрава России. В одномоментное исследование включены 100 мужчин в возрасте 23-70 лет, подписавших информированное согласие. Протокол исследования был одобрен локальным этическим комитетом. Основную группу составили 60 пациентов с ХСН I-III функциональным классом (ФК) по классификации Нью-Йоркской кардиологической ассоциации (NYHA) и фракцией выброса левого желудочка (ФВ ЛЖ) ≤50%, диагностированной не менее чем за 1 год до включения в исследование. Критериями включения для основной группы служили мужской пол, стабильное течение заболевания, отсутствие госпитализаций по поводу декомпенсации ХСН в течение последних 6 месяцев, отсутствие изменений в составе групп препаратов для лечения ХСН в течение 6 месяцев до включения в исследование, в случае приема петлевых диуретиков прием препарата на протяжении более 6 месяцев. В контрольную группу вошли 40 мужчин без ХСН, среди них 20 человек с гипертонической болезнью 1-2 стадии и 20 здоровых лиц. Критериями невключения для всех групп были: хронические заболевания, влияющие на костный обмен: аутоиммунные и онкологические заболевания, миеломная болезнь и другие гематологические заболевания, тяжелая печеночная недостаточность (скорость клубочковой фильтрации <35 мл/мин), гиперфункция щитовидной железы, синдром Кушинга, хроническая обструктивная болезнь легких, бронхиальная астма, сахарный диабет 1 и 2 типа, ревматоидный артрит и системные заболевания соединительной ткани; сопутствующая или проводившаяся в прошлом терапия бисфософонатами, кальцитонином, эстрогенами, глюкокортикостероидами, цитостатиками, препаратами витамина D или кальция, варфарином; инфаркт миокарда, острое нарушение мозгового кровообращения в течение последних 6 месяцев перед исследованием, ревматические пороки сердца, инфекционный эндокардит; алкогольная, токсическая, дисгормональная кардиомиопатии; участие пациента в исследованиях лекарственных препаратов.
Пациенты были опрошены с использованием оригинальной анкеты, включающей информацию о факторах риска сердечно-сосудистых заболеваний, сопутствующей патологии и принимаемых лекарственных препаратах. Всем мужчинам проводились антропометрические измерения: масса тела, рост, окружность талии; измерялось артериальное давление, частота сердечных сокращений. Окружность талии у мужчин ≥94 см считалась критерием абдоминального ожирения. Лабораторное обследование включало измерение уровня N-концевого фрагмента предшественника мозгового натрийуретического пептида В-типа (NT-proBNP).
Под ФА понималась мышечная сила и физическая работоспособность. Сначала проводилось измерение мышечной силы с помощью динамометрии кистевого жима. Снижением мышечной силы у мужчин считалось значение меньше 27 кг. Оценка физической работоспособности проводилась с помощью краткой батареи тестов физической активности (The Short Physical Performance Battery, SPPB), теста "6-минутой ходьбы" (ТШХ), теста "Встань и иди". SPPB включает в себя тесты для определения равновесия пациента, определение скорости ходьбы на 4 метра и тест подъема со стула для оценки мышечной силы нижних конечностей. Для SPPB использовалось пороговое значение ≤8 баллов, для теста "Встань и иди" ≥20 секунд.
Состав тела определяли методом двухэнергетической рентгеновской абсорбциометрии (Dual X-ray Absorptiometry — DXA, Hologic). Анализировали жировую, мышечную и костную массу всего тела, и отдельно туловища, верхних и нижних конечностей. Рассчитывалась аппендикулярная мышечная масса (АММ), равная сумме мышечной массы конечностей (кг), и индекс аппендикулярной скелетной мускулатуры (АСМИ), который представляет собой отношение АММ к квадрату роста в метрах (кг/м2). У мужчин величина АММ менее 15 кг и АСМИ менее 7,0 кг/м2 считались пороговыми для определения низкой мышечной массы.
Статистическая обработка результатов проводилась с использованием пакета прикладных статистических программ SAS (Statistical Analysis System, SAS Institute Inc., USA). Для непрерывных величин представлено среднее значение (М) и стандартное отклонение (σ), либо медиана и интерквартильный размах — Me [Q25;Q75]. При анализе межгрупповых различий, измеренных по интервальной шкале, рассчитывали значения t-критерия Стьюдента и точного F-критерия Фишера. Межгрупповые сравнения интервальных показателей с ненормальными распределениями проводили с помощью дисперсионного анализа oneway ANOVA и тестов Вилкоксона, Краскела-Уоллеса, Ван-дер-Вардена и Сэвиджа. Кроме коэффициентов линейной корреляции Пирсона рассчитывали также ранговые корреляции по Спирмену, критерий хи-квадрат Пирсона и Ф-коэффициенты связи, коэффициенты сопряжённости и коэффициенты V по Крамеру. Значимость различий между показателями оценивали с помощью критерия χ2 Пирсона, коэффициентов сопряженности Крамера и др. Для оценки вклада клинико-инструментальных показателей в изменение компонентов состава тела было использовано регрессионное моделирование с расчетом многомерных пошаговых линейных регрессий. Рассчитывался β-коэффициент регрессии (коэффициент связи между соответствующим предиктором и прогнозируемым показателем). Статистически значимыми считали различия при р <0,05.
Результаты
Общая характеристика групп представлена в табл. 1. Группы были сопоставимы почти по всем изучаемым параметрам, за исключением артериального давления и курения. Отмечены различия по частоте факторов риска: артериальная гипертензия (АГ) чаще отмечалась в группе ХСН, в то время как факторкурения чаще регистрировался в группе контроля.
Пациенты с ХСН имели сочетанную сердечно-сосудистую патологию: ишемическая болезнь сердца с АГ наблюдалась у 35 человек (57%), АГ с фибрилляцией предсердий — у 9 (15%) и 16 (28%) пациентов были представлены различными вариантами кардиомиопатий. Низкую ФВ ЛЖ <40% имели 29 (48%) пациентов, промежуточную ФВ ЛЖ 40-50% — 31 (52%) мужчин. Подавляющее число пациентов были отнесены к I-II ФК ХСН по NYHA. Согласно классификации Василенко-Стражеско 20% пациентов имели I стадию, более половины пациентов с ХСН — IIА стадию заболевания (57%), 23% — IIБ стадию.
Исследование композиционного состава тела в группе ХСН показало статистически значимое снижение общей мышечной массы, мышечной массы туловища и конечностей АСМИ, а также общей костной массы, костной массы туловища и конечностей по мере нарастания ФК ХСН. В то же время средние показатели жировой массы не различались у пациентов в зависимости от ФК. Также в основной группе отмечалось ухудшение средних показателей ФА по мере увеличения ФК ХСН (табл. 2).
Между общей костной массой (r=-0,36, p <0,01), костной массой конечностей (r=-0,591, p <0,001) и ФК ХСН, а также между общей костной массой и стадией ХСН (r=-0,291, p <0,05) была найдена статистически значимая отрицательная корреляционная связь. Также между общим количеством мышечной массы (r=-0,464, p <0,001/ r=-0,302, p <0,05), АММ (r=-0,528, p <0,001/ r=-0,323, p <0,05) и АСМИ (r=-0,446, p <0,001/ r=-0,365, p <0,01) обнаружена статистически значимая отрицательная корреляционная связь с ФК ХСН и уровнем NT-proBNP. Аналогичная связь прослеживалась между АММ и стадией ХСН (r=-0,283, p <0,05). Помимо этого отмечалась положительная корреляционная связь между ФВ ЛЖ и АММ (r=0,389, р <0,01) и АСМИ (r=0,325, р <0,05).
Количество жировой массы тела не показало значимой связи с ФК ХСН. Однако наблюдалась отрицательная связь между повышенным уровнем NT-proBNP, общей жировой массой тела (r=-0,307, р <0,05) и жировой массой туловища (r=-0,327, р <0,05). Была отмечена положительная корреляционная связь между общей жировой массой, жировой массой конечностей и конечно-диастолическим объемом левого желудочка (КДО ЛЖ) (r=0,278, р <0,05/ r=0,288, р<0,05).
Среди показателей ФА была выявлена отрицательная корреляционная связь между динамометрией кистевого жима и ФК ХСН по NYHA (r=-0,459, p <0,001), стадией ХСН (r=-0,424, p <0,001), уровнем NT-proBNP (r=-0,324, p <0,05), КДО ЛЖ (r=
-0,262, p <0,01) и систолическим давлением в легочной артерии (СДЛА) (r=-0,268, p <0,05) а также умеренная положительная корреляционная связь с ФВ ЛЖ (r=0,416, p <0,01). Результат SPPB отрицательно коррелировал со стадией ХСН (r=-0,288, p <0,05), с КДО ЛЖ (r=-0,311, p <0,01) и СДЛА (r=
-0,454, p <0,001).
С помощью линейного регрессионного анализа была подтверждена независимая связь общей костной массы, общей мышечной массы и АММ с ФК ХСН по NYHA после поправки на возраст, расстояние ТШХ, уровень NT-proBNP. Связь между костной и мышечной массой всего тела, а также в туловище и конечностях со стадией ХСН и эхокардиографическими показателями не была подтверждена. Независимый вклад в снижение ФА после коррекции на возраст и уровень NT-proBNP вносили ФК ХСН по NYHA, стадия ХСН и ФВ ЛЖ, также подтверждена независимость связи SPPB с КДО ЛЖ (β=-0,005, р=0,036) и СДЛА (β=-0,049, р=0,0006) (табл. 3).
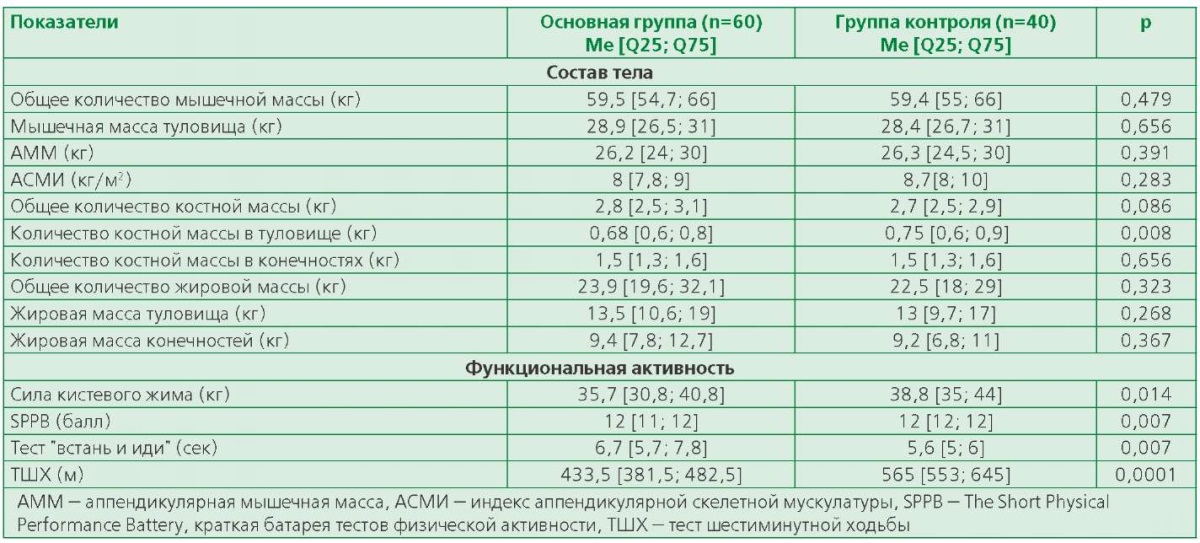
При анализе распределения компонентов состава тела в основной группе в сравнении с группой контроля было отмечено значимое снижение костной массы селективно в туловище у больных ХСН, в то время как значимых различий в средних показателях жировой и безжировой массы тела не выявлено. Мышечная масса была снижена (АСМИ <7 кг/м2) у 4 (6,7%) мужчин основной группы и у 3 (7,5%) мужчин контрольной группы (р=0,878). Однако при оценке показателей ФА у пациентов с ХСН было выявлено значимое снижение мышечной силы (на основании динамометрии) и ухудшение тестов, определяющих физическую работоспособность (SPPB, ТШХ, тест "Встать и иди"), по сравнению с контрольной группой (табл. 4). Снижение мышечной силы по результатам динамометрии отмечалось у 10% мужчин с ХСН и у 2,5% мужчин группы контроля (р=0,113).
Таким образом, у пациентов с ХСН было отмечено снижение общей костной и мышечной массы и ФА при повышении ФК ХСН. ФК ХСН вносил независимый вклад в снижение костно-мышечных параметров. Общая костная масса и АММ наряду с ФК ХСН зависели от стадии заболевания, а также независимым фактором снижения АММ была ФВ ЛЖ. У пациентов с ХСН не обнаружено значимых различий в показателях состава тела, за исключением костной массы туловища, при сравнении с контрольной группой. ФА значимо ниже у мужчин с ХСН по сравнению с контрольной группой и зависит от ФК ХСН по NYHA, стадии заболевания, ФВ ЛЖ, КДО ЛЖ и СДЛА.
Таблица 1. Общая клинико-инструментальная характеристика групп пациентов
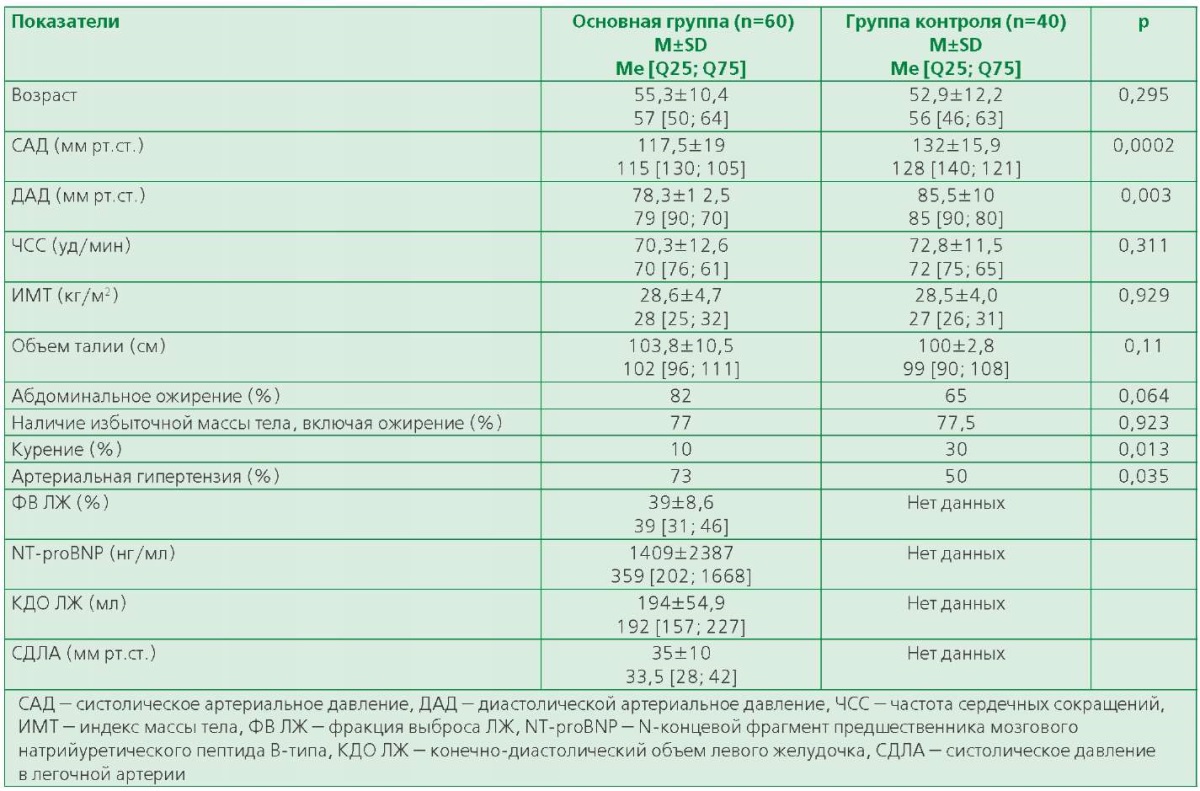
Таблица 2. Показатели состава тела ФА в зависимости от ФК ХСН по NYHA
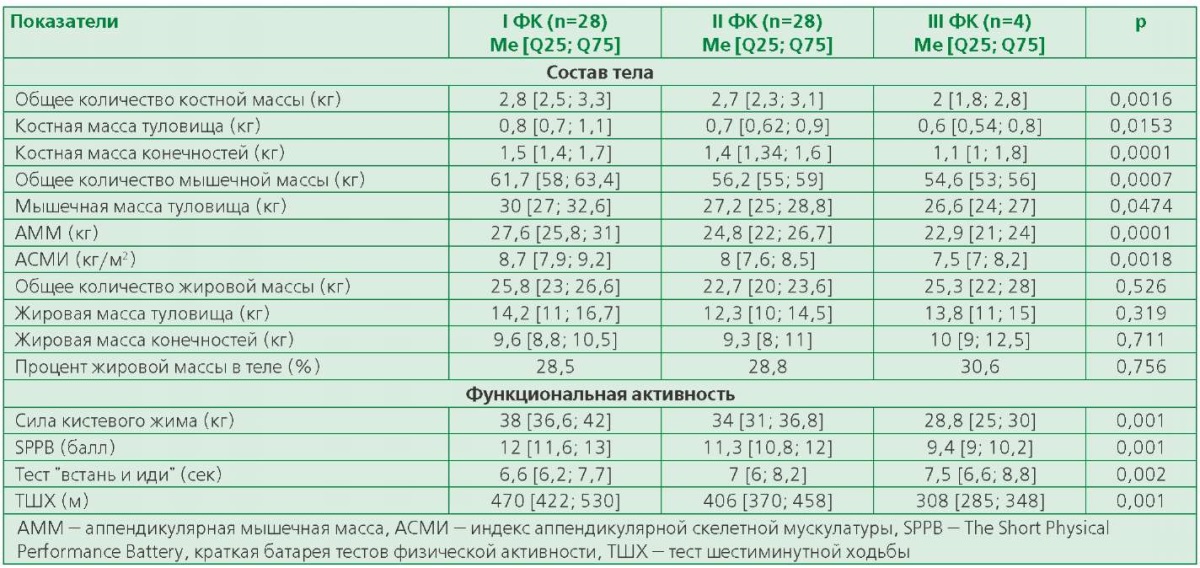
Таблица 3. Взаимосвязь компонентов состава тела и ФА с показателями тяжести ХСН
в многофакторном регрессионном анализе
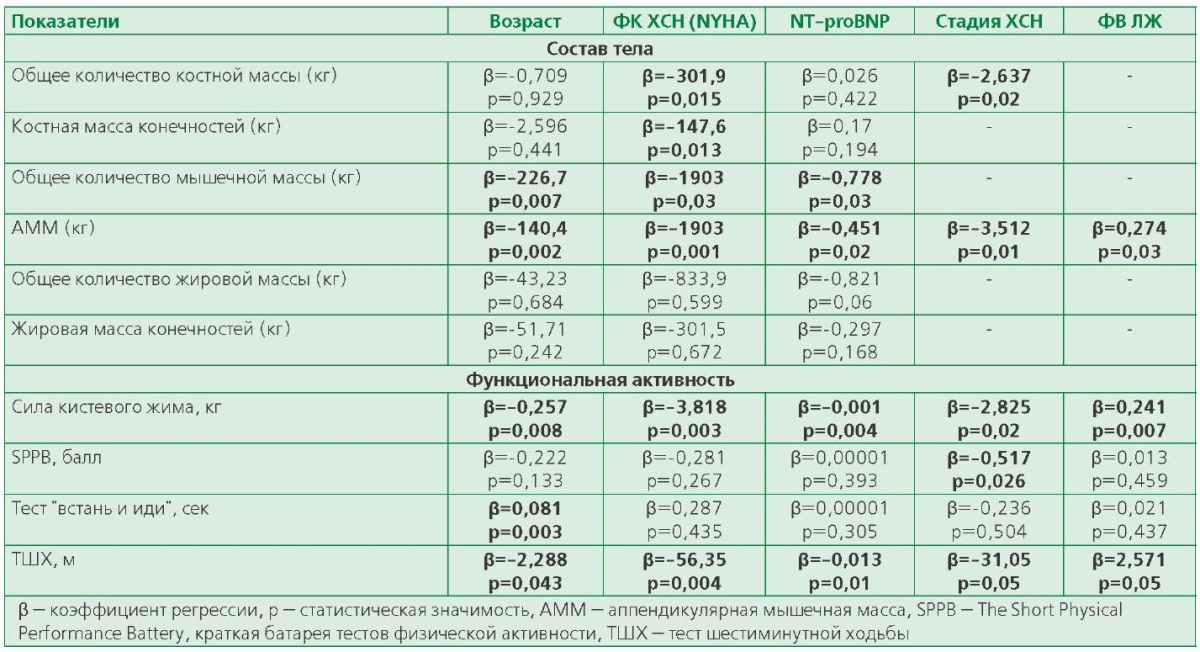
Таблица 4. Композиционный состав тела и ФА у мужчин с ХСН
в сравнении с контрольной группой
Обсуждение
Изменения в составе тела, и, в частности, уменьшение костной и мышечной массы у пациентов с ХСН вносят вклад в непереносимость физических нагрузок и способствуют обострению других клинических состояний, связаны с повторными госпитализациями и увеличением длительности госпитализаций, а также с ухудшением качества жизни и прогноза [15-19].
В данной работе у больных с ХСН было отмечено снижение общей костной массы и костной массы туловища и конечностей при нарастании ФК ХСН. Аналогично в исследовании E. A. Jankowska и соавт. показатели костной массы у мужчин с ХСН IV ФК по NYHA были значительно ниже по сравнению с мужчинами с ХСН I, II и III ФК [20]. В этом же исследовании продемонстрировано значимое снижение средних показателей костной массы в группе ХСН по сравнению с контрольной группой во всех измеряемых участках скелета и показан независимый вклад в снижение костной массы таких показателей тяжести ХСН, как более высокий ФК ХСН по NYHA (β=0,24, р=0,01) и более низкая ФВ ЛЖ (β=0,21, р=0,01), что согласуется с нашими результатами. Однако нами было зарегистрировано статистически значимое снижение костной массы только в туловище у мужчин с ХСН при сравнении с группой контроля. Проведенная E. A. Jankowska и соавт. повторная оценка состава тела через два года показала значительное снижение костной массы у 35% мужчин с ХСН, причем исходно более высокий ФК по NYHA (p <0,05) прогнозировал большую потерю костной массы в будущем [20].
Нами показано, что количество общей мышечной массы, мышечной массы туловища и АММ у пациентов с ХСН снижались при повышении ФК заболевания. В исследовании J. Terrovitis и соавт. [21] аналогичные ассоциации были показаны между средней мышечной массой верхних конечностей пациентов и ФК ХСН: у пациентов с III/IV ФК по NYHA мышечная масса была значительно ниже, чем у пациентов I/II ФК (5,97±1,4 кг против 7,12±1,3 кг, р=0,002). В других областях тела были выявлены сходные ассоциации между мышечной массой и ФК ХСН, но не достигали уровня статистической значимости. В то время как выявленная нами взаимосвязь АММ со стадией ХСН и ФВ ЛЖ не была описана ранее в периодической научной литературе.
В настоящем исследовании, в которое были включены больные ХСН с низкой и промежуточной ФВ ЛЖ, частота ожирения составила 35% и не различалась между основной и контрольной группами. Следует отметить, что в других исследованиях были обнаружены статистически значимые различия в распределении жировой массы тела между пациентами с ХСН с сохранной ФВ (ХСНсФВ) и с низкой ФВ ЛЖ (ХСНнФВ). Так, в крупном исследовании у больных ХСН с помощью магнитно-резонансной томографии было показано значимое увеличение жировой массы тела во всех измеряемых участках тела (перикардиальная, висцеральная подкожная жировая ткань) у пациентов с ХСНсФВ ЛЖ по сравнению с пациентами с ХСНнФВ ЛЖ и группой контроля, тогда как показатели мышечной массы были статистически значимо ниже в группе больных ХСНнФВ ЛЖ [22]. В нашем исследовании были представлены пациенты с низкой и промежуточной ФВ ЛЖ, что могло повлиять на полученные результаты по распределению компонентов жировой массы в основной и контрольной группах. Различия между результатами исследований, по-видимому, связаны с изучением ХСН с разной ФВ (с низкой и промежуточной ФВ с одной стороны и с сохранной фракцией — с другой) и использованием разных методов оценки состава тела.
Также объединенные данные по результатам недавнего метаанализа показывают статистически значимую положительную связь между количеством висцеральной (относительный риск (ОР) 1,08, 95% ДИ 1,04-1,12) и перикардиальной жировой ткани (ОР 1,08, 95% ДИ 1,06-1,10) и риском развития ХСН, причем эта связь была более выражена у пациентов с сохраненной фракцией выброса ЛЖ [23].
Сила кистевого жима является быстрым и простым показателем мышечной функции и тесно связана с общей мышечной силой [24]. В проведенном нами исследовании снижение мышечной силы по результатам динамометрии кистевого жима было зарегистрировано у 10% больных с ХСН, причем степень снижения мышечной силы зависела от ФК по NYHA, что согласуется с результатами, полученными в других работах [25][26]. Помимо этого, у мужчин с ХСН мышечная сила зависела от стадии заболевания и ФВ ЛЖ. Также нами было обнаружено значимое снижение мышечной силы верхних и нижних конечностей в основной группе при сравнении с группой контроля. Похожие результаты были получены в исследовании M. Abdou: у пациентов с ХСН ≥65 лет (n=71) было выявлено значительное снижение как показателей силы кистевого жима, так и мышечной силы нижних конечностей, измеренной с помощью многократного вставания со стула, у всех пациентов с ХСН (9,7±4,4 кг, 8,8±3,1 повторений, соответственно) по сравнению с контрольной группой (77,8±11 кг, 13,5±1,1 повторений, соответственно, р <0,001). Причем показатели мышечной силы статистически значимо снижались с увеличением ФК ХСН по NYHA и уровня мозгового натрийуретического пептида В-типа (р <0,001) и положительно коррелировали с ФВ ЛЖ (р <0,002) [25]. В нашей работе независимый характер связи мышечной силы с ФК ХСН по NYHA, стадией ХСН, ФВ ЛЖ подтвержден в многофакторном регрессионном анализе. Известно, что сила кистевого жима ассоциируется с сердечно–сосудистой смертностью [27][28], но данные о связи с ХСН остаются скудными и противоречивыми [29]. По результатам последнего метаанализа, целью которого было изучение влияния сниженной силы кистевого жима на прогноз у пациентов с ХСН, показано, что низкая мышечная сила связана с высоким риском смертности (ОР 2,00, 95% ДИ 1,55-2,58, р <0,001; I2=0%) независимо от дизайна исследования, возраста пациентов, ФВ ЛЖ, продолжительности наблюдения [30].
Также в нашем исследовании было продемонстрировано значимое снижение таких показателей, как ТШХ, SPPB, тест "Встань и иди" в группе ХСН в сравнении с контрольной группой, и значимое их ухудшение по мере увеличения ФК ХСН, что позволяет отнести наших больных к группе высокого риска неблагоприятных исходов со стороны как сердечно-сосудистой так и костной систем (увеличение количества декомпенсаций ХСН и госпитализаций — с одной стороны и переломов — с другой). В метаанализе 44 проспективных когортных исследований у пациентов с ХСН (n=22 598) низкая ФА по результатам ТШХ, теста на скорость ходьбы, SPPB сопровождалась наихудшим прогнозом [31].
Ограничения исследования
Небольшое количество участников, включение участников только мужского пола, более молодого возраста, по сравнению с предшествующими исследованиями, отсутствие пациентов с ХСН с сохранной ФВ ЛЖ.
Заключение
У мужчин с ХСН различного генеза относительно молодого возраста и с относительно легким течением заболевания повышение ФК ХСН, стадии заболевания и снижение ФВ ЛЖ ассоциируется с потерей костной и мышечной массы, как общей, так и отдельно в туловище и конечностях. Не было отмечено связи клинических и эхокардиографических показателей ХСН с количеством жировой массы. Параметры состава тела при сравнении мужчин основной и контрольной групп не различались, за исключением костной массы туловища, которая значимо снижена в группе ХСН. Показатели ФА были хуже у мужчин с ХСН при сравнении с контрольной группой и снижались по мере увеличения ФК ХСН. Наряду с ФК, стадия ХСН, ФВ ЛЖ, КДО ЛЖ и СДЛА имели независимое влияние на ФА.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование. Исследование проведено при поддержке ФГБУ "Национальный медицинский исследовательский центр терапии и профилактической медицины" Минздрава России.
Funding. The study was performed with the support of National Medical Research Center for Therapy and Preventive Medicine.
Список литературы
1. Christensen HM, Kistorp C, Schou M, et al. Cross-talk between the heart and adipose tissue in cachectic heart failure patients with respect to alterations in body composition: a prospective study. Metabolism. 2014;63(1):141-9. DOI:10.1016/j.metabol.2013.09.017.
2. McAloon CJ, O’Hare P, Osman F, et al. The interplay between heart failure, metabolism and body composition. Br J Hosp Med. 2016;77(6):362-4. DOI:10.12968/hmed.2016.77.6.362.
3. Драпкина О. М., Скрипникова И. А., Яралиева Э. К., и др. Состав тела у пациентов с хронической сердечной недостаточностью. Кардиоваскулярная терапия и профилактика. 2022;21(12):3451. DOI:10.15829/1728-8800-2022-3451.
4. Лелявина Т. А., Ситникова М. Ю., Галенко В. Л., и др. Роль мышечной ткани в патогенезе хронической сердечной недостаточности — возможности воздействия (исследование “ФОРМА”). Российский кардиологический журнал. 2019;(10):58-65. DOI:10.15829/1560-4071-2019-10-58-65.
5. Coats AJ, Clark AL, Piepoli M, et al. Symptoms and quality of life in heart failure: the muscle hypothesis. Br Heart J. 1994;72(2):36-9. DOI:10.1136/hrt.72.2_suppl.s36.
6. Loncar G. Metabolism and the heart: An overview of muscle, fat, and bone metabolism in heart failure. Int J Cardiol. 2013;162(2):77-85. DOI:10.1016/j.ijcard.2011.09.079.
7. Гиоева З. М., Богданов А. Р., Залетова Т. С., и др. Ожирение как фактор риска развития хронической сердечной недостаточности: литературный обзор. Доктор.Ру. 2017;10(139):21-25.
8. Kenchaiah S, Evans JC, Levy D, et al. Obesity and the risk of heart failure. N Engl J Med. 2002;347(5):305-13. DOI:10.1056/NEJMoa020245.
9. Oreopoulos A, Padwal R, Kalantar-Zadeh K, et al. Body mass index and mortality in heart failure: a meta-analysis. Am Heart J. 2008;156(1):13-22. DOI:10.1016/j.ahj.2008.02.014.
10. Miklisanskaya SV, Mazur NA, Solomasova LV, et al. The “obesity paradox” and its degree of proof. Therapeutic Archive. 2020;92(4):84-90 (In Russ.) [Миклишанская С. В., Мазур Н. А., Соломасова Л. В., и др. "Парадокс ожирения" и степень его доказанности. Терапевтический архив. 2020;92(4):84-90]. DOI:10.26442/00403660.2020.04.000421.
11. Fonseca G, Dos Santos MR, de Souza FR, et al. Discriminating sarcopenia in overweight/obese male patients with heart failure: the influence of body mass index. ESC Heart Fail. 2020;7(1):84–91. DOI:10.1002/ehf2.12545.
12. Ying W, Sharma K, Yanek LR, et al. Visceral adiposity, muscle composition, and exercise tolerance in heart failure with preserved ejection fraction. ESC Heart Fail. 2021;8(4):2535-2545. DOI:10.1002/ehf2.13382.
13. Saito H, Matsue Y, Kamiya K, et al. Sarcopenic obesity is associated with impaired physical function and mortality in older patients with heart failure: insight from FRAGILE-HF. BMC Geriatr. 2022;22(1):556. DOI:10.1186/s12877-022-03168-3.
14. Valentova M, Anker SD, von Haehling S. Cardiac Cachexia Revisited. Heart Fail Clin. 2020;16(1):61-69. DOI:10.1016/j.hfc.2019.08.006.
15. Tsuji M, Amiya E, Hatano M, et al. Abdominal skeletal muscle mass as a predictor of mortality in Japanese patients undergoing left ventricular assist device implantation. ESC Heart Fail. 2019;6(3):526-535. DOI:10.1002/ehf2.12429.
16. Platz E, Jhund PS, Claggett BL, et al. Prevalence and prognostic importance of precipitating factors leading to heart failure hospitalization: Recurrent hospitalizations and mortality. Eur J Heart Fail. 2018;20(2):295-303. DOI:10.1002/ejhf.901.
17. Martone AM, Bianchi L, Abete P, et al. The incidence of sarcopenia among hospitalized older patients: Results from the Glisten study. J Cachexia Sarcopenia Muscle. 2017;8(6):907-914. DOI:10.1002/jcsm.12224.
18. von Haehling S. Muscle wasting and sarcopenia in heart failure: A brief overview of the current literature. ESC Heart Fail. 2018;5(6);1074-1082. DOI:10.1002/ehf2.12388.
19. Konishi M, Kagiyama N, Kamiya K, et al. Prognostic impact of upper and lower extremity muscle mass in heart failure. ESC Heart Fail. 2023;10(1):732-737. DOI:10.1002/ehf2.14195.
20. Jankowska EA, Jakubaszko J, Cwynar A, et al. Bone mineral status and bone loss over time in men with chronic systolic heart failure and their clinical and hormonal determinants. Eur J Heart Fail. 2009;11(1):28-38. DOI:10.1093/eurjhf/hfn004.
21. Terrovitis J, Zotos P, Kaldara E, et al. Bone mass loss in chronic heart failure is associated with secondary hyperparathyroidism and has prognostic significance. Eur J Heart Fail. 2012;14(3):326-32. DOI:10.1093/eurjhf/hfs002.
22. Selvaraj S, Kim J, Ansari BA, et al. Body Composition, Natriuretic Peptides, and Adverse Outcomes in Heart Failure With Preserved and Reduced Ejection Fraction. JACC Cardiovasc Imaging. 2021;14(1):203-215. DOI:10.1016/j.jcmg.2020.07.022.
23. Oguntade AS, Islam N, Malouf R, et al. Body Composition and Risk of Incident Heart Failure in 1 Million Adults: A Systematic Review and Dose-Response Meta-Analysis of Prospective Cohort Studies. J Am Heart Assoc. 2023;12(13):e029062. DOI:10.1161/JAHA.122.029062.
24. McGrath RP. Understanding the feasibility and validity of muscle strength measurements in aging adults. J Am Med Dir Assoc. 2019;20(1):99-100. DOI:10.1016/j.jamda.2018.07.011.
25. Abdou M. Usefulness of Upper and Lower Limb Muscles Strength in the Evaluation of Clinical Severity of Heart Failure in Elderly Patients. World J Cardiovasc Dis. 2019;9:370-383. DOI:10.4236/wjcd.2019.95033.
26. Izawa KP, Watanabe S, Yokoyama H. Muscle Strength in Relation to Disease Severity in Patients with Congestive Heart Failure. Am J Phys Med Rehabil. 2007;86(11):893-900. DOI:10.1097/PHM.0b013e318154b592.
27. Imaeva AE, Kapustina AV, Shalnova SA, et al. Role of cognitive impairments and decreased muscle strength in cardiovascular mortality of 55 years and older population. Russian Journal of Cardiology. 2019;(6):61-65 (In Russ) [Имаева А. Э., Капустина А. В., Шальнова С. А., и др. Вклад когнитивных нарушений и сниженной мышечной силы в смертность от сердечно-сосудистых заболеваний в популяции 55 лет и старше. Российский кардиологический журнал. 2019;(6):61-65]. DOI:10.15829/1560-4071-2019-6-61-65.
28. Celis-Morales CA, Welsh P, Lyall DM, et al. Associations of grip strength with cardiovascular, respiratory, and cancer outcomes and all cause mortality: Prospective cohort study of half a million UK Biobank participants. BMJ. 2018;361:k1651. DOI:10.1136/bmj.k1651.
29. Li RM, Dai GH, Guan H, et al. Association between handgrip strength and heart failure in adults aged 45 years and older from NHANES 2011-2014. Sci Rep. 2023;13(1):4551. DOI:10.1038/s41598-023-31578-9.
30. Wang Y, Pu X, Zhu Z, et al. Handgrip strength and the prognosis of patients with heart failure: a meta-analysis. Clin Cardiol. 2023;46(10):1173-1184. DOI:10.1002/clc.24063.
31. Fuentes-Abolafio IJ, Stubbs B, Pérez-Belmonte LM, et al. Physical functional performance and prognosis in patients with heart failure: a systematic review and meta-analysis. BMC Cardiovasc Disord. 2020;20(1);512. DOI:10.1186/s12872-020-01725-5.
Об авторах
И. А. СкрипниковаРоссия
Скрипникова Ирина Анатольевна
Москва
eLibrary SPIN 1514-0880
Э. К. Яралиева
Россия
Яралиева Эльвира Куруглиевна
Москва
eLibrary SPIN 7558-4962
Р. П. Мясников
Россия
Мясников Роман Петрович
Москва
eLibrary SPIN 3287-0327
О. В. Куликова
Россия
Куликова Ольга Викторовна
Москва
eLibrary SPIN 3531-7321
В. Е. Новиков
Россия
Новиков Валерий Евгеньевич
Москва
О. В. Косматова
Россия
Косматова Ольга Владимировна
Москва
eLibrary SPIN 5320-1904
В. А. Выгодин
Россия
Выгодин Владимир Анатольевич
Москва
eLibrary SPIN 9189-8637
О. М. Драпкина
Россия
Драпкина Оксана Михайловна
Москва
eLibrary SPIN 4456-1297
Дополнительные файлы
Рецензия
Для цитирования:
Скрипникова И.А., Яралиева Э.К., Мясников Р.П., Куликова О.В., Новиков В.Е., Косматова О.В., Выгодин В.А., Драпкина О.М. Композиционный состав тела и функциональная активность у мужчин с хронической сердечной недостаточностью. Рациональная Фармакотерапия в Кардиологии. 2023;19(6):557-564. https://doi.org/10.20996/1819-6446-2023-2975. EDN: EQDNAW
For citation:
Skripnikova I.A., Yaralieva E.K., Myasnikov R.P., Kulikova O.V., Novikov V.E., Kosmatova O.V., Vygodin V.A., Drapkina O.M. Body composition and functional activity in men with heart failure. Rational Pharmacotherapy in Cardiology. 2023;19(6):557-564. (In Russ.) https://doi.org/10.20996/1819-6446-2023-2975. EDN: EQDNAW
















































