Перейти к:
Острое повреждение почек как фактор риска фибрилляции предсердий после операции коронарного шунтирования – эффекты ингибиторов натрийглюкозного котранспортера-2
https://doi.org/10.20996/1819-6446-2023-2985
EDN: SXAUHO
Аннотация
Цель. Выявить предикторы развития пароксизмальной формы фибрилляции предсердий (пФП) у больных стабильной стенокардией после операции коронарного шунтирования (КШ), оценить влияние ингибиторов натрий-глюкозного котранспортера-2 (иSGLT-2).
Материал и методы. Обследовано 92 больных со стабильной стенокардией, перенесших КШ, в возрасте 64±7 лет, мужчин — 78,3%. Многососудистое коронарное поражение имели 81,5%, нарушения углеводного обмена — 35,6%, артериальную гипертонию — 96,7%, хроническую болезнь почек (ХБП) — 23,9%, пФП исходно — 10,9%, перенесенный инфаркт миокарда (ИМ) — 54,3% лиц. КШ на работающем сердце проведено 31,5% пациентам, в том числе бимаммарное КШ — 50% больным. Длительность искусственного кровообращения была 68 (55-83) минут, количество шунтов — 2,7±0,7 ед. иSGLT-2 получали 18,5% лиц. Содержание креатинина в крови определяли по методу Яффе, ХБП диагностировали при снижении скорости клубочковой фильтрации менее 60 мл/мин. Острое повреждение почек (ОПП) оценивали в соответствие с критериями KDIGO.
Результаты. Количество больных, имевших пФП после КШ, составило 29,3%, ОПП — 16,3%. Показателями, ассоциированными с развитием пФП после КШ были: содержание креатинина (100;82-142 у больных с пФП и 83;69-105 мкмоль/л — без пФП, р=0,032) и мочевины (7,8;5,8-9,7 у лиц с пФП и 5,9;4,7-9,1 ммоль/л — без пФП, р=0,025) через сутки после вмешательства, случаи послеоперационного ОПП (33,3% у больных с пФП и 9,2% — без пФП, р=0,004), количество пациентов, принимавших иSGLT-2 (3,7% с пФП и 24,6% без пФП, Р=0,019). Вероятность возникновения пФП после КШ возрастала в среднем в 5,5 раза при развитии ОПП. Больные с пФП после КШ в сравнении с пациентами без пФП имеют большее кумулятивное число случаев ОПП, интраоперационного ИМ, сердечной смерти.
Заключение. Количество больных с пФП после КШ составило 29,3%, ОПП — 16,3%. Предиктором развития пФП после КШ явилось послеоперационное ОПП. Применение иSGLT-2 ассоциировалось с меньшей частотой пФП после вмешательства. Больные с пФП после КШ имеют неблагоприятный госпитальный прогноз.
Ключевые слова
Для цитирования:
Кремнева Л.В., Арутюнян Л.А., Гапон Л.И., Суплотов С.Н., Шалаев С.В. Острое повреждение почек как фактор риска фибрилляции предсердий после операции коронарного шунтирования – эффекты ингибиторов натрийглюкозного котранспортера-2. Рациональная Фармакотерапия в Кардиологии. 2023;19(6):549-556. https://doi.org/10.20996/1819-6446-2023-2985. EDN: SXAUHO
For citation:
Kremneva L.V., Arutyunyan L.A., Gapon L.I., Suplotov S.N., Shalaev S.V. Acute kidney injury as a risk factor for atrial fibrillation after coronary artery bypass grafting — effects of sodium-glucose cotransporter-2 inhibitors. Rational Pharmacotherapy in Cardiology. 2023;19(6):549-556. (In Russ.) https://doi.org/10.20996/1819-6446-2023-2985. EDN: SXAUHO
Введение
Наиболее частые осложнения коронарного шунтирования (КШ) в раннем послеоперационном периоде — пароксизмы фибрилляции предсердий (ФП) и острое повреждение почек (ОПП) [1][2]. И ОПП, и пароксизмы ФП существенно повышают риск развития послеоперационных осложнений, госпитальной и отдаленной смертности [3][4]. Послеоперационное ОПП и пароксизмы ФП имеют некоторые общие факторы риска развития, среди которых — пожилой возраст, артериальная гипертония (АГ), сахарный диабет (СД) 2 типа, хроническая болезнь почек (ХБП), хроническая сердечная недостаточность (ХСН) и другие [1]. В ранее проведенных работах показано, что к развитию пароксизмов ФП после КШ предрасполагает не только ХБП, но также послеоперационное ОПП [2][5]. Однако в литературе мы встретили лишь единичные работы, посвященные изучению данной проблемы [2][5].
Ингибиторы натрий-глюкозного котранспортера-2 (SGLT-2) к настоящему времени заняли прочные позиции в лечении больных с нарушениями углеводного обмена (НУО), ХСН, а также ХБП [6-8]. Имеются исследования, показавшие меньшую частоту развития пароксизмов ФП у больных СД 2 типа и синусовым ритмом при применении препаратов данной группы [9-11]. Установлено положительное влияние ингибиторов SGLT-2 на частоту развития ОПП [12][13]. Однако к настоящему времени практически отсутствуют работы по оценке влияния ингибиторов SGLT-2 на частоту развития пароксизмальной формы ФП (пФП) у больных, перенесших КШ.
Цель настоящего исследования — выявление предикторов развития пФП у больных стабильной стенокардией после операции КШ и оценка влияния ингибиторов SGLT-2.
Материал и методы
В исследование были включены 92 больных со стабильной стенокардией, перенесших операцию КШ. Показания к КШ определяли в соответствии с рекомендациями ESC/EACTS 2018 [14]. Из исследования исключали больных, у которых имелись дополнительные показания к выполнению протезирования восходящего отдела аорты или коррекции пороков сердца; пациентов, перенесших менее двух месяцев назад инфаркт миокарда (ИМ) или инсульт, имевших острые или обострения хронических заболеваний, эрозивный гастрит, обострение язвенной болезни желудка или двенадцатиперстной кишки, тяжелые заболевания печени и легких, ХБП 5 ст., СД с уровнями глюкозы в гликемическом профиле более 12-14 ммоль/л, постоянную форму ФП, гипотиреоз и гипертиреоз, терминальную стадию ХСН.
Перед оперативным вмешательством всем пациентам проведено обследование, которое включало общий анализ крови, общий анализ мочи, биохимические параметры крови, рентгенографию органов грудной клетки, электрокардиографию (ЭКГ), эхокардиографию на аппарате Vivid E 90 (GE, США), ультразвуковое исследование артерий и вен нижних конечностей, брахиоцефальных артерий, артерий почек, фиброгастродуоденоскопию, коронарографию по методу M. P. Judkins [15] на установке GE Innova IGS 530 (Франция).
КШ выполняли с использованием искусственного кровообращения или "на работающем сердце" через срединную стернотомию с искусственной вентиляцией легких и фармакохолодовой кардиоплегией.
У всех пациентов определяли содержание креатинина в крови (метод Яффе) на аппарате Synchron СXSystems (Beckman Coulter, США). По формуле CKD-EPI рассчитывали скорость клубочковой фильтрации (СКФ) [16]. При снижении СКФ менее 60 мл/мин диагностировали ХБП [17]. Наличие ОПП и степень его тяжести устанавливали в соответствии с критериями KDIGO [18]. Через 12 и 24 часа после КШ, при необходимости и в более поздние сроки определяли содержание в крови сердечного тропонина I высокочувствительным (hs-cTn I) хемилюминесцентным методом на аппарате PATHFAST (LSI MedienceCorporation, Япония. Уровень 99-го процентиля hs-cTn I для женщин составлял 0,012 нг/л, для мужчин — 0,017 нг/л. Определяли уровень глюкозы в крови электрохимическим методом с использованием чип-сенсоров на аппарате BIOSEN C–line Clinic (Германия) исходно, многократно в первые сутки КШ, а также в более поздние сроки. Рассчитывали средний уровень гликемии в первые сутки КШ. У всех больных до КШ определяли уровень в крови тиреотропного гормона и свободного тироксина иммунохемилюминесцентным методом на анализаторе Cobas e601 (Япония). При пребывании больных с палате интенсивной терапии осуществляли непрерывное мониторирование ЭКГ, после перевода в отделение кардиохирургии первые двое суток также осуществляли мониторирование ЭКГ с помощью прибора МИТАР-01-"Р-Д" (Россия), в последующем проводили ежедневно запись ЭКГ. Эхокардиографию выполняли исходно и перед выпиской больных из стационара.
Проводили оценку госпитальных осложнений после КШ: случаев ОПП, пФП, интраоперационных ИМ, инсультов, смерти от кардиальных причин. Диагностику интраоперационного ИМ проводили с учетом рекомендаций [19]. Учитывали те случаи пароксизмов ФП, которые длились более часа, влияли на гемодинамику или для купирования требовалось проводить медикаментозную терапию. Оценивали частоту госпитальных осложнений по кумулятивному показателю, включавшему случаи сердечной смерти, ОПП, пФП, интраоперационного ИМ, инсульта после КШ. При этом учитывали первое из наступивших событий.
Протокол исследования был одобрен этическими комитетами ФГБОУ ВО "ТюмГМУ" Минздрава России и Тюменского кардиологического научного центра, Томского национального исследовательского медицинского центра Российской академии наук. У больных получено информированное согласие на участие в исследовании. Исследование проведено в соответствии с принципами Хельсинкской декларации Всемирной медицинской ассоциации.
Статистическая обработка результатов проведена с использованием пакета программ SPSS Statistics 23 (IBM, США). Распределение переменных оценивали при помощи критерия Колмогорова-Смирнова. При этом распределение считали нормальным, если критерий Колмогорова-Смирнова был более 0,05 и ненормальным, если критерий был менее 0,05. Результаты представлены в виде среднего и стандартного отклонения (M±SD) или медианы (Me) и межквартильного интервала [ 25%, 75%] в зависимости от вида распределения данных. Значимость различий между анализируемыми группами оценивали с помощью двухстороннего критерия Стьюдента для количественных показателей, для качественных показателей — с помощью критерия Манна-Уитни. Качественные данные сравнивали с использованием таблицы сопряженности, применяли критерий χ2 Пирсона и точный критерий Фишера. Для выявления предикторов развития пФП использован пошаговый логистический регрессионный анализ, оценивали отношение шансов (ОШ) и границ 95% доверительного интервала (ДИ). Статистически значимыми считали различия показателей при р< 0,05.
Результаты
Клинические и ангиографические характеристики больных стабильной стенокардией представлены в табл. 1. Среди включенных в исследование пациентов большинство составляли мужчины с многососудистым поражением коронарных артерий. У 45,6% больных имелись нарушения углеводного обмена. пФП исходно зарегистрирована у 10,9% лиц. Фракция выброса (ФВ) ЛЖ была 58,7±7,8%.
Исходная терапия больных представлена в табл. 2. Преобладающее количество больных принимали до КШ бета-блокаторы, ингибиторы ангиотензинпревращающего фермента или сартаны. Дезагреганты получали все пациенты, их отменяли за 5 дней до операции. 39,1% больных принимали антагонисты кальция, а 18,5% — иSGLT-2, из них 13 (14,1%) человек, имеющих НУО, и 4 (4,3%) — с ХБП без НУО. Использован дапаглифлозин (Форсига, Астра Зенека) и эмпаглифлозин (Джардинс, Берингер Ингельхайм). иSGLT-2 были назначены на амбулаторном этапе лечения, в стационаре был продолжен прием этих препаратов. За сутки до КШ прием иSGLT-2 прекращали и возобновляли на вторые сутки после вмешательства. Больным с НУО были назначены также препараты из группы сульфонилмочевины, инсулин и метформин (табл. 2). Статины принимали все пациенты. Аторвастатин использован у 95,6% лиц. Средняя доза аторвастатина составила 71±5,8 мг в сутки.
Показатели оперативного вмешательства у больных стабильной стенокардией представлены в табл. 3. Половине больных выполнено бимаммарное КШ с использованием двух внутренних грудных артерий, трети пациентов — КШ на работающем сердце. Количество имплантированных шунтов составило 2,7±0,7 ед., кровопотеря была умеренной.
Средний уровень гликемии в первые сутки КШ составил 10,5 (9,1-11,7) ммоль/л (медиана и квартили), уровень hs-cTnI через сутки после вмешательства — 898 (535-2000) нг/л. Уровень креатинина через сутки после КШ в сравнении с исходным практически не изменился: 86 (70-108) и 89 (76-99) мкмоль/л, соответственно, р=0,477.
Зарегистрировано 15 случаев (16,3%) ОПП. ОПП 1 ст. выявлено у 13 (14,1%), 2 ст. — у 2 (2,2%) больных. Случаев тяжелого ОПП, требующего терапии, замещающей функцию почек, не было. В группе лиц с ОПП наблюдали нарастание уровня креатинина с 88,6 (81-90,8) мкмоль/л исходно до –143 (114-205) мкмоль/л после КШ, p=0,001.
пФП после КШ зарегистрирована у 27 (29,3%) больных. В первые сутки КШ пФП отмечена у 3 (3,3%) лиц. Наиболее часто пФП возникала на 2-5 сутки после вмешательства. У 6 (6,5%) лиц пароксизмы ФП возникали неоднократно. Все пароксизмы ФП были тахисистолической формы со средней частотой сокращения желудочков 100-130 в минуту. Среди больных с ХБП (n=22) число лиц с послеоперационной пФП было несколько больше — 40,9% (9 из 22) в сравнении с группой пациентов без ХБП — 25,7% (18 из 70), однако различия не достигали статистической значимости (р=0,172). С целью купирования пФП после КШ у всех пациентов использован амиодарон. Время восстановления синусового ритма составило 6,5 (2-48) часов. У двух (2,2%) больных на фоне антиаритмической терапии сохранялась устойчивая форма ФП, в связи с чем в дальнейшем им была рекомендована терапия, направленная на контроль частоты сердечных сокращений. Первые несколько суток после КШ все больные получали антитромботическую терапию, включающую инфузию гепарина под контролем активированного частичного тромбопластиного времени в сочетании с ацетилсалициловой кислотой (АСК) в дозе 75 мг в сутки. При отмене гепарина пациентам с пФП назначали дополнительно к АСК в дозе 75 мг в сутки апиксабан в дозах 2,5 или 5 мг 2 раза в сутки. Апиксабан в дозе 5 мг 2 раза в сутки получали 17 (63%), в дозе 2,5 мг 2 раза в сутки — 10 (37%) лиц. Больные, не имевшие пФП после КШ, принимали два дезагреганта — АСК 75 мг в сутки и клопидогрел 75 мг в сутки.
Частота пФП после КШ в группе больных с послеоперационным ОПП (n=15) составила 9 (60%), а среди пациентов без ОПП (n=77) — 18 (23,4%) cлучаев, p=0,004.
С целью выявления факторов, ассоциированных с развитием послеоперационной пФП, выборка больных разделена на 2 группы: 1 группа — пациенты, имевшие после КШ пФП (n=27), 2 группа — лица без пФП после вмешательства (n=65). Рассчитана статистическая значимость различий между указанными группами больных по клиникоангиографическим, эхокардиографическим параметрам, показателям КШ, проводимой терапии. Показатели, по которым получены статистически значимые различия между анализируемыми группами больных, представлены в табл. 4.
Показателями, ассоциированными с развитием пФП после КШ, были уровни креатинина более (100 мкмоль/л) и мочевины более (7,8 ммоль/л) через сутки после вмешательства, случаи послеоперационного ОПП, более редкое применение препаратов из группы иSGLT-2. Между группами больных с пФП после КШ и без таковой не выявлено статистически значимых различий в количестве больных с НУО 40,7% (11 из 27) и без таковых — 47,7% (31 из 65), p=0,740; в уровне исходной гликемии — 5,2 (5,10-5,8) ммоль/л и 5,7 (5,2-6,4) ммоль/л, соответственно, p=0,583; гликемии в первые сутки КШ — 10,1 (9,9-12,6) ммоль/л и 8,3 (8,2-11,6) ммоль/л, соответственно, p=0,362. Среди больных с НУО, имевших послеоперационную пФП и без таковой, не было статистически значимых различий в частоте приема гипогликемических препаратов за исключением иSGLT-2.
Показатели, по которым получены статистически значимые различия между группами больных с послеоперационной пФП и без таковой, включены в пошаговый логистический регрессионный анализ. Предиктором развития пФП после КШ у больных стабильной стенокардией были случаи послеоперационного ОПП. При этом развитие ОПП после КШ статистически значимо повышало вероятность возникновения послеоперационной пФП в среднем в 5,5 раза (от 1,4 до 21,6 раз) (табл. 5).
Нами проанализирована также частота госпитальных осложнений после КШ у больных стабильной стенокардией. Зарегистрировано 14 (15,2%) случаев интраоперационного ИМ, 2 (2,2%) — сердечной смерти вследствие интраоперационного ИМ, 15 (16,3%) — ОПП; количество больных, имевших пФП после КШ составило 27 (29,3%). Случаев инсульта не было. Показатель кумулятивной частоты госпитальных осложнений после КШ составил 40,2% (n=37). За исключением случаев ОПП, частота других анализируемых госпитальных осложнений в группах больных с пФП после КШ и без таковой существенно не различалась. Так, частота случаев интраоперационного ИМ в группе пациентов с послеоперационной пФП и без таковой составила 6 (22,2%) и 8 (12,3%), соответственно, р=0,228, сердечной смерти — 1 (3,7%) и 1 (1,5%), соответственно, р=0,503, послеоперационного ОПП — 9 (33,3%) и 6 (9,2%), соответственно, р=0,004. Кумулятивная частота госпитальных осложнений КШ (случаев интраоперационного ИМ, сердечной смерти и ОПП) также была статистически значимо больше с группе больных с пФП в сравнении с пациентами, не имевшими таковой — 12 (44,4%) и 11 (16,9%), p=0,006.
Таблица 1. Клинико-ангиографические характеристики больных стабильной стенокардией
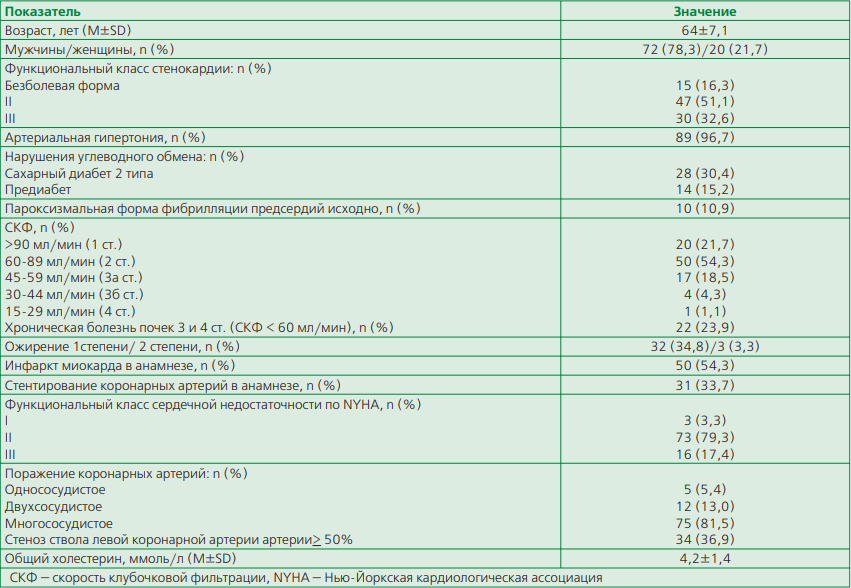
Таблица 2. Исходная терапия больных стабильной стенокардией
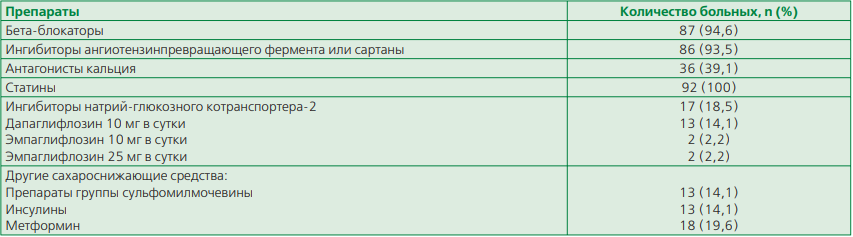
Таблица 3. Показатели оперативного вмешательстваубольных стабильной стенокардией

Таблица 4. Показатели, ассоциированные с послеоперационной пФП,убольных стабильной стенокардией, операцию КШ

Таблица 5. Предикторы развития послеоперационной пФП у больных стабильной стенокардией, перенесших операцию КШ

Обсуждение
Согласно результатам проведенного исследования, наиболее частыми госпитальными осложнениями КШ у больных стабильной стенокардией были пФП и ОПП — 29,3% и 16,3%, соответственно, при этом большинство лиц имели 1 ст. ОПП, а 2 ст. — только 2,2% больных. Случаев тяжелого ОПП, требующего проведения терапии, замещающей функцию почек, не было.
Полученные результаты вполне соответствуют литературным данным. Согласно результатам E.Thorén и соавт. [20], среди регистрируемых после КШ нарушений ритма сердца наиболее часто встречается пФП, ее частота составляет от 20 до 60%. Частота ОПП, связанного в КШ, наблюдаемая в нашей работе, также соответствует результатам других исследований — от 5% до 30% [21][22].
Послеоперационная ФП и ОПП имеют много общих ФР развития — возраст, АГ, СД, ХСН, ХБП, кровопотеря во время операции, продолжительность искусственного кровообращения и окклюзии аорты и др. [1]. Частое сочетание пФП и ОПП после кардиохирургических вмешательств связывают с общностью патогенеза данных осложнений — нестабильностью гемодинамики, гипер- и гиповолемией, гипергликемией, воспалением, оксидативным стрессом и другими факторами [1][5][20]. В нашем исследовании преобладающее число пФП регистрировалось на 2-5 сутки после КШ, т.е. ОПП предшествовало развитию пФП. Однако возможна и противоположная зависимость, когда нестабильность гемодинамики вследствие пароксизма ФП может вызвать ОПП.
Согласно результатам проведенного исследования, сочетание ОПП и пФП после КШ имелось у 9,8% больных. На частое сочетание указанных осложнений после кардиохирургических вмешательств указывают и другие авторы. Так, в ранее проведенных крупных исследованиях R. R. Ng и соавт. и O. M. Cole и соавт., включавших 2885 и 5588 пациентов, частота случаев сочетания указанных послеоперационных осложнений составила 12,9% и 12,5%, соответственно [2][5]. Указанные авторы рассматривают послеоперационное ОПП как ФР риска развития пФП после кардиохирургических операций [2][5]. Так, в исследованиях R. R. Ng и соавт. и O. M. Cole и соавт. риск развития пФП после кардиохирургических вмешательств среди больных с ОПП составил ОШ 1,7 (р<0,001) и ОШ 1,6 (р<0,001), соответственно [2, 5]. В нашем исследовании послеоперационное ОПП повышало вероятность развития пФП после КШ в среднем 5,5 раза (p=0,015).
Следовательно, результаты нашего исследования подтверждают данные литературы о частом сочетании пФП и ОПП после КШ и свидетельствуют о том, что ОПП является важным ФР развития послеоперационной пФП. Следует отметить, что пФП достаточно часто встречается после КШ, тем не менее, в литературе редко обсуждается вопрос об ОПП как важном ФР развития послеоперационной пФП. Мы встретили лишь два крупных исследования, посвященные данной проблеме [2][5].
В нашем исследовании не получено данных о взаимосвязи пФП после КШ с возрастом пациентов, исходной ХБП, СД, функциональным классом ХСН, длительностью операции и искусственного кровообращения и другими факторами, хотя в литературе такие данные имеются [1][2][5].
Согласно результатам нашего исследования, один из факторов, ассоциированных с развитием пФП после КШ, — более редкое применение иSGLT-2. Аналогичные данные получены в работе M. Zhuo и соавт., а также метаанализах W. Li и соавт. и A. S. Scheen, в которых показано, что применение иSGLT-2 у больных СД 2 типа и синусовым ритмом статистически значимо снижает вероятность развития пФП [9-11].
При поиске литературы мы не встретили исследований по оценке влияния иSGLT-2 на частоту возникновения пФП у больных, перенесших КШ. В нашей небольшой работе получены данные об ассоциации частоты приема ингибиторов SGLT-2 с количеством больных, имевших пФП после КШ. Следует подчеркнуть, что иSGLT-2 были назначены не только больным с СД 2 типа, но и пациентам без НУО, имеющим ХБП. Хорошо известно, что в раннем периоде после КШ у преобладающего числа пациентов, даже не имеющих исходно НУО, регистрируется гипергликемия [23]. Гипергликемия повышает риск развития пФП после КШ [24]. иSGLT-2 снижают уровень гликемии и, вероятно, тем самым предупреждают развитие послеоперационной пФП. Возможно, их положительное влияние на частоту пФП после КШ связано также с коррекцией ХСН и с плейотропными эффектами препаратов (противовоспалительным, антиоксидантным, положительным влиянием на функцию эндотелия и энергообеспечение кардиомиоцитов и другими) [25].
Ранее показано, что иSGLT-2 могут быть полезны многим пациентам, перенесшим КШ. Так, в крупном исследовании C.Sardu и соавт. лечение больных иSGLT-2 после КШ, выполненного без использования искусственного кровообращения, как при наличии СД 2 типа, так и без СД, приводило к снижению частоты сердечной смерти и повторной реваскуляризации миокарда на протяжении последующих 5 лет наблюдения [26]. Аналогичные данные получены при субанализе крупного исследования EMPA-REG OUTCOME [27]. Лечение эмпаглифлозином больных, ранее перенесших КШ, сопровождалось снижением обшей и сердечной смертности, частоты госпитализаций по поводу ХСН, замедлением прогрессирования нефропатии. Влияние иSGLT-2 на частоту возникновения пФП после КШ требует дальнейшей оценки в крупных специально спланированных исследованиях.
При оценке госпитальных осложнений КШ нами выявлено, что количество случаев интраоперационного ИМ, сердечной смерти статистически значимо не различалось между группами больных с послеоперационной пФП и без таковой. Однако частота случаев послеоперационного ОПП была статистически значимо больше в группе лиц с пФП после КШ. Кумулятивная частота случаев ОПП, интраоперационного ИМ и сердечной смерти в госпитальный период после КШ также была больше в группе больных с послеоперационной пФП в сравнении с группой лиц без таковой. Следовательно, госпитальный прогноз после КШ был более неблагоприятным среди лиц с послеоперационной пФП.
Ограничения исследования
Относительно небольшое количество включенных в исследование пациентов.
Заключение
Частота пФП в госпитальном периоде после КШ у больных стабильной стенокардией составила 29,3%, ОПП — 16,3%, их сочетание имелось у 9,8% пациентов. С развитием пФП после КШ были ассоциированы более высокие уровни креатинина и мочевины после вмешательства, большее число случаев послеоперационного ОПП, более редкое применение иSGLT-2. Предиктор развития пФП после КШ — случаи послеоперационного ОПП. При этом ОПП повышало вероятность развития пФП после КШ в среднем в 5,5 раза. Применение иSGLT-2 ассоциировалось с меньшей частотой развития послеоперационной пФП. Больные с пФП после КШ в сравнении с пациентами без таковой имеют более неблагоприятный госпитальный прогноз — большее кумулятивное число случаев ОПП, интраоперационного ИМ, сердечной смерти.
Отношения и Деятельность. Нет.
RelationshipsandActivities. None.
Финансирование. Исследование проведено при поддержке государственного бюджетного учреждения здравоохранения Тюменской области "Областная клиническая больница №1".
Funding. The study was performed with the support of the State Budget Institution of the Healthcare Department of Tyumen region "Regional Clinical Hospital №1".
Список литературы
1. Петракова Е. С., Савина Н. М., Молочков А. В. Фибрилляция предсердий после операций аортокоронарного шунтирования: факторы риска, профилактика, лечение. Кардиология. 2020;60(9):134-148. DOI:10.19087/cardio.2020.9.n1074.
2. Cole OM, Tosif S, Shaw M, Lip GYH. Acute Kidney Injury and Postoperative Atrial Fibrillation In Patients Undergoing Cardiac Surgery. J Cardiothorac Vasc Anesth. 2020;34(7):1783-1790. DOI:10.1053/j.jvca.2019.12.048.
3. Auer J, Lamm G, Weber T, et al. Renal function is associated with risk of atrial fibrillation after cardiac surgery. Can J Cardiol.2007;23:859-863. DOI:10.1016/s0828-282x(07)708395.
4. Burrage PS, Low YH, Campbell NG, O’Brien B. New-Onset Atrial Fibrillation in Adult Patients After Cardiac Surgery. Curr Anesthesiol Rep.2019;9(2):174-193. DOI:10.1007/s40140-019-00321-4.
5. Ng RR, Tan GHJ, Liu W, et al. The Association of Acute Kidney Injury and Atrial Fibrillation in an Asian Prospective Cohort Study. Medicine (Baltimore). 2016;95(12):e3005. DOI:10.1097/MD.0000000000003005.
6. Wanner C, Lachin JM, Inzucchi SE, et al; EMPA-REG OUTCOME Investigators. Empagliflozin and Clinical Outcomes in Patients With Type 2 Diabetes Mellitus, Established Cardiovascular Disease, and Chronic Kidney Disease. Circulation. 2018;137(2):119-129. DOI:10.1161/CIRCULATIONAHA.
7. Heerspink HJL, Stefansson BV, Corred-Rotter R, et al.; DAPA-CKD Trial Committees and Investigators. Dapagliflosin in Patients with Chronic Kidney Disease. N Engl J Med. 2020;383(15):1436-1446. DOI:10.1056/NEJMoa2024816.
8. The EMPA-KIDNEY Collaborative Group; Herrington WG, Staplin N, Wanner Ch, et al. Empagliflozin in Patients with Сhronic Kidney Disease. N Engl J Med. 2023;388(2):117-127. DOI:10.1056/NEJMoa2204233.
9. Zhuo MD, Andrea E, Paik JM, et al. Association of sodium-glucose cotransporter-2 inhibitors with incident atrial fibrillation in older adults with type 2 diabetes. JAMA. 2022;3:5(10):e2235995. DOI:10.1001/jamanetworkopen.2022.35995.
10. Li W, Chen X, Xie X, et al. Comparison of sodium-glucose cotransporter-2 inhibitors and glucagon-like peptid receptor agonists for atrial fibrillation in type-2 diabetes mellitus: systematic review with network meta-analisis of randomized controlled trials. J Cardiovasc Pharmacol. 2022;1:79(3):281-288. DOI:10.1097/FJC.0000000000001197.
11. Scheen AJ. Antidiabetic agents and risk of atrial fibrillation/flutter: A comparative critical analisis with a focus on differences between SGLT-2 inhibitors and GLP-1 receptor agonists. Diabetes Metab. 2022;48(6):101390. DOI:10.1016/j.diabet.2022.101390.
12. Zhuo M, Paik JM, Wexler DS, et al. SGLT-2 inhibitors and the risk of acute kidney injury in older adults with type 2 diabetes. Am J Kidney Dis. 2021;79(6):858-867. e1. DOI:10.1053/j.ajkd.2021.09.015.
13. Hua R, Ding N, Guo H, et al. Contrast-Induced Acute Kidney Injury in Patients on SGLT-2 Inhibitors Undergoing Percutaneous Coronary Interventions. A Propensity-Matched Analysis. Front Cardiovasc Med. 2022;9:918167. DOI:10.3389/fcvm2022.918167.
14. Neumann FJ, Sousa-Uva M, Ahlsson A, al.; ESC Scientific Document Group. 2018 ESC/EACTS guidelines on myocardial revascularization. Eur Heart J. 2019;40:87-165. DOI:10.1093/eurheartj/ehy394.
15. Judkins MP. Selective coronary arteriography, a percutaneous transfemoral technic. Radiology. 1967;89(5):815-822. DOI:10.1148/89.5.815.
16. Levey AS, Stevens LA, Schmid CH, et al. A new equation to estimate glomerular filtration rate. Ann Intern Med.2009;5:150(9):604-612. DOI:10.7326/0003-4819-150-9-200905050-00006.
17. Andrassy KM. Comments on KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney Int. 2013;84(3):622-623. DOI:10.1038/ki.2013.243.
18. Ad-hoc working group of ERBP; Fliser D, Laville M, Covic A, et al. A European Renal Best Practice (ERBP) position statement on the Kidney Disease Improving Global Outcomes (KDIGO) Clinical Practice Guidelines on Acute Kidney Injury: Part 1: defenitions, conservative management and contrast-induced nephropathy. Nephrol Dial Transplant. 2012;27(12):4263-4272. DOI:10.1093/ndt/gfs375.
19. Thygesen K, Alpert JS, Jaffe AS, et al.; ESC Scientific Document Group. Fourth universal definition of myocardial infarction 2018. Eur Heart J. 2018;138(20):e618-51. DOI:10.1093/eurheartj/ehy462.
20. Thorén E, Hellgren L, Ståhle E. High incidence of atrial fibrillation after coronary surgery. Interact Cardiovasc Thorac Surg. 2016;22(2):176-80. DOI:10.1093/icvts/ivv326.
21. Karkouti K, Wijeysundera DH, Yau TM, et al. Acute kidney injury after cardiac surgery: focus on modifiable risk factors. Circulation. 2009;119(4):495-502. DOI:10.1161/CIRCULATIONAHA.108.786913.
22. Vives M, Hernandez A, Parramon F, et al. Acute kidney injury after cardiac surgery: prevalence, impact and management challenges. Int J Nephrol Renovasc Dis.2019;12:153-166. DOI:10.2147/IJNRD.S167477.
23. Sheikhzadeh D, Mirina M, Zhad R, et al. Do nondiabetic patients undergoing coronary artery bypass grafting surgery require intraoperative management of hyperglycemia. Acta Anaesthesiol Taiwan. 2011;49(2):2:41-45. DOI:10.1016/j.aat.2011.05.009.
24. Tatsuishi W, Adachi H, Murata M, et al. Postoperative Hyperglycemia and atrial fibrillation after coronary artery bypass graft surgery. Circ J 2015;79(1):112-118. DOI:10.1253/circj.CJ-14-0989.
25. Frank W, Hajdys J, Radzioch E, et al. Cardiovascular disease: therapeutic potential of SGLT-2 inhibitors. Biomedicines 2023;11(7):2085. DOI:10.3390/biomedicines11072085.
26. Sardu C, Massetti M, Testa N, et al. Effects of sodium-glucose transporter-2 inhibitors (SGLT2-I) in patients with ischemic heart disease treated by coronary artery bypass grafting via MiECC: inflammatory burden, and clinical outcomes at 5 years of follow-up. Front Pharmacol. 2021;12:777083. DOI:10.3389/fphar.2021.777083.
27. Verna S, Mazer CD, Fitchett D, et al. Empagliflozin reduces cardiovascular events, mortality and renal events in participants with type 2 diabetes after coronary bypass graft surgery: subanalysis of the EMPA-REG OUTCOME randomized trial. Diabetologia. 2018;61(8):1712-1723. DOI:10.1007/s00125-018-4644-9.
Об авторах
Л. В. КремневаРоссия
Кремнева Людмила Викторовна, кафедра клинической лабораторной диагностики, профессор кафедры
Томск
eLibrary SPIN 9369-3526
Л. А. Арутюнян
Россия
Арутюнян Люсине Амазасповна, кафедра кардиологии и кардиохирургии с курсом скорой медицинской помощи, доцент
Томск
eLibrary SPIN 5664-6065
Л. И. Гапон
Россия
Гапон Людмила Ивановна, руководитель научно-клинического отделения, заслуженный деятель науки
Томск
eLibrary SPIN 2291-2342
С. Н. Суплотов
Россия
Суплотов Сергей Николаевич, кафедра клинической лабораторной диагностики, зав. кафедрой
Томск
eLibrary SPIN 1130-9791
С. В. Шалаев
Россия
Шалаев Сергей Васильевич, кафедра кардиологии и кардиохирургии с курсом скорой медицинской помощи, зав кафедрой, член-корреспондент РАН
Томск
eLibrary SPIN 5285-0082
Дополнительные файлы
Рецензия
Для цитирования:
Кремнева Л.В., Арутюнян Л.А., Гапон Л.И., Суплотов С.Н., Шалаев С.В. Острое повреждение почек как фактор риска фибрилляции предсердий после операции коронарного шунтирования – эффекты ингибиторов натрийглюкозного котранспортера-2. Рациональная Фармакотерапия в Кардиологии. 2023;19(6):549-556. https://doi.org/10.20996/1819-6446-2023-2985. EDN: SXAUHO
For citation:
Kremneva L.V., Arutyunyan L.A., Gapon L.I., Suplotov S.N., Shalaev S.V. Acute kidney injury as a risk factor for atrial fibrillation after coronary artery bypass grafting — effects of sodium-glucose cotransporter-2 inhibitors. Rational Pharmacotherapy in Cardiology. 2023;19(6):549-556. (In Russ.) https://doi.org/10.20996/1819-6446-2023-2985. EDN: SXAUHO















































