Перейти к:
Доказательная фармакотерапия в кардиологии. Национальное руководство
https://doi.org/10.20996/1819-6446-2024-2992
EDN: BZBLMS
Аннотация
Доказательная фармакотерапия является частью доказательной медицины и использует основные ее принципы, но только те из них, которые имеют отношение к лекарственным препаратам. Также незыблемым условием доказательной фармакотерапии является соблюдение правил надлежащей клинической практики.
Целью данного руководства является описание основных методов доказательной фармакотерапии и объективной трактовки полученных результатов, а также особенностей применения препаратов с доказанным действием в реальной клинической практике.
Авторы данного руководства выражают надежду, что оно поможет практическим врачам грамотно трактовать результаты полученных исследований, чтобы осознанно принимать клинические решения. Руководство поможет также тем, кто планирует проводить клинические исследования, избежать при этом типичных ошибок и получить результаты, реально необходимые в клинической практике.
Для цитирования:
Марцевич С.Ю., Кутишенко Н.П., Лукина Ю.В., Якусевич В.В., Толпыгина С.Н., Самородская И.В., Лукьянов М.М., Загребельный А.В., Метельская В.А., Поддубская Е.А., Драпкина О.М. Доказательная фармакотерапия в кардиологии. Национальное руководство. Рациональная Фармакотерапия в Кардиологии. 2024;20(1):105-170. https://doi.org/10.20996/1819-6446-2024-2992. EDN: BZBLMS
For citation:
Martsevich S.Yu., Kutishenko N.P., Lukina Yu.V., Yakusevich V.V., Tolpygina S.N., Samorodskaya I.V., Lukyanov M.M., Zagrebelny A.V., Metelskaya V.A., Poddubskaya E.A., Drapkina O.M. Evidence-based pharmacotherapy in cardiology. National guideline. Rational Pharmacotherapy in Cardiology. 2024;20(1):105-170. (In Russ.) https://doi.org/10.20996/1819-6446-2024-2992. EDN: BZBLMS
Введение
Доказательная фармакотерапия — часть доказательной медицины
Доказательная фармакотерапия использует основные методы доказательной медицины, но только те из них, которые имеют отношение к лекарственным препаратам (ЛП). Методы доказательства эффективности и безопасности ЛП имеют некоторые особенности, которые будут рассмотрены в этом документе.
Использование методов доказательной фармакотерапии в кардиологии продемонстрировало способность целого ряда ЛП реально улучшать прогноз различных сердечно-сосудистых заболеваний (ССЗ) и продлевать жизнь пациентов. Целью данных рекомендаций является описание основных методов доказательной фармакотерапии и объективной трактовки полученных с их помощью результатов, а также особенностей применения препаратов с доказанным действием в реальной клинической практике.
Различные способы доказательств в медицине
Клинический способ
В течение многих веков основным способом доказательства в медицине был так называемый клинический опыт, который далеко не всегда позволял дать объективную оценку проводимому лечению, а иногда приводил и к неблагоприятным последствиям. Так, например, в 40-50-е гг. ХХ в. считалось, что лучшим методом лечения острого инфаркта миокарда (ИМ) является длительное (2-3 мес.) соблюдение абсолютного покоя. Это заключение было основано на клиническом опыте рекомендовавших его специалистов [1], никаких специальных исследований по этому вопросу не проводилось.
С появлением ЛП, для проявления эффекта которых требуются длительные сроки (например, статинов), опыт врача стал играть еще меньшую роль, так как врачу крайне сложно оценить влияние препарата на возникновение отдаленных исходов заболевания. Тем не менее, врач вполне может оценить симптоматическое действие лекарства (например, антиангинальный эффект), а также его безопасность (например, риск возникновения кровотечений).
Патофизиологический способ
Патофизиологический опыт доказательства в медицине, как дополнение клиническому опыту, стал использоваться по мере развития таких наук как физиология, патофизиология, фармакология. Этот способ обосновывает возможность применения того или иного лекарства исходя из механизма его действия, влияния на те или иные биологические процессы, протекающие в организме. Однако, при всей привлекательности этого способа, необходимо признать, что он далеко не всегда находит подтверждение в медицине.
Наглядным примером является активное применение антиаритмических препаратов для лечения больных ишемической болезнью сердца (ИБС), в частности острым ИМ в 70-90-х гг. ХХ в. Тогда считалось, что аритмии являются основной причиной смерти таких больных, была разработана специальная классификация аритмий [2], ранжировавшая их по степени риска внезапной смерти. Примерно в то же время появился многочисленный ряд антиаритмических препаратов, для которых была достаточно убедительно продемонстрирована способность предотвращать аритмии как в эксперименте, так и в клинике, причем в первую очередь это касалось аритмий самых высоких градаций. Эти препараты были рекомендованы для активного клинического использования без проведения дополнительных исследований. В частности, их применение стало обязательным для лечения больных ИБС, особенно в острой стадии ИМ. Были разработаны специальные схемы введения лидокаина, позволявшие поддерживать стабильную его концентрацию в крови.
Такая практика применения антиаритмических препаратов существовала не менее 2-х десятилетий, однако получение результатов рандомизированного контролируемого исследования (РКИ) CAST показало не только ее бесполезность, но и реальную опасность [3]. Препараты 1С-класса — флекаинид и энкаинид, несмотря на отчетливый антиаритмический эффект, не снижали, а увеличивали смертность больных. Другим, не менее показательным примером несостоятельности патофизиологического способа доказательств, была попытка применения нифедипина при остром ИМ. Экспериментальные исследования достаточно убедительно обосновывали его возможную эффективность при этом состоянии. Однако в ряде РКИ не только не была доказана его эффективность при нестабильной стенокардии и ИМ, но получена тенденция к увеличению смертности больных [4][5].
Клинические исследования
Уже с начала XIX в. появилось понимание того, что только клинические исследования могут дать объективный результат об эффективности и безопасности лекарственных средств (ЛС). Далеко не сразу стало очевидным, однако, какой способ проведения исследований является наиболее верным. В середине ХХ в. стало понятным, что обеспечить строгий способ доказательств могут только исследования, основанные на принципе научного эксперимента.
Появление доказательной медицины
Попытки объективизировать лечебный эффект, придать назначаемому лечению научную обоснованность предпринимались несколько сот лет назад. Считается, что основные философские принципы доказательной медицины были сформулированы в середине XIX в. во Франции или несколько раньше [6]. Основные подходы к проведению исследований, основанных на принципах доказательности, появились в середине ХХ в. В 1946 г. было проведено первое классическое РКИ (см. ниже), в котором реализовались основные подходы к проведению исследований, строго основанных на научных доказательствах. В 1967 г. D. L. Sackett сформулировал основной принцип доказательной медицины, под которой он понимал "применение врачом, осуществляющим непосредственную медицинскую помощь, эпидемиологических и биометрических методов в изучении диагностического и терапевтического процесса, чтобы добиться улучшения здоровья" [7]. В 1981 г. он же предложил термин "критическая оценка" (critical appraisal) — метод понимания научной литературы и его применения у постели больного. Однако сам термин "медицина, основанная на доказательствах", впервые появился в 1991 г. в редакционной статье журнала American College of Physicians Journal Club [8]. В 1996 г. D. L. Sackett дал новое определение доказательной медицины — "сознательное использование с учетом здравого смысла современных наилучших доказательств в принятии решений о медицинской помощи конкретным больным" [7], которое, вероятно, наиболее точно отражает сущность этого метода на сегодняшний день. Такое определение доказательной медицины вовсе не исключает использование клинического опыта врача и не требует слепо и бездумно внедрять полученные в конкретных исследованиях данные в реальную клиническую практику.
Рандомизированное контролируемое исследование — "золотой стандарт" доказательной медицины
История РКИ
Понятие РКИ четко сформировалось в середине ХХ в. До сих пор идет спор о том, кто провел первое РКИ, прообразы РКИ проводили еще в XVIII в., однако первое классическое РКИ было проведено, как отмечалось выше, в 1946 г. сэром A. B. Hill. Оно называлось MRC streptomycin trial и было направлено на изучение эффекта недавно открытого стрептомицина у больных туберкулезом [9]. Использование результатов этого исследования не только спасло жизнь десяткам тысяч больных, но и установило определенный алгоритм доказательств в медицине, который существует и по настоящее время.
Что такое РКИ
Под РКИ в настоящее время понимают экспериментальное исследование, выполненное на больных с соблюдением соответствующих этических норм, имеющее заранее определенную цель (реализуется в конечных точках), жесткий протокол, четкие критерии включения и исключения участников, разделяющее больных с помощью рандомизации на две (или более) одинаковых группы, которые различаются только по тому, проводится или не проводится в них изучаемое вмешательство [10].
Особую роль РКИ играют при изучении препаратов, влияющих на исходы заболевания, в первую очередь, на показатели смертности. Утверждать, то, что препарат продлевает жизнь, можно только реально доказав это в соответствующем исследовании, сравнив результаты смертности в основной группе (получающей препарат) и в контрольной группе (не получающей препарат).
В РКИ могут изучаться:
- Эффективность и безопасность вновь созданного препарата при определенной патологии;
- Эффективность и безопасность различных доз одного и того же препарата;
- Эффективность и безопасность уже зарегистрированного препарата по новым показаниям;
Существуют различные виды сравнения в РКИ. Например, новый препарат можно сравнивать с плацебо (в отсутствие базового лечения или на фоне базового лечения), новый препарат можно сравнивать со стандартным препаратом (более старым), наконец можно сравнивать между собой стандартные виды вмешательств, ранее применявшиеся в медицине.
Особенности РКИ с ЛП
Изучение ЛП и, в частности, проведение РКИ с лекарствами, имеет некоторые особенности по сравнению с РКИ с другими лечебными вмешательствами. В них значительно проще обеспечить соблюдение двойного слепого метода, значительно повышающего объективность исследования (что крайне сложно, а иногда и невозможно сделать при изучении хирургических методов лечения). В РКИ с лекарствами полностью исключается такой смещающий фактор, как опыт оперирующего хирурга (в РКИ, изучающих эффективность хирургических методов лечения), фактор, который практически не поддается коррекции при современном способе оперативных вмешательств. Таким образом, РКИ с ЛП в принципе обеспечивают более надежный результат по сравнению с РКИ, изучающими нелекарственные методы воздействия.
Планирование РКИ
РКИ должно обязательно иметь предварительную гипотезу (например, новый препарат лучше старого или новый препарат не хуже старого). Как правило, основная гипотеза РКИ основывается на ранее проведенных экспериментальных и небольших клинических исследованиях. При планировании РКИ выдвигается так называемая нулевая гипотеза, утверждающая, что новый препарат не лучше старого. Задачей РКИ является опровержение нулевой гипотезы, т.е. доказательство того, что новый препарат лучше старого, или, по крайней мере, не хуже его [10].
Виды сравнений в РКИ
В медицине традиционно при появлении новых методов лечения, в том числе новых ЛП, стремились доказать их превосходство перед ранее существовавшими. Этот принцип был сохранен с появлением РКИ, с помощью которых пытались доказать преимущество нового метода лечения перед ранее существовавшим (superiority). Позже появились так называемые исследования эквивалентности (equivalence trials), целью которых было доказать, что новый и старый метод вмешательства одинаковы. Такой метод в настоящее время активно используется для доказательства биоэквивалентности воспроизведенных и оригинальных препаратов.
Появление большого количества ЛП с доказанным действием (в первую очередь в кардиологии во второй половине ХХ в.) создало проблему доказательств преимущества вновь создаваемых препаратов перед препаратами, ранее уже доказавшими свою эффективность в РКИ. Эти новые препараты далеко не всегда оказывались лучше старых (хотя могли быть более удобными и безопасными в применении), поэтому количество РКИ с отрицательными результатами существенно увеличилось.
В связи с этим в начале ХХ в. был предложен новый способ оценки результатов РКИ — доказательство того, что новый препарат может быть несколько хуже старого, но это различие не должно выходить за определенные пределы (non-inferior margins), которые устанавливаются достаточно произвольно, но задаются перед проведением исследования. Считается, что если эффективность нового препарата не выходит за эти пределы, то он по клинической эффективности не должен отличаться от старого препарата. При этом новый препарат должен обладать другими существенными преимуществами перед старым, т.е. быть более безопасным, более удобным в применении, более дешевым и пр. Важно, что эти дополнительные преимущества нового препарата не обязательно доказывать в соответствующих РКИ, их как бы принимают на веру. Исследования такого типа стали называть исследованиями типа "не хуже" (non-inferiority trials) [12].
Достаточно очевидно, что исследования по типу "не хуже" частично выходят за рамки классической доказательной медицины, в первую очередь, за счет произвольного установления границ "не хуже", а также за счет отсутствия требования к доказательствам бóльшего удобства применения новых препаратов. Преимуществом исследований по типу "не хуже" является возможность включения значительно меньшего количества больных, чем в исследования по типу "превосходства", причем чем больше интервал "не хуже", тем меньшее количество больных требуется включить в РКИ. Следует учесть, однако, что, если эффективность изучаемых препаратов (как новых, так и старых) в РКИ по типу "не хуже" относительно невелика, то существует риск, что значительное расширение интервала "не хуже" приведет к тому, что "доказанная" эффективность нового препарата не будет отличаться от плацебо и будет получен ложноположительный результат.
Отношение к значимости исследований "не хуже" различно. Некоторые считают их проведение неэтичным, так как есть риск неоправданного завышения эффективности нового препарата [13], другие считают их проведение вполне оправданным, при условии, что существуют четкие доказательства эффективности препарата сравнения и очевидные доказательства преимуществ применения нового препарата. С помощью исследований по типу "не хуже" была доказана эффективность всех "новых" пероральных антикоагулянтов [14-16]. Использование данного типа РКИ в этом случае объясняли следующими причинами: во-первых, эффективность препарата сравнения — варфарина — в профилактике инсульта, связанного с фибрилляцией предсердий (ФП), ранее была убедительно доказана во множестве РКИ. Во-вторых, преимущества "новых" антикоагулянтов перед варфарином в применении были достаточно очевидны (отсутствие необходимости подбора дозы, регулярного контроля лабораторных показателей).
В то же время, при изучении принципиально новых препаратов, не имеющих аналогов, использование РКИ по типу "не хуже" представляется недопустимым. Так, например, изучение нового гиполипидемического препарата из группы ингибиторов пропротеиновой конвертазы субтилизин-кексинового типа 9 (proprotein convertase subtilisin/kexin type 9, или PCSK9) эволокумаба в исследовании FOURIER проводилось с помощью метода "превосходства" перед плацебо [17].
РКИ эквивалентности достаточно долго использовались для оценки новых ЛП, пока их не сменили РКИ по типу "не хуже". В настоящее время их используют для изучения новых показаний к применению уже существующих ЛП [13]. Некоторые авторы считают, что научное сообщество должно разработать более жесткие критерии для изучения новых препаратов при использовании протокола "не хуже" [18-20].
Исторически в исследованиях по типу "не хуже" считали возможным использовать анализ "per protocol", который предполагает исключение больных с серьезными нарушениями протокола и невысокой приверженностью к лечению. Обоснованием необходимости такого анализа считали тот факт, что упомянутые выше больные "растворяли" различия между рандомизированными группами и увеличивали шанс продемонстрировать эффективность "не хуже" (при том, что новое лечение в действительности хуже стандартного). Однако в последнее время высказывается все больше сомнений в правильности такого анализа, так как он нарушает рандомизацию. Поэтому в последнее время большинство авторов считает, что исследования по типу "не хуже" в первую очередь должны анализироваться с помощью анализа "intention to treat" (анализ результатов исследования, исходя из начального распределения в группы рандомизации) и только после этого — с помощью анализа "per protocol". Только в том случае, если оба вида анализа приводят к одинаковому результату, можно делать вывод, что новый препарат "не хуже", или "хуже" стандартного [21]. Некоторые авторы высказывают однозначное мнение, что в РКИ по типу "не хуже", анализ intention to treat должен быть основным. Четких принципов того, как устанавливаются границы "не хуже", до сих пор нет, и разные авторы высказывают разные суждения по этому вопросу [22][23].
Дизайн исследования
Детальный протокол исследования играет центральную роль в РКИ. Он должен включать цель исследования и объяснение его актуальности и важности для практической медицины, критерии включения и исключения больных, методологию исследования, в том числе метод рандомизации, ослепление назначенного лечения, расписание визитов, учет назначаемых лекарств, одобрение этического комитета, форму информированного согласия, методы статистического анализа [24].
Рандомизация
Впервые понятие рандомизации было сформулировано C. S. Peirce в 1877 г., который рассматривал рандомизацию как главный компонент исследования, позволяющий уменьшить смещение результатов. Первое использование термина рандомизация применительно к экспериментальным исследованиям относится к 1926 г. [25]. Под рандомизацией понимают метод случайного распределения больных в группы изучаемого и контрольного метода лечения. По мнению большинства специалистов в области доказательной медицины, из всех компонентов РКИ именно рандомизация обеспечивает этому виду исследований наиболее высокую степень объективности и научной достоверности [26].
Рандомизация должна обеспечивать идентичность известных и неизвестных характеристик больных в начале исследования. В случае успешной рандомизации формируются две (или более) группы больных, не различающихся между собой. Соответственно, те различия, которые будут выявлены в конце исследования, будут объясняться влиянием изучаемого лечения. В небольших РКИ, несмотря на рандомизацию, смещение результатов все же может иметь место. Стратификация при рандомизации в отношении тех показателей, которые могут повлиять на смещение результатов (например, пола), повысит мощность исследования [27]. Существуют самые разнообразные технические способы рандомизации, обзор которых не входит в задачи данного документа.
Методы ослепления
Понятие "ослепления" вмешательства в клинических исследованиях было впервые сформулировано J. B. Amberson и соавт. в 1931 г. при проведении исследования с использованием рандомизации на больных туберкулезом [28]. Однако попытки сделать неизвестным для испытуемого факт приема препарата или плацебо предпринимались значительно раньше. Так, например, в 1907 г. W. H. R. Revers и H. N. Webber, изучая эффект кофеина на физическую работоспособность, использовали смесь, принимая которую, было невозможно определить, содержит она кофеин или нет [29].
Существует простой, или одинарный, метод ослепления (когда только больной не знает, какой вид лечения ему назначен) и двойной слепой метод (когда ни врач, ни больной не знают, какой препарат принимает больной. Существует также "sham" метод ослепления (sham — поддельный, фиктивный), использующийся при изучении эффективности хирургических методов лечения, когда больным основной и контрольной группы проводится одинаковое хирургическое вмешательство, и только оперирующий хирург знает, использовался или не использовался определенный метод лечения (например, баллонная ангиопластика с установкой стента в коронарную артерию).
Ослепление, особенно двойное слепое, помогает избежать предвзятости исследователей при оценке результатов лечения, особенно при трактовке исходов болезни или возникновении побочных действий, и способствует получению более надежных и независимых данных [30]. В последнее время при проведении крупных РКИ с отдаленным наблюдением стали использовать так называемый PROBE метод (Prospective Randomized Open-label, Blinded Endpoint controlled method), когда препараты назначаются открыто, а исходы заболевания заслеплены для проводящих анализ лиц [31].
Критерии включения и исключения
Критерии включения и исключения больных в РКИ играют важнейшую роль при проведении РКИ и трактовке его результатов. Принято считать, что в РКИ критерии исключения всегда многочисленны, что приводит к формированию высокоселективной когорты больных, нечасто встречающихся в реальной клинической практике. Действительно, во многие РКИ не включаются больные с очень тяжелым течением заболевания, больные пожилого возраста, больные с высокой коморбидностью и пр. Необходимо отметить, однако, что разные РКИ по-разному формулируют критерии невключения (исключения) больных. Так, для того чтобы включить одного больного в некоторых РКИ приходится проскринировать 20-30 пациентов. В то же время, существуют РКИ, в которых критерии исключения не столь многочисленны, есть РКИ, в которые включаются больные с тяжелым течением заболевания. Так, например, в исследовании COMPASS [32] с ривароксабаном абсолютный риск смерти составил около 4%, в исследовании же COMMANDER HF с тем же самым препаратом — 22% [33]. Это свидетельствует о том, что в последнее исследование включались больные с очень тяжелым течением заболевания, а критерии исключения были значительно менее жесткими.
Применение более жестких критериев исключения позволяет составить более однородную группу больных, снижает риск появления опасных побочных действий, уменьшает влияние вмешивающихся факторов, однако всегда несет в себе риск формирования когорты больных, нетипичных для реальной клинической практики.
После окончания РКИ и обработки его результатов по критериям включения и исключения, а также по общей характеристике больных можно составить "портрет" больного, участвовавшего в РКИ. Выводы РКИ всегда будут применимы в клинической практике только к таким же больным.
Размер выборки
Определение количества включаемых в РКИ больных является важнейшей процедурой РКИ, оно проводится заранее и рассчитывается с помощью статистических методов, исходя из предполагаемой выраженности эффекта. Чем больше предполагаемое различие в эффективности используемых методов лечения, тем меньшее количество больных требуется включить в РКИ. Однако не всегда удается правильно предсказать ожидаемый эффект вмешательства (как в основной, так и в контрольной группе), из-за этого многие РКИ обладают недостаточной "мощностью" для выявления эффекта. В таких случаях единственным вариантом установления истинной эффективности вмешательства является проведение нового РКИ [26].
Можно привести примеры, как более двух десятков РКИ, выполненных с конца 50-х до начала 80-х гг. ХХ в., в каждое из которых включалось не более 1000 больных, не выявили влияния внутривенной фибринолитической терапии на показатели смертности при остром ИМ (хотя при этом некоторые из них выявили достоверное учащение кровотечений). Вследствие этого фибринолитическая терапия на некоторое время была признана неэффективной и даже опасной при остром ИМ. Однако после проведения двух исследований — GISSI-1 [34] и ISIS-2 [35], каждое из которых включало более 10000 больных, стало очевидным, что тромболитическая терапия значительно снижает показатели смертности. Стало очевидным также и то, что в течение 20 лет терялись множество жизней больных, при том, что существовал препарат, который мог их спасти. В таких случаях проведение метаанализа ряда небольших исследований теоретически могло прояснить ситуацию.
Количество включаемых в исследование больных в значительной степени зависит от того, какие исходы заболевания включаются в оценку эффективности лечения и как часто они встречаются в изучаемой группе больных. Введение так называемых комбинированных конечных точек позволяет существенно снизить объем выборки. Кроме того, объем выборки зависит от типа сравнения: в исследованиях, выполняемых по типу "не хуже" (non-inferior), объем необходимой выборки всегда будет существенно меньше, чем в исследованиях по типу превосходства (superiority).
Набор и удержание больных
Набор больных в РКИ, особенно с жесткими критериями исключения, нередко является проблемой. По этой причине некоторые РКИ так и не были закончены. Не менее важной проблемой считается потеря больных в процессе исследования (отсутствие контакта с больным и невозможность установить его жизненный статус). Во многом это зависит от наблюдающего больного врача, а также от сложности протокола РКИ. Доля потерянных больных является важным показателем качества исследования, хотя она далеко не всегда приводится при публикации результатов.
Различные виды РКИ
Существуют, по крайней мере, два общих подхода к проведению РКИ. Один из них предполагает после рандомизации наблюдение разных групп больных в течение фиксированного времени с последующей оценкой в конце установленного протоколом периода каких-либо параметров и сравнения их между двумя группами. Например, таким образом можно оценить степень снижения артериального давления (АД), уровня холестерина (ХС) и т.д. и сравнить ее в основной и контрольной группах.
Все больные (кроме выбывших по разным причинам) в таком типе исследований наблюдаются одно и то же время. При таком типе исследований [36] можно выявить различия в действии препарата и плацебо (или двух препаратов), ориентируясь на самые разнообразные показатели; главная проблема состоит в том, чтобы эти показатели обладали какой-либо клинической значимостью.
Принципиально иной подход используется в исследованиях, изучающих те или иные исходы заболевания (так называемые "outcome studies"). Такого рода исследования дают значительно больше клинической информации, поскольку в них оценивается влияние изучаемого метода вмешательства на прогноз заболевания и даже на прогноз жизни. Основная проблема оценки таких исследований заключается в том, что все включенные в них больные наблюдаются разное время (до наступления какого-либо исхода заболевания). В связи с этим были разработаны специальные статистические методы [37][38]. Для оценки результатов таких исследований было предложено понятие конечной точки (см. ниже).
РКИ на одном больном (n-of-1 trials)
Первые рандомизированные исследования на одном больном были выполнены в 80-х гг. ХХ в. [39]. Протокол таких исследований подразумевает последовательное назначение в случайном порядке разных видов терапии, включая плацебо, одному и тому же больному. При этом больной является сам себе контролем. У каждого больного при проведении такого исследования можно выявить наиболее эффективное и безопасное лечение. Описанный выше метод был фактически использован в ряде многоцентровых исследований в нашей стране, проведенных в 80-е — 90-е гг. ХХ в. Так, в исследовании КИАП (Кооперативное исследование по изучению эффективности антиангинальных препаратов) каждому из включённых в него больных стабильной стенокардией напряжения подбирали наиболее эффективный антиангинальный препарат из трех основных групп [40].
В последнее время значимость таких исследований увеличилась в связи с развитием персонализированной медицины [41]. Примером исследования такого типа может случить серия РКИ на одном больном. В этих РКИ была представлена информация о пациентах, которые недавно прекратили терапию статинами из-за появления мышечных симптомов. Всего в исследование было включено 200 больных. Каждому из них в случайной последовательности назначали 2-х месячные периоды терапии аторвастатином, который больные принимали в разных режимах. В конце каждого из периодов лечения у каждого больного оценивали выраженность мышечных симптомов по визуально-аналоговой шкале. Проведенный анализ не выявил влияния аторвастатина в сравнении с плацебо на мышечные симптомы [42].
Обязательным условием проведения РКИ на одном больном является стабильность течения болезни на протяжении исследования. Желательно использование слепого метода (в идеале двойного слепого). Необходимо также иметь возможность количественно оценивать изучаемый показатель.
Анализ результатов РКИ
Основной задачей анализа РКИ является опровержение или подтверждение так называемой "нулевой" гипотезы (см. выше). Первичный статистический анализ позволяет сравнить исходы в той группе, которая была рандомизирована в группу изучаемого лечения (независимо от того, получали его больные или нет), с той группой больных, которая была рандомизирована в контрольную группу. Такой анализ называется "intention to treat" [43]. Именно этот вид анализа является наиболее верным с точки зрения доказательной медицины, хотя, на первый взгляд, он противоречит логике. Возможны и другие виды анализа, например, "per protocol", т.е. больных группируют по тому признаку, какой действительно препарат они реально получали. Такой вид анализа нарушает рандомизацию, поэтому никогда не может использоваться как основной. Вместе с тем, такой вид анализа может использоваться для изучения побочных эффектов препарата, разделив больных на реально принимавших и не принимавших его.
Для упрощения анализа результатов РКИ существует ряд нормативных документов, например, CONSORT [44], которые, однако, не могут охватить всех необходимых деталей для суждения о корректности проведенного исследования.
Конечные точки. ПКТ
Понятие конечной точки появилось в РКИ не сразу. В первых РКИ эффект оценивали по сравнению частоты исходов (в первую очередь смертельных) в основной и контрольной группах. Понятие первичной конечной точки (primary endpoint) (ПКТ) возникло тогда, когда исследования стали анализировать по времени до наступления события (time to event) [45].
Под конечной точкой понимают любой показатель, который поддается четкой регистрации, имеет клиническую и/или прогностическую значимость, наступление которого во времени может быть четко зарегистрировано. ПКТ — это основное событие, по которому оценивают РКИ, оно фактически отражает основную цель исследования. Развитие ПКТ (даже если она не была фатальной) означает окончание исследования для больного [45] при использовании показателя "время до наступления события".
Все исследование планируется и строится таким образом, чтобы была возможность ПКТ четко документировать. ПКТ может иметь самую разную степень "жесткости". Например, ПКТ может быть смерть от всех причин, для сердечно-сосудистых заболеваний — серьезные их осложнения — MACE (Major adverse cardiovascular events), под которыми понимают сердечно-сосудистую смерть, нефатальный ИМ, нефатальный инсульт. Существуют также суррогатные ПКТ, под которыми понимают легко измеряемые показатели, имеющие доказанную связь с жесткими конечными точками.
По динамике частоты регистрации суррогатных конечных точек в идеале можно предсказывать пользу от вмешательства (или вред от него). Выбор суррогатных конечных точек всегда зависит от того, какие больные включаются в РКИ и какое вмешательство в нем изучается. Например, при изучении эффективности антигипертензивных препаратов суррогатной конечной точкой является, как правило, уровень АД, а при изучении эффективности гиполипидемических препаратов — уровень ХС липопротеинов низкой плотности (ХС ЛНП). Следует иметь в виду, что ценность РКИ, использующих суррогатные конечные точки, существенно уступает РКИ, в которых используют жесткие конечные точки. Безусловно, использование в РКИ "жестких" конечных точек делает исследование значительно более убедительным, особенно при заболеваниях, сопровождающихся высоким риском осложнений.
Существует также риск того, что использование суррогатных конечных точек даст ложные результаты об эффективности и безопасности изучаемого препарата. Так, в исследовании ILLUMINATE при использовании торсетрапиба было выявлено его отрицательное влияние на показатели общей смертности, при этом препарат существенно снижал уровень ХС ЛНП и повышал уровень ХС липопротеинов высокой плотности, т.е. благоприятно влиял на суррогатные конечные точки [46].
Достижение ПКТ (какой бы она ни была) означает достижение основного результата исследования, при этом больной выбывает из исследования, этим ПКТ отличается от вторичных, третичных и т.д. конечных точек.
В крупных РКИ 80-х гг. ХХ в. понятие комбинированной ПКТ отсутствовало. В этих исследованиях, как правило, отдельно рассматривали влияние того или иного препарата на серьезные осложнения и показатели смертности. Так, например, в Норвежском многоцентровом исследовании тимолола при остром ИМ (Norwegian Multicenter Timolol Study) отдельно рассматривали влияние препарата на смерть от всех причин и на вероятность повторного ИМ [47].
Анализ результатов исследования по ПКТ
Для оценки основного результата РКИ в течение длительного времени используют показатель, называемый "время до достижения первого события" (time to first occurance), под которым понимают период времени, прошедший между включением больного в исследование и появлением ПКТ. Анализируя различия по этому показателю между основной и контрольной группами, делают выводы об эффективности или неэффективности изучаемого препарата (см. ниже).
Совместные ПКТ
В некоторых исследованиях одновременно используются две ПКТ, для того чтобы выявить два различных вида эффекта проводимого вмешательства (co-primary endpoints). Нередко одна из таких точек отражает эффективность вмешательства, а вторая — его безопасность. Статистический анализ проводится отдельно для каждой ПКТ, соответственно и выводы в отношении влияния вмешательства на эти конечные точки делаются отдельно [48]. Так, в РКИ с прямыми пероральными антикоагулянтами использовались ПКТ эффективности и ПКТ безопасности. В таких случаях анализ результата проводится отдельно для каждой ПКТ. Правда, при возникновении смертельных исходов такой вид анализа становится проблематичным.
Комбинированные ПКТ. Клиническая значимость
Необходимость в создании так называемых комбинированных конечных точек появилась тогда, когда базовая терапия ССЗ значительно улучшилась, в РКИ стало все труднее демонстрировать достоверные различия даже между эффективным новым препаратом и стандартным лечением, для этого требовалось включить в исследование все большее количество больных. Кроме того, возникла необходимость оценивать влияние нового препарата на несмертельные осложнения.
Одним из первых предложил использовать первичные комбинированные конечные точки (ПККТ) при остром ИМ E. Braunwald. Он использовал понятие "неудовлетворительный исход ("unsatisfactory outcome"), в который включил 10 показателей, которые фактически были составляющими ПККТ [49].
В настоящее время под ПККТ понимают "группу индивидуальных конечных точек, которые в совокупности образуют единую конечную точку исследования" [50]. Из этого определения следует, что ПККТ "неделима", наступление любого из ее компонентов означает достижение цели исследования и его окончание для больного. Со статистической точки зрения любой компонент ПККТ равнозначен, что создает определенные сложности при трактовке результатов исследования (см. ниже).
Преимущества и недостатки комбинированных ПКТ
В РКИ применение ПККТ делает более реальным их достижение и поэтому существенно сокращает предполагаемое количество включаемых больных, сроки исследования и его стоимость. Однако это имеет и обратную сторону. Например, включение в состав комбинированной конечной точки такого исхода как госпитализация по поводу ухудшения течения болезни (что часто практикуется в РКИ по изучению хронической сердечной недостаточности (ХСН)) может дать неверное представление об истинных исходах заболевания (как в основной, так и в контрольной группе) под влиянием изучаемого лечения.
Применение ПККТ создает определенные сложности при трактовке результатов РКИ. Это объясняется тем, что с точки зрения статистики все компоненты ПККТ имеют одинаковую значимость. Традиционно статистический анализ в такого рода исследованиях проводят по времени до достижения любого из компонентов ПККТ, который возник первым (time to event). Поэтому, например, госпитализация больного будет означать достижение ПКТ, а последующий через некоторое время ИМ у этого же больного не будет учтен (так как он выбыл из исследования). Кроме того, может возникнуть путаница в оценке компонентов комбинированной конечной точки при одном и том же событии (например, госпитализация больного по поводу нестабильной стенокардии, развившийся через несколько дней ИМ, смертельный исход через несколько дней) [50]. Есть еще один существенный недостаток в использовании ПККТ. Такой подход сокращает длительность наблюдения (за счет того, что первыми по хронологии могут возникать менее значимые компоненты ПККТ), из-за этого исследование может не выявить более значимые отдаленные исходы заболевания [51]. Это может оказаться особенно важным ССЗ, онкологических заболеваний и ряда других. Именно поэтому считается, что для оценки реальных отдаленных исходов заболевания большим преимуществом обладают наблюдательные исследования и в первую очередь регистры [52].
Как трактовать компоненты ПКТ
Сказанное выше свидетельствует, что необходимо стремиться к тому, чтобы все компоненты ПКТ имели примерно одинаковую клиническую значимость. Достаточно давно V. M. Montori и соавт. были сформулированы определенные правила для оценки валидности компонентов ПККТ в клинических исследованиях и правильной интерпретации результатов, полученных при их анализе [53].
Очевидным из этих правил является то, что все компоненты ПККТ должны иметь примерно одинаковую клиническую значимость для пациента. Правда, это не может относиться к смертельному исходу, который практически всегда является компонентом ПККТ, но однозначно несопоставим по значимости с любыми другими исходами болезни.
Не со всеми выводами V. M. Montori и соавт. можно полностью согласиться. Исследователи рекомендовали также анализировать вклад компонентов ПККТ в суммарный эффект вмешательства. Считалось, что если биологический смысл компонентов ПККТ примерно одинаков, то и изучаемое лечение должно влиять на них примерно одинаково. Этот довод иллюстрируют, например, результатами исследования HOPE, в котором применение рамиприла способствовало снижению числа смертей от сердечно-сосудистых причин на 26%, числа ИМ на 20%, числа инсультов — на 32% [54], т.е. примерно в одинаковой степени.
Вместе с тем есть исследования, в которых динамика различных компонентов ПККТ неодинакова, соответственно, возникает вопрос о том, насколько адекватно подобраны компоненты ПККТ. Например, в исследовании TIME динамика разных компонентов ПККТ очень сильно различалась [55]. Еще более сложно решить вопрос трактовки результатов РКИ в том случае, если изученное вмешательство положительно влияет только на один из показателей ПККТ и вообще не влияет на другие. Например, в исследовании LIFE достоверное уменьшение вероятности возникновения ПККТ обеспечивалось исключительно за счет влияния лозартана (его сравнивали с атенололом) на частоту возникновения мозгового инсульта; частота сердечно-сосудистой смерти и ИМ не менялась [56]. Безусловно, на основании этого РКИ нельзя сделать вывод о положительном влиянии лозартана на все компоненты использовавшейся ПККТ, но напрашивающийся вывод о положительном влиянии лозартана на вероятность возникновения инсульта также представляется спорным из-за некорректности анализа по отдельным компонентам ПККТ.
Подводя итог, еще раз отметим, что для анализа эффективности выбранного вмешательства раздельный анализ компонентов ПККТ недопустим. Тем не менее, раздельный анализ частоты достижения эффекта по результатам влияния разных компонентов ПККТ представляет интерес для оценки правильности выбора этих компонентов и клинической значимости ПККТ.
Анализ результатов РКИ при использовании комбинированных ПКТ
Этот анализ в принципе проводится так же, как при использовании однокомпонентных конечных точек. В настоящее время с этой целью обычно используют так называемую модель пропорциональных рисков Кокса. Рассчитывается время до наступления составляющей ПККТ, которая возникла первой. С точки зрения статистики, любой из компонентов ПККТ равнозначен. Хотя с точки зрения клиники это может быть совсем не так (см. ниже). Поэтому возникает естественное желание проанализировать влияние на полученный результат отдельно для каждого из компонентов ПККТ. Однако такой анализ с точки зрения статистики недопустим и не может приводить к каким-либо обоснованным выводам. По правилам классической доказательной медицины анализ составляющих ПККТ автоматически превращает их во вторичные конечные точки со всеми вытекающими из этого последствиями (см. ниже об анализе по вторичным конечным точкам) [57].
Статистические проблемы при анализе комбинированных ПКТ
Не следует путать клиническую значимость методов оценки результатов РКИ и используемых для этого статистических подходов. Ранее результаты РКИ оценивались просто по соотношению умерших в основной и контрольной группах, используя метод χ2 [58]. С конца 70-х гг. ХХ в. основными методами статистического анализа результатов РКИ стали модель пропорциональных рисков Кокса, log-rank тест, кривые Каплана-Мейера. В основе всех этих методов лежит так называемый "анализ времени до первого события" (time-to-first-event analysis), т.е. оценка времени до появления любого из компонентов ПККТ, и расчет таких показателей, как относительный риск, доверительный интервал, величина "р", которые являются основными в оценке результатов РКИ [57]. Такой подход, возможно, был бы идеален при анализе однокомпонентных конечных точек, когда исследователей интересует только одно главное событие. При использовании в РКИ ПККТ такой подход имеет определенные недостатки, прежде всего потому, что первым событием может оказаться менее клинически значимое (например, госпитализация), а последующие, более значимые (например, ИМ, инсульт) не будут учтены при анализе. Кроме того, такой подход не позволяет учесть суммарное число событий у конкретного больного, вероятность повторных событий и пр. [59].
Новые методы анализа по комбинированным ПКТ
Чтобы попытаться избежать основных недостатков изложенного выше анализа "времени до первого события", известный английский биостатистик S. J. Pockok в 2012 г. предложил использовать в РКИ по изучению сердечно-сосудистых препаратов новый метод "win ratio" — метод отношения победителей. При использовании этого метода все конечные точки первоначально распределяются по их клинической значимости (например, при использовании набора конечных точек MACE первой по значимости является смерть, затем следует инсульт, затем ИМ). Затем больные основной и контрольной групп разбиваются на пары в зависимости от индивидуальных показателей их риска. После этого в каждой паре определяют, у кого из больных первым произошло наиболее значимое событие (как правило, смерть). Если оно не произошло ни у одного из больных, таким же образом анализируют первенство в наступлении менее значимого события и т.д. Таким образом, в каждой паре определяется победитель [60]. В результате такого анализа выделяются пары "выигравших" и "проигравших" (по отношению к изучаемому препарату). Далее, рассчитывается отношение "выигравших" и "проигравших", определяется достоверность различий (р), 95% доверительный интервал, после этого вероятность "выигрыша".
С использованием методики "отношения победителей" был проведен ряд исследований (например, ATTR-ACT — сравнение тафамидиса с плацебо при амилоидной кардиомиопатии), некоторые исследования находятся в стадии проведения. Интересно, что результаты ряда уже закончившихся и опубликованных РКИ были пересчитаны с помощью упомянутой методики (например, известные РКИ CHARM, TRILOGY ACS, EPHESUS, PARADIGM-HF и некоторые другие). В большинстве случаев результат нового анализа не привел к пересмотру основных выводов исследования. Одним из исключений является исследование PARADISE-MI, в котором комплекс вальсартан/сакубитрил, вопреки ожиданиям, не превзошел рамиприл во влиянии на ПККТ [61]. Использовался традиционный анализ времени до наступления первого события. Повторный анализ с помощью методики "отношения победителей" привел к противоположному результату и все же сумел показать преимущества вальсартана/сакубитрила [62]. Думается, что проведение такого повторного анализа не было случайным, хотя с позиций доказательной медицины выводы уже проведенного исследования пересмотреть невозможно.
Хотя метод "отношения победителей" предлагает новый подход к оценке исходов в РКИ, его преимущества могут быть полностью обесценены целым рядом его недостатков. К ним относятся в первую очередь субъективность в присвоении риска отдельным его компонентам, а также то, что при формировании пар рассматривается только факт, у кого первым возникло то или иное событие, но игнорируется время, прошедшее от включения больного в исследование до возникновения события. Соответственно, клиническая интерпретация эффекта при использовании данного метода может быть затруднена. Поэтому многие исследователи рекомендуют пользоваться традиционным видом статистического анализа в тех случаях, когда в исследовании есть возможность четко документировать время до наступления первого события, и когда вероятность повторных событий относительно невелика [63].
Другой возможный метод статистического анализа для оценки ПККТ появился около 10 лет назад. Он называется "Взвешенный комплексный анализ конечных точек" (Weighted Composite Endpoint analysis) [64]. Этот метод является расширенным методом анализа "время до события", в котором анализируются все произошедшие у больного нефатальные события; при этом каждому из них присваивается определенный вес. К примеру, в случае MACE, смерти присваивается вес 1,0, инсульту — от 0,47, ИМ — 0,38. Эти значения присваиваются на основании соглашения экспертов [65]. Недостатком метода является субъективность оценки веса каждого из событий ПККТ, что делает применение этого подхода весьма проблематичным.
Метод негативной биноминальной регрессии (negative binominal regression) фактически отказывается от оценки "времени до события", он суммирует все произошедшие события, относящиеся к ПККТ. Его преимуществом является возможность оценить эффективность изучаемого лечения на повторные события. Существенным недостатком метода является необходимость обеспечить одинаковую продолжительность наблюдения для всех больных, что противоречит самому принципу проведения исследований, изучающих выживаемость [51]. При невозможности обеспечить одинаковую продолжительность наблюдения для всех больных прибегают к модели Andersen-Gill, рассматривающей все события, относящиеся к ПККТ, произошедшие у конкретного больного. Модель позволяет оценивать повторные события, причем риск повторного события не увязывается с предшествующим событием. Недостатком модели является присвоение одинаковой значимости разным компонентам ПККТ.
Манипуляция методами статистического анализа комбинированных ПКТ
Все сказанное выше о различиях в подходах к анализу РКИ свидетельствует о том, что выбор какого-либо из методов является весьма субъективным. В принципе, методов, доказывающих, какой из этих видов анализа наиболее верен, не существует. Это создает почву для манипуляции результатами РКИ.
Наглядным примером, как манипулированием современными статистическими подходами в анализе результатов РКИ можно добиться нужного результата, является публикация H. Hara и соавт. [65]. Они показали, что ретроспективный анализ недавно проведенного исследования GLOBAL LEADERS с помощью различных методов статистического анализа может дать желаемый (для производителя ЛП) результат. Как известно, в этом исследовании с помощью традиционного статистического анализа не удалось показать, что тикагрелор, назначаемый в виде монотерапии после проведенной коронарной ангиопластики, имеет преимущество перед традиционной двойной антиагрегантной терапией [67] в отношении влияния на ПККТ (смерть от всех причин или возникновение нового Q-ИМ).
Последовательно применяя упомянутые выше новые методы статистического анализа, H. Hara и соавт. удалось продемонстрировать, что тикагрелор достоверно снижает риск ишемических событий и кровотечений на 5-8% по сравнению с традиционной двойной антиагрегантной терапией [65].
Выше уже упоминался пример, как повторный анализ исследования PARADISE-MI позволил продемонстрировать "невыявленный" ранее эффект сакубитрила/вальсартана на частоту ПККТ после перенесенного ИМ.
Совершенно очевидно, что если методика организации РКИ и их проведения максимально объективизированы и поддаются контролю, то методы их анализа страдают очевидным субъективизмом. Лучшим свидетельством тому является факт, что разные методы статистического анализа могут дать противоположный результат в отношении эффективности изучаемого препарата [62], причем результат этого анализа может зависеть от желания исследователей. При этом никаких строгих доказательств того, какой из методов анализа является более верным, в принципе не существует.
Вторичные, третичные конечные точки
Как уже отмечалось, ПКТ — это исходы заболевания, в отношении которых планировалась мощность исследования. Вторичные конечные точки (ВКТ) — это дополнительные конечные точки, предпочтительно заранее оговоренные, для выявления которых исследование, как правило, не обладает достаточной мощностью. Вторичные, третичные конечные точки могут выбираться произвольно, в зависимости от целей исследования. Они также могут быть однокомпонентными или комбинированными. При возникновении ВКТ больной не прекращает исследование (если только это не смерть больного).
Анализ по ВКТ, а также анализ в определенных подгруппах больных (см. ниже) в РКИ может представлять интерес для формирования гипотез (hypothesis generating), но ни в коем случае не должен отражаться в выводах исследования. Это объясняется тем, что протокол исследования нацелен, в первую очередь, на выявление ПКТ, для выявления ВКТ (третичных) часто нужны дополнительные возможности, методы и т.д., т.е. с точки зрения статистики такой анализ не обладает достаточной мощностью [68].
Наглядным примером, как анализ по ВКТ может ввести в заблуждение, является исследование ELITE. В этом исследовании сравнивали каптоприл с новым тогда препаратом — представителем антагонистов рецепторов ангиотензина II — лозартаном. ПКТ было повышение уровня креатинина сыворотки крови (>26,5 мкмоль/л), по которой различий между препаратами выявлено не было. Неожиданно для исследователей были выявлены существенные различия между каптоприлом и лозартаном (в пользу последнего) во влиянии на ВКТ — смерть или поступление в стационар [69]. Из этого был сделан ошибочный вывод о том, что они обладают явными преимуществами перед ингибиторами ангиотензинпревращающего фермента (ИАПФ) во влиянии на жесткие конечные точки и, в частности, на показатели смертности. В течение некоторого времени этот вывод считался обоснованным и активно продвигался в клинической медицине.
Проведенное позже исследование ELITE II, в котором ПКТ была смерть от всех причин, не выявило никаких различий между двумя этими препаратами [70] и подтвердило, к каким опасным заблуждениям может привести анализ исследования по ВКТ.
Анализ в подгруппах
Выделение каких-то подгрупп больных в РКИ и последующий анализ результатов вмешательства в этих подгруппах (так называемый вторичный анализ), с одной стороны, очень привлекателен, а с другой — таит опасность получения ложных выводов. Это объясняется в первую очередь тем, что при выделении таких подгрупп исследование сразу перестает быть рандомизированным (если только существование таких подгрупп не предусматривалось заранее и рандомизация проводилась стратифицировано), кроме того, теряется его мощность за счет уменьшения количества больных. Вторичный анализ с высокой степенью вероятности может дать статистически значимый ложноположительный результат. Чем больше подгрупп включается во вторичный анализ, тем больше вероятность получить статистически достоверный результат случайно. Это было наглядно продемонстрировано P. M. Rothwell, показавшим на примере ряда РКИ, как можно получить статистически достоверный, но абсолютно бессмысленный результат. Так, при вторичном анализе исследования ISIS-2 он показал, что аспирин был неэффективен у больных, родившихся под знаками Libra и Gemini (Весов и Близнецов) [71].
Этим же ученым было показано, что результаты, полученные в ряде РКИ при проведении анализа в подгруппах и даже вошедшие в клинические рекомендации (КР), были впоследствии опровергнуты в новых РКИ [71].
Можно привести еще один пример, когда американская FDA (Food and Drug Administration) в течение длительного времени, ссылаясь на анализы в подгруппах в нескольких РКИ, не одобряла использование аспирина после транзиторной ишемической атаки у женщин. В результате множество женщин, перенесших транзиторную ишемическую атаку, скончались, не получив жизненно необходимой терапии.
Как указывалось выше, анализ в подгруппах может планироваться заранее и предусматриваться протоколом РКИ (prespecified analysis). Такой анализ можно проводить только при общем положительном результате РКИ [48]. Однако многие статистики считают, что его результаты могут рассматриваться как достоверные только в том случае, если при рандомизации проводилась стратификация.
Заранее предусмотренный анализ в подгруппах при общем положительном результате РКИ (доказанном влиянии на ПКТ) активно используется регуляторными органами при утверждении показаний к назначению препарата у больных конкретных подгрупп, а также фармацевтическими компаниями для коммерческого продвижения препарата. Однако с точки зрения доказательной медицины, как уже отмечалось, его результаты могут оказаться неверными.
Показатели, использующиеся при анализе результатов РКИ
Для количественного анализа результатов РКИ используются следующие показатели [72]:
- Абсолютный риск (Absolute risk, AR) — абсолютное количество событий в группе, отнесенное к численности всей группы в целом
- Относительный риск(Relative risk, RR) — отношение двух абсолютных рисков в двух группах (подвергшихся и не подвергшихся воздействию)
- Снижение относительного риска(Relative risk reduction, RRR) — насколько вмешательство снижает относительный риск по сравнению с невмешательством.
- Отношение рисков(Hazard ratio, HR) — сравнение вероятности наступления неблагоприятного события в одной группе (вмешательства) по сравнению с другой группой (невмешательства). Используется в исследованиях выживаемости с разными сроками наблюдения.
Клиническая и статистическая значимость результатов РКИ
Следует помнить, что далеко не всегда статистическая значимость, полученная в РКИ, означает клиническую значимость. Для оценки последней всегда следует учитывать не только степень снижения относительного риска (о чем сообщается всегда в первую очередь), но и снижение абсолютного риска осложнений.
Например, в исследовании GISSI-Prevenzione, проведенном у больных с ХСН, добавление к терапии n-3 полиненасыщенных жирных кислот в течение 3,9 лет статистически значимо снижало общую смертность больных [HR] 0,91 [ 95,5% ДИ 0,833-0,998] p=0,041. Однако снижение абсолютного риска смерти составило всего 1,3%, что вряд ли можно рассматривать как значимый клинический эффект [73].
Для объективной оценки значимости достигнутого эффекта целесообразно использовать показатель NNT (number needed to treat) — число больных, которых необходимо пролечить, чтобы достичь определенного благоприятного исхода или предотвратить один неблагоприятный исход (фактически, одну конечную точку) в сравнении с контрольной группой. Показатель NNT находится в обратной зависимости от уменьшения абсолютного риска. Многие считают NNT основным показателем эффективности вмешательства в доказательной медицине. Понятно, что чем выше NNT, тем менее эффективно изучаемое лечение. При таком анализе не следует забывать, какими были ПКТ исследования, насколько они были клинически значимыми.
Следует помнить также, что статистическая достоверность, определяемая как p<0,05, является условным понятием [74]. Именно эту величину р предложил в 1925 г. R. Fisher (1890–1962) как отрезную точку, отделяющую достоверный результат от недостоверного. Однако современные статистики постоянно предупреждают, что эта граница является весьма условной, она зависит от того, какой показатель изучается и какова его клиническая значимость. Американское FDA при изучении влияния препарата на показатели смертности требует достижения p<0,01. Необходимо помнить также, что величиной р можно манипулировать. Для обозначения такого подхода предложен термин "p-hacking" (т.е. "захват р") [75].
Другие проблемы анализа РКИ
Даже в грамотно спланированном РКИ могут возникать трудности из-за выбывания больных после рандомизации по разным причинам, а также вследствие плохой приверженности к лечению. Это имеет особую значимость, если отдаленный прогноз выбывших больных отличается от прогноза у тех, кто продолжал наблюдаться. Такой факт был доказан в исследовании Coronary Drug Project, в котором в группе больных, принимавших не менее 80% назначенного препарата (клофибрата), отмечены существенно более низкие показатели 5-летней смертности в сравнении с пациентами с низкой приверженностью (15,0 и 24,6%, соответственно) [76].
Оценка отклика больных при длительном наблюдении
Наилучшим способом обеспечить хороший отклик больных при длительном наблюдении является хороший контакт с ними на протяжении всего исследования [77]. Для этого, в первую очередь, необходимо не включать в РКИ тех больных, в отношении которых существуют сомнения в их желании поддерживать постоянную связь с исследователями. Есть и другие меры, позволяющие обеспечить достаточный отклик больных. Так, при первичном контакте с больным необходимо, кроме номера его телефона, записывать номера телефонов его родственников и ближайших друзей. Может помочь и контакт с лечащим врачом больного. Особенные трудности могут возникать при смене места жительства больного.
Применение результатов РКИ в клинической практике
Лечащий врач имеет дело с конкретным больным, поэтому часто высказывается мнение, что результаты РКИ исключают применение индивидуального подхода к лечению. На самом деле это противоречит истине, поскольку РКИ проводятся у достаточно сильно различающихся между собой больных, причем чем большее количество больных включено в РКИ, тем больше вероятность выявить конкретные группы больных, у которых изучаемое вмешательство будет наиболее эффективно. При этом, однако, необходимо помнить об опасности получения ложноположительного результата в подгруппах (см. выше).
Применение результатов РКИ в клинике, в первую очередь реализуется в создании КР (см. ниже), а также в написании инструкций по применению конкретных препаратов. Некоторые врачи считают возможным применять результаты РКИ непосредственно в своей лечебной практике, однако это несет в себе риск назначения препарата "off label" (вне инструкции).
Существует согласительный документ CONSORT, согласно которому можно проводить анализ качества уже выполненного РКИ. Однако в нем обозначены лишь основные принципы оценки (необходимые, но недостаточные), применение которых далеко не всегда позволяет выявить те или иные дефекты и спорные моменты в том или ином РКИ [44].
Ограничения РКИ
РКИ имеют целый ряд ограничений, однако эти ограничения существенно зависят от качества РКИ, его целей и критериев включения и исключения больных. Основным недостатком РКИ считают селективность включенных в них больных из-за жестких критериев исключения, которые редко встречаются в реальной клинической практике. Тем не менее, как уже отмечалось выше, разные РКИ включают разные популяции больных в плане их репрезентативности. Поэтому каждое РКИ надо оценивать по характеристикам включенных в них больных, их тяжести, коморбидности и пр. Нельзя не признать, однако, что некоторые категории больных действительно нечасто включаются в РКИ (пожилые больные, больные с тяжелыми сопутствующими заболеваниями и пр.).
Кроме того, результаты многих ранее проведенных РКИ устаревают, в первую очередь, из-за того, что меняется базовая терапия того или иного заболевания. Например, практически все исследования с бета-адреноблокаторами (ББ) после перенесенного ИМ были проведены в так называемую "дореперфузионную" эру, когда в остром периоде ИМ не использовалась коронарная ангиопластика, а также не применялись многие современные препараты (ИАПФ, статины). Поэтому ответить на вопрос, насколько ББ в современных условиях, можно только гипотетически. Поскольку проведение новых РКИ с ББ в современных условиях представляется неэтичным, для оценки их реальной эффективности приходится пользоваться данными с меньшим уровнем доказательств (в первую очередь наблюдательными исследованиями).
Всегда ли необходимы РКИ
До появления РКИ такой вопрос в принципе не возникал, поскольку использовались другие методы доказательств. Огромное количество лекарств, считавшихся эффективными, исчезли после внедрения в клинику принципов доказательной медицины, так как оказались либо неэффективными, либо небезопасными. Однако некоторые лекарства и методы лечения, обладавшие быстрым и очевидным эффектом (например, инсулин, пенициллин, тироксин, дефибрилляция и некоторые другие) успешно используются до сих пор. Их относят к классу рекомендаций I. Никто и никогда не требовал проведения РКИ для доказательства их эффективности и безопасности [78].
В некоторых случаях проведение РКИ невозможно по этическим соображениям (например, у беременных женщин). Считается также, что проведение РКИ обычно не оправдано при редких заболеваниях, так как это потребует включения большого количества больных, значительных финансовых затрат и пр. В таких случаях, по-видимому, предпочтительно проведение наблюдательных исследований, в первую очередь, по типу "случай-контроль".
При тех же заболеваниях, которые дают серьезные осложнения и являются причиной высокой смертности населения, проведению РКИ альтернативы нет, только они могут дать достоверную информацию об эффективности нового метода лечения, в первую очередь, о его влиянии на исходы заболевания.
Нерандомизированные исследования с вмешательством
При этом типе исследований выбираются две группы больных (или более), одной из которых активно назначается (в отличие от наблюдательных исследований) изучаемое вмешательство, а другой нет. Рандомизация не проводится. Достичь идентичности двух групп без рандомизации практически невозможно, соответственно полученные в конце исследования различия между группами, как правило, нельзя отнести за счет действия препарата. Тем не менее, при невозможности осуществить рандомизацию, такие исследования иногда проводятся. Например, в начале эпидемии новой коронавирусной инфекции (COVID-19) был проведен ряд таких исследований с препаратом гидроксихлорохин, их результаты оказались противоречивыми (см. ниже).
Исследования "до-после"
Исследования "до-после" фактически являются самым примитивным видом исследования с вмешательством. В них одной и той же группе больных назначают исследуемое вмешательство, затем через определенный период времени оценивают динамику интересующих показателей, по которой делают вывод об эффективности или неэффективности изучаемого препарата [79][80]. Эти исследования имеют множество существенных недостатков, хотя нередко используются для изучения ЛП на пострегистрационном этапе. В первую очередь, к их недостаткам относится сложность учета смещающих факторов. Кроме того, такие исследования игнорируют так называемую регрессию к среднему. В них также не учитываются сезонные изменения ряда показателей, эффект наложения предшествующего лечения (carry-over effect). Тем не менее, в ряде ситуаций, когда проведение сравнительного исследования не представляется возможным, исследования "до-после" могут иметь определенную ценность. В таких случаях необходимо сравнить исходное состояние больных с таковым в других исследованиях, а также оценить частоту осложнений, возникших в процессе наблюдения, с частотой таких же осложнений, зафиксированной в сравнительных исследованиях [80].
Рандомизированные контролируемые исследования — основной источник данных для клинических рекомендаций
Поскольку РКИ, как уже отмечалось, являются самым высоким уровнем доказательств в современной медицине, результаты, полученные в этих исследованиях, в первую очередь, ложатся в основу современных КР — документов, призванных перевести данные доказательной медицины в доступные практическому врачу формы.
Список препаратов, доказавших свое влияние в кардиологии на развитие осложнений ССЗ (так называемые препараты, спасающие жизнь — life-saving drugs) сформировался исключительно на основе проведенных РКИ (табл. 1).
Таблица 1. Препараты, обладающие положительным влиянием на исходы сердечно-сосудистых заболеваний
|
Препараты |
Заболевания, при которых доказано их действие |
|
Аспирин |
Вторичная профилактика сердечно-сосудистых осложнений |
|
Аспирин и тромболитики |
Острый период ИМ |
|
Бета-адреноблокаторы |
Больные ИБС, перенесшие ИМ, ХСН |
|
Ингибиторы ангиотензинпревращающего фермента |
ХСН, перенесенный ИМ с нарушенной функцией левого желудочка |
|
Все основные современные группы антигипертензивных препаратов |
Артериальная гипертония |
|
Статины. Эзетимиб |
Вторичная профилактика сердечно-сосудистых заболеваний |
|
Оральные антикоагулянты |
Первичная и вторичная профилактика мозгового инсульта |
|
Ингибиторы минералокортикоидных рецепторов |
ХСН, перенесенный ИМ с нарушенной функцией левого желудочка |
|
SGLT2-ингибиторы, стимуляторы гуанилатциклазы |
ХСН |
|
Ингибиторы PCSK9 |
Вторичная профилактика ИБС |
|
Примечание: ИБС — ишемическая болезнь сердца, ИМ — инфаркт миокарда, ХСН — хроническая сердечная недостаточность, |
|
Метаанализы
Первые попытки суммировать данные разных научных исследований предпринимались K. Pearson еще в 1904 г. Целью было "провести статистический синтез данных из разных, но подобных, т.е. сопоставимых исследований, итог которого — количественная оценка обобщенных результатов" [81]. Такой подход позволял увеличить статистическую мощность исследования, снизить уровень ошибки второго рода. Термин же "метаанализ" был предложен в 1976 г. психологом G. V. Glass [82].
Вопреки устоявшемуся мнению, на сегодняшний день единого определения метаанализа не существует. Чаще всего метаанализ понимают как статистическую технологию для объединения индивидуальных эффектов ряда исследований, посвященных одному и тому же вопросу, для оценки суммарного эффекта. Есть еще несколько определений метаанализа [83]:
- Наблюдательное исследование, в котором единицами наблюдения являются результаты отдельных исследований или комбинированные результаты индивидуальных больных, полученные в этих исследованиях.
- Статистический анализ, включающий данные двух или более исследований, в которых изучалось одно и то же вмешательство, выполненный с целью выработки общего заключения об эффективности и безопасности этого вмешательства.
- Тип литературного обзора, использующий количественную оценку.
Из этих определений становится очевидным, что не все согласны с определением метаанализа как вершины "доказательной пирамиды" и что эти определения подразумевают разную значимость метаанализа в доказательной медицине.
Метаанализ допустимо выполнить в том случае, если включенные в него исследования схожи по клиническим характеристикам больных, используемой методологии, а также гомогенны в отношении эффекта. Необходимо отметить, что все эти требования в полном объеме соблюсти практически невозможно. Чтобы исключить "публикационный сдвиг" (publication bias), желательно использовать как опубликованные, так и неопубликованные исследования (исследования с нейтральными и отрицательными результатами часто не публикуются) [84][85].
Однако в этом таится определенная опасность, так данные неопубликованных исследований нередко имеют невысокое качество, они не проходят рецензирования (как это делается с опубликованными исследованиями). Детальное рассмотрение техники проведения метаанализа не входит в задачи настоящей работы.
Поскольку метаанализы РКИ давали возможность достаточно легко получить ранее отсутствовавшие данные, основываясь на результатах суммарного анализа относительно небольших исследований, и внести ясность в те вопросы, в отношении которых отдельные РКИ давали противоречивые результаты, их стали считать самым высоким уровнем доказательств. Использование строгих статистических подходов к обработке данных в метаанализах также способствовало их утверждению как "вершины доказательной пирамиды". Однако далеко не все исследователи согласны с таким позиционированием роли метаанализов. Прежде всего, это объясняют тем, что метаанализ является, по сути дела, ретроспективным наблюдательным исследованием со всеми вытекающими последствиями в отношении правомочности его помещения на вершину "доказательной пирамиды".
С момента появления метаанализов ряд авторов высказывал критические замечания в отношении их значимости для доказательной медицины. Так, результаты метаанализа ряда исследований (как наблюдательных, так и рандомизированных) привели к ошибочному выводу об эффективности заместительной гормонотерапии у женщин в постменопаузе в отношении профилактики ИБС [86].
Таким образом, с одной стороны, при проведении метаанализа желательно включать в него все проведенные по изучаемому вопросу исследования (как опубликованные, так и неопубликованные). Считается, что такой подход позволит включить максимальное число больных и, соответственно, выявить максимальное количество конечных точек, т.е. повысить мощность исследования. С другой стороны, этот же подход приводит к тому, что в анализ могут включаться исследования очень невысокого качества.
В кардиологии не так много примеров того, как информация, полученная в метаанализах, выявляет принципиально новые свойства лекарств и сразу попадает в КР. В качестве примера того, что метаанализ может выявить ранее неизвестные факты, часто приводят данные метаанализа РКИ с применением аспирина (и других антиагрегантов) у больных ИБС, в котором удалось продемонстрировать (в отличие от отдельных РКИ) эффективность этого препарата во вторичной профилактике осложнений у таких больных. Это объяснялось тем, что крупных РКИ с применением аспирина у больных ИБС просто не существовало. В данный метаанализ было включено более 200000 больных. Метаанализ продемонстрировал, что применение аспирина (или другого антиагреганта) снижает риск осложнений большинства окклюзирующих ССЗ, включая острый ИМ, ишемический инсульт, нестабильную и стабильную стенокардию, ранее перенесенный ИМ, нарушение мозгового кровообращения, заболевания периферических сосудов, а также ФП [87]. Выводы этого метаанализа сразу же вошли во многие КР, хотя впоследствии некоторые из них были опровергнуты (в частности, об эффективности антиагрегантов при ФП, о необходимости приема аспирина больными с неосложненной ИБС).
Следует помнить, однако, что, комбинируя данные из исследований, где участвовали больные с разными характеристиками (например, с разным уровнем риска), в метаанализе можно получить данные сомнительной клинической значимости. Комбинируя разные РКИ, входящие в метаанализ, можно манипулировать его результатами. В качестве наглядного примера можно привести результаты двух метаанализов, касающихся эффективности и безопасности применения антагонистов кальция, опубликованные в одном и том же номере журнала LANCET, которые дали прямо противоположные результаты [88][89].
Стоит заметить, что метаанализы редко опровергали данные крупных, хорошо спланированных РКИ. Как правило, необычные результаты давали те метаанализы, в которых анализировали показатели, не являвшиеся ПКТ в РКИ. Хорошим примером может служить метаанализ, предположивший повышенный риск онкологических заболеваний у больных, получавших антагонисты рецепторов ангиотензина (АРА) II [90], или метаанализ, показавший увеличение риска сахарного диабета (СД) при применении статинов [91]. Ни в том, ни в другом случае изучаемые в метаанализах показатели во включенных в них РКИ не были даже вторичными или третичными конечными точками. Соответственно, возникает вопрос, насколько четко, объективно и единообразно фиксировались случаи рака (в РКИ, включенных в первый метаанализ) и случаи СД (в РКИ, включенных во второй метаанализ). Кроме того, в ряде РКИ, включенных в метаанализ по влиянию статинов на риск развития СД, выявление новых случаев этого заболевания проводилось ретроспективно. Вот почему с позиций строгой доказательной медицины корректность выводов обоих этих метаанализов вызывает большие сомнения.
Известны и обратные примеры, когда крупные, грамотно проведенные РКИ, опровергали результаты ранее выполненных метаанализов. Хорошим примером может служить проблема применения гормонозаместительной терапии у женщин в постменопаузе для профилактики ИБС (см. выше), когда метаанализ подтвердил ее эффективность, а вскоре проведенное РКИ продемонстрировало не только отсутствие эффекта, но даже опасность ее применения.
В кардиологии нечасто можно встретить примеры, когда данные какого-либо метаанализа оказывали влияние на экспертное мнение в отношении роли того или иного препарата (или группы препаратов) в реальной клинической практике. Причиной этого, в первую очередь является противоречивость выводов, полученных в разных метаанализах. Так, до сих пор не решен вопрос о том, какие классы антигипертензивных препаратов лучше влияют на исходы заболевания: разные метаанализы дают разные результаты [92][93].
Можно привести много примеров, когда метаанализы РКИ давали фантастические результаты в отношении того или иного препарата, которые весьма маловероятно можно было бы получить в отдельном РКИ. Примером может служить метаанализ РКИ, где использовался триметазидин у больных с хронической сердечной недостаточностью. Его результаты показали, что этот препарат способен снизить показатели смерти от всех причин таких больных на 70 (!)% [94]. Такого результата даже близко не удалось достичь при использовании классических препаратов, доказавших свою роль во влиянии на исходы заболевания у этой категории больных.
S. J. Pocock и G. W. Stone справедливо считают, что результаты одного крупного, качественного, обладающего адекватной мощностью РКИ намного ценнее, чем результаты одного, пусть и крупного, метаанализа ряда небольших РКИ [95]. Некоторые специалисты высказывают более резкие суждения, считая, что метаанализы и систематические обзоры потеряли свою значимость в доказательной медицине [96]. M. Maziarz продемонстрировал, что терапевтические решения, основанные на результатах метаанализов, далеко не всегда "оптимально предоставляют полный объем существующих доказательств" [97]. Показано, что с помощью метаанализа можно получить статистически значимые результаты, несмотря на незначительный терапевтический эффект. Крупнейший специалист в области доказательной медицины и в области метаанализов, в частности, J. P. Ioannidis пришел к очень смелому выводу о том, что метаанализы являются "искусством ошибаться" (the art of getting wrong) [98].
Несмотря на эти проблемы, метаанализ вполне можно использовать для оценки нежелательных эффектов препарата, но при этом должна быть уверенность в том, что во всех исследованиях, включенных в такой метаанализ, использовались адекватные методы оценки нежелательных явлений (НЯ) [99].
Пожалуй, наиболее оправданным в настоящее время является проведение метаанализа при внезапном появлении нового, не изученного ранее, заболевания, когда отсутствуют доказанные методы лечения и предлагается использовать ряд препаратов на основании патофизиологического способа доказательств. Обычно при этом проводится ряд небольших клинических исследований различного качества, которые не всегда дают однозначные результаты. Хорошим примером является метаанализ ряда небольших РКИ, изучавших эффективность гидроксихлорохина при COVID-19. Как известно, в начале пандемии этот препарат начали активно применять у больных с COVID-19, основываясь на данных экспериментальных исследований. Проведенный метаанализ показал полную неэффективность этого препарата и даже его способность увеличивать смертность больных [100]. Правда, почти за год до этого такие же данные были получены при публикации результатов оценки роли гидроксихлорохина в крупном РКИ [101].
Наблюдательные исследования
На смену клиническому опыту пришли так называемые наблюдательные, или неинтервенционные, исследования. Основная их особенность — отсутствие активного контролируемого вмешательства со стороны врача.
Наблюдательные исследования сыграли определенную роль в изучении ЛП в кардиологии, однако эта роль оказалась весьма ограниченной. Несмотря на то, что наблюдательные исследования позволяют очень хорошо отследить исходы болезни, они далеко не всегда дают ответ на вопрос, какие факторы на этот исход повлияли. Приписывание положительного исхода болезни какому-либо лекарству, активно назначавшемуся в такого рода исследованиях, нередко приводило к ошибочным выводам, так как на исходы болезни действовали очень многие факторы, и вычленить среди них действие интересующего лекарства далеко не всегда оказывалось возможным.
Существует множество примеров, когда данные, полученные в наблюдательных исследованиях, были впоследствии опровергнуты в РКИ. Так, как уже упоминалось выше, в ряде наблюдательных исследований, выполненных в середине 80-х гг. ХХ в., было продемонстрировано существенное снижение частоты ССЗ у женщин в постменопаузе при применении эстрогенов. Это быстро проникло в клиническую практику (не без активного участия фармацевтических компаний). Однако проведенное впоследствии РКИ HERS [102], в котором использовался двойной слепой метод, не выявило снижения сердечно-сосудистых событий между получавшими эстрогены и не получавшими их. По-видимому, результаты, полученные в наблюдательных исследованиях, оказались следствием влияния смещающих факторов, а не действия изучавшегося лечения. Другим примером могут служить данные наблюдательного исследования о способности дигоксина существенно повышать риски смерти от все причин [103]. Эти данные были впоследствии опровергнуты в крупном РКИ [104].
Наблюдательные исследования, как уже отмечалось, характеризуются отсутствием активного вмешательства; в классическом наблюдательном исследовании оценивается лишь то, что происходит в рамках обычной клинической практики. К наблюдательным исследованиям предъявляются определенные требования, они были сформулированы в 2004 г. и были названы "Strengthening the Reporting of Observational Studies in Epidemiology (STROBE)", или "Ужесточение требований к отчетности о наблюдательных исследованиях в эпидемиологии" [105].
Виды наблюдательных исследований
Существуют разные виды наблюдательных исследований — исследования с историческим контролем, одномоментные, проспективные и ретроспективные когортные исследования, исследования "случай-контроль", а также клинические наблюдения (как за группой больных, так и за отдельным больным). Медицинские регистры (но не базы данных) также являются видом наблюдательных исследований.
Необходимо отметить, что наблюдательные исследования можно подразделить на клинические и неклинические. Такое деление отсутствует в официальных руководствах, однако оно является крайне важным с точки зрения трактовки результатов и определения надежности исследования. В клинических исследованиях исследователь (или лечащий врач) имеет непосредственный контакт с больным и многие данные получает непосредственно от больного. В неклинических исследованиях данные берутся из медицинской документации, непосредственный контакт с больным отсутствует.
Совершенно очевидно, что в ряде случаев клиническое исследование даст более надежный результат. Так, например, при изучении приверженности к назначению ЛП врач получает информацию непосредственно от больного (либо путем прямого опроса, либо с помощью специальных анкет). В неклинических исследованиях та же задача выполняется с помощью анализа реализованных рецептов, что, безусловно, таит в себе опасность получения ошибочных данных, так как реализация рецепта вовсе не означает, что больной принимал выписанный ЛП по рекомендованной схеме или принимал его вообще.
Одномоментные исследования (кросс-секционные исследования)
Смысл одномоментных исследований чисто описательный. Их используют, как правило, в тех случаях, когда отсутствует какая-либо гипотеза, причем проведение одномоментного исследования нередко позволяет эту гипотезу сформулировать. Эти исследования точно описывают характеристику популяции или ее подгрупп. В этих исследованиях частот удается установить распространенность того или иного заболевания, его исходов в конкретный момент времени [106].
Одномоментные исследования выполняются для оценки наличия или отсутствия изучаемого вмешательства в определенный период времени. Они могут оценивать частоту вмешательства в определенной группе больных. Поскольку назначение и исход в одномоментных исследованиях фиксируются в одно и то же время, причинно-следственная связь между ними в принципе не может быть установлена [107]. Это является главным недостатком одномоментных исследований. Например, выявление того, что ожирение чаще встречается у женщин с артритом, ни в коем случае не означает, что ожирение является причиной артрита.
Преимуществами одномоментных исследований является их незатратность, возможность оценить большое число характеристик больных, отсутствие выбывания больных, отсутствие этических проблем при их проведении.
Одномоментные исследования широко используются в фармакоэпидемиологии для оценки частоты назначения лекарств, их соответствия КР, частоты нерациональных назначений лекарств и т.д. Примером может служить крупное исследование в Португалии по изучению частоты потенциально нерациональных лекарственных назначений у пожилых больных [108].
Когортные исследования
Термин "когорта" взят из военной практики, в древнем Риме он обозначал группу из 300-600 воинов. Слово "когорта" в современной эпидемиологии трактуется как "группа людей, с определенными характеристиками, которых наблюдают в течение определенного времени", причем, как правило, наблюдение начинается в начале действия того или иного фактора, который может способствовать развитию болезни и заканчивается при возникновении исходов болезни. Наблюдение может продолжаться неопределенно долго, что делает когортные исследования уникальными при изучении отдаленных исходов заболевания [109]. В когортные исследования может включаться одна или несколько групп больных.
Когортные исследования часто используются в эпидемиологии. Примером может служить знаменитое Фремингемское исследование, фактически первое установившее вклад различных факторов риска в развитие ССЗ и их осложнений [110]. Целый ряд других известных когортных исследований предоставили огромный материал в отношении наших знаний о факторах риска, течении, методах лечения и исходах большого числа заболеваний. К таким исследованиям можно отнести, например, the RCGP Oral Contraception Study [111], NHS [112] и the British Doctors Study [113].
В рамках этих исследований были сделаны выводы об эффективности и безопасности некоторых лекарственных препаратов, которые, правда, подтверждались не всегда. Так, абсолютно не подтвердилась положительная роль гормонозаместительной терапии у женщин в постменопаузе (см. ниже), сделанная в NHS.
Когортные исследования могут быть проспективными и ретроспективными. Проспективные исследования выполняются из настоящего времени в будущее. Поскольку проспективные когортные исследования выполняются по специальному протоколу, они используют заранее оговоренный метод сбора информации, максимально удовлетворяющий поставленной цели. Поэтому качество сбора информации в проспективных исследованиях значительно выше, чем в ретроспективных. Главным недостатком проспективных когортных исследований является необходимость длительного периода для отслеживания отдаленных исходов заболевания.
Ретроспективные когортные исследования могут использовать так называемый исторический контроль. Они используют уже имеющиеся в медицинской документации данные, собранные некоторое время назад. Информация о возникших осложнениях заболевания собирается на основании ранее полученных данных. Многие считают, что поскольку в ретроспективных исследованиях уже имеется информация о возникших исходах, то нельзя делать выводы о причинно-следственной связи исходов и факторов, к ним предрасполагающих [114], поскольку такие выводы могут быть ошибочными [85]. Кроме того, считается, что данные, собранные в ретроспективных исследованиях, всегда будут неполными.
Преимущество ретроспективных исследований — невысокая стоимость и возможность быстрого получения результата. Основной и весьма существенный недостаток — невозможность получить или уточнить собранные данные, а также большое количество пропущенных данных.
Сказанное выше относится к тем случаям, когда исследователь произвольно выбирает больных из ретроспективных данных и когда разные больные наблюдались по-разному. Если же существует четкая система регистрации больных (идеальный вариант — это регистр пациентов) и четкая система наблюдения за больными, то эти факторы перестают играть значимую роль. Так, например, В 1990-х гг. резко увеличилась частота аутизма. Это совпало с увеличением вакцинации от кори, эпидемического паротита, краснухи (вакцина MMR). В связи с этим появилось мнение, что вакцинация способствует развитию аутизма. В Дании было проведено ретроспективное когортное исследование, в которое включили 537 303 детей, родившихся между 1991 и 1998 гг. Были проанализированы данные, внесенные в амбулаторные карты пациентов, оказалось, что вакцинация проведена 82% пациентам, при этом частота аутизма не отличалась среди вакцинированных и невакцинированных. Был сделан вывод об отсутствии причинно-следственной связи между вакцинацией MMR и возникновением аутизма [115].
Возможно также проведение ретро-проспективного исследования. В этом случае исходные данные о больных (например, перенесших ИМ ранее) собираются ретроспективно. А данные об исходах заболевания собираются проспективно, путем поиска больных, оценки их состояния и исходов заболевания. К такому типу исследований относятся российские регистры ЛИС-1 и ЛИС-2 [116][117].
Изучение действия ЛП в когортных исследованиях
Выше говорилось о том, что когортные исследования нередко могут приводить к ошибочному результату в отношении эффективности и безопасности того или иного ЛП. В когортных исследованиях могут наблюдать две или больше групп больных, начиная с воздействия того или иного фактора (например, ЛП) в течение определенного времени или до развития исхода заболевания. В самой простой форме в когортных исследованиях сравнивают группу, подвергшуюся воздействию (например, ЛП), с группой, не подвергшейся воздействию. По различию в частоте исходов можно судить об эффективности или безопасности метода.
В отличие от РКИ, где воздействие является контролируемым, в когортном исследовании воздействие в значительной степени является случайным и не поддается контролю со стороны исследователя.
Поскольку в когортном исследовании исходы болезни оцениваются после того, как было совершено воздействие, теоретически возможно оценивать причинно-следственную связь между воздействием и интересующими исходами при условии максимально возможного исключения воздействия смещающих факторов. На практике, однако, это практически невыполнимо и исключить вероятность ошибки вследствие влияния этих факторов маловероятно.
Попытки изучения эффективности ЛП в рамках когортных исследований предпринимались достаточно давно, их результаты оказались неоднозначными в отношении доказанности действия, о чем уже упоминалось выше. Проведение в последующем РКИ помогало подтвердить или опровергнуть полученные в наблюдательных исследованиях данные. Однако существует немало случаев, когда выводы в отношении эффективности и безопасности лекарств, полученные в когортных исследованиях, просто не могли быть подтверждены или опровергнуты с помощью РКИ по причине отсутствия последних. При этом всегда остается определенная степень неуверенности в отношении учета полученных в когортных исследованиях результатов в клинике.
Так, например, в рамках того же NHS было установлено, что применение у женщин дигоксина ассоциировалось с 45%-м увеличением риска заболевания раком молочной железы (в сравнении с пациентками, никогда не употреблявшими дигоксин) [118]. Эти данные, однако, не были подтверждены в других наблюдательных исследованиях [119]. В систематическом анализе и метаанализе 14 исследований "случай-контроль" и 15 когортных исследований, опубликованных между 1976 и 2016 гг., прием сердечных гликозидов у женщин ассоциировался с 30%-м увеличением риска заболевания раком молочной железы [120]. На сегодняшний день по данной проблеме не было проведено ни одного РКИ, поэтому однозначного ответа о связи приема дигоксина с раком молочной железы нет. Регуляторные органы не сочли данные о канцерогенном влиянии дигоксина убедительными, поэтому ни в одной из инструкций по применению дигоксина возможность развития рака молочной железы не упоминается.
Примером того, насколько может быть опасно доверять результатам когортных исследований по оценке действия ЛП, может служить недавняя пандемия COVID-19, когда при изучении гидроксихлорохина в наблюдательных исследованиях были получены положительные результаты об эффективности этого препарата [121], которые были опровергнуты впоследствии в крупных РКИ (см. ниже).
Представление результатов когортных исследований
Главной задачей исследователя в когортных исследованиях является доказательство того, что группы, подвергшиеся и не подвергшиеся воздействию, не отличаются друг от друга по исходным показателям (такая же задача стоит и перед исследователями в РКИ). Однако в когортных исследованиях решить такую задачу в десятки раз труднее, чем в РКИ из-за отсутствия рандомизации. Возможность доказательства идентичности основной и контрольной групп в значительной степени зависит от числа факторов, с помощью которых описывается исходное состояние пациентов. Чем этих факторов меньше, тем проще доказать отсутствие различий.
Исследования "случай-контроль"
Термин исследования "случай-контроль" был предложен P. E. Sartwell для того, чтобы не заострять внимание на ретроспективном характере этого вида исследований [122]. Исследование этого типа характеризуется тем, что к моменту его начала уже имеется информация об исходе (например, заболевания), поэтому на первичном этапе исследователь в классическом его варианте формирует две группы: группу "случаев", то есть тех, у кого интересующий исход имеется (основная группа), и группу "контролей", то есть лиц, у которых нет изучаемого исхода (контрольная группа).
После этого собираются данные анамнеза больного (в том числе лекарственного анамнеза), физикальные данные в прошлом, данные инструментальных исследований и лабораторных анализов в прошлом. Иными словами, необходимо максимально собрать все характеристики больного за период, предшествовавший заболеванию.
Исследования по типу "случай-контроль" хороши при изучении редких исходов заболевания или исходов с длительным латентным периодом. Исследования "случай-контроль" могут оказаться очень полезны при возникновении новых, ранее неизвестных заболеваний. Так, например, с помощью исследований "случай-контроль" были изучены факторы, предрасполагающие к развитию СПИДа. Исследования "случай-контроль" активно использовались при проведении эпидемиологических и фармакоэпидемиологических исследований [123]. Кроме того, исследования "случай-контроль" используются в тех случаях, когда по тем или иным причинам выполнить другие виды исследования невозможно.
В сравнении с проспективными наблюдательными исследованиями исследования по типу "случай-контроль" относительно незатратны, могут быть выполнены быстро, включают в себя относительно небольшое количество больных и могут показать роль различных факторов в развитии одного и того же исхода.
Смещение (bias) в исследованиях "случай-контроль" является их "ахиллесовой пятой" — они очень чувствительны к ошибкам. Это, в первую очередь, объясняется тем, что информация о многих факторах собирается путем опроса больного или знакомства с ранее собранной документацией, при этом высока вероятность ошибок и отсутствия ряда данных. Кроме того, формирование контрольной группы в исследованиях "случай-контроль" может представлять определенные сложности.
Были сформулированы следующие основные правила проведения этих исследований. Во-первых, очень четко должны быть описаны критерии диагностики в основной группе и критерии отсутствия этого же диагноза в контрольной группе. Во-вторых, больные контрольной группы должны набираться из той же популяции, что и больные основной группы. В-третьих, исследователи, собирающие материал для исследования, не должны знать его основной цели (аналог заслепления результатов), в-четвертых, эти же исследователи должны пройти тренинг по обеспечению единообразия сбора данных в основной и контрольной группах, в-пятых, руководители исследования должны принять все меры для уменьшения смещения полученных результатов, включая статистические технологии [124].
При анализе результатов исследований по типу "случай-контроль" (как и других ретроспективных исследований) следует помнить, что они не позволяют выявить причинно-следственную связь между изучаемыми факторами.
На основании результатов исследований "случай-контроль" были получены важные для практики выводы, которые нередко затем подтверждались в исследованиях более высокого уровня доказательств. Так, например, с помощью этого вида исследований были опровергнуты мнения о том, что прием статинов способствует развитию деменции [125], вакцинация против гриппа увеличивает риск ИМ, а применение парацетамола — риск рака яичников [123]. Более того, именно в исследовании типа "случай-контроль" [126] впервые было показано, что вакцинация от гриппа снижает риск повторного ИМ, что впоследствии было подтверждено в ряде РКИ.
Тем не менее, иногда в исследованиях "случай-контроль" выявляли достаточно странные взаимосвязи. Так, например, была показана связь между наличием в доме беременных женщин домашних животных, например кошки, и последующим развитием психоза у ребенка [127]. Некоторые результаты исследований "случай-контроль" не находили впоследствии подтверждения в РКИ. Так, в 2020 г. в исследовании "случай-контроль" было продемонстрировано, что иммунодепрессор тоцилизумаб (моноклональное антитело против рецепторов интерлейкина-6) снижал риск смерти у больных с тяжелым течением COVID-19 [128]. Это, казавшееся перспективным, действие препарата было впоследствии опровергнуто в РКИ, результаты которого были опубликованы через год [129][130].
В то же время, в ряде исследований по типу "случай-контроль" была получена информация, впоследствии подтвердившаяся в РКИ. Так, в одном из таких исследований была проанализирована связь приема различных антитромботических препаратов и вероятности желудочно-кишечных кровотечений [131]. Впоследствии эти данные фактически были подтверждены в целом ряде РКИ.
Клинические наблюдения и доказательная фармакотерапия
С появлением доказательной медицины важность индивидуальных наблюдений (case reports) отступила на задний план: такие наблюдения рассматривают как самый низкий уровень доказательства. Индивидуальным наблюдениям было оставлено место только при описании очень редких случаев течения болезни. Тем не менее не следует забывать, что история медицины знает примеры, когда эффективность лечения была доказана на одном пациенте. Хорошо известно, что E. Jenner в 1797 г. доказал эффективность вакцинирования против оспы на примере одного единственного пациента [132]. Предположение о роли табака в возникновении рака легких было высказано на основании анализа нескольких клинических случаев у прооперированных больных в 20-х — 30-х гг. ХХ в., крупные когортные исследования и исследования "случай-контроль", подтвердившие эту связь, были выполнены двумя десятилетиями позже. Наблюдение за несколькими больными туберкулезом, принимавшими химиотерапевтические ЛП, привело к выводу, что последние могут улучшать настроение больных, что позволило использовать их впоследствии как антидепрессанты [133].
Достоен упоминания тот факт, что в самом первом в истории РКИ авторы иллюстрировали доказанный ими эффект стрептомицина у больных туберкулезом не только статистическими данными, но и отдельными клиническими примерами [9].
Особое место описание отдельных случаев занимает при выявлении редких побочных эффектов ЛП. Источником таких случаев могут быть как РКИ, так и любые другие наблюдательные исследования, а также реальная клиническая практика. Известно, что, если речь идет о серьезных побочных действиях ЛП, статистический анализ для их идентификации требуется далеко не всегда. Так, несколько внезапных смертей, вызванных некупируемыми нарушениями ритма сердца, которые зарегистрировали разные врачи-онкологи при внутривенном введении противорвотного препарата дромперидона, заставили сразу же отказаться от использования парентеральной лекарственной формы этого препарата.
Отдельные клинические наблюдения в рамках проводимых наблюдательных исследований смогли продемонстрировать не просто плохую приверженность к назначенному лечению, а полный отказ от лечения у некоторых больных, перенесших ИМ (неопубликованные данные). Такие случаи в рамках большого регистра, возможно, не выявят статистически значимых последствий такого поведения больных, но должны заставить насторожиться врачей и организаторов здравоохранения.
Место наблюдательных исследований в доказательной медицине
S. J. Pocock, один из наиболее авторитетных представителей биостатистики, считает, что роль наблюдательных исследований в современной доказательной медицине должна ограничиваться уточнением результатов РКИ: в первую очередь изучением эффективности ЛП у более широких групп больных, в том числе, у пожилых, коморбидных больных, а также представителей разных этнических групп. Анализ результатов наблюдательных исследований может быть полезен в формулировании различных гипотез для организации и проведения новых РКИ [134].
Вместе с тем нельзя не признать, что наблюдательные исследования продолжают играть достаточно большую роль в тех областях медицины, где проведение РКИ невозможно в силу ряда причин. Так, например, данные многих классических РКИ о целом ряде ЛП, проведенных в конце ХХ в., явно устарели, так как значительно изменилась базовая терапия, стали использоваться иные методы лечения и пр. С позиций классической доказательной медицины в таких случаях требуется проведение новых РКИ с теми же препаратами, к чему активно призывает C. B. Granger и соавт. [135]. Однако проведение таких исследований, во всяком случае, в виде классических РКИ, вряд ли можно считать этичным. Поэтому для анализа эффективности старых ЛП в современных условиях не остается ничего другого, как использовать данные наблюдательных исследований, имея при этом в виду, что степень их убедительности вряд ли будет сопоставима со старыми РКИ.
Регистры
Медицинские регистры по определению являются видом наблюдательного исследования. Однако к регистрам применяются значительно более жесткие требования. Регистр "представляет собой организованную систему, которая использует наблюдательные методы исследования для получения однородной информации для оценки определенных исходов в популяции, объединенной определенным заболеванием, состоянием или воздействием, с одной или несколькими предопределенными научными, практическими или экономическими целями" [136]. Протокол регистра должен соответствовать поставленным целям и обеспечивать адекватные методы сбора и анализа данных.
Набор данных для каждого пациента обязательно должен быть однотипным, кроме того, включение пациентов в регистр должно быть сплошным, т.е. включаются все без исключения больные, удовлетворяющие заданным критериям включения в регистр), и ограничиваться строгими временными и территориальными рамками, установленными в дизайне регистра. На включение пациента в регистр не может влиять желание/нежелание исследователя [136][137]. Регистр не нарушает повседневную практическую деятельность врача и, как правило, не предполагает каких-то дополнительных вмешательств. Исключения могут составлять какие-либо методы получения дополнительной информации о больном, например, специальные опросники, анкеты и пр.
Регистры, как и наблюдательные исследования, бывают ретроспективными, проспективными и ретро-проспективными. Регистры имеют самые разнообразные цели: изучение особенностей течения болезни, изучение ее ближайших и отдаленных исходов, оценка качества лечения и его соответствия КР и др. Не следует путать регистры с реестрами, последние являются простой системой записи и учета данных, не имеют конкретной научной цели и не могут служить материалом для серьезного статистического анализа [114].
Регистры подразделяются на административные, проведение которых инициируется медицинскими регулирующими органами, и инициативные, которые проводятся добровольно по желанию исследователей (как правило, представляющих те или иные медицинские сообщества). Первые отличаются большей репрезентативностью полученных данных (за счет сплошного включения медицинских учреждений), вторые, как правило, характеризуются более высоким качеством организации исследования, но отличаются меньшей представительностью, так как в них участвуют в первую очередь те учреждения, где оказывается более качественная медицинская помощь.
Регистры бывают госпитальными и амбулаторными. Первые подробно оценивают все, что происходит с больным в стационаре. Они также могут оценивать и отдаленные исходы заболевания, однако этот процесс связан с определенными техническими трудностями и не всегда обеспечивает достаточный отклик больных при длительных сроках наблюдения.
Амбулаторные регистры проводятся на базе одной или нескольких поликлиник, они позволяют тщательнее отслеживать течение хронически протекающих заболеваний, у них больше возможностей отследить отдаленные исходы болезни и обеспечить тем самым хороший отклик больных.
Недостатки регистров
Главным недостатком регистров, как любого наблюдательного исследования, является сложность оценки причинно-следственного взаимоотношения изучаемых факторов. В первую очередь, это характерно для ретроспективных регистров, в которых можно оценить лишь ассоциации между изучаемыми факторами, но ни в коем случае не их причинно-следственную связь. В проспективных регистрах установление такой связи возможно, но оно всегда затруднено наличием большого количества неучтенных смещающих факторов.
Другой проблемой регистров является наличие так называемых пропущенных данных (missing data). Причины пропущенных данных могут быть самыми различными, они могут быть случайными или систематическими. Самое главное, что неучет пропущенных данных может сильно повлиять на выводы исследования [114][138].
В ретроспективных регистрах восстановить пропущенные данные в принципе невозможно. В проспективных регистрах уже на этапе планирования исследования необходимо предусмотреть методы, снижающие накопление пропущенных данных. Предложена специальная система контроля за пропущенными данными в процессе проведения проспективного регистра1. Нельзя не отметить, что существуют многочисленные подходы к так называемому замещению или заполнению пропусков отсутствующих данных, основанные на разных принципах, описание которых выходит за рамки настоящего руководства. Все они, однако, не избавляют от проблемы смещения полученных результатов.
Роль регистров в изучении ЛП
Как уже отмечалось, регистр является видом наблюдательного исследования. Лечение в регистрах назначается в рамках обычной клинической практики (в отличие от РКИ). Поэтому в принципе регистр не должен использоваться как основной метод изучения эффективности ЛП. Тем не менее, в крупных регистрах, в которые включено большое количество больных, можно выделить группы, получавшие и не получавшие интересующий исследователя ЛП. Однако эти группы, скорее всего, будут сильно отличаться друг от друга по исходным показателям, поэтому относить выявленные различия в исходах заболевания только за счет изучаемого ЛП ни в коем случае нельзя.
Существует целый ряд статистических методик создания одинаковых групп внутри регистра, различающихся по факту приема или неприема изучаемого ЛП (так называемая "псевдорандомизация"). Наиболее известной из них является так называемая методика "propensity score matching". Однако все методики псевдорандомизации страдают целым рядом существенных недостатков. Во-первых, при использовании этих методик выключается из исследования значительная часть участвовавших в них больных. Во-вторых, ни одна из этих методик не может учесть влияния всех смещающих факторов. В первую очередь, речь идет о таких факторах, как приверженность больных к назначенному лечению, мотивы выбора ЛП врачом, наличие противопоказаний к приему ЛП и др. Поэтому никакая псевдорандомизация не может заменить настоящей рандомизации, проводимой в РКИ. Соответственно, данные об эффективности ЛП, полученные на основании регистра, всегда будут обладать существенно меньшей доказательностью, чем данные, полученные в РКИ, и ни в коем случае не могут опровергнуть результаты РКИ [139]. Вот почему КР, как правило, относят регистры к уровню доказательств "C". Тем не менее, Американская ассоциация сердца (АНА) считает, что данные, полученные в грамотно организованных регистрах, можно отнести к уровню доказательств "B".
В то же время, если данные об эффективности ЛП, полученные в результате анализа регистра, совпадают с данными РКИ, это может служить хорошим подтверждением эффективности препарата в реальной клинической практике. В литературе последних лет стали активно различать термины "efficacy" (эффективность, зарегистрированная в РКИ) и "effectiveness" (эффективность, зарегистрированная в условиях реальной клинической практики). Нельзя не отметить, однако, что подходы к оценке "effectiveness" значительно более субъективны, чем подходы к изучению "efficacy" [140]. Для определения реальной эффективности ЛП используют также так называемые прагматические исследования, которые являются упрощенным вариантом РКИ (см. ниже).
Регистры, имеющие большую длительность наблюдения, позволяют выявлять отдаленные исходы заболевания на фоне длительного приема ЛП, а также редкие и отдаленные побочные действия ЛП. При этом, однако, абсолютно необходимо, чтобы "отклик" больных был достаточно высоким, а количество больных с неизвестной судьбой (lost to follow-up) — минимальным. К сожалению, в ряде регистров отклик при отдаленном наблюдении является очень небольшим [141], при этом авторы все-таки позволяют себе проводить анализ факторов, повлиявших на отдаленные исходы болезни.
Регистры являются лучшим средством оценки реального качества лечения, его соответствия КР. Они позволяют оценить так называемую приверженность врачей к соблюдению КР и официальных инструкций по применению ЛП. Кроме того, клинические регистры являются идеальным средством оценки приверженности больных к назначенному врачом лечению (см. ниже).
Результаты, полученные в регистрах, являются одним из основных источников данных фармакоэпидемиологии — науки, изучающей использование и эффекты ЛП на больших группах больных.
Регистры и базы данных
Базы данных принципиально отличаются от медицинских регистров тем, что они не имеют никакой заранее определенной научной цели, а являются простым накоплением получаемых данных. В этом плане их можно сопоставить с реестрами. Современные базы данных могут включать сотни тысяч больных, что делает их весьма привлекательными для проведения научных исследований, в том числе по оценке эффективности ЛП. Статистический анализ, проводимый на основании баз данных, позволяет достаточно легко получить статистическую значимость за счет огромного количества анализируемых больных. Специально созданные статистические методы (например, методика "propensity score") в какой-то мере позволяют имитировать проведение РКИ внутри базы данных с помощью, описанной выше псевдорандомизации [142]. Кроме других многочисленных недостатков при проведении такого вида анализа, при псевдорандомизации исследование является ретроспективным со всеми присущими этому виду исследований недостатками.
Базы данных с точки зрения научного анализа обладают и другим огромным количеством недостатков, причем их выраженность гораздо больше, чем у регистров. Это касается неполноты сбора данных и отсутствия возможности восполнения пропущенных данных, отсутствия сведений о приверженности больных к назначенному лечению, неспособности учитывать прием безрецептурных препаратов и пр. Поэтому выводы об эффективности и безопасности лекарств, и, тем более, о сравнении разных лекарств друг с другом, сделанные на основании анализа баз данных, представляются весьма сомнительными с точки зрения доказательной медицины [143][144]. Настораживает появившаяся в последнее время тенденция широкого использования анализа баз данных и попытки заместить таким анализом результаты, получаемые в РКИ.
Роль регистров в доказательной медицине
В иерархии доказательств эффективности того или иного вмешательства регистры занимают достаточно скромную роль. Европейское общество кардиологов однозначно относит данные, полученные в регистрах, к самому низкому уровню доказательств "C". Американская ассоциация сердца занимает несколько иную позицию, относя хорошо спланированные регистры к уровню доказательства "B", а регистры с методическими дефектами — к уровню доказательств "C" [145].
Следует отметить, что регистры в принципе не предназначены для доказательства пользы от какого-либо вмешательства, их задачи совсем другие, поэтому регистры ни в коем случае не следует противопоставлять РКИ.
Всегда ли результаты рандомизированных контролируемых исследований воспроизводятся в реальной клинической практике?
Экстраполирование результатов РКИ в реальную клиническую практику не всегда просто и однозначно по целому ряду причин. Хорошо известно, например, что РКИ проводятся, как правило, наиболее квалифицированными врачами, в условиях, далеких от рутинной практики, выполнение назначений врача в отношении исследуемого препарата при этом тщательно контролируется [77]. Поэтому возникает вопрос, воспроизведутся ли результаты, полученные в идеальных условиях РКИ, в реальной клинической практике. Сказанное выше диктует необходимость верифицировать результаты, полученные в РКИ, с помощью исследований реальной клинической практики, и такими исследованиями могут явиться как раз наблюдательные исследования эффективности [139][146].
Согласно современным данным фармакоэпидемиологии, результаты РКИ и фактические данные наблюдательных исследований, выполненных в условиях реальной клинической практики, дополняют друг друга, обеспечивая сбор наиболее полной информации об эффективности и безопасности ЛП [147].
Реальные возможности изучения лекарственных препаратов в наблюдательных исследованиях
О месте наблюдательных исследований в современной доказательной медицине говорилось выше. Чаще всего такие исследования проводятся в рамках 4-й фазы исследований. Определенных требований к изучению эффективности ЛП в наблюдательных исследованиях не существует. Такие исследования проводят, как правило, обычные врачи, которые для участия в исследовании могут проходить специальный тренинг по соблюдению современных КР.
Как уже отмечалось, в наблюдательных исследованиях вмешательство, как таковое, отсутствует. Поэтому эффективность ЛП можно изучать только в пределах, не выходящих за рамки клинической практики, которая в идеале должна соответствовать современными КР. В наблюдательных исследованиях врач выписывает больному препарат и в принципе не знает, получил его больной или нет. Для того, чтобы это установить, необходимо оценить приверженность больного к назначенному лечению. В РКИ ЛП практически всегда выдается больному и подлежит специальному учету.
Оценка эффекта в наблюдательных исследованиях
Главная проблема в наблюдательных исследованиях — сформировать контрольную группу, которая по разным причинам не получает ЛП. Эта группа из-за отсутствия рандомизации почти всегда будет отличаться от основной группы. Различные методики псевдорандомизации в рамках наблюдательных исследований позволяют сформировать похожие группы пациентов внутри конкретного исследования. Для этого формируются одинаковые по исходным характеристикам пары больных, различающиеся между собой только фактом приема или неприема изучаемого препарата. Однако все эти методики обладают существенными недостатками, в первую очередь, потому, что при их использовании теряется значительная часть больных. Кроме того, в наблюдательных исследованиях, как правило, невозможно оценить мотивы выбора препарата врачом, а также приверженность больного к назначаемому лечению (если это только не планируется заранее).
Поскольку далеко не все больные соблюдают назначенные им рекомендации, в принципе возможно разделить их на группы приверженных и неприверженных к приему определенного препарата. По такому принципу было построено исследование НИКЕЯ Сравнивая отдаленные исходы заболевания у приверженных и неприверженных к приему никорандила, удалось получить результаты, аналогичные результатам РКИ IONA [148].
Прагматические исследования
Термин "прагматические исследования" появился почти одновременно с термином РКИ. В 1967 г. D. Schwartz и J. Lellouch предложили подразделять все виды клинических исследований на "объясняющие" (explanatory), которые подтверждают "физиологическую или клиническую гипотезу" и "прагматические" (pragmatic), которые доказывают эффективность применения того или иного вмешательства в реальной клинической практике [149]. Впоследствии к "объясняющим" были отнесены РКИ, которые должны были доказывать эффективность (efficacy) вмешательства в идеальных условиях, а к прагматическим — исследования реальной клинической практики (effectiveness), роль которых заключалась в доказательстве эффективности вмешательства в реальных условиях. Следует отметить, что на сегодняшний день принципы подразделения этих двух видов исследований выглядит несколько иначе.
Появление прагматических исследований в том виде, в котором их проводят на сегодняшний день, было обусловлено целым рядом причин. Проведение РКИ требует больших затрат, сопряжено с целым рядом сложностей (в первую очередь организационного характера). Кроме того, большинство РКИ спонсируются фармацевтическими компаниями. Этим объясняется то, что далеко не на все вопросы практической медицины есть ответы в виде РКИ. Вследствие этого клиницисты вынуждены использовать большое количество методов лечения, не имеющих доказательств (например, чем лечить синдром отмены алкоголя, какой препарат из группы вазопрессоров лучше всего использовать для септического шока). Поэтому проведение менее затратных и значительно более доступных прагматических исследований представляет большой интерес для практической медицины.
Принципы проведения прагматических исследований
K. E. Thorpe и соавт. разработали специальный индикатор, состоящий из 9 критериев, для разграничения прагматических исследований и РКИ — PRECIS [150]. Этот индикатор был впоследствии модифицирован в PRECIS -2 [151].
Прагматические исследования фактически являются "облегченным" вариантом РКИ. В них отсутствуют многие методические требования, делающие РКИ "золотым стандартом" доказательств. В них очень часто отказываются от основных принципов надлежащей клинической практики (GCP — Good Clinical Practice), являющейся краеугольным камнем проведения РКИ.
В отличие от РКИ прагматические исследования, как правило, проводят обычные лечащие врачи, не имеющие опыта выполнения исследований и обычно плохо знакомые с основными принципами надлежащей клинической практики. Хотя, в сущности, в прагматических исследованиях возможно применение слепого метода, его в большинстве случаев не используют из-за того, что лечащий врач должен иметь возможность оценить эффект проводимого лечения. Вопрос о том, применить ли у конкретного больного стандартный или новый метод лечения, как правило, решает сам лечащий врач.
В отличие от РКИ, которые проводятся в идеальных контролируемых условиях, в прагматических исследованиях эффект оценивается в условиях реальной клинической практики. В этих исследованиях может не использоваться плацебо, в качестве контроля используют больных, получающих обычную терапию. Считается, что эта терапия отражает реальную клиническую практику [152], хотя на самом деле это не всегда соответствует действительности.
Протокол прагматических исследований не является таким строгим, как в РКИ, он может меняться по ходу проведения исследования. Оценка исходов болезни в прагматических исследованиях, как правило, тоже отличается от таковой в РКИ. В РКИ существует понятие ПКТ, по вероятности достижения которой оценивается все исследование. В прагматических исследованиях оценка может идти сразу по нескольким параметрам, например, по развитию серьезных осложнений и по изменению качества жизни. В прагматических исследованиях не ставится задача, чтобы каждый больной закончил исследование в той группе, в которую он попал. Как правило, однако, анализ ведется исходя из того, к какой группе изначально был отнесен тот или иной больной, т.е. с помощью анализа, аналогичному "intention to treat" [153].
Нельзя не отметить, что строгой границы между РКИ и прагматическими исследованиями не существует. Целый ряд крупных РКИ, оценивавших эффекты ЛП на жесткие конечные точки, в том числе на показатели смертности, проведенных в 80-х и 90-х гг. ХХ в., содержали некоторые элементы прагматических исследований. Эти исследования отличались расширенными критериями включения и небольшим количеством критериев невключения, простым протоколом исследования, использованием упрощенной документации, отсутствием финансовых выплат проводившим его исследователям. Например, в исследованиях ISIS и GUSTO 36, в которые включались больные острым ИМ, карта исследования состояла всего из 1 страницы, ни в процессе исследования, ни после него в них не проводился мониторинг участвовавших в них центров [154]. Валидность результатов этих исследований поддерживалась наличием строгой рандомизации, большим количеством включенных больных, независимой оценкой исходов заболевания.
Вариантом прагматического исследования является исследование RECOVERY (его называют адаптивным исследованием по типу платформы [155], которое начали проводить почти одновременно с возникновением пандемии COVID-19. В отличие от классических РКИ, в которых заранее прописаны все детали протокола (включая все виды терапии, изучаемый препарат и препарат сравнения), адаптивные исследования по типу платформы позволяют прекращать лечение изучаемым ЛП при получении результатов его эффективности в ходе исследования и заменять его на другой препарат. Эту процедуру можно применять несколько раз, что и было сделано в исследовании RECOVERY [155]. Таким образом, в ходе одного и того же исследования можно протестировать несколько препаратов или методов лечения.
Недостатки прагматических исследований
Существенными недостатками прагматических исследований являются практически полное отсутствие контроля за приверженностью к назначенной терапии, возможность так называемого "перекреста" (cross-over), т.е. перехода больного на альтернативную терапию, слабый контроль за исходами заболевания и их документацией.
Соответственно, возникает вопрос, какова степень убедительности данных, полученных в прагматических исследованиях, и к какому уровню доказательств их следует отнести. Можно отметить, что ни в одних нормативных документах, определяющих степень доказательности различных видов доказательств в медицине, прагматические исследования как таковые не фигурируют вообще.
Отсутствие четко оговоренного стандарта лечения контрольной группы нередко создает проблемы при анализе результатов прагматических исследований, особенно в тех случаях, когда это лечение не соответствует существующим КР [156].
Считается, что с этической точки зрения прагматические исследования в значительной степени уменьшают вероятность приема больным препаратов с недокументированной безопасностью, так как в них используют только уже известные и зарегистрированные ЛП [157]. Правда, в прагматических исследованиях эти препараты могут назначаться не по показаниям (off-label). Так, в ситуации с пандемией COVID-19 произошло как раз обратное: хорошо известный ранее препарат гидроксихлорохин, никогда не использовавшийся для лечения вирусных заболеваний, оказывал серьезные побочные действия при сочетании с другими противовирусными и противовоспалительными препаратами.
Фармакоэпидемиология и доказательная фармакотерапия
Фармакоэпидемиология изучает использование и эффективность лекарств на уровне популяции [158]. Сразу следует оговориться, что речь идет не о популяции в целом, а о популяции больных с конкретными заболеваниями. Поэтому классические эпидемиологические исследования, обследующие всю популяцию людей, независимо от наличия у них тех или иных заболеваний, не очень подходят для этой цели и редко используются фармакоэпидемиологией.
Фармакоэпидемиология для своих целей использует в основном наблюдательные исследования: одномоментные (кросс-секционные), когортные и исследования "случай-контроль". Наиболее удобны для этого регистры как отдельных заболеваний, так и специально созданные для изучения назначения отдельных ЛС. Как уже говорилось ранее, при изучении действия препарата в условиях реальной клинической практики используется термин "effectiveness". Правда, методы для изучения "effectiveness" нигде четко не оговорены. Иногда высказывается мнение, что прагматические исследования являются основными в решении этой проблемы. Однако, прагматические исследования, скорее, являются упрощенным вариантом изучения эффективности ЛП в рамках РКИ, а не ее изучением в реальной клинической практике.
Использование наблюдательных исследований с целью изучения "effectiveness", как отмечалось выше, всегда будет обладать меньшей степенью убедительности в сравнении с РКИ. Использование специальных статистических приемов в рамках крупных баз данных, проведение так называемой псевдорандомизации, путем использования методики "propensity score" и ей подобных не решает проблемы, так как не способно устранить действие всех смещающих факторов и даже близко сравниться в этом вопросе с РКИ [159].
Пандемия COVID-19, как индикатор значимости разных типов исследований
Вопрос о роли доказательной медицины вообще и о значимости разных видов клинических исследований в частности приобрел крайнюю актуальность во время возникновения пандемии COVID-19 в начале 2020 г. Как известно, на момент возникновения пандемии не было ни одного ЛС с доказанным действием на течение этого заболевания. Соответственно, возник вопрос о необходимости быстрого получения убедительных данных о реальной эффективности уже существующих ЛП, так как на создание новых просто не было времени.
На основании механизма действия некоторых препаратов, а также результатов их изучения при других вирусных заболеваниях, был сделан вывод о возможной эффективности при COVID-19 целого ряда ЛП, как противовирусных, так и прочих, причем почему-то особые надежды возлагались на гидроксихлорохин и подобные ему препараты.
В самом начале пандемии COVID-19 был выполнен ряд нерандомизированных наблюдательных исследований и небольших рандомизированных исследований, надежность результатов которых была существенно преувеличена. Так, как уже отмечалось, в ряде нерандомизированных исследований был выявлен положительный эффект гидроксихлорохина [121], это же было доказано в небольших и не очень четко спланированных РКИ2 [160]. В когортном исследовании была продемонстрирована эффективность гидроксихлорохина в комбинации с антибиотиком азитромицином [160]. И хотя в других наблюдательных и небольших рандомизированных исследованиях не было получено эффекта гидроксихлорохина в виде монотерапии и в комбинации с азитромицином [161, 162], на основании результатов исследований, давших положительный результат, а также на основании экспериментальных данных и гидроксихлорохин, и азитромицин были поспешно зарегистрированы для лечения COVID-19 в ряде стран [163], в том числе и в России. В результате огромное количество больных стали получать бесполезное (и не всегда безопасное) лечение гидроксихлорохином, причем многие из этих больных могли бы принять участие в крупных РКИ, что фактически было бы для них более полезным [164-166].
Сразу же после начала пандемии COVID-19 был начат ряд классических РКИ по изучению эффективности целого ряде препаратов, в частности исследование ORCHID, в котором оценивали эффективность и безопасность гидроксихлорохина у 821 больного [167]. Результаты этого исследования стали доступны в начале июня 2020 г. и показали полное отсутствие эффекта гидроксихлорохина. Лишь после этого FDA четко определило, что гидроксихлорохин не рекомендуется для лечения COVID-19.
Практически одновременно с началом пандемии было начато прагматическое исследование RECOVERY, которое включило примерно 11000 больных в период с 25 марта по 5 июня 2020 г. Первоначало в этом исследовании было начато изучение гидроксихлорохина, но через некоторое время в его рамках было начато изучение других препаратов — азитромицина, ряда противовирусных препаратов, сыворотки больных, перенесших COVID-19.
В результате исследование RECOVERY дало быстрый ответ о наличии эффекта у кортикостероидов и тоцилизумаба и о неэффективности гидроксихлорохина, лопинавира-ретиновира, азитромицина и сыворотки реконвалесцентов при COVID-19. Считается, что результаты исследования RECOVERY спасли жизни десяткам тысяч больных. На основании результатов этого исследования были внесены изменения в КР [168][169]. Тем не менее, ряд исследователей выражают сомнения в верности некоторых его результатов, и это связано именно с типом самого исследования. В частности, выводы об эффективности дексаметазона и толизумаба некоторые авторы подвергают сомнениям по причине методических особенностей исследования [170][171].
Таким образом, ситуация с внезапно возникшей пандемией COVID-19 четко выявила истинную иерархию доказательств в оценке эффективности ЛП при ранее неизвестном заболевании. Полностью не оправдавший себя патофизиологический метод, весьма противоречивые, а иногда явно ложные данные наблюдательных исследований, несколько сомнительные, но в целом достойные внимания данные прагматических исследований и, наконец, самые объективные данные классических РКИ. Правда, РКИ в основном доказывали неэффективность ранее использовавшихся ЛП, положительный эффект был выявлен лишь в нескольких исследованиях и то не для жестких конечных точек [172].
Доступность и относительная простота проведения прагматических исследований, возможность быстрого получения результата, с одной стороны, делают их идеальным вариантом получения доказательной информации в сложившейся ситуации. С другой стороны, отход от ряда требований классической доказательной медицины вызывает определенные сомнения в достоверности полученных в них результатов.
Клинические рекомендации
Под КР обычно понимают положения, составляемые коллективами экспертов с учетом новейших научных достижений в помощь практическим врачам и потребителям медицинских услуг при принятии решений в определенных клинических обстоятельствах. КР призваны трансформировать данные доказательной медицины, в первую очередь, РКИ, в простые и доступные для практического врача формы.
Американская коллегия врачей (American College of Physicians — ACP) стала первой организацией в США, разработавшей в 1981 г. КР, основанные на доказанном. С тех пор Комитет по клиническим рекомендациям в сотрудничестве с Департаментом клинической политики регулярно разрабатывают КР и продолжают совершенствовать и улучшать их технологию.
Следует помнить, что в настоящее время в разных странах КР носят разный статус. В большинстве стран (например, в США) они не имеют юридического статуса. Однако в спорных ситуациях для установления истины эксперты прибегают именно к ним. Британский NICE (National Institute for Health and Clinical Excellence) считает, что "Клинические рекомендации предназначены для информирования врачей о вариантах клинической практики и соблюдения согласованных стандартов, но не для замены знаний и навыков клиницистов или пожеланий пациентов. Врач может принять осознанное и оправданное решение и отказаться от рекомендаций в конкретных ситуациях, когда считает, что это отвечает интересам пациента, и после обсуждения этого с пациентом"3.
В Российской Федерации (РФ) КР стали создаваться с 90-х гг. ХХ в. профессиональными сообществами, в кардиологии — Всероссийским научным обществом кардиологов (в настоящее время Российское кардиологическое общество — РКО). Первоначально они, как и в большинстве других стран, имели рекомендательный характер. С 1 января 2022 г. КР, утвержденные Минздравом России, получили юридический статус (вступили в силу изменения в Федеральный закон от 21 ноября 2011 г. № 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации", касающиеся обязательного применения медицинскими организациями КР при оказании медицинской помощи).
Как создаются КР
Наиболее простым способом написания КР являются попытки небольшого коллектива исследователей, имеющих опыт анализа данных доказательной медицины и знающих принципы GCP (Good Clinical Practice), обобщить эти данные и создать документы для практического врача, позволяющие принимать решение в разных клинических ситуациях. Источниками данных являются статьи в рецензируемых журналах, так называемая "серая" литература, а также экспертная оценка пользы тех или иных вмешательств. Исторически КР в основном опирались на экспертное мнение, учитывавшее опыт исследователей [173]. Впоследствии роль РКИ в создании КР стала возрастать, в настоящее время КР, как правило, представляют собой синтез данных РКИ, наблюдательных исследований и экспертных заключений.
Так, существует AGREE II инструмент (Appraisal of Guideline ResEarch and Evaluation), включающий 6 модулей и 23 вопроса, каждый из которых может оцениваться экспертами от 1 до 7 баллов (категорически не согласен — абсолютно согласен). Для каждой области высчитывается средний балл. Позже был создан упрощенный инструмент — iCAHE CPG (International Centre for Allied Health Evidence) — перечень качества, содержащий те же области, что и AGREE II, но включающий только 14 вопросов, каждый из которых может иметь ответ "да" или "нет" [174].
Создание КР требует в первую очередь постановки цели и формирования доказательной базы в виде систематического обзора. Первоначально создается план КР, включающий основную цель, задачи, существующие определения, виды медицинской помощи, которой касаются КР, категорию пациентов, которым они предназначены, а также стратегию последующего применения КР. Далее формулируются сами КР, в которых описывается доказательная база и ее убедительность. Универсального стандарта создания КР не существует, хотя имеется ряд документов, позволяющих формализовать их написание, включая "чек-лист" Конференции по стандартизации рекомендаций (COGS — Conference on Guideline Standardization), алгоритм AGREE и ряд других. Все эти документы содержат вопросы о соотношении пользы и вреда при применении того или иного вмешательства, имеющихся ресурсов для его применения, доступности и т.д. Необходимо упомянуть, какая доля больных может рассчитывать на получение пользы от конкретного вмешательства. Если по каким-либо пунктам КР не достигнуто согласия между экспертами, об этом необходимо упомянуть в КР и указать, что послужило поводом для разногласий.
Все положения КР подвергаются классификации, основанной на уровне доказательств (УД) и классе рекомендаций. В России вместо понятия класса рекомендаций используется понятие уровень убедительности рекомендаций (УУР), а вместо понятия уровень доказательности — уровень достоверности доказательств (УДД). Класс КР (УУР КР) отвечает на вопрос о балансе пользы и вреда в сформулированном в положении КР методе/вмешательстве/способе, где I класс КР (или 1 уровень УУР) соответствует максимальной пользе и минимальному вреду, а III класс КР (или 3 уровень УУР) — доказательствам или общепринятому соглашению о том, что данное вмешательство бесполезно или даже может быть вредным.
Уровень доказательности (УДД) информирует, на данных каких исследований базируется каждое положение КР. Считается, что наиболее высокий уровень УДД дают систематические обзоры, в том числе, с метаанализом результатов РКИ, наименьший обычно присваивается положениям, основанным только на мнении экспертов.
Следует отметить, что, по мнению ряда ученых, классификация КР, предлагаемая ESC слишком упрощенная4. В ней не учитывается тот факт, что исследования различного дизайна, в том числе, включаемые в систематические обзоры и метаанализы, могут быть разного качества. Классификацию, где эти параметры УДД учитываются, предлагает Оксфордский университет.
Наиболее удачной и простой в применении можно признать таблицу с добавлением правила "цветов светофора" к обязательности выполнения конкретного положения КР, а также согласование цветом "глубины" доказательности данного утверждения КР. Данная классификация адаптирована из аналогичной, разработанной экспертами Европейского общества по артериальной гипертонии (European Society of Hypertension (ESН)), и представлена на сайте РКО [175]. В этой таблице, в столбце "глубины доказательности" возможно использовать и градацию, предложенную Оксфордским центром доказательной медицины (Centre for Evidence-Based Medicine — (CEBM)), с пятью уровнями доказательности в зависимости от цели оценки. Это несколько усложняет восприятие классификации КР, однако делает ее более точной.
В целом, следует отметить, что подразделение на классы и уровни доказательности положений КР весьма условны, во многом совпадают, а применение той или иной классификации зависит от предпочтения авторов конкретных КР. Тем не менее, при попытках одновременного использования двух разных методов классификации выявляется как полное совпадение, так и существенное расхождение при классифицировании одних и тех же положений.
Качество КР
В настоящее время появляется все больше опасений по поводу качества, надежности и независимости КР. Несмотря на некоторое улучшение качества КР в последнее время, по мнению многих исследователей, в целом они не удовлетворяют понятиям доказательной медицины. Недавно появился документ PAGE (Publishing clinical prActice GuidelinEs) — рекомендации для написания КР от редакторов и рецензентов, подготовленный китайскими специалистами [176]. Среди недавно опубликованных КР, изданных крупными медицинскими сообществами, процент ссылок на крупные РКИ по-прежнему невысок и практически не изменился с 2008 по 2018 гг. Принципиально важно, что не более 15% рекомендаций класса I имеют уровень доказательства А. Отчасти это объясняется тем, что в КР стали намного чаще использовать анализ так называемых "big data" с применением новых статистических методов. Нельзя забывать, однако, что анализ таких данных относится к наблюдательному типу исследований, существенно уступающих по степени доказательств РКИ вследствие влияния смещающих факторов [177]. Не следует забывать также, что на некоторые злободневные для практической медицины вопросы просто не существует ответов в виде РКИ. Это косвенно свидетельствует о том, что проведение РКИ чаще всего спонсируется фармацевтическими компаниями, которые далеко не всегда заинтересованы проводить РКИ на актуальные для практической медицины темы.
Реальное соблюдение КР
Считается, что большинство врачей стремится соблюдать КР [178]. Однако часть врачей считает, что КР слишком категоричны и непрактичны, чтобы их использовать при лечении пациентов. По данным одного из исследований, таких врачей около 10%. Это было особенно характерно для врачей с опытом работы 25 лет и более [179].
Однако данные многочисленных исследований показывают, что в целом процент соблюдения КР весьма невысок. Причем эта тенденция характерна для стран с самым различным уровнем развития. Исследования, проведенные в США и Нидерландах, показали, что 30-40% больных, госпитализированных с острым коронарным синдромом, не получают помощи в соответствии с современными КР, при этом 20-25% назначаемых вмешательств не являются необходимыми или даже небезопасны [180]. В исследовании, проведенном в Швейцарии на больных СД 2 типа, поступавших в одну из клиник, было показано, что контроль уровня глюкозы у большинства больных не соответствовал современным КР [181]. Когортное исследование, проведенное у 438 больных в Испании, показало, что 61,4% не получают терапии в соответствии с КР [182].
Несмотря на создание компьютерных сетей и условий для быстрой доставки больных острым коронарным синдромом в госпиталь, КР в отношении проведения инвазивных вмешательств и назначения медикаментозной терапии выполняются далеко не всегда [183]. Об этом же свидетельствуют данные крупного регистра RESCA+31, проводившегося во Франции [184][185].
Причины несоблюдения КР
Причинам недостаточного использования КР посвящены многочисленные исследования. По данным анализа 76 исследований, в которых проводили опрос врачей, было показано, что барьеры на пути соблюдения КР могут возникать на самых разных этапах оказания медицинской помощи — на уровне одного врача и команды врачей, на уровне больного, на уровне организации медицинской помощи. При анализе систематических обзоров были выделены 6 основных факторов, объясняющих недостаточное соблюдение КР:
- Политические, социальные и культурные
- Факторы, связанные с конкретной клиникой и ее ресурсами
- Факторы, связанные с самими КР
- Факторы, связанные с медицинским персоналом
- Факторы, связанные с пациентом
- Факторы, связанные с врачами (отсутствие заинтересованности и врачей в выполнении КР[186].
Соблюдение КР — путь повышения эффективности терапии
Доступность современных КР позволила сделать вывод о том, что медицина превращается из "медицины, основанной на мнении" (opinion-based medicine) в медицину, основанную на доказательствах [187]. Неоднократно предпринимались попытки улучшить соблюдение КР и, тем самым, повысить качество терапии. В целом ряде наблюдательных исследований было показано, что соблюдение КР способствует улучшению качества лечения и положительно влияет на исходы заболевания. Так, в одном из таких исследований было продемонстрировано, что внедрение КР в реальную клиническую практику ассоциируется со снижением риска смерти через 30 дней и 1 год после перенесенного острого коронарного синдрома [188]. Этот результат объясняли в первую очередь увеличением частоты использования препаратов с доказанным действием.
Следует отметить, однако, что на сегодняшний день не существует убедительных доказательств в виде РКИ того, что соблюдение КР улучшает исходы болезни.
Недостатки КР
Не утихают дебаты о том, насколько совершенны КР и насколько их применение реально позволяет улучшить качество медицинской помощи. У КР есть целый ряд уязвимых точек. Во-первых, не всегда имеется достаточное количество надежных данных для того, чтобы сформулировать недвусмысленные рекомендации; во-вторых, всегда существует возможность манипулировать реально доступными данными доказательной медицины. Нередко КР разных сообществ противоречат друг другу.
Некоторые исследователи считают, что отсутствие независимости и непоследовательность некоторых КР значительно снижает их ценность для практического врача. КР далеко не всегда учитывают наличие сопутствующих заболеваний, вследствие чего их часто сложно использовать у мультиморбидных больных [189]. Специальных документов для лечения мультиморбидных больных не существует. Однако, поскольку мультиморбидность в первую очередь характерна для пожилых больных, рекомендации по их лечению обычно применяются и для больных с бóльшим количеством сопутствующих заболеваний.
Пожилые больные не всегда адекватно представлены в РКИ, поэтому многие вопросы, касающиеся особенностей терапии у этого контингента больных, в КР либо не указаны, либо упомянуты как имеющие меньший уровень доказательств. Существует мнение, что многие проблемы, связанные с лекарствами, у пожилых обусловлены тем, что для их лечения используют обычные КР, которые к ним в принципе неприменимы. Для этого стали использовать термин "не видящая возраста фармакотерапия" ("age-blind pharmacotherapy"). Вследствие этого для пожилых больных создаются специальные документы (см. ниже) по детализации диагностики и лечения. Следует подчеркнуть, что эти документы опираются, как правило, на значительно меньший уровень доказательств, чем классические КР. Это, однако, обычно обусловлено объективными причинами, о которых упоминалось выше [190].
Оценка качества КР
Неоднократно проводились исследования по оценке качества КР. В одном из таких исследований было показано, что большинство КР ACC/AHA основаны на невысоком уровне доказательств, как правило, соглашении экспертов (С), причем количество рекомендаций такого рода в последнее время возрастает [191]. Авторы этого исследования сделали вывод о том, что необходимо улучшить качество написания рекомендаций и расширить доказательную базу, являющуюся источником для их написания. Следует отметить, однако, что уровень доказательств С приходится использовать из-за простого отсутствия данных РКИ. Отмечено, также, что участники написания КР не всегда упоминают о существующем у них конфликте интересов, что иногда позволяет сомневаться в объективности некоторых изложенных в КР суждений [192].
Псевдодоказательная медицина
Данные доказательной медицины могут сознательно или несознательно искажаться. Сознательное искажение, как правило, происходит в интересах тех, кто участвует в процессе создания, производства и распространения лекарств. Безусловно, возможности манипуляции результатами РКИ в настоящее время ограничены целым рядом законодательных актов, нормативных документов, правилами GCP). Тем не менее, возможности манипулирования результатами РКИ и их интерпретации все же существуют. Авторы недавно опубликованной статьи в журнале British Medical Journal высказали мнение, что "практика доказательной медицины в последнее время была коррумпирована вследствие корпоративных интересов, нарушений регуляторных органов и коммерциализации академии" [193]. На Западе появился термин "Кey opinion leader" — KOL ("Ключевой лидер мнения"). Эти лидеры, по мнению некоторых авторов, представляют результаты спонсированных фармацевтическими фирмами РКИ на конференциях и симпозиумах, которые входят в программу непрерывного медицинского образования врачей, где они вместо критической оценки результатов РКИ представляют их в виде, удобном фармацевтическим компаниям.
Крупнейший современный специалист по доказательной медицине J. P. Ioannidis считает, что на всех этапах исследования — планировании, проведении, обработке результатов и их трактовке — существует возможность манипулирования [194]. Во многих исследованиях, опубликованных даже в ведущих медицинских журналах, не выполняется, по крайней мере, часть требований, предъявляемых к РКИ [195].
Способы манипулирования результатами РКИ разнообразны, один из них заключается в создании протокола, когда один препарат, как правило, препарат сравнения, ставится в невыгодные условия перед изучаемым препаратом. В качестве примера можно привести исследование PARADIGM-HF [196], в котором препаратом сравнения был классический эналаприл, продемонстрировавший отчетливое влияние на показатели смертности при лечении хронической сердечной недостаточности. Доза эналаприла в исследовании PARADIGM-HF была ограничена 20 мг/сут., хотя известно, что в исследовании CONSENSUS максимальная доза препарата эналаприла (которую получали около четверти больных) была в 2 раза выше (40 мг/сут.) [197]. Известное исследование ASCOT-BPLA было ошибочно прекращено досрочно из-за решения наблюдательного комитета, посчитавшего, что получено достаточное количество конечных точек. Последующий анализ не выявил достоверных различий в частоте достижения ПКТ между двумя видами лечения, что было неожиданно для исследователей. Тем не менее, неудачное по всем существующим критериям доказательной медицины исследование трактовалось как успешное для амлодипина, именно в таком контексте его рассматривали КР [198].
Нередко результаты в целом неудачных РКИ трактуют по анализу ВКТ [199], а также по анализу в подгруппах (см. выше) [200], что приводит к совершенно ошибочным выводам, которые, однако, вполне устраивают спонсировавшие исследования фармацевтические компании [201].
Выше уже упоминалось о том, что проведение метаанализов позволяет получать данные сомнительной клинической значимости, при этом метаанализы продолжают считаться "вершиной доказательной пирамиды".
Отдельно следует сказать о попытках подменить результаты РКИ анализом результатов наблюдательных исследований и крупных баз данных с помощью различных статистических методов, в частности с помощью псевдорандомизации [202]. Такой подход не имеет ничего общего с доказательной медициной, однако его результаты все чаще предлагают использовать для принятия клинических решений.
Проблемы комбинированной терапии сердечно-сосудистых заболеваний
Назначение нескольких ЛП уже давно является реальностью медицины. Комбинированная терапия может использоваться и при наличии одного заболевания, в основном, для воздействия на разные звенья патогенеза. Ситуация еще более усложняется, если у больного имеются сопутствующие одно или несколько заболеваний некардиологического характера. В итоге больной может получать более 10 ЛП (это называется полифармацией), что может создавать проблемы совместимости ЛП, а также ухудшать приверженность к их к приему. Особенно часто такие проблемы встречаются у пожилых больных. Старение населения сопряжено с повышением количества пациентов с выраженной коморбидностью и вынужденной полифармацией, поэтому межлекарственное взаимодействие становится все более серьезной проблемой [203]. Основные проблемы, связанные с полифармацией, рассматриваются ниже.
Взаимодействие лекарственных препаратов. Классификация
О взаимодействии двух ЛП говорят в том случае, когда эффект одного ЛС влияет или может повлиять на эффект, метаболизм или токсичность другого [204]. Результатом взаимодействия ЛП в составе комбинированной терапии могут быть [203]:
- аддитивность — эффект комбинации препаратов не превышает суммы эффектов отдельных препаратов, составляющих изучаемую комбинацию;
- синергизм — эффект комбинации препаратов больше, чем сумма отдельных эффектов всех препаратов, входящих в комбинацию;
- антагонизм — эффект комбинации препаратов слабее максимального из эффектов отдельных составляющих этой комбинации.
Следует помнить, что данные типы взаимодействия могут проявляться как в отношении основного терапевтического эффекта, так и в отношении побочных реакций препаратов. Последствия взаимодействия различных препаратов могут быть желательными и нежелательными, последние встречаются значительно чаще и основной акцент рассматриваемой проблемы делается на предупреждении возможных последствий нежелательного межлекарственного взаимодействия. Знание практическими врачами основных механизмов взаимодействия ЛП, а также использование доступных интернет-ресурсов и специальных компьютерных программ, направленных на помощь в принятии врачебного решения, позволят на этапе назначения выявить возможные нежелательные комбинации препаратов и снизить риск нежелательных последствий многокомпонентной медикаментозной терапии [203].
Основные виды взаимодействий ЛП
Лекарство может взаимодействовать с заболеванием (drug-disease interaction), т.е. оказывать отрицательное влияние на течение болезни, с другим лекарством (drug-drug interaction), с пищевыми продуктами, с биологически активными добавками, с алкоголем.
Основными механизмами межлекарственных взаимодействий являются фармакокинетическое и фармакодинамическое взаимодействие ЛС, а также комбинация этих двух видов взаимодействия. Кроме того, выделяют фармацевтическое взаимодействие препаратов, происходящее в условиях in vitro [205]. Фармакокинетическое взаимодействие является результатом изменений абсорбции, распределения, метаболизма и/или экскреции препаратов. Фармакодинамическое взаимодействие основано на сочетании фармакологического эффекта препаратов, в результате чего изменяется и результирующий терапевтический эффект [206].
Необходимо различать исследования, оценивающие потенциально опасные взаимодействия (таких исследований большинство), от исследований, оценивающих реальные последствия таких взаимодействий [207]. Потенциальные лекарственные взаимодействия обычно оцениваются в экспериментальных исследованиях (на лабораторных животных или здоровых добровольцах) с помощью фармакокинетических или фармакодинамических методов исследования. Источником информации о таких видах взаимодействия часто служат компьютеризированные программы, данные, заложенные в которые, к сожалению, нередко противоречат друг другу.
О частоте таких взаимодействий можно судить, например, по данным европейского исследования у 1601 пожилого больного, проживающего в 6 европейских государствах: у 46% больных было зафиксировано по крайней мере одно потенциально неблагоприятное взаимодействие, при этом у 10% больных это взаимодействие было расценено, как крайне опасное [208]. Похожие результаты были получены и в ряде других исследований. Эти данные следует интерпретировать с большой осторожностью по целому ряду причин. Во-первых, в разных исследованиях подходы к выявлению потенциально опасных комбинаций существенно различаются. Во-вторых, различаются способы получения этой информации. В-третьих, многие считающиеся опасными комбинации лекарств не имеют никаких доказательств их клинической значимости. Поэтому полученные результаты могут существенно переоценивать частоту неблагоприятных взаимодействий и преувеличивать клиническую значимость проблемы [209].
Следует понимать, что только клинические исследования могут дать реальную картину клинической значимости межлекарственных взаимодействий. Однако и в этом случае их трактовка может быть достаточно непростой, так как зависит от принятых в том или ином исследовании критериев неблагоприятного взаимодействия и способов его выявления.
Типичным примером является возможное взаимодействие между ИАПФ и аспирином у больных с ХСН. Результаты ряда исследований, как экспериментальных, так и клинических, проведенных в 90-х гг. ХХ в., дали основание предположить наличие отрицательного взаимодействия между этими препаратами и, соответственно, возможность ухудшения отдаленных исходов заболевания при совместном назначении ИАПФ и аспирина у больных ХСН. В дальнейшем эти данные не были подтверждены [210]. Однако метаанализ 8 крупных РКИ, опубликованный в 2002 г. и включивший 8 крупных РКИ, выявил возможность отрицательного влияния сочетания названных групп препаратов на исходы ХСН [211].
Опубликованный значительно позже вторичный анализ результатов исследования WARCEF не подтвердил отрицательного влияния аспирина на эффективность ИАПФ при ХСН. Таким образом, на сегодняшний день вопрос о возможности отрицательного влияния аспирина на исходы заболевания у больных, получающих ИАПФ, остается открытым. С точки зрения доказательной медицины неясно, чему доверять больше: результатам метаанализа или вторичному анализу РКИ [212].
Принципы и виды комбинированной терапии
Все возможные комбинации ЛП можно разделить на несколько групп [213]:
- установленные рациональные комбинации;
- возможные рациональные комбинации;
- возможные, но менее рациональные комбинации;
- нерациональные комбинации
- комбинации, рациональность которых требует уточнения.
Кроме того, комбинированная терапия может быть: свободной или фиксированной; полнодозовой и низкодозовой; двух-, трех- и более компонентной.
Идеальная комбинированная терапия должна отвечать ряду обязательных условий:
- безопасность и эффективность компонентов;
- вклад каждого из них в ожидаемый результат;
- разные, но взаимодополняющие механизмы действия.
Желательные и нежелательные комбинации
Несмотря на наличие информации о наиболее опасных межлекарственных взаимодействиях, единого общепринятого списка рациональных и нерациональных комбинаций ЛС не существует. В некоторых КР, но далеко не во всех, содержатся сведения о рациональных и нерациональных комбинациях отдельных ЛП. Так, данная информация доступна в КР по лечению АГ, вероятно, как наиболее частой сердечно-сосудистой патологии, встречающейся у большого количества пациентов с другими хроническими неинфекционными заболеваниями (ХНИЗ). В КР по диагностике и лечению АГ до 2013 г. приводилась схема возможных рациональных и нерациональных комбинаций основных антигипертензивных препаратов (АГП) [214]. В КР 2018 г. ESH и ESC комбинированная терапия позиционируется как основа лечения практически всех пациентов с АГ [215]. В этих рекомендациях приводятся ступенчатые алгоритмы назначения комбинированной антигипертензивной терапии при различных сердечно-сосудистых коморбидных состояниях (ИБС, ФП) с указанием рациональных комбинаций ЛП; отмечены рациональные комбинации АГП и те, которых следует избегать при ряде некардиальных коморбидных состояний (хронической обструктивной болезни легких, хронической болезни почек, онкопатологии).
Подобная информация приводится и в других КР по лечению пациентов с различными ХНИЗ, обычно в разделах, посвященных терапии коморбидных состояний: например, рациональные комбинации антитромботических препаратов у больных ИБС и ФП; сахароснижающих средств у пациентов с СД и сердечно-сосудистой патологией и др. [216][217]. В методических рекомендациях Минздрава России по профилактике, диагностике и лечению COVID-19 приводится таблица, в которой содержатся сведения о нерациональных комбинациях препаратов, использующихся для лечения COVID-19, с ЛП, используемыми для терапии других заболеваний (АГП, антиагрегантов)5.
Недостатком всех перечисленных выше ресурсов является дефицит информации о доказанной клинической значимости указанных в них неблагоприятных комбинаций. Кроме того, нередко данные разных ресурсов отличаются друг от друга.
Опасные комбинации
Отдельного понятия "опасные комбинации" в литературе не существует, однако можно выделить ряд комбинаций ЛП, при применении которых высока вероятность развития крайне серьезных неблагоприятных эффектов, вплоть до смертельных. К таким комбинациям можно отнести сочетание домперидона (противорвотного средства) и флюконазола (противогрибкового препарата), а также антибиотика меропенема с вальпроевой кислотой (противоэпилептическое средство). Описано увеличение вероятности госпитализаций при совместном применении варфарина и ибупрофена [218].
Особенно опасным может быть сочетание ЛП, способных увеличивать продолжительность QT-интервала на ЭКГ и за счет этого повышать вероятность возникновения смертельно опасных видов аритмий (желудочковой тахикардии по типу "пируэт", фибрилляции желудочков) и внезапной смерти. К таким ЛП относятся как сердечно-сосудистые препараты (антиаритмические препараты I и III классов), так и ряд препаратов, использующихся для лечения других заболеваний (в первую очередь антипсихотические препараты, антидепрессанты и антибиотики). Полный список ЛС, увеличивающих продолжительность QT-интервала доступен на сайте https://www.crediblemeds.org.
Понятно, что сочетание двух и более ЛП, обладающих способностью удлинять QT-интервал, многократно повышает риск внезапной смерти, в том числе у больных, не страдающих ССЗ [219]. Проблема сочетания ЛП, удлиняющих QT-интервал, приобрела особую значимость во время прошедшей пандемии COVID-19. Есть основания предполагать, что ряд внезапных смертей, зарегистрированных у больных с COVID-19, был следствием именно таких сочетаний лекарств, особую роль среди которых мог сыграть гидроксихлорохин.
Нежелательные лекарственные взаимодействия также рассматриваются как потенциально предотвратимые врачебные ошибки (см. ниже). С появлением электронной медицинской документации и электронных назначений надежды стали возлагать на программы, которые должны предупреждать делающего назначение врача о возможности взаимодействия с одним или более из принимаемых пациентом ЛП, однако в процессе назначения их часто игнорируют. Таким образом, нельзя рассчитывать на предотвращение всех нежелательных взаимодействий за счет использования электронной системы оповещений. Подробнее об опасных и нежелательных комбинациях будет сказано в разделе "Нерациональное назначение лекарств".
Фиксированные комбинации
Существуют разные способы использования комбинированной терапии. Два, три препарата и более можно назначать последовательно, постепенно титруя дозы компонентов. С клинической точки зрения такой способ наиболее оправдан, так как позволяет оценить эффект и переносимость каждого препарата в отдельности. В последнее время для упрощения процесса лечения появились так называемые фиксированные комбинированные препараты, содержащие два и более ЛП в одной таблетке [220].
Виды фиксированных комбинаций. Плюсы и минусы
Фиксированные комбинации могут быть как полнодозовыми, так и низкодозовыми, двух, трех- и более компонентными. Для создания фиксированных комбинаций всегда используются рациональные сочетания ЛП. Дополнительными требованиями к комбинированным препаратам являются отсутствие непредсказуемых фармакокинетических взаимодействий и оптимальное соотношение остаточного и максимального эффектов. Рациональный подбор компонентов создает предпосылки для назначения один раз в сутки препаратов, которые при монотерапии приходится применять два или даже три раза в сутки.
К достоинствам фиксированных комбинированных препаратов можно отнести следующие:
— простота и удобство приема для пациента;
— простота выписки препарата для врача;
— повышение приверженности пациентов к лечению;
— снижение риска использования нерациональных комбинаций;
К недостаткам фиксированных комбинаций следует отнести трудности в идентификации НЯ, отсутствие уверенности в необходимости применения всех содержащихся компонентов, т.е. риск полифармации.
Концепция полипила. Проблемы и перспективы
Концепция полипила появилась в 2003 г., когда N. J. Wald и M. R. Law на основании метаанализа рассчитали, что прием таблетки, содержащей комбинацию препаратов, доказавших свое влияние на исходы ССЗ, всеми людьми старше 55 лет приведет к снижению частоты сердечно-сосудистых осложнений на 80% [221]. Несмотря на скептическую оценку этой теории многими учеными, вскоре были созданы реальные формы полипила, содержащие разный набор ЛП. Так, в состав одного из вариантов полипила входили сразу 3 АГП в небольших дозах — ББ, тиазидный диуретик, ИАПФ, а также ацетилсалициловая кислота и статин. С ним было проведено 2 РКИ — TIPS, TIPS 3. В исследовании TIPS было показано, что у лиц без наличия ССЗ, но имевших хотя бы один фактор риска (средний риск), назначение полипила (в использованной форме он назывался поликапом) в целом хорошо переносилось и способствовало достижению целевых цифр АД и ХС ЛНП [222]. В исследовании TIPS-3 было продемонстрировано, что комбинированное назначение полипила в сочетании с аспирином у таких же больных способствовало более выраженному снижению частоты сердечно-сосудистых событий, чем плацебо [223].
В РКИ 3-й фазы SECURE включали больных, перенесших ИМ не более 6 мес назад. Больных разделили на 2 группы — получавших терапию, основанную на полипиле, и получавших обычную терапию. Назначение полипила, содержащего аспирин, рамиприл и аторвастатин, способствовало достоверно более выраженному снижению вероятности сердечно-сосудистых осложнений, чем назначение обычной терапии [224].
В настоящее время существуют также фиксированные комбинации АГП и гиполипидемических (статинов), двух различных гиполипидемических препаратов (статин+эзетимиб, статин+фибрат).
Полифармация
Проблемы, связанные с полифармацией, будут изложены в разделе "Проблемы, связанные с ЛП".
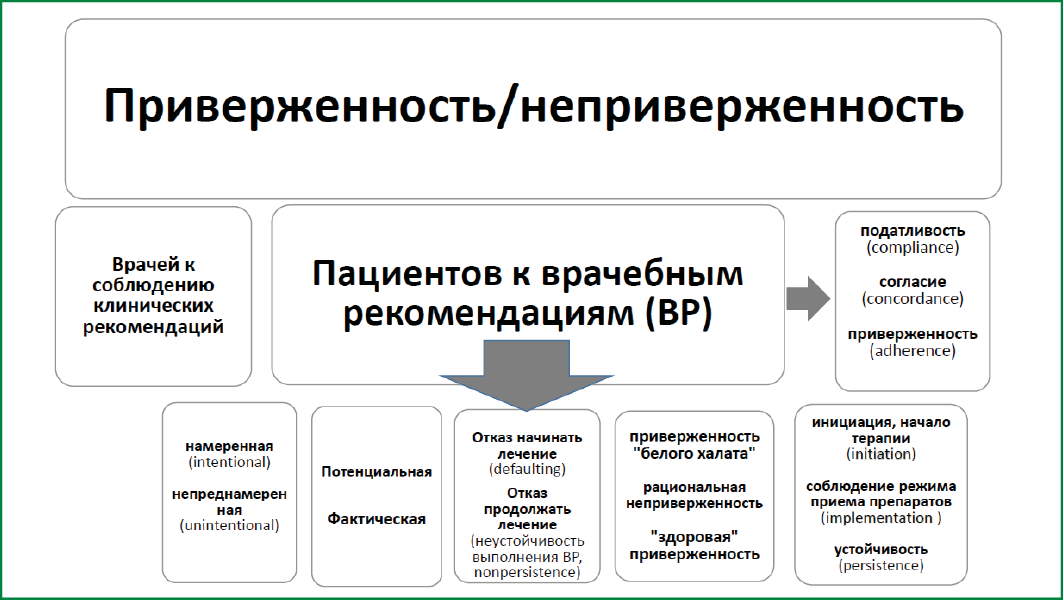
Рисунок 1. Терминология по проблеме приверженности (основано на [226])
Таблица 2. Прямые и косвенные методы определения приверженности к лечению (адаптировано [225][230][231])
|
Метод |
Преимущества метода |
Недостатки метода |
|
ПРЯМЫЕ МЕТОДЫ |
||
|
Непосредственное наблюдение за приемом препарата пациентом |
Самый точный метод при соблюдении определенных условий* |
Пациенты могут прятать таблетки во рту, имитируя прием препарата; метод непрактичен для рутинного применения |
|
Измерение уровня препарата или метаболита в крови |
Объективный |
Высокая стоимость. Возможны колебания активности метаболических процессов и динамика концентрации препарата (метаболитов); "приверженность белого халата" (улучшение приема препаратов перед визитом к врачу), которые могут дать ложное впечатление о приверженности |
|
Измерение биологических маркеров в крови |
Объективный; в клинических исследованиях его можно также использовать для плацебо-контроля |
Высокая стоимость, количественные испытания, необходим сбор биологических жидкостей |
|
Система мониторинга приема лекарственных препаратов (Ingestible Sensor System) |
Объективный; на данном этапе больше подходит для клинических исследований |
Высокая стоимость, сложность биоэтических вопросов, проблема конфиденциальности данных, мало подходит для рутинной клинической практики |
|
КОСВЕННЫЕ МЕТОДЫ |
||
|
Прямой опрос пациентов (direct questioning), сообщения пациентов |
Простой; недорогой; самый приемлемый метод в клинической практике |
Возможны ошибки при увеличении времени между визитами; пациент может легко менять данные |
|
Дневники пациента |
Способ вовлечения пациента в процесс лечения, что повышает приверженность |
Легко изменяются пациентом |
|
Опросники и шкалы |
Простой; недорогой; достаточно удобный в клинической практике |
Данные легко изменяются пациентом |
|
Подсчет таблеток, пустых блистеров (комплаенс) |
Объективный; количественный метод, который легко выполнять |
Пациент может легко изменить данные |
|
Частота выписывания и реализации пациентом новых рецептов, обеспечение пациента препаратом (PDC, MPR**) |
Объективный; легко получить данные |
Выписывание нового рецепта (и выдача лекарства) не эквивалентно приему препарата; нужна закрытая аптечная система (например, в странах с полным покрытием расходов пациентов на приобретение препаратов) при условии, что контроль осуществляется регулярно |
|
Оценка клинического ответа пациента (по общему клиническому состоянию больного) |
Простой; в целом, легко выполним |
На клинический ответ могут повлиять другие факторы, а не приверженность к приему лекарств |
|
Измерение физиологических маркеров (например, частоты сердечного ритма во время приема ББ, АД при антигипертензивной терапии и т.д.) |
Часто легко выполним |
Маркеры могут отсутствовать по другой причине (например, ускоренный метаболизм, низкая абсорбция, отсутствие ответа на лечение и др.) |
|
Электронный контроль препаратов (Medication Events Monitoring System (MEMS)) |
Точный; результаты легко поддаются количественной оценке; можно следить по способу приема препаратов |
Высокая стоимость; требует повторных визитов и загрузки данных из флаконов для препаратов; не всегда удобен для пациентов |
|
Если пациент ребенок — опрос лица, которое оказывает помощь, или учителя |
Простой, объективный |
Данные легко изменяются и могут искажать реальную ситуацию |
|
Примечания: * — метод непосредственного врачебного контроля перорального приема лекарственного препарата (ЛП) пациентом используется, главным образом, в условиях клинических исследований I фазы или в исследованиях биоэквивалентности ЛП, и включает ряд обязательных для выполнения пунктов: выдача пациенту ЛП, прием ЛП под наблюдением врача, последующий тщательный осмотр ротовой полости больного для контроля того, что препарат был проглочен; ** — PDC — proportion of days covered — метод реализуемости выписанных рецептов, MPR — medication possession ratio — метод учета полученных (приобретенных) пациентом ЛП. |
||
Таблица 3. Сравнительная характеристика опросников, рекомендованных для оценки приверженности у пациентов с различными нозологиями [229][232-242]
|
Опросник |
Количество вопросов |
Нозология, для которой разработан, валидирован/рекомендован |
Преимущества |
Недостатки |
|
Опросник |
Количество вопросов |
Нозология, для которой разработан, валидирован/рекомендован |
Преимущества |
Недостатки |
|
4-item Morisky Medication Adherence Scale (MMAS-4) |
4 |
АГ/различные ХНИЗ |
Лаконичный, валидированный |
Нет валидированного перевода на русский язык, невысокие показатели чувствительности и специфичности, оценивает только общую приверженность (общую поведенческую реакцию) |
|
8-item Morisky Medication Adherence Scale (MMAS-8) |
8 |
АГ/различные ХНИЗ |
Лаконичный, валидированный, высокие показатели чувствительности, специфичности |
Нет валидированного перевода на русский язык, запатентован и запрещен к использованию без покупки лицензии, для ряда ХНИЗ не подтверждены заявленные показатели чувствительности и специфичности, оценивает только общую приверженность |
|
Brief Medication Questionnaire (BMQ) |
7 основных |
различные ХНИЗ |
Лаконичный, валидированный, подтвержденные высокие показатели чувствительности, оценивает приверженность к конкретным ЛП, учитывает как пропуски, так и прием "лишних", нерекомендованных препаратов |
Нет валидированного перевода на русский язык, не очень простая система подсчета баллов в полной версии опросника (3 блока, 11 вопросов) |
|
The Self-Efficacy for Appropriate Medication Use Scale (SEAMS) |
21/13 (редуцированная версия) |
различные ХНИЗ |
Разработан и валидирован мультидисциплинарной командой с подтверждением высоких показателей чувствительности и специфичности для пациентов с различными ХНИЗ |
Нет валидированного перевода на русский язык, включает более 10 вопросов даже в редуцированной версии, сложная система подсчета баллов, что делает опросник времязатратным |
|
Medication Adherence Report Scale-5 |
5 |
Психические заболевания/психические и соматические ХНИЗ |
Лаконичный, валидированный, подходит для людей с психическими заболеваниями |
Нет валидированного перевода на русский язык, невысокие показатели чувствительности и специфичности, рекомендован, главным образом, для пациентов с психическими заболеваниями |
|
Medication Adherence Report Scale-10 (MARS-10) |
10 |
Психические заболевания/психические и соматические ХНИЗ |
Лаконичный, валидированный, подходит для людей с психическими заболеваниями |
Нет валидированного перевода на русский язык, невысокие показатели чувствительности и специфичности, рекомендован, главным образом, для пациентов с психическими заболеваниями |
|
Adherence to Refills and Medications Scale (ARMS) |
12 |
ИБС/различные ХНИЗ |
Валидированный для различных ХНИЗ, надежный, определяет барьеры приверженности |
Нет валидированного перевода на русский язык, включает более 10 вопросов |
|
Количественный Опросник Приверженности (КОП-25) |
25 |
АГ, СД/различные ХНИЗ |
Валидированный для различных ХНИЗ, русскоязычный. Наличие версий, адаптированных для различных категорий респондентов, в т.ч. для беременных, для частично дееспособных, для законных представителей недееспособных лиц и т.д. |
Большое количество вопросов, не очень простая система подсчета баллов, что затрудняет применение опросника в условиях реальной клинической практики |
|
Отечественный опросник приверженности |
4 |
АГ |
Валидированный, лаконичный, русскоязычный |
Предназначен только для пациентов с АГ, не выявлено значимой корреляции теста с динамикой АД |
|
Опросник "Уровень комплаентности" |
66 |
Различные ХНИЗ |
Валидированный русскоязычный опросник, позволяющий оценить психологические составляющие приверженности у пациентов с ХНИЗ: социальную, эмоциональную, поведенческую |
Очень большое количество вопросов, затрудняющее применение опросника в обычной клинической практике |
|
Шкала приверженности НОДФ (версия для оценки общей приверженности; модифицированная версия для оценки приверженности к конкретным ЛП) |
3 |
ИБС, СД, ФП/различные ХНИЗ |
Лаконичный, русскоязычный, валидированный для различных ХНИЗ, оценивает различные виды нарушения приверженности, приверженность к конкретным ЛП, определяет барьеры приверженности |
Вариант для оценки общей приверженности обладает менее удовлетворительными показателями чувствительности и специфичности, чем модифицированная версия для оценки приверженности к конкретным ЛП. |
Таблица 4. Мероприятия, способствующие повышению приверженности у пациентов и врачей (основано на [Lukina YuV, Kutishenko NP, Martsevich SYu и соавт. Methodological recommendations [225][231][245-247])
|
УСТРАНЕНИЕ БАРЬЕРОВ ПРИВЕРЖЕННОСТИ, СВЯЗАННЫХ С ПАЦИЕНТОМ И ЗАБОЛЕВАНИЕМ |
|
|
1. |
Подробное информирование пациента о его заболевании, методах лечения и контроля эффективности, о необходимости строгого соблюдения режима приема препаратов (доза, кратность, время, сочетание с пищей и напитками, длительность приема и т.д.). Получение данной информации от лечащего врача или в школах для пациентов с ХНИЗ (Школа для пациентов с ИБС, Школа для пациентов с СД, Школа для пациентов с бронхиальной астмой и др.) |
|
2. |
Составление приемлемого для пациента графика посещения врача, обсуждение способов связи с лечащим врачом |
|
3. |
Увеличение "автономии" пациента в отношениях врач-больной, с вовлечением пациента в процесс принятия решений, поощрение самоконтроля доступных показателей здоровья (уровень АД, глюкозы крови и др.), ведения дневников самоконтроля самочувствия, приема ЛП. |
|
4. |
Улучшение социальной поддержки пациента со стороны семьи, родных, друзей (при желании больного) |
|
5. |
Создание и укрепление положительной мотивации у пациента к поддержанию и восстановлению своего здоровья, предупреждение осложнений заболеваний с помощью лечения и хорошей приверженности к нему |
|
6. |
Использование различных систем напоминаний: программ в смартфонах, смс-оповещений, регулярных телефонных звонков автоматизированных систем оповещения, маркировки блистеров лекарств по дням недели, использование таблетниц с обозначением дней недели и времени суток, со встроенными электронными чипами, учитывающими прием лекарств и др. |
|
7. |
Совмещение приема лекарств с ежедневными бытовыми действиями: едой, чисткой зубов, бритьем и т.д., работающими в качестве напоминаний |
|
8. |
Стимуляция нелекарственного лечения (изменение образа жизни: отказ от вредных привычек, рациональное питание, регулярная физическая нагрузка, нормализация сна и т.д.) |
|
9. |
Повышение самоэффективности пациентов (веры в эффективность и успех достижения целей от реализации собственных действий) на основании информирования пациента и вовлечения его в процесс лечения и контроля его эффективности, безопасности (например, самоконтроль АД, уровень гликемии и т.д.) — внедрение принципов ответственного самолечения |
|
УСТРАНЕНИЕ БАРЬЕРОВ, СВЯЗАННЫХ С ВРАЧОМ |
|
|
1. |
Четкое определение целей лечения и способов контроля их достижения |
|
2. |
Создание доверительных отношений с пациентом, модели сотрудничества в отношениях врач-пациент путем грамотного, качественного, информативного, достаточного по времени консультирования больных |
|
3. |
Делегирование ряда полномочий и ответственности за проводимое лечение пациенту (внедрение принципов ответственного самолечения) |
|
4. |
Осознание риска низкой приверженности пациента при неэффективности назначенного лечения |
|
5. |
Адаптация лечения и поддержки приверженности к нуждам пациента |
|
6. |
Повышение собственного образования в отношении знаний современных КР, в том числе, по рациональной фармакотерапии |
|
УСТРАНЕНИЕ БАРЬЕРОВ, СВЯЗАННЫХ С ТЕРАПИЕЙ |
|
|
1. |
Стимулировать исключительно рациональное использование ЛП (назначение препаратов по показаниям, отказ от назначения "лишних" препаратов, не рекомендованных КР, к которым нет показаний или имеются противопоказания) |
|
2. |
Подбирать индивидуальные схемы приема препарата (идеально в отношении приверженности, но сложно осуществимо на практике: утренний, однократный прием) |
|
3. |
Выбирать экономически выгодные стратегии: фиксированные комбинации, дженериковые (аналоговые) препараты, делимые таблетки, упаковки с большим количеством таблеток и др. |
|
4. |
Упрощение режима приема лекарств (по возможности): минимизация числа таблеток и кратности их приема, устранение неудобств, связанных с приемом лекарств, — очень большие, сложно проглатываемые таблетки, горький неприятный вкус лекарств и др. |
|
5. |
Назначать пролонгированные препараты с минимумом побочных эффектов, отдавать предпочтение комбинированному лечению перед монотерапией в высоких дозах, фиксированным комбинациям перед свободными, что позволяет уменьшить количество принимаемых пациентом таблеток |
|
6. |
Применять комбинированную терапию, основанную на рациональных свободных и фиксированных комбинациях (последние предпочтительней) с целью улучшения приверженности; снижение полифармации при повышении эффективности и безопасности лечения, а также уменьшение клинической инертности врачей в отношении достижения целевых показателей эффективности терапии |
|
7. |
Учитывать стоимость лечения |
|
УСТРАНЕНИЕ БАРЬЕРОВ, СВЯЗАННЫХ С ОРГАНИЗАЦИЕЙ СИСТЕМЫ ЗДРАВООХРАНЕНИЯ |
|
|
1. |
Внедрение инноваций в процесс создания и использования КР: привлечение врачей в процесс разработки и обсуждения КР; проведение новых исследований для дальнейшего развития и улучшения КР |
|
2. |
Создание "работающих" КР, чему способствует ясность и языковая доступность, простота изложения, высокая доказательность, эффективность в достижении желаемых целей, удобство для использования в клинической практике и гибкость подходов (возможность индивидуализации) |
|
3. |
Обязательное документирование и регулярные обновления КР в свете введения новых достижений науки |
|
4. |
Повышение образовательного уровня врачей, в том числе по вопросам приверженности к лечению, ознакомление их с положениями КР, своевременное информирование об изменениях, внесенных в положения КР и официальных инструкций к лекарственным препаратам |
|
5. |
Обучение врачей применению КР в своей клинической практике, начиная со студенческой скамьи и на протяжении всей профессиональной карьеры |
|
6. |
Обмен информацией и сотрудничество между врачами одной и разных специальностей об опыте применения КР на практике, успехах, сложностях, согласии/несогласии |
|
7. |
Совершенствование информационных вспомогательных технологий, обосновывающих принятие верного врачебного решения на основании данных конкретного пациента (разработка компьютерных программ, обозначающих необходимые лечебные назначения согласно КР (с учетом имеющихся у больного заболеваний, их осложнений, противопоказаний) для подбора рациональной терапии с исключением нерациональных комбинаций и назначений |
|
8. |
Совершенствование системы медицинского страхования в ракурсе повышения заинтересованности врачей придерживаться КР на практике |
|
9. |
Улучшение доступности медицинской помощи для пациентов (в том числе, уменьшение времени ее ожидания) |
Приверженность назначенной терапии — необходимое условие эффективного лечения
Одним из значимых этапов проведения эффективной фармакотерапии и достижения ее целей является приверженность лекарственному лечению. В последнее время значимость этой проблемы постоянно растет, ей посвящается все большее количество публикаций.
Определение приверженности, терминология по проблеме
Несмотря на то, что, согласно определению ВОЗ, под приверженностью обычно подразумевают степень соблюдения пациентом врачебных рекомендаций6, в настоящее время данное понятие рассматривается шире и включает в себя не только приверженность пациентов, но и приверженность врачей к выполнению положений КР и официальных инструкций к медицинским препаратам [225].
Решение многих вопросов приверженности затрудняется тем, что на сегодняшний день отсутствуют единые терминология и дефиниция приверженности, общепризнанная классификация различных видов приверженности/неприверженности, нет "золотого стандарта" диагностики и надежных методов, повышающих приверженность к терапии, многофакторностью данной проблемы.
Терминология, классификация приверженности
Терминология по проблеме приверженности, преимущественно, англоязычна, символизирует переход от патерналистской к партнерской системе взаимоотношений врач-пациент, и в какой-то мере отражает вовлеченность пациента в процесс лечения: compliance (соответствие) — подразумевает пассивное выполнение пациентом врачебных рекомендаций, concordance (согласованность) — информирование и более активное вовлечение пациента, сотрудничество врача и пациента, adherence (приверженность) — наиболее часто используемый в научной литературе термин, который отражает степень соблюдения больным рекомендаций врача. В русском языке существует словосочетание — "приверженность (к) лечению", которое неверно с точки зрения лексической и семантической сочетаемости, однако применяется наиболее часто. Кроме него иногда используется калькированный с английского термин "комплаентность", который выглядит еще менее удачным.
Основной термин "приверженность" или связанный с ним антоним "неприверженность", часто сочетаются с различными уточняющими словами: "потенциальная", "фактическая", "первичная", "вторичная" и др., которые, как правило, отражают различные виды приверженности/неприверженности [225]. Основные выделяемые в настоящее время виды приверженности представлены на рис. 1.
Приверженность к терапии на различных этапах лечения называют фазами приверженности. Согласно данной классификации, поддержанной Европейским обществом по приверженности (ESPACOMP), выделяют три фазы: приверженность в начале терапии, соблюдение режима приема ЛП и устойчивость к терапии (initiation, implementation, and persistence) [227][228].
В зависимости от степени нарушения приверженности согласно Шкале приверженности НОДФ (Национального общества доказательной фармакотерапии) выделяют следующие виды: частичная приверженность — какие-либо изменения пациентом врачебных рекомендаций в отношении приема ЛП (дозы, кратности, времени и т.д.), частичная неприверженность — преждевременное прекращение приема препарата (нарушение фазы устойчивости к лечению), полная неприверженность — отказ начать терапию. При выполнении пациентом всех врачебных рекомендаций диагностируют полную приверженность лечению [229].
Диагностика приверженности
Существует несколько десятков методов диагностики приверженности, однако ни один из них не обладает приемлемым сочетанием надежности, достоверности результата и возможности применения в клинической практике. Все методы подразделяются на прямые и косвенные (табл. 2). Прямые более точны, объективны, однако применение их в реальной клинической практике часто затруднено или невозможно по этическим соображениям. Поэтому прямые методы обычно используются в научных исследованиях с обязательным оформлением всех этическо-правовых документов и получением информированного согласия пациента на применение данных процедур. Косвенные методы нередко подвержены субъективизму, легкому изменению и недостаточной достоверности, точности и надежности получаемых данных.
В нашей стране наибольшую распространенность среди косвенных методов оценки приверженности приобрели прямой опрос или интервьюирование пациентов врачом, использование различных опросников, оценка клинического ответа пациента. Реже используются подсчет таблеток и пустых блистеров и анализ дневников самоконтроля пациентов. Следует учесть, что последние методы оценки приверженности в реальной клинической практике возможны только с согласия больного.
Опросники по приверженности
При выборе опросника по приверженности рекомендуется отдавать предпочтение валидированным опросникам, разработанным в нашей стране либо имеющим валидированный перевод на русский язык. Желательно, чтобы в опроснике определялись барьеры приверженности, так как это позволяет наметить план мероприятий по повышению приверженности пациента к лечению. Следует также учитывать, для пациентов с какой нозологией был разработан и валидирован опросник, так как заявленные чувствительность и специфичность теста могут меняться при применении у больных с другой патологией. Кроме того, учитывая дефицит времени у лечащих врачей, особенно амбулаторно-поликлинического звена, рекомендуется отдавать предпочтение лаконичным опросникам, содержащим не более 10 вопросов, легким в обработке и интерпретации результата, не требующим обязательного наличия специальных технических приспособлений для проведения тестирования.
В соответствии с данными критериями для оценки приверженности к лечению могут быть рекомендованы несколько опросников, однако для ряда из них необходимы перевод на русский язык и валидация русскоязычной версии (табл. 3).
Следует подчеркнуть, что ни один из косвенных методов диагностики приверженности не лишен субъективизма, не является абсолютно точным и надежным. Поэтому для повышения точности определения приверженности больных к лечению, выявления ведущих барьеров приверженности для разработки наиболее эффективной персонализированной стратегии повышения приверженности терапии, рекомендуется одновременно применять несколько косвенных способов оценки приверженности. Например, одновременное применение дневников самоконтроля, подсчет принятых пациентом таблеток по пустым блистерам, опросники и др. не только повышает точность диагностики приверженности, но также может способствовать улучшению приверженности больных, т.к. неизбежно вовлекает пациента в процесс лечения и его контроля [225].
Влияние приверженности на исходы заболевания
Крупных исследований (а они могут быть только наблюдательными) по изучению влияния приверженности на исходы заболевания нет. В небольшом когортном исследовании у больных ХСН были выявлены статистически достоверные различия в выживаемости между приверженными и неприверженными к терапии основными ЛП [243].
Ведущие барьеры приверженности и способы их устранения
В докладе ВОЗ, посвященном вопросам приверженности к лечению, факторы, оказывающие влияние на приверженность, подразделяют на 5 групп: связанные с пациентом, с заболеванием, с врачом и организацией системы здравоохранения, с терапией и социально-экономическими факторами. Тем не менее, крупный анализ результатов РКИ и систематических обзоров выявил, что влияние большинства факторов приверженности остается мало изученным [244]. Это подчеркивает необходимость персонализированного подхода к оценке основных барьеров приверженности, позволяющего выбрать наиболее эффективные способы устранения барьеров каждой группы (табл. 4) в каждом конкретном случае. Таким образом, проблема приверженности к терапии в настоящее время является чрезвычайно актуальной, однако ее решение затруднено в связи с наличием целого ряда факторов. Значимость барьеров приверженности нередко индивидуальна и существенно варьирует у разных пациентов в разных ситуациях. Помимо приверженности больных к врачебным рекомендациям, большую роль в решении вопросов рациональной фармакотерапии играет и приверженность врачей к соблюдению КР. Максимально эффективной стратегией, по всей вероятности, должен быть путь воздействия на все или большинство выявленных барьеров приверженности.
Проблема выбора лекарственного препарата и проблема замены
Проблема выбора ЛП существует почти столько же, сколько существует медицина. В течение многих веков практическому врачу предлагался выбор из разных ЛП, среди которых он должен был выбрать одно. Правда, набор ЛП очень сильно менялся с течением времени. Но самое главное — менялись критерии выбора наиболее эффективного и безопасного препарата.
Этапы выбора ЛП
Можно выделить по крайней мере 4 этапа выбора ЛП [248]:
- Выбор группы ЛП
- Выбор препарата внутри группы (класса) ЛП
- Выбор лекарственной формы ЛП
- Выбор между оригинальным препаратом и дженериком
В идеале на всех 4 этапах выбор ЛП должен осуществляться с позиции доказанности, однако далеко не всегда это представляется возможным.
Класс-эффект
Существует мнение, что препараты, относящиеся к одному классу, обладают одинаковыми фармакологическими и клиническими свойствами, что дало основание заменять их друг другом. Это понятие стали называть класс-эффектом. Крайним выражением такой точки зрения является допущение перенесения данных, полученных для одного представителя класса, на других представителей этого же класса. Критики такого подхода называет эту точку зрения "me too drugs" (буквальный перевод — и мы такие же) [249].
Говоря о правомочности использования понятия класс-эффект, следует помнить, что до сих пор не существует строгого определения, какие признаки свидетельствуют об отнесении препаратов к одному классу. Среди таких признаков используют химическую структуру (например, дигидропиридиновые антагонисты кальция), механизм действия (например, ББ), влияние на какой-либо клинический или биологический показатель (например, антикоагулянты). Нередко один и тот же препарат может относиться сразу к нескольким классам (например, никорандил можно отнести к классам нитровазодилататоров, активаторов калиевых каналов, цитопротекторов). Понятно, что отсутствие четкого определения, что такое класс препаратов, делает весьма сомнительной практику бездоказательного перенесения свойств одного препарата на свойства другого, относящегося к тому же классу. Предложенная ВОЗ АТХ (Анатомо-терапевтическо-химическая) классификация препаратов не решает этой проблемы, она до сих пор нечасто используется как в научных исследованиях, так и в практической медицине [250].
Данные РКИ свидетельствуют о том, что разные представители класса (например, ИАПФ) могут различаться между собой по эффективности у одних и тех же категорий больных [251]. Поэтому с точки зрения доказательной медицины переносить данные, полученные при изучении одного представителя класса, на других представителей этого же класса, особенно когда речь идет о препаратах, влияющих на исходы заболевания, недопустимо. Как правило, доказанность действия ЛП при конкретном заболевании учитывается в официальной инструкции по его применению. Например, у ББ бисопролола нет показаний к назначению у больных, перенесших острый ИМ, так как не было проведено ни одного РКИ, где бы этот препарат изучался у такой категории больных. Соответственно, в официальной инструкции по применению этого препарата данное показание отсутствует.
Следует помнить, что КР далеко не всегда учитывают проблему выбора препарата внутри класса и часто уходят от того, чтобы называть, какой конкретный препарат оказался наиболее эффективным в определенной клинической ситуации. Это создает определенные трудности для практического врача и часто приводит к назначению ЛП, не имеющих доказательств эффективности в конкретных клинических ситуациях.
Проблема оригинальных и воспроизведенных препаратов (дженериков)
Под дженериком понимают воспроизведенный ЛП (т.е. его копию), содержащий то же самое действующее вещество, что и оригинальный ЛП [252]. FDA под дженериком понимает "ЛП, сравнимый с оригинальным ЛП по лекарственной форме, силе действия, способу назначения, качеству, фармакологическим свойствам и показаниям к назначению" [253]. Такое определение относится, по-видимому, только к идеальному дженерику. Дженерик содержит то же самое действующее вещество, что и оригинальный препарат, но может отличаться от него содержанием примесей, наполнителей и пр., поэтому неоднократно поднимались вопросы о том, может ли дженерик обеспечить терапию такого же качества, как и оригинальный препарат. Это вопросы как эффективности, так и безопасности воспроизведенного ЛП.
С 2014 г. после внесения очередных изменений в Федеральный закон 429 "Об обращении лекарственных средств" понятие оригинального препарата было заменено понятием референтного препарата, под которым понимается ЛП, "который впервые зарегистрирован в РФ, качество, эффективность и безопасность которого доказаны на основании доклинических и клинических исследований, и который используется для оценки биоэквивалентности и терапевтической эквивалентности, качества, эффективности и безопасности воспроизведенного или биоаналогового (биоподобного) лекарственного препарата". Введение такого определения объясняется, по-видимому, отсутствием в РФ некоторых оригинальных лекарственных препаратов. Например, оригинальный препарат варфарина никогда не регистрировался в РФ, соответственно референтным препаратом варфарина будет впервые зарегистрированный его дженерик. В значительном большинстве случаев понятие оригинального и референтного препарата совпадают.
Об эквивалентности дженерика оригинальному препарату в настоящее время судят по данным фармацевтической эквивалентности (как правило, изучают лишь некоторые ее показатели, в частности, обязательно проводят пробы на растворимость in vitro), а также по данным биоэквивалентности, под которой понимают фармакокинетическую эквивалентность оригинального препарата и препарата-дженерика.
Исследования биоэквивалентности проводят на ограниченном контингенте здоровых добровольцев с помощью рандомизированного перекрестного метода. В качестве показателей фармакокинетики оценивают максимальную концентрацию препарата (Cmax) и время ее достижения, а также площадь под кривой "концентрация-время", так называемую AUC (area under curve). Считается, что 90% значений AUC препарата-дженерика не должны выходить за пределы 80-125% от таких же показателей для оригинального препарата, если это условие соблюдается, то делается вывод и биоэквивалентности дженерика и оригинального препарата [253]. Кроме того, при производстве дженерика обязательно должны соблюдаться правила GMP.
Возникает вопрос, насколько данные фармацевтической и фармакокинетической эквивалентности могут гарантировать клиническую эквивалентность дженерика и какому уровню доказательств они соответствуют. На этот вопрос, по-видимому, могут дать ответ только данные клинических исследований, сравнивающих дженерики и оригинальные препараты. Такие исследования весьма немногочисленны. В журнале JAMA в 2009 г. был представлен метаанализ опубликованных клинических исследований по сравнению оригинальных препаратов и препаратов-дженериков, использующихся в кардиологии [254]. В целом результаты этого метаанализа выявили неплохое соответствие эффективности оригинальных препаратов и дженериков, хотя в отдельных исследованиях, включенных в метаанализ, было выявлено наличие существенных различий.
В 2016 г. были опубликованы результаты другого метаанализа, включившего 74 РКИ по сравнению клинической эффективности оригинальных препаратов и дженериков. Часть исследований проводились на здоровых добровольцах, лишь в некоторых продолжительность наблюдения была более 3 мес и оценивалось влияние на жесткие конечные точки. Тем не менее, в целом не было выявлено достоверных различий в эффективности и безопасности оригинальных препаратов и дженериков, что, по мнению авторов метаанализа, дает право врачам быть уверенными в том, что замена оригинального препарата на дженерик не повлияет на качество лечения [255].
В России было проведено многоцентровое РКИ (КАРДИОКАНОН) по сравнению эффективности и безопасности терапии, основанной на оригинальных препаратах, в сравнении с терапией, основанной на дженериках, у 120 больных со стабильно протекающей ИБС. Не было выявлено достоверной разницы между двумя группами больных во влиянии назначенной терапии на основные клинические (количество приступов стенокардии, потребность в приеме нитроглицерина), гемодинамические (уровень АД, частота сердечных сокращений) и биохимические показатели (уровень липидов, билирубина, трансаминаз). По частоте побочных действий группы больных также не различались между собой [256].
Безопасность фармакотерапии. Основные методы оценки безопасности лекарственных препаратов
Соотношение "эффективность-токсичность" лекарственного средства
Еще в XVI в. швейцарский алхимик, врач и философ Парацельс утверждал: "Всё есть яд и всё есть лекарство. Только доза делает лекарство ядом, а яд — лекарством". C начала XIX в. стало постепенно приходить понимание того, что достаточно давно использующиеся лекарства могут обладать весьма существенными побочными действиями [257]. В 1814 г. были описаны тяжелые побочные действия ртути, её препараты активно использовались в медицине для лечения сифилиса, в качестве диуретиков (меркузал), косметических мазей до конца ХХ в. В середине ХХ в. произошло несколько "лекарственных трагедий", заставивших задуматься о необходимости объективной оценки эффективности и безопасности лекарств.
Примерно в это же время стало понятным, что и качественные ЛП с доказанной эффективностью могут в определенных ситуациях оказывать побочные эффекты. Б. Е. Вотчал писал, что "... если заявляется об отсутствии побочных эффектов у того или иного препарата, следует задуматься, а есть ли у него какие-то эффекты вообще?" [258]. Ему же принадлежит крылатое высказывание: "…мы живём в век всё более безопасной хирургии и всё более опасной терапии". Утверждение, что "Любое вещество, способное оказать терапевтическое воздействие, также может вызывать нежелательные эффекты", сегодня признано во всём мире и встречается во множестве документов и статей [259]. Действительно, с одной стороны, активное развитие фармакологии и фармацевтической промышленности обогащает врачебный арсенал, а с другой — увеличивает опасность ятрогенных осложнений.
Разработка новых ЛП нередко базируется на первоначально установленных негативных свойствах исходных субстанций. Так миорелаксанты, без которых невозможна современная хирургия, по-прежнему называются "курареподобными" препаратами, т.е. обязаны своим появлением изучению свойств этого растительного яда. Сердечные гликозиды в XIX и XX вв. широко применялись при лечении большинства пациентов с сердечно-сосудистой патологией. Однако значительно раньше, еще в средневековье, отвар наперстянки применялся в качестве отравляющего вещества. Антикоагулянты, спасшие огромное количество жизней, одновременно являются основой дератизации. Наблюдение за геморрагическими осложнениями при тяжелой стрептококковой инфекции привело к появлению стрептокиназы и позволило совершить качественный прорыв в терапии коронарного тромбоза, а разработке ИАПФ, без которых немыслима кардиология сегодня, мир обязан изучению яда бразильской гадюки. Наконец, в неврологии и косметологии с успехом применяются препараты на основе ботулотоксина, двух чайных ложек которого достаточно, чтобы уничтожить население небольшой европейской страны.
Проблеме безопасного применения ЛС сегодня уделяется большое внимание, поскольку частота медикаментозных осложнений во всем мире нарастает, а смертность от них стабильно входит в топ-5 причин смерти все последние годы. По данным FDA в США число погибших от побочного действия принимаемых лекарств составляет от 100 до 200 тысяч человек ежегодно [260], а количество госпитализаций по этому поводу достигает 5,5-8,8 млн человек. Поэтому фармаконадзор (выявление, оценка и предотвращение нежелательных последствий применения ЛС) является бурно развивающейся отраслью здравоохранения во всём мире. С целью обеспечения сбора данных из максимального числа источников о возможных негативных последствиях применения лекарств при поддержке ВОЗ в 1968 г. была учреждена специальная программа по международному мониторингу ЛС — The WHO Programme for International Drug Monitoring (DPM). Для её реализации созданы глобальная (VigiBase) и европейская (EudraVigilance) базы данных, национальные базы данных, позднее база данных Евразийского экономического союза. Эти базы позволяют осуществлять сбор, обработку и анализ информации, поступающей с помощью спонтанных сообщений, а также от держателей регистрационных удостоверений и комитетов по безопасности, контролирующих конкретные клинические испытания ЛС.
В РФ этой проблемой занимается Федеральный центр мониторинга безопасности ЛС на базе ФГБУ "Научный центр экспертизы средств медицинского применения" Минздрава России. В научно-практическом журнале "Безопасность и риск фармакотерапии" центр регулярно публикует "Перечень нежелательных последствий применения лекарственных препаратов для медицинского применения". В него входят нежелательные явления, нежелательные лекарственные реакции и поствакцинальные осложнения; установленные неблагоприятные взаимодействия; нарушения применения, неэффективность и неблагоприятное воздействие на окружающую среду.
Следует отметить, что сравнительная оценка результатов мониторинга безопасности ЛС показала, что в РФ уровень репортирования о нежелательных реакциях пока еще ниже уровня, рекомендованного ВОЗ, и такового в странах с наиболее эффективной системой фармаконадзора (США, Швейцария) [261] .
Вопросы терминологии
В официальных документах, медицинской литературе и профессиональном сленге негативные проявления медикаментозной терапии обозначаются множеством понятий. "Нежелательное явление", "побочное действие/побочный эффект", "нежелательная/неблагоприятная/побочная реакция", "лекарственное/медикаментозное осложнение" — далеко неполный перечень определений, которые многие врачи считают синонимами. Это не совсем верно.
По определению экспертов ВОЗ корректным признается термин "неблагоприятная (нежелательная) лекарственная реакция — НЛР (adverse drug reaction — ADR)" Он обозначает "любую непреднамеренную и вредную для организма человека реакцию, которая возникает при использовании ЛС в рекомендуемых дозах с целью профилактики, диагностики, лечения заболеваний или для коррекции физиологических функций". Иными словами, при использовании этого определения предполагается причинно-следственная связь между развитием НЛР и принятым ЛС.
Более широким термином, также официально признанным экспертами ВОЗ, является "неблагоприятное/нежелательное явление — НЯ (adverse event — AE)". Под ним понимается любое неблагоприятное с медицинской точки зрения событие, возникающее во время лечения медикаментом и необязательно имеющее с ним причинно-следственную связь.
При проведении клинических исследований эффективности и безопасности ЛС по принципам ICH GCP исследователь, фиксируя НЯ, должен оценить степень вероятности связи этого события с исследуемым продуктом. Такая связь может расцениваться как определенная (certainly related), вероятная (probably related), возможная (possibly related), маловероятная (unlikely related), и, наконец, "НЯ не связано с исследуемым продуктом или связь не поддаётся оценке" (not assessable). Три первых определения не позволяют исключить связь НЯ с приёмом препарата и должны расцениваться как "неблагоприятная лекарственная реакция".
Кроме того, любое НЯ в клинических исследованиях классифицируется по его "тяжести" и "серьёзности". Степень тяжести НЯ в РКИ принято определять как легкую (mild), когда нежелательное явление не препятствует обычной активности пациента, средней тяжести (moderate), если НЯ мешает ежедневной деятельности пациента и тяжелую (severe), в случае, когда НЯ приводит к невозможности пациента заниматься обычной ежедневной деятельностью. В свою очередь "серьёзность" НЯ определяет группа четко сформулированных критериев. К серьёзным НЯ (serious adverse event — SAE) относится любое неблагоприятное клиническое событие, которое вне зависимости от принимаемого лекарственного препарата и его дозы:
— представляет угрозу для жизни (не потенциально, а в настоящий момент)
— требует госпитализации или ее продления
— приводит к стойкой или выраженной нетрудоспособности/ инвалидности
— проявляется врожденной аномалией/ пороком развития
— может быть расценено как "другое важное медицинское событие", требующее лечения.
Следовательно, "серьезное" НЯ не обязательно "тяжелое" и наоборот. Например, потеря пальца кисти не станет "серьёзным НЯ" для учителя географии, но явится таковым для скрипача-виртуоза в связи с утратой им профессиональной трудоспособности. В то же время, даже достаточно тяжело протекающая острая респираторная вирусная инфекция, не потребовавшее госпитализации, не будет расценено как "серьезное" НЯ.
В случаях, когда при приёме ЛС развивается НЯ, сведения о природе и тяжести которой отсутствуют в инструкции по медицинскому применению препарата (или в брошюре исследователя при проведении РКИ), ее принято обозначать как "непредвиденная нежелательная реакция Unexpected Adverse Drug Reaction", а в случаях соответствия её критериям "серьезного" НЯ — "предполагаемая неожиданная серьёзная неблагоприятная реакция (Suspected Unexpected Serious Adverse Reaction — SUSAR)".
В российских нормативных актах, затрагивающих сферу здравоохранения, а также в отечественной медицинской литературе привычен термин "побочный эффект/побочное действие ЛС". Он не входит в официальный глоссарий ВОЗ, касающийся фармаконадзора, и, скорее всего, связан с не совсем корректным переводом термина "adverse event". Тем не менее, этот термин представлен в Федеральном Законе "Об обращении лекарственных средств" 61-ФЗ от 12 апреля 2010 г. В статье 4 п. 50 Закона "побочное действие" определяется как "реакция организма, возникшая в связи с применением ЛП в дозах, рекомендуемых в инструкции по его применению, для профилактики, диагностики, лечения заболевания или для реабилитации"7. При первом знакомстве с Законом такая формулировка вызывает непонимание, поскольку реакция организма на приём любого ЛС и должна возникать, собственно, ради этого ЛП и назначается. Если строго следовать букве п. 50 Закона, то зафиксированная реакция в виде снижения АД у пациента с АГ после приёма АГП должна расцениваться помимо позитивного и как "побочное" действие этого препарата?
По-видимому, термин "побочный эффект ЛС" имеет право на существование, но не может быть синонимом "неблагоприятной", т.е. вредной для организма реакции. Говоря о НЯ, мы имеем в виду именно "реакцию организма", а используя термин "побочный эффект", подразумеваем свойство не организма, а ЛП. Более уместным представляется использование обсуждаемого термина для обозначения эффекта, который не соответствует целям лечения конкретного пациента. Отождествлять его с вредным (неблагоприятным, нежелательным) воздействием на организм некорректно. Можно привести массу примеров, когда одни и те же свойства ЛС выступают, как в качестве неблагоприятных, так и крайне необходимых. В частности, гипокалиемия, возникающая под действием петлевых диуретиков, традиционно относится к их НЯ. Однако при гиперкалиемии, состоянии отнюдь не менее опасном, способность фуросемида, торасемида, буметамида и других препаратов этой группы активно экскретировать калий является показанием к назначению. Выраженная артериальная гипотония как реакция на приём нитроглицерина у пациента со стенокардией — реакция, безусловно, неблагоприятная. В то же время при активной терапии отёка легких на фоне гипертонического криза, инфузия препарата позволяет управлять АД и разгружать малый круг кровообращение. Урежение частоты сердечных сокращений под действием ББ может выступать как в качестве цели терапии, так противопоказания к назначению. Наконец, в офтальмологии для осмотра глазного дна много лет используется классический побочный эффект М-холинолитиков — расширение зрачка.
Основные проявления и классификация неблагоприятного действия лекарственных средств
Нежелательные эффекты ЛС различаются по ряду параметров: механизму формирования, клинической картине, тяжести течения и прогноза. Они встречаются с различной частотой, требуют разной длительности фармакотерапии для возникновения. Соответственно, неблагоприятные воздействия лекарств на организм можно классифицировать по каждому из этих и ряду других признаков.
Исторически НЛР классифицировались как тип A или тип B. К первому из них относили предсказуемые реакции, связанные с известными фармакологическими свойствами ЛС. Такие реакции отличали высокая частота и низкая смертность. В свою очередь, реакции типа В представлялись как своеобразные или новые реакции, которые невозможно предсказать на основе известных фармакологических характеристик ЛС. Они встречались реже, но отличались высокой смертностью [262]. Позднее эта классификация была расширена сначала до 4, а затем до 6 типов.
Последняя версия такой классификации используется в программе ВОЗ по международному мониторингу ЛС. Она учитывает механизмы развития, время возникновения и клинические особенности неблагоприятных реакций и выглядит следующим образом [259].
Тип А — Dose-related (дозозависимые);
Тип В — Non-dose-related (дозонезависимые);
Тип С — Dose-related and time related (связанные с дозой и длительностью терапии);
Тип D — Time-related (отсроченные);
Тип E — Withdrawal (связанные с прекращением лечения);
Тип F — Unexpected failure of therapy (неожиданная/внезапная неудача терапии).
Каждый из типов характеризуется несколькими видами НЯ.
Виды НЛР
Тип А — дозозависимые (Dose-related)
Это наиболее частые, прогнозируемые (предсказуемые) реакции, связанные с фармакологическими свойствами ЛС. Они могут наблюдаться у любого пациента. К ним относятся:
- токсичность, первичная или связанная с передозировкой(гликозидная интоксикация, печеночная недостаточность при назначении парацетамола, ототоксичность и нефротоксичность аминогликозидов);
- собственно фармакодинамические нежелательные эффекты(головная боль при приёме нитроглицерина; сухой кашель, связанный с применением ИАПФ; кровоточивость, возникающая при лечении антиагрегантами и антикоагулянтами; развитие атриовентрикулярной блокады под действием ББ, верапамила; отёки голеней, возникающие при приёме дигидропиридиновых антагонистов кальция, аритмии, индуцированные антиаритмическими препаратами, ульцерогенное действие стероидов и нестероидных противовоспалительных препаратов (НПВП);
- вторичные нежелательные эффекты(электролитный дисбаланс на фоне лечения салуретиками, антибиотик-ассоциированная диарея, кандидоз, суперинфекция при использовании антибактериальных препаратов);
- НЛР, возникающие, вследствие лекарственных взаимодействий.
В контексте проблемы возникновения НЛР прежде всего следует учитывать однонаправленность нежелательных эффектов совместно принимаемых лекарств. На поверхности лежат нежелательные эффекты, обусловленные схожими фармакодинамическими свойствами препаратов в лекарственной комбинации. Так, риск гиперкалиемии возрастает при сочетанном применении ИАПФ/АРА и препаратов калия. Удлинение интервала QT под действием некоторых антибактериальных, противогрибковых, антигистаминных и психотропных средств способствует усилению проаритмического эффекта амиодарона. Анксиолитические свойства липофильных ББ могут усиливать действие транквилизаторов вплоть до развития тяжелой депрессии (в меньшей степени это свойственно гидрофильным препаратам — атенололу и надололу). При этом важно понимать, что одинаковые побочные проявления действия лекарств далеко не всегда служат противопоказаниями к их одновременному приёму. В первую очередь, назначение таких комбинаций требует тщательного контроля за лечением. Известно, например, повышение риска нарушений углеводного и липидного обмена при длительном совместном применении ББ и тиазидных диуретиков, однако такая комбинация может быть вполне оправдана у ряда пациентов. Риск гиперкалиемии, безусловно, возрастает при сочетанном применении ИАПФ/АРА и блокаторов минералокортикоидных рецепторов (спиронолактона, эплеренона), однако такая комбинация не только оправдана, но и рекомендована к применению у пациентов с выраженной ХСН. Наконец, применение двух и более антигипертензивных препаратов одновременно всегда чревато неоправданно выраженным снижением АД у части больных, но при этом является аксиомой в современных подходах к лечению АГ.
Вышеизложенное не распространяется на ЛС с одинаковой органной токсичностью. Сочетанного их применения практически всегда следует избегать.
Сложнее учитывать потенциальный риск развития НЛР при фармакокинетическом взаимодействии ЛС, когда один из препаратов может влиять на процессы всасывания, распределения, метаболизма и выведения другого. Это способствует изменению расчетной концентрации каждого из препаратов в плазме и тканях и может приводить как к уменьшению эффективности проводимой терапии, так и к повышению частоты НЛР. Так, усиление перистальтики желудочно-кишечного тракта (ЖКТ) под действием прокинетиков (метаклопрамида, домперидона), ограничивая время контакта препарата со всасывающей поверхностью, в большинстве случаев снижает его биодоступность, но лекарствам с быстрым всасыванием (пропранололу, диазепаму, ненаркотическим анальгетикам) позволяет раньше достичь тонкого кишечника и ускорить этот процесс. Это способствует быстрому достижению их максимальной концентрации в плазме, что ускоряет развитие эффектов как терапевтически необходимых, так и нежелательных. Напротив, ослабление моторики ЖКТ под действием антихолинергических ЛС, наркотических анальгетиков, блокаторов Н1-рецепторов и удлинение времени прохождения ЛС по ЖКТ увеличивает их биодоступность, повышая риск развития побочных эффектов. На уровень всасывания ЛС может влиять и ингибирование белка-транспортёра гликопротеина P. Последний "выбрасывает" из энтероцитов в просвет кишечника часть всасывающихся ЛС. Субстратами гликопротеина P являются верапамил, дигоксин, хинидин, лозартан, ранолазин, антиагреганты (блокаторы P2Y12 рецепторов) и антикоагулянты (гатраны и ксабаны), статины (симвастатин, аторвастатин). Совместное применение ингибиторов гликопротеина Р (амиодарона, азитромицина, каптоприла, карведилола, кларитромицина, дилтиазема с его субстратами приводит к более полному всасыванию и увеличению концентрации последних в крови, в результате чего повышается риск развития побочных эффектов [263].
Концентрация одного из совместно принимаемых препаратов может изменяться и вследствие их конкуренции за связь с белками-переносчиками в плазме крови. На уровне метаболизма на действие ЛС в организме может влиять его взаимодействие с препаратами, изменяющими функциональную активность изоферментов цитохрома P-450 (СYP-450). Последние участвуют в метаболизме более 50% ЛС у человека. В частности, с их участием происходит метаболизм таких сердечно-сосудистых ЛП как амлодипин, верапамил, дильтиазем, нифедипин, пропранолол, карведилол, лозартан, ирбесартан, кандесартан, аторвастатин, симвастатин, ловастатин, варфарин, клопидогрел, амиодарон, дронедарон, пропафенон, лидокаин и др. Под действием ингибиторов CYP-450, к которым относятся флавоноиды грейпфрута, некоторые противогрибковые препараты, макролиды, диклофенак, циметидин, ингибиторы протонной помпы (ИПП) (в большей степени омепразол) и др., снижается скорость метаболизма лекарств-субстратов и возникает риск их передозировки с развитием соответствующих проявлений. Для пролекарств, при окислении которых с участием изоферментов образуются активные метаболиты (клопидогрел, спиронолактон), ситуация обратная — ослабление интенсивности метаболизма влечёт снижение эффективности таких лекарств, а усиление под действием препаратов-индукторов CYP-450 ускоряет образование активных форм препарата. Список индукторов (как и ингибиторов) различных изоформ CYP-450 также обширен. Немаловажно, что многие кардиотропные ЛС (амиодарон, антагонисты кальция, статины) могут выступать в качестве субстратов по отношению к одной изоформе CYP-450 и одновременно являться ингибиторами другого изофермента цитохрома [264].
Фармакокинетические взаимодействия конкретных препаратов, на уровне всасывания, распределения, метаболизма (в том числе микросомального окисления с участием CYP-450) в большинстве случаев присутствует в официальной инструкции к применению препарата.
Говоря о взаимодействии лекарств, особенно фармакокинетическом и фармакодинамическом, необходимо отметить, что в большинстве своем они выявлены с помощью фармакокинетических методов исследования. Далеко не всегда ясно, насколько тот или иной тип взаимодействия клинически значим. Хорошим примером является доказанное фармакодинамическое взаимодействие клопидогрела и ИПП омепразола. В эксперименте на 20 здоровых добровольцах было продемонстрировано, что омепразол снижает эффект клопидогреля на агрегацию тромбоцитов [265]. Это послужило поводом сомневаться в целесообразности совместного использования клопидогреля и омепразола у больных, принимающих двойную антиагрегантную терапию. Правда, в рекомендациях AHA в 2013 г. было записано, что "ИПП, чаще всего омепразол, могут влиять на метаболизм клопидогреля, в результате может уменьшаться его эффект "in vivo", однако нет оснований думать, что это фармакодинамическое взаимодействие трансформируется в ухудшение клинических исходов [266]. Точку в этом споре поставили результаты РКИ COGENT, показавшие, что среди больных, получающих аспирин и клопидогрель, назначение ИПП существенно снижало вероятность желудочно-кишечных кровотечений. При этом значимого взаимодействия между клопидогрелем и омепразолом при оценке влияния на вероятность возникновения ПКТ выявлено не было [267].
Другим примером клинической значимости выявленных особенностей метаболизма клопидогрела является генетически обусловленная невосприимчивость к этому препарату за счет полиморфизма гена CYP2C19*2. Это дало повод говорить о возможности клинической неэффективности клопидогрела у некоторых больных и получило отражение в инструкции по применению этого препарата. Анализ в подгруппе исследования TRITON-TIMI 38, показавший, что эффективность клопидогреля (в отличие от прасугреля) значительно ниже у больных с полиморфизмом гена, еще более подтвердил эти опасения [268]. Стали считать, что у больных, идентифицированных как слабые метаболизаторы CYP2C19, риск сердечно-сосудистых событий значительно выше и что для них надо рассматривать альтернативные варианты лечения.
Однако клиническая значимость этого довода была подтверждена далеко не во всех исследованиях. Так, в исследовании TAILOR-PCI терапия, выбранная на основе генотипирования P2Y12-ингибитора, не различалась по влиянию на исходы заболевания через 12 мес. (сердечно-сосудистая смерть, ИМ, инсульт, тромбоз стента, выраженная повторная ишемия) [269]. Следует отметить, что в других исследованиях терапия, основанная на генотипировании P2Y12-ингибиторов, давала определенный результат в отношении снижения основных сердечно-сосудистых осложнений, но не влияла на частоту кровотечений [270].
Тип В — дозонезависимые (Non-dose-related)
Это менее частые, непредсказуемые НЛР. Они не зависят от фармакологических свойств ЛС. В основе НЛР этого типа лежат индивидуальные особенности организма — аллергия или генетически обусловленные нарушения в ферментных системах. К ним относятся:
- индивидуальная лекарственная непереносимость — НЯ, вызываемое препаратом в терапевтической/субтерапевтической дозе (шум в ушах при приёме ацетилсалициловой кислоты или триметазидина, развитие острой почечной недостаточности на фоне терапии ИАПФ). Следует отметить, что индивидуальные реакции на любой ЛП разнообразны и часто парадоксальны;
- идиосинкразия — реакции, детерминированные наследственными дефектами ферментных систем (гемолитическая анемия при приёме фенацетина, ацетилсалициловой кислоты, антиоксидантов у пациентов с дефицитом глюкозо-6-фосфатдегидрогеназы без связи с иммунологическими реакциями или "серый синдром" — рвота, цианоз и в дальнейшем расстройство кровообращения, приводящие к смерти при назначении хлорамфеникола пациентам с дефицитом глюкуронилтрансферазы);
- реакции гиперчувствительности (аллергические/иммунологические), связанные с вовлечением иммунологических механизмов. Подобно идеосинкразии они не зависят от дозы, отличаясь от неё участием иммунной системы в развитии процесса. К ЛС, наиболее часто вызывающим аллергию, относятся белковые препараты (вакцины, сыворотки), полипептиды (инсулин, тромболитики), гаптены в первую очередь антибиотики — бета-лактамы, а также сульфаниламиды, нестероидные противовоспалительные препараты, местные анестетики, препараты йода, витамины и множество других. Проявления этих реакций многочисленны, разнообразны и подробно описаны в соответствующих руководствах. Принято выделять несколько типов реакций гиперчувствительности:
I — реакции немедленной гиперчувствительности, или анафилаксии. Они связаны с повышением продукции IgE, дегрануляцией тучных клеток с высвобождением гистамина, серотонина и лейкотриенов. Клинические проявления этого типа варьируют по тяжести от небольших кожных проявлений (крапивницы) до развития анафилактического шока;
II — цитотоксические (цитолитические) реакции, связанные с высокой продукцией цитотоксических IgG и IgM и реакцией связывания комплемента. Проявляются гемолитической анемией, гранулоцитопенией, тромбоцитопенией;
III — иммунокомплексные реакции, обусловленные образованием иммунных комплексов, включающих IgG. Эти реакции проявляются поражением различных тканей с развитием артрита, васкулита, нефрита, миокардита, гепатита и др. Известен синдром так называемой "лекарственной волчанки", описанный при длительном лечении метилдопа, атенололом, гидролазином, каптоприлом, пропафеноном, прокаинамидом, а также другими ЛС, не относящимися к сердечно-сосудистым;
IV — реакции замедленной гиперчувствительности. Возникают в сенсибилизированном организме при повторных контактах с аллергеном. Наиболее частое проявление — контактный дерматит, развивающийся при применении кремов и мазей (в кардиологии это могут быть кремы, с антитромботическими ингредиентами).
Некоторые аллергические реакции не удаётся классифицировать, их механизмы не изучены, не удаётся воспроизвести такие реакции в эксперименте у животных;
- псевдоаллергические реакции (неиммунологические). Клинически такие реакции могут имитировать любой из вышеобозначенных типов аллергии, однако иммунная система в их формировании не участвует. Такие НЛР возникают при высвобождении из тучных клеток гистамина, серотонина и лейкотриенов. Из кардиотропных ЛС известным либерализатором этих медиаторов является ацетилсалициловая кислота.
Тип С — реакции, связанные с дозой и длительностью терапии (Dose-related and time-related)
К реакциям этого типа относятся:
- лекарственная зависимость — непреодолимая потребность в повторных приёмах препарата с целью улучшения самочувствия или преодоления явлений лишения (абстиненции). Преимущественно касается психотропных препаратов в первую очередь опиоидов. В кардиологии лекарственная зависимость была в своё время была отмечена при применении комплексных препаратов, включавших в свой состав барбитураты (корвалол, валокордин). Диагностика и лечение лекарственной зависимости является прерогативой наркологии и описывается в соответствующих руководствах;
- толерантность — снижение ответа на неоднократно используемый препарат.
Известно снижение антиангинальной активности нитратов длительного действия из-за насыщения специфических рецепторов гладкой мускулатуры сосудов и компенсаторной активации нейрогуморальных вазоконстрикторов. Эффективность салуретиков, главным образом петлевых, может снижаться вследствие гипонатриемии. Известно "ускользание" гипотензивного эффекта ИАПФ у некоторых пациентов, которое связывают с активацией альтернативных (без участия АПФ) путей конверсии ангиотензина I в ангиотензин II;
- кумулятивные эффекты, связанные с длительным применением препарата. Развитие таких реакций характерно для ЛС с медленной элиминацией. Чаще всего связано с бесконтрольным приёмом лекарств пациентом (классический пример — гликозидная интоксикация);
- гормональные нарушения возникают при воздействии ЛС на эндокринную систему, подавлении или стимуляции выработки гормонов (гинекомастия при длительном лечении спиронолактоном, каптоприлом, анаболиками; амиодарон-ассоциированные поражения щитовидной железы). Хорошо известны множественные нежелательные эффекты длительной терапии глюкокортикоидами от расстройств менструального цикла до развития болезни Иценко-Кушинга.
Тип D — отсроченные реакции (Time-related)
- канцерогенные эффекты. С позиций доказательной медицины в настоящее время отсутствуют убедительные свидетельства способности сердечно-сосудистых препаратов стимулировать канцерогенез. Повышение риска развития злокачественных опухолей установлено для ряда других ЛС, в частности препаратов мышьяка, фенацетина, эстрогенов и их комбинаций с прогестероном, иммунодепрессантов и даже некоторых собственно противоопухолевых препаратов [271]. Вместе с тем, после обнаружения связи препаратов раувольфии с развитием рака молочной железы, применение каждого класса кардиотропных средств сопровождается дискуссиями об их возможной канцерогенности. В разное время в литературе приводились данные о том, что прием ББ ассоциирован с увеличением частоты развития рака легких, применение антагонистов кальция — с раком в целом, а тиазидных диуретиков — с раком прямой кишки и карциномой почек. В абсолютном большинстве случаев такой риск развития злокачественных новообразований низок и исчезает после использования в статистическом анализе поправок на сопутствующие факторы [272].
В начале XXI в. активно обсуждалась возможность статинов стимулировать опухолевый рост, однако крупные метаанализы такой связи не выявили [273][274]. Имеются противоречивые данные о потенциальной канцерогенности сартанов. В 2010 г. в Lancet Oncology были опубликованы результаты метаанализа I. Sipahi и соавт., которые вызвали большой резонанс в медицинском сообществе. На выборке (n=61950) пациентов, участвовавших в крупных РКИ по изучению эффективности и безопасности сартанов, было продемонстрировано, что применение АРА на 1-2% увеличивает риск развития рака по сравнению с группой контроля [90]. В противовес этому мнению появились обзоры и метаанализы, которые подобный вывод опровергали. В дискуссии вокруг канцерогенности этого класса препаратов преобладает мнение экспертов, считающих, что убедительных доказательств способности сартанов стимулировать опухолевый рост на сегодня не получено [275].
Важно, что ни в одном из РКИ по изучению эффективности и безопасности сартанов частота развития рака не заявлялась в качестве ПКТ. Выводы о такой опасности АРА получены либо при наблюдательных исследованиях в когортах, либо ретроспективно (post hoc) на основе анализа всех зафиксированных НЯ. Такой анализ в признанной иерархии доказательств в медицине не относится к достаточно убедительным. Тем не менее, группа авторов во главе с I. Sipahi продолжает отстаивать свою точку зрения и в 2022 г. публикует результаты очередного метаанализа, в котором связывает возможную канцерогенность сартанов с их кумулятивным эффектом [276].
Так или иначе, сегодня ни один из мировых регуляторов официально не предупреждает врачей и пациентов о повышенном риске онкопатологии, связанном с лечением АРА II. В любом случае явная польза от использования этого класса ЛС значительно превышает потенциальные риски;
- мутагенные эффекты — способность ЛС вызывать изменения генетического аппарата в половых клетках на стадии их формирования, а также в клетках эмбриона для кардиотропных препаратов не установлена;
- тератогенные эффекты. Безопасная лекарственная терапия беременных представляет отдельный обширный раздел клинической фармакологии. Ни один препарат не может быть зарегистрирован без оценки его влияния на развитие плода. Это влияние может возникать на любом из этапов беременности, приводить к гибели плода или формированию множественных врождённых пороков развития, нарушениям функции органов и систем новорожденного. Воздействие тератогенных веществ на ранних этапах органогенеза проявляется эмбриопатией и в большинстве случаев гибелью зародыша. Воздействие в поздних стадиях развития — структурной и функциональной незрелостью органов несовместимых с жизнью плода (ранняя фетопатия) или поражением нормально заложенных и развившихся органов (поздняя фетопатия). Общепринятой является классификация FDA, которая все ЛС делит на 5 категорий, в зависимости от потенциального тератогенного риска.
Следует отметить, что полноценные РКИ в популяции беременных крайне малочисленны в силу ряда причин, в первую очередь, этических, и данные о тератогенности большинства препаратов получены только в экспериментах с животными и наблюдательных исследованиях. Но в любом случае при терапии беременной пациентки следует назначать только абсолютно показанные ей ЛП, стараться минимизировать их количество, дозы и, по возможности, продолжительность приёма. В период беременности абсолютно противопоказаны ИАПФ и АРА, следует избегать назначения амиодарона и пропафенона (во всяком случае длительного и в больших дозах), при необходимости назначения ББ отдавать предпочтение метопрололу, ацебуталолу и пиндалолу. Варфарин может вызывать кровоизлияние в мозг у плода даже при терапевтических значениях международного нормализованного отношения (МНО) у пациентки. Вся известная информация о возможности назначения того или иного ЛС при беременности в обязательном порядке включается в официальную инструкцию по применению препарата.
Тип E — связанные с прекращением лечения (withdrawal)
- синдром отмены — реакция организма, возникающая в ответ на прекращение действия ЛП и выражающаяся в ухудшении состояния больного. Возникает чаще при одномоментной полной отмене ЛС, которое принималось достаточно долго. Наиболее распространен в психофармакологии. Однако описано возникновение синдрома отмены и при прекращении приема таких групп препаратов как нитраты, ББ и ряда других.
Как правило, в качестве примера приводится абстинентный синдром при отмене опиатов, проявляющийся интенсивными психическими, соматовегетативными и неврологическими нарушениями (одновременно может быть классифицирован и как "лекарственная зависимость").
К синдрому отмены относится также прогрессирование заболевания после прекращения приёма ЛС, для терапии которого они изначально назначались. При этом у пациента могут появиться симптомы, которых не было отмечено ранее, а состояние значительно ухудшиться по сравнению с таковым до лечения. Так, тяжесть синдрома отмены при длительной терапии глюкокортикоидами варьирует в зависимости от сохранности функции коры надпочечников. В лёгких случаях он проявляется слабостью, потерей аппетита, миалгиями, возобновлением симптомов основного заболевания. В тяжёлых возможно развитие так называемого "аддисонического криза" (рвота, коллапс, судороги, развитие острой сердечной недостаточности и гибель пациента, если экстренно не введены глюкокортикоиды). Хорошо известно возобновление приступов стенокардии, повышение АД, развитие аритмий, тремора и других симптомов симпатикотонии при абортивном прекращении приёма ББ. Такие проявления связаны с повышением плотности и чувствительности β-рецепторов в ответ на длительное подавление влияния норадреналина на симпатическую нервную систему препаратами этого класса.
Синдром отмены может возникать и на фоне постоянного приёма препарата, в том случае, если последний достаточно быстро выводится из организма или если перерыв между приёмами доз препарата неоправданно велик. При этом негативные симптомы возникают в промежутках между приёмами очередных доз ЛС, их принято называть феноменом рикошета (rebound effect) или феноменом раннего отрицательного последействия (клонидин, препараты нифедипина короткого действия, трансдермальные формы нитратов).
Тип F — неожиданная неудача терапии (Unexpected failure of therapy)
Этот тип возникает при назначении препарата по показаниям и в терапевтических дозах. К этой группе следует относить случаи резистентности или толерантности (недостаточного эффекта) и рефрактерности (полного отсутствия ответа) на стандартную, хорошо апробированную медикаментозную терапию. Принято различать "мнимую" рефрактерность, при которой отсутствие ответа на лечение обусловлено неправильны дозированием, низкой биодоступностью ЛС или антагонистическим взаимодействием с другим назначенным препаратом, и рефрактерность "истинную" — полное отсутствие эффекта от препарата с хорошей биодоступностью, при применении его в максимально возможной дозе. В кардиологии хорошо известен феномен "резистентной артериальной гипертензии", при котором применение основных терапевтических стратегий — назначение комбинаций из 2-4 представителей основных классов антигипертензивных ЛС в оптимальных (или максимально переносимых) дозах — не вызывают снижения уровня АД до целевых значений. При этом неадекватный контроль АД должен быть подтвержден амбулаторным и домашним мониторингом и исключена псевдорезистентность (плохой комплайнс) и симптоматическая АГ.
К этому типу НЛР также можно отнести парадоксальный эффект, противоречащий известным фармакологическим свойствам ЛС (развитие гипертензивного криза при внутривенной инфузии винпоцетина, возбуждение при назначении седативных лекарств). Приступы стенокардии при приеме нитратов, антагонистов кальция, ББ, вплоть до развития ИМ и внезапной смерти могут быть отнесены к типам E и F в равной степени).
К типу А относится около 75% всех случаев НЯ, к типу В — более 20%, но этот тип сопровождается максимальной летальностью, на долю же остальных типов приходится менее 5% НЛР.
Классификация НЛР по частоте
По частоте (по отношению к числу назначений) НЛР определяются как "очень частые" (>10%), "частые" (от 1 до 10%), "нечастые" (от 0,1 до 1%), "редкие" (от 0,01 до 0,1%), "очень редкие" (<0,01%), и частота неизвестна (по имеющимся данным определить частоту не представляется возможным).
Классификация НЛР по распространенности и локализации
Поскольку одно ЛС может вызывать несколько типов НЛР, в официальных инструкциях по применению препарата чаще принято использовать клиническую классификацию, которая делит все негативные воздействия ЛС на
- общие реакции (анафилактический шок, геморрагический синдром, лихорадка);
- поражение конкретных органов и систем:
— центральной и периферической нервной (нарушение поведенческих и когнитивных функций, вегетативные расстройства);
— сердечно-сосудистой (нарушения ритма и проводимости сердца, ортостатическая реакция, токсический миокардит);
— бронхолёгочной (астма, плеврит, пневмонит);
— кожи и слизистых (крапивница, синдром Лайелла, синдром Стивенса-Джонсона, феномен Артюса);
— опорно-двигательного аппарата (миопатия, миастения, рабдомиолиз, артрит, остеопороз);
— желудочно-кишечного тракта (диспепсия, лекарственные язвы)
— печени (лекарственный гепатит, печеночная недостаточность);
— почек (интерстициальный нефрит) и др.
Классификация НЛР по течению
- острые формы — возникающие в течение первых 60 мин после приёма ЛС (анафилактический шок, ангионевротический отёк, тяжёлый бронхоспазм, острая гемолитическая анемия, тошнота и рвота, вазомоторный ринит);
- подострые формы — развивающиеся через 1-24 ч после приёма ЛС (крапивница, сывороточная болезнь, аллергические васкулиты, колит и антибиотик-ассоциированная диарея, агранулоцитоз и тромбоцитопения);
- латентные формы — возникают через 48 ч и позднее после приёма ЛС (лекарственная экзема, проявления органотоксичности).
Классификация НЛР по тяжести клинического течения
- Реакции лёгкой степени (покраснение кожи, зуд, сонливость, извращение вкуса). Такие реакции обычно исчезают при снижении дозы препарата или прекращения его приёма, они редко требуют специального лечения;
- Реакции средней степени тяжести (экзематозный дерматит, моно- или полиартрит, токсикоаллергический миокардит, гипертермия, электролитный дисбаланс). Они требуют отмены ЛС и медикаментозной коррекции неблагоприятного эффекта;
- Реакции тяжёлой степени — состояния, угрожающие жизни (анафилактический шок, синдром Лайелла, гемолитическая анемия, псевдомембранозный колит, острая почечная недостаточность). При появлении таких НЛР, препарат-провокатор немедленно отменяется, а пациенту проводится интенсивная терапия, как правило в стационаре.
- Летальные реакции (внезапная смерть или исход реакций тяжелой, редко среднетяжелой степени).
Летальные исходы от приёма ЛС чаще всего возникают вследствие:
- желудочно-кишечных кровотечений и осложнений пептических язв (глюкокортикоиды, НПВП, антитромботические препараты);
- других кровотечений (те же + цитостатики);
- апластической анемии и агранулоцитоза (хлорамфеникол, цитостатики, препараты золота, НПВП);
- поражения печени (среди 200 ЛС, способных вызвать поражение данного органа, наиболее часто упоминают противотуберкулёзные и психотропные средства, цитостатики, тетрациклин);
- анафилактического шока, (антибиотики, главным образом бета-лактамы, белковые препараты, местные анестетики;
- поражения почек (при использовании НПВП, аминогликозидов);
- снижения резистентности к инфекциям вследствие применения ЛС, обладающих иммуносупрессивным эффектом (цитостатики, глюкокортикоиды).
Во всем мире в качестве ведущей причины смерти от НЛР с большим отрывом лидируют опиаты.
Факторы риска развития НЛР
Уязвимые группы пациентов в отношении возможного развития НЛР достаточно хорошо известны. Медикаментозные осложнения наиболее часто возникают в группах:
— детей раннего возраста (недоношенных и новорождённых),
— пожилых лиц,
— женщин в период беременности,
— пациентов с указанием на наличие медикаментозных осложнений в анамнезе,
— пациентов с нарушениями биотрансформации и экскреции ЛС (патологии печени, почек)
— больных, длительно получающих медикаментозные препараты (отсроченные НЛР),
— пациентов, получающих более 4 ЛС одновременно. Неконтролируемое взаимодействие особенно опасно при наличии у этих ЛС однонаправленных нежелательных эффектов,
— лиц, получающих лечение препаратом с узким "терапевтическим окном".
Причинами повышенного риска могут служить приём лекарств в сочетании с алкоголем (усиление гепатотоксичности), а также использование препаратов с нарушенными сроками хранения, препаратов низкого качества и фальсификатов [16].
В частности, известно, что регистрация дженериков не требует проведения отдельных клинических испытаний их эффективности и безопасности. При установленной фармацевтической и фармакокинетической эквивалентности его действующего вещества оригиналу на дженерик автоматически экстраполируются и другие свойства бренда, в том числе установленный перечень НЛР. Однако помимо действующей субстанции (качество которой может варьировать у разных производителей), в воспроизведённых препаратах может содержаться ряд примесей, влияющих на профиль их безопасности.
Нельзя не отметить, что повышению частоты нежелательных реакций способствует ряд "немедицинских" факторов. Риск их развития однозначно повысили принятые в ряде стран решения о сокращении сроков экспертной оценки и ускорении процесса регистрации новых лекарств. Стремление как можно раньше обеспечить население высокоэффективными ЛС одновременно увеличивает появление на фармацевтическом рынке ЛС с недостаточно изученной безопасностью. К тому же, в России достаточно распространена практика самолечения, что вкупе с часто свободным отпуском рецептурных ЛС во многих регионах безопасности лекарств отнюдь не способствует.
Методы выявления побочных эффектов лекарственных средств
Оценка безопасности ЛП в РКИ
Поскольку приоритет безопасности фармакотерапии обозначен во всех руководствах по использованию лекарств, выявление и оценка нежелательных реакций каждого препарата начинается уже на стадии его доклинического изучения (in vitro, эксперименты с участием животных), продолжается в каждой фазе РКИ и не прекращается до вывода ЛС из обращения.
Первые сведения о потенциальных угрозах при использовании ЛС у человека получают в ходе рандомизированных контролируемых испытаний. Их проведение регламентируется международным этическим и научным стандартом планирования, проведения, документального оформления и представления результатов исследований с участием человека в качестве субъекта под названием "надлежащая клиническая практика" (ICH GCP). Последняя версия этого документа вступила в силу 17.06.2017. Международным Советом по гармонизации технических требований к фармацевтическим препаратам для человека подчеркивается, что эту версию следует интерпретировать в комплексе с другими руководствами ICH по проведению клинических исследований. Одновременно в РФ при проведении клинических исследований ЛС руководствуются Федеральным Законом об обращении лекарственных средств — 61-ФЗ, от 12.04.2010 № 61-ФЗ, ГОСТом 2005 и приказом Минздрава России от 1 апреля 2016 г. № 200н "Об утверждении правил надлежащей клинической практики".
В РКИ I фазы оценивается безопасность ЛС для здорового человека, а в трёх последующих — в целевых группах пациентов. Протокол каждого конкретного РКИ предусматривает особенности алгоритма выявления НЯ и форме предоставления информации о нем. Важно еще раз подчеркнуть, что в РКИ под НЯ понимается любое отклонение в состоянии здоровья пациента вне зависимости от его связи с назначенным препаратом. В качестве НЯ фиксируется появление каждого нового симптома или диагноза нового заболевания, обострение уже имеющейся хронической патологии, а также изменение функциональных и лабораторных показателей, если они соответствуют критериям "серьезных" НЯ, требуют временной отмены или прекращения приема исследуемого препарата, назначения лечения для их коррекции, повторного анализа или проведения дополнительного обследования.
В любом случае на исследователя возлагается задача подробно описать суть НЯ, оценить его тяжесть, серьёзность, возможную связь с приёмом изучаемого продукта и максимально быстро сообщить о нём. При соответствии НЯ категории "серьёзного" такое сообщение должно быть отправлено не позднее 24 ч с момента получения информации о развитии события. Исследователь должен принять решение об отмене изучаемого продукта либо о продолжении его приёма, назначить при необходимости дополнительное обследование и терапию, направленную на устранение НЯ. В последующий период исследователь осуществляет наблюдение за НЯ, вплоть до его завершения. В случаях, когда НЯ не завершается к окончанию исследования, длительность наблюдения за ним определяется протоколом РКИ. Обычно это наблюдение продолжается не менее 30 сут. и касается главным образом СНЯ. Варианты исхода нежелательной реакции принято определять следующими терминами:
— НЯ явление завершилось без последствий
— НЯ завершилось с последствиями
— НЯ продолжается
— наступила смерть в результате НЯ
— наступила смерть, возможно связанная с НЯ
— наступила смерть, не связанная с НЯ
— исход НЯ неизвестен.
Все сведения о НЯ заносятся в первичную документацию, индивидуальную регистрационную карту пациента и другие документы, определяемые протоколом РКИ. Сумму таких сведений объединяет "Брошюра исследователя". С регистрацией ЛС и вводом его в обращение брошюра исследователя является основой для создания "Официальной инструкции по применению препарата".
Оценка безопасности ЛП в наблюдательных исследованиях
Наблюдательные исследования играют определенную роль в выявлении побочных эффектов ЛС. Среди них особую роль необходимо отвести клиническим регистрам, в которые включаются достаточно представительные группы больных и которые могут наблюдаться неограниченно долго [138]. Из других видов наблюдательных исследований многие авторы отдают предпочтение исследованиям по типу "случай-контроль". Именно в исследованиях этого типа были выявлены такие специфические побочные действия ЛП как способность ингибиторов обратного захвата серотонина вызывать кровотечения из верхней части ЖКТ, способность гормонозаместительной терапии вызывать рак молочной железы, способность антипсихотического препарата оланзопина провоцировать развитие СД [78].
Текущий контроль безопасности лекарственной терапии (лекарственный мониторинг)
По завершении РКИ сбор сведений о негативных эффектах ЛС осуществляется несколькими методами, основным из которых является "метод спонтанных сообщений". Суть его заключается в добровольном предоставлении практическими врачами информации о предполагаемом НЯ ЛС в соответствующие структуры органа фармаконадзора. Эти сообщения подаются в форме заполненного бланка-извещения о нежелательной реакции, содержащего необходимые сведения для верификации таких сообщений. Алгоритм действий врача и форма бланка сообщения определяются Приказом Росздравнадзора от 15.02.2017 № 1071 (ред. от 16.07.2020) "Об утверждении Порядка осуществления фармаконадзора", "Руководством по организации и функционированию центров по фармаконадзору" и методическими рекомендациями "Алгоритм взаимодействия участников системы фармаконадзора по выявлению и работе со спонтанными сообщениями". К достоинствам метода следует отнести его простоту и то, что он позволяет учитывать информацию о всех зарегистрированных ЛС (в регионе, стране) и во всех группах пациентов. Он даёт возможность отдельно оценить частоту и структуру НЯ, вызываемых рецептурными и безрецептурными препаратами, а также при амбулаторном и стационарном лечении. Важно, что метод спонтанных сообщений не ограничен сроками специальных исследований лекарства.
К его недостаткам следует отнести известную долю субъективизма при оценке НЯ врачом и невозможность выявления отсроченных НЛР. Кроме того, метод не позволяет установить истинную частоту негативных реакций из-за низкого показателя регистрации этих реакций даже в странах с отлаженной системой фармаконадзора [277]. Следует отметить, что реальная практика свидетельствует о том, что практические врачи очень редко сообщают о выявленных ими НЯ. Это объясняется целым рядом причин, но главной, по-видимому, является та, что практические врачи не обучены основным принципам их выявления, часто неспособны отличить НЯ от признаков обострения течения заболевания.
В дополнение к методу спонтанных сообщений существуют другие способы контроля — дополнительными постмаркетинговыми исследованиями (IV фаза РКИ) и исследованиями типа "случай-контроль", длительным наблюдением в когортах, рецепторным мониторингом и др. Наконец, периодически публикуются результаты метаанализов крупных РКИ, которые post hoc оценивают частоту и выраженность НЛР в ранее проведённых клинических испытаниях.
Как в ходе клинических исследований, так и при дальнейшем мониторинге безопасности ЛС каждое вновь выявленное негативное изменение в состоянии пациента должно быть оценено с позиции его возможной связи с назначенным медикаментозным лечением. С целью верификации такой связи (или её отрицания) наиболее удобно использовать шкалу Наранжо. Шкала включает 10 вопросов, ответ на каждый из них оцениваются в баллах, общее количество которых позволяет судить о такой связи.
Представляет интерес тот факт, что некоторые установленные фармакодинамические эффекты ЛС, которые в РКИ первоначально были отмечены как побочные, впоследствии могут быть переоценены, отнесены к позитивным, в результате чего кардинально меняется основная концепция применения препарата. Известен пример с силденафилом, показания к применению которого проделали путь от лечения стенокардии до устранения эректильной дисфункции. Повышенная кровоточивость, десятилетиями наблюдавшаяся при лечении воспалительной патологии салицилатами, трансформировала показания к приёму ацетилсалициловой кислоты, сделав аспирин самым широко применяемым антиагрегантом.
Профилактика НЛР
Предупреждение неблагоприятного воздействия лекарств на организм фактически вытекает из изложенной выше информации о факторах риска, механизмах их формирования и клинических проявлениях. С целью минимизации медикаментозных осложнений при назначении каждого препарата следует:
- Соотносить риск и пользу его применения для конкретного пациента на основании известной информации о его фармакологических свойствах.
- По возможности избегать назначения ЛС с известной органной токсичностью пациентам с уже имеющимся поражением соответствующих структур.
- Учитывать негативные стороны взаимодействия всех принимаемых пациентом препаратов, не назначать одновременно ЛС с однонаправленными НЛР.
- Информировать пациента о побочных проявлениях действия ЛС, выделить симптомы, появление которых требует немедленного прекращения его приёма и обращения к врачу. Предупреждать также о нежелательности сочетания назначенного лекарства с рядом пищевых продуктов, алкоголем, воздействиями внешней среды.
- В некоторых случаях применять "терапию прикрытия", например назначить ИПП при длительном лечении антиагрегантами.
- Контролировать приверженность, разъяснять пациенту необходимость строгого соблюдения режима назначенной фармакотерапии
Следует отметить, что по мере накопления сведений о НЛР с помощью регистров и спонтанных сообщений для ряда препаратов, периодически пересматривается соотношение риска и пользы при их использовании. Появляются новые данные о дополнительных нежелательных эффектах традиционных ЛС, требующие особой осторожности при назначении. В частности, список таких препаратов ежегодно обновляет и публикует выходящий во Франции журнал "Prescrire". В 2022 г. этот список представлен 105 международными непатентованными названиями лекарств (МНН) [278]8.
Проблемы, связанные с лекарственными препаратами
Термин "Проблемы, связанные с лекарствами" (ПСЛ) появился в 1980 г. K. Ghose, изучив причины поступления больных в одну из многопрофильных клиник, пришел к выводу, что 8,8% всех госпитализаций обусловлены ПСЛ [279]. Под ПСЛ понимают "проблемы, возникающие у конкретного больного, которые фактически или потенциально вмешиваются в желаемые терапевтические исходы" (определение Pharmaceutical Care Network Europe (PCNE), 1999). Во время работы PCNE в январе 1999 г. была предложена классификация ПСЛ — Drug Related Problems (DRPs). Эта классификация регулярно обновляется, причем документ адаптируется для применения в разных странах [280]. Последнее обновление этого документа состоялось в 2020 г.
На сегодняшний день существует не менее 10 классификаций ПСЛ, среди которых в Европе чаще всего используется классификация PCNE. Следует отметить, что все эти классификации обладают определенными недостатками, не всегда доказана их воспроизводимость, далеко не всегда они опираются на данные доказательной медицины [281].
ПСЛ подразделяют на внутренние (intrinsic) и внешние (extrinsic). К внутренним ПСЛ относятся проблемы, связанные с врачом (ошибки назначения, нерациональное назначение), проблемы, связанные с распределением лекарств (ошибочный пациент, ошибочное время назначения, ошибочная доза и пр.), а также проблемы, связанные с больным (плохая приверженность к назначенному лечению) [282]. К внешним ПСЛ относятся НЛР, которые подробно были описаны ранее.
ПСЛ можно классифицировать по клиническим последствиям. К типу А относят ПСЛ, когда ошибка была сделана, но вовремя выявлена и не была реализована. К крайнему типу относится категория Е, когда в результате ПСЛ больной умер [283]. Существует множество описательных исследований, в которых изучается частота и типы ПСЛ, как правило, в масштабах одной клиники [284]. В одном из таких исследований показано, что большинство ПСЛ были связаны с лечащим врачом, а также с пациентом; существенно реже встречались ПСЛ, связанные со средним медицинским персоналом [285].
В ряде зарубежных работ показана роль пациента в возникновении ПСЛ. Она включает плохую осведомленность о существующих заболеваниях, незнание всех назначенных ЛП, а также плохую приверженность назначенному лечению. Был разработан алгоритм определения риска, связанного с ЛП (The Drug-Associated Risk Tool, DART), предназначенный для выявления у госпитализированных больных повышенного риска ПСЛ, нуждающихся в консультации клинического фармаколога. Этот алгоритм был валидирован по возможности отделять больных с низким и высоким риском ПСЛ [286].
Алгоритм включал полный лекарственный анамнез, диагноз больного, лабораторные данные, структурированный опрос пациента. Оценка медикаментозной терапии включала скрытые и точные критерии нерационального назначения ЛП, в каждом случае оценивалось соотношение пользы и риска. В наблюдательном исследовании была продемонстрирована польза структурированного интервью с пациентом, которое является частью подробного анализа медикаментозной терапии. Такое интервью позволяют выявить до одной трети всех причин ПСЛ, в основном связанных с недостаточной информированностью пациента и с неточностями в документации [287].
РКИ, оценивающие эффект влияния на потенциальные ПСЛ, немногочисленны. Они выполнены на относительно небольшом количестве больных и часто строятся по типу прагматических исследований. ПКТ в этих исследованиях не являются "жесткими". В одном из таких исследований изучали вклад критериев PROMPT-QoL в выявление ПСЛ и роль одобрения врачом рекомендаций клинического фармаколога в отношении качества жизни больных. Использовали простой слепой рандомизированный контролируемый метод. Включено 286 больных с разными заболеваниями. Выявлено, что применение PROMPT-QoL-критериев, одобрение врачом рекомендаций клинического фармаколога положительно влияет на частоту ПСЛ и улучшает исходы заболевания (в отношении качества жизни) [288]. РКИ, оценивавших влияние вмешательства клинического фармаколога на более жесткие ПКТ, не проводилось.
Медицинские ошибки
Единого определения медицинской ошибки не существует. Медицинские ошибки могут трансформироваться в ПСЛ. Не следует путать медицинское и юридическое понимание медицинской ошибки. В настоящее время в законодательстве РФ и большинства других стран понятие медицинской ошибки отсутствует.
В целом под медицинской ошибкой понимают незлоумышленное заблуждение врача в ходе его профессиональной деятельности9. R. E. Ferner и соавт. под медицинской ошибкой понимали "неуспех лечебного процесса, который приводит или потенциально может причинить вред пациенту [289]. Медицинские ошибки могут возникать на любой стадии (выбор лекарства, его хранение, выдача больному и пр.), а значит, являются не только результатом действия врача, но и другого медицинского персонала. N. Ramadanov и соавт. под медицинской ошибкой понимали любое предупреждаемое событие, которое может привести или приводит к нерациональному назначению ЛП (см. ниже), может нанести вред больному, сделанное на любом этапе лечения и включает назначение ЛП в отсутствие показаний, в неправильной дозе, неправильном пути введения, неназначение препаратов с доказанной эффективностью в определенной клинической ситуации, неадекватную замену препарата внутри класса, назначение ненужных лекарств [290].
Согласно данным одного из наблюдательных исследований, при обследовании 882 больных у 26,42% была обнаружена по крайней мере 1 ошибка назначения ЛП. Чаще всего ошибки назначения встречались при применении сердечно-сосудистых препаратов, антибиотиков и гастроэнтерологических препаратов [291]. В другом исследовании идентифицировали врачей, чаще всего допускающих медицинские ошибки. Авторы этого исследования считают, что выявление врачей, наиболее часто назначающих потенциально нерациональные комбинации, может увеличить безопасность терапии, особенно у пожилых больных [292].
- Nguen сформулировал "правило 6" (The rule of six rights)[293] позволяющее минимизировать медицинские ошибки. Это правило включает:
— Назначение правильного лекарства;
— Назначение в правильной дозе;
— Использование правильного способа введения;
— Правильное время приема;
— Назначение "правильному" больному;
— Использование правильной документации.
По последствиям медицинские ошибки делят на потенциально фатальные, потенциально серьезные, потенциально значимые и потенциально незначимые. Для предотвращения медицинских ошибок H. Lavan и соавт. [293] рекомендуют:
- Образование врачей;
- Согласование назначений разных врачей. Фиксация всех ЛП, которые принимает пациент. Согласование всех новых назначений с ранее используемыми ЛП;
- Участие клинического фармаколога в назначениях ЛП;
- Контакт врача и пациента;
- Использование специфических алгоритмов контроля качества назначений: критерии BEERS, STOPP/START критерии, Индекс MAI и др. (см. ниже).
Нерациональное назначение лекарственных препаратов
Под нерациональным назначением лекарств (ННЛ) понимают назначение лекарств, несущее в себе потенциальный риск недостаточной эффективности или побочных эффектов, в то время как существуют варианты более эффективного или более безопасного лечения [294]. ННЛ также называют неспособность достичь оптимального качества лечения [295]. ННЛ можно рассматривать как один из видов ПСЛ, в ряде случаев оно выливается в медицинские ошибки.
ННЛ в первую очередь объединяет такие понятия как недолечивание (underprescribing), неправильное лечение (misprescribing) и перелечивание (overprescribing) [296]. G. A. Assiri и соавт. к ННЛ относят применение лекарств, которое несет в себе риск НЛР, в то время как имеется более эффективное или более безопасное ЛС для лечения этого же заболевания, более частое или более длительное назначение ЛП, чем клинически показано, применение ЛС, взаимодействующих между собой, применение противопоказанных ЛС, неприменение или недостаточное применение ЛС с доказанным действием, которые показаны, но не назначаются по иррациональным причинам [297].
Нарушения функции печени и почек, другие связанные с возрастом нарушения метаболизма, увеличивают риск ННЛ, поэтому этот термин чаще применяется у пожилых больных. Систематический обзор, охвативший 19 исследований, установил, что частота ННЛ у пожилых больных составляла, в среднем, 20,5% [298]. В понятие ННЛ у пожилых больных часто также вкладывают полифармацию, назначение антихолинергических и седативных препаратов (которые у пожилых больных часто дают побочные эффекты), а также так называемый каскад назначения (prescribing cascades) — назначение ЛП для лечения побочных эффектов других ЛС [299].
Следует иметь в виду, что понятие ННЛ используется в первую очередь у пожилых больных, что, в первую очередь, связывают с наличием у них мультиморбидности. Между тем, трудно отрицать, что аналогичные проблемы могут возникать (хотя и с меньшей частотой) и у больных более молодого возраста.
Критерии ННЛ
Критерии ННЛ начали разрабатывать с 90-х гг. ХХ века. К настоящему времени их больше 10, принципы их формирования достаточно сильно различаются между собой. Главной особенностью этих критериев является относительно невысокий уровень доказательств включенных в них положений. Ниже приводится список основных критериев ННЛ:
- Критерии BEERS (Бирса) (последняя версия 2023 г.), предназначены для пожилых пациентов;
- STOPP/START (последняя версия от 2023 г.), критерии для пожилых пациентов;
- Критерии PROMPT (последняя версия от 2014 г.), предназначены для больных любого возраста;
- PIM-check от 2017 г., предназначен для всех больных;
- Medication Appropriateness Index (версия от 2013 г.), предназначены для любого возраста;
- PRISCUS List (версия от 2023 г.), предназначена для пожилых больных;
- Критерии FORTA (версия от 2021 г.), предназначены для пожилых пациентов.
Критерии ННЛ и КР
Не следует путать КР и критерии ННЛ. Первые в основном излагают способы диагностики и лечения конкретной болезни в целом, основываясь, в первую очередь, на данных доказательной медицины. Критерии ННР предлагают подходы к оценке качества лечения конкретного больного, учитывая все существующие у него заболевания и их индивидуальные проявления, а также все принимаемые им ЛП. Иными словами, КР определяют, как лечить болезнь, а критерии ННЛ — как лечить больного.
Различия разных критериев ННЛ
Каждый из критериев ННЛ обладает определенными преимуществами и недостатками. Нередко между ними встречаются определенные противоречия. Критерии STOPP/START отличаются от других тем, что позволяют определять не только ситуации, когда лечение следует прекратить, но и ситуации, когда показанное ЛП следует назначить больному. В когортном нерандомизированном исследовании продолжительностью 5 лет сравнивали у 196 амбулаторных больных способность STOP-J критериев (японская версия STOPP-критериев) и критериев Бирса предсказывать ПКТ — смерть от всех причин и первую госпитализацию [300][301]. У 301 больного старше 65 лет, госпитализированного в клинику, оценивали частоту ННЛ и их связь с НЯ. Частота ННЛ составила 58,5%; в основном они включали избыточное назначение аспирина в качестве первичной профилактики, ББ у больных СД и частыми приступами гипогликемии, недостаточное использование других антиагрегантов и статинов у больных с атеросклеротическими заболеваниями. Отмечена прямая связь между ННЛ и возникновением НЯ при проспективном наблюдении (ОР 11,8, 95% доверительный интервал 5,20-25,3).
Наиболее точным критерием ННЛ представляется Индекс медикаментозного соответствия (Medication Appropriateness Index, MAI), который применим к больному любого возраста. Он включает 10 пунктов. В нем для каждого ЛП, принимаемого больным, рассчитывается адекватность назначения (в соответствии с инструкцией по применению и КР), его безопасность, отсутствие нежелательных комбинаций. В одном исследовании было показано, что MAI имел приемлемую внутреннюю и внешнюю надежность, чаще выявлял потенциально ННЛ, чем обычно используемые точные критерии, предсказывал исходы заболевания и мог демонстрировать позитивный вклад вмешательств, направленных не решение проблем здравоохранения [302]. Необходимо отметить, однако, что этот индекс достаточно сложно рассчитать, он составляется отдельно для каждого используемого ЛП и поэтому требует много времени для введения необходимых данных. Кроме того, он не дает никакой информации о правильности всех назначенных больному ЛП.
Влияние ННЛ на исходы заболевания
Проведено по крайней мере 2 РКИ по изучению влияния коррекции ННЛ на исходы заболевания. В РКИ OPERAM у 2008 больных изучали эффект оптимизации терапии на госпитализации, связанные с применением ЛП, у пожилых мультиморбидных больных с полифармацией. Больные были разделены на 2 группы — обычная терапия и оптимизированная терапия, назначенная врачом и клиническим фармакологом с помощью компьютерной программы, построенной на критериях STOPP/START. Было показано, что частота ННЛ уменьшилась в основной группе, однако это не повлияло на частоту госпитализаций [303].
В РКИ SENATOR у 1537 пожилых больных с мультиморбидностью и полифармацией, поступивших в клинику, сравнивали обычную терапию и оптимизированную терапию, назначенную коллективом экспертов, основанную на критериях STOPP/START. В исследовании не было выявлено различий в частоте возникновения ПКТ (возникновение НЯ) и ВКТ (повторная госпитализация или смерть). Создается впечатление, что оба этих РКИ обладали недостаточной мощностью для выявления различий в исходах заболевания при назначении разных видов терапии, тем более что различия в самой терапии были не такими уж значительными [304]. В многоцентровом РКИ OPTIMIST было показано, что повторное вмешательство клинического фармаколога способно снизить количество добавочных визитов к врачу и вероятность повторной госпитализации [305].
Был проведен ряд систематических обзоров и метаанализов по изучению влияния нерациональной терапии на исходы заболевания. Так, в одном из таких анализов [306] было продемонстрировано, что потенциально ННЛ у пожилых больных, определяемое по критериям Бирса или STOPP/START, не влияло на смерть от всех причин, но достоверно снижало частоту НЯ. T. M. Liew и соавт. [307] провели метаанализ 2804 исследований, включивших 77 624 больных. Изучена роль разных критериев в предсказании исходов болезни. Критерии Бирса не предсказывали смерть от всех причин, но позволяли предсказать повторные госпитализации и ухудшение состояния. Критерии STOPP предсказывали ухудшение состояния, вероятность экстренных визитов к врачу, НЛР, частоту повторных госпитализаций.
Полифармация
По определению ВОЗ, полифармация — это одновременное назначение нескольких ЛП или назначение избыточного количества ЛП [308]. Разные авторы под полифармацией понимают назначение разного количества ЛП. Более корректным представляется не только количественное определение полифармации, но и учет оправданности и безопасности назначения большого количества ЛП. Различают клинически обусловленную полифармацию (clinically required) и полифармацию, включающую назначение непоказанных ЛП (inappropriate polypharmacy) [309]. Такая классификация в настоящее время является наиболее приемлемой.
Причины полифармации
Если под полифармацией понимать просто назначение большого количества ЛП, то она, как правило, является следствием коморбидности и поэтому чаще всего встречается у пожилых больных. Однако и у более молодых больных, например, страдающих ССЗ, полифармация может иметь место; при этом она может быть как клинически обусловленной, так и следствием ННЛ. Современные КР даже при наличии одного ССЗ (например, осложнено протекающей ИБС) настаивают на назначении по крайней мере 5 ЛП, что формально уже может считаться полифармацией [310]. Соответственно данные о распространенности полифармации уместно рассматривать только в связи с имеющимся у больного конкретным заболеванием, а также с наличием полиморбидности.
Как оценить наличие полифармации
На Западе широко практикуется оценка полифармации в электронных системах регистрации больных, в крупных базах данных и пр. Однако такой подход таит в себе ряд серьезных ошибок. Во-первых, при анализе таких источников не всегда понятно, насколько оправданной была полифармация. В электронных системах регистрации не всегда упоминаются все сопутствующие заболевания и состояния, которые могут потребовать дополнительного назначения ЛП. Во-вторых, из этих источников далеко не всегда можно сделать вывод, принимал ли больной назначенные ему ЛП или нет. В-третьих, в этих источниках не может учитываться прием безрецептурных препаратов, которые больной мог принимать самостоятельно.
Из всего сказанного следует, что реально определить количество ЛП, принимаемых больным, можно только при непосредственном контакте с ним. Такую информацию можно получить также в тех наблюдательных исследованиях (в первую очередь, в клинических регистрах), которые изначально были предназначены для оценки приверженности больных назначенному лечению и оценке реально принимаемого больным лечения.
Факторы, способствующие нерациональной полифармации
Нерациональной полифармации способствуют, в первую очередь, ННЛ (см. выше), при этом следует отметить назначение ЛП с недоказанным действием, назначение ЛП при наличии противопоказаний, избыточное назначение комбинированной терапии. Не следует забывать и о "каскаде назначений", когда появление побочных действий одного ЛП влечет за собой назначение новых препаратов, в свою очередь вызывающих НЯ и т.д. [311].
Нередко практикуемое "самолечение", самостоятельное приобретение в аптеке безрецептурных препаратов, безусловно, повышают вероятность нерациональной полифармации.
Влияет ли полифармация на исходы заболевания?
Длительное время было принято считать, что полифармация является независимым фактором риска неблагоприятных исходов заболеваний и НЯ. О повышенном риске смерти при полифармации, особенно у пожилых больных, упоминается в нескольких недавних систематических обзорах. Однако, в большинстве исследований, вошедших в эти обзоры, сведения о полифармации включались из крупных баз данных, в них полифармация оценивалась лишь количественно, не было подразделения на рациональную и нерациональную полифармацию [312][313]. B. Schöttker и соавт. [314] изучали ассоциацию между полифармацией и показателями смертности от неонкологических заболеваний в клиническом исследовании. При этом не было приказано, что полифармация является независимым риском смерти.
Борьба с полифармацией
Оценивая необходимость борьбы с полифармацией, ни в коем случае нельзя рассматривать последнюю в отрыве от конкретного заболевания и наличия мультиморбидности. Наиболее простым способом является так называемый депрескрайбинг (deprescring), т.е. отмена лекарств. Проводя депрескрайбинг, всегда нужно соотносить пользу и риск от конкретного лекарственного препарата [310]. Четко принципы депрескрайбинга разработаны лишь для некоторых категорий больных (пожилых пациентов с АГ, больных СД). Причем и в этих случаях депрескрайбинг рассматривается не как способ борьбы с полифармацией как таковой, а как способ борьбы с побочными действиями и нерациональными назначениями [315].
Не существует доказательств того, что депрескрайбинг может повлиять на клиническое течение болезни и ее исходы [316][317]. Нередко при проведении депрескрайбинга забывают, что ряд ЛП (нитраты, дигидропиридиновые антагонисты кальция, многие антидепрессанты), могут давать так называемый синдром отмены, проявляющийся существенным ухудшением состояния больного, а иногда и более серьезными осложнениями [318].
Наиболее верный метод контроля полифармации предложили M. Wehling и соавт., призывая отменять ненужные лекарства и назначать необходимые препараты (appropriate drugs in, inappropriate drugs out) [317].
Заключение
Таким образом, доказательная фармакотерапия, являясь частью доказательной медицины, использует основные ее принципы. Как и доказательная медицина, доказательная фармакотерапия не может пока еще считаться полноценной наукой, в первую очередь, потому, что трактовка результатов полученных исследований подвержена значительному субъективизму. Тем не менее, основные принципы доказательной медицины, в первую очередь соблюдение правил качественной клинической практики, являются незыблемыми и для доказательной фармакотерапии.
Авторы данного руководства выражают надежду, что оно поможет практическим врачам грамотно трактовать результаты полученных исследований, чтобы осознанно принимать клинические решения. Руководство поможет также тем, кто планирует проводить клинические исследования, избежать при этом типичных ошибок и получить результаты, реально необходимые в клинической практике.
Принятые сокращения
АНА — American Heart Association
COVID-19 — COronaVIrus Disease 2019, новая коронавирусная инфекция
ESC — European Society of Cardiology
ESН — European Society of Hypertension
FDA — Food and Drug Administration
ICH — International Conference on Harmonization
MACE — Major Adverse Cardiovascular Event
PCSK9 — Protein Convertase Subtilisin/Kexin 9
SGLT2 — Sodium/Glucose Cotransporter 2
АГП — антигипертензивные препараты
АД — артериальное давление
АРА — антагонисты рецепторов ангиотензина
ББ — бета-адреноблокатор
ВКТ — вторичная конечная точка
ЖКТ — желудочно-кишечный тракт
ИАПФ — ингибиторы ангиотензинпревращающего фермента
ИБС — ишемическая болезнь сердца
ИМ — инфаркт миокарда
ИПП — ингибиторы протонной помпы
КР — клинические рекомендации
ЛП — лекарственный препарат
ЛС — лекарственное средство
МНО — международное нормализованное отношение
НЛР — неблагоприятная (нежелательная) лекарственная реакция
ННЛ — нерациональное назначение лекарств
НПВП — нестероидные противовоспалительные препараты
НЯ — неблагоприятное/нежелательное явление
ПККТ — первичная комбинированная конечная точка
ПКТ — первичная конечная точка
ПСЛ — проблемы, связанные с лекарствами
РКИ — рандомизированные контролируемые исследования
РКО — Российское кардиологическое общество
РФ — Российская Федерация
СД — сахарный диабет
ССЗ — сердечно-сосудистые заболевания
ФП — фибрилляция предсердий
ХНИЗ — хронические неинфекционные заболевания
ХС — холестерин
ХС ЛНП — холестерин липопротеинов низкой плотности
ЭКГ — электрокардиограмма
Приложение 1. Перечень исследований
ASCOT-BPLA — Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm
ATTR-ACT — Transthyretin Amyloidosis Cardiomyopathy Clinical Trial
BEAUTIFUL — Ivabradine for patients with stable coronary artery disease and left-ventricular systolic dysfunction British Doctors Study
CAST — Cardiac Arrhythmia Supression Trial
CHARM — Candesartan in Heart failure Assessment of Reduction in Mortality and morbidity
COGENT — Clopidogrel with or without omeprazole in coronary artery disease
COMMANDER HF — A Study to Assess the Effectiveness and Safety of Rivaroxaban in Reducing the Risk of Death, Myocardial Infarction, or Stroke in Participants with Heart Failure and Coronary Artery Disease Following an Episode of Decompensated Heart Failure Coronary Drug Project
COMPASS — Cardiovascular Outcomes for People Using Anticoagulation Strategies
CONSENSUS — Cooperative North Scandinavian Enalapril Survival Study
EPHESUS — Eplerenone Post-AMI Heart Failure Efficacy and Survival Study
ELITE — Evaluation of Losartan in the Elderly Study
ELITE II — Losartan Heart Failure Survival Study
FOURIER — Further Cardiovascular Outcomes Research with PCSK9 Inhibition in Subjects with Elevated Risk
GISSI–Italian Group for the Study of Streptokinase in Myocardial Infarction (Gruppo Italiano per lo Studio della Streptochinasi nell’Infarto Miocardico, GISSI)
GISSI-Prevenzione — the Gruppo Italiano per lo Studio della Sopravvivenza nell’Infarto miocardico (GISSI)-Prevenzione trial the independent and combined effects of n-3 PUFA and vitamin E on morbidity and mortality after myocardial infarction
GLOBAL LEADERS — long-term ticagrelor monotherapy versus standard dual antiplatelet therapy followed by aspirin monotherapy in patients undergoing biolimus-eluting stent implantation
HERS — Heart and Estrogen/progestin Replacement Study
HOPE — Heart Outcomes Prevention Evaluation study
ILLUMINATE — Investigation of Lipid Level Management to Understand its Impact in Atherosclerotic Events
ISIS — International Studies of Infarct Survival
ISIS-2 — Second International Study of Infarct Survival
IONA — Impact Of Nicorandil in Angina study
GUSTO 36 — Global Utilization of Streptokinase and Tissue Plasminogen Activator for Occluded Coronary Arteries
LIFE — Losartan Intervention For Endpoint reduction in hypertension study
MICRO-HOPE substudy — the effect of ACE inhibitor treatment with ramipril on microalbuminuria and diabetic retinopathy
MRC streptomycin trial — Medical Research Council streptomycin trial for pulmonary tuberculosis
NHC — Nurses Health Study
OPERAM — Optimising thERapy to prevent Avoidable hospital admission in the Multi-morbid elderly
OPTIMIST study — optimisation of cost effectiveness through individualised follicle stimulating hormone (FSH) stimulation dosages for in vitro fertilisation (IVF) treatment
ORCHID — Randomized Placebo-controlled Clinical Trial of Hydroxychloroquine for Adults Hospitalized with COVID-19
PARADIGM-HF — Prospective Comparison of ARNI with ACEI to Determine Impact on Global Mortality and Morbidity in Heart Failure
PARADISE-MI — Prospective ARNI Versus ACE Inhibitor Trial to Determine Superiority in Reducing Heart Failure Events After Myocardial Infarction
PROMPT-QoL — Patient-reported Outcomes Measure of Pharmaceutical Therapy for Quality of Life
RECOVERY — Randomised Evaluation for COVID-19 therapy
RCGP Contraception Study — the Royal College of General Practitioners’ Oral Contraception Study
SECURE — Secondary Prevention of Cardiovascular Disease in the Elderly trial
SPRINT — Secondary Prevention Reinfarction Israeli Nifedipine Trial
StatinWISE — a series of randomised controlled n-of 1 trials in patients who have discontinued or wish to discontinue statin use due to muscle-related symptoms to assess if atorvastatin treatment causes more muscle symptoms than placebo
TAILOR-PCI — Effect of Genotype-Guided Oral P2Y12 Inhibitor Selection vs Conventional Clopidogrel Therapy on Ischemic Outcomes After Percutaneous Coronary Intervention
TRILOGY ACS — Targeted Platelet Inhibition to Clarify the Optimal Strategy to Medically Manage Acute Coronary Syndromes
The RESCA+31 registry — a multicentre, prospective, multidisciplinary study for accessing compliance with guidelines in patients with ST-segment elevation myocardial infarction after implementation of specific guidelines for emergency care
TIME — Trial of Invasive versus Medical therapy in Elderly patients with chronic symptomatic coronary-artery disease
TIPS — The Indian Polycap Study (Effects of a polypill (Polycap) on risk factors in middle-aged individuals without cardiovascular disease)
TIPS-3 — The third International Polycap Study
TRITON-TIMI 38 — Prasugrel versus clopidogrel in patients with acute coronary syndromes
WARCEF Trial — Warfarin versus Aspirin in Reduced Cardiac Ejection Fraction
ИРИС — Ирумед® и Ирузид®: оценка антигипертензивной эффективности и органопротективных свойств в лечении больных АГ
КАРДИОКАНОН — многоцентровое, открытое, рандомизированное исследование, проводимое в двух параллельных группах пациентов с ИБС и стабильной стенокардией напряжения II-III функционального класса, клинического соответствия генериков с доказанной биоэквивалентностью клинической эквивалентностью с оригинальными лекарственными препаратами
КИАП — Кооперативное исследование по изучению эффективности антиангинальных препаратов
ЛИС-1 — Люберецкое исследование смертности пациентов после перенесенного инфаркта миокарда
ЛИС-2 — Люберецкое исследование смертности больных, перенесших мозговой инсульт или транзиторную ишемическую атаку
НИКЕЯ — изучение влияния дополнительной терапии НИКорандилом на тЕчение ишемической болезни сердца у пациентов со стабильной стенокардией напряжениЯ, получающих стандартную базовую терапию
ПРОФИЛЬ — амбулаторный регистр пациентов с сердечно-сосудистыми заболеваниями и их факторами риска специализированного кардиологического подразделения научного центра
РЕКВАЗА — регистр кардиоваскулярных заболеваний, г. Рязань
РЕКОРД-3 — российский независимый регистр пациентов с острым коронарным синдромом Лаборатории клинической кардиологии ФНКЦ Физико-химической медицины ФМБА
Приложение 2. Перечень документов
AGREE II — Appraisal of Guideline ResEarch and Evaluation
ARMS — Adherence to Refills and Medications Scale
BEERS Criteria — criteria for potentially inappropriate medication use in older adults
CONSORT statement — Consolidated Standards of Reporting Trails
CPG — Clinical Practice Guideline
DPM — the WHO Programme for International Drug Monitoring
DART — The Drug-Associated Risk Tool
The FORTA — Fit fOR The Aged List
GCP — Good Clinical Practice — надлежащая клиническая практика
GMP — Good Manufacturing Practice — качественная производственная практика
MAI — Medication Appropriateness Index
MARS — Medication Adherence Rating Scale
PAGE — Publishing clinical prActice GuidelinEs
PCNE — Pharmaceutical Care Network Europe
PEER — Pharmaceutical Care Of The Elderly In Europe Research
PIM-check — screening checklist Potentially Inappropriate Medication designed by a Delphi method for internal medicine patients
PRECIS — Pragmatic-explanatory Continuum Indicator Summary
PRECIS-2 — Pragmatic-explanatory Continuum Indicator Summary-2
PRISCUS List 2.0 — lists substances that are potentially inappropriate medications (PIM) for the elderly
PROBE — Prospective randomized open blinded end-point
PROMPT-QoL — Patient-reported Outcomes Measure of Pharmaceutical Therapy for Quality of Life
SEAMS — Self-efficacy for Appropriate Medication Use Scale
STOPP/START — Screening Tool of Older Persons’ Prescriptions (STOPP) / Screening Tool to Alert to Right Treatment (START) criteria
The STROBE statement — The Strengthening the Reporting of Observational Studies in Epidemiology, guidelines
1 Аладышкина А. С., Лакшина В. В., Леонова Л. А., Максимов А. Г. Особенности работы с данными, характеризующими здоровье населения: заполнение пропусков в данных. Социальные аспекты здоровья населения [сетевое издание]. 2020;66(1):12. URL: http://vestnik.mednet.ru/content/view/1139/30/lang,ru/ DOI:10.21045/2071-5021- 2020-66-1-12.
2 Efficacy of hydroxychloroquine in patientswith COVID-19: results of a randomized clinical trial | medRxiv. https://www.medrxiv.org/content/10.1101/2020.03.22.20040758v2. Accessed 7 Apr 2020.
3 National Institute for Health and Care Excellence.NICE Charter. [Электронный ресурс]. Режим доступа: https://www.nice.org.uk/Media/Default/About/Who-we-are/NICE_Charter.pdf (дата обращения: 20.12.2018).
4 Самородская И. В. Рекомендации, основанные на доказательствах: часть I. Медвестник. 2020 (12); https://medvestnik.ru/content/medarticles/Rekomendacii-osnovannye-na-dokazatelstvah.html.
5 Prevention, diagnosis and treatment of new coronavirus infection (COVID-19). Temporary methodological recommendations of the Ministry of Health of the Russian Federation. Version 15, 22.02.2022. 245 p. (In Russ.) Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Временные методические рекомендации Минздрава России. Версия 15, 22.02.2022. 245 с. https://static-0.minzdrav.gov.ru/.
6 World Health Organization. Adherence to long-term therapies: evidence for action. WHO Library Cataloguing-in-Publication Data, Geneva, WHO 2003 — 211 рр.
7 Федеральный закон "Об обращении лекарственных средств". http://pravo.gov.ru/proxy/ips/?docbody=&nd=102137440.
8 Towards better patient care: drugs to avoid in 2022. Prescrire Int 2022; 31 (234):50-52. https://english.prescrire.org/en/SummaryDetail.aspx?Issueid=234.
9 https://ru.wikipedia.org/wiki
Список литературы
1. Ланг Г. Ф. Болезни системы кровообращения. М., 1957: 385с.
2. Lown B, Wolf M. Approaches to sudden death from coronary heart disease. Circulation. 1971;44:130-142. DOI:10.1161/01.CIR.44.1.130.
3. Есht DS, Liebeson PR, Mitchell LB, et al. Mortality and morbidity in patients receiving encainide, flecainide, or placebo: The Cardiac Arrhythmia Supression Trial. N. Engl. J. Med. 1991;324:781-788.
4. The Israeli SPRINT Study Group. The Secondary Prevention Reinfarction Israeli Nifedipine Trial (SPRINT): a randomized intervention trial of nifedipine in patients with acute myocardial infarction. Eur Heart J. 1988;9:354-64.
5. Goldbourt U, Behar S, Reicher-Reiss H, et al. Early administration of nifedipine in suspected acute myocardial infarction. The Secondary Prevention Reinfarction Israel Nifedipine Trial 2 Study Arch Intern Med. 1993;153:345-53.
6. Harrison J, Kulkarni K, Baguneid M, et al. Oxford Handbook of Key Clinical Evidence. Oxford University Press, Oxford. 2010:1-3.
7. Sackett DL, Rosenberg WM, Gray JA, et al. Evidence based medicine: what it is and what it isn’t. BMJ. 1996;312(7023):71-2. DOI:10.1136/bmj.312.7023.71.
8. Guyatt GH: Evidence-based medicine. ACP Journal Club. 1991, 114:A16. DOI:10.7326/ACPJC-1991-114-2-A16.
9. Streptomycin in Tuberculosis Trials Committee: Streptomycin treatment of pulmonary tuberculosis. Br Med J. 1948:ii:769-782.
10. Марцевич С.Ю., Кутишенко Н.П., Лукина Ю.В. и др. Клинические исследования по оценке лекарственной терапии: виды, достоверность результатов, место в современной доказательной медицине. Рациональная Фармакотерапия в Кардиологии. 2021;17(2):249-255. DOI:10.20996/1819-6446-2021-04-07.
11. Concato J, Shah N, Horwitz RI. Randomized, controlled trials, observational studies, and the hierarchy of research designs. N Engl J Med. 2000;342(25): 1887-92. DOI:10.1056/NEJM200006223422507.
12. Siegel JP. Equivalence and noninferiority trials. Am Heart J. 2000; 139: S166-70. DOI:10.1161/CIRCULATIONAHA.119.040214.
13. Garattini S, Bertele’ V. Non-inferiority trials are unethical because they disregard patients’ interests. Lancet 2007; 370: 1875–77. DOI:10.1016/S0140-6736(07)61604-3.
14. Connolly SJ, Ezekowitz MD, Yusuf S, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med. 2009;361(12):1139-1151. DOI:10.1056/NEJMoa0905561.
15. Patel MR, Mahaffey KW, Garg J, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med. 2011;365(10):883-891. DOI:10.1056/NEJMoa1009638.
16. Granger CB, Alexander JH, McMurray JJV, et al. Apixaban versus Warfarin in Patients with Atrial Fibrillation. N Engl J Med. 2011;365(11):981-992. DOI:10.1056/NEJMoa1107039.
17. Jaillon P. Controlled randomized clinical trials. Bull Acad Natl Med 2007;191: 739-56.
18. Rief W, Hofmann SG. The limitations of equivalence and non-inferiority trials. Psychol Med. 2019;49(2):349-350. DOI:10.1017/S0033291718002891.
19. Attard N, Totton N, Gillies K, Goulao B. How do we know a treatment is good enough? A survey of non-inferiority trials. Trials. 2022;23(1):1021. DOI:10.1186/s13063-022-06911-8.
20. Leung JT, Barnes SL, Lo ST, Leung DY. Non-inferiority trials in cardiology: what clinicians need to know. Heart. 2020;106(2):99-104. DOI:10.1136/heartjnl-2019-315772.
21. Dunn DT, Copas AJ, Brocklehurst P. Superiority and non-inferiority: two sides of the same coin? Trials. 2018;19(1):499. DOI:10.1186/s13063-018-2885-z.
22. Kim KS, Chan AW, Belley-Côté EP, Drucker AM. Noninferiority Randomized Controlled Trials. J Invest Dermatol. 2022;142(7):1773-1777. DOI:10.1016/j.jid.2022.04.015.
23. Bai AD, Komorowski AS, Lo CKL et al. McMaster Infectious Diseases Fellow Research Group. Intention-to-treat analysis may be more conservative than per protocol analysis in antibiotic non-inferiority trials: a systematic review. BMC Med Res Methodol. 2021;21(1):75. DOI:10.1186/s12874-021-01260-7.
24. Guerrera F, Renaud S, Tabbò F, Filosso PL. How to design a randomized clinical trial: tips and tricks for conduct a successful study in thoracic disease domain. J Thorac Dis. 2017;9(8):2692-2696. DOI:10.21037/jtd.2017.06.147.
25. Fisher RA. The arrangement of field experiments. J Min Agri GB 1926;33:700-725.
26. Ratnani I, Fatima S, Abid MM, Surani Z, Surani S. Evidence-Based Medicine: History, Review, Criticisms, and Pitfalls. Cureus. 2023;15(2):e35266. DOI:10.7759/cureus.35266.
27. Hart PD. Randomised controlled clinical trials. BMJ. 1991;302(6787):1271-1272.
28. Amberson JB, MacMahon BT, Pinner M. A clinical trial of sanocrysin in pulmonary tuberculosis. Am Rev Tuber. 1931;24:401-435.
29. Rivers WHR, Webber HN. The action of caffeine on the capacity of muscular work. The Journal of Physiology. 1907. DOI:10.1113/jphysiol.1907.sp001215.
30. Wood L, Egger M, Gluud LL, et al. Empirical evidence of bias in treatment effect estimates in controlled trials with different interventions and outcomes: metaepidemiological study. BMJ. 2008;336:601-5. DOI:10.1136/bmj.39465.451748.AD.
31. Hansson L, Hedner T, Dahlöf B. Prospective randomized open blinded endpoint (PROBE) study. A novel design for intervention trials. Prospective Randomized Open Blinded End-Point. Blood Press. 1992;1(2):113-9. DOI:10.3109/08037059209077502.
32. Eikelboom JW, Connolly SJ, Bosch J, et al.; COMPASS Investigators. Rivaroxaban with or without Aspirin in Stable Cardiovascular Disease. N Engl J Med. 2017;377(14):1319-1330. doi:10.1056/NEJMoa1709118.
33. Zannad F, Anker SD, Byra WM, et al.; COMMANDER HF Investigators. Rivaroxaban in Patients with Heart Failure, Sinus Rhythm, and Coronary Disease. N Engl J Med. 2018;379(14):1332-1342. DOI:10.1056/NEJMoa1808848.
34. Effectiveness of intravenous thrombolytic treatment in acute myocardial infarction. Gruppo Italiano per lo Studio della Streptochinasi nell’Infarto Miocardico (GISSI). Lancet. 1986;327(8478):397-402. DOI:10.1016/S0140-6736(86)92368-8.
35. Baigent C, Collins R, Appleby P, et al. ISIS-2: 10 year survival among patients with suspected acute myocardial infarction in randomised comparison of intravenous streptokinase, oral aspirin, both, or neither. The ISIS-2 (Second International Study of Infarct Survival) Collaborative Group. BMJ. 1998;316(7141):1337-43. DOI:10.1136/bmj.316.7141.1337.
36. Марцевич С.Ю., Кутишенко Н.П. Исследование КАМЕЛИЯ: сравнение терапии, основанной на карведилоле и метопрололе, у больных артериальной гипертонией и избыточной массой тела и ожирением. Рациональная Фармакотерапия в Кардиологии. 2008;4(5):34-38. DOI:10.20996/1819-6446-2008-4-5-34-38.
37. Cox DR. Regression models and life tables (with discussion). J.R. Statist. Soc., Series B. 1972(2): 187-220. DOI:10.1111/j.2517-6161.1972.tb00899.x
38. Гланц С. Медикобиологическая статистика. М: Практика, 1998.
39. Guyatt G. Determining optimal therapy randomized trials in individual patients. N Engl J Med. 1986;314:889-92. DOI:10.1056/NEJM198604033141406.
40. Metelitsa V., Kokurina EV, Martsevich SY. Individual choice and long-term administration of the antianginal drugs for secondary prevention of ischemic heart disease: problems, new approaches. Sov. Med. Rev. A. Cardiology. 1991;3:111-134.
41. McDonald S, Nikles J. N-of-1 Trials in Healthcare. Healthcare (Basel). 2021;9(3):330. DOI:10.3390/healthcare9030330.
42. Herrett E, Williamson E, Brack K, et al.; StatinWISE Trial Group. Statin treatment and muscle symptoms: series of randomised, placebo controlled n-of-1 trials. BMJ. 2021;372:n135. DOI:10.1136/bmj.n135.
43. Hollis S, Campbell F. What is meant by intention to treat analysis? Survey of published randomised controlled trials. BMJ. 1999;319(7211):670-4. DOI:10.1136/bmj.319.7211.670.
44. Cuschieri S. The CONSORT statement. Saudi J Anaesth. 2019;13(Suppl 1): S27-S30. DOI:10.4103/sja.SJA_559_18.
45. Pocock S, Clayton T, Altman D. Survival plots of time-to-event outcomes in clinical trials: good practice and pitfalls. Lancet. 2002;359:1686-89. DOI:10.1016/S0140-6736(02)08594-X.
46. Barter P, Caulfield M, Eriksson M, et al. Effects of Torcetrapib in Patients at High Risk for Coronary Events. N Engl J Med. 2007;357:2109-22. DOI:10.1056/NEJMoa0706628.
47. The Norwegian Multicenter Study Group. Timolol-induced reduction in mortality and reinfarction in patients surviving acute myocardial infarction. N Engl J Med. 1981;304:801-7.
48. Pocock SJ, Rossello X, Owen R, Collier TJ, Stone GW, Rockhold FW. Primary and Secondary Outcome Reporting in Randomized Trials: JACC State-of-the-Art Review. J Am Coll Cardiol. 2021;78(8):827-839. DOI:10.1016/j.jacc.2021.06.024.
49. Braunwald E. Cannon Cl’, McCabe CH. An approach to evaluating thrombolytic therapy in acute myocardial infarction: the unsatisfactory outcome endpoint. Circulation. 1992;86:683-687.
50. McLeod C, Norman R, Litton E, et al. Choosing primary endpoints for clinical trials of health care interventions. Contemp Clin Trials Commun. 2019;16:100486. DOI:10.1016/j.conctc.2019.100486.
51. Baracaldo-Santamaría D, Feliciano-Alfonso JE, Ramirez-Grueso R, et al. Making Sense of Composite Endpoints in Clinical Research. Journal of Clinical Medicine. 2023;12(13):4371. DOI:10.3390/jcm12134371.
52. Марцевич С.Ю., Лукина Ю.В., Кутишенко Н.П. и др. Краткий обзор методических рекомендаций "Медицинские регистры. Роль в доказательной медицине. Рекомендации по созданию". Кардиоваскулярная терапия и профилактика. 2023;22(6):3615. DOI:10.15829/1728-8800-2023-3615. EDN: RPDYDF.
53. Montori VM, Permanyer-Miralda G, Ferreira-González I, et al. Validity of composite end points in clinical trials. BMJ. 2005;330(7491):594-6. DOI:10.1136/bmj.330.7491.594.
54. Effects of ramipril on cardiovascular and microvascular outcomes in people with diabetes mellitus: results of the HOPE study and MICRO-HOPE substudy. Heart Outcomes Prevention Evaluation Study Investigators. Lancet. 2000;355(9200):253-9. Erratum in: Lancet. 2000;356(9232):860.
55. TIME Investigators. Trial of invasive versus medical therapy in elderly patients with chronic symptomatic coronary-artery disease (TIME): a randomised trial. Lancet. 2001;358:951-7.
56. Dahlöf B, Devereux RB, Kjeldsen SE, et al.; LIFE Study Group. Cardiovascular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomised trial against atenolol. Lancet. 2002;359(9311):995-1003. DOI:10.1016/S0140-6736(02)08089-3.
57. Freemantle N, Calvert M, Wood J, et al. Composite outcomes in randomized trials: greater precision but with greater uncertainty? JAMA. 2003;289(19):2554- 9. DOI:10.1001/jama.289.19.2554.
58. Armitage P. A statistical note on the analysis of the 1948 MRC streptomycin trial. J R Soc Med. 2016;109(8):312. DOI:10.1177/0141076816659004.
59. Lindner JR. Molecular imaging of myocardial and vascular disorders with ultrasound. JACC Cardiovasc Imaging. 2010;3(2):204-11. DOI:10.1016/j.jcmg.2009.09.021.
60. Pocock SJ, Ariti CA, Collier TJ, Wang D. The win ratio: a new approach to the analysis of composite endpoints in clinical trials based on clinical priorities. Eur Heart J. 2012;33(2):176-82. DOI:10.1093/eurheartj/ehr352.
61. PARADISE-MI Investigators and Committees, Pfeffer MA, Claggett B, Lewis EF, et al. Angiotensin receptor–neprilysin inhibition in acute myocardial infarction. New England Journal of Medicine. 2021;385(20):1845-1855. DOI:10.1056/NEJMoa2104508.
62. Berwanger O, Pfeffer M, Claggett B, et al. Sacubitril/valsartan versus ramipril for patients with acute myocardial infarction: win-ratio analysis of the PARADISE-MI trial. Eur J Heart Fail. 2022;24(10):1918-1927. DOI:10.1002/ejhf.2663.
63. Ajufo E, Nayak A, Mehra MR. Fallacies of Using the Win Ratio in Cardiovascular Trials: Challenges and Solutions. JACC Basic Transl Sci. 2023 6;8(6):720-727. DOI:10.1016/j.jacbts.2023.05.004.
64. Ozga AK, Rauch G. Weighted composite time to event endpoints with recurrent events: comparison of three analytical approaches. BMC Med Res Methodol. 2022;22(1):38. DOI:10.1186/s12874-022-01511-1.
65. Hara H, van Klaveren D, Kogame N, et al. Statistical methods for composite endpoints. EuroIntervention. 2021;16(18):e1484-e1495. DOI:10.4244/EIJ-D-19-00953.
66. Hara H, van Klaveren D, Takahashi K, et al.; GLOBAL LEADERS Trial Investigators. Comparative Methodological Assessment of the Randomized GLOBAL LEADERS Trial Using Total Ischemic and Bleeding Events. Circ Cardiovasc Qual Outcomes. 2020;13(8):e006660. DOI:10.1161/CIRCOUTCOMES.120.006660.
67. Vranckx P, Valgimigli M, Windecker S, et al. Long-term ticagrelor monotherapy versus standard dual antiplatelet therapy followed by aspirin monotherapy in patients undergoing biolimus-eluting stent implantation: rationale and design of the GLOBAL LEADERS trial. EuroIntervention. 2016;12(10):1239-1245. DOI:10.4244/EIJY15M11_07.
68. Guillemin F. Primer: the fallacy of subgroup analysis. Nat Clin Pract Rheumatol. 2007;3(7):407-13. DOI:10.1038/ncprheum0528.
69. Pitt B, Segal R, Martinez FA, et al, on behalf of ELITE Study Investigators. Randomised trial of losartan versus captopril in patients over 65 with heart failure (Evaluation of Losartan in the Elderly Study, ELITE). Lancet. 1997;347: 747-52.
70. Pitt B, Poole-Wilson PA, Segal R, et al. Effect of losartan compared with captopril on mortality in patients with symptomatic heart failure: randomised trial--the Losartan Heart Failure Survival Study ELITE II. Lancet. 2000;355(9215):1582-7. DOI:10.1016/s0140-6736(00)02213-3.
71. Rothwell PM. Treating individuals 2. Subgroup analysis in randomised controlled trials: importance, indications, and interpretation. Lancet. 2005;365 (9454):176-86. DOI:10.1016/S0140-6736(05)17709-5.
72. Tripepi G, Jager KJ, Dekker FW, et al. Measures of effect: relative risks, odds ratios, risk difference, and ‘number needed to treat’. Kidney Int. 2007;72(7): 789-91. DOI:10.1038/sj.ki.5002432.
73. Hopper L, Ness A, Higgins JP, et al. GISSI-Prevenzione trial. Lancet. 1999;354(9189):1557. DOI:10.1016/s0140-6736(05)76587-9.
74. Yaddanapudi LN. The American Statistical Association statement on P-values explained. J Anaesthesiol Clin Pharmacol. 2016;32(4):421-423. DOI:10.4103/0970-9185.194772.
75. Wasserstein RL, Lazar NA. The ASA’s statement on P-values: Context, process, and purpose. [Last accessed on 2016 Nov 11]; Am Stat. 2016;70:129-33. DOI:10.1080/00031305.2016.1154108.
76. The Coronary Drug Project. Initial findings leading to modifications of its research protocol. JAMA. 1970;214(7):1303-13.
77. Schulz K. Randomised trials, human nature, and reporting guidelines. Lancet 1996;348:596-98.
78. Rawlins M. De testimonio: on the evidence for decisions about the use of therapeutic interventions. Lancet. 2008;372:2152-61. DOI:10.1016/S0140-6736(08)61930-3.
79. Чазова И. Е., Ратова Л. Г., Колос И.П. и др. Нефропротекция в лечении больных атериальной гипертонией (Результаты исследования ИРИС) Системные гипертензии 2005(1):3-6.
80. Марцевич С.Ю., Перова Н.В., Кутишенко Н.П. и др. Открытое клиническое исследование эффективности и безопасности нового дженерика симвастатина—симвастола. Клиническая фармакология и терапия 2005;14(3):33-36.
81. Pearson K. Report of Certain Enteric Fever Inoculation Statistics. Br Med J. 1904;2. DOI:10.1136/bmj.2.2288.1243.
82. Glass GV. Meta-analysis at middle age: a personal history. Res Synth Methods. 2015;6(3):221-31. DOI:10.1002/jrsm.1133.
83. Glasser S, Duval S. Meta-Analysis. In: Glasser S., ed. Essentials of Clinical Research. University of Alabama at Birmingham AL, USA, 2008.
84. Glass G. Primary, secondary and meta-analysis of research. Educ Res. 1976; 5:3-8.
85. Chumney E, Simpson K. Methods and Design for Outcomes. American Society of Health-System Pharmacists 2006. р.228.
86. Grady D, Rubin SM, Petitti DB, et al. Hormone therapy to prevent disease and prolong life in postmenopausal women. Ann Intern Med. 1992;117(12):1016- 37. DOI:10.7326/0003-4819-117-12-1016.
87. Antithrombotic Trialists’ Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ. 2002;324:71-86.
88. Blood Pressure Lowering Treatment Trialists’ Collaboration. Effects of ACEinhibitors, calcium antagonists, and other blood-pressure-lowering drugs: results of prospectively designed overviews of randomised trials. Lancet. 2000;356:1955-64.
89. Pahor M, Psaty B, Alderman M, et al. Health outcomes associated with calcium antagonists compared with other first-line antihypertensive therapies: a metaanalysis of randomised controlled trials. Lancet. 2000;356:1949-1954.
90. Sipahi I, Debanne SM, Rowland DY, Simon DI, Fang JC. Angiotensin-receptor blockade and risk of cancer: meta-analysis of randomised controlled trials. Lancet Oncol. 2010;11(7):627-36. DOI:10.1016/S1470-2045(10)70106-6.
91. Sattar N, Preiss D, Murray HM, et al. Statins and risk of incident diabetes: a collaborative meta-analysis of randomised statin trials. Lancet. 2010;375: 735-42.
92. Ettehad D, Emdin CA, Kiran A, et al. Blood pressure lowering for prevention of cardiovascular disease and death: a systematic review and meta-analysis. Lancet. 2016;387:957-967.
93. Psaty B, Lumlay T, Furberg C, et al. Low-dose diuretics are the most effective first-line treatment for preventing the occurrence of cardiovascular disease morbidity and mortality. Clinical practice and treatment guidelines should reflect this evidence, and future trials should use low-dose diuretics as the standard for clinically useful comparisons. JAMA. 2003;289:2534-2544.
94. Gao D, Ning N, Niu X, et al. Trimetazidine: a meta-analysis of randomised controlled trials in heart failure. Heart. 2011;97(4):278-86. DOI:10.1136/hrt.2010.208751.
95. Pocock SJ, Stone GW. The Primary Outcome Fails — What Next? N Engl J Med. 2016;375(9):861-70. DOI:10.1056/NEJMra1510064.
96. Møller MH, Ioannidis JPA, Darmon M. Are systematic reviews and meta-analyses still useful research? We are not sure. Intensive Care Med. 2018;44(4):518- 520. DOI:10.1007/s00134-017-5039-y.
97. Maziarz M. Is meta-analysis of RCTs assessing the efficacy of interventions a reliable source of evidence for therapeutic decisions? Stud Hist Philos Sci. 2022;91:159-167. DOI:10.1016/j.shpsa.2021.11.007.
98. Ioannidis JP. Meta-research: The art of getting it wrong. Res. Syn. Meth. 2010;1:169-184.
99. Mariusz M. Is meta-analysis of RCTs assessing the efficacy of interventions a reliable source of evidence for therapeutic decisions? Studies in history and philosophy of science. 2022;91:159-167. DOI:10.1016/j.shpsa.2021.11.007.
100. Axfors C, Schmitt AM, Janiaud P, et al. Mortality outcomes with hydroxychloroquine and chloroquine in COVID-19 from an international collaborative meta-analysis of randomized trials. Nat Commun. 2021;12(1): 2349. DOI:10.1038/s41467-021-22446-z.
101. Casey JD, Johnson NJ, Semler MW, et al. Rationale and Design of ORCHID: A Randomized Placebo-controlled Clinical Trial of Hydroxychloroquine for Adults Hospitalized with COVID-19. Ann Am Thorac Soc. 2020;17(9):1144- 1153. DOI:10.1513/AnnalsATS.202005-478SD.
102. Hulley S, Grady D, Bush T, et al. Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women. Heart and Estrogen/progestin Replacement Study (HERS) Research Group. JAMA. 1998;280(7):605-13. DOI:10.1001/jama.280.7.605.
103. Moss AJ, Davis HT, Conrad DL, et al. Digitalis-associated cardiac mortality after myocardial infarction. Circulation. 1981;64:1150-56.
104. The Digitalis Investigation Group. The effect of digoxin on mortality and morbidity in patients with heart failure. N Engl J Med. 1997;336:525-33.
105. Cuschieri S. The STROBE guidelines. Saudi J Anaesth. 2019;13(Suppl 1):S31-S34. DOI:10.4103/sja.SJA_543_18.
106. Levin KA. Study design III: Cross-sectional studies. Evid Based Dent. 2006;7(1): 24-5. DOI:10.1038/sj.ebd.6400375.
107. Wang X, Cheng Z. Cross-Sectional Studies: Strengths, Weaknesses, and Re - commendations. Chest. 2020;158(1S):S65-S71. DOI:10.1016/j.chest.2020.03.012.
108. Rodrigues DA, Plácido AI, Tavares AB, et al. Potentially Inappropriate Medication Prescribing in Older Adults According to EU(7)-Potentially Inappropriate Medication List: A Nationwide Study in Portugal. Curr Ther Res Clin Exp. 2022;97:100681. DOI:10.1016/j.curtheres.2022.100681.
109. Grimes DA, Schulz KF. Cohort studies: marching towards outcomes. Lancet. 2002;359:341-345.
110. Mahmood SS, Levy D, Vasan RS, Wang TJ. The Framingham Heart Study and the epidemiology of cardiovascular disease: a historical perspective. Lancet. 2014;383(9921):999-1008. DOI:10.1016/S0140-6736(13)61752-3.
111. Kay CR. The Royal College of General Practitioners’ Oral Contraception Study: some recent observations. Clin Obstet Gynaecol. 1984;11(3):759-86.
112. Bao Y, Bertoia ML, Lenart EB, Stampfer MJ, Willett WC, Speizer FE, Chavarro JE. Origin, Methods, and Evolution of the Three Nurses’ Health Studies. Am J Public Health. 2016;106(9):1573-81. DOI:10.2105/AJPH.2016.303338.
113. Doll R, Peto R, Boreham J, Sutherland I. Mortality in relation to smoking: 50 years’ observations on male British doctors. BMJ. 2004;328(7455):1519. DOI:10.1136/bmj.38142.554479.AE
114. Подзолков В.И., Брагина А. Е., Тарзиманова А.И. и др. Артериальная гипертензия и неблагоприятное течение COVID-19 среди госпитализированных больных: данные когортного исследования из России. Рациональная Фармакотерапия в Кардиологии. 2023;19(1):4-10. DOI:10.20996/1819-6446-2023-01-10.
115. Madsen KM, Hviid A, Vestergaard M, Schendel D, Wohlfahrt J, Thorsen P, Olsen J, Melbye M. A population-based study of measles, mumps, and rubella vaccination and autism. N Engl J Med. 2002;347(19):1477-82. DOI:10.1056/NEJMoa021134.
116. Марцевич С.Ю., Гинзбург М.Л., Кутишенко Н.П. и др. Люберецкое исследование смертности (исследование ЛИС): факторы, влияющие на отдаленный прогноз жизни после перенесенного инфаркта миокарда. Профилактическая медицина. 2013;16(2):32-8.
117. Бойцов С.А., Марцевич С.Ю., Гинзбург М.Л. и др. Люберецкое исследование смертности больных, перенесших мозговой инсульт или транзиторную ишемическую атаку (ЛИС-2). Дизайн и оценка лекарственной терапии. Рациональная Фармакотерапия в Кардиологии. 2013;9(2):114-122. DOI:10.20996/1819-6446-2013-9-2-114-122.
118. Ahern TP, Tamimi RM, Rosner BA, Hankinson SE. Digoxin use and risk of invasive breast cancer: evidence from the Nurses’ Health Study and meta-analysis. Breast Cancer Res Treat. 2014;144:427-435. DOI:10.1007/s10549-014-2886-x.
119. Masood S. Is digoxin a breast cancer risk factor? Acute Cardiac Care, 2015,17:2,29-31. DOI:10.3109/17482941.2015.1066823.
120. Karasneh RA, Murray LJ, Cardwell CR. Cardiac glycosides and breast cancer risk: A systematic review and meta-analysis of observational studies. Int J Cancer. 2017;140(5):1035-1041. DOI:10.1002/ijc.30520.
121. Gautret P, Lagier JC, Parola P, et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial. Int J Antimicrob Agents. 2020:105949. DOI:10.1016/j.ijantimicag.2020.10594932205204.
122. Sartwell PE, Nathanson N (eds) Epidemiologic Reviews, Vol 2. Baltimore, The Johns Hopkins University Press. 1980:136-152.
123. Pottegård A. Core concepts in pharmacoepidemiology: Fundamentals of the cohort and case-control study designs. Pharmacoepidemiol Drug Saf. 2022;31(8):817-826. DOI:10.1002/pds.5482.
124. Schulz K, Grimes D. Case-control studies: research in reverse. Lancet. 2002:359:431–34.
125. Jick H, Zornberg GL, Jick SS, et al. Statins and the risk of dementia. Lancet. 2000;356:1627–31.
126. Naghavi M, Barlas Z, Siadaty S, et al. Association of influenza vaccination and reduced risk of recurrent myocardial infarction. Circulation. 2000;102:3039–45.
127. Fuller Torrey E, Rawlings R, Yolken RH. The antecedents of psychoses: a casecontrol study of selected risk factors. Schizophr Res. 2000;46(1):17-23. DOI:10.1016/s0920-9964(99)00237-6.
128. Rojas-Marte G, Khalid M, Mukhtar O, et al. Outcomes in patients with severe COVID-19 disease treated with tocilizumab: a case-controlled study. QJM. 2020;113(8):546-550. DOI:10.1093/qjmed/hcaa206. Erratum in: QJM. 2021;null.
129. Stone JH, Frigault MJ, Serling-Boyd NJ, et al.; BACC Bay Tocilizumab Trial Investigators. Efficacy of Tocilizumab in Patients Hospitalized with Covid-19. N Engl J Med. 2020;383(24):2333-2344. DOI:10.1056/NEJMoa2028836.
130. Rosas IO, Bräu N, Waters M, et al. Tocilizumab in Hospitalized Patients with Severe Covid-19 Pneumonia. N Engl J Med. 2021;384(16):1503-1516. DOI:10.1056/NEJMoa2028700.
131. Hallas J, Dall M, Andries A, et al. Use of single and combined antithrombotic therapy and risk of serious upper gastrointestinal bleeding: population based case-control study. BMJ. 2006;333:726. DOI:10.1136/bmj.38947.697558.AE.
132. Jenner E. An inguiry into the causes and effect of variolae vaccinae, a disease discovered in some of Western connties of England, particulary Gloucestershir and known by the name of the Cow-pox. London., Low, 1798. Springfield [Mass.]: Re-printed for Dr. Samuel Cooley, by Ashley & Brewer, 1802. 116pp.
133. Goodwin JS. The empirical basis for the discovery of new drugs. Persp Biol Med. 1991;35:20-36.
134. Pocock S, Elbourne D. Randomised trials or observational studies? Lancet. 2000;342:1907-9.
135. Granger CB, Pocock SJ, Gersh BJ. The need for new clinical trials of old drugs. Nat Rev Cardiol. 2023;20(2):71-72. DOI:10.1038/s41569-022-00819-1.
136. Gliklich RE, Dreyer NA, Leavy MB. Registries for Evaluating Patient Outcomes: A User’s Guide. 3rd edition. Rockville (MD): Agency for Healthcare Research and Quality (US);2014 Apr. Report No.: 13(14)-EHC111.
137. Bhatt DL, Drozda JP, Shahian DM. ACC/AHA/STS statement on the future of registries and the performance measurement enterprise. J Am Coll Cardiol. 2015; 66(20):2230-45.
138. Марцевич С.Ю., Лукина Ю.В., Кутишенко Н.П. и др. Медицинские регистры. Роль в доказательной медицине. Рекомендации по созданию. Методические рекомендации. М.: ООО "СилицеяПолиграф", 2023. 44 с. ISBN: 978-5-6049087-8-5. DOI:10.15829/ROPNIZ-m1-2023. EDN OCKJVC.
139. Марцевич С.Ю., Кутишенко Н.П., Лукина Ю.В., и др. Наблюдательные исследования и регистры. Их качество и роль в современной доказательной медицине. Кардиоваскулярная Терапия и Профилактика. 2021;20(2):61-6. DOI:10.15829/1728-8800-2021-2786.
140. Singal AG, Higgins PD, Waljee AK. A primer on effectiveness and efficacy trials. Clin Transl Gastroenterol. 2014;5(1):e45. DOI:10.1038/ctg.2013.13.
141. Эрлих А.Д. Клинические характеристики и исходы у пациентов с острым коронарным синдромом и промежуточной фракцией выброса левого желудочка (даннаые регистра "Рекорд-3"). Сердце. 2017;16(4):246-252. DOI:10.18087/RHJ.2017.4.2369.
142. Basu A, Unuigbe A, Masseria C. Understanding differences between what alternate propensity score methods estimate. J Manag Care Spec Pharm. 2023;29(4):391-399.
143. Harris M., Taylor G., Jackson D. Clinical evidence made easy. Banbury. 2014:1- 212.
144. Bakhai A., Patel S., Wang D. Blinding. In: Wang D., Bakhai A., editors. Clinical trials. A practical guide to design, analysis, and reporting. Remedica, London. 2006: 75-87.
145. Pop B, Fetica B, Blaga ML, et al. The role of medical registries, potential applications and limitations. Medicine and pharmacy reports. 2019:92(1):7-14. DOI:10.15386/cjmed-1015.
146. Лукина Ю.В., Кутишенко Н.П., Марцевич С.Ю. Эффективность, безопасность и отдаленные исходы применения никорандила у больных стабильной ишемической болезнью сердца по результатам рандомизированного и наблюдательного исследований. Рациональная Фармакотерапия в Кардиологии. 2019;15(5):641-8. DOI:10.20996/1819-6446-2019-15-5-641-648.
147. Kim HS, Lee S, Kim JH. Real-world Evidence versus Randomized Controlled Trial: Clinical Research Based on Electronic Medical Records. J Korean Med Sci. 2018; 33(34):e213. DOI:10.3346/jkms.2018.33.e213.
148. Martsevich SY, Lukina YV, Kutishenko NP, Semenova YV. Comparison of the outcomes of the prolonged antianginal therapy use in stable coronary artery disease patients according to the data of randomized and observational studies. Contemp Clin Trials Commun. 2021;21:100743. DOI:10.1016/j.conctc.2021.100743.
149. Schwartz D, Lellouch J. Explanatory and pragmatic attitudes in therapeutical trials. J Chronic Dis 1967;20:637-48.
150. Thorpe KE, Zwarenstein M, Oxman AD, et al. A pragmatic-explanatory continuum indicator summary (PRECIS): a tool to help trial designers. J Clin Epidemiol 2009;62:464-75.
151. Loudon K, Treweek S, Sullivan F, et al. The PRECIS-2 tool: designing trials that are fit for purpose. BMJ. 2015;350:h2147. DOI:10.1136/bmj.h2147.
152. Smelt AF, van der Weele GM, Blom JW, et al. How usual is usual care in pragmatic intervention studies in primary care? An overview of recent trials. Br J Gen Pract. 2010;60(576):e305-18. doi:10.3399/bjgp10X514819.
153. Roland M, Torgerson DJ. What are pragmatic trials? BMJ. 1998;316(7127):285. DOI:10.1136/bmj.316.7127.285.
154. Mentz RJ, Hernandez AF, Berdan LG, et al. Good Clinical Practice Guidance and Pragmatic Clinical Trials: Balancing the Best of Both Worlds. Circulation. 2016;133(9):872-80. DOI:10.1161/CIRCULATIONAHA.115.019902.
155. Sirkis T, Jones B, Bowden J. Should RECOVERY have used response adaptive randomisation? Evidence from a simulation study. BMC Med Res Methodol. 2022;22(1):216. DOI:10.1186/s12874-022-01691-w.
156. Macpherson H. Pragmatic clinical trials. Complement Ther Med. 2004;12(2- 3):136-40. DOI:10.1016/j.ctim.2004.07.043.
157. Casey JD, Beskow LM, Brown J, et al. Use of pragmatic and explanatory trial designs in acute care research: lessons from COVID-19. Lancet Respir Med. 2022;10(7):700-714. DOI:10.1016/S2213-2600(22)00044-3.
158. Textbook of pharmacoepidemiology. Strom BL, Kimmel SE, eds. Philadelphia, 2008, 498 p.
159. Shah BR, Laupacis A, Hux JE, Austin PC. Propensity score methods gave similar results to traditional regression modeling in observational studies: a systematic review. J Clin Epidemiol. 2005;58(6):550-9. DOI:10.1016/j.jclinepi.2004.10.016.
160. Gautret P, Lagier JC, Parola P, et al. Clinical and microbiological effect of a combination of hydroxychloroquine and azithromycin in 80 COVID-19 patients with at least a six-day follow up: A pilot observational study. Travel Med Infect Dis. 2020;34:101663. DOI:10.1016/j.tmaid.2020.101663.
161. Molina JM, Delaugerre C, Le Goff J, et al. No evidence of rapid antiviral clearance or clinical benefit with the combination of hydroxychloroquine and azithromycin in patients with severe COVID-19 infection. Med Mal Infect. 2020;50(4):384. DOI:10.1016/j.medmal.2020.03.006.
162. Borba MGS, Val FFA, Sampaio VS, et al.; CloroCovid-19 Team. Effect of High vs Low Doses of Chloroquine Diphosphate as Adjunctive Therapy for Patients Hospitalized With Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Infection: A Randomized Clinical Trial. JAMA Netw Open. 2020;3(4):e208857. DOI:10.1001/jamanetworkopen.2020.8857.
163. Lenzer J. Covid-19: US gives emergency approval to hydroxychloroquine despite lack of evidence. BMJ. 2020;369:m1335. DOI:10.1136/bmj.m133532238355.
164. Million M, Lagier JC, Tissot-Dupont H, et al. Early combination therapy with hydroxychloroquine and azithromycin reduces mortality in 10,429 COVID-19 outpatients. Rev Cardiovasc Med. 2021;22(3):1063-1072. DOI:10.31083/j.rcm2203116.
165. Casadevall A, Dragotakes Q, Johnson PW, et al. Convalescent plasma use in the USA was inversely correlated with COVID-19 mortality. Elife. 2021;10:e69866. DOI:10.7554/eLife.69866.
166. Garibaldi BT, Wang K, Robinson ML, et al. Real-World Effectiveness of Remdesivir in Adults Hospitalized With Coronavirus Disease 2019 (COVID-19): A Retrospective, Multicenter Comparative Effectiveness Study. Clin Infect Dis. 2022;75(1):e516-e524. DOI:10.1093/cid/ciab1035.
167. Boulware DR, Pullen MF, Bangdiwala AS, et al. A Randomized Trial of Hydroxychloroquine as Postexposure Prophylaxis for Covid-19. N Engl J Med. 2020;383(6):517-525. DOI:10.1056/NEJMoa2016638.
168. Duncan A, Halim D, El Kholy K. The RECOVERY trial: An analysis and reflection two years on. Eur J Intern Med. 2022;105:111-112. DOI:10.1016/j.ejim.2022.09.018.
169. Normand ST. The RECOVERY Platform. N Engl J Med. 2021;384(8):757-758. DOI:10.1056/NEJMe2025674.
170. Mahase E. Covid-19: Demand for dexamethasone surges as RECOVERY trial publishes preprint. BMJ. 2020;369:m2512. DOI:10.1136/bmj.m2512.
171. Gupta S, Leaf DE. Tocilizumab in COVID-19: some clarity amid controversy. Lancet. 2021;397(10285):1599-1601. DOI:10.1016/S0140-6736(21)00712-1.
172. Talukder P, Saha A, Roy S, et al. Drugs for COVID-19 Treatment: A New Challenge. Appl Biochem Biotechnol. 2023;195(6):3653-3670. DOI:10.1007/s12010-023-04439-4.
173. Grilli R, Magrini N, Penna A, et al. Practice guidelines developed by specialty societies: the need for a critical appraisal. Lancet. 2000;355:103-06.
174. Hoffmann-Eßer W, Siering U, Neugebauer EA, et al. Guideline appraisal with AGREE II: Systematic review of the current evidence on how users handle the 2 overall assessments. PLoS One. 2017;12(3):e0174831. DOI:10.1371/journal.pone.0174831.
175. Williams B, Mancia G, Spiering W, et al.; ESC Scientific Document Group. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J. 2018;39(33):3021-3104. DOI:10.1093/eurheartj/ehy339. Erratum in: Eur Heart J. 2019;40(5):475.
176. Yang N, Zhao W, Qi WA, et al.; TERM working group. Publishing clinical prActice GuidelinEs (PAGE): Recommendations from editors and reviewers. Chin J Traumatol. 2022;25(6):312-316. DOI:10.1016/j.cjtee.2022.06.007.
177. Fanaroff A, Califf R, Windecker S, et al. Levels of Evidence Supporting American College of Cardiology/American Heart Association and European Society of Cardiology Guidelines, 2008-2018. JAMA. 2019;321(11):1069-1080. DOI:10.1001/jama.2019.1122.
178. van der Sand CR, Leiria TL, Kalil RA. Assessment of the adherence of cardiologists to guidelines for the treatment of atrial fibrillation. Arq Bras Cardiol. 2013;101(2):127-33. DOI:10.5935/abc.20130148.
179. Grol R, Dalhuijsen J, Thomas S, et eal. Attribute sofclinicalguideline sthat influence use ofguidelines in general practice: observationalstudy. BMJ.1998;317(7162):858-61. DOI:10.1136/bmj.317.7162.858.
180. Grol R, Grimshaw J. From best evidence to best practice: effective implementation of change in patients’ care Lancet. 2003;362:1225-30. DOI:10.1016/S0140-6736(03)14546-1.
181. Burgmann K, Fatio S, Jordi B, Rutishauser J. Medical care of type 2 diabetes mellitus in light of international and national recommendations: a retrospective analysis Swiss Med Wkly. 2013;143:w13871. DOI:10.4414/smw.2013.13871.
182. Pepió Vilaubí JM, Orozco-Beltrán D, Gonçalves AQ, et al. Adherence to European clinical practice guidelines for secondary prevention of cardiovascular disease: a cohort study. Int J Environ Res Public Health 2018;15:1233. DOI:10.3390/ijerph15061233.
183. Widimsky P, Toušek P, Toušek F et al. Barriers in the implementation of guidelines for acute coronary syndromes. Focus on antiplatelet therapy. Cor et Vasa Amsterdam: Elsevier Science BV, 2017, 59(3):240-245, 6 pp. ISSN 0010- 8650. DOI:10.1016/j.crvasa.2016.12.002.
184. Sandouk A, Ducassé JL, Grolleau S, et al. Compliance with guidelines in patients with ST-segment elevation myocardial infarction after implementation of specific guidelines for emergency care: results of RESCA+31 registry. Arch Cardiovasc Dis. 2012;105(5):262-70. DOI:10.1016/j.acvd.2012.03.001.
185. LaBresh KA, Ellrodt AG, Gliklich R, et al. Get with the guidelines for cardiovascular secondary prevention: pilot results. Arch Intern Med. 2004;164(2): 203-9. DOI:10.1001/archinte.164.2.203.
186. Wang T, Tan J-YB, Liu X-L, et al. Barriers and enablers to implementing clinical practice guidelines in primary care: an overview of systematic reviews. BMJ Open. 2023;13:e062158. DOI:10.1136/bmjopen-2022-062158.
187. Kredo T, Bernhardsson S, Machingaidze S, et al. Guide to clinical practice guidelines: the current state of play. International Journal for Quality in Health Care. 2016;28(1):122-128. DOI:10.1093/intqhc/mzv115.
188. Eagle K, Montoye C, Riba A, et al. Guideline-Based Standardized Care Is Associated With Substantially Lower Mortality in Medicare Patients With Acute Myocardial Infarction. J Am Coll Cardiol. 2005;46:1242-8. DOI:10.1016/j.jacc.2004.12.083.
189. Grol R. Has guideline development gone astray? Yes. BMJ. 2010;340:c306. DOI:10.1136/bmj.c306.
190. Jørgensen TL, Hallas J, Friis S, Herrstedt J. Comorbidity in elderly cancer patients in relation to overall and cancer-specific mortality. Br J Cancer. 2012;106(7):1353-60. DOI:10.1038/bjc.2012.46.
191. Tricoci P, Allen JM, Kramer JM, Califf RM, Smith SC Jr. Scientific evidence underlying the ACC/AHA clinical practice guidelines. JAMA. 2009301(8):831- 41. DOI:10.1001/jama.2009.205. Erratum in: JAMA. 2009 Apr 15;301(15):1544.
192. Classen DC, Mermel LA. Specialty Society Clinical Practice Guidelines: time for evolution or revolution? JAMA. 2015;314:871-2. DOI:10.1001/jama.2015.7462.
193. Jureidini J, McHenry LB. The illusion of evidence based medicine BMJ. 2022;376:o702. DOI:10.1136/bmj.o702.
194. Ioannidis JP. Why Most Published Research Findings Are False. PLoS Med. 2005;2(8):e124. DOI:10.1371/journal.pmed.0020124. Erratum in: PLoS Med. 2022;19(8):e1004085.
195. Ioannidis JP. Why Most Clinical Research Is Not Useful. PLoS Med. 2016;13(6):e1002049. DOI:10.1371/journal.pmed.1002049.
196. Packer M, McMurray JJ, Desai AS, et al. PARADIGM-HF Investigators and Coordinators. Angiotensin receptor neprilysin inhibition compared with enalapril on the risk of clinical progression in surviving patients with heart failure. Circulation. 2015;131(1):54-61. doi:10.1161/CIRCULATIONAHA.114.013748.
197. The CONSENSUS Trial Study Group. Effects of enalapril on mortality in severe congestive heart failure. Results of Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). New Engl. J. Med. 1987;316:1429-1435. DOI:10.1056/NEJM198706043162301.
198. Dahlöf B, Sever PS, Poulter NR, et al.; ASCOT Investigators. Prevention of cardiovascular events with an antihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in the Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm (ASCOT-BPLA): a multicentre randomised controlled trial. Lancet. 2005;366(9489):895-906. DOI:10.1016/S0140-6736(05)67185-1.
199. Fox K, Ford I, Steg PG, et al.; BEAUTIFUL Investigators. Ivabradine for patients with stable coronary artery disease and left-ventricular systolic dysfunction (BEAUTIFUL): a randomised, double-blind, placebo-controlled trial. Lancet. 2008;372(9641):807-16. DOI:10.1016/S0140-6736(08)61170-8.
200. Rothwel P. Subgroup analysis in randomised controlled trials: importance, indications, and interpretation. Lancet. 2005;365:176-86. DOI:10.1016/S0140-6736(05)17709-5.
201. Stuart J. Pocock, Ph.D., and Gregg W. Stone, M.D. The Primary Outcome Fails— What Next? N Engl J Med 2016;375:861-70. DOI:10.1056/NEJMra1510064.
202. Марцевич С. Ю., Кутишенко Н.П. Рандомизированные клинические исследования и наблюдательные исследования: соотношение в иерархии доказательств эффективности терапии. Рациональная фармакотерапия в кардиологии. 2016;12(5):567-573. DOI:10.20996/1819-6446-2016-12-5-567-573.
203. Марцевич С.Ю., Лукина Ю.В., Драпкина О.М. Основные принципы комбинированной медикаментозной терапии — фокус на межлекарственное взаимодействие. Кардиоваскулярная терапия и профилактика. 2021;20(7):3031. DOI:10.15829/1728-8800-2021-3031.
204. Baxter K, Preston CL. Stockley’s Drug Interactions. Vol 495. Pharmaceutical Press; 2010.
205. Roberts AG, Gibbs ME. Mechanisms and the clinical relevance of complex drug-drug interactions. Clin Pharmacol. 2018;27;10:123-34. DOI:10.2147/CPAA.S146115.
206. Romagnoli KM, Nelson SD, Hines L. Information needs for making clinical recommendations about potential drug-drug interactions: a synthesis of literature review and interviews. BMC Med Inform Decis Mak. 2017;22:21. DOI:10.1186/s12911-017-0419-3.
207. Mallet L, Spinewine A, Huang A. The challenge of managing drug interactions in elderly people. Lancet. 2007;370(9582):185-191. DOI:10.1016/S0140-6736(07)61092-7.
208. Bjorkman IK, Fastbom J, Schmidt IK, Bernsten CB, for The Pharmaceutical Care Of The Elderly In Europe Research (PEER) Group. Drug-drug interactions in the elderly. Ann Pharmacother. 2002;36:1675-81. DOI:10.1345/aph.1A484.
209. Hohl CM, Dankoff J, Colacone A, Afi lalo M. Polypharmacy, adverse drug-related events, and potential adverse drug interactions in elderly patients presenting to an emergency department. Ann Emerg Med 2001;38: 666-71. DOI:10.1067/mem.2001.119456.
210. Stys T, Lawson WE, Smaldone GC, Stys A. Does aspirin attenuate the beneficial effects of angiotensin-converting enzyme inhibition in heart failure? Arch Intern Med. 2000;160(10):1409-13. DOI:10.1001/archinte.160.10.1409.
211. Takkouche B, Etminan M, Caamaño F, Rochon PA. Interaction between aspirin and ACE Inhibitors: resolving discrepancies using a meta-analysis. Drug Saf. 2002;25(5):373-8. DOI:10.2165/00002018-200225050-00005.
212. Teerlink JR, Qian M, Bello NA, et al; WARCEF Investigators. Aspirin Does Not Increase Heart Failure Events in Heart Failure Patients: From the WARCEF Trial. JACC Heart Fail. 2017;5(8):603-610. DOI:10.1016/j.jchf.2017.04.011.
213. Cascorbi I. Drug interactions–principles, examples and clinical consequences. Dtsch Arztebl Int. 2012;109:546-56. DOI:10.3238/arztebl.2012.0546.
214. Mancia G, Fagard R, Narkiewicz K, et al. Task Force Members. 2013 ESH/ESC Guidelines for the management of arterial hypertension: the Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). J Hypertens. 2013;31:1281-357. DOI:10.1097/01.hjh.0000431740.32696.cc.
215. Williams B, Mancia G, Spiering W, et al. Authors/Task Force Members. 2018 ESC/ESH Guidelines for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension. J Hypertens. 2018;36:1953-2041. DOI:10.1097/HJH.0000000000001940.
216. Hindricks G, Potpara T, Dagres N, et al. ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021;42:373-498. DOI:10.1093/eurheartj/ehaa612.
217. Cosentino F, Grant PJ, Aboyans V, et al. ESC Scientific Document Group. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur Heart J. 2020;41:255-323. DOI:10.1093/eurheartj/ehz486.
218. Leal Rodríguez C, Kaas-Hansen BS, Eriksson R, et al. Drug interactions in hospital prescriptions in Denmark: Prevalence and associations with adverse outcomes. Pharmacoepidemiol Drug Saf. 2022;31(6):632-642. DOI:10.1002/pds.5415
219. Eroglu TE, Blom MT, Souverein PC, de Boer A, Tan HL. Multiple categories of non-cardiac QT-prolonging drugs are associated with increased risk of outof-hospital cardiac arrest: real-world data from a population-based study. Europace. 2022;24(4):630-638. DOI:10.1093/europace/euab251.
220. Марцевич С.Ю., Лукина Ю.В., Загребельный А.В. и др. Комбинированная антигипертензивная терапия в реальной клинической практике. Фокус на фиксированные комбинации антигипертензивных препаратов (по данным амбулаторных регистров РЕКВАЗА и ПРОФИЛЬ). Рациональная Фармакотерапия в Кардиологии. 2017;13(3):323-329. DOI:10.20996/1819-6446-2017-13-3-323-329.
221. Wald NJ, Law MR. A strategy to reduce cardiovascular disease by more than 80%. BMJ. 2003 Jun 28;326(7404):1419. DOI:10.1136/bmj.326.7404.1419. Erratum in: BMJ. 2003;327(7415):586. Erratum in: BMJ. 2006;60(9):823.
222. Indian Polycap Study (TIPS); Yusuf S, Pais P, Afzal R, et al. Effects of a polypill (Polycap) on risk factors in middle-aged individuals without cardiovascular disease (TIPS): a phase II, double-blind, randomised trial. Lancet. 2009;373(9672):1341-51. DOI:10.1016/S0140-6736(09)60611-5.
223. Yusuf S, Joseph P, Dans A, et al: International Polycap Study 3 Investigators. Polypill with or without Aspirin in Persons without Cardiovascular Disease. N Engl J Med. 2021;384(3):216-228. DOI:10.1056/NEJMoa2028220.
224. Castellano JM, Pocock SJ, Bhatt DL et al; SECURE Investigators. Polypill Strategy in Secondary Cardiovascular Prevention. N Engl J Med. 2022;387(11):967-977. DOI:10.1056/NEJMoa2208275.
225. Лукина Ю.В., Кутишенко Н.П., Марцевич С.Ю. и др. Приверженность к лекарственной терапии у больных хроническими неинфекционными заболеваниями. Решение проблемы в ряде клинических ситуаций. Методические рекомендации. Профилактическая медицина. 2020;23(3):2042-2060. DOI:10.17116/profmed20202303242.
226. Лукина Ю. В., Кутишенко Н.П., Марцевич С. Ю. Приверженность лечению: современный взгляд на знакомую проблему. Кардиоваскулярная терапия и профилактика. 2017;16(1):91-95.
227. Vrijens B, De Geest S, Hughes DA. et al; ABC Project Team. A new taxonomy for describing and defining adherence to medications. Br J Clin Pharmacol. 2012;73:691-705. DOI:10.1111/j.1365-2125.2012.04167.
228. De Geest S, Zullig LL, Dunbar-Jacob J, et al. ESPACOMP Medication Adherence Reporting Guideline (EMERGE). Ann Intern Med. 2018;169(1): 30-35. DOI:10.7326/M18-0543.
229. Лукина Ю.В., Кутишенко Н.П., Марцевич С.Ю., Драпкина О.М. Разработка и валидизация новых опросников в медицине на примере шкалы приверженности лекарственной терапии. Рациональная Фармакотерапия в Кардиологии. 2021;17(4):576-583. DOI:10.20996/1819-6446-2021-08-02.
230. Lam WY, Fresco P. Medication Adherence Measures: An Overview. Biomed Res Int. 2015; 2015:217047. DOI:10.1155/2015/217047.
231. Osterberg L, Blaschke T. Adherence to medication. N Engl J Med. 2005;353(5):487-97. DOI:10.1056/NEJMra050100
232. Лукина Ю.В., Кутишенко Н.П., Марцевич С.Ю. и др. Опросники и шкалы для оценки приверженности к лечению — преимущества и недостатки диагностического метода в научных исследованиях и реальной клинической практике. Кардиоваскулярная терапия и профилактика. 2020;19(3):2562. DOI:10.15829/1728-8800-2020-2562.
233. Morisky DE, Green LW, Levine DM. Concurrent and predictive validity of a selfreported measure of medication adherence. Med Care. 1986;24(1):67-74. DOI:10.1097/00005650-198601000-00007.
234. Morisky DE, Ang A, Krousel-Wood M, Ward HJ. Predictive validity of a medication adherence measure in an outpatient setting. J Clin Hypertens (Greenwich). 2008;10(5):348-354. DOI:10.1111/j.1751-7176.2008.07572.x.
235. Svarstad BL, Chewning BA, Sleath BL, Claesson C. The Brief Medication Questionnaire: a tool for screening patient adherence and barriers to adherence. Patient Educ Couns. 1999;37(2):113-24. DOI:10.1016/s0738-3991(98)00107-4.
236. Risser J, Jacobson TA, Kripalani S. Development and psychometric evaluation of the Self-efficacy for Appropriate Medication Use Scale (SEAMS) in lowliteracy patients with chronic disease. J Nurs Meas. 2007;15(3):203-19. DOI:10.1891/106137407783095757.
237. Thompson K, Kulkarni J, Sergejew AA. Reliability and validity of a new Medication Adherence Rating Scale (MARS) for the psychoses. Schizophr Res. 2000;42:241-7. DOI:10.1016/s0920-9964(99)00130-9.
238. Fialko L, Garety PA, Kuipers E, et al. A large-scale validation study of the Medication Adherence Rating Scale (MARS). Schizophr Res. 2008;100:53-9. DOI:10.1016/j.schres.2007.10.029.
239. Kripalani S, Risser J, Gatti ME, Jacobson TA. Development and evaluation of the Adherence to Refills and Medications Scale (ARMS) among low-literacy patients with chronic disease. Value Health. 2009;12(1):118-23. DOI:10.1111/j.1524-4733.2008.00400.x.
240. Николаев Н.А., Скирденко Ю.П., Жеребилов В.В. Количественная оценка приверженности к лечению в клинической медицине: протокол, процедура, интерпретация. Качественная клиническая практика. 2016;1:50-59.
241. Фофанова Т.В., Агеев Ф. Т., Смирнова М.Д. Отечественный опросник приверженности терапии: апробация и применение в амбулаторной практике. Системные гипертензии. 2014;2:13-16.
242. Кадыров Р.В., Асриян О.Б., Ковальчук С.А. Опросник "Уровень комплаентности". Монография. Владивосток: Мор.гос. ун-т. 2014. 74 с.
243. Гусейнова Э. Т., Лукина Ю. В., Кутишенко Н.П. и др. Приверженность к медикаментозной терапии и риск сердечно-сосудистых событий у пациентов с хронической сердечной недостаточностью (по данным амбулаторного регистра). Кардиоваскулярная терапия и профилактика. 2022;21(10):3389. DOI:10.15829/1728-8800-2022-3389.
244. Gast A, Mathes T. Medication adherence influencing factors-an (updated) overview of systematic reviews. Syst Rev. 2019;8(1):112. DOI:10.1186/s13643-019-1014-8.
245. Brown MT, Bussell JK. Medication adherence: WHO cares? Mayo Clin Proc. 2011:304-14. DOI:10.4065/mcp.2010.0575.
246. Improving physician adherence to clinical practice guidelines. Barriers and strategies for change. New England Healthcare Institute, 2008, 55 p.
247. Fischer F, Lange K, Klose K, Greiner W, Kraemer A. Barriers and Strategies in Guideline Implementation-A Scoping Review. Healthcare (Basel). 2016;4(3):36. DOI:10.3390/healthcare4030036.
248. Марцевич С.Ю., Кутишенко Н.П., Лукина Ю.В. Проблема выбора лекарственного препарата с позиций доказательной медицины на примере бета-адреноблокаторов. Рациональная Фармакотерапия в Кардиологии. 2010;6(6):876-881. DOI:10.20996/1819-6446-2010-6-6-876-881.
249. Soares I, Carneiro AV. Drug class effects: definitions and practical applications. Rev Port Cardiol. 2002;21(9):1031-42.
250. Марцевич С.Ю. Как решить проблему выбора препарата внутри одного класса с позиций доказательной медицины? Рациональная Фармакотерапия в Кардиологии. 2019;15(2):271- 276. DOI:10.20996/1819-6446-2019-15-2-271-276.
251. Furberg CD, Pitt B. Are all angiotensin-converting enzyme inhibitors interchangeable? J Am Coll Cardiol. 2001;37(5):1456-60. DOI:10.1016/s0735-1097(01)01161-5.
252. Meyer GF. History and regulatory issues of generic drugs. Transplant Proc. 1999;31(3A Suppl):10S-12S. DOI:10.1016/s0041-1345(99)00105-0.
253. Senn S. In the blood: proposed new requirements for registering generic drugs. Lancet. 1998;352(9122):85-6. DOI:10.1016/s0140-6736(98)85007-1.
254. Kesselheim AS, Misono AS, Lee JL et al. Clinical equivalence of generic and brand-name drugs used in cardiovascular disease: a systematic review and meta-analysis. JAMA. 2008;300(21):2514-26. DOI:10.1001/jama.2008.758.
255. Manzoli L, Flacco ME, Boccia S et al. Generic versus brand-name drugs used in cardiovascular diseases. Eur J Epidemiol. 2016;31(4):351-68. DOI:10.1007/s10654-015-0104-8.
256. Марцевич С.Ю., Кутишенко Н.П., Гинзбург М.Л. и др. Исследование КАРДИОКАНОН: способ решения вопроса о клинической эквивалентности оригинальных и воспроизведенных препаратов. Рациональная Фармакотерапия в Кардиологии. 2012;8(2):179-184. DOI:10.20996/1819-6446-2012-8-2-54-55.
257. Avorn J. Two centuries of assessing drug risks. N Engl J Med. 2012;367(3):193-7. DOI:10.1056/NEJMp1206652.
258. Вотчал Б. Е. Очерки клинической фармакологии. Медгиз. М. 1963.
259. Edwards IR, Aronson JK. Adverse drug reactions: definitions, diagnosis, and management. Lancet. 2000;356(9237):1255-9. DOI:10.1016/S0140-6736(00)02799-9.
260. Герасимов В.Б., Лукьянов С.В., Бабахин А.А. и др. Побочные эффекты лекарственных средств. Ремедиум 2005;1-2:32-36.
261. Лепахин В.К., Переверзев А.П., Романов Б.К. Cравнительная оценка количества сообщений о нежелательных реакциях на лекарственные средства. Безопасность и риск фармакотерапии. 2015;(1):30-36.
262. Kaufman G. Adverse drug reactions: classification, susceptibility and reporting. Nurs Stand. 2016;30(50):53-63. DOI:10.7748/ns.2016.e10214.
263. Щулькин А.В., Якушева Е.Н., Попова Н.М. Pоль гликопротеина-р в рациональной фармакотерапии в кардиологии. Рациональная Фармакотерапия в Кардиологии. 2013;9(6):701-707. DOI:10.20996/1819-6446-2013-9-6-701-707.
264. Сычёв Д.А., Отделенов В.А., Денисенко Н.П. и др. Изучение активности изоферментов цитохрома Р450 для прогнозирования межлекарственных взаимодействий лекарственных средств в условиях полипрагмазии. Фармакогенетика и фармакогеномика. 2016;(2):4-11.
265. Ferreiro JL, Ueno M, Capodanno D et al. Pharmacodynamic effects of concomitant versus staggered clopidogrel and omeprazole intake: results of a prospective randomized crossover study. Circ Cardiovasc Interv. 2010;3(5):436-41. DOI:10.1161/CIRCINTERVENTIONS.110.957829.
266. O’Gara PT, Kushner FG, Ascheim DD et al. 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2013;61(4):e78-e140. DOI:10.1016/j.jacc.2012.11.019.
267. Bhatt DL, Cryer BL, Contant CF et al; COGENT Investigators. Clopidogrel with or without omeprazole in coronary artery disease. N Engl J Med. 2010;363(20):1909-17. DOI:10.1056/NEJMoa1007964.
268. Wiviott SD, Braunwald E, McCabe CH, et al; TRITON-TIMI 38 Investigators. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med. 2007;357(20):2001-15. DOI:10.1056/NEJMoa0706482.
269. Pereira NL, Farkouh ME, So D, et al. Effect of Genotype-Guided Oral P2Y12 Inhibitor Selection vs Conventional Clopidogrel Therapy on Ischemic Outcomes After Percutaneous Coronary Intervention: The TAILOR-PCI Randomized Clinical Trial. JAMA. 2020;324(8):761-771. DOI:10.1001/jama.2020.12443.
270. Birocchi S, Rocchetti M, Minardi A, et al. Guide antiplatelet therapy with P2Y12 antagonists in patients undergoing percutaneous coronary intervention: 3 systematic reviews with meta‐analyses of randomized controlled trials with homogeneous design. MEDRXIV. DOI:10.1101/2023.05.25.23290520.
271. Белецкий Г.А., Кирсанов К.И., Лесовая Е.А., Якубовская М. Г. Лекарственный канцерогенез: факторы риска и возможности предотвращения. Успехи биологической химии. 2020;60:173-226.
272. Ослопов В.Н., Макаров М.А., Борисов Д.В. Риск развития злокачественных новообразований при приеме различных классов антигипертензивных препаратов. Практическая медицина. 2013;(3):30-33.
273. Dale KM, Coleman CI, Henyan NN, et al. Statins and cancer risk: a meta-analysis. JAMA. 2006;295(1):74-80. DOI:10.1001/jama.295.1.74.
274. Marelli C, Gunnarsson C, Ross S, et al. Statins and Risk of Cancer: A Retrospective Cohort Analysis of 45,857 Matched Pairs From an Electronic Medical Records Database of 11 Million Adult Americans. J Am Coll Cardiol. 2011;58(5):530-537. DOI:10.1016/j.jacc.2011.04.015.
275. Баранова Е.И. Антигипертензивная терапия антагонистами рецепторов ангиотензина II и риск развития злокачественных новообразований. Артериальная гипертензия 2012;18(5):375-384. DOI:10.18705/1607-419X-2012-18-5-375-384.
276. Sipahi I. Risk of cancer with angiotensin-receptor blockers increases with increasing cumulative exposure: Meta-regression analysis of randomized trials. PLoS One 2022;17(3):e0263461. DOI:10.1371/journal.pone.0263461.
277. Воронина Н.В., Упницкий А.А. Побочные эффекты лекарственных средств и методы их выявления. Лечебное дело 2007;1:3-11.
278. Якусевич В.В. Доказательная медицина: очевидные достоинства и скрытые недостатки. Гепатология и гастроэнтерология 2023;7(1):6-14. DOI:10.25298/2616-5546-2023-7-1-6-14.
279. Ghose K. Hospital bed occupancy due to drug-related problems. J R Soc Med. 1980;73(12):853-6. DOI:10.1177/014107688007301207.
280. Schindler E, Richling I, Rose O. Pharmaceutical Care Network Europe (PCNE) drug-related problem classification version 9.00: German translation and validation. Int J Clin Pharm. 2021;43(3):726-730. DOI:10.1007/s11096-020-01150-w.
281. van Mil JW, Westerlund LO, Hersberger KE et al. Drug-related problem classification systems. Ann Pharmacother. 2004;38(5):859-67. DOI:10.1345/aph.1D182.
282. van den Bemt PM, Egberts TC, de Jong-van den Berg LT et al. Drugrelated problems in hospitalised patients. Drug Saf. 2000;22(4):321-33. DOI:10.2165/00002018-200022040-00005.
283. Gayathri B, Emily Divasish L, Soni M, et al. Drug related problems: a systemic literature review. Indo American Journal of Pharmaceutical Sciences. 2018;05(03):1409-1415. DOI:10.5281/zenodo.1198191.
284. Saldanha V, Araújo IBd, Lima SIVC, et al. Risk factors for drug-related problems in a general hospital: A large prospective cohort. PLOS ONE. 2020;15(5):e0230215. DOI:10.1371/journal.pone.0230215.
285. Amankwa Harrison M, Marfo AFA, Buabeng KO, et al. Drug-related problems among hospitalized hypertensive and heart failure patients and physician acceptance of pharmacists’ interventions at a teaching hospital in Ghana. Health Sci Rep. 2022;5(5):e786. DOI:10.1002/hsr2.786.
286. Kaufmann CP, Stämpfli D, Mory N, et al. Drug-Associated Risk Tool: development and validation of a self-assessment questionnaire to screen for hospitalised patients at risk for drug-related problems. BMJ Open. 2018;8:e016610. DOI:10.1136/bmjopen-2017-016610.
287. Stämpfli D, Boeni F, Gerber A, et al. Assessing the ability of the Drug-Associated Risk Tool (DART) questionnaire to stratify hospitalized older patients according to their risk of drug-related problems: a cross-sectional validation study. BMJ Open. 2018;8:e021284. DOI:10.1136/bmjopen-2017-021284.
288. Sakthong P, Jaisue P. Impact of a drug-related patient-reported outcome measure on drug-related problem identification, physicians’ acceptance, and clinical and quality of life outcomes: a randomized controlled trial. Int J Clin Pharm. 2022;44(2):320-329. DOI:10.1007/s11096-021-01341-z.
289. Ferner RE, Aronson JK. Clarification of terminology in medication errors: definitions and classification. Drug Saf. 2006;29(11):1011-22. DOI:10.2165/00002018-200629110-00001.
290. Ramadanov N, Klein R, Schumann U, et al. Factors, influencing medication errors in prehospital care: A retrospective observational study. Medicine. 2019;98(49):e18200. DOI:10.1097/MD.0000000000018200.
291. Sada O, Melkie A, Shibeshi W. Medication prescribing errors in the medical intensive care unit of Tikur Anbessa Specialized Hospital, Addis Ababa, Ethiopia. BMC Res Notes. 2015;8:448. DOI:10.1186/s13104-015-1435-y.
292. Jayaweera A, Chung Y, Jabbarpour Y. Primary Care Physician Characteristics Associated with Prescribing Potentially Inappropriate Medication for Elderly Patients: Medicare Part D Data. J Am Board Fam Med. 2020;33(4):561-568. DOI:10.3122/jabfm.2020.04.190310.
293. Nguyen A. Bad medicine: preventing drug errors in the prehospital setting. JEMS. 2008;33(10):94-100. DOI:10.1016/S0197-2510(08)70384-X.
294. Fick DM, Cooper JW, Wade WE et al. Updating the Beers criteria for potentially inappropriate medication use in older adults: results of a US consensus panel of experts. Arch Intern Med. 2003;163(22):2716-2724. DOI:10.1001/archinte.163.22.2716. Erratum in: Arch Intern Med. 2004;164(3):298.
295. Lund BC, Carnaham RM, Egge JA, et al. Inappropriate prescribing predicts adverse drig events in older adults. Ann Pharmacother. 2010;44;957-963. DOI:10.1345/aph.1m657.
296. Spinewine A, Schmader KE, Barber N. et al. Appropriate prescribing in elderly people: how well can it be measured and optimised? Lancet. 2007;370(9582):173-184. DOI:10.1016/S0140-6736(07)61091-5.
297. Assiri GA, Shebl NA, Mahmoud MA, et al. What is the epidemiology of medication errors, error-related adverse events and risk factors for errors in adults managed in community care contexts? A systematic review of the international literature. BMJ Open. 2018;8:e019101. DOI:10.1136/bmjopen-2017-019101.
298. Opondo D, Eslami S, Visscher S, et al. Inappropriateness of medication prescriptions to elderly patients in the primary care setting: a systematic review. PLoS One. 2012;7(8):e43617. DOI:10.1371/journal.pone.0043617.
299. Dreischulte T, Shahid F, Muth C, et al. Prescribing Cascades: How to Detect Them, Prevent Them, and Use Them Appropriately. Dtsch Arztebl Int. 2022;119(44):745-752. DOI:10.3238/arztebl.m2022.0306.
300. Huang CH, Umegaki H, Watanabe Y et al. Potentially inappropriate medications according to STOPP-J criteria and risks of hospitalization and mortality in elderly patients receiving home-based medical services. PLoS One. 2019;14(2):e0211947. DOI:10.1371/journal.pone.0211947.
301. Fahrni ML, Azmy MT, Usir E, et al. Inappropriate prescribing defined by STOPP and START criteria and its association with adverse drug events among hospitalized older patients: A multicentre, prospective study. PLoS One. 2019;14(7):e0219898. DOI:10.1371/journal.pone.0219898.
302. Hanlon JT, Schmader KE. The medication appropriateness index at 20: where it started, where it has been, and where it may be going. Drugs Aging. 2013;30(11):893-900. DOI:10.1007/s40266-013-0118-4.
303. Blum MR, Sallevelt BTGM, Spinewine A, et al. Optimizing Therapy to Prevent Avoidable Hospital Admissions in Multimorbid Older Adults (OPERAM): cluster randomised controlled trial. BMJ. 2021;374:n1585. DOI:10.1136/bmj.n1585. Erratum in: BMJ. 2022;379:o2859.
304. Lavan AH, O’Mahony D, Gallagher P, et al. The effect of SENATOR (Software Engine for the Assessment and optimisation of drug and non-drug Therapy in Older peRsons) on incident adverse drug reactions (ADRs) in an older hospital cohort — Trial Protocol. BMC Geriatrics 2019;19:40. DOI:10.1186/s12877-019-1047-9.
305. Ravn-Nielsen LV, Duckert ML, Lund ML, et al. Effect of an In-Hospital Multifaceted Clinical Pharmacist Intervention on the Risk of Readmission: A Randomized Clinical Trial. JAMA Intern Med. 2018;178(3):375-382. DOI:10.1001/jamainternmed.2017.8274.
306. Mekonnen AB, Redley B, de Courten B, et al. Potentially inappropriate prescribing and its associations with health-related and system-related outcomes in hospitalised older adults: A systematic review and meta-analysis. Br J Clin Pharmacol. 2021;87(11):4150-4172. DOI:10.1111/bcp.14870.
307. Liew TM, Lee CS, Goh Shawn KL et al. Potentially Inappropriate Prescribing Among Older Persons: A Meta-Analysis of Observational Studies. Ann Fam Med. 2019;17(3):257-266. DOI:10.1370/afm.2373.
308. Monégat M, Sermet C, Perronnin M, Rococo E. Polypharmacy: defnitions, measurement and stakes involved—review of the literature and measurement tests. Quest d’économie la Santé. 2014;204:1-8.
309. Masnoon N, Shakib S, Kalisch-Ellett L. at al. What is polypharmacy? A systematic review of definitions. BMC Geriatrics.2017;17:230. DOI:10.1186/s12877-017-0621-2.
310. Марцевич С.Ю., Кутишенко Н.П., Лукина Ю.В. и др. Полифармация: определение, влияние на исходы, необходимость коррекции. Рациональная Фармакотерапия в Кардиологии. 2023;19(3):254-263. DOI:10.20996/1819-6446-2023-2924.
311. Halli-Tierney AD, Scarbrough C, Carroll D. Polypharmacy: Evaluating Risks and Deprescribing. Am Fam Physician. 2019;100(1):32-38.
312. Chang TI, Park H, Kim DW, et al. Polypharmacy, hospitalization, and mortality risk: a nationwide cohort study. Sci Rep. 2020;10(1):18964. DOI:10.1038/s41598-020-75888-8.
313. Brockhattingen KK, Anru PL, Masud T, et al. Association between number of medications and mortality in geriatric inpatients: a Danish nationwide registerbased cohort study. Eur Geriatr Med. 2020;11(6):1063-1071. DOI:10.1007/s41999-020-00390-3.
314. Schöttker B, Saum K, Muhlack DC, et al. Polypharmacy and mortality: new insights from a large cohort of order adults by detection of effect modification by multi-morbidity and comprehensive correction of confounding by indication. Eur J Clin Pharmacol. 2017;73:1041-1048. DOI:10.1007/s00228-017-2266-7.
315. Остроумова О.Д., Черняева М.С., Сычев Д.А. Депрескрайбинг антигипертензивных препаратов у пациентов старших возрастных групп. Рациональная фармакотерапия в кардиологии. 2020;16(1):82-93. DOI:10.20996/1819-6446-2020-02-14.
Об авторах
С. Ю. МарцевичРоссия
Марцевич Сергей Юрьевич
Москва
Н. П. Кутишенко
Россия
Кутишенко Наталья Петровна, руководитель лаборатории фармакоэпидемиологических исследований отдела профилактической фармакотерапии
Москва
Ю. В. Лукина
Россия
Лукина Юлия Владимировна
Москва
В. В. Якусевич
Россия
Якусевич Владимир Валентинович
Москва
С. Н. Толпыгина
Россия
Толпыгина Светлана Николаевна
Москва
И. В. Самородская
Россия
Самородская Ирина Владимировна
Москва
М. М. Лукьянов
Россия
Лукьянов Михаил Михайлович
Москва
А. В. Загребельный
Россия
Загребельный Александр Васильевич
Москва
В. А. Метельская
Россия
Метельская Виктория Алексеевна
Москва
Е. А. Поддубская
Россия
Поддубская Елена Александровна
Москва
О. М. Драпкина
Россия
Драпкина Оксана Михайловна
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Марцевич С.Ю., Кутишенко Н.П., Лукина Ю.В., Якусевич В.В., Толпыгина С.Н., Самородская И.В., Лукьянов М.М., Загребельный А.В., Метельская В.А., Поддубская Е.А., Драпкина О.М. Доказательная фармакотерапия в кардиологии. Национальное руководство. Рациональная Фармакотерапия в Кардиологии. 2024;20(1):105-170. https://doi.org/10.20996/1819-6446-2024-2992. EDN: BZBLMS
For citation:
Martsevich S.Yu., Kutishenko N.P., Lukina Yu.V., Yakusevich V.V., Tolpygina S.N., Samorodskaya I.V., Lukyanov M.M., Zagrebelny A.V., Metelskaya V.A., Poddubskaya E.A., Drapkina O.M. Evidence-based pharmacotherapy in cardiology. National guideline. Rational Pharmacotherapy in Cardiology. 2024;20(1):105-170. (In Russ.) https://doi.org/10.20996/1819-6446-2024-2992. EDN: BZBLMS

















































