Перейти к:
Клинические факторы, ассоциированные с развитием феномена невосстановленного коронарного кровотока у пациентов с острым коронарным синдромом
https://doi.org/10.20996/1819-6446-2024-2994
EDN: OPPLHS
Аннотация
Цель. Изучить частоту развития феномена невосстановленного коронарного кровотока (no-/slow-reflow) при первичном чрескожном коронарном вмешательстве (ЧКВ) у пациентов с острым коронарным синдромом (ОКС), и клинические факторы, ассоциированные с его возникновением в повседневной клинической практике.
Материал и методы. Из 2090 пациентов с ОКС, поступивших в ГКБ № 1 им. Н. И. Пирогова г. Москвы в период с 01.01.2017 г. по 01.11.2022 г., выделены 2 группы пациентов с ЧКВ: 1-я группа (n=59) включала пациентов с исходным антеградным коронарным кровотоком TIMI 0 и финальным кровотоком TIMI 0-2 (с феноменом no/slow-reflow); 2-я группа (n=149) включала пациентов с с исходным коронарным кровотоком TIMI 0 и финальным антеградным коронарным кровотоком TIMI 3 (без феномена no/slow-reflow).
Результаты. У пациентов 1-й группы значимо чаще был сахарный диабет (42,4% против 22,8%, p=0,003), перенесенный инсульт в анамнезе (12,1% против 3,4%, p=0,016), более выраженная тяжесть острой сердечной недостаточности по Killip и время "боль-баллон" [7,00 (3,00;16,00) ч против 4,00 (2,30;8,25) ч, p=0,004]. При проведении бинарной логистической регрессии самыми значимыми предикторами развития феномена no-/slow-reflow являлись время "боль-баллон" [отношение шансов (ОШ)=1,03; 95% доверительный интервал (ДИ) 0,95-0,996; p=0,02] и проксимальный уровень поражения инфаркт-связанной артерии [ОШ=3,33; 95% ДИ 1,67-6,57; p<0,001]. Частота наступления летальных исходов с стационаре в группе пациентов с феноменом no-/slow-reflow была в 6,1 раза выше, чем в группе пациентов с нормальным кровотоком [ОШ=6,10±0,433; 95% ДИ 2,614-14,247; p<0,05].
Заключение. Развитие феномена no-/slow-reflow наблюдалось у 2,8% пациентов в клинической практике ГКБ № 1 им. Н. И. Пирогова. Его развитие ассоциировалось с увеличением частоты неблагоприятного исхода заболевания в стационаре. Общее время ишемии миокарда, наличие сахарного диабета, инсульт в анамнезе, более высокий класс острой сердечной недостаточности по Killip при поступлении чаще ассоциировались с развитием феномена no-/slow-reflow. Проксимальный уровень поражения инфаркт-связанной артерии и время "боль-баллон" были независимыми предикторами феномена no-/ slow-reflow.
Ключевые слова
Для цитирования:
Константинова Е.В., Ильин Ю.С., Великоцкий А.А., Рахими Н.А., Богданова А.А., Площенков Е.В. Клинические факторы, ассоциированные с развитием феномена невосстановленного коронарного кровотока у пациентов с острым коронарным синдромом. Рациональная Фармакотерапия в Кардиологии. 2024;20(1):27-34. https://doi.org/10.20996/1819-6446-2024-2994. EDN: OPPLHS
For citation:
Konstantinova E.V., Ilin Yu.S., Velikotskiy A.A., Rakhimi N.A., Bogdanova A.A., Ploshchenkov A.V. Clinical factors associated with the no/slow-reflow phenomenon in patients with acute coronary syndrome. Rational Pharmacotherapy in Cardiology. 2024;20(1):27-34. (In Russ.) https://doi.org/10.20996/1819-6446-2024-2994. EDN: OPPLHS
Введение
В настоящее время чрескожное коронарное вмешательство (ЧКВ) стало ведущим методом лечения пациентов с острым коронарным синдромом (ОКС) [1]. Несмотря на очевидные достоинства этого метода реперфузии, связанные с его эффективностью и малоинвазивностью, в части случаев ЧКВ может сопровождаться развитием осложнений. Одним из осложнений ЧКВ является феномен невосстановленного или замедленного кровотока (no-/slow-reflow), развитие которого снижает эффективность реваскуляризации миокарда [2].
Несмотря на длительное изучение этиопатогенеза данного феномена, природа его окончательно не ясна. Этот феномен включает в себя дистальную эмболию, развитие микрососудистой обструкции, каскад биохимических, патофизиологических и морфологических реакций ткани миокарда, реперфузионно-реоксигенационный синдром в том числе так называемый "reflow-paradox", являющийся механизмом ишемического и парадоксального постишемического повреждения, активный иммунный ответ, нарушение про- и антикоагулянтного гомеостаза, а также индивидуальную предрасположенность к повреждению микроциркуляторного русла [3][4].
Такое многообразие и сложность полученных в фундаментальных исследованиях данных свидетельствует о необходимости дальнейшего изучения как этиопатогенетических механизмом формирования этого феномена, так и предикторов, ассоциированных факторов его развития в реальной клинической практике.
Цель исследования — изучить частоту развития феномена невосстановленного коронарного кровотока (no-/slow-reflow) при первичном ЧКВ у пациентов с ОКС, госпитализированных в ГКБ №1 им. Н. И. Пирогова и факторы, ассоциированные с его возникновением в повседневной работе городской клинической больницы г. Москвы.
Материал и методы
В основу нашего исследования положены данные госпитального регистра пациентов с ОКС, поступивших по каналу скорой медицинской помощи или обратившихся самостоятельно в ГКБ № 1 им. Н. И. Пирогова г. Москвы в период с 1 января 2017 г. по 1 ноября 2022 г. В исследование включались пациенты, у которых диагностирован инфаркт миокарда (ИМ) с или без подъёма сегмента ST и проведено ЧКВ со стентированием коронарной артерии (КА). Критерии исключения: ИМ второго типа, нестабильная стенокардия, тромболитическая терапия на догоспитальном этапе, вазоспастический характер поражения КА, гемодинамически незначимый стеноз с нормальным коронарным кровотоком по данным ангиографии, стресс-индуцированная кардиомиопатия, тяжелое многососудистое поражение КА с необходимостью экстренной операции коронарного шунтирования, невозможность по техническим причинам выполнить ЧКВ, добровольный отказ от проведения ЧКВ, агональное состояние больного.
Проанализированы данные 2090 пациентов, у которых проведена комплексная оценка клинических и демографических показателей, а также, по данным коронароангиографии, проанализирована степень коронарного кровотока в инфаркт-связанной артерии (ИСА) по шкале TIMI (Thrombolysis In Myocardial Infarction) как до, так и после ЧКВ. Феномен no-reflow определялся как отсутствие антеградного поступления контрастного вещества или минимальный кровоток дистальнее места окклюзии и имплантации стента (TIMI 0 и TIMI 1 соответственно). Феномен slow-reflow определялся как степень кровотока TIMI 2 по данной шкале. Однако в исследовании мы изучали группу no-/slow-reflow в совокупности, как результат отсутствия нормального кровотока в виновной КА, несмотря на предпринятые попытки реваскуляризации. На основании результатов по шкале TIMI все пациенты после установки стента были разделены на 2 группы: с невосстановленным/замедленным кровотоком (TIMI 0-2) и с нормальным кровотоком (TIMI 3). В 1-ю группу (с феноменом no/slow-reflow) вошло 59 пациентов с исходным антеградным коронарным кровотоком TIMI 0 — 100%, у которых по факту реваскуляризации был достигнут финальный кровоток TIMI 0-2. Среди пациентов с исходным антеградным кровотоком от TIMI 0 до TIMI 3 (n=2031; TIMI 0 — 43%, TIMI 1 — 28%, TIMI 2 — 21%, TIMI 3 — 8%) с финальным антеградным коронарным кровотоком TIMI 3 случайным образом было отобраны 149 пациентов с исходным коронарным кровотоком TIMI 0 и отсутствием значимых различий в характере поражения коронарного русла, которые составили 2-ю группу (без феномена no/slow-reflow).
Все больные перед ЧКВ получали перорально нагрузочные дозы ацетилсалициловой кислоты (150-325 мг) и тикагрелора (180 мг). При проведении ЧКВ интракоронарно болюсно вводился нефракционированный гепарин в дозе 7500-12500 МЕ в зависимости от массы тела. При диагностировании оператором ангиографического феномена no-/slow-reflow внутривенно болюсно вводился эптифибатид (180 мкг/кг), далее по схеме согласно клиническим рекомендациям [1].
Статистическую обработку данных выполняли в программе Statistica 10 (StatSoft Inc, США), с использованием методов параметрического и непараметрического анализа. Все количественные данные проверяли на предмет нормальности распределения. В случае нормального распределения количественные данные представляли в виде среднего и стандартного отклонения (М±SD). Ненормально распределенные количественные величины описывали при помощи значений медианы (Me) с указанием нижнего и верхнего квартилей (Q1; Q3). Для номинальных данных указывали абсолютные и относительные значения. При сравнительном статистическом анализе для средних величин в нормально распределенных совокупностях количественных данных рассчитывался t-критерий Стьюдента для независимых выборок, в случае ассиметричного распределения данных использовался U-критерий Манна-Уитни. Для оценки всех статистически значимых количественных величин был проведён ROC-анализ с расчетом площади под кривой (AUC) и 95% доверительный интервал (ДИ), и построены характеристические кривые. Для сравнения номинальных данных в изучаемых группах использовался критерий χ2 Пирсона. В случае анализа четырехпольных таблиц при ожидаемом явлении хотя бы в одной ячейке менее 10, нами рассчитывался критерий χ2 с поправкой на непрерывность по Йейтсу (Yates’s correction), или использовался точный критерий Фишера при значении менее 5. В качестве количественной меры эффекта при сравнении относительных показателей нами использовался показатель отношения шансов (ОШ). Определение предикторов развития феномена no-/slow-reflow осуществляли с помощью метода пошаговой бинарной логистической регрессии. В модель логистического регрессионного анализа были включены все показатели, которые имели статистические значимые различия при межгрупповом сравнении. Различия считали статистически значимыми при p<0,05.
Результаты
При сравнении клинико-демографических характеристик у пациентов двух групп не обнаружено статистически значимых различий по возрасту и полу пациентов, антропометрическим показателям, курению, наличию и стадии гипертонической болезни, хронической болезни почек, фибрилляции предсердий, ИМ и вмешательств на КА в анамнезе (табл. 1). Статистически значимо группы различались по наличию сахарного диабета (СД) (42,4% в 1-й группе против 22,8% во 2-й группе, p=0,003), при этом в 1-й группе СД встречался значимо чаще [в 2,6 раза; ОШ = 2,642±0,331; 95% доверительный интервал (ДИ) 1,382-5,052; p<0,05].
Также группы статистически значимо различались по наличию острого нарушения мозгового кровообращения (ОНМК) в анамнезе [ 7 (12,1%) против 5 (3,4%) в 1-й и 2-й группах соответственно, p=0,016]. При этом у пациентов с ОНМК в анамнезе в 4 раза чаще встречался феномен no-/slow-reflow, в сравнении с пациентами без перенесенного ранее ОНМК (ОШ=3,953±0,608; 95% ДИ 1,201-13,01; p<0,05).
У пациентов с более выраженным классом острой сердечной недостаточности (ОСН) наблюдалась большая частота развития феномена no-/slow-reflow (Killip II-IV в 1-й и 2-й группах обнаруживалась в 38,9% и 12,1% соответственно, p<0,001). При попарном сравнении ОСН по классам (Killip) тяжесть ОСН значимо влияла на развитие феномена no-/slow-reflow (рис. 1). При этом отсутствие ОСН (Killip I) при поступлении существенно отличалось от других степеней тяжести ОСН, а кардиогенный шок (Killip IV) имел наибольшую статистическую значимость в развитии феномена no-/slow-reflow.
Больные 1-й группы статистически значимо чаще, чем пациенты 2-й группы, умирали в стационаре [ 18 (30,5%) против 10 (6,7%) человек соответственно, p<0,001]. При этом частота наступления летальных исходов с стационаре в 1-й группе была в 6,1 раза выше чем во 2-й группе (ОШ=6,102±0,433; 95% ДИ 2,614-14,247; p<0,05).
Временной фактор статистически значимо влиял на развитие феномена no-/slow-reflow [время "боль-баллон" составило 7,0 (3,0; 16,0) ч в 1-й группе и 4,0 (2,3; 8,3) ч во 2-й группе, p=0,004]. При этом больные 1-й группы подвергались реваскуляризации на 3 ч позже пациентов 2-й группы.
У пациентов 1-й группы с ОНМК в анамнезе медиана времени ишемии составила 8,1 (5,0;18,0) ч против 7,0 (3,0;16,0) ч у больных без ОНМК (p=0,6).
При сравнении ангиографических параметров в группах не было статистически значимых различий по типу коронарного кровоснабжения и ИСА (табл. 2).
Уровень поражения ИСА имел значимые различия между исследованными группами пациентов (табл. 3). Так, в 1-й группе по сравнению со 2-й группой пациентов значимо чаще отмечался проксимальный уровень поражения ИСА, а наличие стеноза или окклюзии на среднем или дистальном уровне коронарной ИСА не было ассоциировано с увеличением частоты возникновения феномена no-/slow-reflow (p=0,89).
Анализ ROC-кривой (рис. 2) у больных ИМ подтвердил зависимость частоты возникновения феномена no-/slow-reflow от времени от начала болевого синдрома до реваскуляризации. Построенная ROC-кривая вышеперечисленного параметра не пресекала линию нулевой прогностической значимости и ее AUC оказалась достаточно велика.
При проведении бинарной логистической регрессии было определено, что среди проанализированных параметров самыми значимыми предикторами развития феномена no-/slow-reflow являлись время "боль-баллон" (ОШ=1,03; 95% ДИ 0,95-0,996; p=0,02) и проксимальный уровень поражения ИСА (ОШ=3,33; 95% ДИ 1,67-6,57; p<0,001).
Таблица 1. Сравнение клинико-демографических характеристик пациентов изучаемых групп
|
Параметр |
1-я группа (n=59) |
2-я группа (n=149) |
p |
|
Возраст, лет |
66±12 |
64±11,5 |
0,398 |
|
Пол: муж/жен, ٪ |
59,3/40,7 |
70,5/29,5 |
0,122 |
|
ИМТ, кг/м2 |
27,3 (25,0; 32,0) |
27,6 (24,8; 31,5) |
0,842 |
|
Курение, n (٪) |
25 (42,4) |
72 (48,3) |
0,434 |
|
ГБ, n (٪) |
52 (89,7) |
137 (92) |
0,599 |
|
СД, n (٪) |
25 (42,4) |
34 (22,8) |
0,003 |
|
Пациенты с ХБП, n (٪) |
|||
|
С1 |
8 (13,6) |
18 (12,1) |
0,229 |
|
С2 |
24 (40,7) |
88 (59,1) |
|
|
С3а |
15 (25,4) |
27 (18,1) |
|
|
С3b |
7 (11,9) |
9 (6) |
|
|
С4 |
4 (6,8) |
5 (3,4) |
|
|
С5 |
1 (1,7) |
2 (1,3) |
|
|
ФП, n (٪) |
5 (8,6) |
14 (9,4) |
0,862 |
|
ИМ в анамнезе, n (٪) |
7 (12,1) |
26 (17,45) |
0,342 |
|
ЧКВ в анамнезе, n (٪) |
5 (8,6) |
17 (11,4) |
0,559 |
|
КШ в анамнезе, n (٪) |
0 (0) |
2 (1,34) |
0,375 |
|
Данные представлены в виде M±SD или Me (Q1; Q3), если не указано иное. ИМТ — индекс массы тела, ГБ — гипертоническая болезнь, СД — сахарный диабет, ХПБ — хроническая болезнь почек, С1 — скорость клубочковой фильтрации (СКФ) ≥90 мл/мин, С2 — СКФ 60-89 мл/мин, С3а — СКФ 45-59 мл/мин, С3b — СКФ 30-44 мл/мин, С4 — СКФ 15-29 мл/мин, С5 — СКФ <15 мл/мин |
|||
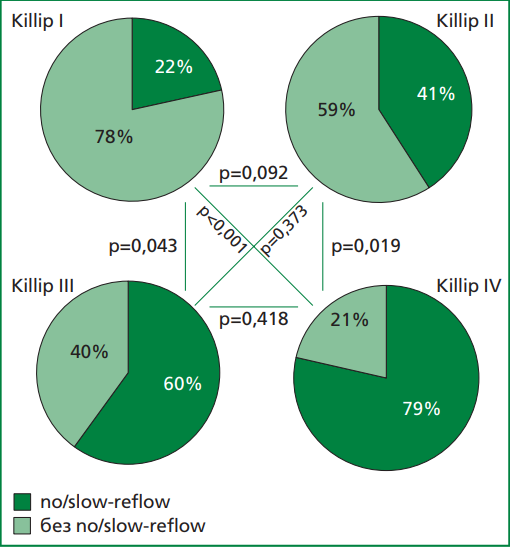
Рисунок 1. Доля пациентов с наличием феномена no-/slow-reflow в зависимости от класса ОСН по Killip среди пациентов, включенных в исследование, ОСН — острая сердечная недостаточность
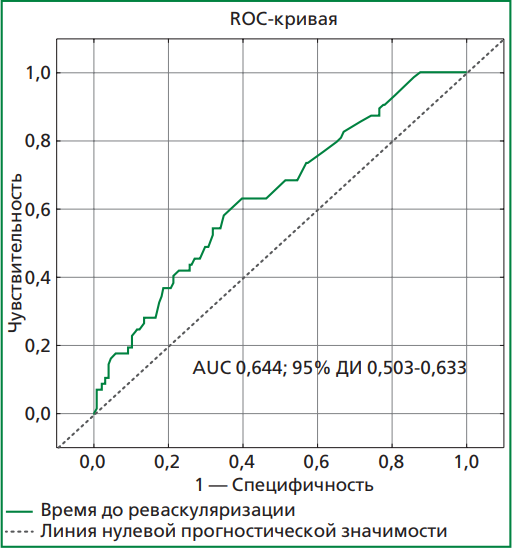
Рисунок 2. ROC-кривая влияния времени ишемии миокарда
Таблица 2. Сравнение ангиографических характеристик пациентов изучаемых групп
|
Параметр |
1-я группа (n=59) |
2-я группа (n=149) |
p |
|
Тип коронарного кровоснабжения у пациентов на КАГ, n (٪) |
|||
|
Правый тип |
46 (77,97) |
126 (84,56) |
0,525 |
|
Левый тип |
5 (8,57) |
9 (6,04) |
|
|
Сбалансированный тип |
8 (13,56) |
14 (9,4) |
|
|
Инфаркт-связанная артерия, n (٪) |
|||
|
Передняя межжелудочковая артерия |
33 (55,93) |
62 (41,61) |
0,657 |
|
Правая коронарная артерия |
17 (28,81) |
55 (36,91) |
|
|
Ветви тупого края |
1 (1,69) |
2 (1,34) |
|
|
Огибающая ветвь левой коронарной артерии |
4 (6,78) |
19 (12,75) |
|
|
Диагональные ветви |
1 (1,69) |
2 (1,34) |
|
|
Интермедиарная артерия |
0 (0) |
2 (1,34) |
|
|
Ствол левой коронарной артерии |
1 (1,69) |
3 (2,01) |
|
|
Многососудистое поражение |
2 (3,39) |
4 (2,68) |
|
Таблица 3. Уровень поражения инфаркт-связанной артерии у пациентов изучаемых групп
|
Уровень поражения инфаркт-связанной артерии |
1-я группа (n=59) |
2-я группа (n=149) |
p |
|
Проксимальный, n (٪) |
52 (88,14) |
59 (39,60) |
<0,001 |
|
Средний, n (٪) |
6 (10,17) |
78 (52,35) |
|
|
Дистальный, n (٪) |
1 (1,69) |
12 (8,05) |
Обсуждение
Феномен невосстановленного коронарного кровотока изучается многие годы и даже десятки лет, но до настоящего времени нет единого мнения о причинах его развития, о его проявлениях и даже о его корректном названии [5]. Установлено, что у пациентов с ОКС развитие этого феномена препятствует достижению адекватного кровотока ИСА и в микроциркуляторном русле, в результате чего происходит дезадаптивное ремоделирование миокарда с развитием гиперплазии, фиброза, формирование постинфарктной аневризмы ЛЖ, что заметно увеличивает риск неблагоприятных клинических исходов, включая смерть, повторный ИМ, уменьшение фракции выброса левого желудочка, злокачественную желудочковую аритмию, хроническую сердечную недостаточность и риск развития механических осложнений инфаркта миокарда [ 6][7].
Феномен невосстановленного кровотока в нашем исследовании развивался у 2,8% процентов пациентов, госпитализированных с ОКС. В работе R. W. Harrison и соавт. частота невосстановленного кровотока составляет 2,3% [8], что близко к полученному нами показателю, но, в целом, по данными литературы, частота развития феномена no-/slow-reflow варьирует от 2% до 44% [2][4][5][7][9-16]. Такие разные данные, возможно, объясняются разными методами диагностики этого феномена, гетерогенностью генетико-демографическим факторов в исследуемых выборках пациентов.
По полученным нами данным, такие факторы, как возраст, пол, индекс массы тела, курение, наличие в анамнезе ГБ, ХБП, ФП, ИМ в прошлом, выполненных ранее ЧКВ и КШ не были ассоциированы с возникновением феномена no-/slow-reflow. Литературные данные свидетельствуют о возможной взаимосвязи некоторых из клинико-демографических факторов с развитием феномена невосстановленного кровотока [10-13]. По данным индийских специалистов, имеется связь пожилого возраста, мужского пола, анамнеза ИБС, ГБ с развитием феномена невосстановленного кровотока, при этом отмечается, что курение является парадоксальным фактором, уменьшающим риск его возникновения у пациентов с ИМ [7]. По-видимому, можно предположить, что противоречивые результаты исследований можно объяснить разными критериями включения больных в выборки, а также этническими и демографическими особенностями пациентов.
По данным A. Kaya и соавт. наличие ФП у пациентов с ИМ ассоциировано с развитием феномена невостановленного коронарного кровотока при выполнении ЧКВ [17]. Однако, возможным объяснением наблюдавшейся закономерности, была не ФП сама по себе, а то, что пациенты с ФП были старше, имели больше коморбидных состояний, со значимо более низкой фракцией выброса левого желудочка и более выраженным поражением коронарного русла по данным ангиографии.
В проанализированной нами выборке пациентов феномен no-/slow-reflow в 2,6 раза чаще наблюдался у пациентов с СД по сравнению с пациентами без такового. Об ассоциации наличия СД и или стрессовой гипергликемии и данного феномена при коронароангиографии сообщают и другие исследователи [18-21]. Возможно, что взаимосвязь между нарушением углеводного обмена и развивающимся феноменом невосстановленного коронарного кровотока лежит в плоскости влияния гипергликемии на функцию эндотелия сосудистой стенки [22][23], которая является одним из звеньев патогенеза возникновения невосстановленного кровотока. В то же время развитие острой гипергликемии является следствием системной реакции организма на возникающее при ИМ повреждение, и её возникновение, не изученное ещё до конца, связано с выделением катехоламинов, кортизола и др. стероидов, а также цитокинов [24]. При этом в фундаментальных исследованиях глюкозотоксические механизмы повреждения описаны в основном на основании изучения больных с хронической гипергликемией [22]. Поэтому, вероятнее всего, именно наличие СД и существующей микроангиопатии ассоциировано с возникновением феномена no-/slow-reflow, в то время как стрессовая гипергликемия лишь дополнительно усиливает уже существующую эндотелиальную дисфункцию и тромбообразование.
В нашей работе отмечена ассоциация феномена no-/slow-reflow с ОНМК в анамнезе. Этот факт можно объяснить, предположительно, тем, что больные с перенесенным ранее ОНМК могут иметь снижение когнитивных функций, в результате чего обращаются за медицинской помощью позднее, чем пациенты без инсульта в анамнезе. Это гипотеза подтверждается в нашем исследовании: у больных с ОНМК и феноменом no-/slow-reflow среднее время ишемии составило более 8 ч, а у пациентов без анамнеза ОНМК и невосстановленным кровотоком — 7 ч.
Нами была продемонстрирована выраженная ассоциация тяжести ОСН у пациентов с ОКС и развитием феномена no-/slow-reflow при ЧКВ. Такие закономерности описывают и другие исследователи [10][13][14][16][19]. По-видимому механизмы, ассоциированные с сердечной недостаточностью (нейрогуморальная активация, воспалительные реакции и оксидативный стресс, эскалация гипоксического и ишемического повреждения, вазоспазм и другие) самым непосредственным образом вовлечены в патогенез не только ОСН, но и феномена невосстановленного кровотока [3, 25].
В нашей работе частота наступления летальных исходов в стационаре среди пациентов с ОКС при наличии феномена no-/slow-reflow была значимо выше, чем у пациентов с нормальным кровотоком в коронарных артериях. R. W. Harrison с соавт. [8], и A. Kaya с соавт. [17] описывают похожие результаты, а Z. Stajic с соавт. [16] отметили и долгосрочный неблагоприятный прогноз у пациентов с эти феноменом. Вероятно, эти закономерности объясняются тем, что у больных с феноменом no-/slow-reflow формируется более значительный объём нефункционирующего миокарда, низкая фракция выброса левого желудочка, что приводит к острой и хронической сердечной недостаточности, большему риску фатальных аритмий.
Объективно повлиять на общее время ишемии миокарда достаточно сложно. Часто оно зависит от самих больных и своевременном обращении за медицинской помощью. В нашем исследовании время ишемии миокарда было определено как предиктор развития феномена no-/slow-reflow, подобные наблюдения сделаны и на похожих популяциях пациентов в других стационарах [10-11][16][26-28]. Так в исследовании И. С. Бессонова и соавт. было показано, что увеличение времени до реваскуляризации >360 мин коррелирует с большей частотой возникновения феномена невосстановленного кровотока [26]. Чем дольше продолжается ишемия миокарда, тем больше повреждается клеток и тканей, происходит эскалация таких процессов, как набухание эндотелиоцитов, адгезия лейкоцитов к внутренней оболочке артерий, обтурация лейкоцитами и тромбоцитами капилляров, повышение сосудистой проницаемости и межклеточный отек, диапедез эритроцитов и нейтрофилов. Результатом всех этих реакций является отсутствие адекватного кровотока ткани миокарда даже после того, как ИСА становится проходима.
Ограничение исследования
Наша работа представляет собой одноцентровое исследование, что могло отражаться в формировании единого мнения в диагностике; имеет сравнительно небольшой размер выборки. Данная публикация представляет первую (клиническую) часть полученных данных проведенного многолетнего регистра регионального сосудистого центра г. Москвы.
Заключение
Развитие феномена no-/slow-reflow отмечено у 2,8% пациентов с ОКС в клинической практике ГКБ№1 им. Н. И. Пирогова (Москва). Развитие данного феномена ассоциировалось с увеличением частоты неблагоприятного исхода заболевания в стационаре. Такие факторы риска, как общее время ишемии миокарда, СД, ОНМК в анамнезе, класс ОСН по Killip при поступлении, чаще были ассоциированы с развитием феномена no-/slow-reflow. Из всех проанализированных факторов время "боль-баллон" и проксимальный уровень поражения ИСА являлись независимыми предикторами развития феномена no-/slow-reflow.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование. Исследование выполнено при поддержке РНИМУ им. Н. И. Пирогова.
Funding. The study was supported by N. I. Pirogov Russian National Research Medical University.
Список литературы
1. Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):251-310. DOI:10.15829/1560-4071-2020-4103.
2. Li H, Fu DG, Liu FY, et al. Evaluation of related factors, prediction and treatment drugs of no-reflow phenomenon in patients with acute ST-segment elevation myocardial infarction after direct PCI. Exp Ther Med. 2018;15(4): 3940-6. DOI:10.3892/etm.2018.5900.
3. Гиляров М.Ю., Иванов И.И., Константинова Е.В., и др. Феномен no-reflow и реперфузионное повреждение миокарда: механизмы и методы лечения. Клиницист. 2021;15(1-4):10-9. DOI:10.17650/1818-8338-2021-15-1-4-K645.
4. Журавлев А.С., Азаров А.В., Семитко С.П., Иоселиани Д. Г. Феномен no-reflow во время первичного чрескожного коронарного вмешательства у пациентов с острым инфарктом миокарда с подъемом сегмента ST, обусловленным массивным коронарным тромбозом. Патогенез и предикторы no-reflow. Кардиология. 2021;61(2):99-105. DOI:10.18087/cardio.2021.2.n1175.
5. Konijnenberg LSF, Damman P, Duncker DJ, et al. Pathophysiology and diagnosis of coronary microvascular dysfunction in ST-elevation myocardial infarction. Cardiovasc Res. 2020;116(4):787-805. DOI:10.1093/cvr/cvz301.
6. Алексеева Я.В., Вышлов Е.В., Павлюкова Е.Н., и др. Влияние разных фенотипов микрососудистого повреждения миокарда на сократительную функцию левого желудочка у пациентов с инфарктом миокарда с подъемом сегмента ST. Кардиология, 2021;61(5):23-31. DOI:10.18087/cardio.2021.5.n1500.
7. Fajar JK, Heriansyah T, Rohman MS. The predictors of no reflow phenomenon after percutaneous coronary intervention in patients with ST elevation myocardial infarction: A meta-analysis. Indian Heart J. 2018;70 Suppl 3(Suppl 3):S406-18. DOI:10.1016/j.ihj.2018.01.032
8. Harrison RW, Aggarwal A, Ou FS, et al; American College of Cardiology National Cardiovascular Data Registry. Incidence and outcomes of noreflow phenomenon during percutaneous coronary intervention among patients with acute myocardial infarction. Am J Cardiol. 2013;111(2):178-84. DOI:10.1016/j.amjcard.2012.09.015.
9. Şahin DY, Gür M, Elbasan Z, et al. SYNTAX score is a predictor of angiographic no-reflow in patients with ST-elevation myocardial infarction treated with a primary percutaneous coronary intervention. Coron Artery Dis. 2013;24(2):148-53. DOI:10.1097/MCA.0b013e32835c4719.
10. Liang T, Liu M, Wu C, et al. Risk Factors for No-Reflow Phenomenon after Percutaneous Coronary Intervention in Patients with Acute Coronary Syndrome. Rev Invest Clin. 2017;69(3):139-45. DOI:10.24875/ric.17002190.
11. Namazi M, Mahmoudi E, Safi M, et al. The No-reflow Phenomenon: Is it Predictable by Demographic factors and Routine Laboratory Data? Acta Biomed. 2021;92(5):e2021297. DOI:10.23750/abm.v92i5.10053.
12. Yang L, Cong H, Lu Y, et al. A nomogram for predicting the risk of no-reflow after primary percutaneous coronary intervention in elderly patients with ST-segment elevation myocardial infarction. Ann Transl Med. 2021;9(2):126. DOI:10.21037/atm-20-8003.
13. Liu Y, Ye T, Chen K, et al. A nomogram risk prediction model for no-reflow after primary percutaneous coronary intervention based on rapidly accessible patient data among patients with ST-segment elevation myocardial infarction and its relationship with prognosis. Front Cardiovasc Med. 2022;9: 966299. DOI:10.3389/fcvm.2022.966299.
14. Aggarwal P, Rekwal L, Sinha SK, et al. Predictors of no-reflow phenomenon following percutaneous coronary intervention for ST-segment elevation myocardial infarction. Ann Cardiol Angeiol (Paris). 2021;70(3):136-42. DOI:10.1016/j.ancard.2021.04.004.
15. Chettibi M, Benghezel S, Bertal S, et al. No reflow: quels facteurs prédictifs? [No reflow: What are the predictors?]. Ann Cardiol Angeiol (Paris). 2015; 64(6):472-80. French. DOI:10.1016/j.ancard.2015.09.059.
16. Stajic Z, Milicevic D, Kafedzic S, et al. Predicting no-reflow phenomenon prior to primary percutaneous coronary intervention using a novel probability risk score derived from clinical and angiographic parameters. Eur Rev Med Pharmacol Sci. 2022;26(3):759-70. DOI:10.26355/eurrev_202202_27984.
17. Kaya A, Keskin M, Tatlisu MA, et al. Atrial Fibrillation: A Novel Risk Factor for No-Reflow Following Primary Percutaneous Coronary Intervention. Angiology 2020;71(2):175-82. DOI:10.1177/0003319719840589.
18. Dogan NB, Ozpelit E, Akdeniz S, et al. Simple clinical risk score for noreflow prediction in patients undergoing primary Percutaneous Coronary Intervention with acute STEMI. Pak J Med Sci. 2015;31(3):576-81. DOI:10.12669/pjms.313.7484.
19. Garzon S. No Reflow in Acute Coronary Syndromes: An Old Foe or a New Frontier? Arq Bras Cardiol. 2021;116(5):968-9. English, Portuguese. DOI:10.36660/abc.20210118.
20. Khalfallah M, Maria DA, Allaithy A. Impact of Stress Hyperglycemia on NoReflow Phenomenon in Patients with ST Elevation Myocardial Infarction Undergoing Primary Percutaneous Coronary Intervention. Glob Heart. 2022;17(1):23. DOI:10.5334/gh.1111.
21. Бессонов И.С., Кузнецов В.А., Зырянов И.П., и др. Влияние сахарного диабета и уровня гликемии на результаты лечения пациентов с острым инфарктом миокарда с подъемом сегмента ST, подвергшихся чрескожным коронарным вмешательствам. Кардиология. 2019;59(3S):16-22. DOI:10.18087/cardio.2520.
22. Tabit CE, Chung WB, Hamburg NM, Vita JA. Endothelial dysfunction in diabetes mellitus: molecular mechanisms and clinical implications. Rev Endocr Metab Disord. 2010;11(1):61-74. DOI:10.1007/s11154-010-9134-4.
23. Clyne AM. Endothelial response to glucose: dysfunction, metabolism, and transport. Biochem Soc Trans. 2021;49(1):313-25. DOI:10.1042/BST20200611.
24. Kalogeris T, Baines CP, Krenz M, Korthuis RJ. Ischemia/Reperfusion. Compr Physiol. 2016;7(1):113-70. DOI:10.1002/cphy.c160006.
25. Alem MM. Endothelial Dysfunction in Chronic Heart Failure: Assessment, Findings, Significance, and Potential Therapeutic Targets. Int J Mol Sci. 2019;20(13):3198. DOI:10.3390/ijms20133198.
26. Бессонов И.С., Кузнецов В.А., Горбатенко Е.А., и др. Влияние общего времени ишемии миокарда на результаты лечения пациентов с острым инфарктом миокарда с подъемом сегмента ST на электрокардиограмме. Кардиология. 2021;61(2):40-6. DOI:10.18087/cardio.2021.2.n1314.
27. Yu Y, Wu Y, Wu X, et al. Risk Factors for no-reflow in patients with STElevation myocardial infarction who underwent percutaneous coronary intervention: a case-control study. Cardiol Res Pract. 2022;2022:3482518. DOI:10.1155/2022/3482518.
28. Ruíz-Avalos JA, Bazán-Rodríguez L, Espinoza-Escobar G, et al. Predictors in noreflow phenomenon in acute myocardial infarction with ST-segment elevation. Arch Cardiol Mex. 2022;92(4):461-8. English. DOI:10.24875/ACM.21000346.
Об авторах
Е. В. КонстантиноваРоссия
Константинова Екатерина Владимировна, доцент кафедры факультетской терапии им. акад. А.И.Нестерова ЛФ, профессор кафедры интервенционной кардиологии и кардиореабилитации ФДПО ИНПОИПР РНИМУ им. Н.И.Пирогова; врач кардиолог ГКБ№1 им. Н.И.Пирогова
Москва
Ю. С. Ильин
Россия
Ильин Юрий Сергеевич, студент
Москва
А. А. Великоцкий
Россия
Великоцкий Антон Александрович, врач отделения ренгенхирургических методов диагностики и лечения
Москва
Н. А. Рахими
Россия
Рахими Навид Ахмад, аспирант кафедры интервенционной кардиологии и кардиореабилитации
Москва
А. А. Богданова
Россия
Богданова Александра Андреевна, доцент кафедры интервенционной кардиологии и кардиореабилитации
Москва
Е. В. Площенков
Россия
Площенков Евгений Валерьевич, заведующий отделения ренгенхирургических методов диагностики и лечения
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Константинова Е.В., Ильин Ю.С., Великоцкий А.А., Рахими Н.А., Богданова А.А., Площенков Е.В. Клинические факторы, ассоциированные с развитием феномена невосстановленного коронарного кровотока у пациентов с острым коронарным синдромом. Рациональная Фармакотерапия в Кардиологии. 2024;20(1):27-34. https://doi.org/10.20996/1819-6446-2024-2994. EDN: OPPLHS
For citation:
Konstantinova E.V., Ilin Yu.S., Velikotskiy A.A., Rakhimi N.A., Bogdanova A.A., Ploshchenkov A.V. Clinical factors associated with the no/slow-reflow phenomenon in patients with acute coronary syndrome. Rational Pharmacotherapy in Cardiology. 2024;20(1):27-34. (In Russ.) https://doi.org/10.20996/1819-6446-2024-2994. EDN: OPPLHS

















































