Перейти к:
Практические подходы к антимикробной терапии инфекционного эндокардита в аспекте национальных и европейских клинических рекомендаций
https://doi.org/10.20996/1819-6446-2024-3006
EDN: CKUHKC
Аннотация
Инфекционный эндокардит (ИЭ) — редкое заболевание с потенциально высоким уровнем летальности, отличающееся изменением "портрета" пациента — увеличением доли лиц пожилого возраста с сопутствующими заболеваниями и дегенеративными пороками, протезированными клапанами и малоинвазивными кардиальными операциями, имплантированными внутрисердечными устройствами, на гемодиализе. Дополнительный весомый негативный вклад вносят увеличение видового разнообразия возбудителей, снижение доли стрептококков, неуклонный рост стафилококковой и энтерококковой принадлежности ИЭ. Успех лечения ИЭ зависит от грамотного назначения антибактериальной терапии. В арсенале врача имеются два основных документа — национальные клинические рекомендации "Инфекционный эндокардит и инфекция внутрисердечных устройств" 2021 г. и европейские клинические рекомендации "ESC Guidelines for the management of endocarditis" 2023 г. В статье обобщены обновленные данные по оптимальному назначению антибактериальной терапии, изложенные в удобном и понятном для практикующего врача формате. Представлены схемы для назначения внутривенной антибактериальной терапии в стационаре не только для традиционных возбудителей (стафилококки, стрептококки и энтерококки), но и для вызывающих значительные трудности редко встречающихся патогенов (возбудители группы HACEK и не-HACEK, Coxiella burnetii, Bartonella sp., Brucella sp., Tropheryma whipplei, Mycobacterium sp., грибы). Подробно изложены принципы эмпирической антибактериальной терапии с наиболее эффективными схемами лечения не только для левостороннего ИЭ, но и для разных вариантов правостороннего ИЭ. Представлены новые современные возможности амбулаторной пероральной антибактериальной терапии ИЭ. В заключении предложены перспективы развития консервативного лечения ИЭ.
Для цитирования:
Котова Е.О., Кобалава Ж.Д. Практические подходы к антимикробной терапии инфекционного эндокардита в аспекте национальных и европейских клинических рекомендаций. Рациональная Фармакотерапия в Кардиологии. 2024;20(1):85-102. https://doi.org/10.20996/1819-6446-2024-3006. EDN: CKUHKC
For citation:
Kotova E.O., Kobalava Zh.D. Practical approaches to antimicrobial therapy for infective endocarditis in the context of national and European clinical guidelines. Rational Pharmacotherapy in Cardiology. 2024;20(1):85-102. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3006. EDN: CKUHKC
Введение
Инфекционный эндокардит (ИЭ) — редкое, но крайне тяжёлое заболевание с потенциально высоким уровнем летальности, поражающее в первую очередь наиболее уязвимые группы пациентов: лица с протезированными клапанами/имплантированными внутрисердечными устройствами, врожденными пороками сердца, на гемодиализе и стареющее население, особенно в странах с высоким уровнем дохода [1][2]. По данным регистра ESC-EORP EURO-ENDO (первое международное проспективное когортное исследование по ИЭ 2017-2019 г.) средний возраст пациентов с ИЭ составил 63 года, 46,0% относились к группе 65 лет и старше [3]. По данным нашего локального регистра на базе Российского университета дружбы народов имени Патриса Лумумбы (ФГБУЗ "КБ им. В. В. Виноградова" г. Москва) средний возраст пациентов составил 54,5 лет, лица старше 60 лет — 43,5% [4].
Традиционно неблагоприятный сценарий течения ИЭ обусловлен рядом причин — трудности своевременной диагностики заболевания, частое отсутствие и/или неверное представление об этиологии болезни, напрямую ограничивающие выбор действенной антибактериальной терапии, а также хрупкость самих пациентов, вызванная непосредственно инфекцией, возрастом, сопутствующей патологией и большой длительностью госпитализации.
Таким образом становится очевидным, что проблема распознавания и лечения ИЭ является гораздо более масштабной. Несмотря на то, что с одной стороны имеется значительное улучшение диагностики ИЭ (совершенствование и появление новых методов визуализации и этиологической верификации — эхокардиографии, позитронной эмиссионной компьютерной томографии, однофотонной эмиссионной компьютерной томографии, совершенствование микробиологических методов, в том числе с включением методов масс-спектрометрии (MALDI-TOF MS), внедрение молекулярно-биологических и иммунохимических методов), мы наблюдаем рост заболеваемости ИЭ в развитых странах с изменением "портрета" пациента (увеличение доли пациентов пожилого возраста с сопутствующими заболеваниями и дегенеративными пороками, пациентов с малоинвазивными операциями по пластике или имплантации клапанов, с постановкой широкого спектра внутрисердечных устройств, с частыми инвазивными медицинскими процедурами, использованием иммуносупрессивных лекарственных препаратов и заместительной почечной терапии) [1-6]. В дополнение к вышесказанным аспектам весомый негативный вклад вносит трансформация этиологической картины — увеличение видового разнообразия возбудителей, снижение доли стрептококков, неуклонный рост стафилококковой и энтерококковой принадлежности ИЭ [1-3][5].
В настоящее время в арсенале врача имеются два важных документа: в 2021 г. Министерством здравоохранения Российской Федерации одобрены первые национальные клинические рекомендации "Инфекционный эндокардит и инфекция внутрисердечных устройств", а в 2023 г. вышли обновленные рекомендации Eвропейского общества кардиологов "ESC Guidelines for the management of endocarditis", содержащие актуальные представления по диагностике и лечению ИЭ [1][2].
Цель настоящей статьи — обобщение данных по возможностям антимикробной терапии и представление их в новом, удобном варианте в аспекте работы практикующего врача.
Общие принципы и виды антибактериальной терапии ИЭ
Основным постулатом для лечения пациентов с ИЭ является комплексный подход. Ключевые принципы лечения ИЭ сложились давно и могут быть представлены следующими положениями:
- антибактериальная терапия должна начинаться как можно раньше, с момента диагностики ИЭ, и соответствовать действующим клиническим рекомендациям, в том числе при вероятном диагнозе ИЭ. Несвоевременное начало лечения может скоротечно привести к разрушению клапанного аппарата и развитию сердечной недостаточности, значительно увеличить риск тромбоэмболических осложнений и персистирующей бактериемии с гематогенной диссеминацией;
- стартовая антибактериальная терапия, как правило, является эмпирической, но необходимо стремиться к максимально быстрому переходу к этиотропной антибактериальной терапии, оптимально через 24-48 ч. При этом большое значение имеет получение быстрых результатов этиологической диагностики (оценка при окраске по Граму, проведение масс-спектрометрии (MALDI-TOF MS));
- парентеральный (чаще внутривенный) путь введения антибактериальных препаратов до клинической стабилизации;
- использование максимальных суточных доз 2 и более бактерицидных антибактериальных препаратов;
- выполнение кардиохирургического лечения на как можно более ранних этапах при наличии показаний;
- проведение патогенетической и симптоматической терапии сердечной недостаточности;
- своевременная диагностика и коррекция осложнений ИЭ.
При выборе режима антибактериальной терапии необходимо учитывать следующий ряд факторов:
- внебольничный или нозокомиальный ИЭ — для нозокомиального ИЭ высока вероятность грамотрицательных внутрибольничных возбудителей и коагулазонегативных стафилококков (CoNS);
- ИЭ нативного или протезированного клапана — для ИЭ протеза клапана высоковероятна стафилококковая этиология;
- длительность сроков после кардиохирургического протезирования клапанов (до 12 мес, более 12 мес) — для раннего ИЭ протеза клапана высоковероятны грамотрицательные внутрибольничные возбудители и коагулазонегативные стафилококки (CoNS);
- наличие имплантированных внутрисердечных устройств — высоковероятна стафилококковая этиология, особенно CoNS;
- индивидуальные особенности пациента — иммуносупрессия, вредные привычки, эпидемиологический анамнез, индивидуальная непереносимость лекарств (в первую очередь β-лактамных препаратов) и др.;
- показания для коррекции дозы и интервала введения антибактериального препарата с учетом функции почек/печени;
- длительность антибактериальной терапии традиционно составляет 4-6 нед (в некоторых случаях может быть сокращена до 2 нед или, наоборот, быть неопределённо долгой).
Предпочтительным является мультидисциплинарный подход к ведению практически каждого пациента с ИЭ, так называемой "командой эндокардита", в первую очередь включающей врача-кардиолога, врача-клинического фармаколога, врача ультразвуковой диагностики, врача-микробиолога и врача сердечно-сосудистого хирурга [1][2].
Эмпирическая антибактериальная терапия
В настоящее время известно более 140 видов возбудителей, ассоциированных с этиологической принадлежностью к ИЭ [1][5]. Выбор эмпирической терапии основан на назначении антибактериальных препаратов, в первую очередь перекрывающих наиболее вероятный спектр патогенов ИЭ. Последние годы ознаменовались появлением серии публикаций, на основании которых этиологическую структуру современного ИЭ можно представить следующим образом:
- наиболее часто встречающаяся тройка возбудителей — стафилококки (Staphylococcus aureusи CoNS метициллинчувствительные/резистентные), энтерококки (Enterococcus faecalis, Enterococcus faecium), стрептококки (в первую очередь комменсалы полости рта из группы Streptococcus viridans) ≈63,0%;
- Грамотрицательные возбудители, представленные группой HACEKи не-HACEK(Pseudomonas sp., Enterobacter sp., Escherichia sp., Klebsiella sp.) составляют 2,8-7,8%;
- Редкие патогены (Brucella sp., Bartonella sp., Coxiella burnetii, Tropheryma whipplei, Mycoplasma sp., Chlamydophila sp.) составляют 0,8-0,9%;
- Грибы (Candida sp., Aspergillus sp.) составляют 0,3% [1-3][5].
Первоочередное значение для выбора правильной эмпирической антибактериальной терапии имеет понимание вида левостороннего ИЭ — внебольничный ИЭ нативного клапана/поздний ИЭ протеза клапана (>12 мес) или нозокомиальный ИЭ/ранний ИЭ протеза клапана (≤12 мес). При этом принципиально важной является вероятность ИЭ, ассоциированного с метициллинрезистентными штаммами S. aureus/CoNS. Особое значение имеет выделение раннего ИЭ протеза клапана и нозокомиального ИЭ, как наиболее часто ассоциированных с метициллинрезистентными формами S. aureus и CoNS [1][2].
В целом, когда речь идет о традиционном сценарии развития внебольничного ИЭ нативного клапана/позднего ИЭ протеза клапана, предпочтительно назначение тройной комбинации антибактериальных препаратов — ампициллин одновременно сочетается с антистафилококковым β-лактамным препаратом (оптимально оксациллин или цефазолин) в комплексе с гентамицином (табл. 1) [1][2][7]. Отдельно отметим, что назначение цефтриаксона или цефотаксима (цефалоспорины III поколения) для эмпирической терапии ИЭ возможно, но их выбор не будет оптимальным, так как они обладают невысокой антистафилококковой активностью и, следовательно, будут уступать по эффективности оксациллину или цефазолину. Также ввиду трудной доступности внутривенных форм ампициллина, альтернативной может быть назначение защищенного препарата (ампициллин 1 г + сульбактам 0,5 г) в дозе 3 г каждые 6 ч внутривенно (в/в) капельно [1][2], однако следует понимать, что доза ампициллина не будет максимальной и составит всего 8 г/сут., вместо 12 г/сут.
В случае наличия аллергической реакции на препараты из группы пенициллинов, рекомендовано их заменить на цефазолин или ванкомицин. Однако, так как цефазолин также является представителем β-лактамных антибактериальных препаратов, необходимо правильно оценить соотношение пользы и риска в зависимости от тяжести аллергической реакции. В случае развития аллергической реакции немедленного типа (анафилактический шок, отек Квинке), препаратом выбора для эмпирической терапии ИЭ нативного клапана/позднего ИЭ протеза клапана является комбинация ванкомицина с гентамицином [1][2]. Однако при этом ванкомицин является заведомо не оптимальным препаратом в отношении метициллинчувствительного S. aureus, что приведет к необходимости коррекции терапии после получения данных об этиологической принадлежности ИЭ.
В отношении нозокомиального ИЭ или раннего ИЭ протеза клапана (≤12 мес) принципиально важно учитывать активность антибактериальных препаратов в отношении метициллинрезистентных представителей S. aureus или CoNS, в связи с чем нецелесообразно назначение антистафилококковых пенициллинов. Опцией выбора будет являться назначение ванкомицина или даптомицина в комбинации с гентамицином [1][2]. Особо отметим, что в случае с ИЭ протеза клапана необходимо назначение третьего препарата — рифампицина на 3-5-е сутки антибактериальной терапии, как препарата, высокоактивного против бактерий, находящихся в биологических пленках на протезах клапанов [1][2][8].
В отношении выбора эмпирической антибактериальной терапии для правостороннего ИЭ необходимо иметь представление о виде и клинической ситуации для развития заболевания. Можно выделить следующие основные клинические варианты:
- ИЭ у пациентов, употребляющих внутривенные психоактивные препараты— в данной ситуации опцией выбора будет являться назначение оксациллина или цефазолина в сочетании с гентамицином. Однако если известно конкретно, какой психоактивный препарат употребляет пациент, то выбор исходной терапии может быть скорректирован: при употреблении в/в пентазоцина высока вероятность инфицирования Pseudomonas aeruginosa (cинегнойная палочка), что сделает целесообразным стартовое назначение антибактериальных препаратов с антисинегнойной активностью; при употреблении коричневого героина в лимонном соке — высока вероятность инфицирования грибами рода Candida sp., что позволит сделать выбор в пользу комбинации антибактериальных препаратов с противогрибковыми [1][2][9][10]. Данные аспекты крайне важно учитывать до этиологической верификации ИЭ, так как у лиц, употребляющих внутривенные психоактивные препараты, как правило ИЭ протекает бурно и остро, в связи с чем промедление может быть опасным;
- ИЭ имплантированных внутрисердечных устройств— в этой ситуации высока вероятность инфицирования метициллинрезистентными CoNS или S. aureus, зачастую обусловленная большей частотой контакта с медицинскими учреждениями и постановкой внутрисосудистых доступов, поэтому в качестве стартовой антибактериальной терапии целесообразно назначение ванкомицина или даптомицина в сочетании с гентамицином [1][2][11].
Безусловно, стартовая эмпирическая антибактериальная терапия не будет являться оптимальной, поэтому помимо уточнения факторов риска и источника инфицирования с определением наиболее вероятного возбудителя ИЭ, параллельно необходимо приложить максимальные усилия для выявления этиологической принадлежности ИЭ.
ИЭ является непростым для диагностики и лечения заболеванием, в том числе в связи со сложным этиологическим алгоритмом. Первоначальное определение возбудителя ИЭ начинается с традиционного микробиологического исследования крови. При этом следует отметить, что абсолютное большинство возбудителей ИЭ относятся к категории хорошо выявляемых патогенов. Микробиологическое исследование крови должно выполняться любому пациенту с подозрением на ИЭ и требует соблюдение ряда непреложных правил:
- исследование проводится не менее 3 раз, при этом за один раз кровь распределятся во флаконы с аэробной и анаэробной питательной средой (всего 6 флаконов), а в каждый флакон вносится не менее 10 мл биологического материала;
- интервалы время между взятием проб должны составлять не менее 30 мин;
- кровь для исследования берется только из периферических вен (недопустимо взятие крови из центральных катетеров);
- кровь берется до начала антибактериальной терапии;
- не обязательно взятие крови на высоте лихорадки;
- необходимо использовать специальные коммерческие флаконы, которые инкубируются в автоматических анализаторах для гемокультур;
- в случае определения роста возбудителя, необходимо первым этапом выполнить исследование с окраской по Граму и полученные предварительные результаты обязательно сообщить врачу;
- для быстрой и точной идентификации возбудителя рекомендовано использование методов масс-спектрометрии (MALDI-TOF MS);
- для выявленных возбудителей необходимо обязательное определение антибиотикочувствительности с определением минимальной ингибирующей концентрации препаратов, в первую очередь для представителей группы Streptococcus sp.и Enterococcus sp. [1][2][12].
Однако представленные сложности правильного выполнения микробиологического исследования одновременно ограничивают его возможности и приводят к высокой встречаемости неинформативных данных, обусловленных высокой частотой отрицательных (31-68%) и ложноположительных результатов с определением этиопатогенетически не связанного возбудителя с текущим эпизодом ИЭ [1, 2, 12, 13]. Очевидно, что от качества этиологической диагностики зависит эффективность назначаемой антибактериальной терапии, в связи с чем широко обсуждается применение дополнительных методов, таких как иммунохимических и молекулярно-биологических, которые также включены в алгоритм диагностики ИЭ [1, 2, 12]. Иммунохимические исследования проводятся для определения антител к редким возбудителям, таким как Brucella sp., Bartonella sp., Coxiella burnetii, Tropheryma whipplei, Mycoplasma sp., Chlamydophila sp. [1, 2, 14]. Однако в случае их выявления, необходимо обязательное подтверждение наличия генетического материала возбудителя молекулярно-биологическими методами (например, исследование крови/ткани клапана методом полимеразной цепной реакции, ПЦР). Ряд исследований показал, что ПЦР-исследование крови позволяет значительно повысить точность и частоту определения возбудителя при ИЭ в разных видах биологического материала — цельная венозная кровь/ткани резецированных клапанов [5, 15]. По нашим собственным результатам, добавление ПЦР-исследования крови к традиционному микробиологическому исследованию на любом этапе диагностики позволило увеличить количество положительных результатов с 58,9 до 76,6% [5]. Однако в целом следует отметить, что пока на данный момент ни одно из дополнительных этиологических исследований не является рутинной практикой, но за ними стоит полноценное будущее точной этиопатогенетической верификации ИЭ. Получение достоверных данных этиологической диагностики ИЭ позволит выполнить деэскалацию антибактериальной терапии с выбором этиотропных препаратов.
Таблица 1. Схемы эмпирической антибактериальной терапии ИЭ

Этиотропная антибактериальная терапия
Стрептококковый ИЭ
ИЭ, вызванный Streptococcus viridans (комменсалы полости рта, Str. mutans, Str. sanguis, Str. mitis, Str. salivarius, Str. oralis), Str. gallolyticus (ранее Str. bovis).
Стрептококковый ИЭ в развитых странах, в том числе в Российской Федерации (РФ) теряет свои лидирующие позиции и на долю Str. viridans приходится 3,2-12,4%, а на долю Str. gallolyticus 1,2-6,6% [1-3, 5]. Для этой группы возбудителей особенно важным является определение чувствительности изолятов к пенициллину, а также достаточная длительность антибактериальной терапии. В случае развития ИЭ, вызванного пенициллинчувствительными представителям стрептококков, классическим вариантом лечения является назначение монотерапии β-лактамными препаратами (природный пенициллин или ампициллин или цефтриаксон) на 4 нед для ИЭ нативного клапана и на 6 нед при ИЭ протеза клапана (табл. 2) [1, 2].
Для стрептококкового пенициллинчувствительного ИЭ нативного клапана есть дополнительная укороченная схема лечения на 2 нед, представленная комбинацией β-лактамного антибактериального препарата с гентамицином [1, 2, 16].
Для пациентов со стрептококковым пенициллинчувствительным ИЭ и аллергической реакцией на β-лактамные препараты рекомендовано назначить лечение ванкомицином на 4 нед для нативного клапана и на 6 нед для протеза клапана [1, 2].
В случае развития стрептококкового ИЭ с умеренной резистентностью к пенициллину (повышенная экспозиция пенициллина) или пенициллинрезистентного, опцией выбора является комбинация β-лактамных препаратов с гентамицином на срок от 4-6 нед в зависимости от вида клапана. Отдельно обратим внимание, что при этом увеличиваются дозы β-лактамных препаратов (пенициллина и ампициллина) с целью создания достаточной их концентрации в вегетациях [1, 2].
ИЭ, вызванный Str. pneumoniae
В отношении других видов стрептококков имеются некоторые особенности, так, для редкого варианта ИЭ, вызванного Str. pneumoniae, необходимо учитывать осложненное течение с развитием пневмонии и менингита (табл. 3) [1, 2, 17]. В случае развития менингита следует избегать назначения пенициллина из-за его плохого проникновения в спинномозговую жидкость [1, 2].
ИЭ, вызванный другими β-гемолитическими стреп-
тококками, Granulicatella sp. и Abiotrophia sp.
Касательно представителей Streptococcus sp. серогрупп A, B, C, G (Str. disgalactiae, Str. intermedius, Str. constellatus, Str. anginosus (Str. milleri), Str. pyogenes, Str. defectivus, Str. agalactiae и др.), а также Granulicatella sp. и Abiotrophia sp., вызванный ими ИЭ также встречается сравнительно редко, он часто ассоциирован с развитием абсцессов, поэтому помимо консервативного лечения, необходима высокая настороженность на проведение кардиохирургического лечения, особенно при развитии ИЭ протеза клапана. В целом антибактериальная терапия для этой группы возбудителей будет аналогичной Str. viridans, за исключением нерекомендованного короткого курса двухнедельной антибактериальной терапии [1, 2, 18, 19].
Стафилококковый ИЭ
Выбор лечения ИЭ, вызванного Staphylococcus aureus и коагулазонегативными стафилококками (S. saprophyticus, S. epidermidis, S. haemolyticus, S. hominis, S. warneri и др.) зависит от ряда факторов, среди которых наибольшее значение имеют — свойства самого изолята (метициллинчувствительные/резистентные штаммы), наличие аллергической реакции и ее тип к β-лактамным препаратам, тип пораженного клапана (нативный или протез) (табл. 4).
Классическим вариантом лечения ИЭ нативного клапана, вызванного метициллинчувствительными S.aureus или CoNS является назначение антистафилококкового β-лактамного антибактериального препарата — оксациллина или цефазолина [1, 2, 20].
В случае развития ИЭ протеза клапана назначение монотерапии антистафилококковыми β-лактамными препаратами недостаточно — проводится комбинированное лечение с гентамицином на 2 нед, а также на 3-5-е сутки дополнительно назначается рифампицин [1, 2, 20, 21]. Ряд исследований продемонстрировал эффективность добавления рифампицина для раннего ИЭ протеза клапана в отношении бактерий в составе биопленок, однако, так как он проявляет антагонизм по отношению к бактерицидным препаратам и снижает их эффективность, рифампицин следует назначать не ранее, чем на 3-5-е сутки от начала терапии [1, 2, 8]. Гентамицин назначается болюсно 1 р/сут в полной дозе не более, чем на 2 нед. Изменение режима введения и пролонгация приема препарата не целесообразна в связи с высокой вероятностью нефротоксичности [1, 2, 20].
При назначении альтернативных режимов лечения ИЭ нативного клапана, вызванного метициллинчувствительными стафилококками, необходимо учитывать степень выраженности аллергической реакции на пенициллины — при наличии реакции немедленного типа избегать их назначения, а также с осторожностью выбирать другие β-лактамные препараты.
Для ИЭ нативного клапана, вызванного метициллинчувствительнным стафилококком альтернативным режимом антибактериальной терапии является назначение даптомицина в высокой дозе 10-12 мг/кг/сут в сочетании с цефтаролином (цефалоспорин с анти-MRSA активностью) или фосфомицином с целью повышения эффективности гликолипопептида и селекции устойчивости к нему бактерий [1, 2, 20, 22]. В отношении ИЭ протеза клапана сохраняется аналогичная стратегия, но к представленной комбинации добавляется гентамицин на 2 нед и рифампицин на 3-5-е сутки.
Для пациентов с метициллинрезистентными S. aureus и CoNS существенных изменений в выборе тактики антибактериальной терапии не произошло. Для ИЭ нативного клапана по-прежнему схемой выбора является назначение ванкомицина в высокой дозе 30-60 мг/кг на 4-6 нед, а в случае с ИЭ протеза клапана — дополнительное назначение гентамицина на 2 нед и рифампицина с 3-5-го дня терапии [1, 2, 8, 20]. Отдельно отметим, что важное значение имеет лекарственный мониторинг, позволяющий назначать ванкомицин и гентамицин под контролем определения концентрации препаратов в плазме крови в связи с их нефротоксичностью. Альтернативные схемы антибактериальной терапии ИЭ, вызванного метициллинрезистентными стафилококками, также в первую очередь основаны на назначении даптомицина, продемонстрировавшего высокую антистафилококковую эффективность. Для ИЭ нативного клапана рекомендовано его сочетание с β-лактамными препаратами (оксациллин или цефтаролин) или с фосфомицином, а для ИЭ протеза клапана представленная комбинация дополняется гентамицином на 2 нед и рифампицином с 3-5-го дня терапии [1, 2, 8, 20, 22].
Более сложные схемы лечения метициллинрезистентных форм стафилококкового ИЭ должны проводится при участии клинического фармаколога и могут быть представлены следующими комбинациями [1, 2, 20, 22-24]:
- Фосфомицин 8-16 г/сут в 3-4 введения в/в + имипенем/циластатин 2-4 г/сут в 3-4 введения в/в (4-6 нед);
- Цефтаролина фосамил 1200 мг/сут в 2 введения в/в (4-6 нед);
- Линезолид 1200 мг/сут в 2 введения в/в + имипенем или эртапенем или меропенем (4-6 нед);
- Ванкомицин 30 мг/кг/сут в 2-3 введения в/в + оксациллин или имипенем или меропенем или эртапенем или цефотаксим или цефтриаксон (4-6 нед);
- Ко-тримоксазол (сульфаметоксазол 4800 мг/сут + триметоприм 960 мг/сут в 4-6 введений) 1 нед в/в, далее 5 нед перорально + клиндамицин 1800 мг/сут в 3 введения в/в (1 нед).
Энтерококковый ИЭ
Энтерококковый ИЭ относится к наиболее сложным для лечения видам ИЭ, так как требует длительной антибактериальной терапии и часто ассоциируется с рецидивирующим течением. Выбор терапии напрямую зависит от чувствительности/резистентности энтерококка к таким препаратам, как ампициллин, гентамицин и ванкомицин. В последние годы отмечается рост полирезистентных штаммов энтерококков, особенно в крупных развитых городах.
В традиционных случаях энтерококкового ИЭ, чувствительного к ампициллину и гентамицину, в арсенале врача имеется два варианта схем антибактериальной терапии — комбинация аминопенициллинов с гентамицином или цефтриаксоном [1, 2, 25, 26]. При этом последний вариант также эффективен в отношении изолятов, устойчивых к гентамицину. Отдельно отметим, что в отношении схем с гентамицином для ИЭ нативного клапана возможно несколько вариантов: при развитии неосложненного ИЭ — сокращенная схема с назначением аминопенициллинов и гентамицина на 2 нед, при осложненном течении ИЭ или длительностью более 3 мес — аминопенициллины назначаются не менее, чем на 6 нед с гентамицином на 2 нед. Таким образом базовым препаратом для лечения энтерококкового ИЭ нативного или протезированного клапана является ампициллин/амоксициллин в комбинации с цефтриаксоном на 6 нед или гентамицином на 2 нед [1, 2, 25, 26]. Укороченная схема лечения на 2 нед невозможна для ИЭ протеза клапана (табл. 5).
Если выявляется энтерококк с высокой резистентностью к гентамицину, то оптимальным является назначение ампициллина с цефтриаксоном на 6 нед для ИЭ нативного и протеза клапана [1, 2, 25, 26].
Более редкая и сложная ситуация возникает при развитии ИЭ, вызванного аминопенициллинрезистентными штаммами энтерококка. В этом случае имеется только одна опция — назначение ванкомицина с гентамицином [1, 2, 27].
В случае развития энтерококкового ИЭ, резистентного к ванкомицину, возможно применение комбинированной терапии, основанной на базовом применении даптомицина в комбинации с другими препаратами, обладающими синергизмом против энтерококка: в первую очередь с ампициллином, а также в более редких сочетаниях — с фосфомицином, цефтаролином или эртапенемом [1, 2]. Последние комбинации расширяют возможности применения эртапенема и, в особенности, цефтаролина фосамила, так как в их инструкциях по применению нет прямых показаний для ИЭ, в связи с чем такие комбинации с назначением "off-label" должны быть обоснованы в истории болезни консилиумом специалистов.
При наиболее тяжелом варианте течения мультирезистентного энтерококкового ИЭ (устойчивость к аминогликозидам, β-лактамам и ванкомицину) в первую очередь следует рассмотреть возможность кардиохирургического лечения. Стратегия антибактериальной терапии должна быть выбрана с обязательным участием клинического фармаколога и может быть представлена следующими схемами лечения [1, 2, 25]:
- Даптомицин 10-12 мг/кг/сут в/в плюс либо ампициллин (200-300 мг/кг/сут в 4-6 дозах в/в), эртапенем (2-4 г/сут в/в), цефтаролина фосамил (1800 мг/сут в 3 дозах в/в) или фосфомицин (12 г/сут в 4 дозах в/в)
- Линезолид 600 мг/сут 2 раза в день в/в или per osв течение ≥8 нед (необходим мониторинг гематоксичности)
- Хинупристин/дальфопристин 7,5 мг/кг/сут 3 раза в день в течение ≥8 нед (не активен в отношении Enterococcus faecalis)
- Даптомицин 10-12 мг/кг/сут в/в плюс тигециклин 100 мг в первое введение, далее по 50 мг 2 р/сут в/в.
Отдельно подчеркнем, что указанные схемы лечения должны быть назначены только при участии "команды эндокардита" с обязательным привлечением клинического фармаколога.
ИЭ, вызванный возбудителями группы HACEK и не-HACEK
К представителям группы HACEK относятся Haemophilus sp., Aggregatibacter sp., Cardiobacterium sp., Eikenella sp. и Kingella sp., нередко трудно выявляющиеся при микробиологическом исследовании. При отсутствии устойчивости к β-лактамным антибактериальным препаратам, схемой выбора является ампициллин в сочетании с гентамицином, а в случае ее наличия — возможно назначение цефтриаксона в монотерапии и в качества альтернативы — ципрофлоксацина тоже в монотерапии (табл. 6) [1, 2, 28].
В случае развития ИЭ, вызванного не-HACEK-грамотрицательными возбудителями, например Pseudomonas aeruginosa, Citrobacter sp., Enterobacter sp., Escherichia sp. (E. coli), Klebsiella sp. (K. pneumoniae), опцией выбора является назначение β-лактамных антибактериальных препаратов в сочетании с аминогликозидами или альтернативная схема с фторхинолонами (см. табл. 6) [1, 2, 29]. Ввиду высокой вероятности связи с нозокомиальным механизмом инфицирования и, следовательно, тяжелого течения ИЭ, такие пациенты должны вестись "командой эндокардита".
ИЭ, вызванный редкими возбудителями
ИЭ, вызванный трудно,- а часто и некультивируемыми возбудителями, такими как Coxiella burnetii, Bartonella hensalae, Bartonella quintana, Brucella sp., грибы, Tropheryma whipplei, Mycobacterium sp., в целом встречается крайне редко [1, 2, 30]. Однако трудности его выявления при традиционном алгоритме диагностики и необходимость применения редко выполняемых дополнительных методов обследования (иммунохимические и ПЦР-исследования) приводят к занижению истинной частоты. Для выявления такого варианта ИЭ большое значение имеют эпидемиологические аспекты, позволяющие заподозрить инфицирование представленными патогенами (табл. 7).
Лечение ИЭ, вызванного редкими возбудителями ввиду плохой изученности и недостаточной доказательной базы в большинстве случаев будет являться эмпирическим. Наименее изученным представляется ИЭ, вызванный T. whipplei (табл. 8) [1, 2].
Грибковый ИЭ
Наиболее частыми возбудителями грибкового ИЭ являются Candida sp. и Aspergillus sp., преимущественно встречающиеся у пациентов с протезами клапанов, употребляющих внутривенные психоактивные препараты и при иммунодефицитных состояниях. Грибковый ИЭ отличается крайне высокой летальностью и сложностью терапии, что определяет высокую востребованность кардиохирургического лечения, длительную терапию пероральными противогрибковым препаратами (азолами) и обязательное ведение "командой эндокардита" с участием клинического фармаколога. Схемы лечения ИЭ, вызванного Candida sp., основаны на длительном применении препаратов из группы эхинокандинов или липосомального амфотерицина В, в сочетании с триазолами или без. Для лечения ИЭ, вызванного Aspergillus sp. препаратом выбора является назначение вориконазола, в том числе в комбинации с анидулафунгином или липосомальным амфотерицином В (табл. 9). Лечение внутривенными препаратами длительное, при этом сроки активной в/в терапии не определены. После окончания стационарного этапа лечения показана продленной супрессивная терапия триазолами, в некоторых случаях — пожизненно [1, 2, 31, 32].
Таблица 2. Схемы антибактериальной терапии стрептококкового ИЭ (Str. viridans, Str. gallolyticus)
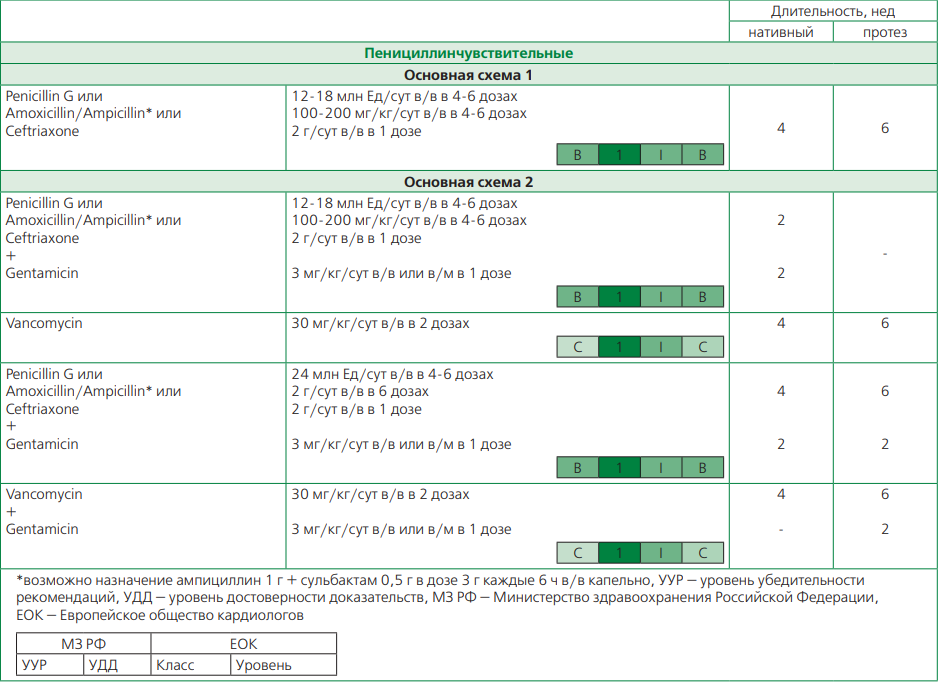
Таблица 3. Схемы антибактериальной терапии стрептококкового ИЭ, вызванного Str. pneumoniae

Таблица 4. Схемы антибактериальной терапии стафилококкового ИЭ
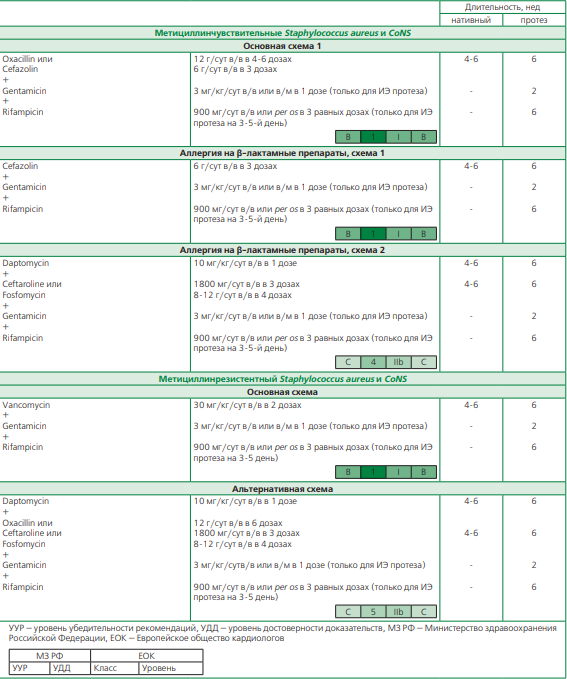
Таблица 5. Схемы антибактериальной терапии энтерококкового ИЭ
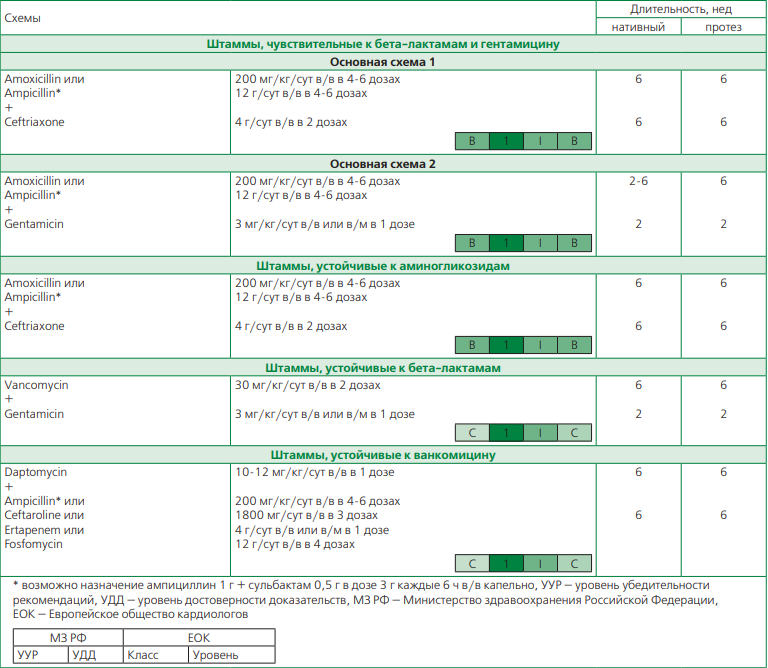
Таблица 6. Схемы антибактериальной терапии ИЭ, вызванного возбудителями группы HACEK и не-HACEK

Таблица 7. Эпидемиологические особенности редких возбудителей ИЭ
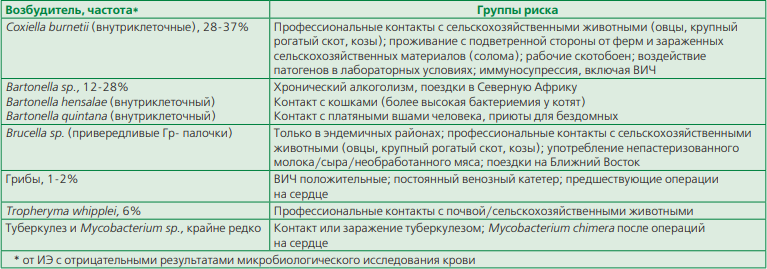
Таблица 8. Схемы антибактериальной терапии ИЭ, вызванного редкими возбудителями
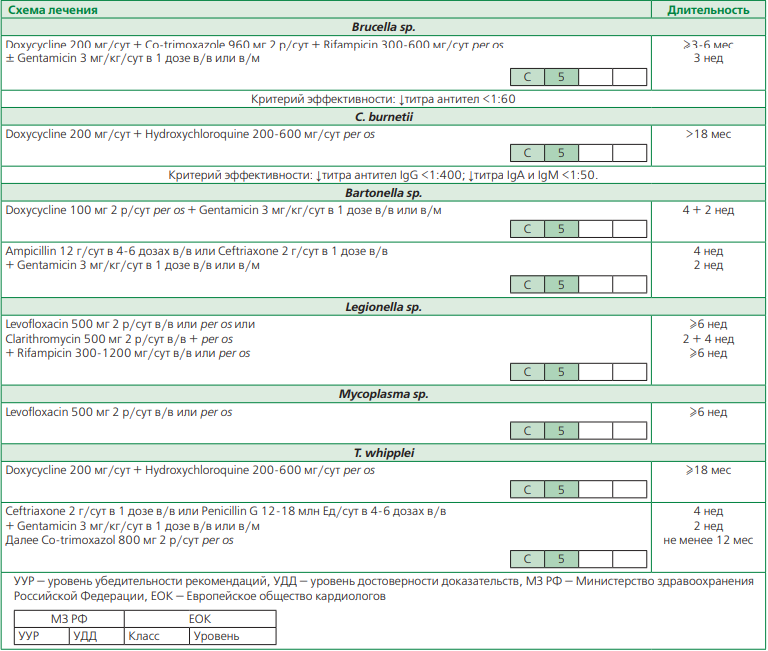
Таблица 9. Схемы антибактериальной терапии грибкового ИЭ

Амбулаторное лечение ИЭ
Современные варианты проведения антибактериальной терапии при ИЭ можно представить следующим образом: острая фаза лечения — первые 2-3 нед (включая проведение кардиохирургического лечения) наиболее опасные для развития осложнений и требующие по этой причине пребывания пациента в стационаре с проведением в/в антибактериальной терапии; фаза консолидации лечения, которая может быть представлена разными вариантами завершения курса антибактериальной терапии — продолжение в/в антибактериальной терапии в стационаре, продолжение в/в антибактериальной терапии амбулаторно стандартными препаратами или препаратами длительного действия, перевод на пероральные режимы антибактериальной терапии (рис. 1) [1, 2, 33]. Наибольший интерес представляют амбулаторные возможности пероральной антибактериальной терапии ИЭ.
В отношении правостороннего ИЭ, в первую очередь у лиц, употребляющих внутривенные психоактивные препараты, первые успешные исследования по назначению амбулаторной пероральной антибактериальной терапии появились еще в 1980-1996 гг., что нашло отражение в европейских клинических рекомендациях по профилактике, диагностике и лечению ИЭ от 2009 г., позднее в аналогичных документах 2015 и 2023 гг., также в национальных клинических рекомендациях "Инфекционный эндокардит и инфекция внутрисердечных устройств" 2021 г. Все представленные документы единообразно предлагают у таких пациентов при инфицировании S. aureus и невозможности проведения в/в антибактериальной терапии альтернативное назначение пероральной комбинации ципрофлоксацина 750 мг 2 р/сут с рифампицином 300 мг 2 р/сут [1, 2, 34].
Новым представлением возможностей антибактериальной терапии левостороннего ИЭ является допустимость перевода пациентов на пероральные режимы лечения, в том числе на ранних сроках лечения. Пересмотр подходов к лечению ИЭ произошел после опубликования результатов крупного исследования Partial oral endocarditis antibiotic treatment (the POET trial, частичная пероральная антибактериальная терапия ИЭ, 2011-2017 гг.), представляющего собой первое рандомизированное многоцентровое сравнительное исследование, non-inferiority, выполненное в Дании, целью которого являлось определение безопасности и эффективности частичной пероральной антибактериальной терапии ИЭ по сравнению с традиционным полным парентеральным лечением [35]. В исследование включались пациенты с левосторонним ИЭ (критерии Duke, 2015), вызванным Streptococcus sp., Enterococcus faecalis, Staphylococcus aureus, CoNS. Критерием перевода на пероральные схемы антибактериальной терапии являлось достижение критериев стабильного состояния пациента — длительность эффективной в/в антибактериальной терапии ≥10 дней и ≥7 дней после кардиохирургического лечения, температура тела <38,0°C более 2 дней, снижение СРБ <25% от максимального значения или <20 мг/л и лейкоцитов менее 15×109 /л, отсутствие абсцессов или поражения клапанов, требующих оперативного лечения после контрольной чреспищеводной (ЧП) эхокардиографии (ЭхоКГ) ≤48 ч до включения, отсутствие других показаний для в/в введения антибактериальных препаратов или невозможности приема пероральных препаратов. Длительность наблюдения составила 6 месяцев и 5 лет, при этом оценивалась комбинированная конечная точка: смерть от всех причин/внеплановое кардиохирургическое вмешательство/эмболические события/рецидив ИЭ тем же возбудителем [35][36]. По результатам проведенного исследования не получено различий между группами частичного перорального лечения ИЭ и стандартного в/в лечения ИЭ как в краткосрочном, так и в отдаленном периодах наблюдения. Таким образом, исследование POET позволило пересмотреть парадигмы проведения антибактериальной терапии при ИЭ, показав возможность ранней выписки пациентов с переводом на амбулаторный прием антибактериальных препаратов, что чрезвычайно важно с точки зрения безопасности (уменьшение риска постинъекционных осложнений, нозокомиальных инфекций), улучшения качества жизни пациентов и снижения экономического бремени ИЭ на стационар. На основании полученных результатов были сформулированы критерии перевода пациентов на амбулаторное лечение и предложены схемы антибактериальной терапии в зависимости от этиологической принадлежности ИЭ, отраженные в российских (2021 г.) и европейских (2023 г.) клинических рекомендациях (табл. 10, 11) [1][2].
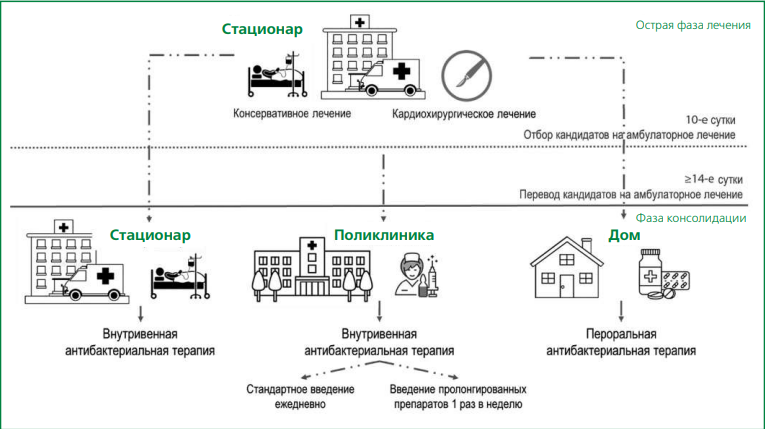
Рисунок 1. Этапы проведения антибактериальной терапии у пациентов с ИЭ
Таблица 10. Критерии перевода пациентов на пероральные режимы антибактериальной терапии

Таблица 11. Рекомендуемые схемы лечения для пероральной амбулаторной антибактериальной терапии
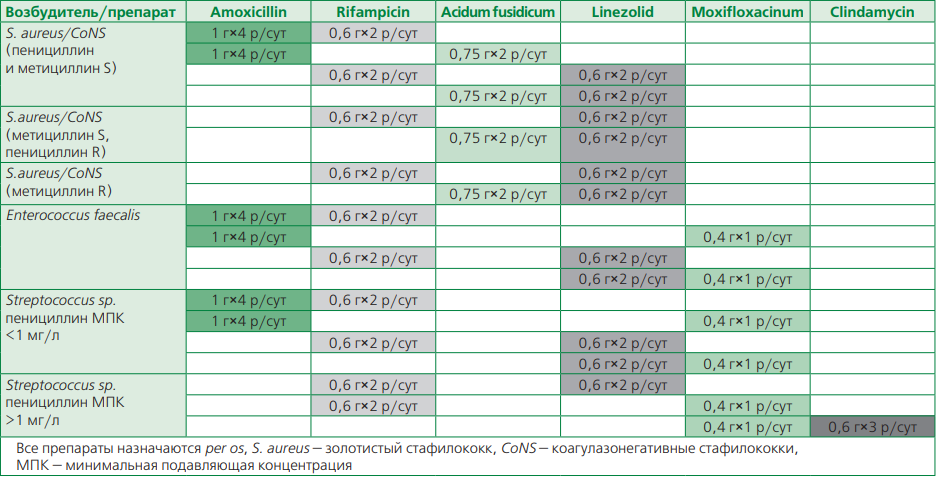
Однако исследование POET имело некоторые особенности и ограничения:
- за 6 лет исследования было рандомизировано только 20% всех обследованных, что подтверждает тщательность отбора пациентов;
- некоторые возбудители были слабо (CoNS) или не представлены совсем (MRSA), то есть этиология ИЭ в POET была преимущественно представленаStreptococcus sp.и Enterococcus sp.;
- некоторые схемы приема антибактериальных препаратов имеют сложный режим дозирования (например, ампициллин через каждые 6 ч);
- для части препаратов необходимо учитывать риск лекарственных взаимодействий и побочных эффектов: для моксифлоксацина и рифампицина — риск гепатотоксичности в комбинированной терапии и у пожилых; для линезолида — гематотоксичность с контролем общего анализа крови до 1 раза в 2 нед;
- не включались пациенты с ожирением (ИМТ >40 кг/м2), где стандартные дозировки препаратов могли бы не обеспечивать должной концентрации препаратов;
- не учитывалась доступность пероральных препаратов — в РФ не зарегистрированы препараты диклоксациллина и труднодоступна пероральная форма фузидовой кислоты;
- обязательное выполнение ЧПЭхоКГ при переводе на пероральный режим антибактериальной терапии может оказаться недоступным для рутинной практики.
В целом следует констатировать, что результаты исследования POET убедительно доказывают возможность безопасного перевода пациентов с в/в на пероральные схемы антибактериальной терапии. Ряд исследований подтвердил клиническую эффективность предложенной в исследовании POET пероральной ступенчатой терапии в реальной практике, позволяющей не менее половины пациентов переводить на амбулаторное лечение [33]. В нашем регистре из 345 пациентов только 55 (15,9%) пациентов были переведены на пероральные режимы антибактериальной терапии согласно критериям POET и предложенным схемам. Мы также наблюдали меньшее количество эмболических событий (55,1% при в/в стационарном лечении против 38,2% при частичном переводе на пероральные схемы лечения, p<0,05) и сопоставимую частоту летальных исходов через год наблюдения (15,7% при в/в стационарном лечении и 12,7% при частичном переводе на пероральные схемы лечения, p>0,05), что еще раз подтверждает безопасность и эффективность амбулаторных пероральных схем лечения у стабильных пациентов с левосторонним ИЭ. Низкую частоту перевода на амбулаторную пероральную ступенчатую терапию можно объяснить рядом факторов, связанных с традиционными ограничениями и особенностями распространения и внедрения практических руководств в современное здравоохранение, таких как недостаточная осведомленность или незнание рекомендаций, предвзятое представление врача по отношению к новой рекомендации и терапевтическая инертность. Широкая пропаганда, обсуждение и внедрение рекомендаций на регулярной основе позволит повысить приверженность врача к соответствующим руководствам в реальной клинической практике.
Перспективы антибактериальной терапии ИЭ
Новые направления лечения ИЭ связаны с применением препаратов пролонгированного действия. Например, ряд исследований сообщает о положительном опыте лечения грамположительного ИЭ при в/в применении далбаванцина с высоким уровнем клинического излечивания до 90% [37]. Благодаря своим фармакокинетическим и фармакодинамическим свойствам далбаванцин можно назначать 1 р/нед или даже 1 раз в 2 нед, что позволит применять его для раннего амбулаторного лечения после стабилизации пациента. Однако препарат пока не зарегистрирован в РФ и не имеет показания для применения при ИЭ.
Также предстоит обсудить и исследовать расширение показаний для перевода пациентов на пероральные режимы терапии: включение любого типа и вида ИЭ, возможность оценки критериев для перевода на любой день после 10 дня лечения, равнозначность трансторакальной или ЧПЭхоКГ перед выпиской, иная этиология ИЭ грамположительный/грамотрицательный/неизвестный возбудитель, правосторонний ИЭ у лиц, не употребляющих внутривенные психоактивные препараты, новые удобные пероральные режимы терапии, мониторинг концентрации применяемых препаратов, особенно в группе пациентов с избыточным весом.
Наиболее необычным, но имеющим хорошие перспективы может оказаться в/в применение бактериофагов или лизинов фагового происхождения в комбинации с антибактериальными препаратами, однако исследования на данный момент преимущественно носят характер экспериментальных или единичных клинических наблюдений [38]. Необходимо большее количество более масштабных исследований.
Заключение
Таким образом, несмотря на то, что ИЭ относится к редким заболеваниям и проведение рандомизированных клинических исследований вызывает значительные трудности, современные национальные и европейские клинические рекомендации представляют собой тщательно выверенные документы, основанные на широком клиническом опыте. Имеющиеся клинические руководства позволяют врачу делать правильный выбор эффективной антибактериальной терапии, в зависимости от вида возбудителя, а также в наиболее сложном случае — при неустановленной этиологии ИЭ. Каков наилучший результат завершения терапии в настоящее время однозначно ответить сложно — продолжение в/в антибактериальной терапии, перевод на в/в амбулаторную терапию (трудно исполним ввиду необходимости проведения в условиях дневного стационара или под тщательным контролем на дому), переход на пероральные схемы антибактериальной терапии (представляется наиболее удобным и безопасным). Тем не менее, успех терапии ИЭ в первую очередь связан со строгим соблюдением клинических рекомендаций, приверженностью пациента к лечению, доступностью лекарственных препаратов для пероральной амбулаторной терапии и качественным стационарным и амбулаторным ведением пациентов с ИЭ.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Приложение
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств) Министерства здравоохранения Российской Федерации [1]
|
УДД |
Расшифровка |
|
1 |
Систематический обзор РКИ с применением метаанализа |
|
2 |
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа |
|
3 |
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль" |
|
5 |
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 2. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств) Министерства здравоохранения Российской Федерации [1]
|
УУР |
Расшифровка |
|
A |
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
|
B |
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
|
C |
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Таблица 3. Шкала оценки классов рекомендаций Европейского общества кардиологов [2]
|
Класс |
Определение |
Предлагаемая формулировка |
|
I |
Доказано или общепризнанно, что диагностическая процедура, вмешательство/ лечение являются эффективными и полезными |
Рекомендовано/ показано |
|
IIa |
Большинство данных/мнений в пользу эффективности/пользы диагностической процедуры, вмешательства, лечения |
Целесообразно применять |
|
IIb |
Эффективность/польза диагностической процедуры, вмешательства, лечения установлены менее убедительно |
Можно применять |
|
III |
Данные или единое мнение, что диагностическая процедура, вмешательство, лечение бесполезны/неэффективны, а в ряде случаев могут приносить вред |
Не рекомендуется |
Таблица 4. Шкала оценки уровней достоверности доказательств Европейского общества кардиологов [2]
|
Уровень |
Определение |
|
A |
Данные многочисленных рандомизированных клинических исследований или метаанализов |
|
B |
Данные получены по результатам одного рандомизированного клинического исследования или крупных нерандомизированных исследований |
|
C |
Согласованное мнение экспертов и/или результаты небольших исследований, ретроспективных исследований, регистров |
Список литературы
1. Демин А.А., Кобалава Ж.Д., Скопин И.И. и др. Инфекционный эндокардит и инфекция внутрисердечных устройств. Клинические рекомендации 2021. Российский кардиологический журнал. 2022;27(10):113-192. DOI:10.15829/1560-4071-2022-5233.
2. Delgado V, Ajmone Marsan N, de Waha S, et al; ESC Scientific Document Group. 2023 ESC Guidelines for the management of endocarditis. Eur Heart J. 2023;44(39):3948-4042. DOI:10.1093/eurheartj/ehad193.
3. Habib G, Erba PA, Iung B, et al; EURO-ENDO Investigators. Clinical presentation, aetiology and outcome of infective endocarditis. Results of the ESC-EORP EURO-ENDO (European infective endocarditis) registry: a prospective cohort study. Eur Heart J. 2019;40(39):3222-3232. DOI:10.1093/eurheartj/ehz620.
4. Кобалава Ж.Д., Котова Е.О. Глобальные и национальные тренды эволюции инфекционного эндокардита. Кардиология. 2022;63(1):1-9. DOI:10.18087/cardio.2023.1.n2307.
5. Котова Е.О., Домоно - ва Э.А., Кобалава Ж.Д. и др. Клинико-диагностическая ценность включения ПЦР-исследования крови в традиционный алгоритм идентификации возбудителей инфекционного эндокардита: когортное исследование 124 пациентов. Терапевтический архив. 2023;95(1):23-31. DOI:10.26442/00403660.2023.01.202042.
6. Асланиди И.П., Голухова Е. З., Пурсанова Д.М. и др. Анализ факторов, влияющих на точность результатов позитронно-эмиссионной томографии, совмещенной с компьютерной томографией, с 18F-фтордезоксиглюкозой при подозрении на инфекционный эндокардит протезированного клапана. Российский кардиологический журнал. 2021;26(12):4764. DOI:10.15829/1560-4071-2021-4764.
7. Willekens R, Puig-Asensio M, Suanzes P, et al. Empirical use of beta-lactam/ beta-lactamase inhibitor combinations does not increase mortality compared with cloxacillin and cefazolin in methicillin-susceptible Staphylococcus aureus bacteraemia: a propensity-weighted cohort study. J Antimicrob Chemother. 2022;77(8):2288-2295. DOI:10.1093/jac/dkac152.
8. Yusuf E, Bramer W, Anas AA. Clinical outcomes of rifampicin combination therapy in implant-associated infections due to staphylococci and streptococci: A systematic review and meta-analysis. Int J Antimicrob Agents. 2023; 63(1): 107015. DOI:10.1016/j.ijantimicag.2023.107015.
9. Pericas JM, Llopis J, Athan E, et al; International Collaboration on Endocarditis (ICE) Investigators. Prospective cohort study of infective endocarditis in people who inject drugs. J Am Coll Cardiol. 2021;77(5):544-555. DOI:10.1016/j.jacc.2020.11.062.
10. Damlin A, Westling K. Patients with infective endocarditis and history of injection drug use in a Swedish referral hospital during 10 years. BMC Infect Dis. 2021;21(1):236. DOI:10.1186/s12879-021-05914-1.
11. Lassen H, Nielsen SL, Gill SUA, Johansen IS. The epidemiology of infective endocarditis with focus on non-device related right-sided infective endocarditis: a retrospective register-based study in the region of Southern Denmark. Int J Infect Dis. 2020;95:224-230. DOI:10.1016/j.ijid.2020.04.011.
12. Котова Е.О., Домонова Э.А., Кобалава Ж.Д. и др. Современные тренды этиологической диагностики инфекционного эндокардита. Рациональная Фармакотерапия в Кардиологии. 2021;17(1):153-164. DOI:10.20996/1819-6446-2021-02-14.
13. Данилов А.И., Алексеева И.В., Аснер Т.В. и др. Реальная практика терапии инфекционного эндокардита в РФ: промежуточные результаты исследования МАЭСТРО. Клиническая Микробиология и Антимикробная Химиотерапия. 2013;15(2):18-19.
14. Boodman C, Wuerz T, Lagacé-Wiens P, et al. Serologic testing for Bartonella in Manitoba, Canada, 2010-2020: a retrospective case series. CMAJ Open. 2022;10(2):E476-E482. DOI:10.9778/cmajo.20210180.
15. Hong H.L., Flurin L., Greenwood-Quaintance K.E. et al. 16S rRNA Gene PCR/ Sequencing of Heart Valves for Diagnosis of Infective Endocarditis in Routine Clinical Practice. J Clin Microbiol. 2023;61(8):e0034123. DOI:10.1128/jcm.00341-23.
16. Sexton DJ, Tenenbaum MJ, Wilson WR, et al. Ceftriaxone once daily for four weeks compared with ceftriaxone plus gentamicin once daily for two weeks for treatment of endocarditis due to penicillin-susceptible streptococci. Endocarditis Treatment Consortium Group. Clin Infect Dis. 1998;27(6):1470- 1474. DOI:10.1086/515038.
17. Perier A, Puyade M, Revest M, et al. Prognosis of Streptococcus pneumoniae endocarditis in France, a multicenter observational study (2000–2015). Int J Cardiol. 2019;288:102-106. DOI:10.1016/j.ijcard.2019.04.048.
18. Fernandez Hidalgo N, Gharamti AA, Aznar ML, et al. Beta-hemolytic streptococcal infective endocarditis: characteristics and outcomes from a large, multinational cohort. Open Forum Infect Dis. 2020;7(5):ofaa120. DOI:10.1093/ofd/ofaa120.
19. Tellez A, Ambrosioni J, Hernandez-Meneses, et al; International Collaboration on Endocarditis (ICE) Investigators. Clinical characteristics and outcome of infective endocarditis due to Abiotrophia and Granulicatella compared to Viridans group streptococci. J Infect. 2022;85(2):137-146. DOI:10.1016/j.jinf.2022.05.023.
20. Saeed K, Bal AM, Gould IM, et al. An update on Staphylococcus aureus infective endocarditis from the International Society of Antimicrobial Chemotherapy (ISAC). Int J Antimicrob Agents. 2019;53(1):9-15. DOI:10.1016/j.ijantimicag.2018.09.014.
21. Ramos-Martinez A, Munoz Serrano A, de Alarcon Gonzalez A, et al; Spanish Collaboration on Endocarditis—Grupo de Apoyo al Manejo de la Endocarditis Infecciosa en España (GAMES). Gentamicin may have no effect on mortality of staphylococcal prosthetic valve endocarditis. J Infect Chemother. 2018;24(7):555-562. DOI:10.1016/j.jiac.2018.03.003.
22. Huang C, Chen I, Lin L. Comparing the outcomes of ceftaroline plus vancomycin or daptomycin combination therapy versus vancomycin or daptomycin monotherapy in adults with methicillin-resistant Staphylococcus aureus bacteremia–a meta-analysis. Antibiotics (Basel). 2022;11(8):1104. DOI:10.3390/antibiotics11081104.
23. Tong SYC, Lye DC, Yahav D, et al; Australasian Society for Infectious Diseases Clinical Research Network. Effect of vancomycin or daptomycin with vs without an antistaphylococcal beta-lactam on mortality, bacteremia, relapse, or treatment failure in patients with MRSA bacteremia: a randomized clinical trial. JAMA. 2020;323(6):527-537. DOI:10.1001/jama.2020.0103.
24. Tissot-Dupont H, Gouriet F, Oliver L, et al. High-dose trimethoprim-sulfamethoxazole and clindamycin for Staphylococcus aureus endocarditis. Int J Antimicrob Agents. 2019;54(2):143-148. DOI:10.1016/j.ijantimicag.2019.06.006.
25. Lupia T, Roberto G, Scaglione L, et al. Clinical and microbiological characteristics of bloodstream infections caused by Enterococcus spp. within internal medicine wards: a two-year single-centre experience. Intern Emerg Med. 2022;17(4):1129-1137. DOI:10.1007/s11739-022-02926-w.
26. Herrera-Hidalgo L, Lopez-Cortes LE, Luque-Marquez R, et al. Ampicillin and ceftriaxone solution stability at different temperatures in outpatient parenteral antimicrobial therapy. Antimicrob Agents Chemother. 2020;64(7):e00309-20. DOI:10.1128/AAC.00309-20.
27. Escola-Verge L, Fernandez-Hidalgo N, Rodriguez-Pardo D, et al. Teicoplanin for treating enterococcal infective endocarditis: a retrospective observational study from a referral centre in Spain. Int J Antimicrob Agents. 2019;53(2):165- 170. DOI:10.1016/j.ijantimicag.2018.10.003.
28. Bläckberg A, Morenius C, Olaison L, et al. Infective endocarditis caused by HACEK group bacteria–a registry-based comparative study. Eur J Clin Microbiol Infect Dis. 2021;40(9):1919-1924. DOI:10.1007/s10096-021-04240-3.
29. Lorenz A, Sobhanie MME, Orzel L, et al. Clinical outcomes of combination versus monotherapy for gram negative non-HACEK infective endocarditis. Diagn Microbiol Infect Dis. 2021;101(3):115504. DOI:10.1016/j.diagmicrobio.2021.115504.
30. Godfrey R, Curtis S, Schilling WH, James P. Blood culture negative endocarditis in the modern era of 16S rRNA sequencing. Clin Med (Lond). 2020;20(4):412- 416. DOI:10.7861/clinmed.2019-0342.
31. Thompson GR 3rd, Jenks JD, Baddley JW, et al. Fungal Endocarditis: Pathophysiology, Epidemiology, Clinical Presentation, Diagnosis, and Management. Clin Microbiol Rev. 2023;36(3):e0001923. DOI:10.1128/cmr.00019-23.
32. Meena DS, Kumar D, Agarwal M, et al. Clinical features, diagnosis and treatment outcome of fungal endocarditis: a systematic review of reported cases. Mycoses. 2022;65(3):294-302. DOI:10.1111/myc.13398.
33. Pries-Heje MM, Hjulmand JG, Lenz IT, et al. Clinical implementation of partial oral treatment in infective endocarditis: the Danish POETry study. Eur Heart J. 2023;44(48):5095-5106. DOI:10.1093/eurheartj/ehad715.
34. Marks LR, Liang SY, Muthulingam D, et al. Evaluation of partial oral antibiotic treatment for persons who inject drugs and are hospitalized with invasive infections. Clin Infect Dis. 2020;71(10):e650-e656. DOI:10.1093/cid/ciaa365.
35. Iversen K, Ihlemann N, Gill SU, et al. Partial oral versus intravenous antibiotic treatment of endocarditis. N Engl J Med. 2019;380(5):415-424. DOI:10.1056/NEJMoa1808312.
36. Pries-Heje MM, Wiingaard C, Ihlemann N, et al. Five-Year Outcomes of the Partial Oral Treatment of Endocarditis (POET) Trial. N Engl J Med. 2022;386(6):601-602. DOI:10.1056/NEJMc2114046.
37. Sader HS, Mendes RE, Pfaller MA, Flamm RK. Antimicrobial activity of dalbavancin tested against Gram-positive organisms isolated from patients with infective endocarditis in US and European medical centres. J Antimicrob Chemother. 2019;74(5):1306-1310. DOI:10.1093/jac/dkz006.
38. Hetta HF, Rashed ZI, Ramadan YN, et al. Phage Therapy, a Salvage Treatment for Multidrug-Resistant Bacteria Causing Infective Endocarditis. Biomedicines. 2023;11(10):2860. DOI:10.3390/biomedicines11102860.
Об авторах
Е. О. КотоваРоссия
Котова Елизавета Олеговна, д.м.н., доцент кафедры внутренних болезней с курсом кардиологии и функциональной диагностики им. академика В.С. Моисеева
Москва
Ж. Д. Кобалава
Россия
Кобалава Жанна Давидовна
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Котова Е.О., Кобалава Ж.Д. Практические подходы к антимикробной терапии инфекционного эндокардита в аспекте национальных и европейских клинических рекомендаций. Рациональная Фармакотерапия в Кардиологии. 2024;20(1):85-102. https://doi.org/10.20996/1819-6446-2024-3006. EDN: CKUHKC
For citation:
Kotova E.O., Kobalava Zh.D. Practical approaches to antimicrobial therapy for infective endocarditis in the context of national and European clinical guidelines. Rational Pharmacotherapy in Cardiology. 2024;20(1):85-102. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3006. EDN: CKUHKC

















































