Перейти к:
Факторы риска развития желудочковых аритмий при несиндромном пролапсе митрального клапана
https://doi.org/10.20996/1819-6446-2024-3015
EDN: TCJSGR
Аннотация
Несиндромный пролапс митрального клапана (ПМК) относится к распространенным в популяции заболеваниям. В большинстве случаев отмечают его доброкачественное течение, вместе с тем исследователи сообщают о связи между ПМК и желудочковыми аритмиями, а также внезапной сердечной смерти (ВСС). Клинические признаки (боль в грудной клетке, синкопе/липотимия, среднесистолический щелчок), результаты инструментальных исследований (электрокардиографического, эхокардиографического, магнитно-р езонансной томографии [МРТ]) позволяют выявить известные ("старые") факторы риска и новые феномены, встречающиеся при нарушениях ритма и проводимости при ПМК. К признакам "аритмического" ПМК, часто выявляемых у женщин молодого возраста, относятся пролабирование утолщенных обеих створок митрального клапана, инверсия зубца Т в нижнебазальных отведениях на электрокардиограмме (ЭКГ), дизъюнкция митрального кольца, фиброз папиллярных мышц и миокарда в нижнебазальной стенке левого желудочка, определяемый при МРТ и в биоптатах миокарда. В 2022 г. консенсусом экспертов European Heart Rhythm Association представлена стратификация риска и принципы лечения пациентов с аритмическим ПМК, выделены группы низкого, промежуточного и высокого риска, а в 2024 г. выполнен первый мета-анализ исследований с целью выявления прогностических факторов риска аритмического ПМК. К наиболее значимым относятся позднее накопление гадолиния при МРТ, инверсия зубца Т на ЭКГ, пролабирование обеих створок митрального клапана и дизъюнкция митрального кольца. При выборе лечения пациентов с аритмическим ПМК учитывают клинические характеристики и применяют персонифицированный подход с целью предупреждения ВСС и тяжелых желудочковых аритмий. Как правило, для профилактики ВСС у пациентов с аритмическим ПМК рассматривают четыре направления лечебной тактики: медикаментозное лечение (бета- адреноблокаторы или недигидропиридиновые блокаторы медленных кальциевых каналов, комбинацию бета-адреноблокатора и флекаинида, или амиодарон), радиочастотная аблация, хирургическое лечение митрального клапана, имплантация кардиовертера- дефибриллятора (для первичной или вторичной профилактики ВСС). Обоснование хирургических, электрофизиологических и/или терапевтических методов лечения зависит от конкретных нарушений ритма.
Ключевые слова
Для цитирования:
Трисветова Е.Л. Факторы риска развития желудочковых аритмий при несиндромном пролапсе митрального клапана. Рациональная Фармакотерапия в Кардиологии. 2024;20(2):249-257. https://doi.org/10.20996/1819-6446-2024-3015. EDN: TCJSGR
For citation:
Trisvetova E.L. Risk factors of ventricular arrhythmias in non-syndromic mitral valve prolapse. Rational Pharmacotherapy in Cardiology. 2024;20(2):249-257. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3015. EDN: TCJSGR
Введение
Пролапс митрального клапана (ПМК) относится к распространенным сердечно-сосудистым заболеваниям, встречающимся у 2-3% населения, одинаково часто у мужчин и женщин [1][2]. Диагностический признак ПМК при двухмерном эхокардиографическом исследовании (ЭхоКГ) в парастернальной позиции по длинной оси — смещение ≥2 мм в систолу одной или обеих створок митрального клапана выше плоскости митрального кольца [3]. ПМК рассматривают как синдромный, возникающий при моногенных наследственных нарушениях соединительной ткани, и несиндромный (первичный), как самостоятельное заболевание, при котором определяют миксоматозную дегенерацию (болезнь Барлоу) или фиброэластический дефицит [4]. Для характеристики ПМК имеет значение толщина пролабирующей створки (створок), измеренная при ЭхоКГ в диастолу: при толщине ≥5 мм (как правило, при миксоматозной дегенерации) ПМК считают классическим, в случаях толщины створки <5 мм — неклассическим [5]. Первичный ПМК относится к наследственным нарушениям соединительной ткани с системными внесердечными нарушениями: воронкообразная грудная клетка, сколиоз, гипермобильность суставов, долихостеномелия, кожные признаки — стрии, вегетативные расстройства [6-8].
С момента первого описания ПМК обсуждается вопрос о течении заболевания и исходах: доброкачественном или с неблагоприятным прогнозом для жизни. В большинстве случаев исследователи считают, что течение ПМК доброкачественное, вместе с тем изредка встречаются внезапная сердечная смерть (ВСС, 0,4-1,9% — внезапная остановка сердца, 7% — ВСС), осложнения, обусловленные развитием митральной регургитации и сердечной недостаточности, аритмий сердца, инфекционного эндокардита, тромбоэмболии [8-11]. Совершенствование диагностических методов исследования, результаты проспективных наблюдений пациентов с ПМК позволили выявить основные факторы, влияющие на развитие желудочковых аритмий и ВСС. Вместе с тем в опубликованных работах существуют противоречивые заключения о значимости при ПМК различных факторов — предикторов желудочковых аритмий сердца и ВСС.
Диагностика факторов риска развития желудочковых аритмий и ВСС при ПМК
Клинические признаки, выявляемые у пациентов с ПМК, включают боль в грудной клетке (кардиалгия или стенокардия), сердцебиение/перебои в работе сердца, синкопе/липотимию [8][12]. Эти признаки определяют у многих пациентов c ПМК с аритмиями и нормальным синусовым ритмом. Вместе с тем синкопе с большей вероятностью возникают у пациентов с ПМК и тяжелыми желудочковыми нарушениями ритма [13]. Следовательно, при симптомном или бессимптомном клиническом течении ПМК необходимо инструментальное обследование для выявления аритмий сердца. При аускультации сердца у пациентов с аритмическим ПМК нередко выслушивают среднесистолический щелчок [8].
Электрокардиографическое исследование относится к обязательным методам диагностики заболеваний сердца. Спектр нарушений ритма и проводимости у лиц с ПМК достаточно обширен: синусовая тахи- или брадикардия, наджелудочковая и желудочковая экстрасистолия, пароксизмальная наджелудочковая тахикардия, миграция водителя ритма, блокада атриовентрикулярная или правой ножки пучка Гиса. Ранее выполненные исследования показали значительную распространенность (от 58% до 89%) желудочковых экстрасистол при ПМК по сравнению с общей популяцией [14]. У небольшой группы пациентов с аритмическим ПМК встречаются жизнеугрожающие желудочковые аритмии [15].
Проспективное (3,1 года) исследование встречаемости тяжелой желудочковой аритмии и факторов риска ее развития у пациентов с ПМК с помощью имплантируемых петлевых регистраторов и имплантируемых кардиовертеров-дефибрилляторов (ИКД) выполнили E. W. Aabel и соавт. [15]. Регистрировали тяжелую желудочковую аритмию: фибрилляция желудочков, устойчивая желудочковая тахикардия, неустойчивая желудочковая тахикардия с признаками гемодинамической нестабильности. Тяжелая желудочковая аритмия впервые наблюдалась у 12% пациентов с имплантируемыми петлевыми регистраторами, 4% событий на человека в год, повторные события у пациентов с ИКД наблюдали у 20 пациентов, 8% на человека в год. По мнению авторов, предикторами впервые возникшей тяжелой желудочковой аритмии с продолжительными эпизодами желудочковой тахикардии и частой желудочковой экстрасистолией служили бóльший конечный диастолический размер левого желудочка и бóльшая протяженность дизъюнкции митрального кольца (ДМК — изменение пространственного соотношения между фиброзным кольцом митрального клапана, стенкой левого предсердия, и верхней частью стенки левого желудочка) [15]. Авторы отметили, что очаговый фиброз миокарда, выявленный методом магнитно-резонансной томографии (МРТ), и инверсия зубца Т, в отличие от результатов многих исследователей, не влияли на появление тяжелой желудочковой аритмии.
К уже известным причинам развития аритмий относятся миксоматозная дегенерация, пролабирование обеих створок, расширение митрального кольца, умеренная и значительная митральная регургитация, вегетативная дисфункция [8][16][17]. К причинам появления желудочковых аритмий относили удлинение интервала QT, которое коррелирует с увеличением толщины передней створки митрального клапана и более высокой степенью ее пролабирования [18].
C. Guenancia и соавт. для выявления связи желудочковых нарушений ритма с митральной регургитацией выполнили суточное мониторирование ЭКГ, тест с физической нагрузкой, ЭхоКГ, МРТ у 179 пациентов с ПМК (средний возраст 52 года, 53% женщины) [19]. Пролабирование обеих створок митрального клапана выявили у 53%, митральную регургитацию легкую у 27%, умеренную у 37%, тяжелую у 12% пациентов, у остальных митральная регургитация отсутствовала. Авторы показали целесообразность проведения теста с физической нагрузкой для обнаружения преждевременных желудочковых сокращений и места их происхождения. У пациентов с изолированными желудочковыми экстрасистолами с умеренной или тяжелой митральной регургитацией, с более высокой степенью пролабирования избыточных створок во время теста с физической нагрузкой часто выявляли неустойчивую желудочковую тахикардию. Среди пациентов с желудочковыми экстрасистолами, обнаруженными во время теста с физической нагрузкой (n=119, 66%), у 52% преждевременные сокращения желудочков исходили из задне-перегородочной папиллярной мышцы, у 28% — из выносящего тракта левого желудочка. По результатам МРТ у этих пациентов выявлен локальный фиброз в области задне-перегородочной папиллярной мышцы и нижне-базальной стенки левого желудочка, рассматриваемый как морфологический субстрат желудочковых аритмий при ПМК [19].
Помимо нарушений ритма и проводимости сердца, у пациентов с ПМК на электрокардиограмме (ЭКГ) в 12 стандартных отведениях и при суточном мониторировании регистрируют нарушения реполяризации. Как правило, маркером желудочковых аритмий сердца при ПМК является отрицательный или двуфазный зубец Т, либо депрессия сегмента ST в нижних (II, III, aVF) и боковых (I, aVL, V5, V6) отведениях [8][13]. Большему количеству отведений с инвертированным зубцом Т соответствовало бóльшая протяженность ДМК. Инверсию зубца Т ≥0,1 мВ в двух и более последовательных отведениях регистрировали при фиброзе миокарда, наличие которого подтверждалось результатами МРТ [17]. Таким образом, отмечена связь между жизнеугрожающими желудочковыми аритмиями и инверсией зубца Т в нижних и боковых отведениях на ЭКГ. С увеличением количества отведений с инверсией зубца Т у пациентов с ПМК (часто при пролабировании обеих створок) повышается риск развития аритмии. Нарушения реполяризации в 80% случаев обнаруживают у пациентов с ПМК и высоким риском желудочковых аритмий и ВСС [16].
Фрагментированный комплекс QRS (fQRS, комплекс в виде зазубрин и расщепления R и S) в двух последовательных отведениях рассматривают как маркер фиброзных или воспалительных изменений в миокарде, обусловливающих при ПМК сложные желудочковые аритмии (класс по Лауну-Вольфу ≥3) [20].
В случае высокой степени митральной регургитации при ПМК экстрасистолы определяют чаще, чем без нее [13]. Источником преждевременных сокращений желудочков являются папиллярные мышцы, волокна ножек пучка Гиса, выносящий тракт левого желудочка [21].
Отмечено, что желудочковая тахикардия в 70-90% случаев при ПМК появляется у женщин, и что причины подобной избирательности многофакторные [22].
ЭхоКГ применяется для диагностики ПМК и дальнейшего наблюдения, оценки морфометрических нарушений и внутрисердечной гемодинамики, а также выявления признаков, влияющих на появление желудочковых аритмий. При трансторакальной двухмерной ЭхоКГ выявляют пролабирование створок в парастернальной позиции по длинной оси или в апикальной 3-камерной позиции [8][23]. По длинной оси в парастернальной позиции проводят измерения диаметра митрального кольца, длины и толщины створок, определение наличия и степени митральной регургитации. При трехмерной ЭхоКГ более точно определяют степень пролабирования сегментов передней и/или задней створки митрального клапана и степень митральной регургитации [24][25].
Согласно наблюдениям, ВСС и желудочковые аритмии встречаются у пациентов с ПМК при любой степени тяжести митральной регургитации. В исследовании M. A. Miller и соавт. у пациентов с ПМК (в 50% случаев пролабировали обе створки, у остальных — задняя створка) и легкой или умеренной митральной регургитацией наблюдали желудочковые аритмии [26]. Ранее Y. Turker и соавт., исследовав пациентов с ПМК и желудочковой экстрасистолией или желудочковой тахикардией, по результатам ЭКГ, холтеровского суточного или непрерывного мониторирования, при многомерном логистическом регрессионном анализе показали, что умеренная или тяжелая регургитация является единственным независимым предиктором желудочковых аритмий (ОШ 8,42; 95% ДИ: 1,49–47,64, р=0,01) [27]. Вероятно, тяжесть митральной регургитации не следует рассматривать как единственный фактор риска развития желудочковых аритмий.
Причинами "аритмического" ПМК и ВСС считают миксоматозную дегенерацию створок со значительной избыточностью, длиной и толщиной обеих или одной изолированной створки [16]. Среди случаев ВСС при ПМК (7% от всех случаев ВСС людей в возрасте до 40 лет, зарегистрированных в течение 31 года в Венето, Италия) C. Basso и соавт. при морфологическом исследовании избыточные, утолщенные, удлиненные задние створки отметили в 30% случаев, обе измененные створки — в 70% случаев [16]. В этом же исследовании у 30 лиц с миксоматозным ПМК и сложными желудочковыми аритмиями (устойчивая или неустойчивая желудочковая тахикардия, фибрилляция желудочков) с нормальной величиной QT пролабирование обеих миксоматозных створок при ЭхоКГ наблюдали в 70% случаев.
При выполнении трансторакальной или чреспищеводной ЭхоКГ у лиц с ПМК и желудочковыми аритмиями определяют ДМК и измеряют ее протяженность [28]. Изменение пространственного соотношения (≥5 мм) между стенкой левого предсердия, прикреплением створок митрального клапана и верхней частью стенки левого желудочка, систолическое "скручивание" (curling) фиброзного кольца, аномальное сокращение миокарда в области задней стенки и межжелудочковой перегородки, относятся к факторам риска развития желудочковых аритмий [29][30]. Распространенность ДМК у пациентов с ПМК по результатам исследований составляет от 42% до 90% [31][32].
В качестве потенциального маркера риска развития желудочковых аритмий и ВСС при ПМК рассматривают высокоскоростной (≥16 см/с) систолический поток на латеральном участке митрального кольца (признак Pickelhaube), который появляется в результате аномальной тракции папиллярной мышцы и участка в заднебазальной стенке миокарда пролабирующей миксоматозной створкой митрального клапана [33].
Применяя метод speckle-tracking ЭхоКГ, исследуют систолическую деформацию различных сегментов миокарда, отражающую электрическую дисперсию. Неоднородность сокращений левого желудочка (механическая дисперсия) в области тракции папиллярных мышц створочной хордой и в других регионах, а также снижение глобальной продольной деформации позволяют идентифицировать лиц с ПМК и высоким риском развития желудочковых аритмий [34]. Рассчитываемый постсистолический индекс позволяет количественно определять степень укорочения миокарда после пикового систолического напряжения во время сердечного цикла. Исследователи считают, что постсистолическое сокращение в двух и более сегментах миокарда ассоциировано с неблагоприятными сердечно-сосудистыми событиями и высокой смертностью [35]. При аритмическом ПМК выявлено высокое постсистолическое сокращение в базальном и среднебоковом сегментах по сравнению с пациентами с ПМК без аритмий сердца [36]. При исследовании пациентов с ПМК и желудочковыми аритмиями методом speckle-tracking ЭхоКГ S. Ermakov и соавт. отметили высокую распространенность механической дисперсии сокращений левого желудочка (59±21 мс против 43±12 мс; p<0,001) по сравнению с пациентами без аритмий [37]. Результаты многомерного анализа, выполненного авторами, показали, что появление желудочковых аритмий не зависело от систолической функции левого желудочка, пролабирования обеих створок митрального клапана и наличия митральной регургитации. Выводы работы свидетельствовали о том, что механическая дисперсия, оцениваемая методом speckle-tracking ЭхоКГ у пациентов с ПМК, является фактором высокого риска аритмий [37].
Электрофизиологическое исследование, согласно выполненным научным работам, проводится по показаниям для выявления жизнеугрожающих аритмий, необходимости в ИКД и/или источников эктопии (папиллярные мышцы или волокна Пуркинье) [38].
Метод МРТ с использованием позднего накопления гадолиния (late gadolinium enhancement, LGE) относится к наиболее информативным неинвазивным исследованиям для оценки морфологии митрального клапанного комплекса, функции желудочков, наличия и степени митральной регургитации, поражения миокарда. Диагностику ПМК с 2 мм порогом экскурсии створки(ок) в левое предсердие выполняют методом МРТ со 100% чувствительностью и 100% специфичностью для задней створки и 78% чувствительностью и 97% специфичностью для передней створки по отношению к трансторакальной ЭхоКГ [10][39]. С помощью МРТ при ПМК обнаруживают ДМК, систолическое скручивание, измеряют диаметр митрального кольца, длину и толщину створок митрального клапана, наличие фиброза, клинически манифестирующего и субклинического (микроскопического).
В 2008 г. Y. Han и соавт., применив метод МРТ при исследовании пациентов с ПМК, описал утолщенные (3,2±0,1 мм против 2,3±0,1 мм) и удлиненные (10,5±0,5 мм/м² против 7,1±0,3 мм/м²) задние створки митрального клапана, больший диаметр фиброзного кольца (27,8±0,7 мм/м² против 21,5±0,5 мм/м² по длинной оси; 22,9±0,7 мм/м² против 17,8±0,6 мм/м² для короткой оси) по сравнению с группой без пролабирования створок митрального клапана [39]. У 63% пациентов с ПМК и сложными желудочковыми (≥3 класса по Лауну-Вольфу) нарушениями ритма сердца исследователи выявили области очагового фиброза папиллярных мышц.
C. Basso и соавт. сопоставили результаты МРТ и гистопатологических данных в группе молодых людей с ПМК, умерших в результате жизнеугрожающих аритмий как причины ВСС [16]. Исследователи выявили фиброз папиллярных мышц в 88% или фиброз в нижнебазальной стенке миокарда в 93% случаев. В другом исследовании при сравнении результатов МРТ у пациентов с первичной митральной регургитацией заместительный фиброз миокарда левого желудочка определили у 36,7% пациентов с ПМК по сравнению с группой без ПМК (6,7%; р<0,001), отметив увеличение площади фиброза наряду с повышением степени тяжести митральной регургитации [40]. Локализацию фиброза в базальной, нижней и нижнебоковой стенках левого желудочка, т.е. в сегментах, непосредственно прилегающих к заднемедиальной папиллярной мышце, обнаружили преимущественно у пациентов с ПМК и устойчивой желудочковой тахикардией или фибрилляцией желудочков.
Таким образом, выполнение МРТ целесообразно у пациентов с ПМК для точной оценки структурных и функциональных нарушений и выявления морфологического субстрата аритмий — очагового либо распространенного фиброза миокарда.
Стратификация риска желудочковых аритмий и ВСС
Исследования, выполненные за период с момента первого описания ПМК, показали, что определенные факторы риска, такие как избыточность и удлинение створок митрального клапана, миксоматозная дегенерация, пролабирование обеих створок, ДМК, инверсия зубца Т на ЭКГ, LGE в определенных сегментах миокарда при МРТ, часто встречаются при тяжелых желудочковых нарушениях ритма и могут учитываться при прогнозе заболевания. Неясной остается комбинация факторов риска, повышающих вероятность диагностики аритмического ПМК.
В консенсусе экспертов EHRA в 2022 году представлена стратификация риска и принципы лечения пациентов с аритмическим ПМК, выделены группы низкого, промежуточного и высокого риска (рис. 1) [41].
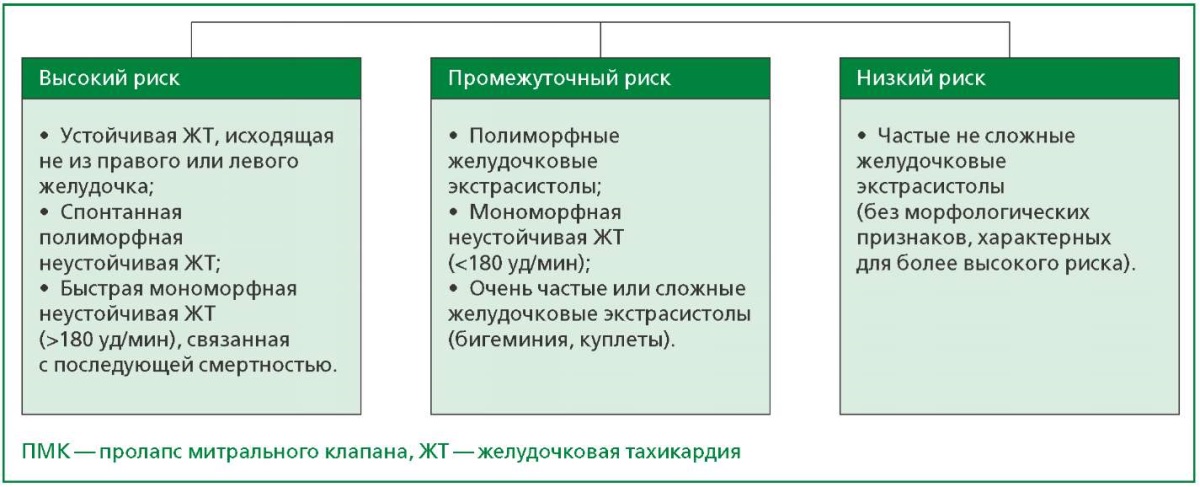
Рисунок 1. Степени риска при желудочковых аритмиях, обусловленных ПМК [41].
При обследовании пациентов с ПМК для прогнозирования желудочковых аритмий сердца необходимо учитывать:
- анамнестические данные с указаниями на синкопе или липотимии (либо ВСС у родственников), среднесистолический щелчок при аускультации сердца;
- результаты ЭКГ мониторирования в течение суток (или длительнее) для определения наличия и характера аритмий сердца, выявления инверсии зубца Т более, чем в двух последовательных отведениях (часто в нижних и боковых отведениях), fQRS;
- данные трансторакальной ЭхоКГ: помимо определения степени ПМК, тяжести митральной регургитации, измерения толщины и длины створок митрального клапана, диаметра фиброзного кольца, определения размеров камер сердца, показателей гемодинамики, необходимо выявление и измерение протяженности ДМК, высокоскоростного (≥16 см/с) систолического потока на латеральном участке митрального кольца (признак Pickelhaube), постсистолического индекса, механической дисперсии, глобальной продольной деформации миокарда;
- результаты МРТ–LGE — уточнение характера морфологических и гемодинамических характеристик сердца, обнаружение участков фиброза в папиллярной мышце, нижней или нижнебоковой стенках и других сегментах миокарда левого желудочка.
В 2024 г. опубликован первый метаанализ 10 исследований с участием 1715 пациентов, направленный на выявление прогностических факторов риска аритмического ПМК [42]. К признакам, необходимым для анализа и статистической обработки, отнесли следующие: инверсия зубца Т и корригированный интервал QT, пролабирование одной или обеих створок митрального клапана, длину и толщину створок, глобальную продольную деформацию миокарда, механическую дисперсию, митральную регургитацию (по результатам трансторакальной ЭхоКГ). Фракцию выброса левого желудочка, диаметр фиброзного кольца, протяженность ДМК рассматривали по результатам ЭхоКГ или МРТ. Оценивали наличие и распространенность сегментов миокарда с LGE при МРТ, учитывали половую детерминированность, анамнез фибрилляции предсердий.
В итоге к наиболее значимым рассчитанным прогностическим факторам аритмий у пациентов с ПМК относились следующие:
- позднее накопление гадолиния (отношение шансов (ОШ) 16,67; p=0,005),
- инверсия зубца Т (ОШ 2,63; p<0,0001),
- пролабирование обеих створок митрального клапана (ОШ 1,92; p<0,0001),
- ДМК (ОШ 2,60; p<0,0001).
У пациентов с ПМК выявили более длинную переднюю и заднюю створки митрального клапана, бóльшую толщину передней створки, бóльшую протяженность ДМК и бóльшую распространенность LGE, повышенную механическую дисперсию миокарда по сравнению с пациентами с ПМК без аритмий сердца [42]. Исследователи отметили, что наличие сегментов миокарда с LGE при МРТ в 16 раз повышает вероятность развития желудочковой аритмии у пациентов с ПМК [42].
Одной из причин появления областей миокарда с очаговым или распространенным фиброзом является предшествующее воспаление с избыточной пролиферацией фибробластов, которое является результатом аномального натяжения папиллярной мышцы и миокарда створочной хордой пролабирующего митрального клапана [26][43]. Другой причиной развития интерстициального фиброза, не ограничивающегося нижней и нижне-базальной стенкой, а распространенного на переднюю и передне-боковую стенку считают первичное поражение миокарда в виде кардиомиопатии [44]. Исследование пациентов с ПМК (80% женщины) методом МРТ без тяжелой митральной регургитации с желудочковой аритмией показало больший объем внеклеточного матрикса миокарда по сравнению с пациентами без аритмий сердца (31% против 27%; р=0,002). Данная связь определялась женским полом и независимо ассоциировалась после коррекции на факторы риска сердечно-сосудистых заболеваний с ДМК и LGE (p<0,01) [44].
Наличие заместительного фиброза в миокарде объясняет повышение механической дисперсии и снижение глобальной продольной деформации миокарда у пациентов с аритмическим ПМК [29][36]. E. Scheirlynck и соавт. в 2019 г. впервые показали, что у пациентов с желудочковой аритмией при ПМК и ДМК выше концентрация в крови стимулирующего фактора роста, кодируемого геном 2 (sST2), по сравнению с пациентами с ПМК без аритмии сердца [45]. В настоящее время sST2 рассматривается как маркер желудочковой аритмии при ПМК, возникающей в результате растяжения миокарда при патологических процессах, обусловленных воспалением, апоптозом и растяжением кардиомиоцитов, фиброзом миокарда [45][46]. В другом исследовании M. Chivulesku и соавт. доказали, что уровень циркулирующего в крови трансформирующего фактора роста-бета (TGF-β), способствующего миксоматозной дегенерации, коррелирует с протяженностью ДМК и фиброзом у лиц с ПМК и желудочковыми аритмиями [17].
Предложенные факторы риска развития желудочковых аритмий и ВСС встречаются с различной частотой и оценкой значимости у исследователей, поскольку во многих случаях отсутствует стандартизация методов выявления. Схема основных методов исследования и признаков, встречающихся при желудочковых аритмиях, у пациентов с ПМК представлена на рис. 2.
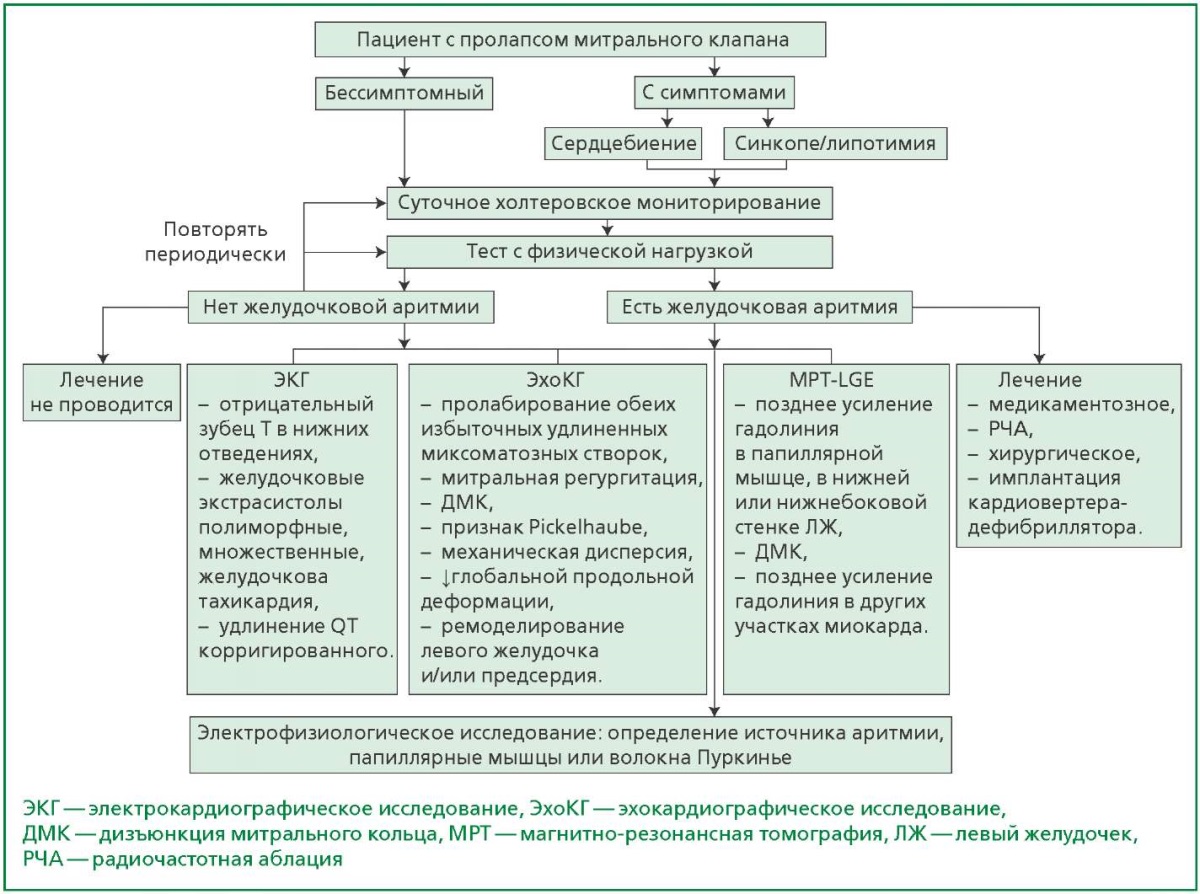
Рисунок 2. Схема методов диагностики факторов риска развития желудочковых аритмий
и лечебной тактики у пациентов с ПМК [13], [38].
Ориентируясь на характер выявленных аритмий, проводят дальнейшее наблюдение и лечение пациентов с ПМК.
Принципы лечения
При выборе лечения пациентов с аритмическим ПМК учитывают клинические характеристики и применяют персонифицированный подход с целью предупреждения ВСС и тяжелых желудочковых аритмий. Как правило, для профилактики ВСС у пациентов с аритмическим ПМК рассматривают четыре направления лечебной тактики: медикаментозное лечение, радиочастотная аблация (РЧА), хирургическое лечение митрального клапана, ИКД. Предложенные методы лечения направлены на улучшение качества жизни и выживаемости пациентов с аритмическим ПМК.
Выбор групп лекарственных средств для лечения желудочковых аритмий сердца направлен на рекомендуемые при других заболеваниях антиаритмические препараты, часто бета-адреноблокаторы или недигидропиридиновые блокаторы медленных кальциевых каналов [9][41]. Флекаинид, пропафенон и амиодарон уменьшают количество желудочковых экстрасистол и улучшают функцию левого желудочка [47-50]. Конкретные указания, основывающиеся на доказательной базе исследований по эффективности бета-адреноблокаторов или других антиаритмических препаратов у пациентов с ПМК, отсутствуют.
Во всех ситуациях при выявлении желудочковых аритмий необходимо рассматривать ИКД для первичной или вторичной профилактики ВСС. Согласно рекомендациям, первичная профилактика показана в случае симптомной сердечной недостаточности с фракцией выброса <35%, при неэффективности оптимальной медикаментозной терапии в течение трех месяцев [51]. Неизвестно, относятся ли к этой группе пациенты с ПМК, поскольку значительное снижение фракции выброса левого желудочка наблюдается редко.
Вторичная профилактика с ИКД показана при анамнестических указаниях и документальном подтверждении остановки сердца с фибрилляцией желудочков или желудочковой тахикардией без каких-либо других причин у пациента с ПМК [52].
Таким образом, убедительные данные о показаниях к ИКД для первичной профилактики ВСС у пациентов с ПМК в настоящее время не разработаны. Установку ИКД для вторичной профилактики ВСС проводят согласно существующим рекомендациям при других состояниях с тяжелыми желудочковыми аритмиями.
Метод РЧА применяют при мультифокальных частых желудочковых экстрасистолах, желудочковой тахикардии, фибрилляции желудочков. Показания к РЧА могут включать рефрактерность или непереносимость медикаментозной терапии, предпочтения пациентов в связи с нежеланием длительного приема антиаритмических препаратов [53]. Механизмы желудочковой аритмии при ПМК нередко обусловлены фиброзом папиллярных мышц или волокон Пуркинье, где выполнение РЧА является технически сложной задачей из-за глубокого расположения очагов эктопии, к тому же эктопические очаги могут локализоваться в других областях (выносящий тракт, фиброзное кольцо) [54]. Эффективность РЧА показана при рецидивирующей желудочковой тахикардии при ПМК, обусловленной электрической нестабильностью миокарда, вызванной фиброзом в нижнебоковой стенке левого желудочка [55]. При проспективном исследовании после эффективной РЧА у пациентов с ПМК и мультифокальной эктопией развиваются гемодинамически значимые желудочковая тахикардия/фибрилляция желудочков, обусловленные прогрессированием изменений миокарда и желудочковых аритмий [56]. Рецидивы желудочковой аритмии, вероятно обусловленные распространенным фиброзом миокарда по результатам МРТ-LGE, наблюдают в 26-32% случаев [53-55].
Оперативное лечение ПМК для предупреждения желудочковых аритмий остается предметом дискуссии. В представленных исследованиях после оперативного лечения ПМК частота желудочковых аритмий снижалась у молодых людей (~42 года), у пожилых (~62 года), такого эффекта не наблюдали [57][58]. Прогрессирующий диффузный фиброз папиллярных мышц и сегментов миокарда в местах их локализации, в области митрального кольца, хордах с возрастом и наличием сопутствующих заболеваний, вероятно, относился к причинам желудочковой аритмии [59]. Роль различных хирургических методов лечения на митральном клапане в предупреждении желудочковых аритмий остается неопределенной.
Заключение
Пациенты с ПМК и желудочковыми аритмиями составляют небольшую группу населения, вместе с тем развитие ВСС и снижение качества жизни у людей молодого возраста являются социально значимой проблемой кардиологии. В настоящее время совершенствование диагностических методов позволило выявить новые и пересмотреть значимость уже известных факторов риска, обнаружение которых улучшает прогнозирование развития желудочковых нарушений ритма при ПМК. Проводятся генетические исследования семей с ПМК, высказывается предположение, требующее дальнейших исследований и доказательств, о возможном участии генов FLNC, LMNA, SCN5A и HCN4 в развитии аритмического синдрома. Комплексное обследование пациентов с ПМК с учетом возможного наличия факторов риска желудочковых аритмий позволит своевременно использовать доступные методы лечения, предупредить тяжелые осложнения и улучшить прогноз.
Отношения и деятельность. Нет.
Relationships and Activities. None.
Список литературы
1. Freed LA, Levy D, Levine RA, et al. Prevalence and clinical outcome of mitral-valve prolapse. N Engl J Med. 1999;341(1):1-7. DOI:10.1056/NEJM199907013410101.
2. Delling FN, Vasan RS. Epidemiology and pathophysiology of mitral valve prolapse: new insights into disease progression, genetics, and molecular basis. Circulation. 2014;129(21):2158-70. DOI:10.1161/CIRCULATIONAHA.113.006702.
3. Otto CM, Nishimura RA, Bonow RA, et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease: Executive Summary: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2021;143(5):e35-e71. DOI:10.1161/CIR.0000000000000932.
4. Adams DH, Rosenchek R, Falk V. Degenerative mitral valve regurgitation: best practice revolution. Eur Heart J. 2010;31(16):1958-66. DOI:10.1093/eurheartj/ehq222.
5. Freed KA, Benjamin EL, Levy D, et al. Mitral valve prolapse in the general population: the benign nature of echocardiographic features in the Framingham Heart Study. Am J Coll Cardiol. 2002;40(7):1298-304. DOI:10. 1016/s0735-1097(02)02161-7.
6. Kelly RE. Jr. Pectus excavatum historical background, clinical picture, preoperative evaluation and criteria for operation. Semin Pediatr Surg. 2008;17(3):181-93. DOI:10.1053/j.sempedsurg.2008.03.002.
7. Basso C, Iliceto S, Thiene G, Perazzolo Marra M. Mitral Valve Prolapse, Ventricular Arrhythmias, and Sudden Death. Circulation. 2019;140(11):952-64. DOI:10.1161/CIRCULATIONAHA.118.034075.
8. Трисветова Е. Л., Юдина О. А. Пролапс митрального клапана и наследственные нарушения соединительной ткани. Минск: Альфа-книга; 2022].
9. Alenazy A, Eltayeb A, Alotaibi MK, et al. Diagnosis of Mitral Valve Prolapse: Much More than Simple Prolapse. Multimodality Approach to Risk Stratification and Therapeutic Management. J Clin Med. 2022;11(2):455. DOI:10.3390/jcm11020455.
10. Deng Y, Liu J, Wu S, et al. Arrhythmic Mitral Valve Prolapse: A Comprehensive Review. Diagnostics (Basel). 2023;13(18):2868. DOI:10.3390/diagnostics13182868.
11. Bayer-Topilsky T, Suri RM, Topilsky Y, et al. Mitral Valve Prolapse, Psychoe motional Status, and Quality of Life: Prospective Investigation in the Current Era. Am J Med. 2016;129(10):1100-9. DOI:10.1016/j.amjmed.2016.05.004.
12. Hayek E, Gring CN, Griffin BP. Mitral valve prolapse. Lancet. 2005;365(9458): 507-18. DOI:10.1016/S0140-6736(05)17869-6.
13. Essayagh B, Sabbad A, Antoine C, et al. Presentation and Outcome of Arrhythmic Mitral Valve Prolapse. J Am Coll Cardiol. 2020:76(6):637-49. DOI:10.1016/j.jacc.2020.06.029.
14. Savage DD, Levy D, Garrison RJ, et al. Mitral valve prolapse in the general population. 3. Dysrhythmias: the Framingham study. Am Heart J. 1983;106(3):582-6. DOI:10.1016/0002-8703(83)90706-8.
15. Aabel EW, Chivulesku M, Lie ØH, et al. Ventricular arrhythmias in arrhythmic mitral valve syndrome-a prospective continuous long-term cardiac monitoring study. Europace. 2023;25(2):506-16. DOI:10.1093/europace/euac182.
16. Basso C, Perazzolo Marra MP, Rizzo S, et al. Arrhythmic Mitral Valve Prolapse and Sudden Cardiac Death. Circulation. 2015;132(7):556-66. DOI:10.1161/CICULATIONAHA.115.016291.
17. Chivulesku M, Aabel EW, Gjersten E, et al. Electrical markers and arrhyth mic risk associated with myocardial fibrosis in mitral valve prolapse. Europace. 2022;24(7):1156-63. DOI:10.1093/europace/euac017.
18. Zouridakis EG, Parthenakis FI, Kochiadalis GE, et al. QT dispersion in patients with mitral valve prolapse is related to the echocardiographic degree of the prolapse and mitral leaflet thickness. Europace. 2015;3(4):292-8. DOI:10.1053/eupc.2001.0186.
19. Guenancia C, Pace N, Hossu G, et al. Prevalence and Determinants of PVCs Originating From the Mitral Apparatus in Patients With MVP. JACC Clin Electrophysiol. 2022;8(4):526-8. DOI:10.1016/j.jacep.2021.12.005.
20. Kaya Ü, Eren H. Fragmented QRS may be associated with complex ventric ular arrhythmias in mitral valve prolapse. Minerva Cardioangiol. 2020;68(6);577-85. DOI:10.23736/S0026-4725.20.05123-3.
21. Sriram CS, Syed FF, Ferguson ME, et al. Malignant bileaflet mitral valve prolapse syndrome in patients with otherwise idiopathic out-of-hospital cardiac arrest. J Am Coll Cardiol. 2013;62(3):222-30. DOI:10.1016/j.jacc.2013.02.060.
22. Korovesis TG, Koutrolou-Sotiropoulou P, Katritsis DG. Arrhythmogenic Mitral Valve Prolapse. Arrhythm Electrophysiol Rev. 2022;11:e16. DOI:10.15420/aer.2021.28.
23. Lancellotti P, Tribouilloy C, Hagendorff A, et al; Scientific Document Committee of the European Association of Cardiovascular Imaging. Recommendations for the echocardiographic assessment of native valvular regurgitation: an executive summary from the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2013;14(7):611-44. DOI:10.1093/ehjci/jet105.
24. Lang MR, Tsang W, Weinert L. et al. Valvular heart disease. The value of 3-dimensional echocardiography. J Am Coll Cardiol. 2011;58(19):1933-44. DOI:10.1016/j.jacc.2011.07.035.
25. Mantegazza V, Gripari P, Tamborini G, et al. 3D echocardiography in mitral valve prolapse. Front Cardiovasc Med. 2023:9:1050476. DOI:10.3389/fcvm.2022.1050476.
26. Miller MA, Devesa A, Robson PM, et al. Arrhythmic Mitral Valve Prolapse With Only Mild or Moderate Mitral Regurgitation: Characterization of Myo cardial Substrate. JACC Clin Electrophysiol. 2023;9(8 Pt3):1709-16. DOI:10.1016/j.jacep.2023.04.011.
27. Turker Y, Ozaydin M, Acar G, et al. Predictors of ventricular arrhythmias in patients with mitral valve prolapse. Int J Cardiovasc Imaging. 2010;26(2): 139-45. DOI:10.1007/s10554-009-9514-6.
28. Алехин М. Н. Значение эхокардиографии в выявлении и оценке митральной аннулярной дизъюнкции. Ультразвуковая и функциональная диагностика. 2022;3:17-29]. DOI:10.24835/1607-07712022-3-17-29.
29. Perazzolo Marra M, Basso C, De Lazzari M, et al. Morphofunctional abnormalities of mitral annulus and arrhythmic mitral valve prolapse. Circ Cardiovasc Imaging. 2016;9(8):e005030. DOI:10.1161/CIRCIMAGING.116.005030.
30. Dejgaard LA, Skjølsvik ET, Lie ØH, et al. The mitral annulus disjunction arrhythmic syndrome. J Am Coll Cardiol. 2018;72(14):1600-09. DOI:10.1016/j.jacc.2018.07.070.
31. Wunderlich NC, Ho SY, Flint N, Siegel RJ. Myxomatous mitral valve disease with mitral valve prolapse and mitral annular disjunction: clinical and functional significance of the coincidence. J Cardiovasc Dev Dis. 2021;8(2):9. DOI:10.3390/jccd8020009.
32. Konda T, Tani T, Suganuma N, et al. The analysis of mitral annular disjunction detected by echocardiography and comparison with previously reported pathological data. J Echocardiogr. 2017;15(4):176-85. DOI:10.1007/s12574017-0349-1.
33. Muthukumar L, Rahman F, Jan MF, et al. The Pickelhaube sign: novel echocardiographic risk marker for malignant mitral valve prolapse syndrome. JACC Cardiovasc Imaging. 2017;10(9):1078-80. DOI:10.1016/j.jcmg.2016.09.016.
34. van Wijngaarden A, de Riva M, Hiemstra YL, et al. Parameters associated with ventricular arrhythmias in mitral valve prolapse with significant regurgitation. Heart. 2021;107(5):411-8. DOI:10.1136/heartjnl-2020-317451.
35. Brainin P, Biering-S ørensen SR, Møgelvang R, et al. Postsystolic Shortening by Speckle Tracking Echocardiography Is an Independent Predictor of Cardiovascular Events and Mortality in the General Population. J Am Heart Assoc. 2018;7(6):e008367. DOI:10.1161/JAHA.117008367.
36. Muthukumar L, Jahangir A, Jan MF, et al. Left Ventricular Global and Regional Deformation in Arrhythmic Myxomatous Bileaflet Mitral Valve Prol apse Syndrome. JACC Cardiovasc Imaging. 2020;13(8):1842-4. DOI:10.1016/j.jcmg.2020.02.035.
37. Ermakov S, Gulhar R, Lim L, et al. Left ventricular mechanical dispersion predicts arrhythmic risk in mitral valve prolapse. Heart. 2019;105(14):1063-9. DOI:10.1136/heartjnl-2018-314269.
38. Chakrabarti AK, Bogun F, Liang JJ. Arrhythmic Mitral Valve Prolapse and Mitral Annular Disjunction: Clinical Features, Pathophysiology, Risk Stratification, and Management. J Cardiovasc Dev Dis. 2022;9(2):61. DOI:10. 3390/jcdd9020061.
39. Han Y, Peters DC, Salton CJ, et al. Cardiovascular Magnetic Resonance Characterization of Mitral Valve Prolapse. JACC Cardiovasc Imaging. 2008; 1(3):294-303. DOI:10.1016/j.jcmg.2008.01.013.
40. Kitkungvan D, Nabi F, Kim RJ, et al. Myocardial Fibrosis in Patients With Primary Mitral Regurgitation With and Without Prolapse. J Am Coll Cardiol. 2018;72(8):823-34. DOI:10.1016/j.jacc.2018.06.048.
41. Sabbag A, Essayagh B, Barrera JDR, et al. EHRA expert consensus statement on arrhythmic mitral valve prolapse and mitral annular disjunction complex in collaboration with the ESC council on valvular heart disease and the European Association of Cardiovascular Imaging endorsed by the Heart Rhythm Society, by the Asia Pacific Heart Rhythm Society, and by the Latin American Heart Rhythm Society. Europace. 2022;24(12):1981-2003. DOI:10.1093/europace/euac125.
42. Pistelli L, Vetta G, Parlavecchio A, et al. Arrhythmic risk profile in mitral valve prolapse: A systematic review and metanalysis of 1715 patients. J Cardiovasc Electrophysiol. 2024;35(2):290-300. DOI:10.1111/jce.16149.
43. Miller MA, Adams DH, Pandis D, et al. Hybrid Positron Emission Tomography/ Magnetic Resonance Imaging in Arrhythmic Mitral Valve Prolapse. JAMA Cardiol. 2020;5(9):1000-5. DOI:10.1001/jamacardio.2020.1555.
44. Tastet L, Dixit S, Nguen T, et al. Interstitial Fibrosis and Arrhythmic Mitral Valve Prolapse: Unravelling Sex-B ased Differences. medRxiv [Preprint]. 2024: 2024.01.12.24301217. DOI:10.1101/2024.01.12.24301217.
45. Scheirlynck E, Dejgaard L, Skjølsvik E, et al. Increased levels of sST2 in patients with mitral annulus disjunction and ventricular arrhythmias. Open Heart. 2019;6(1):e001016. DOI:10.1136/openhrt-2019-001016.
46. Weinberg EO, Shimpo M, De Keulenaer GW, et al. Expression and Regula tion of ST2, an Interleukin-1 Receptor Family Member, in Cardiomyocytes and Myocardial Infarction. Circulation. 2002;106(23):2961-6. DOI:10.1161/01.CIR.
47. Aabel EW, Dejgaard LA, Chivulesku M, et al. Flecainide in patients with arrhythmic mitral valve syndrome: A case series. Heart Rhythm. 2023;20(4): 635-6. DOI:10.1016/j.hrthm.2022.12.024.
48. Stec S, Sikorska A, Zaborska B, et al. Benign symptomatic premature ventricular complexes: short- and long-term efficacy of antiarrhythmic drugs and radiofrequency ablation. Kardiol Pol. 2012;70(4):351-8.
49. Singh SN, Fletcher RD, Fisher SG, et al. Amiodarone in patients with congestive heart failure and asymptomatic ventricular arrhythmia. Survival trial of antiarrhythmic therapy in congestive heart failure. N Engl J Med. 1995;333(2):77-82. DOI:10.1056/NEJM199507133330201.
50. Hyman MC, Mustin D, Supple G, et al. Class IC antiarrhythmic drugs for suspected premature ventricular contractioninduced cardiomyopathy. Heart Rhythm. 2018;15(2):159-63. DOI:10.1016/j.hrthm.2017.12.018.
51. Vahanian A, Beyersdorf F, Praz F, et al; ESC/EACTS Scientific Document Group. 2021 ESC/EACTS guidelines for the management of valvular heart disease. Eur Heart J. 2021;43(7):561-632. DOI:10.1093/eurheartj/ehab395.
52. Priori SG, Blomstrom-Lundqvist C, Mazzanti A, et al; ESC Scientific Document Group. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: the task force for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death of the European Society of Cardiology (ESC) endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC). Eur Heart J. 2015;36(41):2793-867. DOI:10.1093/eurheartj/ehv316.
53. Bumgarner JM, Patel D, Kumar A, et al. Management and outcomes in mitral valve prolapse with ventricular arrhythmias undergoing ablation and/ or implantation of ICDs. Pacing Clin Electrophysiol. 2019;42(4):447-52. DOI:10.1111/pace.13613.
54. Enriquez A, Shirai Y, Huang J, et al. Papillary muscle ventricular arrhythmias in patients with arrhythmic mitral valve prolapse: electrophysiologic substrate and catheter ablation outcomes. J Cardiovasc Electrophysiol. 2019;30(6):827-35. DOI:10.1111/jce.13900.
55. Kubala M, Essyagh B, Michelena HI, et al. Arrhythmic mitral valve prolapse in 2023: Evidence-based update. Front Cardiovasc Med. 2023;10:1130174. DOI:10.3389/fcvm.2023.1130174.
56. Marano PJ, Lim LJ, Sanchez JM, et al. Long-term outcomes of ablation for ventricular arrhythmias in mitral valve prolapse. J Interv Card Electrophysiol. 2021;61(1):145-54. DOI:10.1007/S10840-020-00775-1.
57. Hosseini S, Rezaei Y, Samiei N, et al. Effects of mitral valve repair on ventricular arrhythmia in patients with mitral valve prolapse syndrome: A report of two cases. Int J Cardiol. 2016;222:603-5. DOI:10.1016/j.ijcard.2016.08.053.
58. Vaidya VR, DeSimone CV, Damle N, et al. Reduction in malignant ventricular arrhythmia and appropriate shocks following surgical correction of bileaflet mitral valve prolapse. J Interv Card Electrophysiol. 2016;46(2):137-43. DOI:10.1007/s10840-015-0090-5.
59. Naksuk N, Syed FF, Krittanawong C, et al. The effect of mitral valve surgery on ventricular arrhythmia in patients with bileaflet mitral valve prolapse. Indian Pacing Electrophysiol J. 2016;16(6):187-91. DOI:10.1016/j.ipej.2016.10.009.
Об авторе
Е. Л. ТрисветоваБеларусь
Трисветова Евгения Леонидовна
Минск
Дополнительные файлы
Рецензия
Для цитирования:
Трисветова Е.Л. Факторы риска развития желудочковых аритмий при несиндромном пролапсе митрального клапана. Рациональная Фармакотерапия в Кардиологии. 2024;20(2):249-257. https://doi.org/10.20996/1819-6446-2024-3015. EDN: TCJSGR
For citation:
Trisvetova E.L. Risk factors of ventricular arrhythmias in non-syndromic mitral valve prolapse. Rational Pharmacotherapy in Cardiology. 2024;20(2):249-257. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3015. EDN: TCJSGR















































