Перейти к:
Сравнение качества моделей логистической регрессии и дерева классификации при прогнозировании госпитальной летальности у пациентов старческого возраста с острым инфарктом миокарда без подъема сегмента ST электрокардиограммы
https://doi.org/10.20996/1819-6446-2024-3029
EDN: QOHDFE
Аннотация
Цель. С помощью метода CHAID (Chi Squared Automatic Interaction Detection) разработать дерево классификации для прогнозирования госпитальной летальности у больных c инфарктом миокарда без подъема сегмента ST электрокардиограммы (ИМбпST) в возрасте 75 лет и старше и сравнить качество построенной модели с моделью логистической регрессии.
Материал и методы. Проведен ретроспективный анализ данных историй болезни 119 последовательно включенных пациентов в возрасте ≥75 лет, госпитализированных в кардиологический стационар в связи с ИМбпST в 2020-2021 гг. Построение прогностической модели вероятности летального исхода выполнялось при помощи метода логистической регрессии. Для оценки влияния различных предикторов, влияющих на вероятность летального исхода за период госпитализации у пациентов с ИМбпST, было разработано дерево классификации методом CHAID. Для проведения сравнения качества моделей логистической регрессии и дерева классификации оценивались площади под ROC-кривой и доверительные интервалы (ДИ).
Результаты. При построении бинарной логистической регрессии было установлено, что факторами, увеличивающими госпитальную летальность, служили кардиогенный шок (КШ) — отношение шансов (ОШ) 47,55; 4,00-589,16; p=0,002, впервые возникший пароксизм фибрилляции предсердий — ОШ 6,45; 1,39-30,42; p=0,018, число баллов по шкале GRACE — на каждое повышение на 1 балл — ОШ 1,03; 1,00-1,05; p=0,046. Похожие данные были получены и при анализе дерева классификации: у пациентов с КШ прогнозируемая летальность составляла 91,7%. Вероятность неблагоприятного исхода на основании построенного дерева классификации была выше, чем в среднем в анализируемой выборке у лиц без КШ, атриовентрикулярной блокады 2-3 степени, отека легких, но с блокадой правой ножки пучка Гиса на электрокардиограмме (25,0%) и у лиц без КШ и атриовентрикулярной блокады 2-3 степени, но с отеком легких и зубцом Q на электрокардиограмме (50,0%). Оба метода прогнозирования госпитальной летальности применимы у больных с ИМбпST. Статистически значимых различий в качестве обеих построенных моделей не получено — разность площадей под ROC-кривыми составила 0,043±0,268 с 95% ДИ -0,055-0,141, p=0,387.
Заключение. Обе разработанные модели могут быть применимы для определения вероятности смерти в стационаре у пациентов с ИМбпST. В настоящее время начат и продолжается набор пациентов в проспективное исследование аналогичного дизайна, в ходе которого запланирована валидация построенных моделей прогнозирования.
Ключевые слова
Для цитирования:
Переверзева К.Г., Якушин С.С., Перегудова Н.Н., Мишутина М.В. Сравнение качества моделей логистической регрессии и дерева классификации при прогнозировании госпитальной летальности у пациентов старческого возраста с острым инфарктом миокарда без подъема сегмента ST электрокардиограммы. Рациональная Фармакотерапия в Кардиологии. 2024;20(4):418-425. https://doi.org/10.20996/1819-6446-2024-3029. EDN: QOHDFE
For citation:
Pereverzeva K.G., Yakushin S.S., Peregudova N.N., Mishutina M.V. Comparison of the quality of logistic regression models and a classification tree in predicting hospital mortality in elderly patients with non-ST-elevation myocardial infarction. Rational Pharmacotherapy in Cardiology. 2024;20(4):418-425. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3029. EDN: QOHDFE
Введение
Самое грозное проявление ишемической болезни сердца — инфаркт миокарда (ИМ) [1][2], смертность от которого, несмотря на внедрение высокоэффективных методов реперфузии и вторичной профилактики, остается на высоком уровне [3][4]. Медицинская помощь пациентам с острым коронарным синдромом осуществляется в соответствии с клиническими рекомендациями "Острый ИМ с подъемом сегмента ST электрокардиограммы" (ИМпST) 2020 г [1] и "Острый коронарный синдром без подъема сегмента ST электрокардиограммы" (ОКСбпST) 2020 г [2], в которых указано, что "рутинная стратификация риска с помощью шкал у пациентов с ИМ с подъемом сегмента ST в период госпитализации не рекомендуется" [1], а для пациентов с ОКСбпST "для стратификации риска неблагоприятного исхода рекомендуется использовать валидированные индексы и шкалы" [2]. При этом в качестве шкалы для оценки прогноза рекомендовано использовать GRACE, число баллов по которой, наряду с другими факторами риска, определяет временные промежутки проведения коронароангиографии с намерением выполнить чрескожное коронарное вмешательство (ЧКВ) [2]. Несомненным плюсом шкалы GRACE является то, что в нее в качестве фактора риска включен возраст пациента [5]. Однако, для пациентов в возрасте 75 лет и старше это означает, что они автоматически получают 75-100 баллов по шкале GRACE (в возрасте 75-79 лет — 75 баллов, 80-89 лет — 91 балл, в 90 и более лет — 100 баллов) и, в подавляющем большинстве случаев, в силу возраста относятся к категории высокого риска неблагоприятного исхода. Отнесение пациентов 75 лет и старше к категории умеренного и низкого риска неблагоприятного исхода возможно только при отсутствии признаков острой сердечной недостаточности, оптимальных показателях систолического артериального давления, частоты сердечных сокращений, уровней креатинина сыворотки крови и сердечного тропонина, либо при значениях этих показателей, имеющих по шкале GRACE "вес" ноль баллов, например, систолическое артериальное давление ≥200 мм рт.ст., частота сердечных сокращений ≤50 уд./мин. В связи с этим при ранжировании пациентов с ОКСбпST в возрасте 75 лет и старше по шкале GRACE, число баллов по ней в отдельных случаях не отражает тяжесть состояния пациента, обусловленную ОКСбпST.
Неточность определения риска неблагоприятного исхода приобретает особую важность у ослабленных и коморбидных пациентов, пациентов с многососудистым поражением коронарных артерий и наличием хронических окклюзий коронарных артерий, для которых проведение реваскуляризации миокарда в сроки, превышающие 2-24 часа, может быть более безопасным с позиций прогноза, нежели проведение вмешательства в первые сутки после поступления.
В этой связи представляется целесообразной разработка новых шкал и прогностических моделей, уточняющих риски неблагоприятного исхода у пациентов с ОКСбпST в возрасте 75 лет и старше. При этом поиск предикторов для возможных новых шкал и моделей и разработка самих шкал и моделей, окончательная валидация которых должна осуществляться в рандомизированных контролируемых исследованиях, могут и, вероятно, должны осуществляться на основании ретро- и проспективных регистровых исследований, позволяющих осуществлять сплошное включение пациентов, а в случае проспективного исследования и оценивать вклад скрининговых методов диагностики старческой астении в прогноз [6].
Вместе с тем при разработке шкал и моделей для последующей валидации необходимо учитывать и оценивать их исходное качество. В зависимости от метода показателями эффективности модели могут быть такие, как чувствительность, специфичность, точность (accuracy/precision), F-мера, AUROC (c-индекс), критерий Акаике, среднеквадратическая ошибка [7][8].
Цель исследования — с помощью метода CHAID (Chi Squared Automatic Interaction Detection) разработать дерево классификации для прогнозирования госпитальной летальности у больных c инфарктом миокарда без подъема сегмента ST электрокардиограммы (ИМбпST) в возрасте 75 лет и старше и сравнить качество построенной модели с моделью логистической регрессии.
Материал и методы
Проведен ретроспективный анализ данных историй болезни 119 последовательно включенных пациентов в возрасте ≥75 лет, госпитализированных в кардиологический стационар в связи с ИМбпST в 2020-2021 гг. Средний возраст пациентов — 82,4±4,8 года, мужчин — 35 (29,4%). Критериев исключения в данном исследовании не предусмотрено. Исследование одобрено локальным этическим комитетом вуза 06.12.2021 протокол №6. Отдельная форма информированного согласия для участия в исследовании не подписывалась. Считалось достаточным подписания формы информированного согласия на обследование и лечение в условиях клинического лечебно-профилактического учреждения, тип исследования — ретроспективный.
Выделены 2 группы пациентов, первую из которых составили 20 (16,8%) пациентов, умерших в период госпитализации в стационаре, вторую — 99 (83,2%) выживших пациентов. Медиана времени наступления летального исхода составила 2,0 [ 0,8;5,5] дня.
Статистический анализ
Статистический анализ проводился с использованием программ StatTech v. 4.0.4 (ООО "Статтех", Россия) и IBM SPSS Statistics v.26 (IBM Corporation, США). Соответствие нормальному распределению количественных показателей оценивали с помощью критериев Шапиро-Уилка и Колмогорова-Смирнова. Количественные показатели, описывали с помощью среднего значения и стандартного отклонения в виде — M±SD при нормальном распределении и с помощью медианы и нижнего и верхнего квартилей в виде — Mе [ Q1; Q3] при распределении, отличном от нормального. Категориальные данные описывали с указанием абсолютных значений и частот. Сравнение двух групп по количественному показателю при нормальном распределении проводилось с помощью t-критерия Уэлча, а при распределении, отличном от нормального — с помощью U-критерия Манна-Уитни. Сравнение двух и более групп по качественному признаку выполнялось с помощью критерия хи-квадрат Пирсона (при n>10) или точного критерия Фишера (при n≤10).
Построение прогностической модели вероятности летального исхода выполняли при помощи метода логистической регрессии. Мерой определенности, указывающей на ту часть дисперсии, которая может быть объяснена с помощью логистической регрессии, служил коэффициент R2 Найджелкерка.
Для оценки влияния различных предикторов, связанных с вероятностью летального исхода за период госпитализации у пациентов с ИМбпST, было разработано дерево классификации методом CHAID. Смертельный исход был включен в качестве зависимой переменной, а все остальные анализируемые параметры (пол, возраст, индекс массы тела, наличие у пациента гипертонической болезни, ишемической болезни сердца и ИМ в анамнезе, стентирования и ангиопластики коронарных артерий в анамнезе, хронической сердечной недостаточности и хронической болезни почек в анамнезе, сахарного диабета, перенесенного инсульта, хронической обструктивной болезни легких и бронхиальной астмы, диагностированной ранее анемии, онкозаболевания, новой коронавирусной инфекции (COVID-19) в текущую госпитализацию; глубина и локализация ИМ, его рецидивирующее течение, стентирование и ангиопластика коронарных артерий в текущую госпитализацию, тромбоз стента, класс по Killip, нарушения ритма и проводимости: фибрилляция желудочков, желудочковая и наджелудочковая тахикардия, желудочковая и наджелудочковая экстрасистолия, впервые возникший эпизод фибрилляции предсердий (ФП), атриовентрикулярные блокады; уровень гемоглобина, лейкоцитов, МВ-фракции креатинфосфокиназы, тропонина, глюкозы, креатинина (в первые сутки госпитализации), показатели липидного спектра; фракция выброса левого желудочка, измеренная по Тейхольцу; степень поражения коронарных артерий, число баллов по шкале GRACE) использовались в качестве независимых переменных. Максимальная глубина дерева составила 4, с минимальными 10 случаями в родительском узле и минимальным 5 случаем в дочернем узле.
Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода, применяли метод анализа ROC (receiver operating characteristic)-кривых. Разделяющее значение количественного признака определяли как значение с наивысшим индексом Юдена.
Для проведения сравнения качества моделей логистической регрессии и дерева классификации оценивали площади под ROC-кривой и доверительные интервалы (ДИ).
Показатели, частота определения которых хотя бы в одной из групп пациентов составляла менее 80%, в модели прогнозирования не включались.
Различия считались значимыми при p<0,05.
Выбор двух методов статистического анализа обусловлен тем, что каждый из них имеет ряд преимуществ и ряд ограничений [9]. В данной работе объединения данных прогнозных моделей не проводилось. Обе модели были сохранены как обучающие для последующих работ, так как в настоящее время начат и продолжается набор пациентов в проспективное исследование аналогичного дизайна и завершается набор пациентов в ретроспективное исследование аналогичного дизайна.
Результаты
Госпитальная летальность среди включенных больных составила 16,8%. Средний возраст выписанных пациентов — 82,3±4,7 года, умерших — 83,0±5,8 года, р=0,288. Среди выписанных пациентов женщин было 70 (70,7%), среди умерших — 14 (70,0%), p=0,95.
Основные клинико-анамнестические характеристики обеих групп пациентов представлены в табл. 1. Анализируемые группы различались только по ИМТ — для выживших этот показатель составлял 27,9 [ 24,3; 30,1] кг/м2, а для умерших — 24,3 [ 23,0; 27,8] кг/м2, p=0,017 и глубине ИМ: не-Q-ИМ встречался у выживших пациентов статистически значимо чаще, чем у умерших — 38,4% vs 10,0%, p=0,010.
Таблица 1. Основные клинико-анамнестические характеристики
в группах выживших и умерших
|
Показатель |
Выжившие (n=99) |
Умершие (n=20) |
p |
|
ИМТ, кг/м2, Mе [ Q1; Q3] |
27,9 [ 24,3; 30,1] |
24,3 [ 23,0; 27,8] |
0,017* |
|
ИБС в анамнезе, n (%) |
84 (84,8) |
18 (90,0) |
0,548 |
|
ИМ в анамнезе, n (%) |
42 (42,4) |
10 (50,0) |
0,533 |
|
ЧКВ анамнезе, n (%) |
12 (12,1) |
2 (10,0) |
0,121 |
|
Гипертоническая болезнь, n (%) |
99 (100,0) |
20 (100,0) |
- |
|
ХСН в анамнезе**, n (%) |
98 (99,0) |
18 (90,0) |
0,073 |
|
ХБП**, n (%) |
22 (22,2) |
4 (20,0) |
0,826 |
|
Сахарный диабет, n (%) |
37 (37,4) |
4 (20,0) |
0,136 |
|
ХОБЛ, n (%) |
5 (5,1) |
0 (0) |
0,588 |
|
Бронхиальная астма, n (%) |
2 (2,0) |
2 (10,0) |
0,131 |
|
Анемия в диагнозе, n (%) |
17 (17,2) |
6 (30,0) |
0,185 |
|
Инсульт в анамнезе, n (%) |
16 (16,2) |
2 (10,0) |
0,483 |
|
Онкологическое заболевание, n (%) |
8 (8,1) |
2 (10,0) |
0,675 |
|
COVID-19 в текущую госпитализацию, n (%) |
10 (10,1) |
0 (0) |
0,209 |
|
Q-ИМ, n (%)# |
61 (61,6) |
18 (90,0) |
0,010* |
|
не-Q-ИМ, n (%)# |
38 (38,4) |
2 (10,0) |
0,010* |
|
Рецидив ИМ, n (%) |
3 (3,0) |
2 (10,0) |
0,196 |
|
Тромбоз стента, n (%) |
1 (1,0) |
1 (5,0) |
0,309 |
|
ЧКВ***, n (%) |
32 (32,3) |
9 (45,0) |
0,277 |
* — указаны статистически значимые различия;
** — статистически значимых различий в частоте стадий получено не было;
# — статистически значимых различий в локализации ИМ получено не было;
*** — статистически значимых различий в частоте ЧКВ ствола левой коронарной артерии, передней межжелудочковой артерии, правой коронарной артерии, огибающей артерии, диагональной ветви, ветви тупого края и задне-боковой ветви получено не было.
ИМТ — индекс массы тела, ИБС — ишемическая болезнь сердца, ИМ — инфаркт миокарда, ХСН — хроническая сердечная недостаточность, ХБП — хроническая болезнь почек, ХОБЛ — хроническая обструктивная болезнь легких, ЧКВ — чрескожное коронарное вмешательство
При анализе данных лабораторных исследований было выявлено, что группы выживших и умерших пациентов по уровням гемоглобина, лейкоцитов, МВ-фракции креатинфосфокиназы, тропонина, креатинина (в первые сутки госпитализации), всех показателей липидного спектра статистически значимо не различались. Не было различий между анализируемыми группами по данным эхокардиографии и коронароангиографии.
Группы умерших и выживших пациентов статистически значимо различались по числу баллов по шкале GRACE: в группе выживших среднее значение составило — 182±28 балла, в группе умерших — 230±28 баллов, p<0,001.
Среди умерших пациентов наблюдалась бóльшая частота осложнений ИМ (табл. 2): острой сердечной недостаточности и впервые возникшей ФП.
Таблица 2. Частота развития осложнений ИМ в группах выживших и умерших
|
Показатель |
Выжившие (n=99) |
Умершие (n=20) |
P |
|
Killip I, n (%) |
48 (48,5) |
3 (15,0) |
0,006 |
|
Killip II, n (%) |
39 (39,4) |
4 (20,0) |
0,13 |
|
Killip III, n (%) |
11 (11,1) |
2 (10,0) |
1,0 |
|
Кардиогенный шок, n (%) |
1 (1,0) |
11 (55,0) |
<0,001 |
|
Отек легких (в т.ч. у лиц с кардиогенным шоком), n (%) |
12 (12,1) |
8 (40,0) |
<0,002 |
|
Фибрилляция желудочков, n (%) |
1 (1,0) |
1 (5,0) |
0,309 |
|
Желудочковая тахикардия, n (%) |
2 (2,1) |
1 (5,0) |
0,426 |
|
Желудочковая экстрасистолия, n (%) |
9 (9,1) |
3 (5,0) |
1,0 |
|
Фибрилляция предсердий (впервые), n (%) |
11 (11,1) |
8 (40,0) |
0,001 |
|
АВ блокады 2-3 степени, n (%) |
3 (3,0) |
3 (15,0) |
0,059 |
|
АВ блокады 2-3 степени, потребовавшие временной электрокардиостимуляции, n (%) |
1 (1,0) |
1 (5,0) |
0,309 |
|
Наджелудочковая тахикардия, n (%) |
1 (1,0) |
0 (0,0) |
1,0 |
|
Наджелудочковая экстрасистолия, n (%) |
5 (5,1) |
1 (5,0) |
1,0 |
|
Блокада левой ножки пучка Гиса, n (%) |
8 (8,1) |
2 (10,0) |
0,675 |
|
Блокада правой ножки пучка Гиса, n (%) |
8 (8,1) |
1 (5,0) |
0,117 |
АВ блокады — атриовентрикулярные блокады
Для прогнозирования смертельного исхода за период госпитализации было разработано дерево классификации, построенное с помощью метода CHAID: было получено 6 терминальных узлов характеристики которых представлены на рис. 1.
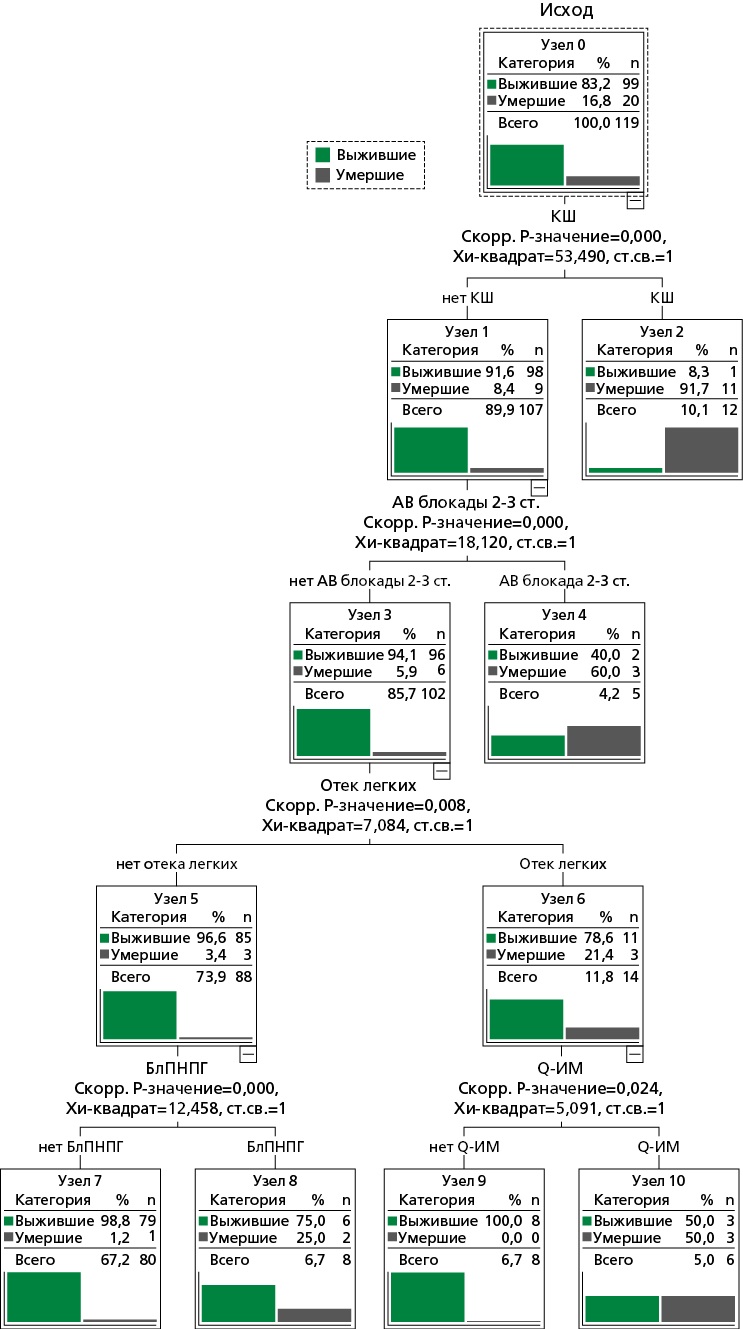
Рисунок 1. Дерево классификации для прогнозирования вероятности смерти в стационаре
КШ — кардиогенный шок, АВ блокады — атриовентрикулярные блокады, БлПНПГ — блокада правой ножки пучка Гиса, ст.св. — степеней свободы
Согласно представленным данным, при отсутствии кардиогенного шока (КШ), атриовентрикулярной (АВ)-блокады 2-3 степени, отека легких и не-Q-ИМ прогнозировалась летальность 0%. При отсутствии КШ, АВ-блокады 2-3 степени, отека легких и блокады правой ножки пучка Гиса (БлПНПГ) на электрокардиограмме (ЭКГ) ожидаемая летальность составляла 1,3%.
Наличие отека легких при Q-ИМ и отсутствие КШ, АВ-блокады 2-3 степени, увеличивало прогнозируемую летальность до 50%, наличие АВ-блокады 2-3 степени при отсутствии КШ — до 60,0%, а при наличии КШ — до 91,7%.
При оценке зависимости вероятности смерти в стационаре у больных с ИМбпST от предсказанной вероятности, полученной на основании построенного дерева классификации, с помощью ROC-анализа была получена следующая кривая (рис. 2). Площадь под ROC-кривой, составила 0,952±0,029 с 95% ДИ 0,895-1,00. Полученная модель была статистически значимой (p<0,001).
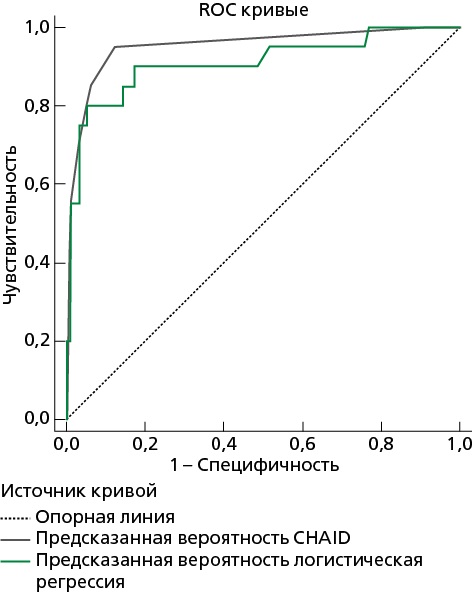
Рисунок 2. ROC-кривая для предсказанной вероятности, полученной на основе дерева классификации, построенного методом CHAID и ROC-кривая для логистической функции P
Пороговое значение для предсказанной вероятности в точке cut-off, которому соответствовало наивысшее значение индекса Юдена, составило 0,131. Госпитальная смерть прогнозировалась при предсказанной вероятности выше данной величины или равном ей. Чувствительность и специфичность модели составили 95,0% и 87,9%, соответственно.
Методом бинарной логистической регрессии была разработана прогностическая модель для определения вероятности смерти в стационаре в зависимости от ИМТ, глубины ИМ, наличия отека легких, КШ, впервые возникшего пароксизма ФП, АВ-блокады 2-3 степени, БлПНПГ и числа баллов по шкале GRACE.
Полученная регрессионная модель является статистически значимой (p<0,001). Исходя из значения коэффициента детерминации Найджелкерка, модель объясняет 60,4% наблюдаемой дисперсии показателя "госпитальная летальность". Характеристики связи предикторов модели с вероятностью смерти в стационаре представлены в табл. 3.
Таблица 3. Характеристики связи предикторов модели
с вероятностью смерти в стационаре
|
Предикторы |
Скорректированное ОШ; 95% ДИ |
p |
|
Кардиогенный шок |
47,550; 4,001-589,162 |
0,002 |
|
ФП впервые |
6,449; 1,389-30,418 |
0,018 |
|
GRACE |
1,026; 1,000-1,053 |
0,046 |
ФП — фибрилляция предсердий, ОШ — отношение шансов, ДИ — доверительный интервал; значение свободного члена = -7,993.
При оценке зависимости вероятности смерти в стационаре от значения логистической функции P с помощью ROC-анализа была получена следующая кривая (см. рис. 2). Площадь под ROC-кривой составила 0,909±0,045 с 95% ДИ 0,821-0,997. Полученная модель была статистически значимой (p<0,001).
Пороговое значение логистической функции P в точке cut-off, которому соответствовало наивысшее значение индекса Юдена, составило 0,116. Госпитальная смерть прогнозировалось при значении логистической функции P выше данной величины или равном ей. Чувствительность и специфичность модели составили 85,0% и 85,9%, соответственно.
На рисунке 2 представлено сравнение площадей под ROC-кривыми вероятности смерти в стационаре, определенными методом CHAID и методом бинарной логистической регрессии.
При этом разность площадей под ROC-кривыми составила 0,043±0,268 с 95% ДИ -0,055-0,141. Полученная разница была статистически незначимой (p=0,387).
Обсуждение
В проведенном исследовании на основании построения модели бинарной логистической регрессии было установлено, что факторами, увеличивающими госпитальную летальность у больных с ИМбпST, служили КШ — отношение шансов (ОШ) 47,55; 4,00-589,16; p=0,002, впервые возникший пароксизм ФП — ОШ 6,45; 1,39-30,42; p=0,018, число баллов по шкале GRACE — на каждое повышение на 1 балл — ОШ 1,03; 1,00-1,05; p=0,046.
Похожие данные были получены и при анализе дерева классификации: у пациентов с КШ у больных с ИМбпST прогнозируемая летальность составляла 91,7%. При заданных параметрах дерева классификации впервые возникший пароксизм ФП и число баллов по шкале GRACE в построенную прогнозную модель не включились. При этом вероятность неблагоприятного исхода на основании построенного дерева классификации была выше, чем в среднем в анализируемой выборке, у лиц без КШ, АВ-блокады 2-3 степени, отека легких, но с БлПНПГ на ЭКГ (25,0%) и у лиц без КШ и АВ-блокады 2-3 степени, но с отеком легких и зубцом Q на ЭКГ (50,0%).
Оба метода прогнозирования госпитальной летальности применимы у больных с ИМбпST. Статистически значимых различий в качестве обеих построенных моделей не получено — разность площадей под ROC-кривыми составила 0,043±0,268 с 95% ДИ -0,055-0,141, p=0,387. Для подтверждения этого факта в настоящее время запланировано и проводится проспективное исследование аналогичного дизайна. Пациенты, включаемые в это исследование, представляют внешнюю валидационную выборку для описываемых моделей. Также завершается набор в ретроспективное исследование аналогичного дизайна, пациенты, включаемые в него, представляют для разработанных моделей тестовую выборку пациентов.
Примечательно, что наряду с такими факторами риска смертельного исхода, как КШ, отек легких, число баллов по шкале GRACE и АВ-блокада 2-3 степени, вероятность неблагоприятного исхода в проведенном исследовании увеличивали наличие БлПНПГ и впервые возникший пароксизм ФП.
Прогностическая роль БлПНПГ при ИМпST была изучена рядом авторов. H. Basit и соавт. установили, что БлПНПГ у пациентов с ИМпST является предиктором неблагоприятного прогноза: у таких пациентов чаще возникает острая сердечная недостаточность и они имеют более высокие показатели госпитальной летальности [10]. Аналогичные данные в отношении внутрибольничной смерти у пациентов с ИМпST и персистирующей БлПНПГ, подвергнутых ЧКВ, были получены и N. Amdouni и соавт. [11]. Связь БлПНПГ с общей смертностью, внутрибольничной смертностью и смертностью в отдаленном периоде у пациентов с острым ИМ была показана и в метаанализе, проведенном L. Xiang и соавт. [12]. Вместе с тем прогностическая роль БлПНПГ при ИМбST, особенно у пациентов старческого возраста, изучена недостаточно.
Одним из частых осложнений острого ИМ является впервые возникшая ФП (частота 6-21%) [13][14], при этом в настоящее время нет однозначных данных о связи ее с краткосрочными исходами (за исключением геморрагических осложнений). В частности, в исследовании G. Lip и соавт. впервые возникшая ФП, развившаяся после проведения ЧКВ у пациентов с ИМпST, не была ассоциирована со смертностью в период госпитализации, а развившаяся на фоне ОКСбпST была независимо ассоциирована со смертностью [14][15]. Возможно, решающее значение в связи ФП с прогнозом имеет время ее возникновения. Но данный факт подтверждается не всеми авторами [16]. Интересна точка зрения Г. С. Галяутдинова и соавт., которые сообщают о том, что "если допустить, что впервые возникшая ФП не оказывает прогностического влияния, то ее можно рассматривать как маркер тяжести течения ОКС и острой сердечно-сосудистой недостаточности" [14].
Ограничения исследования
Исследование носило ретроспективный характер. Показатели, частота определения которых хотя бы в одной из групп пациентов составляла менее 80%, в модели прогнозирования не включались. Отсутствующие данные встречались только у пациентов, которые скончались в первые часы после госпитализации, в связи с чем исключение из моделей прогнозирования показателей с частотой определения менее 80% могло повлиять на полученные результаты. Исследование было ограничено небольшой выборкой пациентов (n=119). Диагнозы ОКСбпST, Q-ИМ и не-Q-ИМ были установлены лечащим врачом во время нахождения пациента в стационаре.
Заключение
В связи с необходимостью более точной оценки риска неблагоприятного исхода, обусловленного ИМбпST, у пациентов в возрасте 75 лет и старше, а также особенностями шкалы GRACE, которая не всегда отражает тяжесть состояния, обусловленную ОКСбпST, в данной категории пациентов, была проведена сравнительная оценка применения двух методов статистического анализа, результаты которых могут быть полезны при разработке новых шкал.
На основании построения бинарной логистической регрессии была разработана прогностическая модель для определения вероятности смерти в стационаре и установлено, что факторами, увеличивающими госпитальную летальность, являлись: КШ (ОШ 47,55; 4,00-589,16; p=0,002), впервые возникший пароксизм ФП (ОШ 6,45; 1,39-30,42; p=0,018), число баллов по шкале GRACE (на каждое повышение на 1 балл — ОШ 1,03; 1,00-1,05; p=0,046).
Для определения вероятности смерти в стационаре при анализе дерева классификации были получены похожие данные: у пациентов с КШ прогнозируемая летальность составляла 91,7%. При отсутствии КШ и наличии АВ-блокады 2-3 степени вероятность летального исхода составляла 60,0%, при отсутствии КШ, АВ-блокады, наличии отека легких и Q-ИМ — 50%. Статистически значимых различий в качестве обеих построенных моделей не получено. Обе они могут быть применимы для определения вероятности смерти в стационаре у пациентов в возрасте 75 лет и старше.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование: Работа выполнена при поддержке Рязанского государственного медицинского университета им. акад. И. П. Павлова.
Funding: The study was performed with the support of I. P. Pavlov Ryazan State Medical University.
Список литературы
1. Российское кардиологическое общество. Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы. Клинические рекомендации 2020. Российский Кардиологический Журнал. 2020;25(11):4103. DOI:10.15829/29/1560-4071-2020-4103.
2. Барбараш О. Л., Дупляков Д. В., Затейщиков Д. А. и др. Острый коронарный синдром без подъема сегмента ST электрокардиограммы. Клинические рекомендации 2020. Российский Кардиологический Журнал. 2021;26(4):4449. DOI:10.15829/1560-4071-2021-4449.
3. Олейник Б. А., Стародубов В. И., Евдаков В. А. и др. Ассоциации показателей летальности и доступности скорой и специализированной, в том числе высокотехнологичной, медицинской помощи при остром коронарном синдроме в Российской Федерации. Российский кардиологический журнал. 2023;28(9):5514. DOI:10.15829/1560-4071-2023-5514.
4. Бойцов С. А., Алекян Б. Г., Шахнович Р. М., Ганюков В. И. Что меняется в лечении острого коронарного синдрома в Российской Федерации? Рациональная Фармакотерапия в Кардиологии. 2022;18(6):703-9. DOI:10.20996/1819-6446-2022-12-14.
5. Granger CB, Goldberg RJ, Dabbous O, et al; Global Registry of Acute Coronary Events Investigators. Predictors of hospital mortality in the global registry of acute coronary events. Arch Intern Med. 2003;163(19):2345-53. DOI:10.1001/archinte.163.19.2345.
6. Anand A, Cudmore S, Robertson S, et al. Frailty assessment and risk prediction by GRACE score in older patients with acute myocardial infarction. BMC Geriatr. 2020;20(1):102. DOI:10.1186/s12877-020-1500-9.
7. de Hond AAH, Leeuwenberg AM, Hooft L, et al. Guidelines and quality criteria for artificial intelligence-based prediction models in healthcare: a scoping review. NPJ Digit Med. 2022;5(1):2. DOI:10.1038/s41746-021-00549-7.
8. Лучинин А. С. Прогностические модели в медицине. Клиническая онкогематология. 2023;16(1):27-36. DOI:10.21320/2500-2139-2023-16-1-27-36.
9. Груздев А. В. Прогнозное моделирование в IBM SPSS Statistics и R: Метод деревьев решений. М.: ДМК Пресс; 2016.
10. Basit H, Kahn A, Zaidi S, et al. A Case of ST-Elevation Myocardial Infarction With Right Bundle Branch Block, an Ominous Sign of Critical Coronary Occlusion. Cureus. 2022;14(1):e21216. DOI:10.7759/cureus.21216.
11. Amdouni N, Chamtouri I, Ben Abdallah A, et al. Incidence and in-hospital outcomes of right bundle branch block in patients with ST elevation myocardial infarction undergoing primary angioplasty. Arch Cardiovasc Dis Suppl/ 2022;14(1):14. DOI:10.1016/j.acvdsp.2021.09.026.
12. Xiang L, Zhong A, You T, et al. Prognostic Significance of Right Bundle Branch Block for Patients with Acute Myocardial Infarction: A Systematic Review and Meta-Analysis. Med Sci Monit. 2016;22:998-1004. DOI:10.12659/msm.895687.
13. Schmitt J, Duray G, Gersh BJ, Hohnloser SH. Atrial fibrillation in acute myocardial infarction: a systematic review of the incidence, clinical features and prognostic implications. Eur Heart J. 2009;30(9):1038-45. DOI:10.1093/eurheartj/ehn579.
14. Галяутдинов Г. С., Горелкин И. В., Ибрагимова К. Р., Садриев Р. Р. Впервые возникшая фибрилляция предсердий в условиях острого коронарного синдрома. Актуальные вопросы. Рациональная Фармакотерапия в Кардиологии. 2018;14(3):451-7. DOI:10.20996/1819-6446-2018-14-3-451-457.
15. Lip GY, Nieuwlaat R, Pisters R, et al. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the euro heart survey on atrial fibrillation. Chest. 2010;137(2):263-72. DOI:10.1378/chest.09-1584.
16. Consuegra-Sánchez L, Melgarejo-Moreno A, Galcerá-Tomás J, et al. Short- and long-term prognosis of previous and new-onset atrial fibrillation in ST-segment elevation acute myocardial infarction. Rev Esp Cardiol (Engl Ed). 2015;68(1):31-8. DOI:10.1016/j.rec.2014.03.017.
Об авторах
К. Г. ПереверзеваРоссия
Переверзева Кристина Геннадьевна.
Рязань
С. С. Якушин
Россия
Якушин Сергей Степанович.
Рязань
Н. Н. Перегудова
Россия
Перегудова Наталья Николаевна.
Рязань
М. В. Мишутина
Россия
Мишутина Мария Владимировна.
Рязань
Дополнительные файлы
Рецензия
Для цитирования:
Переверзева К.Г., Якушин С.С., Перегудова Н.Н., Мишутина М.В. Сравнение качества моделей логистической регрессии и дерева классификации при прогнозировании госпитальной летальности у пациентов старческого возраста с острым инфарктом миокарда без подъема сегмента ST электрокардиограммы. Рациональная Фармакотерапия в Кардиологии. 2024;20(4):418-425. https://doi.org/10.20996/1819-6446-2024-3029. EDN: QOHDFE
For citation:
Pereverzeva K.G., Yakushin S.S., Peregudova N.N., Mishutina M.V. Comparison of the quality of logistic regression models and a classification tree in predicting hospital mortality in elderly patients with non-ST-elevation myocardial infarction. Rational Pharmacotherapy in Cardiology. 2024;20(4):418-425. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3029. EDN: QOHDFE

















































