Перейти к:
Пристеночный инфекционный эндокардит у пациентки с тетрадой Фалло: клинический случай
https://doi.org/10.20996/1819-6446-2024-3047
EDN: CSCSKG
Аннотация
В статье приводится клинический случай развития пристеночного инфекционного эндокардита (ИЭ) с формированием вегетаций в области верхней трети межжелудочковой перегородки у пациентки А. 51 года с некорригированной тетрадой Фалло. Пациентка поступила с жалобами на учащенное сердцебиение, перебои в работе сердца, отёки стоп, голеней до верхней трети, одышку в покое, общую слабость, повышение температуры до 39 оС, потливость, головную боль. При проведении трансторакальной эхокардиографии (ЭхоКГ) на верхней трети межжелудочковой перегородки (МЖП) со стороны правого желудочка (ПЖ) визуализируется дополнительное эхо-позитивное линейное подвижное длиной 0,9 см образование, подобное на хордах трикуспидального клапана (ТК). Таким образом, на основании выявления 1 большого критерия Duke (визуализирующий критерий — наличие пристеночной вегетации) и 3 малых критериев (предрасполагающие факторы — ВПС "синего типа"; лихорадка >38 оС; результаты культурального исследования крови, не удовлетворяющие большому критерию), данных лабораторно-инструментальной диагностики и анамнеза был установлен диагноз: "Вторичный инфекционный эндокардит с поражением верхней трети МЖП". С учетом чувствительности идентифицированной микрофлоры назначены полимиксин и моксифлоксацин. На фоне терапии появились сухой кашель, сухие хрипы в проекции средней доли справа. Для исключения септической эмбологенной пневмонии проведена компьютерная томография органов грудной клетки, на которой очаговых/инфильтративных изменений выявлено не было. Однако, был визуализирован шунт, соединяющий брахиоцефальный ствол с правой легочной артерией, что, возможно, объясняет причину компенсации гипоксемии, возникшей из-за патологической гемодинамики в результате высокого легочного стеноза. Учитывая неполную эффективность терапии, а также чувствительность выделенных инфекционных агентов, было принято решение о смене антибактериальной терапии на ванкомицин в комбинации с имипенемом. Консервативные методы лечения позволили не только компенсировать имеющиеся клинические симптомы, но и достичь референсных значений лабораторных показателей, несмотря на невозможность проведения оперативного вмешательства.
Ключевые слова
Для цитирования:
Котляр И.Е., Фильчкова А.Е., Ененков Н.В., Сидашова А.С., Кондратьев Д.О., Добрынина Н.В., Васюшкина К.И., Горохова Т.А. Пристеночный инфекционный эндокардит у пациентки с тетрадой Фалло: клинический случай. Рациональная Фармакотерапия в Кардиологии. 2024;20(4):485-492. https://doi.org/10.20996/1819-6446-2024-3047. EDN: CSCSKG
For citation:
Kotlyar I.E., Filchkova A.E., Enenkov N.V., Sidashova A.S., Kondratyev D.O., Dobrynina N.V., Vasyushkina K.I., Gorokhova T.A. Mural infectious endocarditis in a patient with tetralogy of Fallot: a clinical case. Rational Pharmacotherapy in Cardiology. 2024;20(4):485-492. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3047. EDN: CSCSKG
Введение
Пристеночный инфекционный эндокардит (ПИЭ) является редкой формой с вовлечением неклапанного эндокарда [1]. Диагностика ПИЭ стала возможна благодаря совершенствованию методов визуализации сердца, чем, возможно, можно объяснить рост заболеваемости в последние годы. По данным испанского регистра GAMES (Grupo de Apoyo al Manejo de la Endocarditis Infectiosa en España), частота ПИЭ составляет 0,7% случаев инфекционного эндокардита (ИЭ) [2].
Данная форма ИЭ наиболее часто наблюдается у пациентов среднего возраста, преимущественно женского пола [3]. Описаны локализации ПИЭ в левом (ЛЖ) и правом желудочках (ПЖ) [4], а также левом предсердии (ЛП) [3]. Основной причиной ПИЭ у пациентов являются недавние медицинские вмешательства в анамнезе (использование венозного катетера и др.), а также ослабленный иммунитет [2]. Считается, что инфицирование эндокарда и клапанных структур происходит во время бактериемии, в том числе транзиторной, например, во время лечения по поводу кариеса зуба [5].
Кроме того, врожденные пороки "синего типа", в том числе некорригированная тетрада Фалло (ТФ), относятся к заболеваниям сердца с наиболее высоким риском развития ИЭ [6]. Частота ИЭ у пациентов с ТФ, перенесших хирургическое вмешательство, составляет около 18%, тогда как у пациентов с некоррегированной ТФ около 4% [7].
ТФ, впервые описанная в 1888 г. Этьеном-Луи Артуром Фалло, характеризуется наличием четырех анатомических аномалий сердца: инфундибулярный стеноз ПЖ, большой подаортальный дефект межжелудочковой перегородки, смещение аорты к ПЖ (декстрапозиция менее 50%), гипертрофия ПЖ [8]. Данный комбинированный врожденный порок сердца (ВПС) является наиболее распространенным пороков "синего типа", частота его встречаемости составляет 8-13% среди пациентов [9]. Эпидемиологические исследования и протоколы патологоанатомического вскрытия показали, что только 2% всех пациентов с ТФ доживают до четвертого десятилетия жизни [9].
Согласно клиническим рекомендациям, пациенты с пороками "синего типа", в том числе с ТФ, нуждаются в антибиотикопрофилактике ИЭ после процедур высокого риска: стоматологические (операции в области дёсен, периапикальной области зуба или прободение слизистой оболочки рта), кардиологические (имплантация протезов клапанов, электрокардиостимулятора), а также случаи, при которых инвазивные процедуры выполняются на фоне инфекционного процесса [5].
В настоящей статье представлен клинический случай развития ПИЭ у 51-летней пациентки с неоперированной ТФ, а также результат достижения положительного клинического эффекта при применении исключительно консервативной терапии.
Описание клинического случая
Пациентка А., 51 года, 09.02.2023 поступила в областной клинический кардиологический диспансер г. Рязань с жалобами на учащенное сердцебиение, перебои в работе сердца, отёки стоп, голеней до верхней трети, одышку в покое, общую слабость, повышение температуры до 39 °С, потливость, головную боль.
Из анамнеза известно, что в возрасте трех лет был диагностирован ВПС — ТФ, по поводу чего оперирована не была. Последние 15 лет отмечала пастозность голеней, регулярно принимала спиронолактон 25 мг/сут. с удовлетворительной переносимостью. В феврале 2022 г. перенесла новую коронавирусную инфекцию (COVID-19). Вследствие высоких показателей С-реактивного белка (СРБ, до 120 мг/л) длительное время (около 3 месяцев) получала метилпреднизолон в дозе до 24 мг/сут., в связи с развившимся постковидным синдромом. В марте 2022 г. впервые был выявлен пароксизм фибрилляции предсердий, в связи с чем была госпитализирована в кардиологический стационар и в дальнейшем назначена терапия: амиодарон 200 мг/сут., бисопролол 5 мг/сут., спиронолактон 50 мг/сут., апиксабан 5 мг 2 раза в сут. В декабре 2022 года пациентка проходила лечение в стоматологической клинике по поводу кариеса, профилактическая антибактериальная терапия не проводилась.
Настоящее ухудшение с начала января 2023 г., когда пациентка перенесла острую респираторную вирусную инфекцию: появились боль в горле, заложенность носа, ринорея, (экспресс-тест на антиген SARS-CoV-2 отрицательный). Поскольку в течение 6 дней отмечала повышение температуры до 38,5-39,5 °С, амбулаторно были назначены левофлоксацин 500 мг/сут. и, вследствие высокой концентрации СРБ (130 мг/л) — метилпреднизолон 8 мг/сут. Терапия проводилась 10 дней и привела к стойкому клиническому улучшению и нормализации температуры тела, в связи с чем антибактериальная терапия была отменена и начато снижение дозы метилпреднизолона по стандартной схеме. Однако через несколько дней повторно резко повысилась температура тела до 39 °С с выраженным ознобом и потливостью, также появились одышка, общая слабость, отёки голеней. Для исключения пневмонии выполнена нативная компьютерная томография органов грудной клетки (23.01.2023): очаговых и инфильтративных изменений не выявлено, отмечена картина стеноза устья легочного ствола, признаки легочной гипертензии.
В связи с наличием ВПС, а также нарастанием клиники сердечной недостаточности (СН) на фоне перенесенного острой респираторной вирусной инфекции пациентка госпитализирована в кардиологический диспансер с диагнозом: постковидный синдром, дифференциальный диагноз с неревматическим миокардитом, перикардитом, ИЭ.
При поступлении: общее состояние пациентки относительно удовлетворительное, температура тела 38,5 °С, кожные покровы бледные, акроцианоз. В легких дыхание везикулярное, хрипов нет. Частота дыхательных движений 20 в минуту. Тоны сердца ослаблены, ритм правильный, акцент 2 тона над легочной артерией, систолический шум в точках выслушивания клапана легочной артерии, трикуспидального и митрального клапанов. Артериальное давление — 120/70 мм рт.ст., частота сердечных сокращений (ЧСС) 76 уд/мин. Живот мягкий, безболезненный. Печень — по краю реберной дуги. Селезенка не пальпируется. Отёки стоп, голеней до верхней трети.
На ЭКГ на момент поступления (рис. 1) обращают на себя внимание признаки гипертрофии правых и левых отделов сердца с изменениями в миокарде.

Рисунок 1. Электрокардиография на момент поступления. Синусовый ритм. Умеренное отклонение ЭОС вправо. Гипертрофия правого желудочка с изменениями в миокарде. Признаки увеличения ЛП, ПП.
Общий анализ мочи без патологических изменений. При поступлении в рамках дифференциальной диагностики взят анализ крови для бактериологического исследования.
На эхокардиографии (ЭхоКГ) от 09.02.2023 визуализирован ВПС: тетрада Фалло. Снижение сократимости миокарда ЛЖ (фракция выброса 48% по Teicholz). Дилатация полости ЛП (5,0 см), ПЖ (3,5 см), ПП (4,3×6,5 см). Гипертрофия миокарда ПЖ. Аневризма восходящего отдела аорты. Недостаточность аортального клапана (регургитация 2 ст.), трикуспидального клапана (ТК, регургитация 2 ст.). Стеноз легочной артерии (систолический градиент давления на ТК — 88 мм рт.ст.). Нарушение диастолической функции ЛЖ. Небольшое количество жидкости в полости перикарда. Данных за ИЭ получено не было.
При проведении Холтеровского мониторирования ЭКГ от 14.02.2023 (на фоне приема бисопролола 5 мг/сут.) в течение периода исследования наблюдался синусовый ритм со средней ЧСС 75 уд/мин (от 63 до 103 уд/мин). Зарегистрирована редкая желудочковая экстрасистолия (одиночные желудочковые экстраситолы — 179), редкая наджелудочковая экстрасистолия (одиночные наджелудочковые — 329, парная наджелудочковая — 16, групповая — 61), паузы после ускоренного предсердного ритма (63 эпизода) общей продолжительностью 2 сек. Значимые изменения сегмента ST-T не зарегистрированы при недостижении субмаксимальной ЧСС. Средний корригированный интервал QT за сутки 441 мсек.
С учётом полученных данных установлен диагноз: "ВПС: Тетрада Фалло. Пароксизмальная форма фибрилляции предсердий (последний пароксизм от 2022 г.) CHA2DS2VASC — 2 балла, HAS-BLED — 0 баллов. ХСН 2А, ФК 3. Высокая легочная гипертензия, систолический градиент давления на ТК 88 мм рт.ст.). Постковидный синдром (по клиническим данным)".
Назначена терапия: спиронолактон 50 мг/сут., торасемид 3,75 мг/сут., бисопролол 5 мг/сути, амиодарон 200 мг/сут., ривароксабан 20 мг/сут., метилпреднизолон 8 мг/сут., пантопразол 40 мг/сут.
На фоне лечения в течение 6 дней отмечалась заметная положительная динамика: нормализация температуры, уменьшение одышки, отёков. На 17.02.2023 планировалась выписка пациентки.
15.02.2023 были получены результаты бактериологического анализа крови, в котором была обнаружена микст-флора: Klebsiella pneumoniae, Acinetobacter spp., Streptococcus spp. (табл. 1). 17.02.2023 коллегиально была проведена повторная трансторакальная ЭхоКГ: на верхней трети межжелудочковой перегородки (МЖП) со стороны ПЖ визуализируется дополнительное эхо-позитивное линейное подвижное длиной 0,9 см образование, подобное на хордах ТК (рис. 2).
Таблица 1. Результаты бактериологического исследования
|
Возбудитель/Чувствительность |
Klebsiella pneumoniae (09.02.2023 и 15.02.2023) |
Acinetobacter spp. (09.02.2023) |
Streptococcus spp. (09.02.2023 и 16.02.2023) |
|
Полимиксин |
+ |
||
|
Ампициллин/сульбактам |
+ |
||
|
Цефоперазон/сульбактам |
+ |
||
|
Амоксициллин/клавулановая кислота |
+ |
||
|
Ломефлоксацин |
+ |
||
|
Ципрофлоксацин |
+ |
||
|
Ванкомицин |
+ |
||
|
Цефтриаксон |
+ |
||
|
Линкомицин |
+ |
||
|
Амикацин |
+ |
||
|
Цефепим |
+ |
||
|
Оксациллин |
+ |
"+" — чувствительность возбудителя к антибиотику
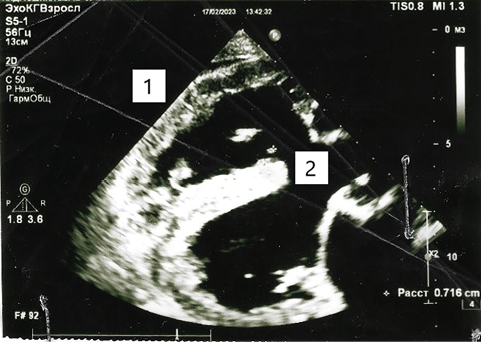
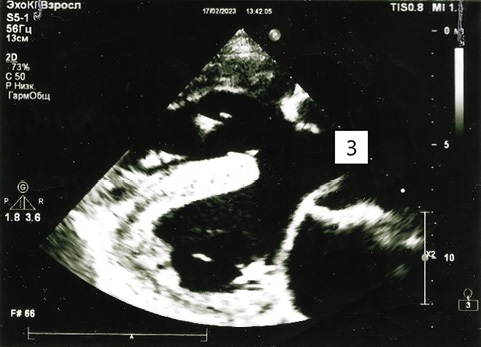
Рисунок 2. Эхокардиография. Вегетации на верхней трети межжелудочковой перегородки.
1 — гипертрофия правого желудочка; 2 — дефект межжелудочковой перегородки; 3 — декстрапозиция аорты.
Несмотря на получение нескольких возбудителей в посеве крови, его результаты можно рассматривать лишь как малый диагностический критерий Duke ИЭ (результаты культурального исследования крови, не удовлетворяющие большому критерию), поскольку единственным типичным возбудителем ИЭ в описанном случае является Acinetobacter spp., выделенный однократно, а Streptococcus spp. — не был идентифицирован как типичный (S. viridans, S. gallolyticus (S. bovis), а Klebsiella pneumoniae не описана как типичный возбудитель ИЭ [5].
Таким образом, на основании выявления 1 большого критерия Duke (визуализирующий критерий — наличие пристеночной вегетации) и 3 малых критериев (предрасполагающие факторы — ВПС "синего типа"; лихорадка >38 °С; результаты культурального исследования крови, не удовлетворяющие большому критерию), данных лабораторно-инструментальной диагностики и анамнеза был установлен диагноз:
Основной: Вторичный инфекционный эндокардит с поражением верхней трети МЖП со стороны ПЖ, хорд ТК. ВПС:Тетрада Фалло. Дилатация ЛП, ПП, ПЖ. Расширение корня аорты. Недостаточность аортального клапана (регургитация 2 ст.), ТК (регургитация 2 ст.).
Осложнения: ХСН IIА с промежуточной ФВ (48%), ФК 3. Высокая легочная гипертензия (систолический градиент давления на ТК = 88 мм рт.ст.). Вторичный компенсаторный эритроцитоз. Редкая политопная экстрасистолия, эпизоды ускоренного ритма (по ХМ-ЭКГ от 14.02.2023). Пароксизмальная форма фибрилляции предсердий (единственный эпизод от 2022 г.). CHA2DS2VASC — 2 балла, HAS-BLED — 0 баллов.
С учетом чувствительности идентифицированной микрофлоры (особенно — Klebsiella pneumoniae как самого резистентного возбудителя) пациентке с 17.02.2023 назначены внутривенно: полимиксин 50 мг/сут., моксифлоксацин 400 мг/сут. На фоне терапии появились настойчивый сухой кашель, сухие хрипы в проекции средней доли справа. Для исключения септической эмбологенной пневмонии проведена повторная компьютерная томография органов грудной клетки без контрастирования (16.02.2023), на которой очаговых/инфильтративных изменений выявлено не было, однако был визуализирован шунт, соединяющий брахиоцефальный ствол с правой легочной артерией, что, возможно, объясняет причину компенсации гипоксемии, возникшей из-за патологической гемодинамики в результате высокого легочного стеноза. Больная консультирована пульмонологом, диагноз: хронический бронхит, вне обострения — назначен тиотропия бромид 2,5 мкг по 1 вдоху 1 раз в день 14 дней.
На фоне проводимой медикаментозной терапии отмечалась положительная динамика (рис. 3): температура тела нормализовалась, заметно уменьшились отеки нижних конечностей, одышка, но сохранялись настойчивый приступообразный кашель, повышенные уровни СРБ (>48 мг/л), скорости оседания эритроцитов (53 мм/ч) и лейкоцитоз (10,31х109/л) (табл. 2, результаты от 30.03.2023).
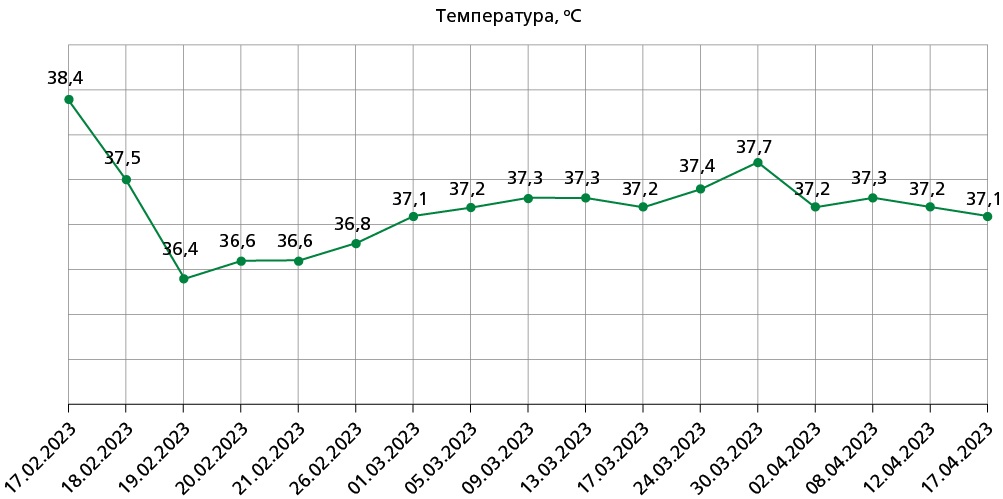
Рисунок 3. Температурный лист
Таблица 2. Результаты лабораторных исследований в динамике
|
09.02.2023 |
13.02.2023 |
30.03.2023 |
17.04.2023 |
|
|
Эритроциты, *1012/л |
5,41 |
5,94 |
4,95 |
4,78 |
|
Hb, г/л |
158 |
173 |
141 |
134 |
|
Ht, % |
51,5 |
56,7 |
46,2 |
44,0 |
|
Лейкоциты, 109/л |
11,33 |
7,16 |
10,31 |
9,84 |
|
СОЭ, мм/ч |
41 |
40 |
50 |
53 |
|
ОХС, ммоль/л |
5,57 |
|||
|
Креатинин, мкмоль/л |
68,7 |
86,27 |
93,37 |
|
|
СКФ (CKD-EPI) мл/мин/1,73м2 |
105 |
67,0 |
61,2 |
|
|
СРБ, мг/мл |
229 |
>48 |
>48 |
138,97 |
Нb — гемоглобин, Ht — гематокрит, СОЭ — скорость оседания эритроцитов, ОХС — общий холестерин, СКФ — скорость клубочковой фильтрации, СРБ — С-реактивный белок
Учитывая неполную эффективность терапии, а также чувствительность выделенных инфекционных агентов, 29.03.2023 было принято решение о смене антибактериальной терапии на ванкомицин 925 мг/сут. в комбинации с имипенемом/циластатином 250 мг 3 раза в день с последующим повышением дозировки до 500 мг 3 раза в день. Однако клиническая и лабораторная картина существенно не изменились (см. табл. 2). В связи с чем принято решение о консультации с выездной бригадой кардиохирургов ФГБУ "НМИЦ ССХ им. А. Н. Бакулева" Минздрава России, по результатам которой оперативное вмешательство не было показано и рекомендовано продолжение консервативной терапии.
17.04.2023 пациентка была выписана по собственному желанию. На момент выписки сохранялись субфебрилитет и лабораторные признаки воспалительного процесса. В день выписки выполнена ЭхоКГ: на правожелудочковой поверхности МЖП визуализируются образования нитевидной формы 0,9 см.
Даны рекомендации по лечению: амоксициллин/клавуланат 1000 мг 2 раза/сут. в течении 14 дней, спиронолактон 50 мг/сутки, торасемид 7,5 мг/сут., бисопролол 2,5 мг/сутки, ривароксабан 20 мг/сут., амиодарон 200 мг/сут. Сухой приступообразный кашель в данной ситуации расценен как проявление легочной гипертензии — к терапии добавлен силденафил 20 мг 3 раза в день.
На фоне получаемой терапии через 1 месяц отмечалось заметное клиническое улучшение: нормализовалась температура тела, уменьшились одышка, кашель, отеки. Через 6 месяцев произошла нормализация лабораторных показателей: СРБ 1,03 мг/л, скорость оседания эритроцитов — 28 мм/ч, гемоглобин — 168 г/л; ЭхоКГ без существенной динамики, за исключением снижения систолического градиента давления на ТК — 70 мм рт.ст.
Обсуждение
"Долголетие" пациентки с некорригированной ТФ, возможно, объясняется уникальным сочетанием ВПС и шунта, соединяющего брахиоцефальный ствол с правой легочной артерией, что служит причиной компенсации гипоксемии, возникшей из-за патологической гемодинамики в результате высокого легочного стеноза. Подобный клинический случай был представлен в работе P. Sousa и соавт., в которой авторы к возможной причине компенсации некорригированной ТФ у 72-летней пациентки относят хорошо развитый ЛЖ и компенсированный подпульмональный стеноз [10]. Кроме того, к механизмам длительного выживания при некорригированной ТФ относят формирование системно-легочных коллатералей, обеспечивающих кровоток справа налево [11], наличие открытого артериального протока [12] или системная гипертензия, обеспечивающая баланс давления между желудочками [13].
Предрасполагающие процедуры, такие как лечение кариеса и удаление зуба, даже в условиях антибиотикопрофилактики, могут привести к транзиторной бактериемии в результате повреждения слизистой оболочки и развитию ИЭ, особенно у пациентов с врожденными пороками сердца [5]. В работе А. А. Обрезан и соавт. представлен клинический случай развития ИЭ ТК, ассоциированный с микст-флорой. Источником полирезистентной микрофлоры, аналогично представленному нами случаю, послужило заболевание зубов, а именно обострение хронического периодонтита [14]. Кроме того, на фоне перенесенной COVID-19 в 2022 г. пациентка длительное время принимала глюкокортикоиды, которые за счет иммунносупресивного эффекта могли стать одним из факторов транзиторной бактериемии.
Дифференциальная диагностика ИЭ и COVID-19 в эпидемический/пандемический периоды представляет большую сложность, поскольку врачи склонны считать признаки инфекционного процесса у пациента проявлением основного эпидемиологического заболевания, что приводит к несвоевременному направлению пациента на верифицирующие методы обследования. Е. О. Котова и соавт. отмечает, что пациентам с ИЭ в период пандемии COVID-19 гораздо реже проводилась ЭхоКГ и сроки диагностики ИЭ у них увеличивались [15]. Согласно данным B. Cosyns и соавт., чреспищеводная (ЧП) ЭхоКГ среди пациентов с ИЭ в период пандемии COVID-19 выполнялась на 49% реже по сравнению с 2019 г., что может являться причиной недостаточной диагностики ИЭ [16]. Таким образом, в период пандемии или эпидемии любой инфекции не следует терять настороженность в отношении ИЭ, в особенности у пациентов высокого риска. Кроме того, принимать решение о назначении глюкокортикоидов следует после исключения ИЭ и/или диагностики COVID-19 с помощью антител, что не было сделано в описываемой клинической ситуации.
Вызывает значительные трудности, особенно на ранних стадиях, и визуализация вегетаций при ПИЭ с помощью трансторакальной ЭхоКГ. При этом, если у пациента с подозрением на ИЭ на основании клинических проявлений при проведении трансторакальной ЭхоКГ не обнаружено явных вегетаций, следует немедленно выполнить ЧП ЭхоКГ [2][13]. В представленном клиническом случае ЧП ЭхоКГ не выполнялась, что привело к замедлению постановки диагноза и несвоевременному назначению терапии.
В связи с отказом пациентки от дальнейшего пребывания в стационаре, была назначена пероральная антибиотикотерапия. Однако с позиций клинических рекомендаций, имелись критерии для перехода на пероральную антибактериальную терапию: продолжительность внутривенной антибактериальной терапии более 10 дней; лихорадка <38,8 °С более 2 дней; СРБ <25% от максимального и лейкоциты <15×109/л; отсутствие признаков абсцедирования, нарастания клапанной регургитации, перикардита, миокардита по данным трансторакальной ЭхоКГ и ЧП ЭхоКГ [5].
Показания к хирургическому вмешательству при ПИЭ совпадают с ИЭ клапанных структур и включают: тяжелую СН, септический шок, рецидивирующие эмболы, тяжелую клапанную дисфункцию, внутрисердечные осложнения (абсцесс), инфекцию протезированного клапана и большие подвижные вегетации или стойкую бактериемию, несмотря на адекватную антибактериальную терапию [2][3]. В представленном клиническом случае имелась прогрессирующая СН и неполная эффективность антибактериальной терапии, что заставило задуматься об оперативном вмешательстве. Однако, учитывая доброкачественное течение ВПС и высокие риски хирургического вмешательства, было принято решение о продолжении консервативного медикаментозного лечения, которое оказалось эффективным.
Заключение
Представленный клинический случай интересен прежде всего уникальным сочетанием нескольких достаточно редко встречающихся клинических ситуаций (достижение больной с неоперированной ТФ возраста 40 лет и более, появление и реализация этиологических, патогенетических факторов ИЭ, проявившихся в пристеночной форме), возможным в реальной клинической практике. Кроме того, данный случай продемонстрировал недостатки ведения подобных пациентов, показав необходимость преодолевать клиническую "стереотипность мышления", свойственную многим практикующим врачам.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Пациенткой было подписано добровольное информированное согласие на публикацию.
Список литературы
1. Malas W, Ruge M, Quito MR, et al. Left atrial mural endocarditis in the absence of significant structural heart disease. Am Heart J Plus. 2021;2:100009. DOI:10.1016/j.ahjo.2021.100009.
2. Gutiérrez-Villanueva A, Muñoz P, Delgado-Montero A, et al; Spanish Collaboration on Endocarditis — Grupo de Apoyo al Manejo de la Endocarditis infecciosa en España (GAMES). Mural Endocarditis: The GAMES Registry Series and Review of the Literature. Infect Dis Ther. 2021;10(4):2749-64. DOI:10.1007/s40121-021-00490-y.
3. Hosokawa S, Okayama H, Hiasa G, et al. Isolated left atrial infective mural endocarditis. Intern Med. 2018;57(7):957-60. DOI:10.2169/internalmedicine.9559-17.
4. Tahara M, Nagai T, Takase Y, et al. Primary mural endocarditis without valvular involvement. J Ultrasound Med. 2017:36(3):659-64. DOI:10.7863/ultra.16.03049.
5. Демин А. А., Кобалава Ж. Д., Скопин И. И. Инфекционный эндокардит и инфекция внутрисердечных устройств. Клинические рекомендации 2021. Российский кардиологический журнал. 2022;27(10):5233. DOI:10.15829/1560-4071-2022-5233.
6. Havers-Borgersen E, Butt JH, Smerup M, et al. Incidence of Infective Endocarditis Among Patients With Tetralogy of Fallot. J Am Heart Assoc. 2021;16;10(22):e022445. DOI:10.1161/JAHA.121.022445.
7. Di Flippo S, Delahaye F, Semiond B, et al. Current patterns of infective endocarditis in congenital heart disease. Heart. 2006;92(10):1490-1495. DOI:10.1136/hrt.2005.085332.
8. Apitz C, Webb GD, Redington AN. Tetralogy of Fallot. Lancet. 2009;374(9699):1462-71. DOI:10.1016/S0140-6736(09)60657-7.
9. Wen Y, Liu X, Zhao Y, et al. Quadruple valve replacement for patient with infective endocarditis 16 years after Fallot’s Tetralogy Repair procedure: A case report. Heliyon. 2023;10(1):e23351. DOI:10.1016/j.heliyon.2023.e23351.
10. Sousa P, Santos W, Marques N, et al. A 72-year-old woman with an uncorrected tetralogy of Fallot presenting with possible pulmonary endocarditis: a case report. J Med Case Rep. 2013;7:150. DOI:10.1186/1752-1947-7-150.
11. Liberthson RR, Miller SW, Drew F, et al. Congenital extracardiac shunts with tetralogy of Fallot. Cardiovasc Intervent Radiol. 1981;4(2):131-5. DOI:10.1007/BF02552393.
12. Sokol I, Vincelj J, Kirin M. Echocardiographic features of adult tetralogy of Fallot with natural palliative correction by patent ductus arteriosus. Croat Med J. 2003;44(2):234-8.
13. Chandrasekaran B, Wilde P, McCrea WA. Tetralogy of Fallot in a 78-year-old man. N Engl J Med. 2007;357(11):1160–1. DOI:10.1056/NEJMc063349.
14. Обрезан А. А., Кучерявенко Ю. М., Маликов К. Н., Долгушев Д. А. Инфекционный эндокардит трикуспидального клапана, ассоциированный с микст-флорой, осложненный септической пневмонией, на фоне обострения перекрестного синдрома и декомпенсации сахарного диабета. Российский кардиологический журнал. 2020;25(11):4080. DOI:10.15829/1560-4071-2020-4080.
15. Котова Е. О., Писарюк А. С., Кобалава Ж. Д. и др. Инфекционный эндокардит и COVID-19: анализ влияния инфицирования SARS-CoV-2 на особенности диагностики, течения, прогноз. Российский кардиологический журнал. 2023;28(1):5229. DOI:10.15829/1560-4071-2023-5229.
16. Cosyns B, Motoc A, Arregle F, Habib G. A Plea Not to Forget Infective Endocarditis in COVID-19 Era. JACC Cardiovasc Imaging. 2020;13(11):2470-1. DOI:10.1016/j.jcmg.2020.07.027.
Об авторах
И. Е. КотлярРязанский государственный медицинский университет им. академика И.П. Павлова
Россия
Котляр Илья Евгеньевич - студент 6 курса.
Рязань
А. Е. Фильчкова
Россия
Фильчкова Анастасия Евгеньевна.
Рязань
Н. В. Ененков
Россия
Ененков Никита Васильевич.
Рязань
А. С. Сидашова
Россия
Сидашова Анна Сергеевна.
Рязань
Д. О. Кондратьев
Россия
Кондратьев Данила Олегович.
Рязань
Н. В. Добрынина
Россия
Добрынина Наталья Валентиновна.
Рязань
К. И. Васюшкина
Россия
Васюшкина Кристина Игоревна.
Рязань
Т. А. Горохова
Россия
Горохова Татьяна Александровна.
Рязань
Дополнительные файлы
Рецензия
Для цитирования:
Котляр И.Е., Фильчкова А.Е., Ененков Н.В., Сидашова А.С., Кондратьев Д.О., Добрынина Н.В., Васюшкина К.И., Горохова Т.А. Пристеночный инфекционный эндокардит у пациентки с тетрадой Фалло: клинический случай. Рациональная Фармакотерапия в Кардиологии. 2024;20(4):485-492. https://doi.org/10.20996/1819-6446-2024-3047. EDN: CSCSKG
For citation:
Kotlyar I.E., Filchkova A.E., Enenkov N.V., Sidashova A.S., Kondratyev D.O., Dobrynina N.V., Vasyushkina K.I., Gorokhova T.A. Mural infectious endocarditis in a patient with tetralogy of Fallot: a clinical case. Rational Pharmacotherapy in Cardiology. 2024;20(4):485-492. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3047. EDN: CSCSKG

















































