Перейти к:
Частота выявления хронического миокардита у больных с фибрилляцией предсердий по результатам одноцентрового исследования
https://doi.org/10.20996/1819-6446-2024-3048
EDN: BSBCTV
Аннотация
Цель. Оценить частоту выявления хронического миокардита у пациентов с фибрилляцией предсердий (ФП).
Материал и методы. В исследование было включено 145 пациентов (мужчины — 118 (81,4%), медиана возраста 45 (38; 50) лет. Большинство пациентов имели пароксизмальную форму ФП (60 (41,4%)), чуть меньше — персистирующую — 55 (37,9%), длительно персистирующую имели 30 (20,7%) больных. Всем пациентам проведена радиочастотная аблация ФП и эндомиокардиальная биопсия (ЭМБ) с последующими гистологическим и иммуногистохимическим исследованиями (ИГХ). Морфологическую верификацию миокардита проводили в соответствии с модифицированными Всемирной федерацией сердца Далласскими критериями.
Результаты. Признаки хронического миокардита выявлены у 64 больных (44,1%). Медиана возраста пациентов с миокардитом составила 44 (36,5;49) года, без миокардита — 46 (38;51) лет. У мужчин миокардит выявлен в 50 случаях (42%), у женщин — в 14 (51,9%). При пароксизмальной ФП миокардит обнаружен у 25 больных (41,7%), при персистирующей — у 23 (41,8%), при длительно персистирующей — у 16 (53,3%). Группы с хроническим миокардитом и без оказались сопоставимы при сравнении по основным эхокардиографическим показателям. Регрессионный анализ не показал значимого влияния данных факторов на вероятность обнаружения хронического миокардита у пациентов с ФП. У пациентов до 30 лет не обнаруживалось признаков воспаления без наличия фиброза миокарда, тогда как максимальная стадия фиброзирования встречалась у больных от 31 до 40 лет. Стадия фиброза не зависела от пола. Чаще других в биоптатах выявлялось сочетание энтеровируса и вируса герпеса 6 типа. У пациентов старше 51 года в биоптатах в основном отсутствовала экспрессия какого-либо вируса при ИГХ.
Заключение. Хронический миокардит у больных с ФП статистически значимо чаще выявлялся у более молодых пациентов (до 50 лет включительно), причем чаще встречался у женщин, а также при наличии длительно персистирующей формы ФП вне зависимости от пола. Обнаружение признаков фиброза миокарда более характерно для больных молодого возраста с максимальной стадией в возрасте от 31 до 40 лет.
Ключевые слова
Для цитирования:
Арчаков Е.А., Баталов Р.Е., Хлынин М.С., Драгунова М.А., Ситкова Е.С., Эшматов О.Р., Московских Т.В., Усенков С.Ю., Степанов И.В., Афанасьев С.А., Попов С.В. Частота выявления хронического миокардита у больных с фибрилляцией предсердий по результатам одноцентрового исследования. Рациональная Фармакотерапия в Кардиологии. 2024;20(4):409-417. https://doi.org/10.20996/1819-6446-2024-3048. EDN: BSBCTV
For citation:
Archakov E.A., Batalov R.E., Khlynin M.S., Dragunova M.A., Sitkova E.S., Eshmatov O.R., Moskovskikh T.V., Usenkov S.Yu., Stepanov I.V., Afanasyev S.A., Popov S.V. Prevalence of chronic myocarditis in patients with atrial fibrillation according to the results of a single-center study. Rational Pharmacotherapy in Cardiology. 2024;20(4):409-417. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3048. EDN: BSBCTV
Введение
Миокардит — воспалительное заболевание миокарда, связанное с развитием дисфункции сердца [1]. Известны проявления острого миокардита с развитием выраженной сердечной недостаточности, внезапным снижением фракции выброса (ФВ) с соответствующей клинической картиной. Эти проявления заставляют клиницистов проводить интенсивную диагностику и лечение этого патологического процесса. Хронический миокардит протекает более скрытно, не вызывая стремительную отрицательную динамику и быстрых значимых нарушений функции сердца, однако со временем приводит к тем же негативным последствиям [2][3]. В современных рекомендациях по диагностике воспалительных изменений сердца указано о необходимости проведения эндомиокардиальной биопсии (ЭМБ) (золотого стандарта для выявления миокардита), чаще в случаях, когда наступили выраженные нарушения функции сердца (снижение ФВ, развитие сердечной недостаточности, возникновение жизнеугрожающих желудочковых тахиаритмий) [4]. В клинической практике часто встречаются пациенты с предсердными нарушениями ритма сердца (фибрилляция и трепетание предсердий, предсердные тахикардии), у которых, на первый взгляд, нет очевидной причины аритмий и отсутствуют выраженные признаки сердечной недостаточности со снижением ФВ. Эти больные, возможно, не менее остро нуждаются в выполнении ЭМБ для установки диагноза, проведении, как минимум, патогенетической терапии и оценки влияния воспаления на течение заболевания. Несмотря на это, широкого применения ЭМБ у пациентов с предсердными тахиаритмиями не получила, в связи с чем велика вероятность несвоевременной диагностики основного инфекционно-воспалительного заболевания миокарда, прогрессирования фиброзных изменений сердца и, соответственно, безуспешных попыток катетерного лечения. Вероятно, проблема связана с отсутствием крупных популяционных исследований с прижизненной диагностикой миокардита у больных с предсердными нарушениями ритма сердца.
Цель данного исследования — оценить частоту выявления хронического миокардита у пациентов с фибрилляцией предсердий (ФП).
Материал и методы
Дизайн исследования
Исследование было проведено в соответствии с Хельсинкской декларацией после одобрения соответствующими комитетами по этике и регулирующими органами и после подписания информированного согласия всеми участниками (протокол этического комитета научно-исследовательского института кардиологии Томского НИМЦ № 208 от 20.01.2021 г.). Проведено проспективное одноцентровое пилотное исследование. Дизайн исследования: включение пациентов согласно критериям, клиническое обследование, выполнение процедуры аблации (радиочастотная аблация фибрилляции предсердий в объеме изоляции устьев легочных вен), сразу же после аблации выполнение ЭМБ из правого желудочка с последующей диагностикой признаков воспаления, деление больных на 2 группы в зависимости от выявленных критериев миокардита, сравнение групп.
Популяция пациентов
Под наблюдением находились 152 пациента с симптомной идиопатической пароксизмальной, персистирующей и длительно персистирующей формами ФП. Критерии включения: возраст более 18 лет, идиопатическая ФП, резистентная к антиаритмическим препаратам классов I-IV, ранее процедура аблации ФП не проводилась, передне-задний размер левого предсердия <5,5 см. Не было исключений по анатомии легочных вен или истории ФП/трепетания предсердий. В анамнезе у больных отсутствовала связь дебюта аритмии сердца с перенесенными накануне инфекционно-воспалительными заболеваниями, а так же отсутствовали сведения о перенесенном остром миокардите. В выборке отсутствовали пациенты с артериальной гипертензией, сахарным диабетом, ишемической болезнью сердца, ожирением 3 ст. и другими заболеваниями, которые могли бы оказать влияние на появление, прогрессирование ФП. Обязательным условием до госпитализации и оперативного лечения было выполнение диагностической коронарографии. Пациенты с наличием атеросклеротического поражения коронарных артерий не включались в исследование. Во время госпитализации диагноз устанавливался на основании жалоб, анамнеза и объективных исследований. Всем больным до оперативного лечения проведены: общеклинический, биохимический анализ крови, определение уровня гормонов щитовидной железы, регистрация электрокардиограммы, суточное мониторирование электрокардиограммы и артериального давления. Для оценки морфо-функциональных показателей сердца выполнено эхокардиографическое исследование сердца (аппарат Philips HD15, Нидерланды), оценивали размеры отделов сердца и ФВ левого желудочка по методу Симпсона. После исключения с помощью данных методов диагностики основных заболеваний, которые чаще всего служат причинами ФП (гипертоническая болезнь, ишемическая болезнь сердца, заболевания щитовидной железы, врожденные и приобретенные клапанные пороки сердца, структурные генетические заболевания сердца (гипертрофическая, дилатационная кардиомиопатия), перенесенная острая ревматическая лихорадка), пациент включался в исследование.
Процедура аблации и взятия ЭМБ
Больным проведено интервенционное лечение ФП. До вмешательства проводилась чреспищеводная эхокардиография (для исключения тромбоза полостей сердца), антикоагулянтная терапия. Для радиочастотной антральной изоляции легочных вен во всех случаях использовалась система CARTO (Biosense Webster, Калифорния, США). Контроль изоляции осуществлялся циркулярным катетером Lasso (Biosense Webster, Калифорния, США). При аблации использовали индекс аблации (AI) (Biosense Webster, Калифорния, США). При необходимости синусовый ритм восстанавливали электрической кардиоверсией. Непосредственно после аблации под рентгенологическим контролем выполнена ЭМБ из верхушки, межжелудочковой перегородки и выносящего тракта правого желудочка с помощью биопсийных щипцов BIPAL (Cordis Corporation, East Bridgewater, NJ, США). Полученные образцы маркировали соответствующим образом и фиксировали в 10% забуференном нейтральном формалине.
Гистологическое и иммуногистохимическое исследование
Окрашивание парафиновых срезов проводилось гематоксилином и эозином и по Ван Гизону. У больных старше 45 лет для исключения кардиального амилоидоза выполнялась гистохимическая окраска Конго красным. Гистологические препараты исследовали на светооптическом уровне (микроскоп AxioImager M2, Zeiss). Для морфологической верификации миокардита использовали Далласские критерии, модифицированные Всемирной федерацией сердца [1]. Во всех случаях оценивали активность воспаления (Grading) и выраженность фиброза (Staging), которую определяли с учетом полуколичественных гистологических критериев C. Basso и соавт. [1] для оценки морфологических изменений при воспалительной кардиомиопатии с учетом консенсуса Европейского общества кардиологов по диагностике и лечению миокардитов [5][6]. Для оценки площади интерстициального фиброза по отношению к площади среза миокарда применялась программа обработки и анализа изображения Zeiss Efficient Navigation — ZEN (Carl Zeiss, Германия).
С целью определения иммунофенотипа инфильтрирующих воспалительных клеток (CD3, CD45RO, CD68) в каждом фрагменте миокарда выполнялось иммуногистохимическое исследование (ИГХ) и выявление экспрессии антигенов кардиотропных вирусов. Были применены следующие антитела: мышиные моноклональные антитела к CD3 (Clone LN10, Leica, Германия), мышиные моноклональные антитела к CD45R0 (Clone UCHL1, Leica, Германия), мышиные моноклональные антитела к CD68 (Clone 514H12, Leica, Германия), мышиные моноклональные антитела к парвовирусу B19 (Clone R92F6, Cell Marque, США), кроличьи поликлональные антитела к белку VP-1 энтеровирусов (Invitrogen, США), кроличьи поликлональные антитела к вирусу герпеса 2 типа (Cell Marque, США), кроличьи поликлональные антитела к вирусу простого герпеса 1 типа (Cell Marque, США), мышиные моноклональные антитела к аденовирусу (Clone 20/11 & 2/6, Cell Marque, США), мышиные моноклональные антитела к цитомегаловирусам (Clones DDG9 + CCH2, DBS, США) и кроличьи моноклональные антитела к вирусу Эпштейна-Барр (Clone MRQ-47, Cell Marque, США). ИГХ окрашивание проводили с использованием автоматизированного иммуностейнера Leica BOND-MAX (Leica Microsystems GmbH, Германия) в соответствии со стандартным протоколом с использованием набора Bond Polymer Refine Detection Kit DC9800 (Leica Microsystems GmbH, Германия). Экспрессия маркеров клеток воспалительного инфильтрата оценивалась путем подсчета числа позитивно окрашенных клеточных элементов в 1 мм2 при увеличении ×400. Экспрессия вирусных антигенов оценивалась по наличию и выраженности позитивного окрашивания в различных клеточных структурах биоптата (кардиомиоциты, эндотелий капилляров, эндокард, клетки стромы и воспалительного инфильтрата).
При гистологическом исследовании биоптатов оценивалась выраженность фиброза в баллах согласно данным C. Basso с соавт. [1]. Для стадирования фиброза учитывали следующие показатели: интерстициальный/заместительный фиброз: отсутствует — 0 баллов, от 10 до 20% — 1, от 20 до 40% — 2, более 40% — 3; субэндокардиальный фиброз: отсутствует — 0, имеется — 1; эндокардиальный фиброэластоз: отсутствует — 0, имеется — 1; максимальный бал — 5 [1].
При выписке из стационара у всех пациентов имелся синусовый ритм. После процедуры всем пациентам назначались антиаритмические и антикоагулянтные препараты в течение трех месяцев. Клиническое наблюдение пациентов на данном этапе исследования не предполагалось. Результаты ЭМБ и ИГХ незамедлительно предоставлялись пациентам с соответствующими рекомендациями к выполнению.
Статистический анализ
Для выполнения статистического анализа применяли программы Statistica версии 10.0 и MedCalc версии 18.9.1. Соответствие нормальному закону распределения количественных данных проверено с помощью критерия Шапиро-Уилка. Показатели, не соответствующие нормальному закону распределения, сравнивали с помощью критерия Манна-Уитни или теста Краскела-Уоллиса. Результаты представляли в виде медианы и интерквантильного размаха. Силу линейной взаимосвязи между количественными показателями оценивали с помощью коэффициента ранговой корреляции Спирмена. Связь между качественными данными определяли с помощью ꭓ2 Пирсона или двустороннего точного теста Фишера. Результаты регрессионного анализа были представлены в виде отношения шансов с 95% доверительным интервалом (ДИ). Различия считали значимыми при уровне p<0,05.
Результаты
Из 152 пациентов, ЭМБ проведена у 145 пациентов (остальные пациенты от проведения ЭМБ отказались), из них 118 (81,4%) мужчин. Медиана возраста составила 45 (38; 50) лет. По форме ФП: 60 (41,4%) — больных с пароксизмальной, 55 (37,9%) — с персистирующей и 30 (20,7%) — с длительно персистирующей.
По результатам ЭМБ признаки хронического лимфоцитарного миокардита выявлены у 64 больных (44,1%). Большинство больных имели хронический миокардит (различной степени активности от G1 до G4), что проявлялось не только в обнаружении >14 лимфоцитов и моноцитов/макрофагов на 1 мм2, но и наличии невыраженного некроза кардиомиоцитов и иногда вовлечении эндокарда (тромбоз и воспаление). Клинические данные групп представлены в табл. 1.
Таблица 1. Клиническая характеристика пациентов с фибрилляцией предсердий
|
Параметр |
Выявлен миокардит (n=64) |
Не выявлен миокардит (n=81) |
Р |
|
Демографические показатели |
|||
|
Возраст, лет |
44 (36,5;49) |
46 (38;51) |
0,89 |
|
Мужской пол, n (%) |
50 (78,1) |
68 (83,9) |
0,37 |
|
Форма ФП |
|||
|
Пароксизмальная, n (%) |
25 (39) |
35 (43,2) |
0,74 |
|
Персистирующая, n (%) |
23 (35,9) |
32 (39,5) |
0,76 |
|
Длительно-персистирующая, n (%) |
16 (25) |
14 (17,3) |
0,35 |
|
Показатели Эхо-КГ |
|||
|
ФВ (В), % |
65 (58,5;69) |
64 (60;67) |
0,89 |
|
ПЖ, мм |
24 (23;26) |
24 (21;25) |
0,87 |
|
ЛП, мм |
42 (38,5;44,5) |
42 (38;45) |
0,28 |
|
МЖП, мм |
10 (9;11) |
10 (9;11) |
0,41 |
|
ЗСЛЖ, мм |
10 (9;10) |
10 (9;10) |
0,81 |
|
КСО, мл |
39 (32;50) |
41 (35;49) |
0,97 |
|
КДО, мл |
115 (99;125) |
112 (103;127) |
0,41 |
|
КДР, мм |
50 (48;54) |
50 (48;52,5) |
0,52 |
|
КСР, мм |
32 (30,36) |
32 (30;35) |
0,97 |
|
Антиаритмическая терапия |
|||
|
Класс I, n (%) |
34 (53,1) |
44 (54,3) |
0,93 |
|
Класс III, n (%) |
26 (40,6) |
32 (39,5) |
0,92 |
Данные представлены Ме (25%;75%), для категориальных показателей n (%). ФП — фибрилляция предсердий, Эхо-КГ — эхокардиография, ФВ(В) — фракция выброса в В-режиме, ПЖ — правый желудочек, ЛП — левое предсердие, МЖП — межжелудочковая перегородка, ЗСЛЖ — задняя стенка левого желудочка, КСО — конечный систолический объем, КДО — конечный диастолический объем, КДР — конечный диастолический размер, КСР — конечный систолический размер
Группы были сопоставимы по клиническим характеристикам, включая одинаковое распределение пациентов по форме ФП. В обеих группах преобладали пациенты мужского пола.
Для лучшего понимания распределения встречаемости хронического миокардита все пациенты были разделены на возрастные группы.
Статистически значимых различий выявленного миокардита в возрастных группах не было. В первых трех группах миокардит встречался примерно в половине случаев (рис. 1А). В старшей группе встречаемость миокардита была наименьшей. Вероятность выявления хронического миокардита статистически значимо выше у больных до 50 лет включительно (рис. 1Б).
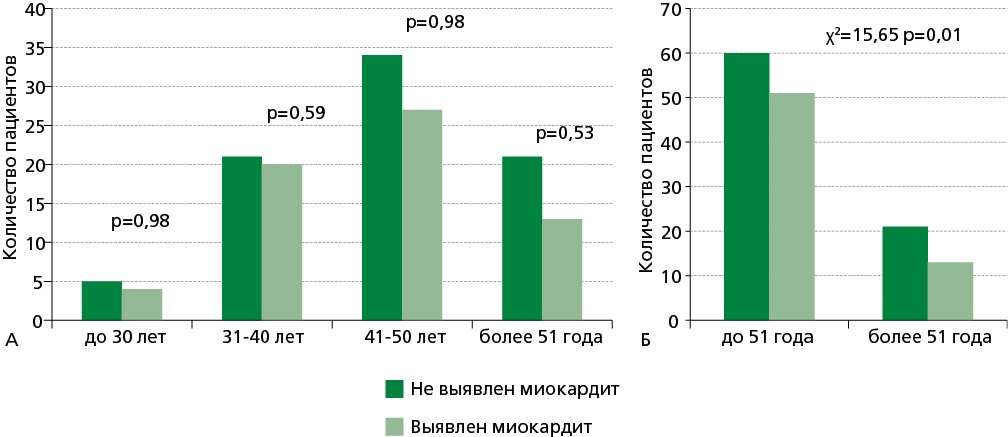
Рисунок 1. Распространенность миокардита у пациентов с фибрилляцией предсердий в разных возрастных группах. А — деление на четыре возраста, Б — деление на две возрастные группы
Проанализирована вероятность выявления миокардита у больных в зависимости от пола. У мужчин хронический миокардит выявлен в 50 случаях (42%), у женщин — в 14 (51,9%) (различие статистически не значимо, р=0,31).
При пароксизмальной ФП миокардит обнаружен у 25 больных (41,7%), при персистирующей — у 23 (41,8%), при длительно персистирующей — у 16 (53,3%). Таким образом, вероятность выявления хронического миокардита у больных с более тяжелой длительно персистирующей формой ФП выше, чем при других.
При гистологическом исследовании образцов ЭМБ оценивали выраженность фиброза в баллах. В исследуемой выборке преобладали больные с 3 и 4 стадией фиброза (рис. 2А). В 11 случаях в биоптатах признаков фиброза не обнаружено.
Не выявлено ни одного пациента до 30 лет без фиброза миокарда. Наиболее часто в возрастной группе от 31 до 40 лет встречались максимальная 5 стадия, а также часто 3 и 4 стадии фиброза (рис. 2Б). Стадия фиброза не зависела от пола.
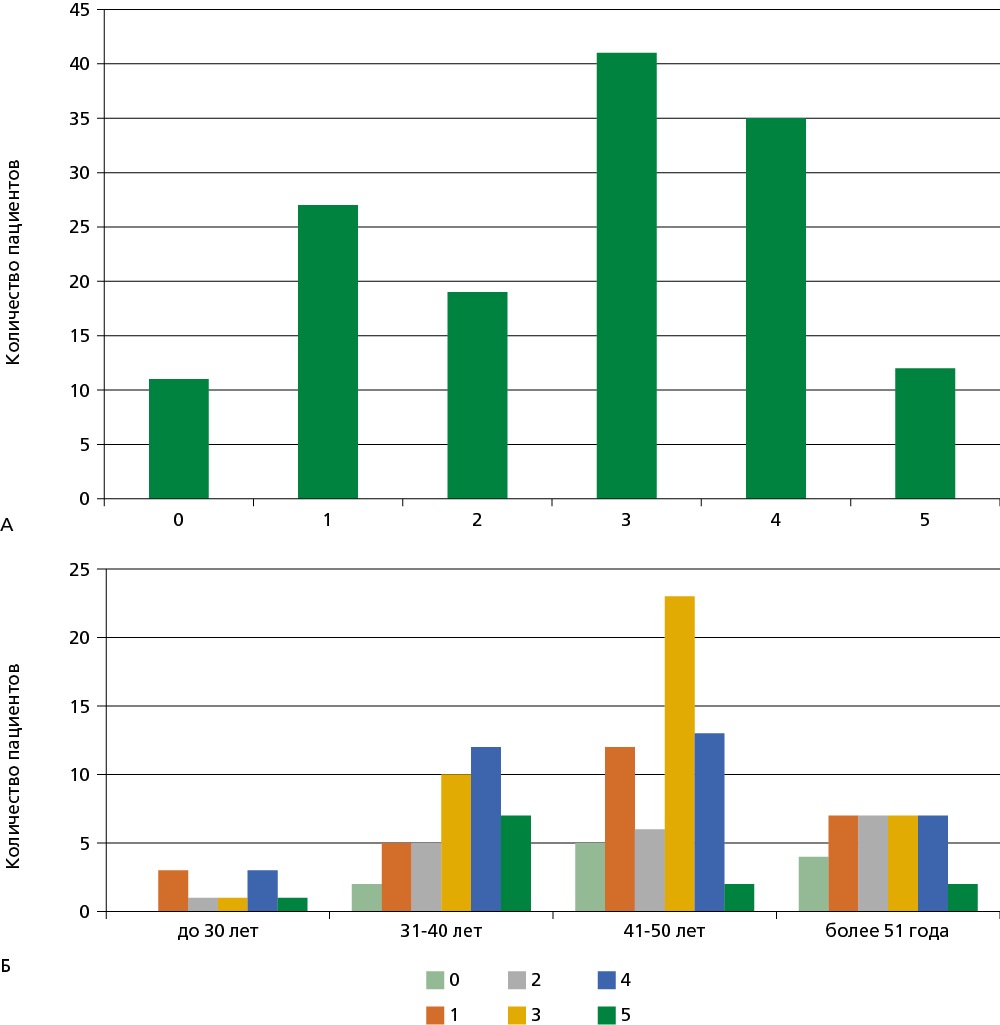
Рисунок 2. А. Частота встречаемости разной стадии фиброза у больных с миокардитом Б. Встречаемость разных стадий фиброза миокарда в зависимости от возраста (0-5 стадии фиброза)
Проведена оценка влияния различных факторов на вероятность выявления хронического миокардита (рис. 3), значимые факторы не обнаружены.
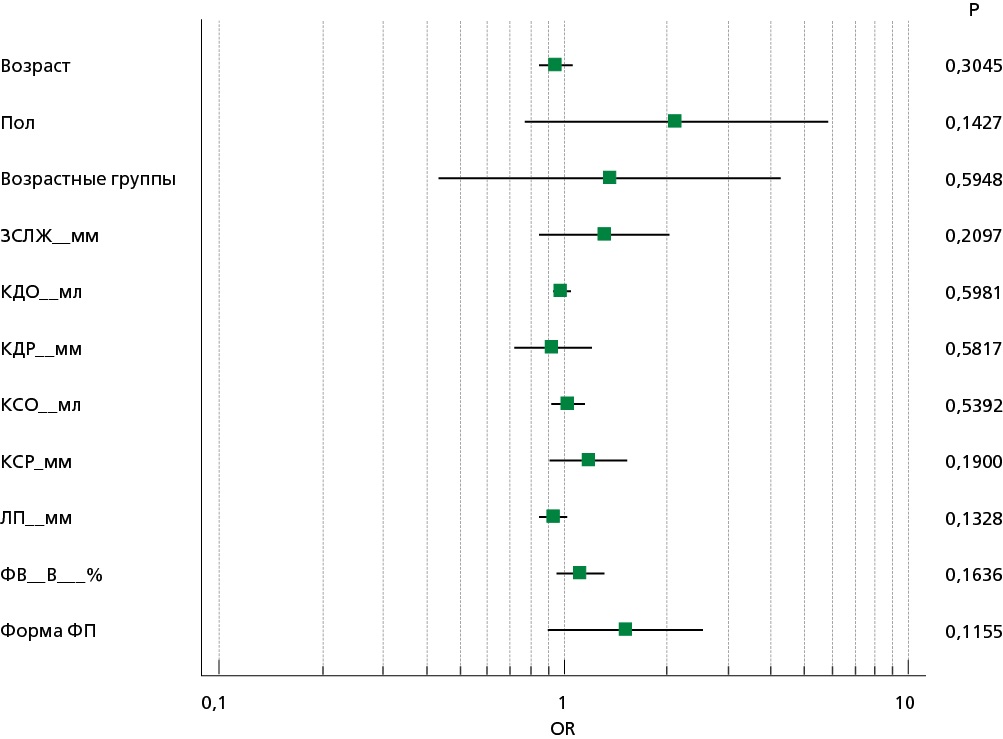
Рисунок 3. Оценка влияния демографических и клинико-инструментальных факторов на вероятность обнаружения миокардита
OR — отношение шансов (точка — показатель ОШ, линия — 95% доверительный интервал, p — уровень статистической значимости). ЗСЛЖ — задняя стенка левого желудочка, КСО — конечный систолический объем, КДО — конечный диастолический объем, КДР — конечный диастолический размер, КСР — конечный систолический размер, ЛП — левое предсердие, ФВ — фракция выброса (В-режим), ФП — фибрилляция предсердий
По результатам ИГХ выявлена экспрессия антигенов следующих вирусов: наиболее часто встречалось сочетание герпеса 6 типа и энтеровируса — в 72 образцах (49,7%), реже — энтеровирус — 20 (13,8%), еще реже герпес 6 типа — 10 (6,9%), сочетание вирусов герпеса 6 типа, Эпштейн-Барр и энтеровируса документировано в 8 случаях (5,5%). Значительно реже обнаруживалась экспрессия антигенов вирусов герпеса 1 типа — 1 (0,7%), 2 типа — 1 (0,7%), парвовируса — 1 (0,7%). Исследовались и другие антигены — аденовируса, цитомегаловируса, однако выявить их не удалось. У 21 пациента (14,5%) при явных признаках хронического миокардита, экспрессии каких-либо из исследуемых антигенов вирусов не было обнаружено, что может быть связано с невирусными причинами, такими как аутоиммунные, либо с наличием у данных больных более редких вирусов, которые не были включены в диагностическую ИГХ панель (рис. 4).
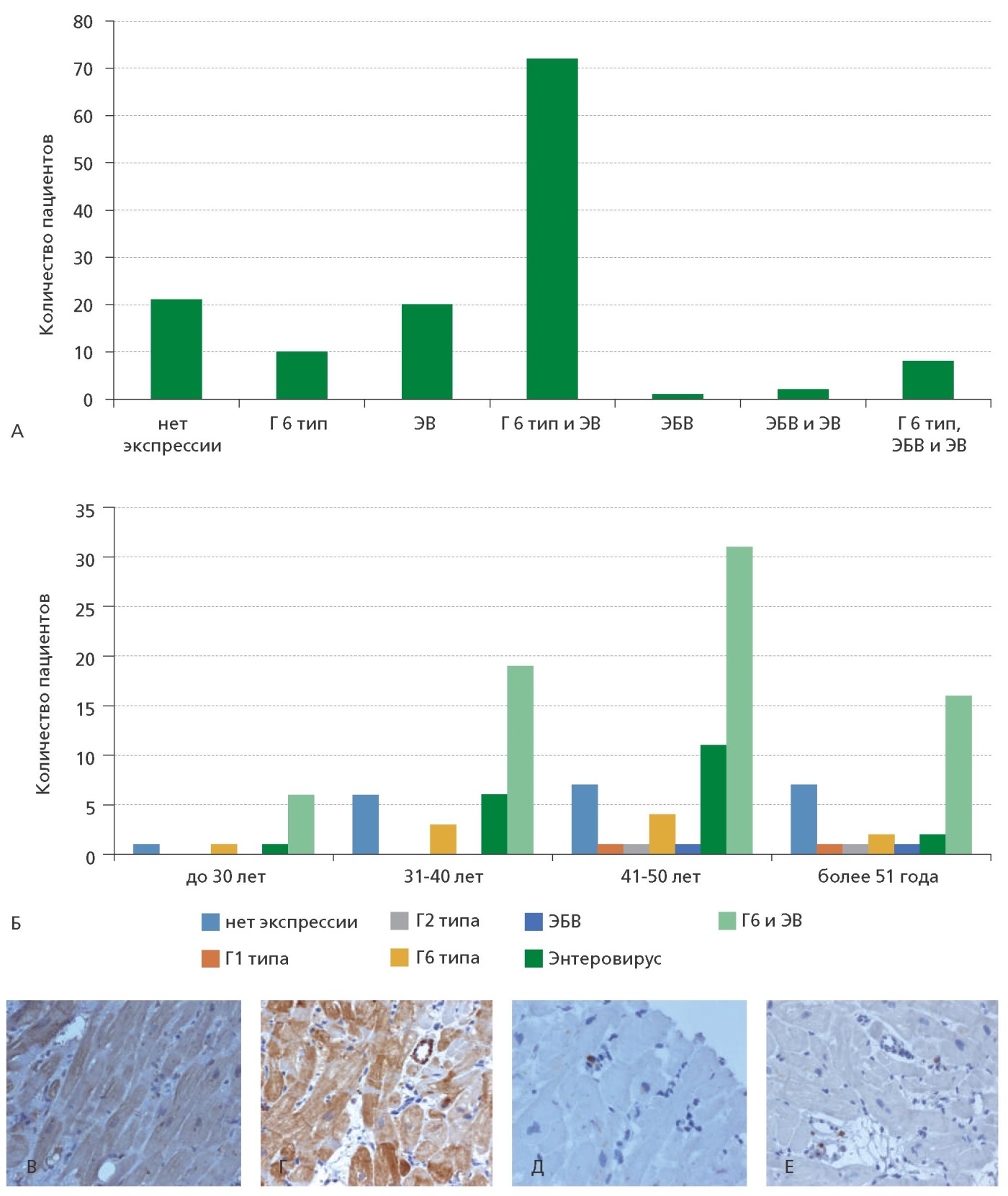
Рисунок 4. А — Наиболее часто встречаемая экспрессия антигенов вирусов в исследуемых образцах. Б — Экспрессия генов по возрастным группам. В — Иммуногистохимическая реакция с антителами к энтеровирусу. Отмечается позитивное окрашивание цитоплазмы кардиомиоцитов. Увеличение х400. Г — Иммуногистохимическая реакция с антителами к энтеровирусу. Отмечается позитивное окрашивание цитоплазмы кардиомиоцитов, эндотелиоцитов капилляра. Увеличение х400. Д — Иммуногистохимическая реакция с антителами к герпес вирусу 6 типа. Отмечается позитивное окрашивание цитоплазмы макрофагов. Увеличение х400. Е — Иммуногистохимическая реакция с антителами к CD3. Увеличение х400.
Г1–Г6 типа — герпес 1-6 типа, ЭВ — энтеровирус, ЭБВ — Эпштейн-Барр вирус.
Выявлено, что в первой и второй возрастных группах экспрессия вирусов менее разнообразна, чем в старшей возрастной группе. Так, в возрасте до 40 лет не было выявлено антигенов вируса герпеса 1-го и 2-го типов, Эпштейн-Барр вируса, тогда как у пациентов старше 41 года они встречались. Во всех возрастных группах преобладали пациенты с сочетанием экспрессии вирусов герпеса 6 типа и энтеровируса.
Обсуждение
Вирусный миокардит остается серьезной проблемой в современной кардиологии и подчеркивает необходимость изучения разных подходов к более точной диагностике и поиску инновационных направлений в лечении. Современные клинические рекомендации по миокардиту основываются на крупных регистровых исследованиях, выполненных по результатам аутопсии большого количества пациентов с различной патологией [4]. Так, например, в одном из самых крупных регистров в Финляндии, V. Kytö и соавт. изучили влияние пола и возраста на возникновение миокардита [7]. По их данным, миокардит чаще встречался у мужчин (76,61%; 95% ДИ от 75,11% до 78,05%), чем у женщин (23,39%; 95% ДИ от 21,95% до 24,89%, p<0,0001). Молодые мужчины (16-20 лет) особенно подвержены риску развития миокардита, тогда как женщины чаще всего заболевают в постменопаузальном возрасте (56-60 лет).
В другом крупном исследований, G. Passarino и соавт. проанализировали данные 17162 аутопсий [8]. Миокардит по гистологическим Далласским критериям был обнаружен в 91 случае. Заболевание чаще встречалось у пациентов от 20 до 39 лет, без различий между мужчинами и женщинами.
Анализ результатов посмертных исследований позволил выявить значимую клиническую проблему — прижизненную гиподиагностику миокардита, особенно хронического. Одним из решений может являться более широкое применение ЭМБ в клинической практике или поиск новых способов прижизненного обнаружения воспаления миокарда [9-11]. Для этого существует потребность в большем количестве исследований, направленных на расширение и уточнение показаний для ЭМБ.
В представленной работе проанализирована частота встречаемости хронического миокардита у пациентов с ФП. Необходимо отметить, что в большинстве случаев в анамнезе у больных отсутствовала связь дебюта аритмии сердца с перенесенными накануне инфекционно-воспалительными заболеваниями и обнаружение миокардита было "случайной находкой". Согласно полученным данным, существует тенденция большей частоты встречаемости хронического миокардита у женщин (51,9% против 42% у мужчин). Кроме того, статистически значимо чаще миокардит обнаруживается в возрасте до 51 года. В этом аспекте наши данные оказались сопоставимы с результатами процитированных исследований [7][8]. Ответ на вопрос, почему активный воспалительный процесс, запущенный вирусной инфекцией, чаще встречается в более молодом возрасте, вероятно, скрыт в механизмах иммунного ответа. Установлено, что клеточная устойчивость к вирусным инфекциям является одной из реакций врожденного иммунитета. В нескольких исследованиях показано, что в молодом возрасте продукция провоспалительных цитокинов более активна, чем в пожилом, наблюдается более выраженный процесс воспаления в миокарде [12-14], а также развитие фиброзных изменений. Максимальная стадия фиброза наблюдалась у пациентов до 50 лет, со снижением показателя в старшем возрасте. У больных до 30 лет, при наличии миокардита, фиброз наблюдался в 100% случаев.
По данным литературы, наиболее частыми причинами лимфоцитарного миокардита служат: аденовирус, энтеровирус, цитомегаловирус, вирус Эпштейна-Барра, вирус гепатита С, вирусы простого герпеса 1 и 2, вирус герпеса человека 6, вирусы гриппа А и В, парвовирус В19 и риновирус [14]. В проведённом исследовании было проанализировано большинство из перечисленных возбудителей. В некоторых случаях вирус не был идентифицирован с помощью использованного набора антител, что может быть связано либо с наличием другого вируса, либо с его элиминацией на момент исследования. В исследованной выборке преобладали пациенты с сочетанием экспрессии вирусов герпеса 6 типа и энтеровируса. Отмечено, что у больных в возрасте до 40 лет не было выявлено антигенов вируса герпеса 1-го и 2-го типов, Эпштейн-Барр вируса, в то время как в старших группах эти вирусы встречались. Интерпретация полученных данных в настоящий момент представляет затруднения и требует дополнительных исследований в этой области.
Ограничения исследования
Проведено одноцентровое проспективное исследование, в которое было включено небольшое количество пациентов (n=145). В исследовании проводилась ЭМБ из правого желудочка. Однако, согласно некоторым работам, проведенным ранее, было показано, что миокардит в желудочках сердца совпадает с миокардитом предсердий [6]. Идентификации вирусов в нашем случае проводилось только с помощью ИГХ исследования, молекулярно-генетические методы не применялись. Также к ограничениям можно отнести и невозможность установления причины отсутствия экспрессии антигенов вирусов у больных миокардитом. Кроме того, не оценивалось влияние лечения миокардита.
Заключение
Признаки хронического миокардита у больных с ФП статистически значимо чаще выявлялись у пациентов в возрасте до 51 года. Чаще хронический миокардит обнаруживается у женщин и при длительно персистирующей форме ФП, вне зависимости от пола. У более молодых пациентов с хронических миокардитом чаще всего встречается фиброз миокарда, максимальная стадия фиброза характерна для больных от 31 до 40 лет. У пациентов старше 51 года в биоптатах чаще других отсутствовала экспрессия какого-либо вируса при ИГХ исследовании.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Список литературы
1. Basso C, Calabrese F, Angelini A, et al. Classification and histological, immunohistochemical, and molecular diagnosis of inflammatory myocardial disease. Heart Fail Rev. 2013;18(6):673-81. DOI:10.1007/s10741-012-9355-6.
2. Yancy CW, Jessup M, Bozkurt B, et al; American College of Cardiology Foundation; American Heart Association Task Force on Practice Guidelines. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2013;62(16):e147-239. DOI:10.1016/j.jacc.2013.05.019.
3. Палеев Н. Р., Палеев Ф. Н., Санина Н. П. и др. Сердечная недостаточность при миокардитах и роль иммунных механизмов в ее развитии. РМЖ. 2014;22(12):878-82.
4. Арутюнов Г. П., Палеев Ф. Н., Моисеева О. М. и др. Миокардиты у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(11):4790. DOI:10.15829/1560-4071-2021-4790.
5. Caforio AL, Pankuweit S, Arbustini E, et al; European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2013;34(33):2636-48. DOI:10.1093/eurheartj/eht210.
6. Mitrofanova LB, Orshanskaya V, Ho SY, Platonov PG. Histological evidence of inflammatory reaction associated with fibrosis in the atrial and ventricular walls in a case-control study of patients with history of atrial fibrillation. Europace. 2016;18(suppl 4): iv156-62. DOI:10.1093/europace/euw361.
7. Kytö V, Sipilä J, Rautava P. The effects of gender and age on occurrence of clinically suspected myocarditis in adulthood. Heart. 2013;99(22):1681-4. DOI:10.1136/heartjnl-2013-304449.
8. Passarino G, Burlo P, Ciccone G, et al. Prevalence of myocarditis at autopsy in Turin, Italy. Arch Pathol Lab Med. 1997;121(6):619-22.
9. Puntmann VO, Voigt T, Chen Z, et al. Native T1 mapping in differentiation of normal myocardium from diffuse disease in hypertrophic and dilated cardiomyopathy. JACC Cardiovasc Imaging. 2013;6(4):47584. DOI:10.1016/j.jcmg.2012.08.019.
10. Voigt A, Elgeti T, Durmus T, et al. Cardiac magnetic resonance imaging in dilated cardiomyopathy in adults — towards identification of myocardial inflammation. Eur Radiol. 2011;21(5):925 35. DOI:10.1007/s00330-010-1985-2.
11. Friedrich MG, Sechtem U, Schulz-Menger J, et al.; International Consensus Group on Cardiovascular Magnetic Resonance in Myocarditis. Cardiovascular magnetic resonance in myocarditis: A JACC White Paper. J Am Coll Cardiol. 2009;53(17):147587. DOI:10.1016/j.jacc.2009.02.007.
12. Jatczak B, Leszek J, Siemieniec I, et al. Age- and disease-related innate immunity of human leukocytes ex vivo. Exp Gerontol. 2012;47(1):8-13. DOI:10.1016/j.exger.2011.09.010.
13. Dunham CL, Frank JA. Ultrasound Pressure-Dependent Cytokine and Immune Cell Response Lost in Aged Muscle. Ultrasound Med Biol. 2024;50(4):494-501. DOI:10.1016/j.ultrasmedbio.2023.12.009.
14. Mejias NH, Martinez CC, Stephens ME, de Rivero Vaccari JP. Contribution of the inflammasome to inflammaging. J Inflamm (Lond). 2018;15:23. DOI:10.1186/s12950-018-0198-3.
Об авторах
Е. А. АрчаковРоссия
Арчаков Евгений Александрович.
Томск
Р. Е. Баталов
Россия
Баталов Роман Ефимович.
Томск
М. С. Хлынин
Россия
Хлынин Михаил Сергеевич.
Томск
М. А. Драгунова
Россия
Драгунова Марина Александровна.
Томск
Е. С. Ситкова
Россия
Ситкова Екатерина Сергеевна.
Томск
О. Р. Эшматов
Россия
Эшматов Отабек Рахимжанович.
Томск
Т. В. Московских
Россия
Московских Татьяна Валерьевна.
Томск
С. Ю. Усенков
Россия
Усенков Станислав Юрьевич.
Томск
И. В. Степанов
Россия
Степанов Иван Вадимович.
Томск
С. А. Афанасьев
Россия
Афанасьев Сергей Александрович.
Томск
С. В. Попов
Россия
Попов Сергей Валентинович.
Томск
Дополнительные файлы
Рецензия
Для цитирования:
Арчаков Е.А., Баталов Р.Е., Хлынин М.С., Драгунова М.А., Ситкова Е.С., Эшматов О.Р., Московских Т.В., Усенков С.Ю., Степанов И.В., Афанасьев С.А., Попов С.В. Частота выявления хронического миокардита у больных с фибрилляцией предсердий по результатам одноцентрового исследования. Рациональная Фармакотерапия в Кардиологии. 2024;20(4):409-417. https://doi.org/10.20996/1819-6446-2024-3048. EDN: BSBCTV
For citation:
Archakov E.A., Batalov R.E., Khlynin M.S., Dragunova M.A., Sitkova E.S., Eshmatov O.R., Moskovskikh T.V., Usenkov S.Yu., Stepanov I.V., Afanasyev S.A., Popov S.V. Prevalence of chronic myocarditis in patients with atrial fibrillation according to the results of a single-center study. Rational Pharmacotherapy in Cardiology. 2024;20(4):409-417. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3048. EDN: BSBCTV

















































