Перейти к:
Клиническое применение сервисов поддержки принятия врачебных решений при ведении пациентов с фибрилляцией предсердий
https://doi.org/10.20996/1819-6446-2024-3062
EDN: UBFTZZ
Аннотация
В кардиологии, как и других отраслях медицины, в настояшее время существует необходимость не только оптимизировать лечение пациентов, уменьшить финансовые расходы, но и улучшить отдаленные исходы. Объем информации, необходимый для решения подобных задач, велик, а время врача сильно ограничено. Для помощи врачу может быть использовано дополнительное программное обеспечение (ПО), способное обрабатывать за короткий промежуток времени большие массивы данных. Сервисы поддержки принятия врачебных решений (СППВР) — вид ПО, позволяющий на основании многочисленных клинических характеристик обеспечивать врача информацией о наиболее вероятном диагнозе, профиле риска пациента, наиболее подходящей терапии и т.д. На сегодняшний день подобные СППВР все больше находят свое применение в различных сферах кардиологии и сердечно-сосудистой медицины. Накоплен опыт их применения и в Российской Федерации. В клинической практике остается актуальной проблема корректного назначения антикоагулянтной терапии, что приводит к сохранению высокого риска тромбоэмболических событий. Кроме того, несмотря на наличие доказанной пользы назначения антикоагулянтной терапии пациентам с фибрилляцией предсердий (ФП) при высоком риске тромбоэмболических осложнений, в клинической практике прослеживается определенная частота "недоназначения" оральных антикоагулянтов (ОАК). Внедрение стратегии персонифицированного подхода к выбору антикоагулянтов, основанного на индивидуальных характеристиках пациентов, может значительно улучшить приверженность назначенной терапии и, как следствие, снизить риск тромбоэмболических осложнений. В данной статье рассматриваются положительные и отрицательные стороны применения СППВР в ведении пациентов с ФП, выделены основные ограничения при их использовании в условиях, приближенных к реальной клинической практике.
Ключевые слова
Для цитирования:
Пономаренко А.В., Гаврилко А.Д., Гартунг А.А., Полякова М.С., Оганесян А.А., Бенимецкая К.С., Лосик Д.В., Шалаев С.В. Клиническое применение сервисов поддержки принятия врачебных решений при ведении пациентов с фибрилляцией предсердий. Рациональная Фармакотерапия в Кардиологии. 2024;20(4):468-477. https://doi.org/10.20996/1819-6446-2024-3062. EDN: UBFTZZ
For citation:
Ponomarenko A.V., Gavrilko A.D., Gartung A.A., Poliakova M.S., Oganesyan A.A., Benimetskaya K.S., Losik D.V., Shalaev S.V. Clinical application of clinical decision support systems in the management of patients with atrial fibrillation. Rational Pharmacotherapy in Cardiology. 2024;20(4):468-477. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3062. EDN: UBFTZZ
Введение
Непрерывно увеличивающийся объем клинических рекомендаций (КР) по различным нозологиям, появление новых препаратов, устройств и подходов для диагностики и лечения пациентов (таких, как телеметрия, носимые и имплантируемые устройства регистрации электрокардиограммы и т.д.) требуют от врача более детального и объективного определения профиля риска пациента, установки более точных и сложных диагнозов, а также более деликатного назначения терапии [1].
Сервисы поддержки принятия врачебных решений (СППВР) — вид программного обеспечения (ПО) или набор цифровых инструментов, позволяющий на основании многочисленных входных данных (клинических характеристик) обеспечивать врача информацией о наиболее вероятном диагнозе, профиле риска пациента, наиболее подходящей терапии, предназначенный для улучшения процесса принятия решений в клинической практике и включающий оповещения, рекомендации, чек-листы и сводки [2-4].
В широком смысле большинство цифровых инструментов в арсенале лечащего врача, начиная от онлайн-калькуляторов и заканчивая КР, находящимися на официальных сайтах различных медицинских сообществ, можно отнести к СППВР. Поэтому обозначенные проблемы медицины и кардиологии в частности указывают на необходимость использования в качестве СППВР более сложных систем, способных автоматически устанавливать предварительный диагноз, рассчитывать риски, выделять группы пациентов, более приверженных той или иной терапии на основании больших объемов данных, поступающих из различных источников. Такие СППВР все больше находят свое применение в различных сферах кардиологии и сердечно-сосудистой медицины [5]. В реальной клинической практике СППВР показывают возможность увеличения приверженности врачей КР, более корректного назначения терапии при распространенных заболеваниях кардиологического профиля [6-8], более точного прогнозирования риска [9], уменьшения вероятности назначения противопоказанных препаратов и неблагоприятных лекарственных взаимодействий [10][11]. Кроме того, СППВР могут обеспечивать работников административного звена аналитической информацией по качеству оказываемой помощи, а также служить инструментом контроля неблагоприятных событий и госпитализаций, что способствует оптимизации финансовых затрат на лечение пациентов, более эффективному использованию коечного фонда [7][12]. Несмотря на вышеуказанные преимущества СППВР, существуют также ограничения их применения.
В обзоре освещаются наиболее значимые публикации по опыту клинического применения СППВР у пациентов с фибрилляцией предсердий (ФП), обсуждаются ограничения применения данных инструментов и дальнейшие пути их возможного развития.
Описание технологий СППВР для клинициста
СППВР представляет собой ПО, которое на основании поступающей извне информации генерирует ответ, содержащий информацию о диагнозе, профиле риска и наиболее эффективной и безопасной терапии для конкретной клинической ситуации [3].
На примере ПО ООО "МедикБук" работа СППВР может быть представлена следующими этапами (рис. 1). Первый этап заключается в построении цифрового профиля пациента на основании структурированной и неструктурированной информации из медицинской информационной системы (МИС). Цифровой профиль пациента — "двойник" данных из МИС, пригодный для дальнейшего анализа алгоритмами ПО (рис. 2). Второй этап представляет собой анализ цифрового профиля пациента при помощи алгоритмов оцифрованных КР (рис. 3). При этом формируется список схем терапии с учетом КР для данного пациента. На следующем этапе происходит анализ данного перечня на наличие абсолютных и относительных противопоказаний с применением данных из государственного реестра лекарственных средств. Финальный этап анализа заключается в индивидуализации терапии с учетом клинических субгрупп исследований, касающихся данной патологии. Сформированный отчет предоставляется в веб-браузере либо, при наличии интеграции, непосредственно в МИС. Помимо помощи в назначении терапии, СППВР также предоставляет информацию в виде информационных панелей для организаторов здравоохранения [13].
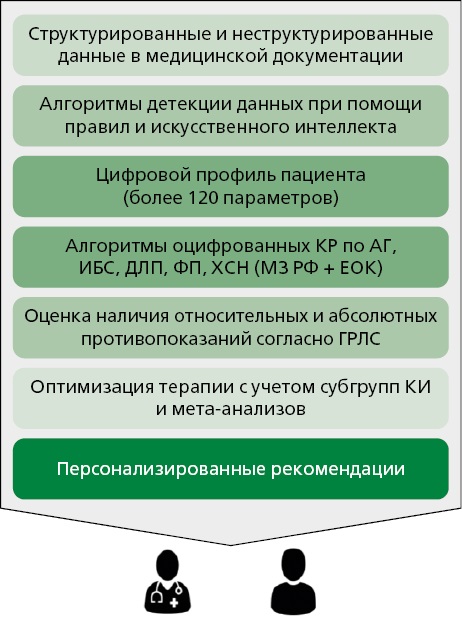
Рисунок 1. Принципиальная схема работы СППВР на примере ПО "МедикБук"
КР — клинические рекомендации, АГ — артериальная гипертензия, ИБС — ишемическая болезнь сердца, ДЛП — дислипидемия, ФП — фибрилляция предсердий, ХСН — хроническая болезнь сердца, МЗ РФ — Министерство здравоохранения Российской Федерации, ЕОК — Европейское общество кардиологов, ГРЛС — государственный реестр лекарственных средств, КИ — клинические исследования СППВР — сервис поддержки принятия врачебных решений ПО — программное обеспечение

Рисунок 2. Пример формирования фрагмента цифрового профиля пациента из текста ЭМК пациента (СППВР "МедикБук")
СППВР — сервис поддержки принятия врачебных решений, ЭМК — электронная медицинская карта, МКБ — международная классификация болезней, ЧСС — частота сердечных сокращений, NYHA класс — функциональный класс сердечной недостаточности по NYHA
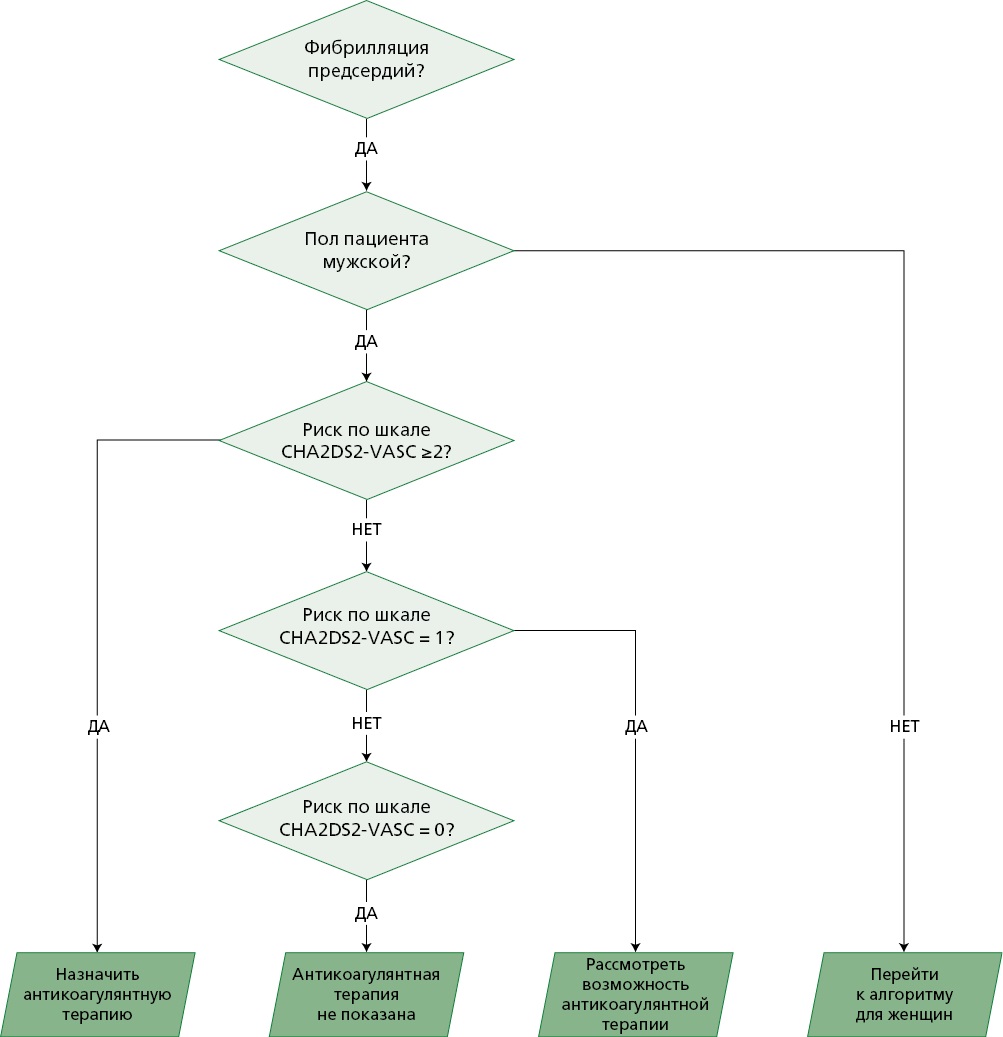
Рисунок 3. Пример фрагмента алгоритма оцифрованных КР МЗ РФ по ФП (СППВР "МедикБук")
КР — клинические рекомендации, СППВР — сервис поддержки принятия врачебных решений, CHA2DS2-VASc — шкала оценки риска тромбоэмболических осложнений у пациентов с ФП
Некоторые СППВР имеют в своем составе модели машинного обучения. Машинное обучение — один из видов искусственного интеллекта, основанный на принципе обучения при помощи нейронных сетей [1]. Результатом обучения подобных систем на примерах из практики могут быть модели, обладающие большей прогностической точностью. К примеру, одна из моделей прогнозирования развития 10-летнего риска сердечно-сосудистых заболеваний платформы прогностической аналитики "Webiomed" имеет показатели точности 80,2% при площади под кривой 0,83. Для сравнения, аналогичные показатели для Фремингемской шкалы имеют более низкие метрики: точность 70,0% при площади под кривой 0,59 [14]. Однако прогнозирование риска без рекомендаций по коррекции терапии имеет невысокую практическую значимость при применении моделей в клинике.
Применение СППВР при назначении антикоагулянтной терапии
Одно из ключевых направлений применения СППВР — улучшение качества назначаемой терапии и приверженности врачей КР. Несмотря на наличие доказанной пользы назначения антикоагулянтной терапии пациентам с ФП при высоком риске тромбоэмболических осложнений, в клинической практике прослеживается определенная частота "неназначения" оральных антикоагулянтов (ОАК) [15][16]. С этих позиций СППВР представляется перспективным инструментом, способным увеличить соответствие назначения антикоагулянтной терапии КР. Так, в исследовании "ИНТЕЛЛЕКТ" были проанализированы карты пациентов с ФП и артериальной гипертензией из МИС Национального медицинского исследовательского центра им. В. А. Алмазова [17]. Группа медицинских экспертов, не имеющая данных о терапии в электронной медицинской карте (ЭМК) (назначенной врачом), выполняла повторные назначения терапии данным пациентам на основании их цифровых профилей и при помощи СППВР. Оценка соответствия назначенной терапии актуальным КР осуществлялась независимыми медицинскими экспертами по специальности "кардиология". Обе группы экспертов использовали СППВР ООО "MedicBK" для оценки и назначения терапии. Основной результат исследования — антикоагулянтная терапия не соответствовала КР в 8% случаев. Эксперты, применявшие СППВР, на 15% чаще назначали "новые" ОАК [ 95% доверительный интервал (ДИ) 10-21], если сравнивать с терапией, назначенной врачами, в медицинских картах.
В сходном проспективном исследовании проанализировано частота соответствия назначений антикоагулянтов КР врачами общей практики, использующими СППВР, интегрированный в МИС [18]. Помимо оценки факта корректного назначения показаний к назначению антикоагулянтной терапии, также оценивалась корректность выбора препарата и его дозировок. Показано, что применение ПО увеличивало вероятность соответствия КР в 8,07 раза по сравнению с контрольной группой (скорректированное отношение шансов = 8,07, 95% ДИ (2,57-25,34), p<0,001).
В нескольких исследованиях оценивали влияние СППВР на клинические исходы у пациентов с ФП. Так, в рамках рандомизированного исследования IMPACT-AF первичной конечной точкой стало совокупное количество незапланированных госпитализаций из-за сердечно-сосудистых заболеваний и обращений в отделения неотложной помощи из-за ФП [19]. В группе вмешательства врачам был предоставлен доступ к сводной таблице, в которую вошли пациенты, имеющие отличные от рекомендуемых СППВР назначения антикоагулянтной терапии. Врачам предлагалось пересмотреть свои назначения для этих пациентов. Несмотря на применение СППВР, статистически значимой разницы по первичной конечной точке обнаружено не было (отношение шансов: 0,98 [ 95% ДИ 0,71-1,37], p=0,92). Кроме того, не обнаружено влияние на количество массивных кровотечений (n=7 — контрольная группа, n=8 — группа СППВР, p=0,93). Возможной причиной неспособности СППВР обеспечить статистически значимое преимущество в снижении частоты первичной конечной точки стало наличие большого количества пациентов, уже находящихся на оптимальной терапии согласно КР.
Схожие результаты были получены в исследовании S. van Doorn и соавт. [20]. СППВР, автоматически рассчитывающий сумму баллов по шкале CHA2DS2-VASc на основании ретроспективных данных, полученных из ЭМК, рекомендовала назначение антикоагулянтной терапии согласно КР в группе вмешательства. Врачам в группе контроля не предоставлялась дополнительная информация по лечению пациентов. В группу вмешательства было включено 1129, в группу контроля — 1226 пациентов. Первичной конечной точкой была частота ишемического инсульта, транзиторной ишемической атаки (ТИА) и/или тромбоэмболии. Вторичными точками служили частота кровотечений и доля пациентов, которым в соответствии с КР назначалась антикоагулянтная терапия. Не обнаружено значимых различий по первичной конечной точке между группами с СППВР и без СППВР (отношение рисков (ОР) 1,3, 95% ДИ 0,8-2,1). Кроме того, не было различий в частоте кровотечений и использовании антикоагулянтов. Согласно мнению авторов, одна из возможных причин отсутствия значимого влияния применения СППВР на первичную конечную точку заключается в том, что большое количество пациентов уже получали ОАК, и, несмотря на большой объем выборки, это не позволило получить выраженную разницу между группами сравнения. Другое возможное объяснение — врачи общей практики в группе вмешательства не уделяли достаточного внимания рекомендациям СППВР: предоставление врачам рекомендаций по лечению каждый раз, когда пациент посещает клинику или открывается ЭМК пациента, может привести к распространенной ошибке "слишком большого количества уведомлений", что приводит к их игнорированию.
В исследовании L. O. Karlsson и соавт. СППВР предоставлял информацию врачу, ответственному за пациента, об отсутствии назначения ОАК при высоком риске тромбоэмболических осложнений, оцененном по алгоритму с применением шкалы CHA2DS2-VASc [21]. Основной результат исследования — увеличение соответствия назначаемой терапии КР со статистически значимой разницей при сравнении с группой контроля через 1 год исследования (73,0% против 71,2%, p=0,013). Однако, как и в работе S. van Doorn и соавт., в исследовании L. O. Karlsson и соавт. не найдены значимые различия в отношении уменьшения частоты инсульта, ТИА, системной эмболии в группе вмешательства (49 [ 95% ДИ 43-55] на 1000 пациентов с ФП в группе СППВР в сравнении с 47 [ 95% ДИ 39-55] на 1000 пациентов с ФП в группе контроля, p=0,64). Отсутствие статистической значимости различий по данным конечным точкам связано с незначительным приростом частоты назначения ОАК (2,7% в группе СППВР и 1,2%, в контрольной группе) и небольшим периодом наблюдения. Как заявляют авторы, незначительное увеличение частоты назначения ОАК в группе СППВР было связано с игнорированием врачами сообщений СППВР о необходимости назначения ОАК. В подавляющем большинстве случаев причиной неназначения антикоагулянтной терапии вопреки сообщениям СППВР послужило наличие у пациентов таких факторов риска, как повышенный риск кровотечений, риск падений, онкологической патологии и деменции, что не учитывалось программой.
Метаанализ, включающий оба вышеперечисленных исследования, также не показал статистически значимых различий по твердым точкам эффективности применения СППВР (ОР: 1,12, 95% ДИ: 0,88-1,42, p=0,357), в то время как имелась тенденция к меньшей частоте кровотечений в группе вмешательства (ОР: 1,79, 95% ДИ: 0,61-1,01, p=0,063) [22]. Тем не менее, данный систематический обзор продемонстрировал статистически значимое различие в частоте большего соответствия назначений действующим КР в группе СППВР, однако клиническая разница оказалась незначительной, хотя, принимая во внимание факт минимального отклонения ОР от 1, следует констатировать, что разница в частоте соответствия КР в группах была минимальна (ОР: 1,03, 95% ДИ: 1,01-1,04, p=0,004). Кроме того, частота соответствия назначаемой терапии внутри группы СППВР варьировала в широком диапазоне (55-85%). Авторы связывают такой разброс внутри группы с трудностями в работе с ПО.
В исследовании D. L. Arts и соавт. СППВР, интегрированный в МИС, работал по логике, основанной на 15 правилах КР Европейского общества кардиологов по показаниям к назначению ОАК у пациентов с ФП [23]. Несоответствие правил в реальном времени у того или иного пациента приводило к появлению всплывающего оповещения в правом нижнем углу. Основной находкой исследования стала крайне низкая частота использования СППВР — 5%, причем более половины оповещений (58%) были проигнорированы. Интересно то, что частота игнорирования сообщений возрастала со временем. По мнению авторов, это стало основной причиной неспособности исследования показать преимущества в плане увеличения приверженности назначений врачей КР при использовании сервиса (50% в контрольной группе и 55% в группе интервенции, р=0,23).
В исследовании M. H. Eckman и соавт. применение сходного СППВР привело к уменьшению дискордантности в назначениях ОАК, выраженной в несоответствии между назначениями в ЭМК и рекомендациями СППВР в течение 1 года исследования, с 63,3% до 58,3% [24]. Тем не менее, авторы статьи утверждают, что данная разница оказалась меньше ожидаемой. Как и в исследовании D. L. Arts и соавт., это может быть объяснено сложностью принятия решения в реальной клинической практике, которая не может полностью быть описана древом принятия решения, основанным на КР. Под этим подразумевается наличие высокого риска кровотечений, которые не учитывались программой, наличие падений в анамнезе, значительный коморбидный фон и другие факторы, которые определяют низкую продолжительность жизни. Тем не менее, врачи, участвовавшие в исследовании, утверждали, что даже в случае неназначения ОАК по причине вышеупомянутых ограничений, вопреки рекомендациям СППВР, сообщения системы часто становились причиной обсуждения подобных спорных моментов с пациентом.
Основные ограничения исследований, а также клинические ограничения применения описанных СППВР перечислены в табл. 1.
Таблица 1. Исследования, посвященные оценке применения СППВР
при назначении ОАК у пациентов с ФП
|
Автор, год |
n |
Тип исследования |
Длительность наблюдения (мес.) |
Звено здравоохранения |
Результаты |
Ограничения исследования |
Ограничения СППВР |
|
Cox JL, 2020 [21] |
1145 |
Рандомизированное, проспективное, открытое |
12 |
Первичное |
Незапланированная госпитализация или обращение в приемное отделение по поводу причин, связанных с ФП — 130 в группе контроля, 118 в группе СППВР, ОР: 0,98 [ 95% ДИ 0,71-1,37], P=0,926 Большие кровотечения (n=7 в группе контроля, n=8 в группе СППВР, P=0,939) |
Предвзятый набор врачами пациентов, которые уже находятся на оптимальном лечении |
Невозможность интеграции программы в МИС. Игнорирование оповещений |
|
Ru X, 2023 [20] |
115 |
Не рандомизированное |
15 |
Первичное |
Частота соответствия назначений антикоагулянтной терапии КР 75,5% в СППВР и 38,7% в контрольной группе |
Исходный возраст и показатель HAS-BLED не были одинаковыми. Неполные данные о пациентах, большая доля исключенных данных. Выбор лечения врача и пациента иногда отличался от предложенного СППВР |
ПО не учитывало лекарственные взаимодействия, риски падения, когнитивного дефицита, а также наличие психоэмоциональных расстройств |
|
Eckman MH, 2016 [26] |
1493 |
Кластерное, рандомизированное |
12 |
Первичное |
Уменьшение частоты несоответствия назначаемой терапии рекомендациям СППВР с 63% до 59% (p =0,02) |
Из исследования исключались пациенты с впервые выявленной формой ФП |
ПО не учитывало риск кровотечений, сопутствующие заболевания, а также риск падений |
|
Karlsson LO, 2018 [23] |
14800 |
Кластерное, рандомизированное, проспективное |
12 |
Первичное |
Частота соблюдения рекомендаций через 1 год: 73,0%, 95% ДИ 64,6–81,4% — в группе СППВР 71,2%, 95% ДИ 60,8-81,6%, p=0,013 — в контрольной группе; Частота инсульта, ТИА или системной тромбоэмболии: 49 [ 95% ДИ 43-55] на 1000 пациентов с ФП в группе СППВР и 47 [ 95% ДИ 39-55] на 1000 пациентов с ФП в контрольной группе, р=0,64 |
Исследования на популяции с высоким уровнем соблюдения рекомендаций. Кроссовер ввиду закрытия одной из клиник в контрольной группе. Короткий период наблюдения |
Не учитывался риск падений, кровотечений, а также неизлечимых заболеваний, таких как злокачественные новообразования и деменция. Усталость от оповещений системы |
|
van Doorn S, 2018 [22] |
1129 |
Рандомизированное, кластерное, открытое, проспективное |
31 |
Первичное |
Частота ишемического инсульта, ТИА и/или тромбоэмболии: 1,96 в группе СППВР и 1,42 в контрольной группе, ОР 1,3, 95% ДИ 0,8-2,1; Частота крупных кровотечений: 0,79 на 100 человеко-лет в группе вмешательства и 0,82 на 100 человеко-лет в контрольной группе (ОР 0,9, 95% ДИ 0,5-1,9) |
Отсутствие ослепления при сборе данных Недостаточное количество качественных данных для оценки кровотечений |
Не учитывались противопоказания к антикоагулянтной терапии, сопутствующие заболевания |
|
Лосик Д.В., 2021 [19] |
300 |
Ретроспективное, не рандомизированное |
12 |
Амбулаторное и стационарное |
Эксперты, применявшие СППВР, на 15% (95% ДИ 10-21%) чаще назначали новые ОАК. Антиаритмическая терапия не отвечала рекомендациям в 31% случаев. При использовании СППВР эксперты на 14% (95% ДИ 4-19%) чаще отдавали предпочтение монотерапии антиаритмическими препаратами и на 32% (95% ДИ 26-37%) чаще назначали радиочастотную аблацию устьев легочных вен |
В исследование не включались пациенты с вторичной АГ, заболеванием щитовидной железы, как причины ФП, острым коронарным синдромом в течение последних 6 мес., активным заболеванием печени, скоростью клубочковой фильтрации <30 мл/мин |
Не учитывались пожелания пациента и социальные факторы |
|
Arts DL, 2017 [25] |
781 |
Кластерное, рандомизированное, проспективное |
11 |
Первичное |
Показатели обеих групп улучшились на 8% и 5% соответственно. Статистически значимой разницы между группами не было (контроль: 50%, вмешательство: 55%, P=0,23) |
Финансовые и организационные ограничения |
Прекращение поддержки плагина СППВР |
СППВР — сервис поддержки принятия врачебных решений, МИС — медицинская информационная система, ПО — программное обеспечение, ОР — отношение рисков, ДИ — доверительный интервал, АГ — артериальная гипертензия, КР — клинические рекомендации, ОАК — оральные антикоагулянты, ТИА — транзиторная ишемическая атака, ФП — фибрилляция предсердий
Другие аспекты использования СППВР у пациентов с ФП
Другим направлением применения СППВР является выбор стратегии контроля ритма и/или частоты сердечных сокращений (ЧСС).
В исследовании А. В. Пономаренко и соавт. ретроспективно были проанализированы 232 ЭМК пациентов, направленных на катетерную аблацию ФП с целью выявления предикторов неэффективности процедуры при помощи СППВР [25]. Предикторы риска неэффективности процедуры были основаны на исследовании CABANA (индекс массы тела (ИМТ), размеры левого предсердия и возраст) [26]. Риск рецидива ФП был обнаружен у 49,5% пациентов, направленных на первичную процедуру, и у 36,2% пациентов из группы повторной аблации. Доля ЭМК пациентов с прогнозируемым риском рецидива ФП по критерию ИМТ составила 17,6% в группе первичной аблации и 17,7% в группе повторной аблации (p=0,977). Таким образом, повторные процедуры составляют существенную долю в популяции пациентов с показаниями для катетерной аблации ФП, исходно имеющих. высокий риск рецидива ФП. Ограничениями данного исследования служили ретроспективный характер анализа и необходимость проведения длительного проспективного рандомизированного исследования для полноценной оценки способностей СППВР в выявлении заведомо неуспешных процедур радиочастотной аблации. Также были учтены лишь основные предикторы "неуспеха" на основании предыдущих исследований, расширение количества предикторов может сделать механизмы выявления рецидива ФП после аблации более точными и персонализированными.
В уже процитированном исследовании "ИНТЕЛЛЕКТ", кроме анализа антикоагулянтной терапии, проводилась оценка соответствия КР антиаритмической терапии. Несоответствие обнаружено в 31% случаев, а при выборе контроля ритма врачи, использующие СППВР, чаще назначали катетерную изоляцию устьев легочных вен [17].
В настоящее время продолжаются исследования с применением СППВР "QRhythm", ядро которого представляет собой алгоритм, созданный искусственным интеллектом в ходе машинного обучения [27]. Этот СППВР на основе таких данных, как возраст, ЧСС, ИМТ, длительность диагноза ФП, наличие хронической сердечной недостаточности, артериальной гипертензии, размер левого предсердия и наличие симптомов, связанных с ФП, рекомендует придерживаться в том или ином случае контроля ритма или контроля ЧСС. В настоящее время в рамках данного исследования опубликованы результаты опроса 33 врачей, тестировавших данную систему [26]. Наивысшую оценку получила безопасность системы; средний балл — 4,7 из 5. На 4,5 балла врачи оценили ценность использующихся для анализа входных данных, на 4,3 балла — соответствие популяции, на которой обучалась модель, реальной клинической практике, и на 4,3 — обратную интерпретируемость, означающую степень понимания врачом причин тех или иных рекомендаций СППВР. 6 врачей использовали приложение в своей практике и ответили также на ряд других вопросов. По их итогам, половина врачей доверяет рекомендациям приложения, большая часть не боится использовать его в клинической практике и считает, что легко сможет научиться им пользоваться. Большая часть врачей считает, что это приложение повысит эффективность лечения ФП в той или иной степени. С учётом клинического разнообразия пациентов, противоречивых данных клинических исследований, нельзя утверждать, что для всех пациентов будет одинаково полезен только контроль ЧСС или только контроль ритма. По мнению авторов, СППВР как раз могут помочь врачу в выборе наилучшей стратегии для того или иного пациента.
Ограничения использования СППВР в клинических исследованиях и пути их преодоления
Помимо ограничений самих исследований, применение СППВР в условиях, приближенных к реальной клинической практике, также сопряжено с некоторыми трудностями, которые могут снижать клиническую эффективность данного ПО. Ограничениями применения некоторых СППВР, имеющих в своем составе алгоритмы искусственного интеллекта, являются низкая интерпретируемость результатов и недоверие к технологии. По мнению исследователей, анализировавших использование приложения "QRhythm", это два основных препятствия между развитием данного направления в здравоохранении и его внедрением в клиническую практику [27]. Примером СППВР с низким уровнем доверия может быть расчет прогностических шкал системой "Webiomed" по причине отсутствия строгих алгоритмов и калькуляторов расчета [27]. Анализ текста, который был написан врачом, не всегда является строгим эталоном для обучения модели и может приводить к ошибкам интерпретации. С большим доверием врачи относятся к автоматически рассчитанным шкалам на основе существующих калькуляторов и алгоритмам на основе базы знаний (КР, положения и приказы).
Еще одно ограничение использования СППВР — в ряде исследований они не были интегрированы в существующую МИС. Врачам приходилось получать доступ к СППВР через отдельную платформу, что добавляло дополнительные этапы в их рабочий процесс и приводило к снижению частоты использования сервисов [17][19]. Проблема интеграции подчеркивает важность "бесшовного" включения СППВР в существующие МИС для их эффективного использования в клинической практике.
В нескольких исследованиях сообщается о снижении частоты использования ПО из-за проблемы "слишком большого количества уведомлений", которая приводит к их игнорированию [21]. Данная проблема не является уникальной и может быть решена через три подхода: большая конкретизация, улучшение визуального дизайна и изменение содержания [28].
Еще одним препятствием клиническому применению СППВР, работающих по логике КР, может быть неспособность учитывать весь спектр особенностей пациента, которые принимает во внимание врач в клинической практике. Так, ПО может не учитывать ряд противопоказаний при назначении терапии. В некоторых исследования это послужило причиной игнорирования рекомендаций системы о необходимости назначения ОАК [17][20]. Такие характеристики пациента, как высокий риск падений, наличие заболеваний, ограничивающих продолжительность жизни, высокий риск кровотечений сложны для оцифровки и включения в алгоритм работы СППВР.
В заключение необходимо отметить, что, как и любое ПО, СППВР могут функционировать со сбоями. Они могут быть связаны с целым рядом причин, включая изменения в программном коде, непреднамеренное отключение логических правил и внешние сбои. По данным некоторых исследований, такие ошибки бывают нередки, и зачастую имеют персистирующий характер [29].
Заключение
Наибольшее количество публикаций, посвященных клиническому применению СППВР у больных ФП, посвящено аспектам назначения антитромботической терапии. Наибольший интерес в этой связи продиктован имеющейся на сегодняшний день проблемой недостаточного использования ОАК у пациентов с показаниями к назначению таковых.
Подавляющее большинство статей, посвященных использованию СППВР в аспекте назначения антикоагулянтной терапии, продемонстрировали увеличение приверженности врачей КР при использовании СППВР. Тем не менее, лишь часть из упомянутых исследований имели в качестве конечных точек клинические исходы. Исследования, которые оценивали влияние различных СППВР на риск развития ишемических событий, а также их профиль безопасности, продемонстрировали противоречивые результаты.
Наиболее вероятной причиной неспособности проведенных исследований СППВР зафиксировать статистически значимые различия в уменьшении риска развития ишемических событий является недостаточный размер выборок и небольшая длительность наблюдений. Концептуальные ограничения самих СППВР, такие, как игнорирование программных сообщений врачами, участвующими в исследованиях, также могло оказывать влияние на результаты исследований за счет снижения эффективности применения данных сервисов.
Отношения и Деятельность. Бенимецкая К. С. и Лосик Д. В. — сотрудники ООО "МедикБук".
Relationships and Activities. Benimetskaya K. S. and Losik D. V. are employees of LLC MedicBook.
Финансирование: Работа выполнена при поддержке Тюменского государственного медицинского университета Министерства здравоохранения Российской Федерации.
Funding: The study was performed with the support of Tyumen State Medical University of the Ministry of Healthcare of the Russian Federation.
Список литературы
1. Itchhaporia D. Artificial intelligence in cardiology. Trends Cardiovasc Med. 2022; 32(1):34-41. DOI:10.1016/j.tcm.2020.11.007.
2. Knoery CR, Heaton J, Polson R, et al. Systematic Review of Clinical Decision Support Systems for Prehospital Acute Coronary Syndrome Identification. Crit Pathw Cardiol. 2020;19(3):119-125. DOI:10.1097/HPC.0000000000000217.
3. Bright TJ, Wong A, Dhurjati R, et al. Effect of clinical decision-support systems: a systematic review. Ann Intern Med. 2012;157(1):29-43. DOI:10.7326/0003-4819-157-1-201207030-00450.
4. Mills S. Electronic Health Records and Use of Clinical Decision Support. Crit Care Nurs Clin North Am. 2019;31(2):125-131. DOI:10.1016/j.cnc.2019.02.006.
5. Lu Y, Melnick ER, Krumholz HM. Clinical decision support in cardiovascular medicine. BMJ. 2022;377:e059818. DOI:10.1136/bmj-2020-059818.
6. McKie PM, Kor DJ, Cook DA, et al. Computerized Advisory Decision Support for Cardiovascular Diseases in Primary Care: A Cluster Randomized Trial. Am J Med. 2020;133(6):750-756.e2. DOI:10.1016/j.amjmed.2019.10.039.
7. Groenhof TKJ, Asselbergs FW, Groenwold RHH, et al; UCC-SMART study group. The effect of computerized decision support systems on cardiovascular risk factors: a systematic review and meta-analysis. BMC Med Inform Decis Mak. 2019;19(1):108. DOI:10.1186/s12911-019-0824-x.
8. Sheibani R, Sheibani M, Heidari-Bakavoli A, et al. The Effect of a Clinical Decision Support System on Improving Adherence to Guideline in the Treatment of Atrial Fibrillation: An Interrupted Time Series Study. J Med Syst. 2017;42(2):26. DOI:10.1007/s10916-017-0881-6.
9. Groenhof TKJ, Rittersma ZH, Bots ML, et al; Members of the UCC-CVRM Study Group. A computerised decision support system for cardiovascular risk management ‘live’ in the electronic health record environment: development, validation and implementation-the Utrecht Cardiovascular Cohort Initiative. Neth Heart J. 2019;27(9):435-442. DOI:10.1007/s12471-019-01308-w.
10. Kaushal R, Shojania KG, Bates DW. Effects of computerized physician order entry and clinical decision support systems on medication safety: a systematic review. Arch Intern Med. 2003;163(12):1409-16. DOI:10.1001/archinte.163.12.1409.
11. Wolfstadt JI, Gurwitz JH, Field TS, et al. The effect of computerized physician order entry with clinical decision support on the rates of adverse drug events: a systematic review. J Gen Intern Med. 2008; 23(4):451-8. DOI:10.1007/s11606-008-0504-5.
12. Jacob V, Thota AB, Chattopadhyay SK, et al. Cost and economic benefit of clinical decision support systems for cardiovascular disease prevention: a community guide systematic review. J Am Med Inform Assoc. 2017;24(3):669-676. DOI:10.1093/jamia/ocw160.
13. Бенимецкая К. С., Проваторов С. И., Ежов М. В., и др. РетроспектИвНый анализ назначений гиполипидемической и анТитромботичЕской терапии при помощи сервиса поддержки принятия врачебных решений на основе данных реаЛьной кЛиничЕской праКТики. "Исследование ИНТЕЛЛЕКТ-3". Кардиология. 2023;63(11):46-56. DOI:10.18087/cardio.2023.11.n2555.
14. Гусев А. В., Гаврилов Д. В., Корсаков И. Н. и др. Перспективы использования методов машинного обучения для предсказания сердечно-сосудистых заболеваний. Врач и информационные технологии. 2019;(3): 41-47.
15. Al-Khatib SM, Pokorney SD, Al-Khalidi HR, et al. Underuse of oral anticoagulants in privately insured patients with atrial fibrillation: A population being targeted by the IMplementation of a randomized controlled trial to imProve treatment with oral AntiCoagulanTs in patients with Atrial Fibrillation (IMPACT-AFib). Am Heart J. 2020;229:110-117. DOI:10.1016/j.ahj.2020.07.012.
16. Hsu JC, Freeman JV. Underuse of Vitamin K Antagonist and Direct Oral Anticoagulants for Stroke Prevention in Patients With Atrial Fibrillation: A Contemporary Review. Clin Pharmacol Ther. 2018;104(2):301-310. DOI:10.1002/cpt.1024.
17. Лосик Д. В., Козлова С. Н., Кривошеев Ю. С., и др. Результаты ретроспективного анализа выбора терапии при помощи сервиса поддержки принятия врачебных решений у пациентов с артериальной гипертензией и фибрилляцией предсердий (ИНТЕЛЛЕКТ). Российский кардиологический журнал. 2021;26(4):54-60. DOI:10.15829/1560-4071-2021-4406.
18. Ru X, Wang T, Zhu L, et al. Using a Clinical Decision Support System to Improve Anticoagulation in Patients with Nonvalve Atrial Fibrillation in China’s Primary Care Settings: A Feasibility Study. Int J Clin Pract. 2023;2023:2136922. DOI:10.1155/2023/2136922.
19. Cox JL, Parkash R, Foster GA, et al; IMPACT-AF Investigators. Integrated Management Program Advancing Community Treatment of Atrial Fibrillation (IMPACT-AF): A cluster randomized trial of a computerized clinical decision support tool. Am Heart J. 2020;224:35-46. DOI:10.1016/j.ahj.2020.02.019.
20. van Doorn S, Rutten FH, O’Flynn CM, et al. Effectiveness of CHA2DS2-VASc based decision support on stroke prevention in atrial fibrillation: A cluster randomised trial in general practice. Int J Cardiol. 2018; 273:123-129. DOI:10.1016/j.ijcard.2018.08.096.
21. Karlsson LO, Nilsson S, Bång M, et al. A clinical decision support tool for improving adherence to guidelines on anticoagulant therapy in patients with atrial fibrillation at risk of stroke: A cluster-randomized trial in a Swedish primary care setting (the CDS-AF study). PLoS Med. 2018;15(3):e1002528. DOI:10.1371/journal.pmed.1002528.
22. Sakurai R, Ohe K. Effects of Computerized Guideline-Oriented Clinical Decision Support System on Antithrombotic Therapy in Patients with Atrial Fibrillation: A Systematic Review and Meta-Analysis. Stud Health Technol Inform. 2019;264:768-772. DOI:10.3233/SHTI190327.
23. Arts DL, Abu-Hanna A, Medlock SK, van Weert HC. Effectiveness and usage of a decision support system to improve stroke prevention in general practice: A cluster randomized controlled trial. PLoS One. 2017;12(2):e0170974. DOI:10.1371/journal.pone.0170974.
24. Eckman MH, Lip GY, Wise RE, et al. Impact of an Atrial Fibrillation Decision Support Tool on thromboprophylaxis for atrial fibrillation. Am Heart J. 2016;176:17-27. DOI:10.1016/j.ahj.2016.02.009.
25. Пономаренко А. В., Кривошеев Ю. С., Михеенко И. Л., и др. Поиск потенциальных факторов, ассоциированных с неуспехом катетерной аблации фибрилляции предсердий. Ретроспективный анализ электронных медицинских карт при помощи сервиса поддержки принятия врачебных решения (исследование СЕЛЕКТ ФП). Кардиологический вестник. 2023;18(2):35-42. DOI:10.17116/Cardiobulletin20231802135.
26. Packer DL, Mark DB, Robb RA et al. Effect of Catheter Ablation vs Antiarrhythmic Drug Therapy on Mortality, Stroke, Bleeding, and Cardiac Arrest Among Patients With Atrial Fibrillation: The CABANA Randomized Clinical Trial. JAMA. 2019;321(13):1261-1274. DOI:10.1001/jama.2019.0693.
27. Stacy J, Kim R, Barrett C, et al. Qualitative Evaluation of an Artificial Inteligence-Based Clinical Decision Support System to Guide Rhythm Management of Atrial Fibrillation: Survey Study. JMIR Form Res. 2022;6(8):e36443. DOI:10.2196/36443.
28. Backman R, Bayliss S, Moore D, Litchfield I. Clinical reminder alert fatigue in healthcare: a systematic literature review protocol using qualitative evidence. Syst Rev. 2017;6(1):255. DOI:10.1186/s13643-017-0627-z.
29. Litchfield I. Clinical reminder alert fatigue in healthcare: a systematic literature review using qualitative evidence. The Annals of Family Medicine. 2023;21(Suppl 3):5499. DOI:10.1370/afm.22.s1.5499.
30. Wright A, Hickman TT, McEvoy D, et al. Analysis of clinical decision support system malfunctions: a case series and survey. J Am Med Inform Assoc. 2016;23(6):1068-1076. DOI:10.1093/jamia/ocw005.
Об авторах
А. В. ПономаренкоРоссия
Пономаренко Андрей Викторович - заведующий лабораторией технологий управления здоровьем в ИХБФМ СО РАН; врач сердечно сосудистый хирург, аритмолог, директор по науке и развитию в ЦНМТ.
Новосибирск
А. Д. Гаврилко
Россия
Гаврилко Артем Дмитриевич - врач по рентгенэндоваскулярным диагностике и лечению ОКБ №1; ассистент кафедры кардиологии и кардиохирургии с курсом СМП ТюмГМУ МЗ РФ.
Тюмень
А. А. Гартунг
Россия
Гартунг Анна Андреевна - врач-кардиолог, эксперт по медицине.
Новосибирск
М. С. Полякова
Россия
Полякова Мария Сергеевна – студент, Институт клинической медицины.
Тюмень
А. А. Оганесян
Россия
Оганесян Анна Артуровна - студент, Институт клинической медицины.
Тюмень
К. С. Бенимецкая
Россия
Бенимецкая Ксения Сергеевна - врач кардиолог, к.м.н., медицинский директор ООО “Медикбук”; старший преподаватель Кафедры внутренних болезней Института медицины и психологии им. В. Зельмана, НГУ
Новосибирск
Д. В. Лосик
Россия
Лосик Денис Владимирович - научный руководитель.
Новосибирск
С. В. Шалаев
Россия
Шалаев Сергей Васильевич - д.м.н., заведующий кафедрой кардиологии и кардиохирургии с курсом СМП ТюмГМУ МЗ РФ, профессор, член-корреспондент РАН.
Тюмень
Дополнительные файлы
Рецензия
Для цитирования:
Пономаренко А.В., Гаврилко А.Д., Гартунг А.А., Полякова М.С., Оганесян А.А., Бенимецкая К.С., Лосик Д.В., Шалаев С.В. Клиническое применение сервисов поддержки принятия врачебных решений при ведении пациентов с фибрилляцией предсердий. Рациональная Фармакотерапия в Кардиологии. 2024;20(4):468-477. https://doi.org/10.20996/1819-6446-2024-3062. EDN: UBFTZZ
For citation:
Ponomarenko A.V., Gavrilko A.D., Gartung A.A., Poliakova M.S., Oganesyan A.A., Benimetskaya K.S., Losik D.V., Shalaev S.V. Clinical application of clinical decision support systems in the management of patients with atrial fibrillation. Rational Pharmacotherapy in Cardiology. 2024;20(4):468-477. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3062. EDN: UBFTZZ

















































