Перейти к:
Выраженная гипертрофия и фиброз миокарда у пациента с акромегалией: нужна ли профилактика внезапной сердечной смерти?
https://doi.org/10.20996/1819-6446-2024-3063
EDN: XOJKNT
Аннотация
Анализ наиболее частых причин смертности при акромегалии указывает, что подавляющее большинство (около 60%) больных погибают от сердечно-сосудистых заболеваний, к которым также относятся нарушения ритма и проводимости сердца и развитие внезапной сердечной смерти (ВСС). В статье представлено клиническое наблюдение, посвященное вопросу профилактики ВСС у пациента с акромегалией. У больного при обследовании были выявлены предикторы ВСС: выраженная гипертрофия левого желудочка, отсроченное накопление контраста по данным магнитно-резонансной томографии сердца, снижение систолической функции миокарда левого желудочка по эхокардиографии, желудочковые нарушений ритма, зарегистрированные при холтеровском мониторировании электрокардиограммы, сердечная недостаточность. Пациенты с акромегалией подвержены более высокому риску развития нарушений ритма и проводимости сердца за счет формирования акромегалической кардиомиопатии: гипертрофии левого желудочка, диастолической и систолической дисфункции, миокардиальному фиброзу и как следствие электрической нестабильности миокарда. Основной сложностью является отсутствие клинических рекомендаций для ведения такой группы пациентов. Существующие рекомендации не отображают возможность применения стандартного алгоритма для пациентов с акромегалией, не учитывают выраженную гипертрофию левого желудочка, как фактор риска ВСС у больных без генетически детерминированной гипертрофической кардиомиопатии.
Ключевые слова
Для цитирования:
Алмасханова А.А., Мелкозёров К.В., Пржиялковская Е.Г., Тарбаева Н.В., Кошарная Р.С., Гомова И.С., Алфёрова П.А., Рожинская Л.Я., Калашников В.Ю., Белая Ж.Е., Мельниченко Г.А., Мокрышева Н.Г. Выраженная гипертрофия и фиброз миокарда у пациента с акромегалией: нужна ли профилактика внезапной сердечной смерти? Рациональная Фармакотерапия в Кардиологии. 2024;20(3):349-356. https://doi.org/10.20996/1819-6446-2024-3063. EDN: XOJKNT
For citation:
Almaskhanova A.A., Melkozerov K.V., Przhiyalkovskaya E.G., Tarbaeva N.V., Kosharnaia R.S., Gomova I.S., Alferova P.A., Rozhinskaya L.Ya., Kalashnikov V.Y., Belaya Zh.E., Melnichenko G.A., Mokrysheva N.G. Severe myocardial hypertrophy and fibrosis in a patient with acromegaly: is the prevention of sudden cardiac death needed? Rational Pharmacotherapy in Cardiology. 2024;20(3):349-356. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3063. EDN: XOJKNT
Введение
Развитие внезапной сердечной смерти (ВСС) в результате злокачественного течения аритмий — серьезная проблема здравоохранения, на ВСС приходится половина всех случаев смерти от сердечно-сосудистых заболеваний во всем мире [1]. Профилактика ВСС чрезвычайно ограничена из-за невозможности в настоящее время убедительно предсказать риск ее развития, а также множества сопутствующих факторов, которые этот риск могут увеличивать.
Акромегалия — редкое нейроэндокринное заболевание, которое сопровождается гиперсекрецией гормона роста (соматотропный гормон, СТГ) и инсулиноподобного фактора роста 1 (ИФР-1). В 95% случаев заболевание связано с аденомой гипофиза чистой или смешанной секреции, но очень редко может возникать из-за эктопической продукции СТГ [2]. Для акромегалии характерны специфические изменения черт лица, увеличение кистей, стоп и утолщение мягких тканей.
Хирургическое лечение остается методом выбора для большинства пациентов с акромегалией, поскольку приводит к немедленной ремиссии заболевания, однако эффективность оперативного вмешательства составляет около 50%, поэтому половина пациентов нуждается в последующем проведении консервативного лечения [3]. В случае отсутствия ремиссии на фоне медикаментозного лечения может применяться лучевая терапия, обладающая меньшей эффективностью и сопровождающаяся развитием целого ряда побочных эффектов, включая гипопитуитаризм, цереброваскулярные заболевания и вторичные злокачественные новообразования головного мозга.
Из-за медленного прогрессирования акромегалия часто диагностируется не ранее, чем через 4-10 лет после начала заболевания. Так как от начала заболевания до момента постановки диагноза акромегалии проходит длительное время, за этот период пациенты чаще всего уже приобретают ряд сопутствующих осложнений (сердечно-сосудистых, респираторных, метаболических ревматологических), совокупность которых помимо основного механизма, связанного с гиперпродукцией СТГ является дополнительным фактором риска развития нарушений ритма и проводимости сердца (НРПС) [3].
Гиперсекреция СТГ и ИФР-1 инициирует сложный сигнальный каскад и вызывает изменения кардиомиоцитов, что приводит к развитию акромегалической кардиомиопатии, которая сопровождается концентрической бивентрикулярной гипертрофией за счет увеличения ширины сердечных миоцитов и близкого расположения саркомеров [4].
Наиболее значимыми гистологическими изменениями являются повышенное отложение внеклеточного коллагена, миофибриллярные нарушения, участки некроза моноцитарных клеток и лимфомононуклеарной инфильтрации; каждый компонент постепенно нарушает архитектуру всего миокарда и приводит к диастолической и систолической дисфункции, клапанной регургитации [1][4].
Анализ наиболее частых причин смертности указывает, что подавляющее большинство (около 60%) больных акромегалией погибают от сердечно-сосудистых заболеваний, к которым также относятся НРПС и развитие ВСС, 25% — от болезней органов дыхания и 15% — от злокачественных новообразований [5].
У пациентов с акромегалией преобладают гипертрофия левого желудочка (ГЛЖ) и нарушение диастолической функции, особенно у пожилых пациентов с длительно существующим заболеванием [2]. Миокардиальный интерстициальный диффузный фиброз, развившийся на фоне акромегалии, является важным фактором в формировании электрической нестабильности миокарда и как следствие развития НРПС. Аритмии могут выявляться у 20-40% больных акромегалией и являться основной причиной ВСС. НРПС наиболее часто проявляется желудочковой экстрасистолией, пароксизмальной формой фибрилляции предсердий, пароксизмальной наджелудочковой тахикардией, синдромом слабости синусового узла, желудочковой тахикардией и блокадой ножки пучка Гиса. Злокачественная желудочковая тахиаритмия может быть причиной обмороков и ВСС у пациентов с акромегалией [6].
Желудочковые нарушения ритма являются основной причиной ВСС и представляют наибольшую опасность и сложность выявления [7]. Число случаев ВСС варьируется от 1,4 на 100 тыс человеко-лет (95% доверительный интервал (ДИ) 0,95-1,98) у женщин и до 6,68 на 100 тыс. человеко-лет (95% ДИ 6,24-7,14) у мужчин. Оценка точной распространенность ВСС в России затруднена, примерная доля во всех возрастных группах составляет 49,1% (123,3 на 100 тыс. населения в год) [7].
В данной публикации представлено описание клинического наблюдения пациента с акромегалией, выраженной гипертрофией, фиброзом миокарда и желудочковыми нарушениями ритма сердца.
Описание клинического случая
Пациент Н., 54 лет был госпитализирован в Национальный медицинский исследовательский центр эндокринологии Минздрава России. Пациент добровольно подписал информированное согласие на публикацию персональной медицинской информации в обезличенной форме в журнале "Рациональная Фармакотерапия в Кардиологии".
При поступлении у пациента имелись жалобы на повышение артериального давления (АД) до 220/160 мм рт.ст., наблюдаемые более 10 лет, одышку при физической нагрузке, эпизоды остановки дыхания во сне, храп, изменение внешности, боль в коленных суставах, потливость, общую слабость.
Приблизительно с возраста 43 лет у пациента появились первые признаки болезни в виде изменения внешности: укрупнение носа, губ, ушей, языка, увеличение размера стоп и кистей. Впервые акромегалия заподозрена терапевтом почти через 10 лет после первых признаков проявления заболевания. Далее пациент был направлен в областную клиническую больницу по месту жительства, где при обследования диагностирована активная стадия акромегалии — ИФР-1 711 нг/мл (норма до 280 нг/мл), СТГ в ходе глюкозотолерантного теста (0 мин — 20,9 нг/мл, 30 мин — 13,3 нг/мл, 60 мин — 11,7 нг/мл, 120 мин — 22,8 нг/мл). Учитывая данные магнитно-резонансной томографии (МРТ) головного мозга с контрастированием (гипофиз 11×9×15 мм, неоднородной структуры за счет гипоинтенсивного участка округлой формы диаметром 7-8 мм, воронка гипофиза умеренно смещена вправо, хиазма не изменена), рекомендовано оперативное лечение.
У пациента длительный анамнез артериальной гипертензии (АГ), более 10 лет повышение АД до 220/160 мм. рт.ст. Отмечались изменения на электрокардиограмме (ЭКГ): признаки выраженной гипертрофии миокарда, отрицательные зубцы Т, предположительно, на основании зарегистрированной ЭКГ был поставлен диагноз постинфарктного кардиосклероза. Эхокардиографическое (ЭхоКГ) исследование не проводилось, контроль АД не осуществлялся. Регулярно принимал антигипертензивную терапию: периндоприл 8 мг утром, бисопролол 2,5 мг утром, лерканидипин 10 мг вечером, ацетилсалициловая кислота 50 мг вечером, аторвастатин 20 мг вечером.
При госпитализации в Национальный медицинский исследовательский центр эндокринологии на момент поступления обращали на себя внимание акромегалоидные черты лица: укрупненный нос, уши, губы, надбровные дуги, макроглоссия, диастема, выраженная складчатость кожи волосистой части головы, увеличенные стоп и кистей. Периферических отёков не наблюдалось. При антропометрическом измерении: вес 103 кг, рост 180 см, индекс массы тела — 31,8 кг/м2. Уровень АД был повышен до 170/100 мм рт.ст. Аускультативная картина сердца без особенностей, частота сердечных сокращений 75 в минуту. Частота дыхания и сатурация были в норме, хрипы в лёгких не выслушивались. При осмотре живота выявлено увеличение размеров печени. При тесте с 6 минутной ходьбой, пациентом пройдено 410 метров.
За период госпитализации подтверждена активная стадия акромегалии: ИФР 1 825,9 нг/мл (норма до 280), СТГ 5,74 нг/мл (норма до 1,23). Данных за нарушение углеводного обмена и функции щитовидной железы, а также за иные гормональные нарушения выявлено не было.
При МРТ головного мозга выявлено ассиметричное расположение гипофиза со следующими размерами (вертикальный — права 5 мм, слева 9,5 мм, поперечный 17 мм, переднезадний — 12 мм). Расположение воронки по средней линии. В левой части гипофиза имелось объемное образование неоднородной структуры, размерами 7×9×8 мм, образование деформировало медиальную стенку левого кавернозного синуса. Таким образом подтверждена эндоселлярная аденома гипофиза с тенденцией к инфра- и параселлярному распространению. Пациент консультирован нейрохирургом — рекомендовано выполнение трансназального транссфеноидального удаления аденомы гипофиза.
В ходе предоперационной подготовки на ЭКГ выявлены признаки ГЛЖ (SV1 26 мм, R V6 36 мм (индекс Соколова-Лайона = 62 мм), R I более 100 мм, отрицательные зубцы ТV2-V6, RI + SIII > 20 мм; снижение сегмента ST1 >0,5 мм при RI > SI) (рис. 1), в тоже время не исключалось наличие очаговых изменений в миокарде ЛЖ.
Во время суточного мониторирования ЭКГ на фоне синусового ритма в ночные и утренние часы зарегистрировано 6 эпизодов желудочковой тахикардии (рис. 2), длительностью до 8 комплексов. Признаков дисфункции синусового узла и предсердно-желудочкового узла не выявлено, средняя частота сердечных сокращений составила 72 уд./мин.
При ЭхоКГ подтверждена выраженная ГЛЖ (рис. 3), преимущественно за счет межжелудочковой перегородки, верхушки и боковой стенки ЛЖ — толщина межжелудочковой перегородки составила 39 мм. Масса миокарда 720 г. Признаков обструкции выносящего тракта не обнаружено — средний градиент давления составил 17 мм рт.ст. (норма до 25 мм рт.ст.). Объём левого предсердия 87 мл (до 52 мл). Правые камеры сердца не расширены. Нарушения локальной сократимости не выявлено, глобальная систолическая функция незначительно снижена: фракция выброса (ФВ) составила 48%. Вместе с тем, глобальная продольная деформация миокарда ЛЖ была существенно снижена до — 7% (рис. 4), наблюдалось нарушение диастолической функции 2 степени. Определялась умеренная недостаточность аортального клапана, митральная и трикуспидальная регургитация от умеренной до средней степени.
Уровень N-концевого пропептида натриуретического гормона (В-типа) был повышен до 291 пг/мл (норма 0-125 пг/мл).
При коронароангиографии выявлено увеличение диаметра левой коронарной артерии до 6 мм и правой коронарной артерии до 8 мм, признаки атеросклероза без значимого сужения коронарных артерий (рис. 5). Проведена МРТ сердца, выявлено утолщение миокарда ЛЖ до 40 мм, очаговое и диффузное отсроченное накопление контраста миокардом ЛЖ (рис. 6).
Для исключения наличия генетически-детерминированной гипертрофии миокарда пациенту проведено генетическое тестирование — были исследованы таргетные области генов ACTC1, DES, FLNC, GLA, LAMP2, MYBPC3, MYH7, MYL2, MYL3, PLN, PRKAG2, PTPN11, TNNC1, TNNI3, TNNT2, TPM1, TTR, мутаций в которых не выявлено.
Таким образом, в ходе обследования диагноз ишемической болезни сердца исключен. Было установлено, что изменения миокарда наиболее вероятно обусловлены акромегалической кардиомиопатией.
Назначена медикаментозная терапия с целью нормализации показателей АД и гиперлипидемии: периндоприл 10 мг утром, торасемид 5 мг утром, нифедипин, таблетки с модифицированным высвобождением 60 мг утром и 30 мг вечером, бисопролол 2,5 мг утром, аторвастатин 40 мг вечером. На фоне проводимой терапии уровень АД нормализовался, несколько увеличилась толерантность к физической нагрузке. После чего пациенту проведена трансназальная, транссфеноидальная аденомэктомия. После хирургического лечения отмечалась ремиссия акромегалии: уровень ИФР-1 248 нг/мл (норма до 280 нг/мл) и СТГ в ходе глюкозотолерантного теста (подавление менее 1 нг/мл во всех 5 точках), признаков гипопитуитаризма в послеоперационном периоде отмечено не было.
Пациент выписан с рекомендациями продолжить приём лекарственных препаратов, наблюдаться у кардиолога и эндокринолога, провести полисомнографию, холтеровское мониторирование ЭКГ и ЭхоКГ через 1 месяц.
Известно, что через четыре года после выписки из стационара (при телефонном контакте) пациент был жив, госпитализаций не было. От предложенного осмотра и обследования пациент отказался.
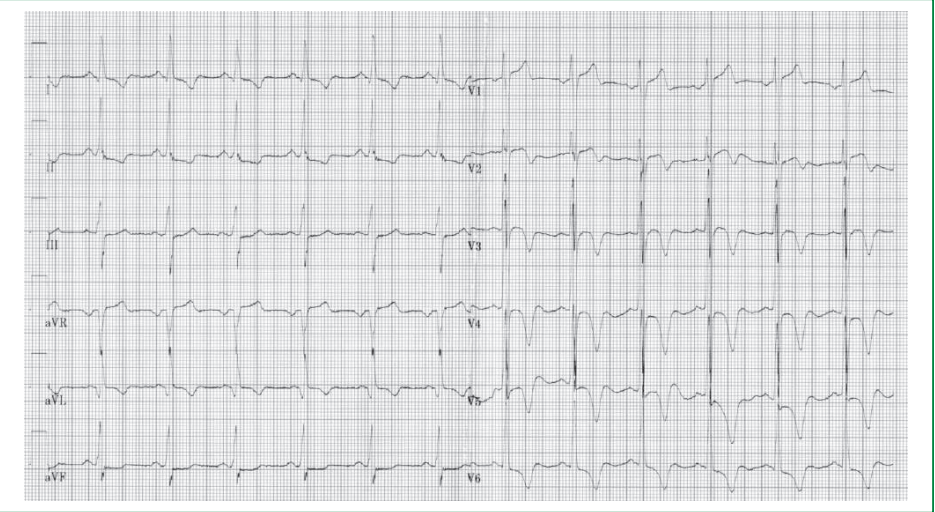
Рисунок 1. Электрокардиограмма, признаки гипертрофии миокарда ЛЖ
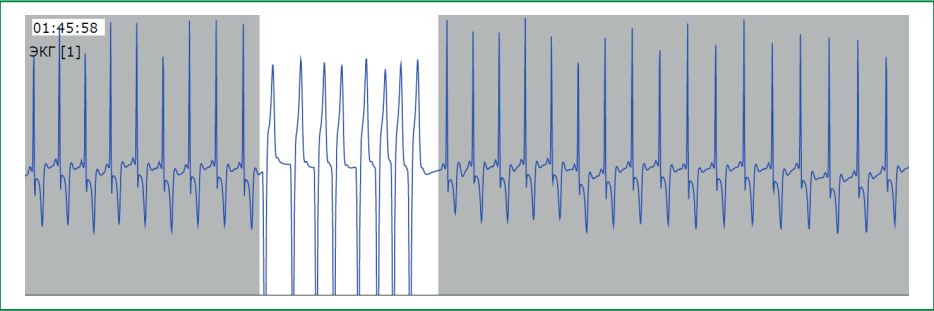
Рисунок 2. Фрагмент желудочковой тахикардии при холтеровском мониторировании ЭКГ
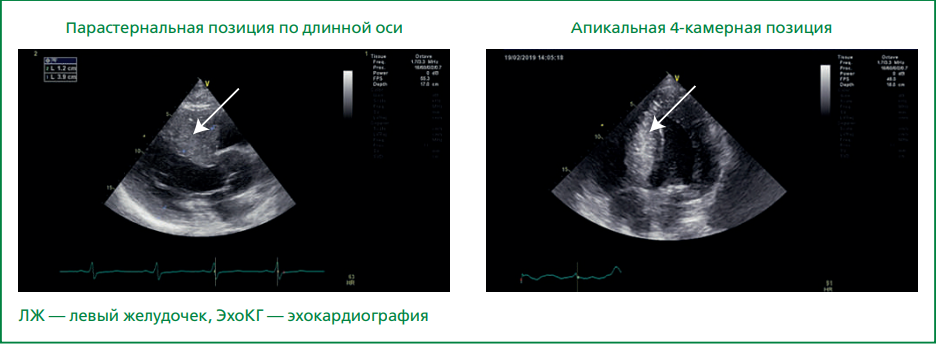
Рисунок 3. Признаки выраженной гипертрофии миокарда ЛЖ по данным ЭхоКГ, толщина межжелудочковой перегородки 39 мм (белыми стрелками указана гипертрофированная межжелудочковая перегородка)
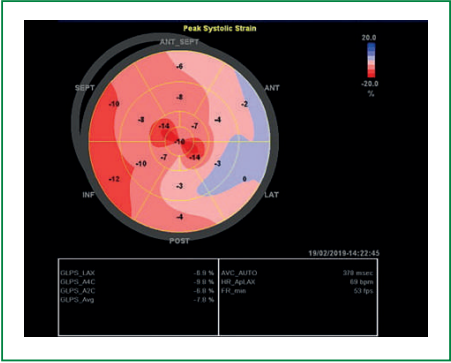
Рисунок 4. ЭхоКГ. Показатель глобальной продольной деформации ЛЖ снижен
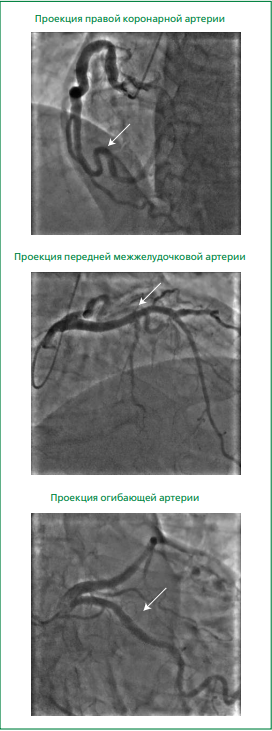
Рисунок 5. Коронароангиография. Признаки атеросклероза без гемодинамически значимого сужения коронарных артерий
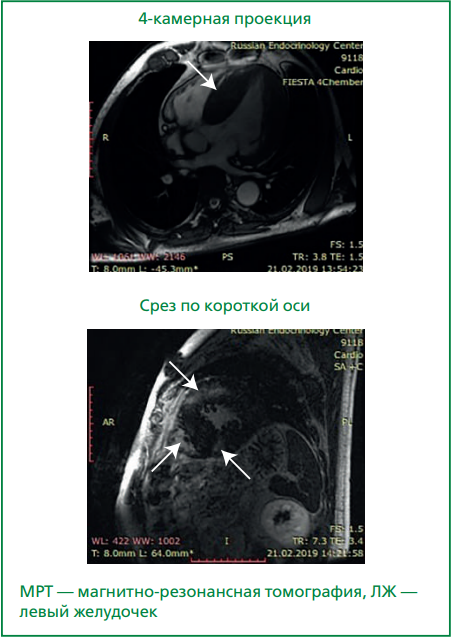
Рисунок 6. МРТ сердца. Гипертрофия миокарда и признаки миокардиального фиброза ЛЖ
Обсуждение
Основа лечения и профилактики осложнений акромегалии — удаление аденомы гипофиза и нормализации уровня СТГ и ИРФ-1 [3]. В то же время, имеются литературные данные, что несмотря на нормализацию уровня СТГ и ИРФ-1, у больных с акромегалией существует высокий риск развития сердечно-сосудистых событий, в том числе фатальных нарушений ритма и ВСС [8][9].
В литературе встречаемость НРПС у пациентов с акромегалией составляет от 7 до 40%. Такая широкая вариабельность выявления аритмий, вероятно, связана с небольшой статистической мощностью проводимых исследований и коротким периодом наблюдения [10]. Несмотря на большое количество литературных обзоров, посвященных оценке риска развития НРПС при акромегалии, остаются открытыми вопросы, связанные с распространенностью аритмий и предикторами риска ВСС. E. A. Rodrigues и соавт. удалось провести анализ 34 больных акромегалией [11]. У 14 из 34 пациентов имелись аритмии, однако у одного пациента была диагностирована ишемическая болезнь сердца, что и могло послужить причиной развития нескольких эпизодов симптоматической желудочковой тахикардии. У 13 пациентов наблюдались частые желудочковые экстрасистолы и у 1 пациента продолжительный период регистрировалась асимптоматическая желудочковая бигеминия. Авторы выявили закономерность более частого выявления аритмий у больных с ГЛЖ и перегрузкой ЛЖ при наличии неизменённых коронарных артерий.
В одно из исследований G. Kahaly и соавт. было включено тридцать два пациента с акромегалией. Выявлено, что распространенность желудочковых аритмий была значительно выше у больных акромегалией по сравнению с контрольной группой (15/32 (48%) и 6/50 (12%), соответственно, p<0,01) [12].
Наше исследование, посвященное НРПС у пациентов с акромегалией, предварительные данные которого были опубликованы в 2020 г, продемонстрировало высокую встречаемость аритмии у пациентов данной группы — более 40% [13]. Кроме того, у 61% больных с НРПС выявлялось отсроченное накопление контраста по данным МРТ сердца, ввиду чего можно предположить связь между наличием диффузного фиброза и риском развития НРПС у пациентов с акромегалией.
В представленном наблюдении наличие у больного выраженной гипертрофии миокарда, неустойчивой желудочковой тахикардии и отсроченного накопления контраста миокардом по данным МРТ, согласно действующим на то время клиническим рекомендациям, было недостаточно для проведения первичной профилактики ВСС — имплантации кардиовертера-дефибриллятора (ИКД) [7][14]. В то же время, при оценке риска ВСС по шкале, разработанной для больных с гипертрофической кардиомиопатией (ГКМП) (HCM Risc-SCD) результат составил 4,17% в течение пяти лет, в связи с чем следовало бы рассмотреть ИКД 1. Однако, мы не получили данных за ГКМП по результатам генетического типирования, а влияние на прогноз жизни толщины миокарда ЛЖ у больных акромегалией не определено.
У данного больного при обследовании были выявлены специфические предикторы ВСС: выраженная ГЛЖ, отсроченное накопление контраста по данным МРТ сердца, снижение систолической функции миокарда ЛЖ по ЭхоКГ, желудочковые нарушений ритма, зарегистрированные на холтеровском мониторе ЭКГ, сердечная недостаточность. Уровень N-концевого пропептида натрийуретического гормона (В-типа) был повышен, однако интерпретация его у больных с акромегалией может быть затруднена, т.к. по результатам описания различных клинических наблюдений данные о его уровне у пациентов с акромегалией расходятся. Выраженность ГЛЖ нашего пациента не позволяла рассматривать АГ в качестве основной причины её развития. В литературных источниках имеются сведения о том, что ГЛЖ может развиваться у больных акромегалией независимо от наличия АГ [15]. По результатам метаанализа, проведенного X. Guo и соавт., было отмечено, что гипертрофия желудочков встречается у 90% больных акромегалией с длительным течением заболевания и может достигать 70% у пациентов без АГ [15]. Возникновение гипертрофии миокарда у больных без АГ и метаболических нарушений свидетельствует о специфической акромегалической кардиомиопатии, обусловленной прямым влиянием избытка СТГ на сердце.
ИКД может быть использован для первичной профилактики ВСС при ишемической и неишемической кардиомиопатии. С целью определения критериев для ИКД широко используется показатель фракции выброса ЛЖ, однако применение только этого параметра имеет низкую специфичность в отношении выбора группы пациентов для профилактической ИКД. Кроме того, подавляющее большинство ВСС происходит у пациентов с сохранной ФВ [7][14].
В 2022 г. были опубликованы новые рекомендации по профилактике ВСС с гипокинетической недилатационной кардиомиопатией [14]. Так, при снижении ФВ <50% и при 2 и более факторах риска (синкопы, отсроченное накопление контраста при МРТ, индуцированная устойчивая мономорфная желудочковая тахикардия при внутрисердечном электрофизиологическом исследовании, мутации в генах LMNA, PLN, FLNC и RBM следует рассмотреть ИКД [14].
Данные рекомендации по профилактике ВСС не отображают возможность применения такого алгоритма у больных акромегалией, не учитывают выраженную ГЛЖ, как фактор риска ВСС у больных без ГКМП, и требуют проведения нерутинных обследований, таких как МРТ сердца и внутрисердечного электрофизиологического исследования.
Заключение
Клинический случай демонстрирует выраженную ГЛЖ, что встречается достаточно редко, в том числе у больных акромегалией. Представленная структурная патология сердца потенциально может увеличивать риск ВСС. В тоже время, влияние таких изменений миокарда на прогноз не определено. Исключением является ГКМП, данных за наличие которой у пациента в клиническом случае не получено. Учитывая сложность проведения профилактики ВСС, перспективой является определение критериев стратификации высокого и низкого риска развития ВСС для больных акромегалией, в том числе со значимой ГЛЖ, что требует проспективных исследований и длительного наблюдения.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
1 https://professional.heart.org/en/guidelines-and-statements/hcm-risk-calculator
Список литературы
1. Zaman S, Goldberger JJ, Kovoor P. Sudden Death Risk-Stratification in 2018-2019: The Old and the New. Heart Lung Circ. 2019;28(1):57-64. DOI:10.1016/j.hlc.2018.08.027.
2. Sharma MD, Nguyen AV, Brown S, Robbins RJ. Cardiovascular Disease in Acromegaly. Methodist Debakey Cardiovascular J. 2017;13(2):64-7. doi:10.14797/mdcj-13-2-64.
3. Gadelha MR, Kasuki L, Lim DS, Fleseriu M. Systemic complications of acromegaly and the impact of the current treatment landscape: an update. Endocr Rev. 2019;40(1):268-332. DOI:10.1210/er.2018-00115.
4. Sharma AN, Tan M, Amsterdam EA, Singh GD. Acromegalic cardiomyopathy: Epidemiology, diagnosis, and management. Clin Cardiol. 2018;41(3):419-25. DOI:10.1002/clc.22867.
5. Colao A, Ferone D, Marzullo P, Lombardi G. Systemic complications of acromegaly: epidemiology, pathogenesis, and management. Endocr Rev. 2004;25(1):102-52. DOI:10.1210/er.2002-0022.
6. Arias MA, Pachón M, Rodríguez-Padial L. Ventricular tachycardia in acromegaly. Rev Port Cardiol. 2011;30(2):223-6.
7. Лебедев Д. С., Михайлов Е. Н., Неминущий Н. М., и др. Желудочковые нарушения ритма. Желудочковые тахикардии и внезапная сердечная смерть. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(7):4600. DOI:10.15829/1560-4071-2021-4600.
8. Yokota F, Arima H, Hirano M, et al. Normalisation of plasma growth hormone levels improved cardiac dysfunction due to acromegalic cardiomyopathy with severe fibrosis. BMJ Case Rep. 2010;2010:bcr1220092559. DOI:10.1136/bcr.12.2009.2559.
9. An Z, He YQ, Liu GH, et al. Malignant ventricular tachycardia in acromegaly: a case report. Sao Paulo Med J. 2015;133(1):55-9. DOI:10.1590/1516-3180.2012.6410005.
10. Parolin M, Dassie F, Vettor R, et al. Electrophysiological features in acromegaly: re-thinking the arrhythmic risk? J Endocrinol Invest. 2021;44(2):209-21. DOI:10.1007/s40618-020-01343-0.
11. Rodrigues EA, Caruana MP, Lahiri A, et al. Subclinical cardiac dysfunction in acromegaly: evidence for a specific disease of heart muscle. Br Heart J. 1989;62(3):185-94. DOI:10.1136/hrt.62.3.185.
12. Kahaly G, Olshausen KV, Mohr-Kahaly S, et. al. Arrhythmia profile in acromegaly. Eur Heart J. 1992;13(1):51-6. DOI:10.1093/oxfordjournals.eurheartj.a060047.
13. Мелкозёров К. В., Пржиялковская Е. Г., Тарбаева Н. В. и др. Нарушение ритма и проводимости сердца у больных акромегалией: роль магнитно-резонансной томографии сердца. Терапевтический Архив. 2020;92(10):70-7. DOI:10.26442/00403660.2020.10.000787.
14. Zeppenfeld K, Tfelt-Hansen J, de Riva M, et al; ESC Scientific Document Group. 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Eur Heart J. 2022;43(40):3997-4126. DOI:10.1093/eurheartj/ehac262.
15. Guo X, Fu H, Pang H, Xing B. Risk of left ventricular hypertrophy and diastolic and systolic dysfunction in Acromegaly: A meta-analysis. J Clin Neurosci. 2018;48:28-33. DOI:10.1016/j.jocn.2017.10.067.
Об авторах
А. А. АлмасхановаРоссия
Алмасханова Алина Анатольевна - врач−эндокринолог общеклинического отделения ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России.
Москва
К. В. Мелкозёров
Россия
Мелкозёров Константин Владимирович.
Москва
Е. Г. Пржиялковская
Россия
Пржиялковская Елена Георгиевна.
Москва
Н. В. Тарбаева
Россия
Тарбаева Наталья Викторовна.
Москва
Р. С. Кошарная
Россия
Кошарная Раиса Станиславовна.
Москва
И. С. Гомова
Россия
Гомова Ирина Сергеевна.
Москва
П. А. Алфёрова
Россия
Алфёрова Полина Андреевна.
Москва
Л. Я. Рожинская
Россия
Рожинская Людмила Яковлевна.
Москва
В. Ю. Калашников
Россия
Калашников Виктор Юрьевич.
Москва
Ж. Е. Белая
Россия
Белая Жанна Евгеньевна.
Москва
Г. А. Мельниченко
Россия
Мельниченко Галина Афанасьевна.
Москва
Н. Г. Мокрышева
Россия
Мокрышева Наталья Георгиевна.
Москва
Рецензия
Для цитирования:
Алмасханова А.А., Мелкозёров К.В., Пржиялковская Е.Г., Тарбаева Н.В., Кошарная Р.С., Гомова И.С., Алфёрова П.А., Рожинская Л.Я., Калашников В.Ю., Белая Ж.Е., Мельниченко Г.А., Мокрышева Н.Г. Выраженная гипертрофия и фиброз миокарда у пациента с акромегалией: нужна ли профилактика внезапной сердечной смерти? Рациональная Фармакотерапия в Кардиологии. 2024;20(3):349-356. https://doi.org/10.20996/1819-6446-2024-3063. EDN: XOJKNT
For citation:
Almaskhanova A.A., Melkozerov K.V., Przhiyalkovskaya E.G., Tarbaeva N.V., Kosharnaia R.S., Gomova I.S., Alferova P.A., Rozhinskaya L.Ya., Kalashnikov V.Y., Belaya Zh.E., Melnichenko G.A., Mokrysheva N.G. Severe myocardial hypertrophy and fibrosis in a patient with acromegaly: is the prevention of sudden cardiac death needed? Rational Pharmacotherapy in Cardiology. 2024;20(3):349-356. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3063. EDN: XOJKNT

















































