Перейти к:
Баксдростат и финеренон: новые ингибиторы гормональной системы альдостеронсинтаза-альдостерон-минералокортикоидный рецептор для лекарственной терапии резистентной артериальной гипертензии
https://doi.org/10.20996/1819-6446-2024-3064
EDN: KAQZDN
Аннотация
Резистентная артериальная гипертензия (АГ) характеризуется отсутствием контроля целевого артериального давления (АД), несмотря на длительный прием оптимальных или максимально переносимых доз трех разных антигипертензивных препаратов, включая диуретик. Пациенты с резистентной АГ входят в группу лиц с высоким риском сердечно-сосудистых и почечных осложнений, включая ускоренное прогрессирование хронической болезни почек с более быстрым переходом ее в конечную стадию заболевания. В основе резистентной АГ лежит чувствительная к соли, объем-зависимая форма АГ, которая обычно протекает на фоне повышенной продукции альдостерона и нормальной или даже сниженной активности ренина плазмы крови. Ключевую роль в ее формировании играет увеличение реабсорбции натрия в почках, связанное с избыточной активностью чувствительных к альдостерону эпителиальных натриевых каналов (epithelial sodium channel, ENaC), контролирующих реабсорбцию этого иона в дистальных сегментах нефрона. Предполагается, что в этом патологическом процессе, помимо альдостерона, участвует также малая Rho ГТФаза Rac1 — регуляторный G-белок, который может вступать в прямое лиганд-независимое взаимодействие с минералокортикоидными рецепторами, выполняя функцию мощного нестероидного активатора передачи их внутриклеточных сигналов. По данным контролируемых, рандомизированных клинических исследований, оптимальным четвертым препаратом для преодоления резистентности у таких пациентов является стероидный антагонист минералокортикоидных рецепторов (АМКР) спиронолактон. Однако включение этого препарата в антигипертензивную терапию не только не обеспечивает контроль АД у значительной части пациентов с резистентной АГ, но и существенно повышает риск развития гиперкалиемии, особенно у лиц с нарушенной функцией почек. В обзоре представлены данные об особенностях фармакодинамики и фармакокинетики новых ингибиторов гормональной системы альдостеронсинтаза-альдостерон-минералокортикоидный рецептор баксдростата и финеренона, а также результаты клинических исследований, посвященных оценке клинической эффективности и профиля безопасности этих препаратов у пациентов с резистентной АГ.
Ключевые слова
Для цитирования:
Кузьмин О.Б., Бучнева Н.В., Белянин В.В., Жежа В.В., Столбова М.В. Баксдростат и финеренон: новые ингибиторы гормональной системы альдостеронсинтаза-альдостерон-минералокортикоидный рецептор для лекарственной терапии резистентной артериальной гипертензии. Рациональная Фармакотерапия в Кардиологии. 2024;20(4):451-459. https://doi.org/10.20996/1819-6446-2024-3064. EDN: KAQZDN
For citation:
Kuzmin O.B., Buchneva N.V., Belyanin V.V., Zhezha V.V., Stolbova M.V. Baxdrostat and finerenone: new aldosterone synthase-aldosterone-mineralocorticoid receptor hormonal system inhibitors for the drug treatment of resistant arterial hypertension. Rational Pharmacotherapy in Cardiology. 2024;20(4):451-459. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3064. EDN: KAQZDN
Введение
Резистентная форма артериальной гипертензии (АГ) является клинической разновидностью неконтролируемой АГ, при которой соответствующие меры по ведению образа жизни и длительный прием оптимальных или максимально переносимых доз трех разных антигипертензивных препаратов, включая диуретик, не обеспечивают достижение целевого значения артериального давления (АД) <140/90 мм рт.ст., несмотря на подтвержденную приверженность лечению [1].
В популяции пациентов с АГ распространенность истинной резистентной АГ достигает 10,3%, с увеличением до 22,9% среди больных с АГ и хронической болезнью почек (ХБП) [2]. Пациенты с истинной резистентной АГ входят в группу лиц с высоким риском сердечно-сосудистых и почечных осложнений, включая ускоренное прогрессирование ХБП с более быстрым переходом ее в конечную стадию заболевания [3][4]. В связи с этим для достижения целевых значений АД у таких больных, особенно у лиц с ХБП и сахарным диабетом 2 типа (СД2), разрабатываются новые схемы лечения с добавлением к трем ранее используемым препаратам четвертого лекарственного средства, обладающего иным механизмом антигипертензивного действия.
Выявление ключевой роли нейрогормонального дисбаланса и, прежде всего, повышенной активности гормональной системы альдостеронсинтаза-альдостерон-минералокортикоидный рецептор в формировании солечувствительной, объем-зависимой резистентной АГ позволило разработать новые подходы к повышению эффективности лекарственной терапии этой популяции больных. Сравнение антигипертензивных эффектов стероидного антагониста минералокортикоидных рецепторов (АМКР) спиронолактона с доксазозином и некоторыми другими антиадренергическими средствами показало, что для контроля АД у лиц с резистентной АГ оптимальным четвертым препаратом является спиронолактон, который при назначении в дозе 25-50 мг/сут. позволяет достичь целевого уровня систолического АД <135 мм рт.ст. у 58% пациентов. Это положение, полученное в контролируемых, рандомизированных клинических исследованиях PATHWAY-2 и ReHOT [5][6], нашло отражение в современных рекомендациях по диагностике и ведению пациентов с АГ [1][7][8].
Между тем, включение стероидного АМКР спиронолактона в антигипертензивную терапию не обеспечивает достижение адекватного контроля АД у значительной части пациентов с резистентной АГ, участвовавших в исследовании PATHWAY-2 [5]. Длительный прием этого препарата в комбинации с ингибиторами ангиотензин-превращающего фермента (иАПФ) или заменяющими их блокаторами АТ1-ангиотензиновых рецепторов (БРА) связан также с высоким риском развития гиперкалиемии, особенно у лиц с выраженной ХБП [9][10]. Неблагоприятной особенностью спиронолактона является недостаточная селективность, которая клинически проявляется в гинекомастии и эректильной дисфункции у мужчин и нарушения менструального цикла у женщин, возникающих при блокаде стероидных рецепторов мужских и женских половых гормонов [9].
В данном нарративном обзоре представлены данные об особенностях фармакодинамики и фармакокинетики новых ингибиторов гормональной системы альдостеронсинтаза-альдостерон-минералокортикоидный рецептор баксдростата1 и финеренона, а также результаты клинических исследований, посвященных оценке клинической эффективности и профиля безопасности этих препаратов у пациентов с резистентной АГ.
Система альдостеронсинтаза-альдостерон-минералокортикоидный рецептор и почечные механизмы формирования солечувствительной резистентной АГ
Почки играют главную роль в патогенезе эссенциальной и различных форм вторичной АГ [11]. Одним из основных факторов, включающих почки в механизм формирования АГ, является нарушение прессорного натрийуреза, благодаря которому они выполняют функцию "баростата" сердечно-сосудистой системы, поддерживающего системное АД на уровне, необходимом для сохранения водно-солевого и циркуляторного гомеостаза организма. Воздействие на почки генетических, нейрогормональных и других факторов, увеличивающих реабсорбцию натрия в проксимальном и других отделах нефрона, ведет к подавлению этого механизма и компенсаторному сдвигу кривой "перфузионное давление/натрийурез" в сторону повышенного АД. Благодаря этому в сердечно-сосудистой системе устанавливается новый, более высокий уровень АД, способствующий восстановлению способности почек поддерживать в организме адекватный баланс натрия и объем внеклеточной жидкости [12-14].
Клинические данные свидетельствуют о том, что в основе резистентной АГ лежит чувствительная к соли, объем-зависимая форма АГ, которая обычно протекает на фоне повышенной продукции альдостерона, сохранения гиперактивности симпатической нервной системы и нормальной или даже сниженной активности ренина плазмы [14]. У пациентов с резистентной АГ, несмотря на длительную терапию иАПФ/БРА и диуретиками, сохраняется повышенная реабсорбция натрия в почках, которая сопровождается увеличением объема внутрисосудистой жидкости, характерным для низкорениновой, солечувствительной АГ. Нарушение прессорного натрийуреза при этой форме АГ, в отличие от лиц с солерезистентной АГ, характеризующихся повышенной активностью ренин-ангиотензиновой системы, происходит не в проксимальных канальцах почек, а в дистальных отделах нефрона [16]. Главную роль в увеличении реабсорбции натрия почками у таких больных играют чувствительные к альдостерону эпителиальные натриевые каналы (epithelial sodium channel, ENaC), контролирующие реабсорбцию этого иона в конечной части дистальных почечных канальцев и кортикальных собирательных трубках [17][18]. Этот функциональный дефект почечной реабсорбции натрия не только прямо включается в механизм повышения АД у пациентов с резистентной АГ, но и является одной из основных причин их повышенной солечувствительности, так как препятствует компенсаторному увеличению потери натрия с мочой при длительном избыточном потреблении соли [16][19].
В формировании этого дефекта почечной обработки натрия у больных с резистентной АГ ключевую роль играет повышенная активность системы альдостеронсинтаза-альдостерон-минералокортикоидный рецептор [20]. Это касается и лиц с истинной резистентной АГ после исключения у них псевдорезистентности, первичного гиперальдостеронизма и других форм вторичной АГ, как правило, представляющих собой эндокринные нарушения. У большинства из них также наблюдается сдвиг нейрогормонального баланса в сторону повышения активности альдостерона и, особенно, увеличения отношения альдостерон/ренин плазмы крови, характерного для больных с низкорениновой, солечувствительной резистентной АГ [5]. Причины повышенной продукции альдостерона у таких пациентов недостаточно ясны, но одной из них может быть феномен прорыва (ускользания) альдостерона, возникающий при длительном назначении иАПФ/БРА [21][22]. Эти нейрогормональные нарушения имеют неблагоприятные последствия, которые проявляются не только в эндотелиальной дисфункции, ремоделировании и увеличении жесткости артериальных сосудов, но и в повышении активности ENaC и сохранении избыточной реабсорбции натрия в дистальных отделах нефрона, препятствующей снижению АД, несмотря на длительную терапию тиазидными/тиазидоподобными диуретиками.
В стимулирующем действии альдостерона на ENaC участвуют минералокортикоидные рецепторы клеток дистального отдела нефрона, которые являются гормонально регулируемыми факторами транскрипции, запускающими скоординированные изменения в экспрессии многочисленных генов, включая гены структурных и регуляторных белков. Основной эффект альдостерона связан с активацией классического сигнального пути, который индуцирует синтез, транслокацию структурных белков и повышение плотности ENaC в апикальной мембране канальцевых клеток. Альдостерон увеличивает также транскрипцию гена и содержание в клетках киназы Sgk1 (сывороточной и глюкокортикоидиндуцируемой киназы 1) — основного регуляторного белка, который включается в механизм повышения экспрессии структурных белков ENaC и облегчения переноса ионов натрия через апикальную клеточную мембрану [23][24].
Активация минералокортикоидных рецепторов в клетках дистальных отделов нефрона может происходить и без альдостерона в результате связывания с ними других биологически активных веществ. Одним из них является малая Rho ГТФаза Rac1 — регуляторный G-белок, который участвует в передаче внутриклеточных сигналов, регулирующих организацию актинового цитоскелета, генерацию активных форм кислорода (АФК) и функциональное состояние клеток почечной ткани, включая мезангиальные клетки клубочков, подоциты и эпителиальные клетки почечных канальцев [25][26]. Недавно установлено, что Rac1 может вступать в прямое лиганд-независимое взаимодействие с минералокортикоидными рецепторами, выполняя функцию мощного нестероидного активатора передачи их внутриклеточных сигналов. Благодаря этому под влиянием избыточной активности Rac1, независимо от уровня в крови альдостерона, ускоряются процессы ядерной транслокации минералокортикоидных рецепторов и возрастает активность сигнальных путей, контролирующих ENaC в клетках дистальных отделов нефрона [27][28].
Сейчас становится все более очевидным, что аномальная активация Rac1 в ответ на солевую нагрузку может прямо участвовать в патогенезе низкорениновой, солечувствительной АГ, лежащей в основе резистентной АГ. У крыс Dahl-SS с классической моделью чувствительной к соли АГ с низкой активностью ренина наблюдается парадоксальная активация минералокортикоидных рецепторов, которая не зависит от альдостерона, но сопровождается повышением активности нисходящей киназы Sgk1 и гиперэкспрессией ENaC в апикальной мембране канальцевых клеток [29]. Многочисленные данные указывают на то, что этот внутриклеточный эффект опосредуется регуляторным белком Rac1, который лиганд-независимым способом взаимодействует с минералокортикоидными рецепторами, активирует ENaC в дистальных отделах нефрона и включается в механизм формирования низкорениновой, солечувствительной АГ с низким содержанием альдостерона в крови [30-32]. Свой вклад в активацию Rac1, увеличение реабсорбции натрия и повышение АД при этой форме АГ вносит, по-видимому, и хроническое воспаление почечной ткани. Недавно установлено, что провоспалительный цитокин IL-6 (интерлейкин-6) с участием АФК и Rac1 активирует минералокортикоидные рецепторы конечной части дистальных канальцев и запускает сигнальные пути, которые приводят к увеличению активности не только ENaC, но и чувствительного к тиазидам NCC (Na+-Cl-–котранспортера), участвующего в реабсорбции натрия в этом сегменте нефрона [33]. Внутриклеточный механизм, реализующий действие активированных лиганд-независимым способом минералокортикоидных рецепторов на NCC, остается неясным, так как сам альдостерон не оказывает прямого влияния на активность этого ионного транспортера (рис.).
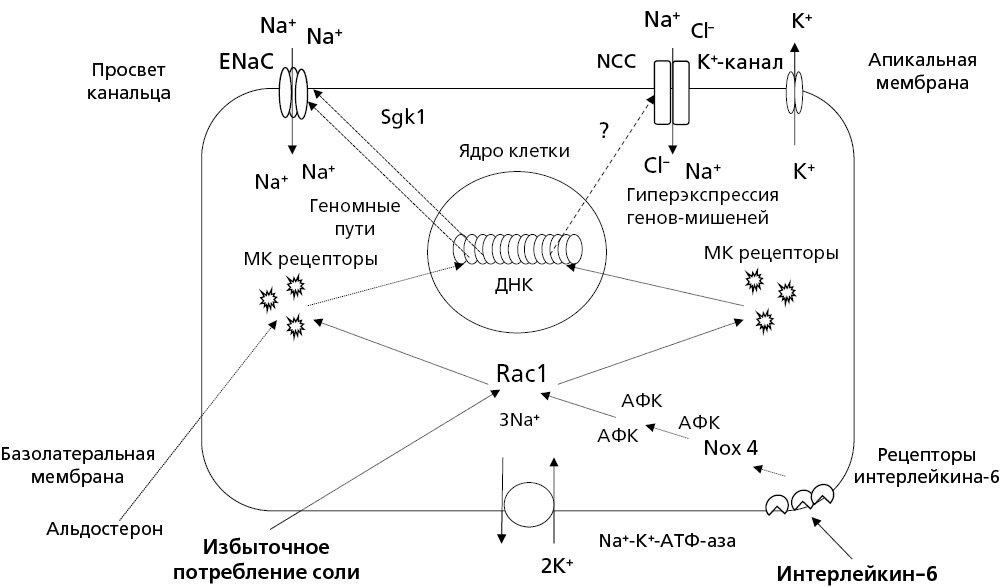
Рисунок. Включение Rac1 в механизм независимой от альдостерона стимуляции реабсорбции натрия в клетках дистального отдела нефрона
АФК — активные формы кислорода, ДНК — дезоксирибонуклеиновая кислота, МК рецепторы — минералкортикоидные рецепторы, ENaC — эпителиальный натриевый канал, NCC — Na+-Cl-–котранспортер, Nox 4 — НАДФН-оксидаза 4, Rac1 — малая Rho гуанозин-3-фосфатаза Rac1, Sgk1 — сывороточная и глюкокортикоидиндуцируемая киназа 1
Выявление независимого от альдостерона почечного механизма формирования низкорениновой, солечувствительной АГ с участием Rac1 подтверждает представление о "субклиническом гиперальдостеронизме", в основе которого лежит продукция альдостерона низкого уровня и/или повышенная чувствительность минералокортикоидных рецепторов к действию этого гормона [34]. Однако такая особенность нейрогормонального дисбаланса характерна лишь для части больных с истинной резистентной АГ. Большинство же пациентов с резистентной АГ имеют повышенный уровень альдостерона в крови, который характерен для лиц с вторичными формами АГ, включая больных с первичным гиперальдостеронизмом, ХБП и СД2 [14]. Следует поэтому ожидать, что в этой популяции пациентов селективные ингибиторы альдостеронсинтазы, избирательно подавляющие продукцию альдостерона, могут оказывать достаточно выраженный антигипертензивный эффект. В то же время АМКР способны снижать АД при солечувствительной АГ не только у лиц с повышенным, но и низким уровнем альдостерона, что косвенно подтверждает участие в формировании этого фенотипа АГ механизмов, не связанных с участием этого гормона [35].
Селективный ингибитор альдостеронсинтазы баксдростат
Селективные ингибиторы альдостеронсинтазы — новый класс ингибиторов гормональной системы альдостеронсинтаза-альдостерон-минералокортикоидный рецептор, которые избирательно тормозят процесс образования альдостерона в клетках коры надпочечников и снижают его содержание в крови [36]. Наиболее перспективным из них является препарат второго поколения баксдростат, который обладает более чем 100-кратной селективностью в отношении альдостеронсинтазы (CYP11B2) по сравнению со стероидной 11β-гидроксилазой (CYP11B1), контролирующей синтез глюкокортикоидного гормона кортизола. Благодаря таким свойствам баксдростат при назначении в терапевтических дозах практически не влияет на продукцию кортизола и не вызывает нежелательные побочные эффекты, связанные с недостаточной выработкой этого гормона [36]. В настоящее время баксдростат проходит клинические исследования в качестве нового лекарственного препарата для лечения заболеваний, связанных с неадекватно повышенным уровнем альдостерона, включая резистентную АГ, ХБП и первичный гиперальдостеронизм.
По данным фармакокинетических исследований, проведенных у 56 здоровых лиц, баксдростат быстро всасывается в кишечнике, относительно медленно метаболизируется в печени с образованием активного метаболита и частично выводится почками. Пик концентрации препарата в крови наблюдается спустя 2-3 часа после приема, период полувыведения составляет 26-31 часов, что обеспечивает его эффективность при однократном назначении в течение суток. Баксдростат в дозе 2,5-5,0 мг/сут. к 10 дню наблюдения вызывает устойчивое снижение уровня альдостерона в сыворотке крови на 51-73%, не оказывая при этом заметного влияния на содержание в ней кортизола. Побочные эффекты встречаются редко и включают головную боль, назофарингит и диарею. Период полувыведения и величина почечного клиренса при однократном приеме 10 мг препарата существенно не изменяются у больных ХБП с СКФ <15 мл/мин/1,73 м², что предполагает отсутствие необходимости коррекции суточной дозы у лиц с тяжелым нарушением функции почек [37][38].
Недавно опубликованы результаты исследования BrigHTM, в котором оценивалась эффективность и безопасность баксдростата у 248 больных резистентной АГ с высоким уровнем альдостерона, которые были рандомизированы в группы сравнения, получавшие препарат в дозе 0,5, 1 и 2 мг/сут. или плацебо [39]. Из них около 40% участников имели СД2, более 90% принимали иАПФ/БРА. Среднее исходное значение СКФ в группах сравнения составляло 81-85 мл/мин/1,73 м². К концу 12 недель наблюдения офисное систолическое АД (САД) при приеме баксдростата в дозе 2, 1 и 0,5 мг/сут. снизилось на -20,3, -17,5 и -12,1 мм рт.ст., соответственно, по сравнению с -9,4 мм рт.ст. в группе плацебо. Величина снижения САД по сравнению с плацебо составила -11,0 мм рт.ст. (95% доверительный интервал (ДИ): -5,5 до -16,4; р<0,0001) при назначении баксдростата в дозе 2 мг/сут. и -8,1 мм рт.ст. (95% ДИ: -2,8 до -13,5; р=0,003) при приеме 1 мг/сут. Целевой уровень САД <130/80 мм рт.ст. был достигнут примерно у 46% лиц из группы пациентов, получавших препарат в дозе 2 мг/сут. Прием баксдростата в максимальной дозе сопровождался снижением более чем на 50% уровня альдостерона, приростом примерно в 2 раза активности ренина плазмы и отсутствием каких-либо существенных сдвигов в содержании кортизола в крови. В ходе исследования не было отмечено серьезных побочных эффектов, включая признаки недостаточности коры надпочечников. Всего зарегистрировано 6 случаев гиперкалиемии (≥5,5 ммоль/л), из-за которых ни один из участников не прекратил терапию. После промежуточной оценки результатов, показавших высокую клиническую эффективность и безопасность применения баксдростата у больных резистентной АГ с сохраненной функцией почек, исследование было досрочно завершено [39].
В настоящее время в рамках клинического исследования 2-ой фазы изучаются особенности антигипертензивного действия и профиль безопасности баксдростата у больных ХБП с неконтролируемой АГ. В исследование включены более 200 пациентов с С2-С4 стадиями ХБП (СКФ 25-75 мл/мин/1,73 м²), у которых офисное САД, несмотря на длительный прием максимальных доз иАПФ/БРА и других антигипертензивных препаратов, сохраняется на уровне ≥140 мм рт.ст. Участники разделены на группу плацебо и группы активного лечения, получающие низкую и высокую дозы баксдростата. Период активного лечения продолжится 26 недель. Основная первичная конечная точка — изменение среднего значения офисного САД по сравнению с плацебо в группах пациентов, получавших низкую и высокую дозу препарата. Длительность изучения безопасности баксдростата составит 32 недели2. Результаты исследования позволят не только получить первоначальные данные об эффективности и безопасности баксдростата у больных ХБП с неконтролируемой АГ, но и оценить необходимость коррекции суточной дозы препарата в этой популяции пациентов.
Недавно запланировано масштабное исследование BaxHTM, посвященное выяснению эффективности, безопасности и переносимости баксдростата при его длительном назначении лицам с неконтролируемой и резистентной АГ. Предполагается, что в этом исследовании примут участие примерно 720 пациентов с уровнем СКФ ≥45 мл/мин/1,73 м², у которых, несмотря на длительный прием стабильных доз двух антигипертензивных препаратов, включая диуретик (неконтролируемая АГ) или трех и более препаратов, включая диуретик (резистентная АГ), не удается достичь целевого АД. Основные первичные конечные точки — изменение величины офисного и 24-часового амбулаторного систолического АД по сравнению с плацебо спустя 24 недели после назначения баксдростата в дозах 1 и 2 мг/сут. В период до 54 недель предполагается оценить переносимость и профиль безопасности препарата, включая серьезные побочные явления и побочные эффекты, приводящие к прекращению режима лечения3.
Результаты исследования BrigHTM показывают, что селективный ингибитор альдостеронсинтазы баксдростат в дозе 2 мг/сут. обеспечивает к концу 12 недель лечения контроль целевого офисного САД <130/80 мм рт.ст. у 46% больных резистентной АГ с С2 стадией ХБП и характеризуется благоприятным профилем безопасности с низким риском развития гиперкалиемии [39]. Новые клинические исследования позволят более точно оценить перспективы применения баксдростата как возможной альтернативы спиронолактону для преодоления резистентной АГ не только у лиц с сохраненной функцией почек, но и у пациентов с С3-С4 стадиями ХБП.
Нестероидный АМКР финеренон
Высокоселективный, нестероидный АМКР финеренон — препарат третьего поколения, который по сравнению со своими предшественниками спиронолактоном и эплереноном обладает улучшенными фармакодинамическими, фармакокинетическими свойствами и имеет более благоприятный профиль безопасности.
По химической структуре финеренон является производным дигидронафтиридина, которое благодаря "объемному" лиганд-независимому связыванию эффективно блокирует минералокортикоидные рецепторы даже в отсутствии альдостерона, что предполагает его высокую клиническую эффективность у лиц с низким содержанием этого гормона в крови [40]. Новый препарат избирательно взаимодействует с минералокортикоидными рецепторами разной локализации, но, в отличие от спиронолактона, не вызывает гинекомастию, сексуальную дисфункцию у мужчин, нарушение менструального цикла у женщин и другие побочные эффекты, характерные для длительной блокады стероидных рецепторов мужских и женских половых гормонов [41]. Данные, полученные в доклинических исследованиях, свидетельствуют о том, что финеренон превосходит стероидные АМКР по своим противовоспалительным и антифибротическим свойствам и обладает более выраженным кардио- и нефропротективным действием [42][43].
Нестероидная структура финеренона определяет не только специфическое взаимодействие с минералокортикоидными рецепторами, но и фармакокинетические свойства, которые существенно отличают его от стероидных аналогов. Финеренон, обладающий в 6-10 раз меньшей липофильностью, не проникает через гематоэнцефалический барьер и, в отличие от спиронолактона и эплеренона, накапливающихся преимущественно в почечной ткани, равномерно распределяется между сердцем и почками [42]. Такое сбалансированное распределение объясняет некоторые клинические эффекты финеренона, включая надежную кардиопротекцию и более низкий риск гиперкалиемии. Новый АМКР хорошо переносится, имеет короткий период полувыведения (2-3 часа), который практически не изменяется у пациентов с относительно сохраненной функцией почек и незначительно возрастает у лиц с выраженной почечной недостаточностью [44]. Предполагается, что более короткий период полувыведения финеренона по сравнению с эплереноном (4-6 часов) и спиронолактоном (16,5 часов) также может быть одной из причин снижения риска гиперкалиемии [45]. Длительный прием финеренона вызывает у больных с С3-С4 стадиями ХБП прирост содержания в крови примерно на 40%, но не требует существенной коррекции дозы, так как начальная доза назначается с учетом исходного уровня СКФ, а затем титруется в соответствии с динамикой содержания калия в сыворотке крови и величиной снижения СКФ [46].
В недавно завершенных исследованиях FIGARO-DKD и FIDELIO-DKD оценивалось влияние финеренона на основные почечные и сердечно-сосудистые исходы у больных СД2 с С2-С4 стадиями ХБП, длительное время получающих ингибиторы ренин-ангиотензиновой системы [47][48]. Ретроспективный анализ результатов этих исследований, полученных у 13026 больных в течение 3 лет наблюдения, подтвердил высокую клиническую эффективность и безопасность применения нового препарата в этой популяции пациентов. Частота гиперкалиемии, приводившей к прекращению лечения, была низкой и составила в среднем 1,7% при приеме финеренона и 0,6% при назначении плацебо. Случаев смерти из-за гиперкалиемии не было зарегистрировано [49]. На основании этих данных эксперты KDIGO рекомендовали финеренон для снижения риска прогрессирования ХБП, нефатального инфаркта миокарда и госпитализации по поводу сердечной недостаточности больным СД2 с СКФ >25 мл/мин/1,73 м², нормальной концентрацией калия в крови и альбуминурией (≥30 мг/г креатинина), получающих максимальные дозы иАПФ/БРА [50].
Первоначальные данные об антигипертензивном действии финеренона у пациентов с резистентной АГ получены в ретроспективном анализе FIDELITY-TRH, посвященном сравнительной оценке влияния финеренона (10-20 мг/сут.) и спиронолактона (25-50 мг/сут.) на величину снижения офисного САД у больных резистентной АГ с выраженной диабетической ХБП, участвовавших ранее в исследованиях FIDELITY и AMBER [52]. В него были отобраны 624 пациента из исследования FIDELITY [49] и 295 лиц из исследования AMBER, в котором выяснялась возможность применения патиомера (вещества, связывающего калий) для снижения риска гиперкалиемии при длительном назначении спиронолактона больным резистентной АГ с диабетической нефропатией [51]. Исходные значения СКФ в группах сравнения находились на уровне 35-37 мл/мин/1,73 м², что соответствует С3б стадии ХБП. Сравнивались результаты, полученные через 17 недель в исследовании FIDELITY, и данные, полученные спустя 12 недель в исследовании AMBER. Установлено, что величина снижения офисного САД в группе финеренона составляет -7,1 мм рт.ст., в группе плацебо -1,3 мм рт.ст. (разница -5,74; 95% доверительный интервал (ДИ): -3,49 до -7,99; р<0,0001). Аналогичные показатели для групп спиронолактон+патиомер и спиронолактон+плацебо составили соответственно -11,7 и -10,8 мм рт.ст. (разница -1,0; 95% ДИ: -2,4 до -4,1; р=0,58). Случаи гиперкалиемии (≥5,5 ммоль/л) выявлены у 12% больных в группе финеренона и у 3% пациентов в группе плацебо по сравнению с 35% при назначении спиронолактона+патиомера и 64% при приеме спиронолактона+плацебо. Прекращение лечения из-за гиперкалиемии было отмечено у 0,3% лиц, получавших финеренон, и у 0%, принимавших плацебо, по сравнению с 7% больных в группе спиронолактон+патиомер и 23% в группе спиронолактон+плацебо [52].
Результаты исследования FIDELITY-TRH указывают на то, что финеренон уступает спиронолактону по степени снижения офисного САД у больных резистентной АГ с выраженной диабетической нефропатией, но значительно превосходит его по показателям безопасности, связанным с риском развития гиперкалиемии. Не исключено, что новый препарат с учетом его специфического лиганд-независимого взаимодействия с минералокортикоидными рецепторами может оказаться более эффективным антигипертензивным препаратом, чем спиронолактон, для лечения больных резистентной АГ с низким уровнем альдостерона, в формировании которой участвуют активированные Rac1 минералокортикоидные рецепторы почек (см. рис.). Дальнейшие клинические исследования позволят более точно оценить особенности антигипертензивного действия финеренона и профиль его безопасности в разных группах больных резистентной АГ с сохраненной и нарушенной функцией почек.
Заключение
Селективный ингибитор альдостеронсинтазы баксдростат и нестероидный АМКР финеренон — новые ингибиторы гормональной системы альдостеронсинтаза-альдостерон-минералокортикоидный рецептор, которые изучаются в клинических исследованиях как перспективные лекарственные средства для лечения ХБП, сердечной недостаточности и резистентной АГ.
Новое исследовние BaxHTM позволит выяснить клиническую эффективность и безопасность длительного лечения баксдростатом пациентов с резистентной АГ и начальными стадиями ХБП. Для оценки эффективности и безопасности применения баксдростата у больных резистентной АГ с более тяжелыми стадиями ХБП (С3б-С4) необходимы дополнительные клинические исследования.
По данным сравнительного исследования FIDELITY-TRH, финеренон уступает спиронолактону у больных резистентной АГ с выраженной диабетической нефропатией по степени снижения офисного САД, но значительно превосходит его по безопасности применения, связанного с риском развития тяжелой гиперкалиемии. В дальнейших клинических исследованиях необходимо выяснить, сохраняет ли новый антагонист минералокортикоидных рецепторов клиническую эффективность и благоприятный профиль безопасности не только в этой категории пациентов, но и в других группах больных с резистентной АГ.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование. Работа выполнена при поддержке Оренбургского государственного медицинского университета.
Funding. The study was performed with the support of the Orenburg State Medical University.
1. Препарат не зарегистрирован в РФ.
2. AstraZeneca. ClinicalTrial. Gov ID NCT05432167.
3. AstraZeneca. ClinicalTrial. Gov ID NCT06034743.
Список литературы
1. Mancia G, Kreutz R, Brunström M, et al. 2023 ESH Guidelines for the management of arterial hypertension The Task Force for the management of arterial hypertension of the European Society of hypertension: Endorsed by the International Society of Hypertension (ISH) and the European Renal Association (ERA). J Hypertens. 2023;41(12):1874-2071. DOI:10.1097/HJH.0000000000003480.
2. Noubiap JJ, Nansseu JR, Nyaga UF, et al. Global prevalence of resistant hypertension: a meta-analysis of data from 3.2 million patients. Heart. 2019;105(2):98-105. DOI:10.1136/heartjnl-2018-313599.
3. Carey RM, Calhoun DA, Bakris GL, et al; American Heart Association Professional/Public Education and Publications Committee of the Council on Hypertension; Council on Cardiovascular and Stroke Nursing; Council on Clinical Cardiology; Council on Genomic and Precision Medicine; Council on Peripheral Vascular Disease; Council on Quality of Care and Outcomes Research; and Stroke Council. Resistant hypertension: detection, evaluation, and management: A scientific statement from the American Heart Association. Hypertension 2018;72(5):e53-e90. DOI:10.1161/HYP.0000000000000084.
4. Кузьмин О. Б., Жежа В. В., Ландарь Л. Н., Салова О. А. Резистентная артериальная гипертензия у пациентов с хронической болезнью почек: распространенность, прогностическое значение, причины и подходы к антигипертензивной терапии. Нефрология. 2019;23(1):37-44. DOI:10.24884/1561-6274-2019-23-37-44.
5. Williams B, MacDonald TM, Morant S, et al; British Hypertension Society’s PATHWAY Studies Group. Spironolactone versus placebo, bisoprolol, and doxazozin to determine the optimal treatment for drug-resistant hypertension (PATHWAY-2): a randomized, double-blind, crossover trial. Lancet. 2015;386(10008):2059-68. DOI:10.1016/S0140-6736(15)00257-3.
6. Krieger EM, Drager LF, Giorgi DMA, et al; ReHOT Investigators. Spironolactone versus clonidine as a fourth-drug therapy for resistant hypertension: the ReHOT randomized study (Resistant Hypertension Optimal Treatment). Hypertension. 2018;71(4):681-90. DOI:10.1161/HYPERTENSIONAHA.117.10662.
7. Whelton PK, Carey RM, Aronow WS, et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the Prevention, Detection, Evaluation, and Management of High Blood Pressure in Adults: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Hypertension. 2018;71(19): e127-e248. DOI:10.1161/HYP.0000000000000066.
8. Кобалава Ж. Д., Конради А. О., Недогода С. В. и др. Артериальная гипертензия у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(3):3786. DOI:10.15829/1560-4071-2020-3-3786.
9. Manolis AA, Manolis TA, Melita H, Manolis AS. Eplerenone versus spironolactone in resistant hypertension: an efficacy and/or cost or just a men’s issue? Curr Hypertens Rep. 2019;21(3):22. DOI:10.1007/s11906-019-0924-0.
10. Bolignano D, Palmer SC, Navaneethan SD, Strippoli GF. Aldosterone antagonists for preventing the progression of chronic kidney disease. Cochrane Database Syst Rev. 2014;29(4):CD007004. DOI:10.1002/14651858.CD007004.pub3.
11. Kim GH. Primary role of the kidney in pathogenesis of hypertension. Life (Basel). 2024;14(1):119. DOI:10.3390/life14010119.
12. Guyton AC. Renal functional curve: a key to understanding the pathogenesis of hypertension. Hypertension. 1987;10(1):1-6. DOI:10.1161/01.hyp.10.1.1.
13. Кузьмин О. Б., Пугаева М. О., Бучнева Н. В. Почечные механизмы нефрогенной артериальной гипертонии. Нефрология. 2008;12(2):39-46. DOI:10.24884/1561-6274-2008-12-2-39-46.
14. McDonough AA, Nguyen MT. Maintaining balance under pressure: integrated regulation of renal transporters during hypertension. Hypertension. 2015;66(3):450-5. DOI:10.1161/HYPERTENSIONAHA.115.04593.
15. Gaddam KK, Nishizaka MK, Pratt-Ubunama MN, et al. Characterization of resistant hypertension: association between resistant hypertension, aldosterone, and persistent intravascular volume expansion. Arch Intern Med. 2008;168(11):1159-64. DOI:10.1001/archinte.168.11.1159.
16. Hall JE. Renal Dysfunction, Rather Than Nonrenal Vascular Dysfunction, Mediates Salt-Induced Hypertension. Circulation.2016;133(9):894-906. DOI:10.1161/CIRCULATIONAHA.115.018526.
17. Pavlov TC, Staruschenko A. Involvement of ENaC in the development of salt-sensitive hypertension. Am J Physiol Renal Physiol. 2017;313(2):F135-F140. DOI:10.1152/ajprenal.00427.2016.
18. Mutchler SM, Kirabo A, Kleyman TR. Epithelial sodium channel and salt-sensitive hypertension. Hypertension. 2021;77(3):759-67. DOI:10.1161/HYPERTENSIONAHA.120.14481.
19. Bailey MA, Dhaun N. Salt-sensitivity: causes, consequences, and resent advances. Hypertension. 2024;81(3):476-89. DOI:10.1161/HYPERTENSIONAHA.123.17959.
20. Nesterov V, Bertog M, Canonica J, et al. Critical role of mineralcorticoid receptor in aldosterone-dependent and aldosterone independent regulation of ENaC in the distal nephron. Am J Physiol Renal Physiol. 2021;321(3):F257-F268. DOI:10.1152/ajprenal.00139.2021.
21. Mogi M. Aldosterone breakthrough from pharmacological perspective. Hypertens Res. 2022;45(6):967-75. DOI:10.1038/s41440-022-00913-4.
22. Lopez AG, Louiset E, Lefebre H. Aldosterone breakthrough as a clue to the physiological importance of paracrine regulation of aldosterone secretion. Hypertens Res. 2022;45(11):1832-34. DOI:10.1038/s41440-022-01009-9.
23. Pearce D, Soundararajan R, Trimpert C, et al. Collecting duct principal cell transport processes and their regulation. Clin J Am Soc Nephrol. 2015;10(1):135-46. DOI:10.2215/CJN.05760513.
24. Valinsky WC, Touyz RM, Shrier A. Aldosterone, SGK1, and ion channels in the kidney. Clin Sci (Lond). 2018;132(2):173-83. DOI:10.1042/CS20171525.
25. Steichen C, Herve C, Hauet T, Bourmeuster N. Rho GTPases in kidney physiology and diseases. Small GTPases. 2022;13(1):141-61. DOI:10.1080/21541248.2021.1932402.
26. Bock F, Dong X, Li S, et al. Rac1 promotes kidney collecting duct repair by mechanically coupling cell morphology to mitotic entry. Sci Adv. 2024;10(6):eadi7840. DOI:10.1126/sciadv.adi7840.
27. Carpushev AV, Levchenko V, Ilatovskaya D, et al. Novel role Rac1/WAVE signaling mechanism in regulation of the epithelial Na+ channel. Hypertension. 2011;57(5):996-1002. DOI:10.1161/HYPERTENSIONAHA.110.157784.
28. Pavlov TC, Levchenko V, Staruschenko A. Role of Rho GDP dissociation inhibitor α in control of epithelium sodium channel (ENaC) mediated sodium reabsorption. J Biol Chem. 2014;289(41):28651-9. DOI:10.1074/jbc.M114.558262.
29. Aoi W, Niisato N, Sawabe Y, et al. Abnormal expression of ENaC and SGK1 mRNA induced by dietary sodium in Dahl salt-sensitivity hypertensive rats. Cell Biol Int. 2007;31(10):1288-91. DOI:10.1016/j.cellbi.2007.03.036.
30. Shibata S, Mu S, Kawarazaki H, et al. Rac1 GTFase in rodent kidneys is essential for salt-sensitive hypertension via a mineralcorticoid receptor-dependent pathway. J Clin Invest. 2011;121(8):3233-43. DOI:10.1172/JCI43124.
31. Nagase M. Role of Rac1 GTFase in salt-sensitive hypertension. Curr Opin Nephrol Hypertens. 2013;22(2):148-55. DOI:10.1097/MNH.0b013e32835d0751.
32. Kawarazaki W, Fujita T. Aberrant Rac1-mineralcorticoid receptor pathways in salt-sensitive hypertension. Clin Exp Pharmacol Physiol. 2013;40(12):929-36. DOI:10.1111/1440-1681.12177.
33. Wynne BM, Samson TK, Moyer HC, et al. Interleukin 6 mediated activation of the mineralcorticoid receptor in the aldosterone sensitive nephron. Am J Physiol Cell Physiol. 2022;323(5):C1512-C1523. DOI:10.1152/ajpcell.00272.2021.
34. Gray Z, Tu W, Chertow GM, Bhalla V. Aldosterone sensitivity: an opportunity to explore the pathogenesis of hypertension. Am J Physiol Renal Physiol. 2021;320(3):F325-F335. DOI:10.1152/ajprenal.00415.2020.
35. Shah SS, Zhang J, Gwini SM, et al. Efficacy and safety of mineralcorticoid receptor antagonists for the treatment of low-renin hypertension: a systematic review and meta-analysis. J Hum Hypertens. 2024;38(5):383-392. DOI:10.1038/s41371-023-00891-1.
36. Bogman K, Schwab D, Delporte ML, et al. Preclinical and early clinical profile of a highly selective and potent oral inhibitor aldosterone synthase (CYP11B2). Hypertension. 2017;69(1):189-96. DOI:10.1161/HYPERTENSIONAHA.116.07716.
37. Freeman MW, Bond M, Murphy B, et al. Results from a phase 1, randomized, doubly-blind, multiple ascending dose study characterizing the pharmacokinetics and demonstrating the safety and selectivity of the aldosterone synthase inhibitor baxdrostat in healthy volunteers. Hypertens Res. 2023;46(1):108-18. DOI:10.1038/s41440-022-01070-4.
38. Freeman MW, Halvorsen YD, Bond M, et al. Results from a phase 1 study assessing the pharmacokinetic of the aldosterone synthase inhibitor baxdrostat in participants with varying degrees of renal function. Clin Pharmacol Drug Dev. 2024;4(13):410-18. DOI:10.1002/cpdd.1371.
39. Freeman MW, Halvorsen YD, Marshall W, et al; BrigHTN Investigators. Phase 2 trial of baxdrostat for treatment-resistant hypertension. N Engl J Med. 2023;388(5):395-405. DOI:10.1056/NEJMoa2213169.
40. Amazit L, Le Billan F, Kolkhof P, et al. Finerenone impedes aldosterone-dependent nuclear import of the mineralcorticoid receptor and prevents genomic recruitment of steroid receptor coactivator-1. J Biol Chem. 2015;290(36):21876-89. DOI:10.1074/jbc.M115.657957.
41. Bärfacker R, Kuhl A, Hilisch A, et al. Discovery of BAY94-8862: a nonsteroidal antagonist of the mineralcorticoid receptor for treatment of cardiorenal diseases. ChemMedChem. 2012;7(8):1385-403. DOI:10.1002/cmdc.201200081.
42. Kolkhof P, Delbeck M, Kretschmer A, et al. Finerenone, a novel selective nonsteroidal mineralcorticoid receptor antagonist protects from rat cardiorenal injury. J Cardiovasc Pharmacol. 2014;64(1):69-78. DOI:10.1097/FJC.0000000000000091.
43. Grune J, Benz V, Brix S, et al. Steroidal and nonsteroidal mineralcorticoid receptor antagonists cause differential cardiac gene expression in pressure overload-induced cardiac hypertrophy. J Cardiovasc Pharmacol. 2016;67(5):402-11. DOI:10.1097/FJC.0000000000000336.
44. Heinig R, Kimmeskamp-Kirschbaum N, Halabi A, Lentini S. Pharmacokinetics of the novel nonsteroidal mineralcorticoid receptor antagonist finerenone (BAY94-8862) in individuals with renal impairment. Clin Pharmacol Drug Dev. 2016;5(6):488-501. DOI:10.1002/cpdd.263.
45. Agarwal R, Anker SD, Bakris G, et al; FIDELIO-DKD and FIGARO-DKD Investigators. Investigating new treatment opportunities for patients with chronic kidney disease in type 2 diabetes: the role of finerenone. Nephrol Dial Transplant. 2022;37(6):1014-23. DOI:10.1093/ndt/gfaa294.
46. Heinig R, Essing T. The pharmacokinetics of the nonsteroidal mineralcorticoid receptor antagonist finerenone. Clin Pharmacokinet. 2023;62(12):1673-93. DOI:10.1007/s40262-023-01312-9.
47. Pitt B, Filippatos G, Agarwal R, et al. Cardiovascular events with finerenone in kidney disease and type 2 diabetes. N Engl J Med. 2021;385(24):2252-63. DOI:10.1056/NEJMoa2110956.
48. Bakris GL, Agarwal R, Anker SD, et al; FIDELIO-DKD Investigators. Effect of finerenone on chronic kidney disease outcomes in type 2 diabetes. N Engl J Med. 2021;383(23):2219-29. DOI:10.1056/NEJMoa2025845.
49. Agarwal R, Filippatos G, Pitt B, et al; FIDELIO-DKD and FIGARO-DKD investigators. Cardiovascular and kidney outcomes with finerenone in patients with type 2 diabetes and chronic kidney disease: the FIDELITY pooled analysis. Eur Heart J. 2022;43(6):474-84. DOI:10.1093/eurheartj/ehab777.
50. Navaneethan SD, Zoungas S, Caramori ML, et al. Diabetes management in chronic kidney disease: synopsis of the KDIGO 2022 Clinical practice guidelines update. Ann Intern Med. 2023;176(3):381-7. DOI:10.7326/M22-2904.
51. Agarwal R, Rossignol P, Romero A, et al. Patiomer versus placebo to enable spironolactone use in patients with resistant hypertension and chronic kidney disease (AMBER): a phase 2, randomized, double-blind, placebo-controlled trial. Lancet. 2019;394(10208):1540-50. DOI:10.1016/S01140-6736(19)32135-X.
52. Agarwal R, Pitt B, Palmer B, et al. A comparative post hoc analysis of finerenone and spironolactone in resistant hypertension in moderate-to-advanced chronic kidney disease. Clin Kidney J. 2022;16(2):293-302. DOI:10.1093/ckj/sfac234.
Об авторах
О. Б. КузьминРоссия
Кузьмин Олег Борисович – профессор, кафедра фармакологии.
Оренбург
Н. В. Бучнева
Россия
Бучнева Наталья Викторовна – доцент, кафедра фармакологии.
Оренбург
В. В. Белянин
Россия
Белянин Виталий Васильевич – доцент, кафедра фармакологии.
Оренбург
В. В. Жежа
Россия
Жежа Владислав Викторович - доцент, кафедра фармакологии.
Оренбург
М. В. Столбова
Россия
Столбова Марина Владимировна.
Оренбург
Дополнительные файлы
Рецензия
Для цитирования:
Кузьмин О.Б., Бучнева Н.В., Белянин В.В., Жежа В.В., Столбова М.В. Баксдростат и финеренон: новые ингибиторы гормональной системы альдостеронсинтаза-альдостерон-минералокортикоидный рецептор для лекарственной терапии резистентной артериальной гипертензии. Рациональная Фармакотерапия в Кардиологии. 2024;20(4):451-459. https://doi.org/10.20996/1819-6446-2024-3064. EDN: KAQZDN
For citation:
Kuzmin O.B., Buchneva N.V., Belyanin V.V., Zhezha V.V., Stolbova M.V. Baxdrostat and finerenone: new aldosterone synthase-aldosterone-mineralocorticoid receptor hormonal system inhibitors for the drug treatment of resistant arterial hypertension. Rational Pharmacotherapy in Cardiology. 2024;20(4):451-459. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3064. EDN: KAQZDN

















































