Перейти к:
Нарушения в системе гемостаза у пациентов с инфарктом миокарда без обструкции коронарных артерий
https://doi.org/10.20996/1819-6446-2024-3065
EDN: VLJLAP
Аннотация
Цель. Изучить состояние тромбоцитарного и плазменного звеньев гемостаза у пациентов с инфарктом миокарда без обструкции коронарных артерий (ИМБОКА).
Материал и методы. В исследование включены 42 пациента с инфарктом миокарда без подъема сегмента ST на ЭКГ: ИМБОКА (n = 24) и инфарктом миокарда с обструкцией коронарных артерий (ИМОКА) (n=18). Оценивали способность тромбоцитов к агрегации в ответ на активацию (на агрегометрах Solar 2110 и LASCA), функциональную активность тромбоцитов, кальциевую сигнализацию. Плазменное звено гемостаза дополнительно оценивали глобальным тестом свертывания крови "Тромбодинамика". В качестве контрольной группы для тестов были набраны здоровые добровольцы.
Результаты. При анализе способности тромбоцитов образовывать агрегаты методом агрегометрии было обнаружено, что тромбоциты у пациентов в группе ИМБОКА значимо хуже образуют агрегаты при стимуляции аденозиндифосфатом в различных концентрациях относительно группы пациентов с ИМОКА, однако при стимуляции тромбоцитов коллагеном данный эффект был обратным. Методом проточной цитометрии по протоколу теста функциональной активности тромбоцитов было выявлено, что в обеих группах был значимо увеличен размер тромбоцита после активации, снижена гранулярность тромбоцитов, как в покое, так и при активации, значимо снижено количество прокоагулянтных фосфатидилсерин-положительных тромбоцитов, а также снижен выброс плотных гранул после активации. В тесте исследования кальциевой сигнализации было выявлено ослабление высвобождения кальция в ответ на аденозиндифосфат в группе пациентов с ИМБОКА относительно группы пациентов с ИМОКА. При изучении плазменного звена как по данным рутинных тестов, так и по результатам теста "Тромбодинамика" значимых различий между группами, а также отклонений от референсных значений выявлено не было.
Заключение. Активность тромбоцитов по данным большинства тестов значимо не различалась между группами ИМБОКА и ИМОКА, однако в группе ИМБОКА по данным некоторых тестов активность тромбоцитов была ниже, чем в группе ИМОКА. При изучении плазменного звена гемостаза в обеих группах регистрировалась нормокоагуляция.
Ключевые слова
Для цитирования:
Писарюк А.С., Филькова А.А., Тухсанбоев Ё.С., Свидельская Г.С., Игнатова А.А., Пономаренко Е.А., Мартьянов А.А., Тараканова А.А., Мерай И.А., Пантелеев М.А., Свешникова А.Н., Кобалава Ж.Д. Нарушения в системе гемостаза у пациентов с инфарктом миокарда без обструкции коронарных артерий. Рациональная Фармакотерапия в Кардиологии. 2024;20(4):386-400. https://doi.org/10.20996/1819-6446-2024-3065. EDN: VLJLAP
For citation:
Pisaryuk A.S., Filkova A.A., Tukhsanboev E.S., Svidelskaya G.S., Ignatova A.A., Ponomarenko E.A., Martyanov A.A., Tarakanova A.A., Meray I.A., Panteleev M.A., Sveshnikova A.N., Kobalava Z.D. Coagulation disorders in myocardial infarction with nonobstructive coronary arteries. Rational Pharmacotherapy in Cardiology. 2024;20(4):386-400. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3065. EDN: VLJLAP
Введение
Независимо от механизма развития инфаркта миокарда (ИМ), на любом этапе патогенеза вовлечена система гемостаза. Доподлинно неизвестно, существуют ли различия в состоянии системы гемостаза у пациентов с ИМ с обструкцией коронарных артерий (ИМОКА) и без. В литературе встречаются противоречивые данные: в некоторых исследованиях различия не обнаружены [1], другие сообщают о повышенной протромботической активности у группы пациентов с ИМ без обструкции коронарных артерий (ИМБОКА) [2-4]. Более того, анализ регистров показал, что в этой группе пациентов частота случаев тромбофилии выше, чем у пациентов с ИМОКА, и составляет от 14 до 19% [5][6]. Эти данные часто используют для продвижения гипотезы о ведущей роли гемостаза в патогенезе развития "истинного" ИМБОКА. Кроме того, есть сведения об ассоциации "гиперреактивных" тромбоцитов [7] с патогенезом развития сердечно-сосудистых событий [8-16], но исследований, посвященных особенностям тромбоцитарного звена в этой группе пациентов, не было. Понимание состояния системы гемостаза у пациентов с ИМБОКА могут повлиять на будущие направления клинических исследований антитромботической терапии в этой группе.
Цель исследования — изучение состояния тромбоцитарного и плазменного звеньев гемостаза у пациентов с ИМБОКА.
Материал и методы
Проспективное исследование выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice), принципами Хельсинкской декларации и одобрено локальным этическим комитетом Медицинского института Российского университета дружбы народов имени Патриса Лумумбы (протокол № 6 от 17.03.2022). Все пациенты, последовательно поступающие и включенные в исследование в 2022-2023 гг, подписали добровольное информированное согласие. Критерии включения: соответствие четвертому универсальному определению ИМ; необструктивное поражение коронарного русла (стенозы <50%) [17]. Критерии исключения: постоянный прием антикоагулянтной терапии, выявленный "неишемический" паттерн по данным магнитно-резонансной томографии (МРТ) сердца с использованием позднего усиления гадолинием (миокардит, синдром такоцубо и др.), повышение тропонина, связанное с некоронарным повреждением миокарда (сердечная недостаточность, болезни легких, хроническая болезнь почек и др.). Всем включенным пациентам было выполнено рутинное обследование: проведена коронарная ангиография по стандартной методике, эхокардиографическое исследование с помощью ультразвуковой системы VIVID Е9 (GE Healthcare); лабораторное обследование включало в себя клинический анализ крови с оценкой гематокрита, исследование уровня эритроцитов, уровня тромбоцитов, ширины распределения тромбоцитов по объему, оценку тромбокрита, среднего объема тромбоцитов в крови, определение международного нормализованного отношения, активированного частичного тромбопластинового времени, D-димера, тропонина I, креатинина, скорости клубочковой фильтрации, уровня липидов, трансаминаз. Для исследования гемостаза образцы крови брали при поступлении до введения антикогулянта и ингибитора P2Y12-рецепторов. Использовали вакуумные пробирки с одним из антикоагулянтов: гирудином, цитратом натрия, литий-гепарином. Пациенты в основной группе (ИМБОКА) и в группе сравнения (ИМОКА) были подобраны таким образом, чтобы не было выраженных различий по клинико-анамнестическим характеристикам и сопутствующей терапии, для исключения влияния других факторов на состояние системы гемостаза. В качестве контрольной группы для тестов были набраны здоровые добровольцы (n=72 для теста функциональной активности тромбоцитов, n=16 для теста оценки кальциевой сигнализации, n=12 для агрегометрии, n=53 для теста тромбодинамики), которые не переносили никаких респираторных заболеваний и не принимали никаких лекарственных препаратов минимум за 2 недели до исследования, были сопоставимы по полу и возрасту с основными группами и подписали добровольное информированное согласие.
Агрегометрия
Для исследования агрегации тромбоцитов из цельной крови, взятой в пробирки с цитратом натрия, выделяли богатую тромбоцитами плазму (БТП) при помощи центрифугирования 200 g 5 минут. Агрегацию тромбоцитов наблюдали методом световой трансмиссионной (турбидометрической) агрегометрии (СТА) на приборе Solar AP 2110. Регистрацию образования агрегатов из тромбоцитов вели при равномерном перемешивании 250 мкл БТП магнитным якорем со скоростью 800 оборотов в минуту. Тромбоциты активировали различными концентрациями аденозиндифосфата (АДФ) (1-20 мкмоль/л), либо добавлением смеси серотонина (20 мкмоль/л) и адреналина (200 нмоль/л), либо пептидом, активирующим рецептор тромбина PAR-1 (TRAP-6 — 10 мкмоль/л) в присутствии ингибитора рецептора к АДФ P2Y12 — ARC-69931MX, либо арахидоновой кислотой в концентрации 1 ммоль/л, коллагеном в концентрации 1 мкг/мл (полный протокол агрегометрии представлен в табл. 1). В качестве референсного образца с полным светопропусканием использовали плазму, обедненную тромбоцитами (центрифугирование цельной крови проводили на скорости 2000 g в течение 15 мин). Хлорид кальция до финальной концентрации 2 мМ добавляли в суспензию тромбоцитов перед измерениями, в которых указано наличие ионов кальция. Рекальцификацию проводили для более физиологичного исследования агрегации тромбоцитов, а также наблюдения обратимой агрегации тромбоцитов [17] (произвольного развала агрегатов после их формирования в присутствии ионов кальция в среде), что позволило оценить "индекс необратимости", параметр, показывающий, какая доля тромбоцитов осталась в агрегате после его формирования в ответ на добавление активатора. Для предотвращения наблюдения работы плазменного звена перед рекальцификацией суспензии тромбоцитов в неё добавлялся гирудин в концентрации 10 ед/мкл. Сигнал регистрировали каждую секунду.
Таблица 1. Индукторы тромбообразования в тесте агрегометрия
на приборе Solar AP 2110
|
1. |
АДФ 1 мкмоль/л (1 мкМ). БТП предварительно рекальцифицирована добавлением CaCl2 до концентрации 2 ммоль/л (2 мМ). |
|
2. |
АДФ 2 мкмоль/л (2 мкМ). БТП предварительно рекальцифицирована добавлением CaCl2 до концентрации 2 ммоль/л (2 мМ). |
|
3. |
АДФ 3 мкмоль/л (3 мкМ). БТП предварительно рекальцифицирована добавлением CaCl2 до концентрации 2 ммоль/л (2 мМ). |
|
4. |
АДФ 5 мкмоль/л (5 мкМ). |
|
5. |
АДФ 20 мкмоль/л (20 мкМ). |
|
6. |
TRAPs 10 мкмоль/л (10 мкМ) + ARC-69931MX. БТП предварительно рекальцифицирована добавлением CaCl2 до концентрации 2 ммоль/л (2 мМ). |
|
7. |
TRAPs 10 мкмоль/л (10 мкМ) + ARC-69931MX. |
|
8. |
Адреналин 200 нмоль/л (200 нМ) + серотонин 20 мкмоль/л (20 мкМ). БТП предварительно рекальцифицирована добавлением CaCl2 до концентрации 2 ммоль/л (2 мМ). |
|
9. |
Арахидоновая кислота 1 ммоль/л (1 мМ). БТП предварительно рекальцифицирована добавлением CaCl2 до концентрации 2 ммоль/л (2 мМ). |
|
10. |
Арахидоновая кислота 1 ммоль/л (1 мМ). БТП предварительно рекальцифицирована добавлением CaCl2 до концентрации 2 ммоль/л (2 мМ). |
|
11. |
Коллаген 1 мкг/мл. БТП предварительно рекальцифицирована добавлением CaCl2 до концентрации 2 ммоль/л (2 мМ). |
TRAPs — thrombin receptor activating peptides (пептиды, активирующие рецептор тромбина), АДФ — аденозиндифосфат, БТП — богатая тромбоцитами плазма.
Лазерный анализатор частиц LaSca-TMF для анализа лазерного рассеяния
Образование диагрегатов тромбоцитов наблюдали на приборе LASCA (BioMedSystems Ltd., Санкт-Петербург, Россия). Для получения БТП кровь с цитратом натрия центрифугировали при 100 g в течение 5 мин. После центрифугирования БТП оставляли при комнатной температуре в течение 30 мин. Для всех измерений малоуглового рассеяния БТП разбавляли до концентрации 10 000 тромбоцитов/мкл в модифицированном буфере HEPES (140 мМ NaCl, 10 мМ HEPES, 2 мМ KCl, 1 мМ MgCl2, 2 мМ CaCl2, 5 мМ глюкозы, pH 7,4, все реагенты произведены Sigma-Aldrich, Сент-Луис, Миссури, США). Тромбоциты стимулировали 800 нМ АДФ (Sigma-Aldrich, Сент-Луис, Миссури, США) или 0,4 мкг/мл коллагена (Технология Стандарт, Россия). Исследования агрегации проводили на лазерном анализаторе LaSca-T (BioMedSystems Ltd., Санкт-Петербург, Россия), адаптированном для изучения физиологии клеток [18]. Интенсивность рассеянного света под углами 1 и 12 градусов непрерывно измеряли при температуре в кювете 23°С и перемешивании 1200 об/мин. Для всех расчетов использовали программное обеспечение LaSca_32 (BioMedSystems Ltd., Санкт-Петербург, Россия).
Функциональная активность тромбоцитов (ФАТ)
Функциональный ответ тромбоцитов анализировали с использованием проточной цитометрии на приборе NovoCyte (ACEA Biosciences, США) по протоколу, описанному А. А. Игнатовой и соавт. [19]. 20 мкл крови, взятой в пробирки с цитратом натрия, разбавляли 1:20 в буфере Тирода (150 мМ NaCl, 2,7 мМ KCl, 1 мМ MgCl2, 0,4 мМ Na2HPO4, 20 мМ HEPES, 5 мМ глюкозы, 0,5% альбумина из бычьей сыворотки, pH 7,4). Тромбоциты загружали мепакрином (10 мкМ) в течение 30 мин при 37°С. Для активации тромбоцитов в разбавленную кровь добавляли смесь коллаген-подобного пептида (CRP) (10 мкг/мл), пептида, активирующего рецептор тромбина PAR-1 (TRAP-6, 12,5 мкМ) и 2,5 мМ CaCl2. Активацию проводили в течение 10 мин. В неактивированные образцы добавляли соответствующее количество буфера с 2,5 мМ CaCl2. Окрашивание тромбоцитов проводили антителами против P-селектина (CD62P-Alexa647), против гликопротеина IIb/IIIa (CD61-PE), активированного состояния гликопротеина IIb/IIIa (PAC1-FITC), против гликопротеина Ib (CD42b-PE). Для оценки прокоагулянтной активности тромбоцитов (фосфатидилсерин-положительных) использовали Аннексин V, меченный флуорофором Alexa647. Смесь антител добавляли к активированным и неактивированным образцам на 10 мин, затем образцы разбавляли до объема 180 мкл буфера с CaCl2 и анализировали на проточном цитометре Novocyte.
Кальциевая сигнализация
Функциональный ответ тромбоцитов (связывание фибриногена, мобилизация кальция, экспозиция фосфатидилсерина) анализировали с использованием проточной цитометрии на приборе BD FACS Canto II (BD Biosciences, США). Для измерения уровня кальция во внутриклеточных депо, гирудинированную цельную кровь инкубировали с 2 мкМ Fura-red в присутствии 1 U/мл апиразы в течение 35 мин при 37°C. После осаждения эритроцитов полученную богатую лейкоцитами плазму (БЛП) разбавляли в буфере Тирода с кальцием до конечной концентрации 1000 тромбоцитов/мкл и оставляли в покое на 30 мин. 100 мкг/мл Alexa-488 меченного человеческого фибриногена добавляли за 2 мин до загрузки образца в поточный цитометр BD FACS Canto II. Образцы анализировали в непрерывном режиме согласно протоколу, описанному в работе [20].
Тромбодинамика
Исследование проводили с использованием анализатора "Регистратор тромбодинамики Т-2" и набора для тромбодинамического анализа (LLC HemaCore, Москва, Россия): 120 мкл бедной тромбоцитами плазмы крови переносили в пробирку, содержащую ингибитор кукурузного трипсина (CTI), и инкубировали в течение 3 мин при 37°С, затем переносили в пробирку, содержащую ацетат кальция. Рециркулированную плазму помещали в камеру. В плазму погружали вставку с иммобилизованным тканевым фактором. Рост сгустка, начинающийся с поверхности, покрытой тканевым фактором, отслеживали с помощью рассеянного света с использованием цифровой камеры в течение 60 мин. Изображения сгустков использовали для определения их размера, который измеряли как расстояние от края активатора до точки, где интенсивность рассеянного света была половиной максимальной интенсивности рассеянного света сгустка на активаторе. Скорости роста сгустка определяли как угловые коэффициенты зависимости размера сгустка от времени в интервале от 2 до 6 мин после начала образования сгустка (начальная скорость, Vi) и от 15 до 25 мин (устойчивая скорость, Vst).
МРТ сердца
Исследование проводили на магнитно-резонансном томографе с полем 3 Тесла (Magnetom Via, Siemens Healthliners, ФРГ) с использованием стандартного протокола МРТ сердца, включавшего в себя кино-последовательности, Т1- и Т2-картирование, позднее усиление гадолинием. МРТ сердца с кардиосинхронизацией и с внутривенным контрастированием препаратами гадолиния (гадобутрол ("Гадовист", Bayer, ФРГ) 1 ммоль/мл в дозировке 0,15 мл/кг веса тела пациента) проводили в течение 1-й недели госпитализации. Анализ изображений выполняли с помощью программы CV142 (Circle, Канада).
Статистический анализ
Математическую и статистическую обработку полученных данных проводили с использованием пакетов прикладного программного обеспечения Stata/MP 13.0 (для Windows 64-bit), Prism (GraphPad, США) и Excel 2016 (Microsoft, США).
Для описания количественных переменных использовали среднее арифметическое значение (М) и стандартное отклонение среднего значения (SD) (для параметрических данных) или медиану (Me) и интерквантильный размах [IQR] (для непараметрических данных). С целью оценки нормальности распределения применяли тест Колмогорова-Смирнова, Skewness тест. Значимость различий между двумя группами по количественным переменным оценивали при помощи U-критерия Мана-Уитни (для непараметрических данных) и t-тест Стьюдента (для параметрических данных). Качественные переменные описывали абсолютными (n) и относительными (%) значениями. Для определения значимости различий качественных показателей использовали критерии хи-квадрат (χ2) и точный критерий Фишера. Статистическую значимость определяли при значении двустороннего р<0,05.
Результаты
В исследование включены 42 пациента с ИМ без подъема сегмента ST (24 пациента в основной группе и 18 пациентов в группе контроля). Медиана возраста пациентов в группах ИМБОКА и ИМОКА составила 58,5 [ 53,5; 65,0] лет и 67,0 [ 58,0; 70,0] лет, соответственно, без значимых различий. Основные клинико-анамнестические характеристики пациентов представлены в табл. 2.
Таблица 2. Характеристика пациентов (n=42)
|
Параметр |
ИМБОКА (n=24) |
ИМОКА (n=18) |
p-value |
|
Клинико-демографические данные |
|||
|
Пол м/ж, n (%) |
9/15 (37,5/62,5) |
12/6 (66,7/33,3) |
0,061 |
|
Возраст на момент госпитализации, лет (Me [ IQR]) |
58,5 [ 53,5-65,0] |
67,0 [ 58,0-70,0] |
0,111 |
|
ИМТ, кг/м2 (Me [ IQR]) |
27,7 [ 24,0-30,65] |
26,8 [ 25,2-29,2] |
0,939 |
|
Гипертоническая болезнь, n (%) |
22 (91,7) |
18 (100,0) |
0,209 |
|
Курение, n (%) |
4 (16,7) |
4 (22,2) |
0,650 |
|
Сахарный диабет, n (%) |
3 (12,5) |
6 (33,3) |
0,103 |
|
ХСН, n (%) |
6 (25,0) |
8 (44,4) |
0,186 |
|
ХБП, n (%) |
1 (4,2) |
3 (16,7) |
0,099 |
|
Заболевание периферических артерий, n (%) |
0 (0,0) |
2 (11,1) |
0,094 |
|
Инфаркт головного мозга/ТИА в анамнезе, n (%) |
0 (0,0) |
1 (5,5) |
0,243 |
|
ХОБЛ, n (%) |
0 (0,0) |
2 (11,1) |
0,094 |
|
Язвенная болезнь желудка и 12пк, n (%) |
2 (8,3) |
1 (5,5) |
0,729 |
|
Гемодинамические данные |
|||
|
Систолическое артериальное давление, мм рт.ст. (Me [ IQR]) |
133,5 [ 127,5-150,5] |
136,0 [ 115,0-165,0] |
0,829 |
|
Диастолическое артериальное давление, мм рт.ст. (Me [ IQR]) |
83,0 [ 76-88] |
75,5 [ 66,0-87,0] |
0,120 |
|
Частота сердечных сокращений, уд в мин (Me [ IQR]) |
75,0 [ 69,5-87,5] |
80,0 [ 70,0-84,0] |
0,859 |
|
Лабораторные данные |
|||
|
Лейкоциты, 109/л (Me [ IQR]) |
7,0 [ 5,9-9,3] |
8,7 [ 7,3-9,6] |
0,082 |
|
Гемоглобин, г/л (Me [ IQR]) |
141,5 [ 129,5-149,5] |
136,0 [ 125,0-150,0] |
0,380 |
|
Тромбоциты, 1012/л (Me [ IQR]) |
227,5 [ 199,5-260,0] |
210,0 [ 182,0-230,0] |
0,269 |
|
С-реактивный белок, мг/л (Me [ IQR]) |
4,8 [ 2,3-7,6] |
21,2 [ 12,8-23,9] |
0,009 |
|
Тропонин при поступлении, нг/мл (Me [ IQR]) |
0,102 [ 0,039-0,760] |
0,127 [ 0,026-0,195] |
0,712 |
|
Тропонин в динамике через 6 часов, нг/мл (Me [ IQR]) |
0,136 [ 0,074-1,265] |
0,376 [ 0,144-1,199] |
0,134 |
|
Холестерин, ммоль/л (Me [ IQR]) |
5,7 [ 4,9-7,4] |
5,4 [ 3,8-6,5] |
0,208 |
|
ЛПНП, ммоль/л (Me [ IQR]) |
3,1 [ 2,6-4,6] |
3,0 [ 2,1-4,2] |
0,492 |
|
Глюкоза, ммоль/л (Me [ IQR]) |
5,7 [ 5,3-6,0] |
7,1 [ 6,2-13,5] |
<0,001 |
|
Креатинин, мкмоль/л (Me [ IQR]) |
79,1 [ 69,1-89,5] |
98,4 [ 85,7-117,0] |
<0,001 |
|
СКФ при поступлении, мл/мин/1,73 м2 (Me [ IQR]) |
80,7 [ 64,3-95,8] |
58,3 [ 44,6-73,8] |
0,012 |
|
Медикаментозная терапия |
|||
|
АСК, n (%) |
24 (100,0) |
18 (100,0) |
|
|
Оральные антикоагулянты, n (%) |
0 (0,0) |
0 (0,0) |
|
|
Бета-блокаторы, n (%) |
21 (95,4) |
17 (94,4) |
0,834 |
|
иАПФ, n (%) |
21 (95,4) |
18 (100,0) |
0,360 |
|
АМКР, n (%) |
0 (0,0) |
3 (16,7) |
0,070 |
|
Липидснижающие препараты (статины), n (%) |
24 (100,0) |
18 (100,0) |
|
|
Инотропная терапия, n (%) |
0 (0,0) |
0 (0,0) |
|
|
Диуретики, n (%) |
7 (29,1) |
8 (44,4) |
0,307 |
|
Инструментальные данные |
|||
|
ФВ левого желудочка, % (Me [ IQR]) |
58,0 [ 55,0-60,5] |
50,0 [ 42,0-54,0] |
<0,001 |
|
Наличие зон НЛС, % |
1 (4,5) |
11 (61,1) |
<0,001 |
|
СДЛА, мм рт.ст. (Me [ IQR]) |
27,0 [ 25,0-30,0] |
26,5 [ 25,0-31,0] |
0,908 |
АСК — ацетилсалициловая кислота, АМКР — антагонисты минералокортикоидных рецепторов, иАПФ — ингибиторы ангиотензинпревращающего фермента, ИМ — инфаркт миокарда, ИМБОКА — инфаркт миокарда без обструкции коронарных артерий, ИМОКА — инфаркт миокарда с обструкцией коронарных артерий, ИМТ — индекс массы тела, КШ — коронарное шунтирование, ЛПНП — липопротеиды низкой плотности, НЛС — нарушение локальной сократимости, СДЛА — систолической давление в легочной артерии, СКФ — скорость клубочковой фильтрации, ТИА — транзиторная ишемическая атака, УЗИ — ультразвуковое исследование, ФВ — фракция выброса, ХБП — хроническая болезнь почек, ХОБЛ — хроническая обструктивная болезнь легких, ХСН — хроническая сердечная недостаточность, ЧКВ — чрескожное коронарное вмешательство.
Отмечены значимые различия концентраций глюкозы, креатинина, С-реактивного белка и больший объем поражения миокарда по данным эхокардиографии у пациентов с ИМОКА, остальные лабораторные и гемодинамические параметры значимо не различались.
При анализе тромбоцитарного звена рутинными методами было получено, что количество тромбоцитов, средний объем тромбоцитов, ширина распределения тромбоцитов по объему и тромбокрит в группах не различались. Показатели представлены в табл. 3.
Таблица 3. Уровень тромбоцитов и морфологические характеристики тромбоцитов (n=42)
|
Параметр |
ИМБОКА (n=24) |
ИМОКА (n=18) |
p-value |
|
Тромбоциты, 1012/л (Me [ IQR]) |
227,5 [ 199,5-260,0] |
210,0 [ 182,0-230,0] |
0,269 |
|
PDW, % (Me [ IQR]) |
16,4 [ 16,1-16,9] |
16,7 [ 16,4-17,2] |
0,226 |
|
PCT, % (Me [ IQR]) |
20,7 [ 16,7-25,4] |
19,3 [ 15,5-23,3] |
0,593 |
|
MPV, фл (Me [ IQR]) |
9,7 [ 8,7-10,4] |
9,1 [ 8,2-10,5] |
0,423 |
ИМБОКА — инфаркт миокарда без обструкции коронарных артерий, ИМОКА — инфаркт миокарда с обструкцией коронарных артерий, PDW — ширина распределения тромбоцитов по объему, PCT — тромбокрит (общий объем тромбоцитов в крови), MPV — средний объем тромбоцитов в крови
При выполнении СТА было получено, что по показателю максимума агрегации тромбоцитов и показателю скорости агрегации тромбоцитов у пациентов в группе ИМБОКА значимо снижено образование агрегатов тромбоцитов при стимуляции АДФ в различных концентрациях относительно группы пациентов с ИМОКА (рис. 1, 2). В то же время по показателю максимума агрегации тромбоцитов в группе пациентов с ИМОКА при стимуляции тромбоцитов коллагеном значимо снижено образование агрегатов относительно пациентов в группе ИМБОКА (снижено образование как крупных агрегатов по данным Solar 2110, так и малых агрегатов по данным LASCA) (рис. 1, 3). В обеих группах (ИМБОКА и ИМОКА) индекс необратимости агрегации тромбоцитов в ответ на стимуляцию различными концентрациями АДФ и стимуляцию TRAP-6 (активатор рецептора PAR-1) снижен относительно референсных значений, следовательно, агрегаты менее стабильны (рис. 4).
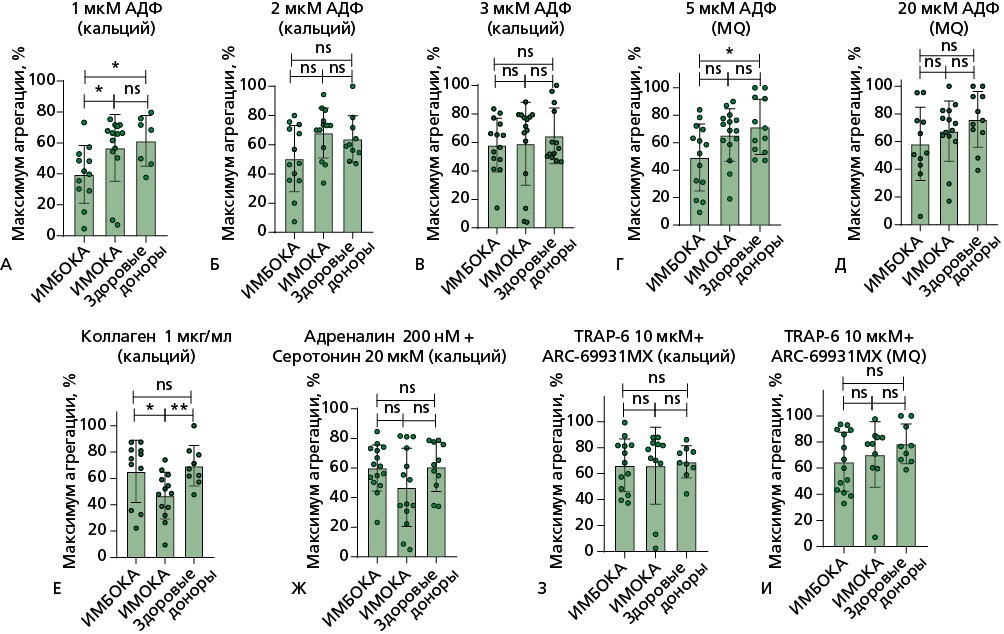
Рисунок 1. Световая трансмиссионная агрегометрия на агрегометре Solar AP 2110. Максимум агрегации тромбоцитов.
В плазме, обогащенной тромбоцитами, анализ показателя максимума агрегации тромбоцитов (измеряется в %) выявил следующие различия:
А — при стимуляции тромбоцитов АДФ в концентрации 1 мкмоль/л в присутствии ионов кальция в группе ИМБОКА показатель значимо снижен относительно показателей в группе здоровых добровольцев и относительно группы ИМОКА; Б, В — при стимуляции тромбоцитов АДФ в концентрации 2 мкмоль/л и 3 мкмоль/л в присутствии ионов кальция различий между группами не выявлено; Г — при стимуляции тромбоцитов АДФ в концентрации 5 мкмоль/л в группе ИМБОКА показатель значимо снижен относительно показателей в группе здоровых добровольцев; Д — при стимуляции тромбоцитов АДФ в концентрации 20 мкмоль/л в присутствии ионов кальция различий между группами не выявлено; Е — при стимуляции тромбоцитов коллагеном в концентрации 1 мкг/мл показатель максимума агрегации значимо снижен в группе ИМОКА относительно группы ИМБОКА и относительно показателей в группе здоровых добровольцев; Ж, З, И — при стимуляции тромбоцитов адреналином в концентрации 200 нмоль/л и cеротонином 20 мкмоль/л, TRAP-6 в концентрации 10 мкмоль/л различий между группами не выявлено.
Богатая тромбоцитами плазма активировалась различными индукторами агрегации, время измерения составляло 600 секунд. В тех измерениях, где происходила рекальцификальция БТП до измерения, указано (кальций). В образцах без рекальцификации указано (MQ). Сравнение показателей между группами проводилось с помощью критерия Манна-Уитни: n.s — статистически не значимые различия, * — p<0,05; ** — p<0,01; *** — p<0,001.
TRAP-6 — thrombin receptor activating peptide 6 (пептид 6, активирующий рецептор тромбина), АДФ — аденозиндифосфат, БТП — богатая тромбоцитами плазма, ИМБОКА — инфаркт миокарда без обструкции коронарных артерий, ИМОКА — инфаркт миокарда с обструкцией коронарных артерий.
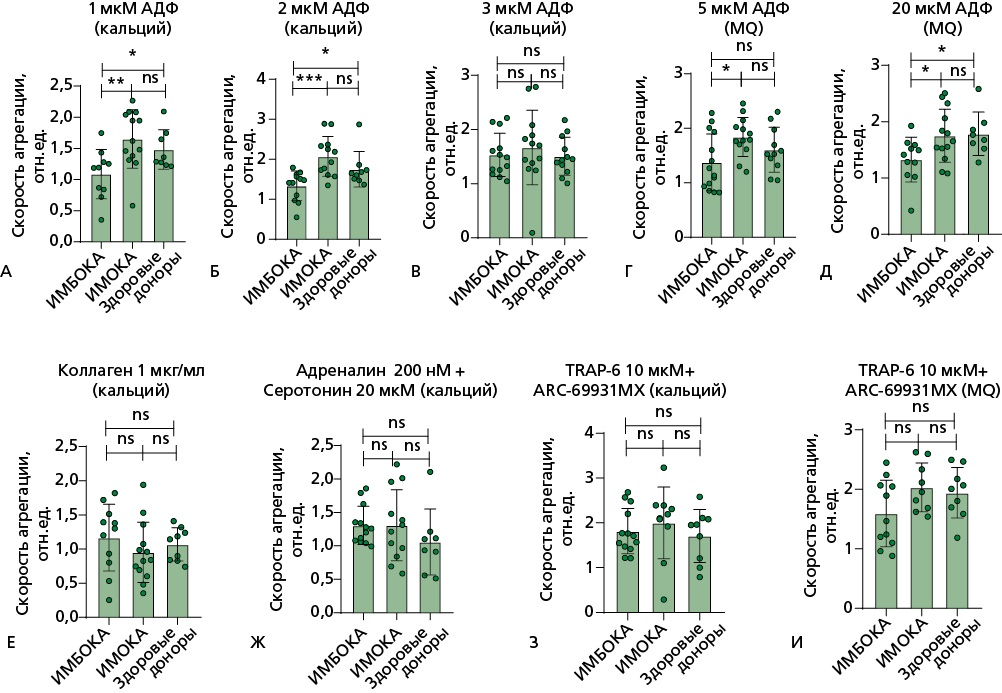
Рисунок 2. Световая трансмиссионная агрегометрия на агрегометре Solar AP 2110. Скорость агрегации тромбоцитов.
В БТП анализ показателя скорости агрегации тромбоцитов (измеряется в относительных единицах) выявил следующие различия:
А, Б, Д — при стимуляции тромбоцитов АДФ в концентрациях 1, 2, 20 мкмоль/л в присутствии ионов кальция в группе ИМБОКА показатель значимо снижен относительно показателей в группе здоровых добровольцев и относительно группы ИМОКА; В — при стимуляции тромбоцитов АДФ в концентрации 3 мкмоль/л различий между группами не выявлено; Г — при стимуляции тромбоцитов АДФ в концентрации 5 мкмоль/л в группе ИМБОКА показатель значимо снижен относительно группы ИМОКА; Е, Ж, З, И — при стимуляции тромбоцитов коллагеном в концентрации 1 мкг/мл, адреналином в концентрации 200 нмоль/л и cеротонином 20 мкмоль/л, TRAP-6 в концентрации 10 мкмоль/л различий между группами не выявлено.
БТП активировалась различными индукторами агрегации, время измерения составляло 600 секунд. В тех измерениях, где происходила рекальцификальция БТП до измерения, указано (кальций). В образцах без рекальцификации указано (MQ). Сравнение показателей между группами проводилось с помощью критерия Манна-Уитни: n.s. — статистически не значимые различия, * — p<0,05; ** — p<0,01; *** — p<0,001.
TRAP-6 — thrombin receptor activating peptide 6 (пептид 6, активирующий рецептор тромбина), АДФ — аденозиндифосфат, БТП — богатая тромбоцитами плазма, ИМБОКА — инфаркт миокарда без обструкции коронарных артерий, ИМОКА — инфаркт миокарда с обструкцией коронарных артерий
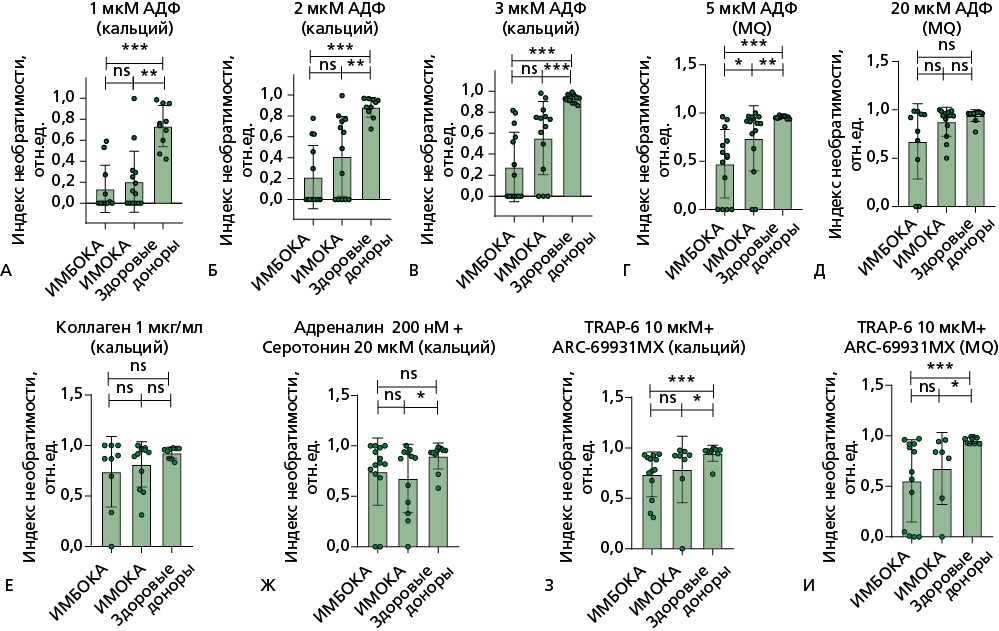
Рисунок 3. Световая трансмиссионная агрегометрия на агрегометре LASCA.
В БТП при анализе формирования агрегатов малых размеров при стимуляции тромбоцитов АДФ в концентрации 800 нмоль/л выявлены следующие различия:
А, Б — группах ИМБОКА и ИМОКА показатель начальной скорости и амплитуды агрегации тромбоцитов значимо снижены относительно показателей здоровых добровольцев, между собой группы не различаются; В — амплитуда изменения формы значимо снижена в группе ИМОКА по сравнению с контрольной группой и группой ИМБОКА.
В БТП при анализе формирования агрегатов малых размеров при стимуляции тромбоцитов коллагеном в концентрации 0,4 мг/мл:
Г — показатель начальной скорости между группами не различается; Д, Ж — в группе ИМОКА показатели амплитуды агрегации и времени плазменного звена свертывания снижены относительно группы ИМБОКА и группы здоровых добровольцев; Е — показатель амплитуда изменения формы между группами не различается; З — показатель Лаг-тайм у пациентов значимо снижен относительно здоровых добровольцев, между собой группы больных по данному показателю не различаются.
Сравнение показателей между группами проводилось с помощью критерия Манна-Уитни: n.s. — статистически не значимые различия, * — p<0,05; ** — p<0,01; *** — p<0,001.
АДФ — аденозиндифосфат, БТП — богатая тромбоцитами плазма, ИМБОКА — инфаркт миокарда без обструкции коронарных артерий, ИМОКА — инфаркт миокарда с обструкцией коронарных артерий
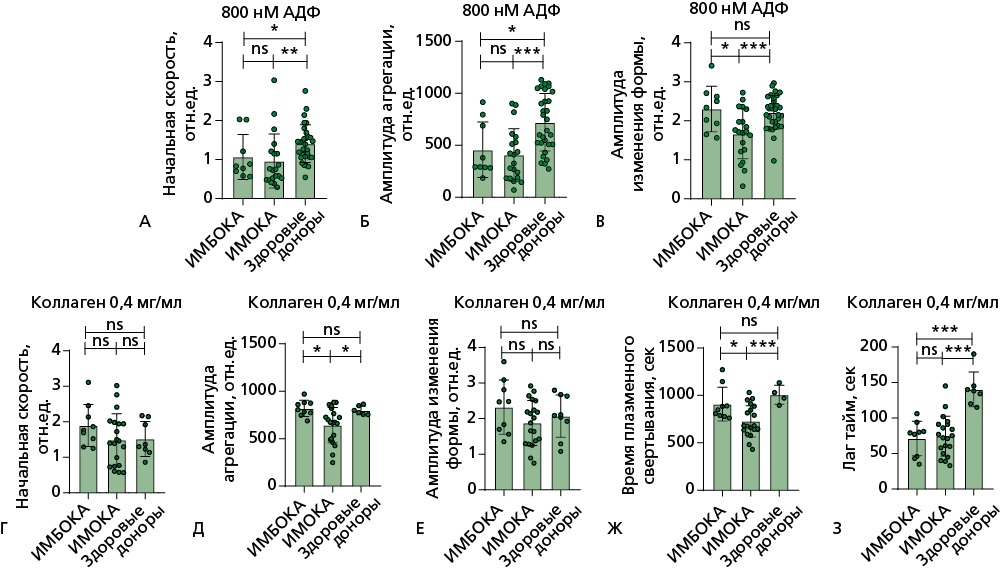
Рисунок 4. Световая трансмиссионная агрегометрия на агрегометре Solar AP 2110. Индекс необратимости.
В БТП анализ стабильности агрегатов тромбоцитов — индекс необратимости — выявил следующие различия: А, Б, В — при стимуляции тромбоцитов АДФ в концентрациях от 1 до 3 мкмоль/л в присутствии ионов кальция в группах ИМБОКА и ИМОКА показатель значимо снижен относительно показателей группы здоровых добровольцев; Г — при стимуляции тромбоцитов АДФ в концентрации 5 мкмоль/л в группе ИМБОКА показатель значимо снижен относительно группы ИМОКА; Д, Е, Ж — при стимуляции тромбоцитов АДФ в концентрации 20 мкмоль/л, коллагеном в концентрации 1 мкг/мл, адреналином в концентрации 200 нмоль/л и cеротонином 20 мкмоль/л показатели между группами не различались; З, И — при стимуляции тромбоцитов TRAP-6 в концентрации 10 мкмоль/л в присутствии ингибитора рецептора к АДФ P2Y12 — ARC-69931MX, как в присутствии ионов кальция, так и в их отсутствии показатель значимо снижен относительно показателей группы здоровых добровольцев.
БТП активировалась различными индукторами агрегации, время измерения составляло 600 секунд. В тех измерениях, где происходила рекальцификальция БТП до измерения, указано (кальций). В образцах без рекальцификации указано (MQ). Сравнение показателей между группами проводилось с помощью критерия Манна-Уитни: n.s. — статистически не значимые различия, * — p<0,05; ** — p<0,01; *** — p<0,001.
TRAP-6 — thrombin receptor activating peptide 6 (пептид 6, активирующий рецептор тромбина), АДФ — аденозиндифосфат, БТП — богатая тромбоцитами плазма, ИМБОКА — инфаркт миокарда без обструкции коронарных артерий, ИМОКА — инфаркт миокарда с обструкцией коронарных артерий
При выполнении проточной цитометрии по протоколу теста ФАТ (в покое и после активации тромбоцитов CRP и TRAP-6) было выявлено, что в группе пациентов с ИМБОКА значимо снижен уровень гликопротеина Ib после активации (адгезия к повреждению через фактор Виллебранда) по сравнению с группы ИМОКА. Кроме того, в обеих группах значимо увеличен размер и гранулярность тромбоцита после активации, значимо снижено количество фосфатидилсерин-положительных (прокоагулянтных) тромбоцитов и выброс плотных гранул после активации относительно контрольной группы. У группы ИМОКА снижен p-селектин (выброс альфа-гранул), как в покое, так и при активации относительно группы здоровых добровольцев (рис. 5).
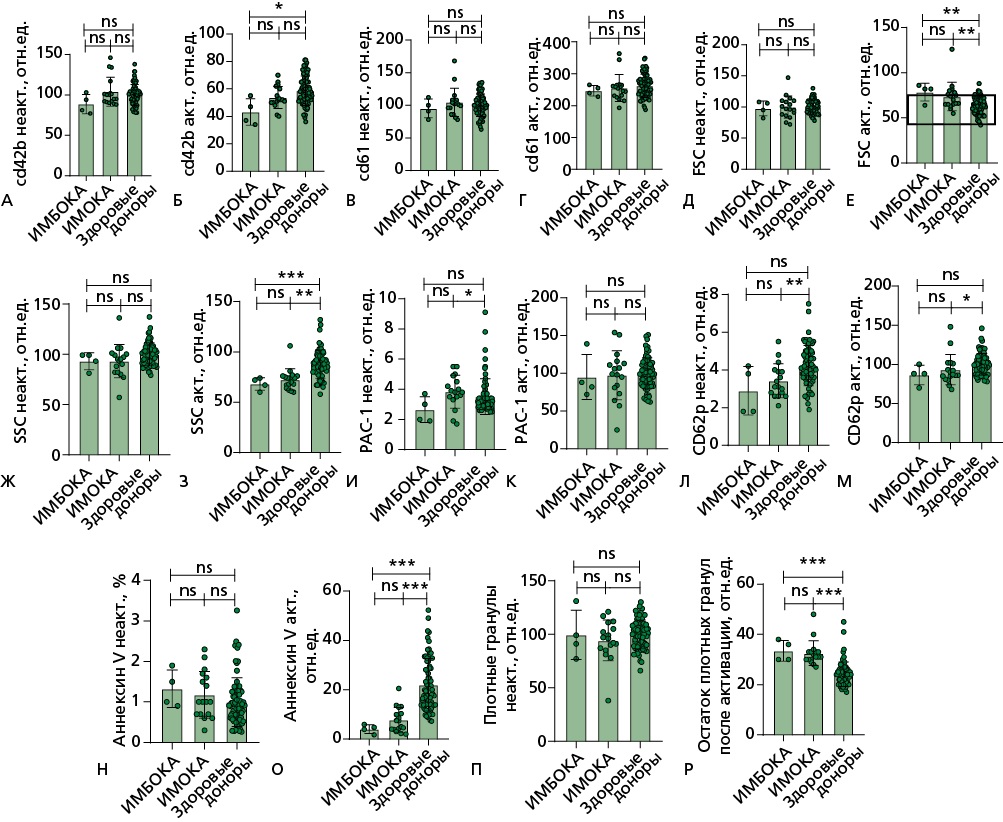
Рисунок 5. Проточная цитометрия на цитофлуориметре NovoCyte по протоколу теста ФАТ (в покое и после активации тромбоцитов CRP и TRAP-6)
Измеряемые в тесте параметры и флуоресцентные метки для их анализа: А, Б — уровень гликопротеина Ib — CD42b-PE; В, Г — уровень гликопротеина IIb/IIIa — CD61-PE; Д, Е — FSC — прямое светорассеяние, определяющее размер тромбоцитов; Ж, З — SSC — боковое светорассеяние, определяющее гранулярность тромбоцитов; И, К — уровень активированного гликопротеина IIb/IIIa — PAC1-FITC; Л, М — P-селектин — CD62P-Alexa647; Н, О — фосфатидил-положительные тромбоциты по маркеру Аннексин V; П, Р — плотные гранулы в тромбоцитах до и после активации. Сравнение показателей между группами проводилось с помощью критерия Манна-Уитни: n.s. — статистически не значимые различия, * — p<0,05; ** — p<0,01; *** — p<0,001.
TRAP-6 — thrombin receptor activating peptide 6 (пептид 6, активирующий рецептор тромбина), CRP — collagen-related peptide (коллаген-подобный пептид), ИМБОКА — инфаркт миокарда без обструкции коронарных артерий, ИМОКА — инфаркт миокарда с обструкцией коронарных артерий, ФАТ — функциональная активность тромбоцитов
При исследовании кальциевой сигнализации внутри тромбоцита в ответ на стимул (кинетика активации тромбоцита в течение 10 минут после добавления активаторов АДФ, CRP либо TRAP-6) было выявлено, что высвобождение кальция в ответ на АДФ в группе ИМОКА более выражено, чем в группе ИМБОКА (рис. 6).
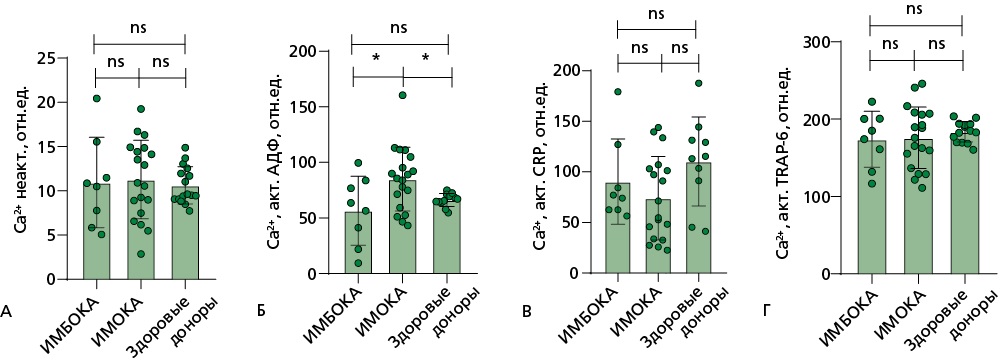
Рисунок 6. Проточная цитометрия на цитофлуориметре BD FACS Canto II для изучения кальциевой сигнализации: кинетика тромбоцита в течении 10 мин после активации тромбоцитов АДФ, CRP либо TRAP-6
Проточная цитометрия на цитофлуориметре BD FACS Canto II для изучения кальциевой сигнализации: кинетика тромбоцита измерялась А — до активации и в течении 10 мин после активации тромбоцитов; Б — АДФ; В — CRP либо Г — TRAP-6. Кальциевая сигнализация исследовалась при помощи загрузки тромбоцитов Fura-red. Сравнение показателей между группами проводилось с помощью критерия Манна-Уитни: n.s. — статистически не значимые различия, * — p<0,05; ** — p<0,01; *** — p<0,001.
TRAP-6 — thrombin receptor activating peptide 6 (пептид 6, активирующий рецептор тромбина), CRP — collagen-related peptide (коллаген-подобный пептид), АДФ — аденозиндифосфат, ИМБОКА — инфаркт миокарда без обструкции коронарных артерий, ИМОКА — инфаркт миокарда с обструкцией коронарных артерий, ФАТ — функциональная активность тромбоцитов
При анализе данных рутинных показателей системы гемостаза выявлено, что у пациентов в группе ИМБОКА определяется статистически значимо более низкий уровень международного нормализованного отношения (р=0,032). По остальным показателям, включая активированное частичное тромбопластиновое время и D-димер различий выявлено не было. Показатели системы гемостаза представлены в табл. 4.
Таблица 4. Показатели системы гемостаза (n=42)
|
Параметр |
ИМБОКА (n=24) |
ИМОКА (n=18) |
p-value |
|
АЧТВ, с (Me [ IQR]) |
26,9 [ 25,5-29,8] |
27,5 [ 22,5-30,3] |
0,799 |
|
ПВ, с (Me [ IQR]) |
11,7 [ 11,3-12,0] |
12,2 [ 11,7-13,1] |
0,037 |
|
МНО (Me [ IQR]) |
1,0 [ 0,9-1,1] |
1,1 [ 1,0-1,2] |
0,032 |
|
D-димер, нг/мл (Me [ IQR]) |
156,5 [ 126-210] |
113,5 [ 33-626] |
0,572 |
АЧТВ — активированное частичное тромбопластиновое время, ИМБОКА — инфаркт миокарда без обструкции коронарных артерий, ИМОКА — инфаркт миокарда с обструкцией коронарных артерий, МНО — международное нормализованное отношение, ПВ — протромбиновое время.
При анализе данных интегрального теста свертывания с помощью регистратора "Тромбодинамика" было получено, что у пациентов в группах ИМБОКА и ИМОКА значимо снижены размер сгустка и скорости (начальная и стационарная), у группы ИМОКА значимо увеличено время образования сгустка, при этом плотность сгустка в группе пациентов с ИМБОКА была ниже. Однако данные значения не выходили за границы референсных значений, и у всех пациентов регистрировалась нормокоагуляция (рис. 7).
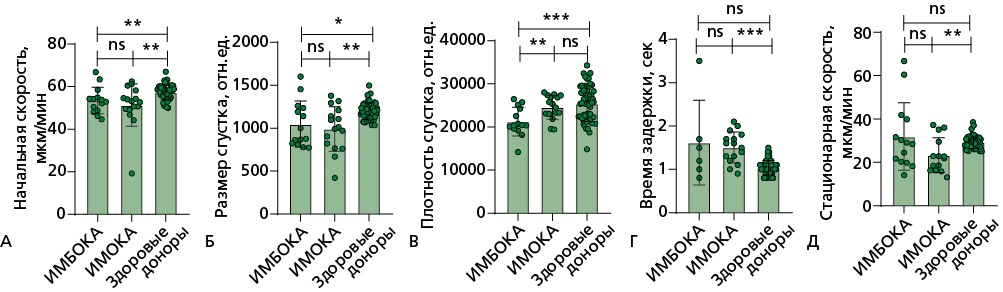
Рисунок 7. Тромбодинамика.
В плазме крови при анализе данных интегрального теста свертывания с помощью регистратора "Тромбодинамика":
А, Б — показатели начальной скорости роста сгустка (измеряется в мкм/мин), размер сгустка (измеряется в относительных единицах) снижены по отношению к группе здоровых добровольцев; В — показатель плотности сгустка (измеряется в относительных единицах) в группе пациентов ИМБОКА ниже относительно группы пациентов с ИМОКА и группы здоровых добровольцев; Г — время задержки роста сгустка было значимо повышено в группе ИМОКА относительно группы здоровых добровольцев; Д — показатель стационарной скорости роста сгустка (измеряется в мкм/мин), снижен в группе ИМОКА по отношению к группе здоровых добровольцев.
Сравнение показателей между группами проводилось с помощью критерия Манна-Уитни: n.s. — статистически не значимые различия, * — p<0,05; ** — p<0,01; *** — p<0,001.
ИМБОКА — инфаркт миокарда без обструкции коронарных артерий, ИМОКА — инфаркт миокарда с обструкцией коронарных артерий.
Обсуждение
Существует гипотеза, что тромбоцитарно-эритроцитарный сгусток может быть причиной развития ИМБОКА, описаны случаи ИМБОКА у пациентов с тромбоцитозом [21]. В проведенном исследовании у пациентов в группе ИМБОКА по сравнению с пациентами в группе ИМОКА различий по количеству тромбоцитов выявлено не было, при этом в работе Д. А. Воробьевой и соавт. [4] был выявлен более высокий уровень тромбоцитов у пациентов с ИМБОКА на 2-е и 4-е сутки острого ИМ (р=0,046 и р=0,01). Тромбокрит и рутинные морфологические характеристики тромбоцитов (средний объем тромбоцитов, ширина распределения тромбоцитов по объему) в группах не различались и ранее не были изучены. Исследование функции тромбоцитов с данным набором исследований (СТА, ФАТ и оценка кальциевой сигнализации) ранее не проводилось в группе пациентов с ИМБОКА. По данным исследования M. K. Puurunen и соавт. с применением метода СТА (в популяции Framingham Heart Study) выявлено, что на фоне стимуляции АДФ в концентрации 1,0 мкмоль/л повышенная агрегация тромбоцитов значимо ассоциировалась с развитием ишемического инсульта (относительный риск (RR) 1,68 [ 95% доверительный интервал (ДИ) 1,13-2,50], p=0,011) [22]. В проведенном исследовании по данным СТА был получен профиль тромбоцитов со сниженным образованием агрегатов по сравнению с контрольной группой, который можно было бы объяснить тем, что у пациентов было ингибирование вторичной активации тромбоцитов ацетилсалициловой кислотой: все пациенты получили на догоспитальном этапе нагрузочную дозу 250 мг, так как были доставлены в стационар с направительным диагнозом "острый коронарный синдром". При этом также были выявлены межгрупповые различия: при стимуляции рецепторов P2Y1 и P2Y12 (активатором АДФ в различных концентрациях) в группе ИМБОКА ответ был ниже, чем в группе ИМОКА, а при стимуляции коллагеном (рецепторы адгезии гликопротеин IIb/IIIa и гликопротеиновый рецептор VI) ответ, был ниже в группе ИМОКА. Таким образом, в группе пациентов с ИМБОКА агрегация была снижена относительно группы ИМОКА, на фоне стимуляции АДФ как в исследовании [22], что потенциально определяет худший прогноз и частоту сердечно-сосудистых событий у пациентов с обструктивным атеросклерозом коронарных артерий. В исследовании A. Lee и соавт. [23] активность тромбоцитов оценивали по поверхностной экспрессии P-селектина, PAC-1 и тромбоцитарно-моноцитарных агрегатов с помощью проточной цитометрии у пациентов с ИМБОКА и ИМОКА: количество тромбоцитарно-моноцитарных агрегатов было значительно выше и в группе пациентов ИМБОКА (M±SD, 27,3±2,6), и в группе пациентов с ИМОКА (29,7±3) по сравнению с контрольной группой (19±1,4, p=0,027 и p=0,005, соответственно). Количество тромбоцитарно-моноцитарных агрегатов при поступлении значимо коррелировало с показателями психологического стресса (R=0,412, p=0,009) и со временем снижалось в группе пациентов с ИМОКА (p=0,006), а у женщин в группе пациентов с ИМБОКА оставалось повышенным (p=0,49). В этом же исследовании значимых различий в других маркерах активности тромбоцитов (P-селектин и PAC-1) между группами ИМБОКА, ИМОКА и группой контроля выявлено не было. Авторы сделали заключение, что тромбоцитарно-моноцитарные агрегаты повышаются остро как в группе пациентов ИМБОКА, так и в группе пациентов с ИМОКА и связаны с психологическим стрессом, однако повышение тромбоцитарно-моноцитарных агрегатов сохраняется в течение длительного времени только в группе пациентов ИМБОКА, но не ИМОКА [23]. Перекрестное взаимодействие между тромбоцитами и моноцитами является важнейшим механизмом, связывающим тромбоз и воспаление. Таким образом, полученные результаты указывают на потенциальное различие в патофизиологии ИМБОКА и ИМОКА. В настоящем исследовании увеличении размера тромбоцита после активации, снижение Р-селектина, как в покое, так и после активации, снижение количества прокоагулянтных фосфатидилсерин-положительных тромбоцитов и выброс плотных гранул после активации в обеих группах не различались. Высвобождение кальция в ответ на АДФ в группе ИМБОКА было менее выражено, чем в группе ИМОКА, то есть по отношению к группе ИМОКА активность тромбоцитов в группе ИМБОКА была снижена. Все эти данные, а также показатели ФАТ указывают на фенотип "усталых" (exhausted) тромбоцитов у пациентов с ИМБОКА, что свидетельствует об их подактивации в кровотоке и снижении нормальной функциональной активности [7].
В качестве одной из возможных причин ИМБОКА в предыдущих исследованиях и обзорах постулировалось наличие тромбофилии, приводящие к повышенной склонности к внутрисосудистому образованию тромбов [24][25]. В исследовании S. Maiwald и соавт. в группах ИМБОКА и ИМОКА состояние системы гемостаза изучалось интегральным тестом оценки гемостаза — тестом генерации тромбина, было показано, что результаты данного теста были схожи в группе ИМБОКА и ИМОКА и были значимо выше, чем в контрольной группе. Несмотря на то, что интерпретация результатов исследования была затруднена небольшим размером выборки, тем не менее это было первое исследование, где было показаны особенности состояния гемостаза у таких пациентов [26]. В исследовании S. Pasupathy и соавт. также изучался гемостаз в группах ИМБОКА и ИМОКА при помощи теста генерации тромбина, было показано отсутствие различий по основным показателям теста (включая эндогенный тромбиновый потенциал, пик образования тромбина, время задержки роста сгустка, время до образования пика и индекс скорости) между группами, было также показано отсутствие различий в частоте обнаружения врожденных и приобретенных тромбофилий и значений D-димера [1]. В проведенном исследовании впервые был использован другой интегральный тест для оценки гемостаза — тест "Тромбодинамика". Показано, что в обеих группах (ИМБОКА и ИМОКА) значимо снижены размеры сгустка, скорость его образования (как начальная, так и стационарная), при этом в группе пациентов с ИМБОКА плотность сгустка ниже относительно группы ИМОКА. Тем не менее, полученные значения не выходили за пределы референсных интервалов, таким образом, у всех пациентов регистрировалась нормокоагуляция. Потенциальным объяснением такого результата может быть то, что у пациентов с ИМБОКА происходит небольшой разрыв атеросклеротической бляшки, который не выявляется по данным коронарной ангиографии, и он может быть причиной атеротромбоза, приводящего к обструкции коронарной артерии. Такие нарушения практически невозможно обнаружить по данным интегральных тестов оценки гемостаза (теста генерации тромбина, "Тромбодинамика"). Потенциальная роль такого механизма развития ИМБОКА была описана в исследовании H. R. Reynolds и соавт., где у 16 из 42 пациентов, которым выполнялось внутрисосудистое ультразвуковое исследование во время коронароангиографии, был выявлен разрыв бляшки [27].
Повышенный уровень фибриногена в плазме крови вне зависимости от причины может вызывать состояние гиперкоагуляции, которое влияет на степень и продолжительность формирования тромба при атеротромбозе, есть данные о том, что уровень фибриногена может быть связан с риском развития ИМ [28]. В исследовании S. Pasupathy и соавт. [1] было выявлено незначительное повышение фибриногена в группе ИМБОКА и ИМОКА, при этом различий между группами в уровне D-димера в этом же исследовании выявлено не было, хотя известно, что D-димер свидетельствует о продолжающемся образовании и лизисе тромба и о том, что у пациентов с ИМ повышена фибринолитическая активность в течение нескольких недель. В исследовании Д. А. Воробьевой и соавт. положительный D-димер определялся у 4 (25%) пациентов с ИМБОКА и не определялся в группе ИМОКА (p=0,020) [4]. В данном исследовании значимых различий по уровню D-димера выявлено не было.
Ограничения исследования
Ограничениями данного исследования является относительно небольшой размер выборки, однако рассчитать размер выборки для данной популяции было сложно из-за того, что исследований особенностей тромбоцитарного звена изучаемыми методами и интегрального теста оценки гемостаза с использованием регистратора "Тромбодинамика" у пациентов с ИМБОКА ранее не проводилось и доля ожидаемого количества событий неизвестна. Другое ограничение исследования — включались пациенты с выявленным ишемическим паттерном по данным МРТ сердца и без выявленных изменений по данным МРТ сердца, исключались только пациенты с неишемическим паттерном. В группе пациентов, у которых не было выявлено изменений по данным МРТ сердца (неклассифицированный ИМБОКА) дальнейшее интракоронарное обследование для выявления точной причины развития ИМБОКА не проводилось, что также могло повлиять на результаты исследования. Еще одним ограничением изучения состояния тромбоцитарного звена является тот факт, что пациенты получили нагрузочную дозу ацетилсалициловой кислоты на догоспитальном этапе, что также могло повлиять на результаты исследования, однако изучение состояния гемостаза у пациентов с острым коронарным синдромом не должно быть причиной несвоевременного назначения антитромбоцитарных препаратов в связи с высокой вероятностью развития осложнений и неэтично. Кроме того, группа сравнения (пациенты с ИМОКА) также получала нагрузочную дозу и интерес представляли возможные выявленные различия между группами.
Заключение
Таким образом, глобальное состояние системы гемостаза и рутинные маркеры коагуляции в данном исследовании не различались между пациентами в группах ИМОКА и ИМБОКА, и незначительно отличались от показателей в группе здоровых добровольцев, что подтвердило результаты прошлых исследований о том, что разница в анатомии коронарных артерий и степень атеросклеротического поражения существенно не влияют на плазменное звено системы гемостаза, а выдвинутая ранее гипотеза о протромботическом состоянии системы гемостаза у пациентов с ИМБОКА неубедительна и вряд ли может повлиять на клиническую практику. Вместе с тем установлено, что активность тромбоцитов в группе пациентов с ИМОКА выше, с ИМБОКА. В связи с полученными данными представляется рациональной стратегия двойной антитромбоцитарной терапии с клопидогрелом (без мощных ингибиторов P2Y12 рецепторов тромбоцитов), однако данная гипотеза требует подтверждения в рандомизированных клинических исследованиях.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование: Работа выполнена при поддержке гранта Российского научного фонда (проект № 24-15-00387) с использованием биоматериала человека, собранного и сохраняемого в рамках научной программы. Оборудование для сбора, хранения и транспортировки биоматериала человека, оборудование для обследования пациентов приобретено за счет средств Программы стратегического академического лидерства РУДН.
Funding: The study was performed with the support of Grant from the Russian Science Foundation (project No. 24-15-00387). Equipment for the collection, storage and transportation of human biomaterial, equipment for the study of patients, was supported by the RUDN University Strategic Academic Leadership Program.
Список литературы
1. Pasupathy S, Rodgers S, Tavella R, et al. Risk of Thrombosis in Patients Presenting with Myocardial Infarction with Nonobstructive Coronary Arteries (MINOCA). TH Open. 2018;2(2):e167-72. DOI:10.1055/s-0038-1645875.
2. Федорова С. Б., Кулагина И. В., Рябов В. В. Полиморфизмы генов факторов системы гемостаза у пациентов с невыраженными изменениями коронарных артерий при остром коронарном синдроме. Кардиология. 2019;59(10):14-22. DOI:10.18087/cardio.2019.10.2680.
3. Рябов В. В., Гомбоева С. Б., Лугачева Ю. Г. и др. Неблагоприятные варианты генов метаболизма фолатов у пациентов с острым коронарным синдромом при необструктивном коронарном атеросклерозе. Российский кардиологический журнал. 2018;23(10):33-42. DOI:10.15829/1560-4071-2018-10-33-42.
4. Воробьева Д. А., Лугачева Ю. Г., Капилевич Н. А., Рябов В. В. Сравнительный анализ протромботической активности у пациентов с инфарктом миокарда при необструктивном и обструктивном поражениях коронарных артерий. Российский кардиологический журнал. 2021;26(2):3939. DOI:10.15829/1560-4071-2021-3939.
5. Pasupathy S, Air T, Dreyer RP, et al. Systematic review of patients presenting with suspected myocardial infarction and nonobstructive coronary arteries. Circulation. 2015;131(10):861-70. DOI:10.1161/CIRCULATIONAHA.114.011201.
6. Da Costa A, Tardy B, Haouchette K, et al. Long-term prognosis of patients with myocardial infarction and normal coronary angiography: impact of inherited coagulation disorders. Thromb Haemost. 2004;91(2):388-93. DOI:10.1160/TH03-07-0442.
7. Кобалава Ж. Д., Писарюк А. С., Филькова А. А., и др. Фенотипы тромбоцитов и практические аспекты методов тестирования функции тромбоцитов в кардиологии. Рациональная Фармакотерапия в Кардиологии. 2023;19(6):614-628. DOI:10.20996/1819-6446-2023-2981.
8. Gurbel PA, Antonino MJ, Bliden KP, et al. Platelet reactivity to adenosine diphosphate and long-term ischemic event occurrence following percutaneous coronary intervention: a potential antiplatelet therapeutic target. Platelets. 2008;19(8):595-604. DOI:10.1080/09537100802351065.
9. Price MJ, Endemann S, Gollapudi RR, et al. Prognostic significance of post-clopidogrel platelet reactivity assessed by a point-of-care assay on thrombotic events after drug-eluting stent implantation. Eur Heart J. 2008;29(8):992-1000. DOI:10.1093/eurheartj/ehn046.
10. Frere C, Cuisset T, Quilici J, et al. ADP-induced platelet aggregation and platelet reactivity index VASP are good predictive markers for clinical outcomes in non-ST elevation acute coronary syndrome. Thromb Haemost. 2007;98(4):838-43.
11. Blindt R, Stellbrink K, de Taeye A, et al. The significance of vasodilator-stimulated phosphoprotein for risk stratification of stent thrombosis. Thromb Haemost. 2007;98(6):1329-34.
12. Cuisset T, Frere C, Quilici J, et al. High post-treatment platelet reactivity is associated with a high incidence of myonecrosis after stenting for non-ST elevation acute coronary syndromes. Thromb Haemost. 2007;97(2:282-287.
13. Marcucci R, Gori AM, Paniccia R, et al. Cardiovascular death and nonfatal myocardial infarction in acute coronary syndrome patients receiving coronary stenting are predicted by residual platelet reactivity to ADP detected by a point-of-care assay: a 12-month follow-up. Circulation. 2009;119(2):237-342. DOI:10.1161/CIRCULATIONAHA.108.812636.
14. Sibbing D, Braun S, Morath T, et al. Platelet reactivity after clopidogrel treatment assessed with point-of-care analysis and early drug-eluting stent thrombosis. J Am Coll Cardiol. 2009;53(10):849-56. DOI:10.1016/j.jacc.2008.11.030.
15. Cuisset T, Frere C, Quilici J, et al. Predictive values of post-treatment adenosine diphosphate-induced aggregation and vasodilator-stimulated phosphoprotein index for stent thrombosis after acute coronary syndrome in clopidogrel-treated patients. Am J Cardiol. 2009;104(8):1078-82. DOI:10.1016/j.amjcard.2009.06.007.
16. Breet NJ, Van Werkum JW, Bouman HJ, et al. Comparison of platelet function tests in predicting clinical outcome in patients undergoing coronary stent implantation. JAMA. 2010;303(8):754-62. DOI:10.1001/jama.2010.181.
17. Collet JP, Thiele H, Barbato E, et al; ESC Scientific Document Group. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J. 2021;42(14):1289-1367. doi: 10.1093/eurheartj/ehaa575.
18. Филькова А. А., Пантелеев М. А., Свешникова А. Н. Обратимая агрегация тромбоцитов в присутствии ионов кальция: механизмы и потенциальная значимость. Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2019;18(3):120-9. DOI:10.24287/1726-1708-2019-18-3-120-129.
19. Mindukshev I, Gambaryan S, Kehrer L, et al. Low angle light scattering analysis: a novel quantitative method for functional characterization of human and murine platelet receptors. Clin Chem Lab Med. 2012;50(7):1253-62. DOI:10.1515/CCLM.2011.817.
20. Ignatova AA, Ponomarenko EA, Polokhov DM, et al. Flow cytometry for pediatric platelets. Platelets. 2019;30(4):428-37. DOI:10.1080/09537104.2018.1513473.
21. Ovsyannikova GS, Fedorova DV, Tesakov IP, et al. Platelet functional abnormalities and clinical presentation in pediatric patients with germline RUNX1, ANKRD26, and ETV6 mutations. Haematologica. 2022;107(10):2511-16. DOI:10.3324/haematol.2022.281340.
22. Alonge S, Acone L, Toscano E, Mortara A. MINOCA in a young patient with elevated platelet count [abstract]. Eur Heart J Suppl. 2021;23:suab140.004. DOI:10.1093/eurheartj/suab140.004.
23. Puurunen MK, Hwang SJ, Larson MG, et al. ADP Platelet Hyperreactivity Predicts Cardiovascular Disease in the FHS (Framingham Heart Study). J Am Heart Assoc. 2018;7(5):e008522. DOI:10.1161/JAHA.118.008522
24. Lee А, Barrett T, Spruill T, et al. Platelet-Monocyte Aggregates Correlate With Psychological Stress and Are Increased in Women With Myocardial Infarction With Non-Obstructive Coronary Artery Disease (MINOCA): Findings From the American Heart Association Go Red for Women Strategically Focused Research Network [abstract]. Circulation. 2019;140 Suppl 1:A14829.
25. Kardasz I, De Caterina R. Myocardial infarction with normal coronary arteries: a conundrum with multiple aetiologies and variable prognosis: an update. J Intern Med. 2007;261(04):330-48. DOI:10.1111/j.1365-2796.2007.01788.x.
26. Maiwald S, Oey RC, Sivapalaratnam S, et al. Abnormal hemostatic parameters in patients with myocardial infarction but angiographically normal coronary arteries [letter]. Int J Cardiol. 2014;174(3):734-5. DOI:10.1016/j.ijcard.2014.04.099.
27. Reynolds HR, Srichai MB, Iqbal SN, et al. Mechanisms of myocardial infarction in women without angiographically obstructive coronary artery disease. Circulation. 2011;124(13):1414-25. DOI:10.1161/CIRCULATIONAHA.111.026542.
28. Wilhelmsen L, Svärdsudd K, Korsan-Bengtsen K, et al. Fibrinogen as a risk factor for stroke and myocardial infarction. N Engl J Med. 1984;311(08):501-5. DOI:10.1056/NEJM198408233110804.
Об авторах
А. С. ПисарюкРоссия
Писарюк Александра Сергеевна - к.м.н., ассистент кафедры внутренних болезней с курсом кардиологии и функциональной диагностики РУДН.
Москва
А. А. Филькова
Россия
Филькова Александра Андреевна.
Москва
Ё. С. Тухсанбоев
Россия
Тухсанбоев Ёкубджон Сулаймонович.
Москва
Г. С. Свидельская
Россия
Свидельская Галина Сергеевна.
Москва
А. А. Игнатова
Россия
Игнатова Анастасия Александровна.
Москва
Е. А. Пономаренко
Россия
Пономаренко Евгения Александровна.
Москва
А. А. Мартьянов
Россия
Мартьянов Алексей Александрович.
Москва
А. А. Тараканова
Россия
Тараканова Анастасия Алексеевна.
Москва
И. А. Мерай
Россия
Мерай Имад Ахмадович.
Москва
М. А. Пантелеев
Россия
Пантелеев Михаил Александрович.
Москва
А. Н. Свешникова
Россия
Свешникова Анастасия Никитична.
Москва
Ж. Д. Кобалава
Россия
Кобалава Жанна Давидовна.
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Писарюк А.С., Филькова А.А., Тухсанбоев Ё.С., Свидельская Г.С., Игнатова А.А., Пономаренко Е.А., Мартьянов А.А., Тараканова А.А., Мерай И.А., Пантелеев М.А., Свешникова А.Н., Кобалава Ж.Д. Нарушения в системе гемостаза у пациентов с инфарктом миокарда без обструкции коронарных артерий. Рациональная Фармакотерапия в Кардиологии. 2024;20(4):386-400. https://doi.org/10.20996/1819-6446-2024-3065. EDN: VLJLAP
For citation:
Pisaryuk A.S., Filkova A.A., Tukhsanboev E.S., Svidelskaya G.S., Ignatova A.A., Ponomarenko E.A., Martyanov A.A., Tarakanova A.A., Meray I.A., Panteleev M.A., Sveshnikova A.N., Kobalava Z.D. Coagulation disorders in myocardial infarction with nonobstructive coronary arteries. Rational Pharmacotherapy in Cardiology. 2024;20(4):386-400. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3065. EDN: VLJLAP

















































