Перейти к:
Многососудистое стентирование коронарных артерий, осложненное тромбозами стентов на фоне наследственной тромбофилии: клинический случай
https://doi.org/10.20996/1819-6446-2024-3070
EDN: UDPPSP
Аннотация
Актуальной проблемой остается определение роли и значения полиморфизма генов, кодирующих компоненты свертывающей и противосвертывающей системы крови, в увеличении риска развития инфаркта миокарда и его тромботических осложнений, в том числе связанных с проведением стентирования коронарных артерий. Представлен клинический случай пациента с многососудистым поражением коронарных артерий и наличием наследственной тромбофилии — полиморфизма генов тромбофилии (гетерозигота F13, ITGA2), что сопровождалось драматической динамикой рецидивирующих тромбозов стентов, развившимся повторным инфарктом миокарда на фоне проводимой тройной и в последующем двойной антитромботической терапии. Повторный тромбоз диктовал необходимость проведения хирургической реваскуляризации — коронарного шунтирования. В многофакторный характер развития тромбоза стентов могут вносить вклад и наследственные тромбофилические состояния, что может затруднять как диагностику причин данного осложнения, так и выбор вариантов антиагрегантной и антикоагулянтной терапии, что особенно актуально в условиях ограниченного временного фактора в случае развития острого тромбоза стентов. К факторам риска тромбоза стента в описанном клиническом случае относятся наследственная тромбофилия, многососудистое поражение коронарных артерий с вовлечением ствола левой коронарной артерии, множественная имплантация стентов, перенесенный инфаркт миокарда, повторная реваскуляризация. Выявлен ряд вариантов мутаций генов, ответственных за повышение риска тромбообразования, которые могут иметь различное клиническое значение, в то же время с точки зрения генетического полиморфизма полностью исключить такое влияние не представляется возможным. Относительно выбора антитромботической терапии в группе пациентов с врожденными тромбофилиями, рецидивирующими или рефрактерными к лечению тромбозов неизвестной этиологии, редкими локализациями тромбов данных рандомизированных клинических исследований об эффективности прямых пероральных антикоагулянтов в настоящее время недостаточно, поэтому варфарин остается препаратом выбора для лечения этой особой группы пациентов. Диагностика наследственных тромбофилических состояний влияет на выбор рациональной терапии и вторичной профилактики тромботических осложнений.
Ключевые слова
Для цитирования:
Сафиуллина З.М., Межонов Е.М., Вятчинина С.В., Вялкина Ю.А., Серещева А.Х. Многососудистое стентирование коронарных артерий, осложненное тромбозами стентов на фоне наследственной тромбофилии: клинический случай. Рациональная Фармакотерапия в Кардиологии. 2024;20(6):669-678. https://doi.org/10.20996/1819-6446-2024-3070. EDN: UDPPSP
For citation:
Safiullina Z.M., Mezhonov E.M., Viatchinina S.V., Vyalkina Yu.A., Sereshcheva A.Kh. Multivessel coronary artery stenting complicated by stent thrombosis in the setting of hereditary thrombophilia: a clinical case. Rational Pharmacotherapy in Cardiology. 2024;20(6):669-678. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3070. EDN: UDPPSP
Введение
Наряду с традиционными модифицируемыми и немодифицируемыми факторами риска, у пациентов с ишемической болезнью сердца (ИБС) достаточно часто выявляются генетически обусловленные тромбофилические состояния [1][2]. Актуальной проблемой остается определение роли и значения полиморфизма генов, кодирующих компоненты свертывающей и противосвертывающей системы крови, в увеличении риска развития инфаркта миокарда (ИМ) и его осложнений, в том числе связанных с проведением стентирования коронарных артерий (КА) [3].
Представляется актуальным представление клинического случая пациента с многососудистым поражением КА, осложненным неоднократными тромбозами стентов, развившимся повторным ИМ на фоне наследственной тромбофилии — полиморфизма генов тромбофилии: гетерозигота F13, ITGA2.
Описание клинического случая
Пациент Х., 1970 г.р., находился в стационаре областной клинической больницы № 1 с 26.08.2022 по 27.09.2022.
Из анамнеза заболевания следует, что ИБС манифестировала в марте 2020 г. клинической картиной нестабильной стенокардии. Выполнена экстренная коронароангиография (КАГ), выявлено многососудистое поражение КА (протяжённый стеноз передней нисходящей артерии (ПНА) после отхождения первой диагональной артерии (ДА) до 90%, стеноз проксимальной трети первой ДА до 60%, стеноз средней трети правой коронарной артерии (ПКА) до 95%). Проведена транслюминальная баллонная ангиопластика (ТБКА) со стентированием ПКА, рекомендовано проведение ТБКА со стентированием ПНА и ДА в плановом порядке, которое выполнено в августе 2020 г.
22.07.2022 перенёс острый крупноочаговый ИМ передне-боковой стенки левого желудочка (ЛЖ). В стационаре по месту жительства при проведении КАГ выявлен стеноз 60% ствола левой коронарной артерии (ЛКА) в дистальной части с переходом на устье ПНА, стеноз в устье ПНА 80% с переходом на стент проксимального сегмента, признаки окклюзии в стенте ДА от устья, рестеноза в стенте ПКА нет. Пациенту было рекомендовано проведение чрескожного коронарного вмешательства (ЧКВ) ствола ЛКА в плановом порядке через 1 мес. после перенесенного острого ИМ в условиях областной клинической больницы № 1. В исследованиях от 22.07.2022 в общем анализе крови отмечается нейтрофильный лейкоцитоз до 13,45×109/л, тромбоциты — 340×109/л, гемоглобин — 140 г/л, тропонин I — 812 нг/л, фибриноген — 3,14 г/л, международное нормализованное отношение (МНО) — 1,05, протромбиновый индекс — 92%, холестерин липопротеинов низкой плотности — 2,48 ммоль/л, креатинин — 81 мкмоль/л, СКФ (CKD-EPI) 96 мл/мин/1,73 м2.
При поступлении в областную клиническую больницу № 1 наблюдалась стенокардия напряжения III функционального класса. В течение нескольких лет — гипертоническая болезнь с максимальными цифрами артериального давления до 190/100 мм рт.cт., на фоне проводимой терапии целевой уровень АД достигнут. Нарушения ритма сердца, острое нарушение мозгового кровообращения, сахарный диабет отрицает. Не курит в течение 2 лет, ранее курил в течение длительного времени, индекс курения 21. Амбулаторно принимал клопидогрел 75 мг/сут., ацетилсалициловую кислоту 100 мг/сут., спиронолактон 25 мг/сут., периндоприл 2 мг/сут., метопролол 25 мг/сут., аторвастатин 80 мг/сут., изосорбида мононитрат 80 мг/сут. На фоне получаемой терапии сохранялись жалобы на давящую боль за грудиной при незначительных физических нагрузках, проходящую в покое или в течение 2-3 мин после приема нитроглицерина.
Объективный статус при поступлении: масса тела — 104 кг, рост — 182 см, индекс массы тела — 31,4 кг/м2. Общее состояние удовлетворительное. Кожные покровы физиологической окраски, чистые. Периферических отеков нет. Частота дыхательных движений — 14 в минуту. Сатурация — 99%. Дыхание везикулярное, хрипов нет. Частота сердечных сокращений — 60 в минуту. Артериальное давление на правой руке 120/70 мм рт.ст. Тоны сердца ясные, ритмичные. Шумы сердца не выслушиваются. Пульсация на периферических артериях определяется. Живот мягкий, безболезненный. Селезенка не пальпируется. Печень по краю реберной дуги, безболезненная.
При поступлении 26.08.2022 общий анализ мочи без особенностей, скорость клубочковой фильтрации (CKD-EPI) — 105 мл/мин/1,73 м2, холестерин липопротеинов низкой плотности — 1,32 ммоль/л, холестерин липопротеинов высокой плотности — 0,77 ммоль/л, триглицериды — 0,61 ммоль/л, МНО — 1,01. В общем анализе крови от 26.08.2022 отмечается нейтрофильный лейкоцитоз до 11,9×109/л, тромбоцитоз — 537×109/л, гемоглобин — 136 г/л. Электрокардиография (ЭКГ) от 26.08.2022: ритм синусовый 73 в минуту, нарушение процессов реполяризации по передне-боковой стенке ЛЖ в виде инверсии зубцов Т. По данным эхокардиографии от 17.08.2022 гипокинез передне-боковых сегментов миокарда ЛЖ, фракция выброса (ФВ) ЛЖ — 58%.
На фоне двойной антитромбоцитарной терапии клопидогрелом и ацетилсалициловой кислотой 30.08.2022 в плановом порядке проведено ТБКА со стентированием ствола ЛКА с выходом в ПНА (1 стент 4,0-20 мм с лекарственным покрытием (эверолимус) без технических трудностей, достигнут кровоток по шкале TIMI (Thrombolysis in Myocardial Infarction) 3, диссекции в зоне стентирования нет, боковые ветви не скомпрометированы (рис. 1). На ЭКГ, зарегистрированной после проведения ЧКВ, ритм синусовый 71 в минуту, в сравнении с ЭКГ от 26.08.2022 улучшение процессов реполяризации по верхушечно-боковой стенке левого желудочка (слабоположительные зубы Т). Через 2 ч после проведенного вмешательства пациент отметил появление интенсивной давящей боли за грудиной, по ЭКГ подъем сегмента ST до 2 мм в отведениях I, aVL, V1-V2. В экстренном порядке проведена ангиография (рис. 2А), выявлена тромботическая окклюзия in stent ствола ЛКА, ПНА (кровоток TIMI 0), пристеночный дефект контрастирования в устье огибающей артерии (ОА) до 90% (кровоток TIMI 1). Консилиумом принято решение о переводе пациента на тикагрелор, дана нагрузочная доза 180 мг. Выполнена тромбэкстракция (фрагменты "красного" тромба), восстановление антеградного кровотока по ПНА и ОА TIMI 2-3. Множественные дефекты контрастирования in stent в стволе ЛКА, ПНА, ОА. Проведено ТБКА со стентированием ствола ЛКА и ПНА (стент 4,0–24 мм с лекарственным покрытием (эверолимус). При контроле множественные дефекты контрастирования в стентированных артериях (острый ретромбоз). Консилиумом у операционного стола принято решение о незамедлительной инфузии эптифибатида по схеме (двукратный болюс 180 мкг/кг внутривенно с одновременным введением через инфузомат 2 мкг/кг/мин в течение 24 ч). Выполнено "прижатие" пристеночных дефектов контрастирования in stent ствола ЛКА и ПНА баллонами системы доставки с экспозицией раздутого баллона 40 сек. При контроле дефектов контрастирования in stent ствола ЛКА, ПНА нет, дефект контрастирования в устье ОА, стенозирующий просвет до 80%. Принято решение о переходе в бифуркационную методику стентирования ствола ЛКА техникой "Т", проведено ТБКА со стентированием ОА (стент 4,0-24 мм с лекарственным покрытием на биодеградируемом полимере (сиролимус). При контроле артерии проходимы, кровоток TIMI 3.
Отмечалось повышение тропонина I до 15,5 нг/л от 30.08.2022 с дальнейшей динамикой — 7283 нг/л от 31.08.2022. На ЭКГ от 31.08.2022 ритм синусовый 65 в минуту, нарушение процессов реполяризации по передне-перегородочной стенке ЛЖ в виде двухфазных зубцов Т, по верхушечно-боковой стенке в виде инверсии зубцов Т.
Эхокардиография от 31.08.2022: митральный клапан — створки тонкие, размер основания аорты — 2,2 см, аортальный клапан — створки тонкие, пиковый градиент давления — 6,8 мм рт.ст., конечный диастолический размер ЛЖ — 5,5 см, конечный систолический размер ЛЖ — 4,1 см, конечно-диастолический объем — 145 мл, конечно-систолический объем — 77 мл, ударный объем — 67 мл; ФВ ЛЖ — 46% (Simpson); толщина межжелудочковой перегородки в диастолу — 1,1 см; толщина задней стенки ЛЖ — 1,1 см, диффузный гипокинез стенок.
02.09.2022 вновь рецидив ангинозного болевого синдрома, по ЭКГ элевация сегмента ST до 1 мм по передне-боковой стенке ЛЖ, депрессии сегмента ST до 1,5 мм по нижней стенке. В экстренном порядке проведена ангиография (рис. 2Б), выявлен тромбоз в стентах ПНА, выполнена тромбэкстракция (фрагменты "красного" тромба), достигнуто восстановление антеградного кровотока TIMI 2-3, в то же время отмечается частичная миграция тромба в дистальные (терминальные) отделы ПНА (от аспирации из дистальных отделов решено отказаться). С учетом рецидива тромбоза стента в стволе ЛКА начато введение эптифибатида по схеме. В зону тромбоза от среднего отдела ПНА до устья ПНА имплантированы стенты 3,0-28 мм и 3,5-33 мм с лекарственным покрытием (эверолимус). При контроле — ствол ЛКА и ПНА проходимы (за исключением терминального отдела ПНА), кровоток TIMI 3. 03.09.2022 через 20 мин после окончания инфузии эптифибатида, продолжавшейся в течение 12 ч, вновь рецидив ангинозного болевого синдрома, элевация сегмента ST по передне-боковой стенке ЛЖ, проведена экстренная КАГ, выявлена тромботическая окклюзия in stent ПНА (рис. 2В), выполнена тромбэкстракция, восстановление антеградного кровотока TIMI 2-3, остаточный стеноз 95%, после проведения ТБКА со стентированием ПНА (стент 3,0-48 мм с лекарственным покрытием на биодеградируемом полимере (сиролимус) отмечался кровоток TIMI 3. Начата инфузия эптифибатида (по схеме) в течение 24 ч, вводились парентеральные антикоагулянты. С учетом неоднократного тромбоза стентов ПНА на фоне двойной антитромбоцитарной терапии ацетилсалициловой кислотой и клопидогрелом, а затем в комбинации с тикагрелором дежурным врачом принято решение о смене антитромбоцитарного препарата на прасугрел по жизненным показаниям.

Рисунок 1. Индексное ЧКВ пациента от 30.08.2022.
Таблица. Исследование генетических полиморфизмов
№ | Наименование исследования | Результаты |
Генотип | ||
1 | F2:20210 G>A | GG |
2 | F5:1691 G>A (Arg506Gln) | GG |
3 | F7:10976 G>A (Arg353Gln)) | GG |
4 | F13: G>A (Val34Leu) | TT |
5 | FGB:-455 G>A | GG |
6 | ITGA2: 807 C>T (Phe224Phe) | TT |
7 | ITGB3: 1656 T>C (Leu33Pro) | TT |
8 | SERINE1 (PAI-1): -675 5G>4G | 5G 5G |
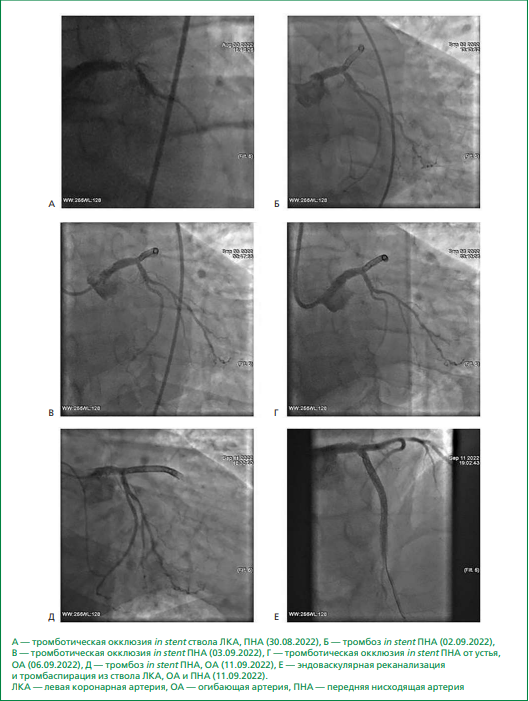
Рисунок 2. Коронароангиограмма пациента.
В динамике отмечено снижение уровня тропонина I до 1025 нг/л (02.09.2022).
В общем анализе крови от 03.09.2022 лейкоцитоз — 19,95×109/л, тромбоцитоз 685×109/л. В динамике вновь нарастание маркеров миокардиального повреждения, уровень тропонина I составил 5951 нг/л (03.09.2022).
На фоне терапии эноксапарином 1 мг/кг 2 раза в сут., ацетилсалициловой кислотой 100 мг/сут. и прасугрелом 10 мг/сут. 06.09.2022 возник рецидив ангинозного болевого синдрома, при проведении ангиографии (рис. 2Г) отмечалась тромботическая окклюзия in stent ПНА от устья, ОА. Выполнены тромбэкстракция и ТБКА со стентированием ПНА (стент 3,5-44 мм с лекарственным покрытием на биодеградируемом полимере (сиролимус), при контроле множественные дефекты контрастирования в стентированных сегментах ПНА (острый ретромбоз), начата инфузия эптифибатида (по схеме). При контроле после введения второго болюса эптифибатида дефектов контрастирования не отмечалось. В общем анализе крови от 07.09.2022 лейкоцитоз 18,72×109/л, гипохромная анемия легкой степени (гемоглобин 118 г/л), тромбоцитоз 845×109/л (этот уровень являлся максимальным за период госпитализации).
Учитывая рецидивирование тромбоза с целью исключения коагулопатии проведено дополнительное обследование, по лабораторным данным от 07.09.2022 дефицит естественных антикоагулянтов исключен (протеин С — 89%, протеин S — 73%, антитромбин III — 78%), однако выявлен пограничный уровень волчаночного антикоагулянта 1,25 в скрининговом исследовании. Проведено исследование факторов свертывания крови 07.09.2022: фибриноген — 60 мг/дл, плазминоген — 60%, фактор Виллебранда — 271%, фактор VIII — 111%, фактор IX — 98%.
07.09.2022 — антитела к кардиолипину и антитела классов (IgG, IgM, IgA) к бета-2-гликопротеину I в пределах референсных значений 5,7 и 4,47 МЕ/мл соответственно.
Для исключения коагулопатии в рамках паранеопластического синдрома 07.09.2022 проведена компьютерная томография органов грудной и брюшной полостей (в том числе в режиме ангиографии для оценки наличия возможных тромботических осложнений), головного мозга, по результатам которых данных за очаговые изменения не получено. 08.09.2022 при исследовании генетического полиморфизма (табл.) выявлен полиморфизм генов тромбофилии — гетерозигота F13, ITGA2. При исследовании мутации V617F в 14 экзоне JAK-2 киназы от 12.09.2022 мутантной формы гена не обнаружено, BCR/ABL t (9;22) от 13.09.2022 молекулярный ответ не выявлен.
08.09.2022 пациент консультирован гематологом, поставлен диагноз: носитель полиморфизма генов тромбофилии: гетерозигота F13, ITGA2. Вторичная полицитемия. Вторичный тромбоцитоз, вторичная коагулопатия. При анализе миелограммы от 12.09.2022 расширен гранулоцитарный росток, повышено количество мегакариоцитов, препарат нормоклеточный, атипичных клеток нет. При иммунофенотипировании образца костного мозга данных за острый лейкоз и моноклональную В-клеточную лимфопролиферацию не выявлено.
Учитывая рецидивирующие тромбозы стентов на фоне антикоагулянтной и антитромбоцитарной терапии, документы направлены 07.09.2022 на консультацию в ФГБУ "НМИЦ им. В. А. Алмазова" Минздрава России с целью определения дальнейшей тактики ведения (вариантов антитромбоцитарной и антикоагулянтной терапии), уточнения возможного варианта коагулопатии и необходимости специфической терапии.
08.09.2022 рецидив ангинозного болевого синдрома, транспортирован в ангиоблок, подтвержден тромбоз стента в ПНА, выполнена тромбэкстракция, ТБКА со стентированием ПНА (стент 3,5-48 мм с лекарственным покрытием на биодеградируемом полимере (сиролимус), начато введение эптифибатида по схеме.
08.09.2022 консультантом ФГБУ "НМИЦ им. В. А. Алмазова" Минздрава России рекомендовано продолжить двойную антиагрегантную терапию ацетилсалициловой кислотой и прасугрелом, проводить инфузию нефракционированного гепарина (НФГ) с поддержкой уровня активированного частичного тромбопластинового времени в 1,5-2 раза выше референтных значений на протяжении 2 сут., через 2 сут. при отсутствии признаков рецидивирующего тромбоза инициировать терапию варфарином с последующим прекращением инфузии НФГ при достижении МНО выше 2,0. Продолжение тройной антитромботической терапии до 3 мес. с включением варфарина под контролем МНО, ацетилсалициловой кислоты, деэскалация терапии дезагрегантами с переходом с прасугрела на клопидогрел. Через 3 мес. под контролем коагулограммы рекомендован переход на двойную антитромботическую терапию (варфарин и клопидогрел). В случае повторного тромбоза было рекомендовано выполнение коронарного шунтирования (КШ).
С 09.09.2022 пациент переведен на НФГ под контролем активированного частичного тромбопластинового времени. На фоне продолжения двойной антитромбоцитарной терапии и инфузии НФГ 11.09.2022 рецидив ангинозного болевого синдрома, транспортирован в ангиоблок, тромбоз стентов в ПНА, ОА (рис. 2Д). Консилиумом у операционного стола принято решение о выполнении операции КШ, в качестве временной меры поддержки питания миокарда решено выполнить эндоваскулярную реканализацию и тромбаспирацию из ствола ЛКА, ОА и ПНА без имплантации стентов (рис. 2Е) с последующим переводом пациента в открытую операционную для аорто-маммаро-коронарного шунтирования.
11.09.2022 выполнено оперативное лечение — КШ в экстренном порядке на фоне ИМ передне-верхушечно-боковой стенки левого желудочка в условиях искусственного кровообращения: аортокоронарное шунтирование — интермедиарная артерия и ОА (аутовеной), маммарно-коронарное шунтирование — передняя межжелудочковая ветвь (левая внутренняя грудная артерия). Кровопотеря во время оперативного лечение составила 250 мл, с заместительной целью пациенту проводились трансфузии компонентов крови.
12.09.2022 в связи с развитием острой ишемии вследствие тромбоэмболических осложнений, вероятно, ассоциированных с установкой артериальных катетеров, было выполнено оперативное вмешательство — тромбэмболэктомия из артерий левой верхней конечности.
Во время госпитализации на фоне ангинозных приступов с 30.08.2022 на электрокардиограмме признаки острого передне-бокового ИМ с положительной ускоренной динамикой на фоне реваскуляризаций миокарда.
После хирургической реваскуляризации 11.09.2022 на фоне проводимой терапии по данным эхокардиографии от 23.09.2022 отмечалось увеличение ФВ ЛЖ до 52%.
Сформулирован следующий клинический диагноз:
Основной диагноз: ИБС. Постинфарктный кардиосклероз (22.07.2022). Состояние после ТБКА со стентированием ПКА (март 2020 г.). Состояние после ТБКА со стентированием ПНА и ДА (август 2020 г.). Состояние после ТБКА со стентированием ствола ЛКА (30.08.2022). Острый тромбоз стента от 30.08.2022. Состояние после ТБКА со стентированием ствола ЛКА, ПНА, ОА (30.08.2022). Подострый тромбоз стента от 02.09.2022. Состояние после ТБКА со стентированием ПНА (02.09.2022). Острый тромбоз стента от 03.09.2022. Состояние после ТБКА со стентированием ПНА (03.09.2022). Подострый тромбоз стента от 06.09.2022. Состояние после ТБКА со стентированием ПНА (06.09.2022). Подострый тромбоз стента от 08.09.2022. Состояние после ТБКА со стентированием ПНА (08.09.2022). Подострый тромбоз стента от 11.09.2022. Повторный ИМ 4b типа передне-верхушечно-боковой стенки левого желудочка от 30.08.2022-11.09.2022. Состояние после операции КШ в условиях искусственного кровообращения: аортокоронарное шунтирование — интермедиарная артерия и ОА (аутовеной), маммарно-коронарное шунтирование — передняя межжелудочковая ветвь (левая внутренняя грудная артерия) от 11.09.2022. ХСН IIA с умеренно сниженной ФВ ЛЖ, ФК III. Состояние после тромбэмболэктомии из артерий левой верхней конечности от 12.09.2022.
Сопутствующие заболевания: гипертоническая болезнь III стадии, 3 степени, риск 4. Носитель полиморфизма генов тромбофилии: гетерозигота F13, ITGA2. Вторичная полицитемия: вторичный тромбоцитоз, вторичная коагулопатия.
Таким образом, у пациента Х., 1970 г.р. с клинической картиной ИБС (ангинозные приступы с 2020 г.) на фоне многососудистого поражения КА, состояния после ангиопластики ПКА в марте 2020 г. и ПНА, ДА в августе 2020 г. отмечалась дестабилизация течения заболевания: в июле 2022 г. пациент перенёс ИМ — при выполнении КАГ выявлялось прогрессирование атеросклеротического поражения КА с формированием стеноза ствола ЛКА. В связи с диагностированными изменениями на КАГ отсрочено (30.08.2022) выполнены ангиопластика и стентирование ствола ЛКА, ПНА. В последующем регистрировались повторные тромбозы стентов, проводились повторные вмешательства 30.08.2022, 02.09.2022, 03.09.2022, 06.09.2022, 08.09.2022, суммарно 5 случаев тромбоза стента, суммарно пациенту имплантировано 9 стентов. Антитромботическая терапия включала эноксапарин, НФГ, ацетилсалициловую кислоту, клопидогрел с переходом на тикагрелор и затем на прасугрел, повторно вводились блокаторы гликопротеиновых рецепторов 2b/3a (эптифибатид) по схеме.
В послеоперационном периоде пациенту рекомендовано продолжить терапию: ацетилсалициловая кислота 100 мг на 3 мес., клопидогрел 75 мг в течение года после аорто-маммаро-коронарного шунтирования, варфарин (МНО 2,0-3,0) длительно. На фоне антитромботической терапии назначались ингибитор протонной помпы (пантопразол 20 мг/сут.), ингибитор ангиотензинпревращающего фермента (периндоприл 5 мг/сут.), антагонист минералокортикоидных рецепторов (эплеренон 50 мг/сут.), бета-блокатор (бисопролол 5 мг/сут.), статин (аторвастатин 80 мг/сут.).
Обсуждение
Тромбоз стента обусловлен многими факторами, включая сопряженные как с самим пациентом, так и с характером поражения КА, процедурой и техникой ЧКВ [4][5]. Независимо от характеристик ЧКВ и связанных с ним процедурных факторов, пациент, вероятно, является самым непредсказуемым фактором риска тромбоза стента.
Согласно современным данным, распространённость тромбоза стента составляет 0,87-2,2% [6]. Следует подчеркнуть, что развитие острого коронарного синдрома патогенетически ассоциируется с более высокой частотой тромбоза стента после ЧКВ в сравнении с пациентами со стабильной ИБС [7]. По данным некоторых регистров, частота развития тромбоза стента составляет до 0,4-0,6% в год [8][9]. В раннем исследовании стентирования при остром коронарном синдроме STENTIM I тромбозы стента происходили преимущественно в первые 7 дней (50% случаев в первые 48 ч. после стентирования) [10].
Тромбоз стента представляет собой многофакторный процесс, включающий различные механизмы. Среди причин и факторов риска тромбоза стента выделяют непосредственно связанные с техникой и процедурой выполнения инвазивного вмешательства, ассоциированные с состоянием пациента, характером поражения КА. Среди факторов риска тромбоза стента, связанных с техникой выполнения инвазивной процедуры, выделяют следующие: неправильное расположение стента, неполное раскрытие стента, резидуальная диссекция, феномен замедленного или отсутствующего кровотока после стентирования slow flow/no reflow, имплантация множественных стентов и стентов большой длины, методика crush бифуркационного стентирования и т. д. [11-13]. Факторы, влияющие на развитие тромбоза стента, также связаны с характером поражения КА: многососудистое поражение, тотальная хроническая окклюзия, бифуркационные поражение и т. д. [12][13]. К факторам, ассоциированным с состоянием пациента, относятся наследственные тромбофилии, генетическая резистентность к клопидогрелу, острый коронарный синдром, сахарный диабет, пожилой возраст, хроническая сердечная недостаточность с низкой ФВ ЛЖ и т. д. [14-16].
В одной из немногочисленных работ, оценивающих влияние наследственных нарушений свертываемости крови на генез тромбоза стента, D. Zavalloni и соавт. была оценена распространенность мутации фактора V Лейдена G1691A, мутации фактора II (протромбина) G20210A и гомозиготного полиморфизма метилентетрагидрофолатредуктазы (MTHFR, внутриклеточный фермент, участвующий в превращении гомоцистеина в метионин) C677T у пациентов с тромбозом стента [16]. Распространенность вышеупомянутых вариаций генов была изучена у 127 пациентов: 50 из них поступили по поводу тромбоза стента и 77 пациентов ранее лечились с помощью ЧКВ без развития тромбоза стента. В 28% случаев пациенты с тромбозом стента были носителями по крайней мере 1 вариации гена. Распространенность мутации фактора V Лейдена G1691A (отношение шансов (ОШ)=0,64; 95% доверительный интервал (ДИ) 0,04-10,5), мутации фактора II G20210A (ОШ=0,63; 95% ДИ 0,12-3,28) и гомозиготного полиморфизма MTHFR C677T (ОШ=1,13; 95% ДИ 0,47-2,72) существенно не различалась между пациентами с тромбозом стента и без него. Модель логистической регрессии не показала значимой связи между вариациями гена и тромбозом стента (ОШ=0,61; 95% ДИ 0,24-1,60; p=0,32). Несмотря на то, что значимой связи между изученными вариациями гена и тромбозом стента обнаружено не было, выявление высокой распространенности по крайней мере 1 генной аномалии у такой редкой подгруппы пациентов позволило сделать важный вывод, что скрининг на тромбофилию может быть оправдан в случаях развития тромбоза стента [16].
В работе А. А. Березовской и соавт. носительство варианта 34V гена F13A1, кодирующего A-субъединицу фактора свёртывания 13, предрасполагало к возобновлению клинических проявлений ИБС после ЧКВ [17]. Работы, исследующие развитие тромбозов стентов или тромбоза шунтов у пациентов с ИБС на фоне наследственных тромбофилий, крайне немногочисленны, и они в основном ограничиваются описанием клинических случаев [18][19]. Согласно европейским рекомендациям по реваскуляризации миокарда, решение об экстренной операции или ЧКВ рекомендовано принимать кардиокомандой, основываясь на возможности реваскуляризации, объеме миокарда в зоне риска, сопутствующих заболеваниях, клиническом статусе (класс рекомендаций I, уровень доказательности С) [20].
К факторам риска тромбоза стента у пациента в описанном клиническом случае относятся врожденная тромбофилия, многососудистое поражение КА с вовлечением ствола ЛКА, множественная имплантация стентов, перенесенный ИМ, повторная реваскуляризация.
Ангиографические результаты исследования пациента после имплантации стента 30.08.2022 считались оптимальными. Согласно клиническим рекомендациям, внутрисосудистая визуализация может быть рассмотрена при проведении ЧКВ, в то же время не существует рекомендаций, определяющих показания к внутрисосудистой визуализации КА класса рекомендаций IIа и уровне доказательности выше А [21]. Авторы не могут отрицать возможный факт ультразвуковых недостатков стентирования вследствие отсутствия внутрисосудистой визуализации в качестве ограничения данного наблюдения, однако, даже при предположительном их наличии, речь может идти о синергическом влиянии факторов тромбоза (тромбофилия, и, возможно, ультразвуковые особенности стентирования). Авторами описан случай из реальной клинической практики, и не всегда имеется возможность проведения внутрисосудистой визуализации в силу тех или иных причин.
Выявлен ряд вариантов мутаций генов, ответственных за повышение риска тромбообразования, которые могут иметь различное клиническое значение, в то же время с точки зрения генетического полиморфизма полностью исключить такое влияние не представляется возможным. Согласно данным литературы, полиморфизм гена ITGA2 приводит к повышению риска возникновения ИМ в 2,8 раза, а также ишемического инсульта, послеоперационных тромбозов [22][23]. Мутация SERPAIN 1 (антагонист тканевого активатора плазминогена) повышает риск сердечно-сосудистых осложнений в 2 раза [22][23]. Наличие мутации гена МТНFR в 3 раза повышает риск развития сердечно-сосудистых заболеваний, поскольку высокий уровень гомоцистеина повреждает эндотелий сосудов, увеличивает вероятность атеросклероза и тромбоза [22][23].
По данным Е. П. Панченко, варианты факторов свертывания крови, сопровождающиеся высокой протромботической активностью, дефициты антитромбинов, гепарин-индуцированная тромбоцитопения, относятся к врожденным тромбофилиям, связанных с высоким риском тромбообразования [24].
В представленном клиническом случае у пациента с многососудистым поражением КА отмечались рецидивирующие тромбозы стентов, повторный ИМ на фоне наследственной тромбофилии — полиморфизма генов тромбофилии (гетерозигота F13, ITGA2), что диктовало необходимость проведения КШ.
Что касается выбора антитромботической терапии в группе пациентов с врожденными тромбофилиями, рецидивирующими или рефрактерными к лечению тромбозов неизвестной этиологии, редкими локализациями тромбов, то данных рандомизированных клинических исследований об эффективности прямых пероральных антикоагулянтов в настоящее время недостаточно [25][26], поэтому варфарин остается препаратом выбора для лечения этой особой группы пациентов.
К ограничениям клинического случая следует отнести отсутствие внутрисосудистой визуализации, что не позволяет исключить мальпозицию стента как возможную причину дальнейшего ряда событий.
Заключение
Тромбоз стентов может быть обусловлен многими факторами, в том числе наследственными тромбофилическими состояниями, что затрудняет как диагностику причин данного осложнения, так и выбор вариантов антиагрегантной и антикоагулянтной терапии, что особенно актуально в условиях ограниченного временного фактора в случае развития острого тромбоза стентов. Таким образом, своевременная диагностика наследственных тромбофилических состояний, наряду с оценкой иных, более распространенных факторов риска тромбоза, может оказать влияние на выбор рациональной терапии, определения оптимальной стратегии ведения и вторичной профилактики тромботических осложнений.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование: Работа выполнена при поддержке Тюменского государственного медицинского университета.
Funding: The study was performed with the support of the Tyumen State Medical University.
Список литературы
1. Пономаренко И. В., Сукманова И. А. Традиционные факторы риска и генные мутации тромбоза, ассоциированные с острым коронарным синдромом у пациентов молодого возраста. Кардиология. 2018;59(1S):19-24. DOI:10.18087/cardio.2602.
2. Шушанова А. С., Гладких Н. Н., Ягода А. В. Инфаркт миокарда 1 типа в молодом возрасте: вклад проатерогенных факторов и генетических тромбофилий. Терапия. 2023;4:30-7. DOI:10.18565/therapy.2023.4.30-37.
3. Киселева М. А., Болгова М. Ю. Тромбофилии как причина неатерогенных инфарктов миокарда. Евразийский кардиологический журнал. 2019;(S2):210.
4. Коротаева Е. С., Королева Л. Ю., Ковалева Г. В. и др. Основные предикторы тромбоза стента у пациентов с острым коронарным синдромом после чрескожного коронарного вмешательства на фоне различной двой ной антитромбоцитарной терапии. Кардиология. 2018;58(S1):12-21. DOI:10.18087/cardio.2423.
5. Sohail M, Patel P, Midha S, et al. Identifying the Incidence, Predictors, Outcomes, and Prevention of Stent Thrombosis (ST) in Post-percutaneous Coronary Revascularization Patients With Drug-Eluting Stents (DES): A Systematic Review. Cureus. 2023;15(9):e45150. DOI:10.7759/cureus.45150.
6. Коротаева Е. С., Королева Л. Ю., Носов В. П. и др. Основные факторы, влияющие на развитие тромбоза стента у пациентов с острым коронарным синдромом. Кардиология и сердечно-сосудистая хирургия. 2019;12(4):329-35. DOI:10.17116/kardio201912041329.
7. Chi G, AlKhalfan F, Lee JJ, et al. Factors associated with early, late, and very late stent thrombosis among patients with acute coronary syndrome undergoing coronary stent placement: analysis from the ATLAS ACS 2-TIMI 51 trial. Front Cardiovasc Med. 2024;10:1269011. DOI:10.3389/fcvm.2023.1269011.
8. Tada T, Byrne RA, Simunovic I, et al. Risk of stent thrombosis among bare-metal stents, first-generation drug-eluting stents, and second-generation drug-eluting stents: results from a registry of 18,334 patients. JACC Cardiovasc Interv. 2013;6(12):1267-74. DOI:10.1016/j.jcin.2013.06.015.
9. Raber L, Magro M, Stefanini GG, et al. Very late coronary stent thrombosis of a newer-generation everolimus-eluting stent compared with early-generation drug-eluting stents: a prospective cohort study. Circulation. 2012;125(9):1110-21. DOI:10.1161/CIRCULATIONAHA.111.058560.
10. Monassier JP, Hamon M, Elias J, et al. Early versus late coronary stenting following acute myocardial infarction: results of the STENTIM I Study (French Registry of Stenting in Acute Myocardial Infarction). Cathet Cardiovasc Diagn. 1997;42(3):243-8. DOI:10.1002/(sici)1097-0304(199711)42:3<243::aid-ccd1>3.0.co;2-c.
11. Шумаков Д. В., Шехян Г. Г., Зыбин Д. И. и др. Поздние осложнения чрескожных коронарных вмешательств. РМЖ. 2020;28(10):25-8.
12. Ge L, Airoldi F, Iakovou I, et al. Clinical and angiographic outcome after implantation of drug-eluting stents in bifurcation lesions with the crush stent technique: importance of final kissing balloon post-dilation. J Am Coll Cardiol. 2005;46(4):613-20. DOI:10.1016/j.jacc.2005.05.032.
13. Гительзон Д. Г., Файбушевич А. Г., Гительзон Е. А. и др. Повторный тромбоз коронарных стентов. Клиническая физиология кровообращения. 2022;19(3):197-200. DOI:10.24022/1814-6910-2022-19-3-197-200.
14. Santos-Pardo I, Andersson Franko M, Lagerqvist B, et al. Glycemic Control and Coronary Stent Failure in Patients With Type 2 Diabetes Mellitus. J Am Coll Cardiol. 2024;84(3):260-72. DOI:10.1016/j.jacc.2024.04.012.
15. Коротаева Е. С., Королева Л. Ю., Носов В. П. и др. Многофакторное прогнозирование развития тромбоза стента у пациентов с острым коронарным синдромом после чрескожного коронарного вмешательства на фоне двойной антитромбоцитарной терапии. Кардиология. 2019;59(11):5-13. DOI:10.18087/cardio.2019.11.n343.
16. Zavalloni D, Presbitero P, Lodigiani C, et al. Prevalence of inherited thrombophilia in patients with documented stent thrombosis. Circ J. 2012;76(8):1874-9. DOI:10.1253/circj.cj-11-1358.
17. Березовская А. А., Клокова Е. С., Петрищев Н. Н. Генетические предикторы возобновления клиники ишемической болезни сердца после чрезкожного коронарного вмешательства. Патологическая физиология и экспериментальная терапия. 2017;61(4):81-6. DOI:10.25557/IGPP.2017.4.8527.
18. Бокерия Л. А., Мерзляков В. Ю., Самуилова Д. Ш. и др. Тромбоз шунтов после миниинвазивной реваскуляризации миокарда у больного со скрытой формой тромбофилии. Грудная и сердечно-сосудистая хирургия. 2008;(4):66-8.
19. Hsu Y-M S, Despotis GJ. Coronary artery bypass grafting in 2 thrombophilic patients with protein S deficiency. A A Case Rep. 2014;2(8):92-4. DOI:10.1213/XAA.0000000000000005.
20. Neumann FJ, Sousa-Uva M, Ahlsson A, et al; ESC Scientific Document Group. 2018 ESC/EACTS guidelines on myocardial revascularization. Eur Heart J. 2019;40:87-165. DOI:10.1093/eurheartj/ehy394.
21. Byrne RA, Rossello X, Coughlan JJ, et al; ESC Scientific Document Group. 2023 ESC Guidelines for the management of acute coronary syndromes. Eur Heart J. 2023;44(38):3720-826. DOI:10.1093/eurheartj/ehad191.
22. Васильев С. А., Виноградов В. Л., Смирнов А. Н. и др. Тромбозы и тромбофилии: классификация, диагностика, лечение, профилактика. РМЖ. Медицинское обозрение. 2013;21(17):896-901.
23. Акимова Н. М., Епифанова У. В., Левченко А. С., Майскова Е. А. Повторный инфаркт миокарда у пациента молодого возраста как проявление первичной тромбофилии. Бюллетень медицинских интернет-конференций. 2018;8(8):368-9.
24. Панченко Е. П. Осталось ли место для варфарина после появления прямых оральных антикоагулянтов? Атеротромбоз. 2022;12(2):32-42. DOI:10.21518/2307-1109-2022-12-2-32-42.
25. Janczak DT, Mimier MK, McBane RD, et al. Rivaroxaban and apixaban for initial treatment of acute venous thromboembolism of atypical location. Mayo Clin Proc. 2018;93(1):40-7. DOI:10.1016/j.mayocp.2017.10.007.
26. Warkentin TE, Pai M, Linkins LA. Direct oral anticoagulants for treatment of HIT: update of Hamilton experience and literature review. Blood. 2017;130(9):1104-13. DOI:10.1182/blood-2017-04-778993.
Об авторах
З. М. СафиуллинаРоссия
Сафиуллина Земфира Мидхатовна
Тюмень
Е. М. Межонов
Россия
Межонов Евгений Михайлович
Тюмень
С. В. Вятчинина
Россия
Вятчинина Светлана Владимировна
Тюмень
Ю. А. Вялкина
Россия
Вялкина Юлия Александровна
Тюмень
А. Х. Серещева
Россия
Серещева Алевтина Хайдаровна
Тюмень
Дополнительные файлы
Рецензия
Для цитирования:
Сафиуллина З.М., Межонов Е.М., Вятчинина С.В., Вялкина Ю.А., Серещева А.Х. Многососудистое стентирование коронарных артерий, осложненное тромбозами стентов на фоне наследственной тромбофилии: клинический случай. Рациональная Фармакотерапия в Кардиологии. 2024;20(6):669-678. https://doi.org/10.20996/1819-6446-2024-3070. EDN: UDPPSP
For citation:
Safiullina Z.M., Mezhonov E.M., Viatchinina S.V., Vyalkina Yu.A., Sereshcheva A.Kh. Multivessel coronary artery stenting complicated by stent thrombosis in the setting of hereditary thrombophilia: a clinical case. Rational Pharmacotherapy in Cardiology. 2024;20(6):669-678. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3070. EDN: UDPPSP
JATS XML
















































