Перейти к:
Липопротеин(а), атеросклероз и сердечно-сосудистый риск
https://doi.org/10.20996/1819-6446-2024-3080
EDN: QZQZAN
Аннотация
В конце XX века установлен вклад гиперлипопротеинемии(а) в раннее появление и тяжелое течение атеросклероза коронарных, церебральных и периферических артерий, показана его взаимосвязь с развитием стеноза аортального клапана. Результаты эпидемиологических исследований позволяют определить липопротеин(а) (Лп(а)) как новую мишень диагностики, профилактики и фармакотерапии атеросклеротических сердечно-сосудистых заболеваний (ССЗ). Атерогенность Лп(a) выше, чем липопротеинов низкой плотности в 6 раз и может быть причиной быстро прогрессирующего и раннего атеросклероза. Консенсус Европейского общества атеросклероза 2022 года определил пороговое значение Лп(а) для "исключения" риска атеросклеротических ССЗ менее 30 мг/дл. Диапазон значений Лп(а) между 30 мг/дл и 50 мг/дл создают так называемую "серую зону" когда следует учитывать возможный риск, связанный с Лп(а), а также другие факторы риска ССЗ. При значении Лп(а) >180 мг/дл риск ССЗ эквивалентен риску пациентов с гетерозиготной семейной гиперхолестеринемией. В данном обзоре обсуждаются генетические и патофизиологические свойства Лп(а), а также эпидемиологические данные, демонстрирующие его влияние на сердечно-сосудистую заболеваемость. Экстракорпоральные методы удаления избытка Лп(а) из сыворотки крови являются в настоящее время единственным доказанным вариантом коррекции данной дислипидемии. Каскадная плазмофильтрация способствует снижению уровня холестерина липопротеинов низкой плотности (ЛНП) и Лп(а) более чем на 60%, а также снижению уровня окисленных фосфолипидов в плазме. Согласно отечественным рекомендациям 2023 года, критериями для проведения экстракорпорального лечения является уровень Лп(а) >50,0 мг/дл. Приводятся рекомендации по скринингу и лечению пациентов с повышенным уровнем Лп(а), а также спектр разрабатываемых фармакотерапевтических препаратов для снижения его уровня в крови.
Ключевые слова
Для цитирования:
Полякова Е.А., Халимов Ю.Ш., Баженова Е.А., Бахер Т.М. Липопротеин(а), атеросклероз и сердечно-сосудистый риск. Рациональная Фармакотерапия в Кардиологии. 2024;20(5):559-565. https://doi.org/10.20996/1819-6446-2024-3080. EDN: QZQZAN
For citation:
Polyakova E.A., Khalimov I.S., Bazhenova E.A., Bakher T.M. Lipoprotein(a), atherosclerosis and cardiovascular risk. Rational Pharmacotherapy in Cardiology. 2024;20(5):559-565. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3080. EDN: QZQZAN
Введение
В настоящее время атеросклеротические сердечно-сосудистые заболевания (АССЗ), принявшие характер эпидемии, являются основной причиной смертности как в мире, так и в Российской Федерации [1-3]. Риск развития сердечно-сосудистых осложнений и прогноз течения атеросклероза во многом зависят от контроля и достижения целевых показателей как холестерина липопротеинов низкой плотности (ХС ЛНП), так и холестерина, не входящего в состав липопротеинов высокой плотности [3]. Тем не менее, даже при исходно невысоком уровне ХС ЛНП и регулярной гиполипидемической терапии, возможно прогрессирование атеросклероза [3][4]. Одной из причин распространения атеросклеротического процесса и развития неблагоприятных сердечно-сосудистых событий является повышенный уровень липопротеина(а) (Лп(а)) [4][5].
Лп(а) впервые был описан K. Berg в 1963 г. как одна из модификаций ЛНП [5]. Более поздние исследования показали, что Лп(а) и ЛНП — это разные частицы, так как относятся к разным классам 1. До настоящего времени существуют различные подходы к терминологии, применяемой для этого макромолекулярного комплекса. Многие исследователи придерживаются термина липопротеин(а), а часть — считают, что необходимо использовать формулировку "липопротеид(а)". В отечественной и зарубежной литературе наиболее распространено использование термина "липопротеин(а)", так как комплекс является представителем класса сложных белков, простетическая группа которых представлена липидом.
По оценкам популяционных исследований 20-30% населения планеты имеют повышенные уровни Лп(а) в сыворотке крови [6]. Генетические и эпидемиологические исследования показали роль этого липопротеина в повышении заболеваемости АССЗ [7]. Так, по данным консенсуса Европейского общество атеросклероза (European Atherosclerosis Society, EAS) 2022 г., каждый пятый человек в мире подвержен риску развития АССЗ, ассоциированному с высоким уровнем Лп(а) в крови [8].
Несмотря на то, что открытие Лп(а) датируется 1963 г., интерес к нему как к мишени управления сердечно-сосудистым риском (ССР) растет, и в последние годы ведется разработка потенциальных лекарственных методов лечения [7]. Гиперлипопротеинемия(а) находит отражение в рекомендациях Американской кардиологической ассоциации, Американской коллегии кардиологов как фактор, повышающий риск развития АССЗ [9]. Осенью 2022 года EAS опубликовало согласительный документ о роли Лп(а) как в повышении риска АССЗ, так и аортального стеноза, а Национальная липидная ассоциация в 2022 г. опубликовала заявление о необходимости внедрения оценки Лп(а) в широкую клиническую практику [6][9][10]. В клинических рекомендациях Российского кардиологического общества "Нарушения липидного обмена" 2023 г. также отдельное внимание уделено гиперлипопротеинемии(а), пороговым значениям для определения ССР и подходам к коррекции данного нарушения [3]. По состоянию на апрель 2024 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA) не одобрило ни одного лекарственного препарата для снижения уровня Лп(а) в крови, наряду с этим, изменение образа жизни оказывает незначительное влияние на уровень этого липопротеина 2. Клинические исследования лекарственных препаратов для снижения уровня Лп(а) фазы I завершены, фаз II и III продолжаются, а Лп(а) становится новой целью для снижения риска и заболеваемости ССЗ во всем мире, особенно у лиц без факторов риска или с контролируемыми факторами риска [11-14]. Исследование уровня Лп(а) в сыворотке крови имеет решающее значение для персонализированной модификации факторов риска, направленной на снижение глобального бремени ССЗ [15].
В данном обзоре рассмотрены генетические и патофизиологические свойства Лп(а), а также эпидемиологические данные, демонстрирующие его влияние на сердечно-сосудистую заболеваемость. Приведены рекомендации по скринингу и лечению пациентов с повышенным уровнем Лп(а), а также спектр разрабатываемых фармакотерапевтических препаратов для снижения его уровня в крови [12][14][15].
Генетические аспекты Лп(а)
Содержание Лп(а) в крови детерминировано генетически и не зависит от статуса курения, наличия сахарного диабета, артериальной гипертензии и других факторов риска. Прием статинов не влияет на уровень Лп(а) [8][12].
Концентрация Лп(a) преимущественно определяется генетической изменчивостью локуса LPA. Экспрессия гена LPA полностью проявляется к 2 годам, а уровень Лп(a) в крови устанавливается к 5 годам жизни человека [6]. Большая часть изменчивости концентрации Лп(a) в крови связана с полиморфизмом повторов крингл-домена IV (KIV) [12]. Cогласно литературным данным, концентрация Лп(а) может быть связана и с другими генами (APOE, CETP и APOH) [12]. Оценку риска, связанного с Лп(a), достаточно проводить путем измерения концентрации этого липопротеина в крови, а текущий консенсус EAS уточняет, что генотипирование гена LPA и исследование размера экспрессируемой изоформы апо(а) дополнительной ценности не имеют, являясь к тому же дорогостоящими [6][7]. Однако постепенное накопление результатов исследований по генотипированию гена LPA может в дальнейшем способствовать индивидуализации расчёта ССР, так варианты гена LPA уже включены в полигенные шкалы оценки ССР у больных с ишемической болезнью сердца [15].
Структура Лп(а), вклад в атерогенез и аортальный стеноз
Лп(а) состоит из двух компонентов: аполипопротеина В-100, содержащего липопротеин, аналогичный ЛНП, и соединенного через дисульфидный мостик с аполипопротеином(а) (апо(а)) (рис. 1).
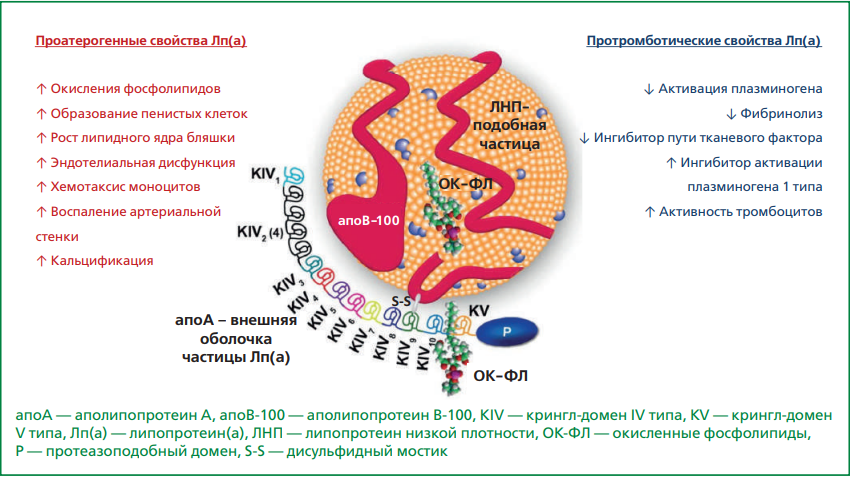
Рисунок 1. Структура липопротеина(a) (адаптировано из [7], согласно Creative Commons Attribution-NonCommercial-NoDerivs License (https://creativecommons.org/licenses/by/4.0/)).
Апо(а) представляет собой белок, кодируемый геном LPA, гомологичный плазминогену [7]. Апо(a) по своей структуре представлен доменами, называемыми "kringle", (крендель, англ.), которые, собственно, и сходны с аналогичными доменами плазминогена. Плазминоген содержит крингл-домены IV типа, но в Лп(a) обнаружены крингл-домены IV (KIV) и V типов. В апо(а) присутствуют десять подтипов KIV. Каждый подтип имеет одну копию, за исключением KIV2, число копий которого может широко варьировать и вызывать гетерогенность молекулярной массы апо(а) в популяции. Количество повторов KIV2 генетически кодируется вариантами локуса LPA [12]. Более повторяющиеся домены KIV2 приводят к формированию более крупных изоформ Лп(a) и снижению атерогенности по сравнению с меньшим количеством повторов KIV2 (малые изоформы Лп(a)) [7].
Точный патофизиологический механизм атерогенеза и развития аортального стеноза на фоне высокого Лп(а) неизвестен. Некоторые данные свидетельствуют о том, что атерогенность Лп(a) в 6 раз выше, чем атерогенность ХС ЛНП, и может быть опосредована не только его ускоренным накоплением в атеросклеротической бляшке, но и участием в клеточной передаче сигналов [6]. Кроме того, Лп(a) способствует повышению активности хронического субклинического воспаления и прогрессирования роста атеросклеротической бляшки, в том числе из-за его взаимодействия с окисленными фосфолипидами [7]. В плазме крови окисленные фосфолипиды преимущественно переносятся Лп(а) посредством ковалентного присоединения к апо(a), таким образом, поддерживая хроническое воспаление, атерогенез и процессы кальцификации [15]. Кроме того, апо(а) содержит протеазоподобный домен, гомологичный плазминогену, и теоретически может ингибировать фибринолиз, тем самым увеличивая риск тромбоза [7]. Однако исследования ex vivo у человека не продемонстрировали какого-либо влияния снижения Лп(а) на фибринолитическую активность плазмы крови [13]. Опубликованные данные свидетельствуют о том, что повышение Лп(а) не является фактором риска венозных тромбозов и нарушений фибринолиза [1]. Наряду с этим процессы развития и прогрессирования аортального стеноза у пациентов с высоким уровнем Лп(а) могут быть ассоциированы со способностью этого липопротеина проникать через интиму створок аортального клапана, вызывая воспаление и кальцификацию с последующей деформацией створок [15].
У кого необходимо исследовать уровень Лп(а) в крови?
Российские, европейские и американские рекомендации предписывают измерять Лп(a) хотя бы один раз в жизни у всех лиц старше 18 лет для своевременного выявления повышенного риска ССЗ, что также отражено и в консенсусе EAS 2022 г. [3][9]. Лицам моложе 18 лет исследование Лп(а) в крови рекомендуется при наличии ранних проявлений атеросклероза, при наличии АССЗ, семейном анамнезе ранних АССЗ у родственников или при известном семейном анамнезе гиперлипопротеинемии(а) [3]. Если известно, что у члена семьи выявлена семейная гиперхолестеринемия с повышением уровня Лп(а) в крови и/или АССЗ, развившееся в молодом возрасте, то рекомендовано проведение каскадного скрининга родственников с определением данного липопротеина в крови [6][9].
На основе согласительного документа EAS разработано клиническое руководство по оценке индивидуального риска в зависимости от уровня Лп(a) в крови, которое доступно в виде калькулятора на сайте общества и рекомендовано к использованию как врачами, так и пациентами [3].
Современные подходы к коррекции гиперлипопротеинемии(а)
Учитывая возросшую осведомленность врачей и охват лабораторным тестированием содержания Лп(а) в сыворотке крови пациентов, перед клиницистами встает вопрос об интерпретации результатов и способах коррекции в случае выявления гиперлипопротеинемии(а). Для эффективного управления данным фактором риска, необходимо достоверное измерение уровня Лп(a) в крови, оценка факторов, влияющих на концентрацию Лп(a), понимание пороговых значений Лп(a), при которых возрастает ССР, когда необходимость коррекции его уровня становится очевидной.
Оптимальным уровнем Лп(а) в сыворотке крови в зависимости от единиц измерения считается значение <0,3 г/л, <30 мг/дл или 75 нмоль/л. В соответствии с клиническими рекомендациями "Нарушения липидного обмена", 2023 г., уровень Лп(а) >50 мг/дл ассоциируется с увеличением ССР [3][9].
Негенетические факторы также могут способствовать вариабельности концентрации данного липопротеина в крови. Большинство традиционных факторов риска существенно не влияет на содержание Лп(a) в крови. Тенденцию к более низкому уровню Лп(а) в крови можно проследить у пациентов на фоне низкоуглеводной диеты и с высоким содержанием полиненасыщенных жиров в рационе, а также при таких состояниях, как гипертиреоз, прием менопаузальной гормональной терапии, тяжелая печеночная недостаточность, выраженный воспалительный процесс (сепсис) [6][12].
Вместе с тем, прием тиреостатических препаратов или радиоактивного йода, наоборот, увеличивает содержание Лп(а) на 20-25%, а заместительная терапия гипотиреоза снижает Лп(а) на 5-20% [7][13]. Факторы, способствующие повышению уровня Лп(а), включают высокоуглеводную диету и употребление насыщенных жиров, гипотиреоз, нефротический синдром и беременность [7][15][16]. Поэтому, в ряде клинических ситуаций стоит оценивать Лп(а) повторно, например, когда первичная оценка была проведена во время острого воспалительного процесса.
В случае повышения уровня Лп(а) в крови с целью первичной профилактики АССЗ необходимо оценить 10-летний и пожизненный риск с помощью шкал риска для конкретного региона проживания пациента, например, SCORE2 [3]. Для рестратификации риска необходимо рассмотреть возможность оценки индекса коронарного кальция с помощью компьютерной томографии сердца у пациентов с пограничным или промежуточным 10-летним риском АССЗ [3][9]. Также с целью первичной профилактики необходимо модифицировать основные факторы ССР, включая дислипидемию, артериальную гипертензию, ожирение, курение, нарушение толерантности к глюкозе и сахарный диабет.
В целях вторичной профилактики АССЗ у больных с гиперлипопротеинемией(а) и в сочетании с нецелевым уровнем ХС ЛНП необходимо назначение высокоинтенсивной терапии статинами, возможно, в сочетании с эзетимибом, а в случае их неэффективности рассмотреть возможность назначения пропротеин конвертазы субтилизин-кексинового типа 9 (PCSK9)-таргетных препаратов (эволокумаб, алирокумаб, инклисиран) [3][9]. Кроме коррекции содержания ХС ЛНП в сыворотке крови у пациентов с АССЗ и уровнем Лп(а) >50 мг/дл, следует рассмотреть возможность проведения каскадной плазмофильтрации [3]. Также необходимо проводить модификацию основных факторов риска рецидива ССЗ, включая все выше перечисленные факторы риска. Средства фармакотерапии гиперлипопротеинемии(а) находятся на стадии клинических исследований.
Порог Лп(a), повышающий риск АССЗ
В более ранних рекомендациях и консенсусных документах пороговым значением уровня Лп(а) в сыворотке крови считался уровень 50 мг/дл или выше, который было рекомендовано использовать в качестве признака, повышающего 10-летний риск АССЗ [6]. Консенсус EAS 2022 г определил пороговое значение Лп(а) для "исключения" риска АССЗ менее 30 мг/дл [6]. Диапазон значений Лп(а) между 30 мг/дл и 50 мг/дл — так называемая "серая зона" когда следует учитывать возможный риск, связанный с Лп(а), а также другие факторы риска ССЗ [3][6]. При значении Лп(а) >180 мг/дл риск ССЗ эквивалентен риску пациентов с гетерозиготной семейной гиперхолестеринемией [3].
Способы коррекции гиперлипопротеинемии(а)
В настоящее время не существует лекарственных препаратов, одобренных для целевого воздействия на уровень Лп(а). Коррекция образа жизни не приводит к существенным изменениям Лп(а) [7]. Учитывая эти реалии, рекомендуется агрессивная коррекция модифицируемых ССР с акцентом на индивидуальное для каждого пациента управление уровнем ХС ЛНП, артериального давления, глюкозы в крови, массы тела, повышение физической активности и диету.
Существуют противоречивые данные о влиянии терапии статинами на содержание Лп(а) в сыворотке крови. Так, величина эффекта варьировала от снижения Лп(a) на13% (95% доверительный интервал (ДИ) 10-15%) в исследовании CARDS, когда пациенты получали терапию аторвастатином, до обратного эффекта — увеличения уровня Лп(а) на 15% (95% ДИ 13-17%) в Скандинавском исследовании 4S (The Scandinavian Simvastatin Survival Study) [17][18]. Вместе с тем, метаанализ 2018 г. не показал какого-либо значимого эффекта терапии статинами на уровень Лп(а) [18]. Несмотря на то, что статины могут незначительно повышать уровни Лп(а), их не следует отменять или снижать дозу у пациентов с повышением Лп(а) в крови, т.к. контроль и достижение целевых значений ХС ЛНП, преобладают над любым потенциальным риском, связанным с увеличением Лп(а) [19].
Существуют данные о влияния моноклональных антител к PCSK9 (эволокумаб и алирокумаб) на уровень Лп(а). Степень снижения ССР была наибольшей у пациентов с более высокими исходными показателями Лп(a) в крови. Например, в исследовании FOURIER была проведена стратификация участников по исходному содержанию Лп(а) выше или ниже 120 нмоль/л. У лиц с уровнем Лп(а) >120 нмоль/л, снижение абсолютного риска, при терапии эволокумабом по сравнению с плацебо, составило 2,41%, а число пациентов, нуждающихся в лечении за 3 года, составило 41 против 1,41% и 71, в случае, если исходный уровень Лп(a) был ниже 120 нмоль/л [20]. Следует отметить, что в данном исследовании на фоне терапии эволокумабом уровень Лп(a) в сыворотке крови снизился на 27%.
Подобное снижение ССР наблюдали в исследовании ODYSSEY OUTCOMES при содержании Лп(а) >60 мг/дл [21]. Ассоциированное с терапией алирокумабом снижение Лп(а) было независимо связано с более низким риском общих сердечно-сосудистых событий: снижение Лп(а) на 5 мг/дл сопровождалось снижением частоты острых сердечно-сосудистых событий на 2,5% [22].
Также существуют данные о влиянии инклисирана (малая интерферирующая РНК, направленная на деградацию матричной РНК PCSK9), на содержание Лп(а). Так, в исследовании отечественных авторов ко 2-му месяцу терапии инклисираном уровень Лп(а) снизился на 27,8%, а через 1 месяц после второй инъекции (4-й месяц от начала терапии) снижение было чуть менее существенным, но также значимым, и составило 13,9% от исходного [23], что согласуется с данными K. K. Ray и соавт., согласно которым инклисиран способствовал снижению Лп(a) на 18,6% от исходного уровня [24].
В целом, PCSK9-таргетная терапия не имеет прямого показания для лечения гиперлипопротеинемии(а). Данных, подтверждающих рутинное ее использование с целью коррекции гиперлипопротеинемии(а) в сыворотке крови, в настоящее время недостаточно.
Экстракорпоральные методы удаления избытка Лп(а) из сыворотки крови являются в настоящее время единственным доказанным вариантом коррекции данной дислипидемии [3][9]. Каскадная плазмофильтрация способствует снижению уровня ХС ЛНП и Лп(а) более чем на 60%, а также снижению уровня окисленных фосфолипидов в плазме [1]. Нужно отметить, что согласно отечественным клиническим рекомендациям 2023 г., критериями для проведения экстракорпорального лечения пациентов с гетерозиготной семейной гиперхолестеринемией является уровень холестерина ЛНП >5,0 ммоль/л и уровень Лп(а) >50,0 мг/дл [3].
Терапия ниацином также сопровождается снижением содержания Лп(а) в крови на 20-25%, но не рекомендована в качестве способа лечения данной дислипидемии из-за отсутствия достаточной доказательной базы и существенных побочных эффектов [25]. Вместе с тем, исследований эффективности и безопасности ниацина в популяции лиц с повышенным уровнем Лп(а) не проводилось.
Эзетимиб, фибраты и бемпедоевая кислота не оказывают значительного влияния на уровень Лп(a) в крови [26][27].
Данных о необходимости назначения ацетилсалициловой кислоты пациентам с гиперлипопротеинемией(а) в настоящее время недостаточно и, по меньшей мере, должно определяться категорией ССР конкретного пациента [10][13].
Повышенное содержание Лп(а) в сыворотке крови взаимосвязано с ранее диагностированным или впервые выявленным кальцинированным аортальным стенозом [8]. Нужно отметить, что на сегодняшний день не существует фармакотерапевтического подхода, способного замедлить прогрессирование аотрального стеноза. Лечение симптомного и тяжелого аортального стеноза заключается в хирургическом вмешательстве или транскатетерной имплантации аортального клапана. Разработка и использование препаратов, которые эффективно и безопасно снижали бы уровень Лп(а) в крови, предотвращая или замедляя прогрессирование аортального стеноза, крайне востребованы, особенно на ранних стадиях.
Перспективы фармакотерапии и управления ССР, ассоциированным с гиперлипопротеинемией(а)
Снижение риска ССЗ за счет коррекции содержания Лп(а) представляет собой одну из наиболее многообещающих терапевтических задач первичной и вторичной профилактики в XXI веке. Перспективы диагностики и лечения гиперлипопротеинемии(а) включают:
- Расширение возможностей рутинного исследования уровня Лп(а) (рис. 2) [3][8][9]:
- Все взрослые с установленным АССЗ;
- Все взрослые с ранним семейным анамнезом АССЗ;
- Лица в возрасте до 18 лет с ишемическим инсультом в анамнезе, семейным анамнезом раннего АССЗ или известным семейным анамнезом с высоким уровнем Лп(а);
- Скрининг всех лиц старше 18 лет один раз в жизни на основании отечественных клинических рекомендаций.
- Результаты текущих рандомизированных клинических исследований II и III фаз по оценке сердечно-сосудистых исходов у больных с гиперлипопротеинемией(а) при назначении таргетной терапии, основанной на принципе РНК интерференции и редактировании генома (рис. 2) [28, 29]:
- Рандомизированные клинические исследования фармакотерапии, снижающей уровень Лп(а) (пелакарсен, олпасиран);
- Рандомизированные клинические исследования влияния препаратов (пелакарсен, олпасиран), снижающих уровень Лп(а), на развитие и/или прогрессирование стеноза аортального клапана.
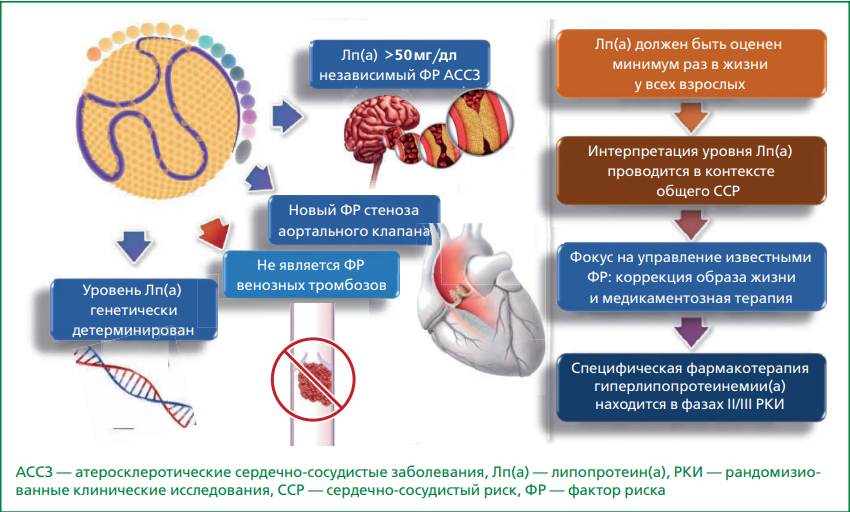
Рисунок 2. Липопротеин(а) как фактора глобального сердечно-сосудистого риска (адаптировано из [8], согласно Creative Commons Attribution-NonCommercial-NoDerivs License (https://creativecommons.org/licenses/by/4.0/))
Заключение
Повышение уровня Лп(а) в сыворотке — независимый фактор риска АССЗ и аортального стеноза. Применение таргетной фармакотерапии, снижающей синтез Лп(а) в печени, будет возможно в ближайшие годы после завершения рандомизированных клинических исследований, однако имеющиеся работы и данные менделевской рандомизации свидетельствуют о важности и необходимости управления данным типом дислипидемии. Фармакотерапия, демонстрирующая, что коррекция гиперлипопротеинемии(а) приводит к снижению бремени сердечно-сосудистых осложнений, станет очередным прорывом в профилактической кардиологии и позволит снизить сердечно-сосудистый риск. До того, как подобное лечение станет доступным, необходимо повышать осведомленность врачей о негативном влиянии высокого уровня Лп(a) и необходимости рутинного тестирования взрослого населения для своевременного выявления групп риска развития АССЗ, аортального стеноза и своевременного определения показаний для проведения каскадной плазмофильтрации.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование: Работа выполнена при поддержке Первого Санкт-Петербургского государственного медицинского университета им. акад. И. П. Павлова.
Funding: The study was performed with the support of Pavlov First Saint Petersburg State Medical University.
1 Khovidhunkit W. Lipoprotein(a). 2023. In: Feingold KR, Anawalt B, Blackman MR, et al. Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK596274/
2 https://dps.fda.gov/ndc.
Список литературы
1. Бойцов С.А., Погосова Н.В., Аншелес А.А. и др. Кардиоваскулярная профилактика 2022. Российские национальные рекомендации. Российский кардиологический журнал. 2023;28(5):5452. DOI: 10.15829/1560-4071-2023-5452.
2. Mach F, Baigent C, Catapano AL, et al; ESC Scientific Document Group. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2020;41(1):111-88. DOI: 10.1093/eurheartj/ehz455
3. Ежов М. В., Кухарчук В. В., Сергиенко И. В. и др. Нарушения липидного обмена. Клинические рекомендации 2023. Российский кардиологический журнал. 2023;28(5):5471. DOI: 10.15829/1560-4071-2023-5471.
4. Marcovina SM, Koschinsky ML. Lipoprotein(a) as a risk factor for coronary artery disease. Am J Cardiol. 1998;82(12A):57U-66U; discussion 86U. DOI: 10.1016/s0002-9149(98)00954-0.
5. Berg K. A new serum type system in man–the Lp system. Acta Pathol Microbiol Scand. 1963;59:369-82. DOI: 10.1111/j.1699-0463.1963.tb01808.x.
6. Kenet G, Lutkhoff LK, Albisetti M, et al. Impact of thrombophilia on risk of arterial ischemic stroke or cerebral sinovenous thrombosis in neonates and children: a systematic review and meta-analysis of observational studies. Circulation. 2010;121(16):1838-47. DOI: 10.1161/CIRCULATIONAHA.109.913673.
7. Tasdighi E, Adhikari R, Almaadawy O, et al. LP(a): Structure, Genetics, Associated Cardiovascular Risk, and Emerging Therapeutics. Annu Rev Pharmacol Toxicol. 2024;64:135-57. DOI: 10.1146/annurev-pharmtox-031023-100609.
8. Kronenberg F, Mora S, Stroes ESG, et al. Lipoprotein(a) in atherosclerotic cardiovascular disease and aortic stenosis: a European Atherosclerosis Society consensus statement. Eur Heart J. 2022;43(39):3925-46. DOI: 10.1093/eurheartj/ehac361.
9. Grundy SM, Stone NJ, Bailey AL, et al. 2018 AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA Guideline on the Management of Blood Cholesterol: a Report of the American College of Cardiology/American Heart Association Task Force on Clinical Prac tice Guidelines. Circulation. 2019;139(25):e1082–e1143. DOI: 10.1016/j.jacc.2018.11.002.
10. Wilson DP, Jacobson TA, Jones PH, et al. Use of Lipoprotein(a) in clinical practice: a biomarker whose time has come. A scientific statement from the National Lipid Association. J Clin Lipidol. 2019;13(3):374-92. DOI: 10.1016/j.jacl.2019.04.010.
11. Small AM, Pournamdari A, Melloni GEM, et al. Lipoprotein(a), C-Reactive Protein, and Cardiovascular Risk in Primary and Secondary Prevention Populations. JAMA Cardiol. 2024;9(4):385-91. DOI: 10.1001/jamacardio.2023.5605.
12. Nicholls SJ, Nissen SE, Fleming C, et al. Muvalaplin, an Oral Small Molecule Inhibitor of Lipoprotein(a) Formation: A Randomized Clinical Trial. JAMA. 2023;330(11):1042-53. DOI: 10.1001/jama.2023.16503.
13. Laffin LJ, Nissen SE. Lp(a) — an overlooked risk factor. Trends Cardiovasc Med. 2024;34(3):193-9. DOI: 10.1016/j.tcm.2023.01.003
14. Frampton JE. Inclisiran: A Review in Hypercholesterolemia. Am J Cardiovasc Drugs. 2023;23(2):219-30. DOI: 10.1007/s40256-023-00568-7.
15. Manikpurage HD, Paulin A, Girard A, et al. Contribution of Lipoprotein(a) to Polygenic Risk Prediction of Coronary Artery Disease: A Prospective UK Biobank Analysis. Circ Genom Precis Med. 2023;16(5):470-7. DOI: 10.1161/CIRCGEN.123.004137.
16. Kronenberg F. Lipoprotein(a): from Causality to Treatment. Curr Atheroscler Rep. 2024;26(3):7582. DOI: 10.1007/s11883-024-01187-6.
17. Deshmukh HA, Colhoun HM, Johnson T, et al. Genome-wide association study of genetic determinants of LDL-c response to atorvastatin therapy: importance of Lp(a). J Lipid Res. 2012;53(5):1000-11. DOI: 10.1194/jlr.P021113.
18. Berg K, Dahlen G, Christophersen B, et al. Lp(a) lipoprotein level predicts survival and major coronary events in the Scandinavian Simvastatin Survival Study. Clin Genet. 1997;52(5):254-61. DOI: 10.1111/j.1399-0004.1997.tb04342.x.
19. Willeit P, Ridker PM, Nestel PJ, et al. Baseline and on-statin treatment lipoprotein(a) levels for prediction of cardiovascular events: individual patientdata meta-analysis of statin outcome trials. Lancet. 2018;392(10155):1311-20. DOI: 10.1016/S0140-6736(18)31652-0.
20. O’Donoghue ML, Fazio S, Giugliano RP, et al. Lipoprotein(a), PCSK9 Inhibition, and Cardiovascular Risk. Circulation. 2019;139(12):1483-92. DOI: 10.1161/CIRCULATIONAHA.118.037184.
21. Szarek M, Bittner VA, Aylward P, et al; ODYSSEY OUTCOMES Investigators. Lipoprotein(a) lowering by alirocumab reduces the total burden of cardio vascular events independent of low-density lipoprotein cholesterol lowering: ODYSSEY OUTCOMES trial. Eur Heart J. 2020;41(44):4245-55. DOI: 10.1093/eurheartj/ehaa649.
22. Bittner VA, Szarek M, Aylward PE, et al; ODYSSEY OUTCOMES Committees and Investigators. Effect of alirocumab on lipoprotein(a) and cardiovascular risk after acute coronary syndrome. J Am Coll Cardiol. 2020;75(2):133-44. DOI: 10.1016/j.jacc.2019.10.057.
23. Полякова Е. А., Лапин С. В., Мазинг А. В. и др. Первые результаты применения инклисирана в клинической практике у пациентов с дислипидемией. РМЖ. 2023;(9):18-29.
24. Ray KK, Kallend D, Koenig W, et al. 6 monthly inclisiran and atherogenic lipoprotein reductions in Orion-11. JACC. 2020;75(11_Supplement_1):1853. DOI: 10.1016/S0735-1097(20)32480-3.
25. AIM-HIGH Investigators; Boden WE, Probstfield JL, Anderson T, et al. Niacin in patients with low HDL cholesterol levels receiving intensive statin therapy. N Engl J Med. 2011;365(24):2255-67. DOI: 10.1056/NEJMoa1107579.
26. Sahebkar A, Simental-Mendia LE, Watts GF, et al; Lipid and Blood Pressure Metaanalysis Collaboration (LBPMC) Group. Comparison of the effects of fibrates versus statins on plasma lipoprotein(a) concentrations: a systematic review and meta-analysis of head-to-head ran domized controlled trials. BMC Med. 2017;15(1):22. DOI: 10.1186/s12916-017-0787-7.
27. Thompson PD, Rubino J, Janik MJ, et al. Use of ETC-1002 to treat hypercholesterolemia in patients with statin intolerance. J Clin Lipidol. 2015;9(3):295-304. DOI: 10.1016/j.jacl.2015.03.003.
28. Springer AD, Dowdy SF. GalNAc-siRNA conjugates: leading the way for delivery of RNAi therapeutics. Nucleic Acid Ther. 2018;28(3):109-18. DOI: 10.1089/nat.2018.0736.
29. Nair JK, Attarwala H, Sehgal A, et al. Impact of enhanced metabolic stability on pharmacokinetics and pharmacodynamics of GalNAc-siRNA conjugates. Nucleic Acids Res. 2017;45(19):10969-77. DOI: 10.1093/nar/gkx818.
Об авторах
Е. А. ПоляковаРоссия
Полякова Екатерина Анатольевна
Санкт-Петербург
Ю. Ш. Халимов
Россия
Халимов Юрий Шавкатович
Санкт-Петербург
Е. А. Баженова
Россия
Баженова Елена Анатольевна
Санкт-Петербург
Т. М. Бахер
Россия
Бахер Тимур Мохамадович
Санкт-Петербург
Дополнительные файлы
Рецензия
Для цитирования:
Полякова Е.А., Халимов Ю.Ш., Баженова Е.А., Бахер Т.М. Липопротеин(а), атеросклероз и сердечно-сосудистый риск. Рациональная Фармакотерапия в Кардиологии. 2024;20(5):559-565. https://doi.org/10.20996/1819-6446-2024-3080. EDN: QZQZAN
For citation:
Polyakova E.A., Khalimov I.S., Bazhenova E.A., Bakher T.M. Lipoprotein(a), atherosclerosis and cardiovascular risk. Rational Pharmacotherapy in Cardiology. 2024;20(5):559-565. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3080. EDN: QZQZAN
JATS XML
















































