Перейти к:
Постмиокардиальный синдром после перенесенного инфаркта миокарда и чрескожного коронарного вмешательства
https://doi.org/10.20996/1819-6446-2024-3112
EDN: STPYHE
Аннотация
Постмиокардиальный синдром (синдром Дресслера) представляет собой форму вторичного перикардита с перикардиальным выпотом или без него, возникающий в результате повреждения миокарда. Постмиокардиальный синдром не является распространенным заболеванием, однако его следует заподозрить у пациентов, имеющих патогномоничные симптомы после перенесенного инфаркта миокарда (ИМ). В статье представлено клиническое наблюдение мужчины 65 лет, курильщика, имеющего избыточную массу тела, гипертоническую болезнь в анамнезе, ИМ с подъёмом сегмента ST, стентирование огибающей ветви левой коронарной артерии, тромбаспирацию. По данным коронарографии у больного выявлено многососудистое поражение коронарных артерий. Через 2 недели после стентирования состояние пациента ухудшилось: появились одышка, боль в левой половине грудной клетки, лихорадка. При обследовании на амбулаторном этапе выявлены двухсторонний гидроторакс, гидроперикард. Госпитализирован в стационар, проводилось лечение ибупрофеном 600 мг 3 раза в сутки в течение 7 дней, с положительным эффектом. Но через 10 дней после выписки пациент вновь отметил нарастание одышки, повышение температуры тела, рецидив тупой боли в грудной клетке, был госпитализирован в ГКБ №67 им. Л. А. Ворохобова, где в процессе обследования выявлены двухсторонний гидроторакс, гидроперикард, пневмонит и был установлен диагноз "Постмиокардиальный синдром, рецидивирующее течение". Лечение в стационаре проводилось колхицином, метилпреднизолоном, ацетилсалициловой кислотой, тикагрелором, лозартаном, бисопрололом, амлодипином, спиронолактоном. На фоне проводимой терапии состояние улучшилось, пациент стал отмечать повышение толерантности к физической нагрузке, постепенное регрессирование тупой боли в грудной клетке слева, снижение температуры тела до субфебрильных цифр. Отмечалась положительная динамика лабораторных показателей.
Ключевые слова
Для цитирования:
Клименко А.А., Демидова Н.А., Веселкин В.В., Кирдяшкина T.А., Чинова А.А., Шандановина Ю.А. Постмиокардиальный синдром после перенесенного инфаркта миокарда и чрескожного коронарного вмешательства. Рациональная Фармакотерапия в Кардиологии. 2024;20(5):581-587. https://doi.org/10.20996/1819-6446-2024-3112. EDN: STPYHE
For citation:
Klimenko A.A., Demidova N.A., Veselkin V.V., Kirdyashkina T.A., Chinova A.A., Shandanovina Yu.A. Postmyocardial syndrome after myocardial infarction and percutaneous coronary intervention. Rational Pharmacotherapy in Cardiology. 2024;20(5):581-587. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3112. EDN: STPYHE
Введение
Постмиокардиальный синдром или синдром Дресслера — аутоиммунное осложнение инфаркта миокарда (ИМ), проявляющееся сочетанием перикардита, плеврита и пневмонита, возникающее через 2-6 недель после острого ИМ, оперативных вмешательств на сердце, травматического повреждения или эндоваскулярных вмешательств [1-3]. Постмиокардиальный синдром является "поздним" перикардитом, в отличие от "раннего" или эпистенокардитического перикардита, развивающегося в первые дни трансмурального ИМ вследствие вовлечения висцерального и париетального листков перикарда [4]. По данным разных авторов, постмиокардиальный синдром в 3,5 раза чаще развивается у мужчин и встречается примерно в 3-5,8% случаев ИМ [3]. Распространенность атипичных, малосимптомных, а следовательно, недиагностируемых форм может достигать 15-23% [4]. В эпоху ранней реперфузии распространенность постмиокардиального синдрома снизилась [3][5][6]. Более того, классический постмиокардиальный синдром в виде полисерозита (перикардит, плеврит) и пневмонита, в настоящее время встречается крайне редко [2]. Постмиокардиальный синдром чаще развивается после распространенного ИМ, особенно передней и нижней стенки с вовлечением правого желудочка [6].
Аналогичная синдрому Дресслера симптоматика может наблюдаться после тупой травмы сердца, эндоваскулярных вмешательств (чрескожные коронарные вмешательства, установка электрокардиостимулятора, радиочастотная аблация), кардиохирургических операций (операции по замене клапанов и др.), все чаще проводимых в последние годы. В таких случаях осложнение с описанными William Dressler симптомами называют синдромом посткардиального повреждения, или синдромом посткардиальной травмы, посткардиотомным синдромом (после операций на сердце). Наиболее часто наблюдается перикардит или перикардит в сочетании с плевритом [7].
Развитие острого перикардита описано и после тромбоэмболии легочной артерии (ТЭЛА), что вероятно связано с повреждением миокарда правого желудочка [8].
Этиология постмиокардиального синдрома до конца не изучена, но предполагается, что повреждение кардиомиоцитов и мезотелиальных клеток перикарда и попадание клеток крови в перикард приводит к отложению иммунных комплексов в перикарде, плевре и легких, что вызывает воспаление [1][3][9]. Аутоиммунный генез патологии доказывает обнаружение аутоантител (антитела к актину и актомиозину) и увеличение доли лимфоцитов, содержащих поверхностные иммуноглобулины IgG. Кроме того, длительный латентный период от повреждения сердца до клинического начала и хороший ответ на глюкокортикоидную терапию и нестероидные противовоспалительные препараты подтверждают это предположение [6].
Клинически постмиокардиальный синдром проявляется повышением температуры тела, иногда до фебрильных цифр, болью в грудной клетке при перикардите и плеврите. Возможны жалобы на слабость, сердцебиение, одышку. Из атипичных клинических проявлений чаще всего встречается изолированный пневмонит, напоминающий очаговую пневмонию. Развитие этого варианта осложнения нередко служит основанием для назначения антибактериальной терапии, неэффективность которой заставляет врача задуматься об ином генезе симптоматики [8]. При пневмоните может наблюдаться кашель, снижается насыщение крови кислородом. Также пациенты могут предъявлять жалобы на боль в суставах, реже отмечается появление артрита [10].
Клиническая картина постмиокардиального синдрома, как правило, развивается через 1-6 недель после первоначального повреждения миокарда, чаще на 2-3 неделе [8].
Лабораторно в пользу постмиокардиального синдрома свидетельствует лейкоцитоз со сдвигом влево, повышение скорости оседания эритроцитов и С-реактивного белка (СРБ), редко эозинофилия [1][11].
На электрокардиограмме (ЭКГ) можно увидеть наиболее частые признаки перикардита: распространенная вогнутая элевация сегмента ST с депрессией сегмента PR в отсутствие реципрокных изменений; признак Сподика (нисходящее направление сегмента TP (или целого QRS-TP), который при перикардите присутствует во многих отведениях; соотношение сегмента ST/зубец T в V6 >0,25 [12]. Также возможна электрическая альтернация, низковольтажная ЭКГ при массивном перикардиальном выпоте.
В большинстве случаев трансторакальной эхокардиографии (ЭхоКГ) достаточно для выявления жидкости в полости перикарда [1]. Вспомогательными визуализирующими методами являются магнитно-резонансная томография сердца, обладающая хорошей чувствительностью и специфичностью для диагностики перикардита, а также компьютерная томография (КТ) органов грудной клетки [1][3][6][13-15].
Низкая распространенность постмиокардиального синдрома, отсутствие патогномоничных проявлений, вариабельность клинической картины, небольшое количество публикаций побудили нас поделиться следующим клиническим наблюдением.
Цель работы — представить клиническое наблюдение пациента, у которого развился постмиокардиальный синдром после перенесенного ИМ.
Описание клинического случая
Пациент Л., 65 лет, в течение последних лет отмечал повышение артериального давления (АД) до 170/100 мм рт.ст., лекарственных препаратов не принимал. Курит на протяжении 30 лет по 1 пачке сигарет в день.
24.03.2023 ночью у больного внезапно появилась тупая боль в области грудной клетки слева, которая разбудила его. Ранее боль ангинозного характера никогда не возникала. Боль сопровождалась одышкой, усиливающейся в положении лежа на спине, повышением АД до 160/100 мм рт.ст., в связи с чем через 3 часа после начала симптомов больной вызвал бригаду скорой медицинской помощи. При регистрации ЭКГ зафиксирован подъем сегмента ST на 3 мм в отведениях II и III, V5, V6, депрессия сегмента ST на 3 мм в V1. На догоспитальном этапе пациенту была проведена терапия: нитроглицерин 0,5 мг сублингвально, клопидогрел 300 мг и ацетилсалициловая кислота 300 мг перорально. Пациент был доставлен в приёмное отделение городского сосудистого центра с направительным диагнозом "Острый коронарный синдром". При дообследовании уровень тропонина I 98,2 нг/л (референсные значения 0,02-0,06 нг/л). Госпитализирован в отделение реанимации и интенсивной терапии с диагнозом: "Острый инфаркт миокарда нижней стенки левого желудочка с подъёмом сегмента ST". 24.03.2023 г. была выполнена коронароангиография, по данным которой у пациента визуализировалось многососудистое поражение коронарных артерий (ангиографические признаки тромботической субокклюзии в проксимальном сегменте огибающей артерии, стеноз правой коронарной артерии в проксимальном сегменте 80-85%, стеноз передней межжелудочковой ветви (ПМЖВ) в проксимальном сегменте до 65%, стеноз в среднем сегменте ПМЖВ до 50%) с последующим проведением тромбаспирации, транслюминальной баллонной ангиопластики со стентированием огибающей ветви левой коронарной артерии. 25.03.2023 г. пациент был переведён в кардиологическое отделение, где проводилась двойная антитромбоцитарная терапия, антигипертензивная, гастропротективная, липидснижающая терапия, на фоне чего состояние пациента улучшилось, боль в грудной клетке и одышка регрессировали, уровень тропонина I снизился до 3 нг/л.
30.03.2023 пациент был выписан с рекомендациями продолжить приём бисопролола 5 мг в сутки, лозартана 50 мг в сутки, амлодипина 5 мг, спиронолактона 25 мг в сутки, тикагрелора 90 мг 2 раза в сутки, ацетилсалициловой кислоты 100 мг в сутки, пантопразола 20 мг в сутки, аторвастатина 40 мг в сутки.
Через 2 недели после выписки пациент отметил повышение температуры тела до 39°С в течение 6 дней, появление одышки при умеренной физической нагрузке. Обратился в поликлинику к терапевту, была выполнена КТ органов грудной клетки, выявлена жидкость в плевральных полостях, гидроперикард. Пациент госпитализирован в стационар, заподозрен постмиокардиальный синдром, проводилось лечение ибупрофеном 600 мг 3 раза в сутки в течение 7 дней с положительным эффектом — одышка регрессировала, температура тела нормализовалась. После выписки ибупрофен не принимал.
На протяжении 10 дней пациент чувствовал себя удовлетворительно, но 30.04.2023 стал ощущать нарастание одышки в покое, тупую постоянную боль в области грудной клетки слева. 02.05.2023 вызвал бригаду скорой медицинской помощи, госпитализирован во 2-е кардиологическое отделение ГКБ №67 им. Л. А. Ворохобова.
При поступлении состояние больного средней тяжести. Температура тела 38°С. Индекс массы тела 28,3 кг/м2. Частота дыхательных движений 20 в минуту. Сатурация 90% при дыхании атмосферным воздухом. При аускультации в легких ослабленное везикулярное дыхание в нижних отделах с двух сторон. Отмечено повышение АД до 165/90 мм рт.ст. Частота сердечных сокращений (ЧСС) 95 уд./мин. При аускультации сердца выслушивались приглушенные I и II тоны над верхушкой.
Выполнен тест 6-минутной ходьбы — 355 м, что соответствует II функциональному классу (ФК) сердечной недостаточности.
В лабораторных показателях обращало внимание повышение уровня лейкоцитов до 11,9х109/л, нейтрофилов до 9х109/л, N-концевого пропептида мозгового натрийуретического пептида (NT-proBNP) 5000 пг/мл, Д-димера до 0,604 мкг/мл (референсные значения до 0,5 мкг/мл), при этом уровень тропонина I и КФК (МВ) оставались в норме (табл.).
На ЭКГ регистрировались синусовый ритм с ЧСС 100 ударов в минуту, элевация сегмента ST до 3 мм в II, III, V6, депрессия ST в V1 отведении (рис. 1).
Пациенту было выполнено ультразвуковое исследование плевральных полостей: признаки двустороннего гидроторакса.
По результатам ЭхоКГ: акинез задней стенки, гипо-акинез нижнебоковой стенки ЛЖ, фракция выброса 52%, малый выпот в перикарде (сепарация листков перикарда 7 мм).
На рентгенограмме органов грудной клетки: признаки минимально выраженного выпота в правой плевральной полости (рис. 2).
Таблица. Лабораторные показатели пациента
|
Параметр |
02.05.2023 |
11.05.2023 |
Референсные значения |
|
Лейкоциты, 109/л |
11,9 |
6,2 |
3,6-9,2 |
|
Нейтрофилы, 109/л |
9,0 |
4,5 |
1,7-7,6 |
|
КФК-МВ, ЕД/л |
14,9 |
15,0 |
0-24,0 |
|
АСТ, ЕД/л |
32,6 |
30,1 |
0-35,0 |
|
АЛТ, ЕД/л |
42,8 |
35,2 |
0-45,0 |
|
Креатинин, мМоль/л |
73,5 |
74 |
72,0-127,0 |
|
Калий, мМоль/л |
3,83 |
3,6 |
3,5-5,1 |
|
Д-димер, нг/мл |
0,604 |
0,498 |
0-500 |
|
С-реактивный белок, мг/дл |
10,1 |
5 |
0-5 |
|
NT-proBNP, пг/мл |
5000 |
1950 |
<20-299 |
|
Холестерин, мМоль/л |
4,47 |
4,3 |
0-5,3 |
|
ТГ общие, мМоль/л |
1,07 |
1,03 |
0-1,7 |
|
ХС ЛНП, мМоль/л |
2,0 |
1,97 |
2,5-4,0 |
|
ХС ЛВП, мМоль/л |
1,4 |
1,3 |
0,7-1,73 |
|
Тропонин I, нг/л |
0,9 |
0,8 |
0-1 |
|
КФК-МВ — креатинкиназа МВ, АСТ — аспартатаминотрансфераза, АЛТ — аланинаминотрансфераза, NT-proBNP — предшественник натрийуретического пептида, ТГ — триглицериды, ЛНП — липопротеины низкой плотности, ЛВП — липопротеины высокой плотности |
|||
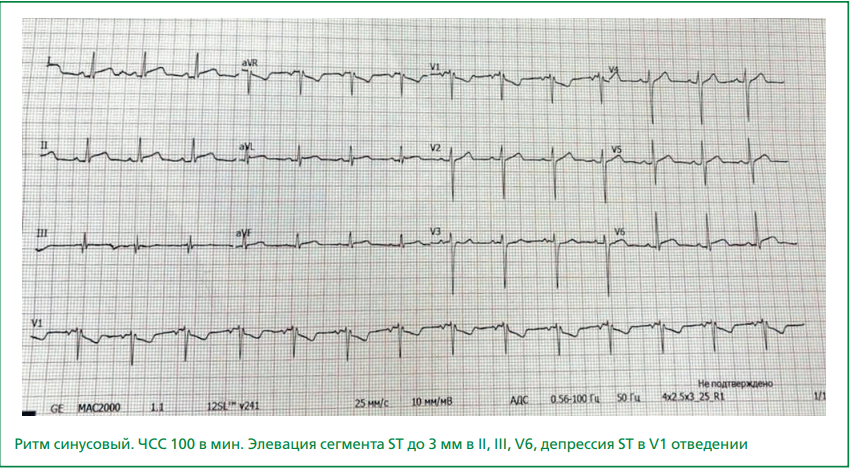
Рисунок 1. ЭКГ пациента Л. от 30.04.2023.
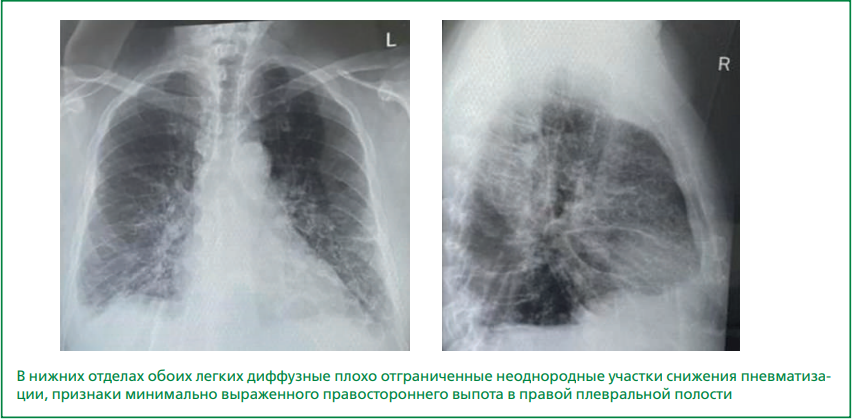
Рисунок 2. Рентгенография органов грудной клетки пациента Л. от 30.04.2023.
Для исключения ТЭЛА 05.05.2023 г. пациенту была выполнена КТ органов грудной клетки с внутривенным контрастированием: данных за ТЭЛА не получено. В базальных отделах легких перибронхиально имеются участки "матового стекла".
Проводился поиск инфекционных причин перикардита — исключены герпесвирусные инфекции (полимеразная цепная реакция на вирус герпеса 6 типа, Эпштейна-Барр, цитомегаловирус отрицательны), новая коронавирусная инфекция, грипп, энтеровирусная инфекция. Маркеры вирусных гепатитов В, С, вирус иммунодефицита человека отрицательны. Антитела к Chlamydophila pneumonia, Mycoplasma pneumoniae, S. pneumoniaе — отрицательны.
Анализ крови на антиядерные антитела отрицательный. Уровни тиреотропного гормона, свободного Т4 в норме. Бактериологическое исследование крови дало отрицательный результат. Пациент был консультирован фтизиатром, выполнялся диаскин-тест: данных за туберкулез нет.
Пациенту было выполнено ультразвуковое исследование брюшной полости, щитовидной железы, эзофагогастродуоденоскопия, колоноскопия, которые не выявили онкопатологии.
Учитывая хронологическую связь развития перикардита с перенесенным ИМ, сочетание гидроперикарда, гидроторакса, признаки пневмонита по данным КТ органов грудной клетки, повышение уровня СРБ, исключение других причин перикардита, установлен следующий клинический диагноз: "Основное заболевание: Ишемическая болезнь сердца. Постинфарктный кардиосклероз (неQ-образующий инфаркт миокарда нижне-боковой стенки левого желудочка от 24.03.2023). Атеросклероз коронарных артерий: стеноз правой коронарной артерии в проксимальном сегменте 80-85%, стеноз ПМЖВ в проксимальном сегменте до 65%, стеноз в среднем сегменте ПМЖВ до 50%. Тромбаспирация, транслюминальная баллонная ангиопластика со стентированием огибающей ветви левой коронарной артерии от 24.03.2023. Фоновое заболевание: Гипертоническая болезнь III стадии. Неконтролируемая АГ. Ожирение 1 степени. Риск сердечно-сосудистых осложнений 4. Осложнения: Постмиокардиальный синдром (синдром Дресслера), рецидивирующее течение: экссудативный перикардит с малым количеством выпота, двусторонний минимальный плеврит, пневмонит. Хроническая сердечная недостаточность с сохраненной фракцией выброса (52%), IIA стадии, II ФК по NYHA".
В связи с рецидивирующим характером перикардита после предшествующего назначения ибупрофена, пневмонитом, в качестве противовоспалительной терапии пациенту назначен метилпреднизолон 16 мг в сутки в сочетании с колхицином 0,5 мг 1 раз в день. Продолжена двойная антитромбоцитарная терапия (ацетилсалициловая кислота 100 мг в сутки, тикагрелол 90 мг 2 раза в сутки), спиронолактон 50 мг в сутки, лозартан 50 мг в сутки, бисопролол 5 мг в сутки, амлодипин 5 мг в сутки, пантопразол 20 мг в сутки, аторвастатин 40 мг в сутки.
На фоне проводимой терапии состояние улучшилось. Пациент стал отмечать повышение толерантности к физической нагрузке, постепенное регрессирование тупой боли в области грудной клетки, снижение температуры тела до субфебрильных цифр. При динамическом контроле лабораторных показателей отмечалось снижение уровня СРБ до 5 мг/л, нормализация уровня лейкоцитов, снижение уровня NT-proBNP до 1950 пг/мл.
При контрольной ЭхоКГ от 11.05.2023 отмечалось уменьшение выпота в полости перикарда (сепарация листков перикарда до 3 мм), при ультразвуковом исследовании плевральных полостей данных за гидроторакс не получено.
В удовлетворительном состоянии пациент был выписан из стационара под наблюдение кардиолога по месту жительства. Было рекомендовано продолжить терапию метилпреднизолоном 4 таблетки в сутки (16 мг) в течении месяца, колхицином 0,5 мг 1 раз в сутки в сутки в течение 4-6 месяцев с оценкой через 1 мес. результатов анализов крови (лейкоциты, тромбоциты, гемоглобин, скорость оседания эритроцитов, СРБ, биохимический анализ крови), ЭхоКГ с последующим решением вопроса о темпах снижения дозы глюкокортикоидов (ГК) — при положительной динамике по 1/2 таблетки 1 раз в 7 дней, также во время приема метилпреднизолона и двойной антитромбоцитарной терапии — пантопразол 20 мг в день.
При телефонном контакте с больным после выписки 10.09.2023 состояние удовлетворительное, одышка и боль в грудной клетке больше не рецидивировали. 11.08.2023 пациенту выполнено стентирование правой коронарной артерии, послеоперационный период протекал без осложнений. При ЭхоКГ от августа 2023 г. данных за наличие жидкости в полости перикарда не получено. Прием метилпреднизолона пациент закончил в августе 2023 г., продолжает прием колхицина 0,5 мг в сутки.
Обсуждение
Постмиокардиальный синдром, хотя и не является распространенным заболеванием, следует предполагать у всех пациентов с лихорадкой и болью в грудной клетке плеврального характера, особенно если симптомы появляются через 2 недели после ИМ, травмы или операции на сердце, в том числе после радиочастотной аблации, установки электрокардиостимулятора, чрескожных коронарных и внутрисердечных вмешательств, аорто-коронарного шунтирования [13]. В представленном клиническом наблюдении постмиокардиальный синдром мог явиться осложнением не только самого ИМ, но и инвазивного вмешательства — больному кроме стандартного чрескожного коронарного вмешательства (ЧКВ) и стентирования проводилась тромбоаспирация, которая по техническому исполнению сложна и также могла стать причиной ятрогенного повреждения перикарда. Тромбоаспирация является нежелательным видом лечения острого коронарного синдрома согласно клиническим рекомендациям, в которых эксперты советуют воздержаться от рутинной тромбоаспирации и принимать решение о ее выполнении в начале или по ходу ЧКВ только на основании индивидуальных ангиографических и клинических данных пациента [2].
Диагноз "постмиокардиальный синдром" установить не всегда легко, поскольку симптомы могут быть сходными с пневмонией, инфекционным плевритом и перикардитом, инфекционным эндокардитом, ТЭЛА, стенокардией, рецидивом или повторным ИМ, сердечной недостаточностью, пневмотораксом, перикардитом при системных заболеваниях соединительной ткани [1].
Клиническое течение чаще доброкачественное, поддающееся консервативному лечению противовоспалительными препаратами, включая нестероидные противовоспалительные препараты (НПВП) и колхицин. Среди НПВП предпочтение отдается ацетилсалициловой кислоте, ибупрофену и напроксену. В некоторых случаях, при рецидивах болезни, требуется назначение ГК. В редких случаях постмиокардиальный синдром может вызывать более серьезные осложнения, включая тампонаду сердца и констриктивный перикардит, массивный плевральный выпот. Такие осложнения могут потребовать инвазивного лечения, включая перикардиоцентез или перикардиэктомию, пункцию плевральной полости.
В ранние сроки после ИМ следует избегать применения НПВП, так как это может привести к истончению рубца, расширению зоны некроза и разрыву свободной стенки миокарда [16]. Ацетилсалициловая кислота является предпочтительным средством лечения постинфарктного перикардита, применяется в дозировке 500-1000 мг каждые 6-8 часов [2][3]. Клинический ответ ожидается быстро, в течение 48 часов. При отсутствии ответа на лечение НПВП, необходимо применить колхицин или ГК. Назначения ГК следует избегать в первый месяц после ИМ из-за возможного нарушения заживления миокарда, что приводит к увеличению частоты разрывов стенки желудочков [11].
Продемонстированы убедительные данные, что при использовании колхицина в качестве дополнения к НПВП улучшаются показатели ремиссии через 1 неделю и снижается частота рецидивов как при остром, так и при рецидивирующем перикардите по сравнению с приемом только НПВП [3].
Основной известный противовоспалительный эффект колхицина — блокада полимеризации тубулина с нарушением сборки микротрубочек, с подавлением провоспалительной функции лейкоцитов, особенно гранулоцитов, в которых концентрируется колхицин.
Наиболее распространенным побочным эффектом, связанным с колхицином, является непереносимость со стороны желудочно-кишечного тракта, особенно диарея, о которой сообщалось у 7-10% пациентов, получающих терапию колхицином [2].
Ранняя диагностика постмиокардиального синдрома имеет решающее значение, поскольку благоприятный прогноз зависит от того, насколько быстро проводится лечение.
К сожалению, нередки рецидивы постмиокардиального синдрома, как в нашем клиническом наблюдении. Обычно рецидивы возникают в течение первого года после начального эпизода, при быстрой отмене противовоспалительной терапии. Есть сообщения о возможности назначения внутривенного иммуноглобулина при рефрактерных к терапии случаях, особенно у детей [17].
Заключение
Описанный клинический случай демонстрирует необходимость включать постмиокардиальный синдром в круг дифференциально-диагностического поиска у пациентов с лихорадкой и болью в грудной клетке, если в анамнезе имеется указание на перенесенный ИМ, травматическое повреждение сердца, в том числе ятрогенная травма, связанная с кардиохирургическими вмешательствами, ЧКВ, имплантацией электрода водителя ритма, радиочастотной аблацией в течение предыдущего месяца. Ранняя диагностика имеет решающее значение, поскольку благоприятный прогноз зависит от того, как быстро и правильно была назначена терапия.
Отношения и Деятельность. Нет.
Список литературы
1. Imazio M, Hoit BD. Post-cardiac injury syndromes. An emerging cause of pericardial diseases. Int J Cardiol. 2013;168(2):648-52. DOI: 10.1016/j.ijcard.2012.09.052.
2. Российское кардиологическое общество (РКО). Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4103. DOI: 10.15829/29/1560-4071-2020-4103.
3. Перикардиты. Клинические рекомендации 2022 года. Российский кардиологический журнал. 2023;28(3):107-67. DOI: 10.15829/1560-4071-2023-5398.
4. Maisch B, Seferović PM, Ristić AD, et al; Task Force on the Diagnosis and Management of Pricardial Diseases of the European Society of Cardiology. Guidelines on the diagnosis and management of pericardial diseases executive summary. The Task force on the diagnosis and management of pericardial diseases of the European society of cardiology. Eur Heart J. 2004;25(7):587-610. DOI: 10.1016/j.ehj.2004.02.002.
5. Ginanjar E, Herdita T. Persistent ST Segment Elevation After Repeated Percutaneous Coronary Intervention: A Dressler Syndrome? Acta Med Indones. 2022;54(4):607-13.
6. Van Kolen K, Jogani S, Belmans A, Schurmans J. Fever after acute myocardial infarction: Dressler’s syndrome demonstrated on cardiac MRI. Int J Cardiol. 2015;183:209-10. DOI: 10.1016/j.ijcard.2014.12.086.
7. Zhang R, Du J, Liu M. Post-cardiac injury syndrome occurred two months after permanent dual-chamber pacemaker implantation. BMC Cardiovasc Disord. 2023;23(1):259. DOI: 10.1186/s12872-023-03252-5.
8. Aten K, Raney K, Alomar A. Dressler Syndrome: Not Just a Relic of the Past. Cureus. 2022;14(10):e30670. DOI: 10.7759/cureus.30670.
9. Jerjes-Sánchez C, Ramírez-Rivera A, Ibarra-Pérez C. The Dressler syndrome after pulmonary embolism. Am J Cardiol. 1996;78(3):343-5. DOI: 10.1016/s0002-9149(96)00290-1.
10. Хамитов Р. Ф., Латфуллин И. А., Ким З. Ф. Случай аутоиммунного постинфарктного синдрома Дресслера. Вестник современной клинической медицины. 2009:2(4):60-6.
11. Leib AD, Foris LA, Nguyen T, Khaddour K. Dressler Syndrome. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023.
12. Witting MD, Hu KM, Westreich AA, et al. Evaluation of Spodick’s Sign and Other Electrocardiographic Findings as Indicators of STEMI and Pericarditis. J Emerg Med. 2020;58(4):562-9. DOI: 10.1016/j.jemermed.2020.01.017.
13. Adler Y, Charron P, Imazio M, et al; ESC Scientific Document Group. 2015 ESC Guidelines for the diagnosis and management of pericardial diseases: The Task Force for the Diagnosis and Management of Pericardial Diseases of the European Society of Cardiology (ESC) Endorsed by: The European Association for CardioThoracic Surgery (EACTS). Eur Heart J. 2015;36(42):2921-64. DOI: 10.1093/eurheartj/ehv318.
14. Хэмптон Дж. Р. Атлас ЭКГ. 150 клинических ситуаций. Пер. с англ. М.: Медицинская литература; 2007.
15. Campos ID, Salgado A, Azevedo P, Vieira C. Dressler’s syndrome: are we underdiagnosing what we think to be rare? BMJ Case Rep. 2019;12(5):e227772. DOI: 10.1136/bcr-2018-227772.
16. Пырикова Н. В., Антропова О. Н., Осипова И. В. Нежелательные реакции со стороны сердечно-сосудистой системы при приеме нестероидных противовоспалительных препаратов и пути их снижения. Рациональная Фармакотерапия в Кардиологии. 2019;15(5):750-8. DOI: 10.20996/1819-6446-2019-15-5-750-758.
17. del Fresno MR, Peralta JE, Granados MÁ, et al. Intravenous immunoglobulin therapy for refractory recurrent pericarditis. Pediatrics. 2014;134(5):e1441-6. DOI: 10.1542/peds.2013-3900.
Об авторах
А. А. КлименкоРоссия
Клименко Алеся Александровна
Москва
Н. А. Демидова
Россия
Демидова Наталья Александровна
Москва
В. В. Веселкин
Россия
Веселкин Владимир Владимирович
Москва
T. А. Кирдяшкина
Россия
Москва
А. А. Чинова
Россия
Чинова Алина Александвровна
Москва
Ю. А. Шандановина
Россия
Шандановина Юлия Александровна
Москва
Рецензия
Для цитирования:
Клименко А.А., Демидова Н.А., Веселкин В.В., Кирдяшкина T.А., Чинова А.А., Шандановина Ю.А. Постмиокардиальный синдром после перенесенного инфаркта миокарда и чрескожного коронарного вмешательства. Рациональная Фармакотерапия в Кардиологии. 2024;20(5):581-587. https://doi.org/10.20996/1819-6446-2024-3112. EDN: STPYHE
For citation:
Klimenko A.A., Demidova N.A., Veselkin V.V., Kirdyashkina T.A., Chinova A.A., Shandanovina Yu.A. Postmyocardial syndrome after myocardial infarction and percutaneous coronary intervention. Rational Pharmacotherapy in Cardiology. 2024;20(5):581-587. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3112. EDN: STPYHE
JATS XML
















































