Перейти к:
Развитие дислипидемии у лиц, перенесших комплексное лечение опухоли центральной нервной системы в детстве
https://doi.org/10.20996/1819-6446-2024-3118
EDN: TJMKNJ
Аннотация
Цель. Оценить влияние комплексной противоопухолевой терапии на показатели липидного и гормонального профиля у лиц, перенесших лечение опухоли центральной нервной системы (ЦНС) в детстве.
Материал и методы. В одномоментное одноцентровое исследование включены 48 пациентов, перенесших оперативное, химиотерапевтическое и лучевое лечение опухоли ЦНС в детстве. Были исследованы липидный (общий холестерин, холестерин липопротеинов низкой плотности (ХС ЛНП), холестерин липопротеинов очень низкой плотности (ХС ЛОНП), холестерин липопротеинов высокой плотности (ХС ЛВП) и триглицериды) и гормональный (трийодтиронин, тироксин, тиреотропный гормон (ТТГ), лютеинизирующий гормон, фолликулостимулирующий гормон, соматотропный гормон, дигидроэпиандростерон, адренокортикотропный гормон, инсулиноподобный фактор роста-1 (ИФР-1)) профили.
Результаты. У молодых пациентов (21,7±4,3 года), перенесших комплексное лечение, включавшее оперативное вмешательство, химио- и лучевую терапию опухоли ЦНС в детстве, независимым предиктором развития дислипидемии и повышенного уровня ХС ЛНП >3,0 ммоль/л была общая краниальная доза лучевой терапии. При проведении корреляционного анализа была выявлена положительная связь уровня ХС ЛНП с общей краниальной дозой (r=0,414; p=0,007). Статистически значимые корреляционные связи выявлены между показателями общего холестерина и ИФР-1 (r=-0,41; p=0,028), ХС ЛНП и ИФР-1 (r=-0,44; p=0,028), ХС ЛОНП и соматотропным гормоном (r=-0,44; p=0,033). Кроме того, уровень ХС ЛНП был связан с изменением ТТГ (r=-0,39; p=0,017), а ХС ЛОНП с ТТГ (r=-0,42; p=0,016).
Заключение. У пациентов, перенесших комплексное лечение опухоли ЦНС в детстве, выявлена высокая частота дислипидемии, связанная с общей краниальной дозой лучевой терапии. Учитывая наличие эндокринологических нарушений, в частности соматотропной недостаточности и гипотиреоза, можно предположить их влияние на развитие дислипидемии. Также нельзя исключать влияние приема глюкокортикоидов во время онкологического лечения на липидный профиль этих пациентов. Полученные результаты подтверждают необходимость разработки практических рекомендаций для динамического наблюдения пациентов, перенесших комплексное лечение опухолей ЦНС в детстве для своевременного выявления заболеваний сердечно-сосудистой системы.
Ключевые слова
Для цитирования:
Новикова А.И., Павлова М.Г., Потемкина Н.А., Фадеев Л.Б., Полтавская М.Г. Развитие дислипидемии у лиц, перенесших комплексное лечение опухоли центральной нервной системы в детстве. Рациональная Фармакотерапия в Кардиологии. 2024;20(6):605-609. https://doi.org/10.20996/1819-6446-2024-3118. EDN: TJMKNJ
For citation:
Novikova A.I., Pavlova M.G., Potemkina N.A., Fadeev L.B., Poltavskaya M.G. Development of dyslipidemia in patients after complex treatment of central nervous system tumors in childhood. Rational Pharmacotherapy in Cardiology. 2024;20(6):605-609. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3118. EDN: TJMKNJ
Введение
По данным Central Brain Tumor Register of the United States, первичные новообразования центральной нервной системы (ЦНС) занимают второе место в структуре злокачественных новообразований (ЗНО) в педиатрии, составляя около 16-20% общего количества и являясь наиболее распространенными солидными опухолями у детей. Ежегодно в России регистрируется около 1000-1200 новых случаев опухолей ЦНС [1][2]. Для сердечно-сосудистого прогноза у больных, перенесших комплексное лечение ЗНО в детстве, значение имеют традиционные факторы риска, в частности дислипидемия [3] — самое частое метаболическое нарушение после перенесенного онкологического заболевания в детстве. В исследовании J. F. Goldberg и соавт. оценивались распространенность дислипидемии и связанный с ней сердечно-сосудистый риск среди детей, перенесших ЗНО [4]. Проанализирован липидный профиль 4115 человек через 5 лет после перенесенного ЗНО, у 3406 из них (средний возраст на момент исследования составлял 35,2±10,4 года) ранее не выявлялась дислипидемия и 624 здоровых лиц, сопоставимых по возрасту, полу и этнической принадлежности. Ранее не диагностированная дислипидемия с аномальным уровнем холестерина липопротеинов низкой плотности (ХС ЛНП) (>160 мг/дл) была выявлена у 4% пациентов основной группы. У лиц, перенесших ЗНО, у которых ранее не была диагностирована дислипидемия, уровень ХС ЛНП был выше, а уровень холестерина высокой плотности (ХС ЛВП) ниже, чем в контрольной группе. Краниальное облучение (КО) (отношение рисков (ОР) 2,2, 95% доверительный интервал (ДИ) 1,6-3,0 для ХС ЛВП) и лучевая терапия (ЛТ) перед трансплантацией гемопоэтических клеток (ОР 6,7, 95% ДИ 3,5-13,0 для ХС ЛВП; ОР 9,9, 95% ДИ 6,0-16,3 для триглицеридов) ассоциировались с повышенным риском развития дислипидемии. Ранее не диагностированная дислипидемия у детей, перенесших ЗНО, была связана с повышенным риском инфаркта миокарда и ишемической кардиомиопатии. Еще в одном обзорном исследовании была показана связь ЛТ с увеличением частоты выявления атеросклероза, а также с местом облучения и дозой ЛТ [5]. КО было тесно связано с дислипидемией и метаболическим синдромом, вторично влияющим на секрецию гормона роста. Также есть данные, что применение химиотерапевтических препаратов и глюкокортикоидов (ГК) приводит к развитию воспаления и ускорению атерогенеза за счет выделения свободных радикалов и активации липогенеза в печени [6]. Имеется значительное количество исследований эффектов ЛТ при лимфоме Ходжкина и раке молочной железы [7][8], однако недостаточно данных о влиянии противоопухолевой терапии на липидный профиль у лиц после перенесенного лечения опухоли ЦНС в детстве.
Ранее были опубликованы результаты собственных исследований, в которых продемонстрирована сравнительная характеристика пациентов, перенесших комплексное лечение по поводу краниальных и краниоспинальных опухолей в детстве, и здоровых лиц [9,10]. Были сопоставлены данные липидного профиля, эндотелиальной функции и толерантности к физической нагрузке. Полученные результаты послужили поводом для проведения дополнительного анализа данных.
Цель — оценить влияние комплексной противоопухолевой терапии на показатели липидного и гормонального профиля у лиц, перенесших лечение опухоли ЦНС в детстве.
Материал и методы
Работа выполнена на кафедре кардиологии, функциональной и ультразвуковой диагностики Института клинической медицины им. Н. В. Склифосовского Первого МГМУ им. И. М. Сеченова Минздрава России (Сеченовский Университет). Исследование зарегистрировано на сайте сlinicalTrials.gov с номером NCT05641636 и выполнено в соответствии с этическими принципами проведения биомедицинских исследований, отраженными в Хельсинкской декларации Всемирной медицинской ассоциации. Протокол был одобрен локальным этическим комитетом Первого МГМУ им. И. М. Сеченова (выписка из протокола №14-19 заседания локального этического Комитета от 13.11.2019).
Проведено одномоментное одноцентровое исследование. Включены пациенты, перенесшие комплексное лечение опухоли ЦНС в детстве. Все пациенты, завершившие лечение по поводу опухолей ЦНС в детском и подростковом возрасте не менее 1 года до начала обследования, были направлены детским нейроонкологом в клинику эндокринологии для исключения и коррекции (при наличии) эндокринологических нарушений. Далее все пациенты направлялись в клинику кардиологии для обследования.
Критериями включения в основную группу были: 1) возраст от 16 до 40 лет; 2) перенесенное краниальное и/или краниоспинальное облучение в возрасте до 18 лет по поводу опухоли ЦНС; 3) завершение противоопухолевой терапии не менее чем за 1 год до включения в исследование; 4) наличие подписанного информированного согласия. Критерии исключения: 1) беременность и лактация; 2) наличие психической патологии, препятствующей участию в исследовании; 3) отсутствие оптимальной коррекции эндокринных нарушений (при наличии); 4) рецидив ЗНО; 5) новое ЗНО; 6) сведения о наличии сердечно-сосудистой патологии до онкологического лечения; 7) острые инфекционно-воспалительные заболевания; 8) тяжелая коморбидная патология; 9) выраженные неврологические нарушения. При соответствии критериям включения пациенты подписывали добровольное информированное согласие.
Исследование лабораторных показателей проводилось в централизованной лабораторно-диагностической службе Первого МГМУ им. И. М. Сеченова Минздрава России (Сеченовский Университет) при использовании анализаторов AU 5800, AU 480, Advia 1800. Для диагностики дислипидемии был исследован липидный профиль. На основании рекомендаций по кардиоваскулярной профилактике 2022 г. оптимальными считали следующие значения: общий холестерин сыворотки (ОХС) <5,0 ммоль/л, ХС ЛНП <3,0 ммоль/л, холестерин липопротеидов очень низкой плотности (ХС ЛОНП) <1,02 ммоль/л, ХС ЛВП >1,2 ммоль/л, триглицериды <1,7 ммоль/л. Дислипидемию диагностировали при наличии одного и более показателей, выходящих за пределы указанных значений [11].
Взятие крови, оценка и коррекция эндокринологических нарушений осуществлялись в клинике эндокринологии Первого МГМУ им. И. М. Сеченова Минздрава России (Сеченовский Университет). После 8-часового голодания натощак проводился забор крови из кубитальной вены для определения таких показателей, как трийодтиронин, тироксин (Т4), тиреотропный гормон (ТТГ), лютеинизирующий гормон, фолликулостимулирующий гормон, соматотропный гормон, дигидроэпиандростерон, адренокортикотропный гормон, инсулиноподобный фактор роста-1 (ИФР-1).
Статистическая обработка проводилась с использованием программы анализа данных GraphPad Prism 9.2.0, а также с использованием языка программирования Python для построения моделей множественной логистической регрессии. Качественные показатели представляли в виде абсолютного числа наблюдений и доли в процентах от общего числа больных по выборке в целом или в соответствующей группе. Значения количественных параметров представлены в виде среднего арифметического ± среднеквадратичного отклонения (Mean±SD). Для проверки на нормальность распределения использовали тест Шапиро—Уилка. Модели множественной регрессии строили с учетом множественного тестирования гипотез. Значение p<0,05 считали статистически значимым.
Результаты
В группу исследования включены 48 пациентов, перенесших комплексное лечение опухоли ЦНС в детстве (средний срок после окончания лечения — 6,9±5,4 лет), средний возраст которых составил 21,7±4,3 года (41,7% — мужчины). Возраст на момент постановки диагноза — 13,6±4,3 лет. Подробная клинико-демографическая характеристика пациентов, перенесших комплексное лечение опухоли ЦНС в детстве, опубликована ранее [9][10]. Пациентам проводилось комплексное лечение онкологического заболевания, которое включало хирургическое вмешательство — тотальное или субтотальное удаление образования было проведено у 40 пациентов, КО получили 8 пациентов, краниоспинальное облучение — 40 пациентов, химиотерапевтическое лечение по различным протоколам, включавшим препараты платины, алкилирующие агенты и алкалоиды, получили 43 пациента. Онкологическое лечение сопровождалось приемом ГК, однако не всегда были указаны дозировка препарата и продолжительность приема. У 39 пациентов выявлены различные эндокринологические нарушения, обусловленные перенесенным противоопухолевым лечением (рис.).
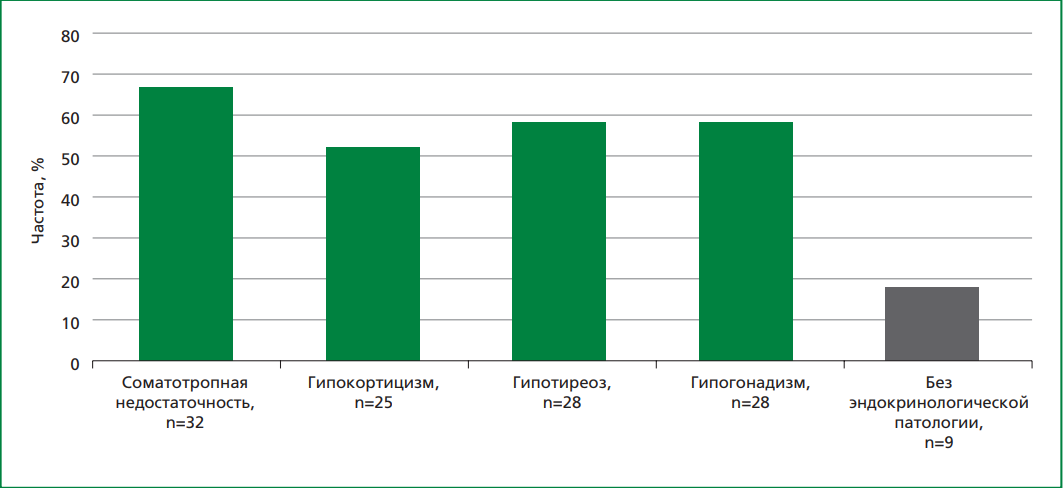
Рисунок. Эндокринологические нарушения у пациентов, перенесших комплексное лечение по поводу краниальных и краниоспинальных опухолей в детстве.
Проведен корреляционный анализ, при котором выявлена положительная связь уровня ХС ЛНП с общей краниальной дозой (r=0,414; p=0,007). Также были выявлены статистически значимые корреляционные связи между показателями ОХС и ИФР-1 (r=-0,41; p=0,028), ХС ЛНП и ИФР-1 (r=-0,44; p=0,028), ХС ЛОНП и соматотропным гормоном (r =-0,44; p=0,033). Кроме того, обратная корреляционная связь была выявлена между ХС ЛНП и ТТГ (r=
-0,39; p=0,017) и ХС ЛОНП и ТТГ (r=-0,42; p=0,016).
При проведении статистического моделирования с использованием множественной линейной регрессии оценивались следующие показатели: пол, возраст на момент постановки диагноза, возраст на момент начала лечения, возраст на момент окончания лечения, количество лет, прошедших после окончания лечения, дозы ЛТ, полученные на различные области, различные химиотерапевтические препараты, показатели гормонального профиля. Установлено, что химиотерапия не влияла на развитие дислипидемии. Общая краниальная доза являлась статистически значимым предиктором, влияющими на концентрацию ХС ЛНП у пациентов, перенесших онкологическое лечение опухоли ЦНС в детстве (p=0,005). Однако не обнаружено статистически значимых предикторов, влияющих на концентрацию ОХС, ХС ЛВП и триглицеридов.
Обсуждение
В настоящей работе обследованы 48 пациентов в возрасте от 16 до 40 лет (в среднем 21,7±4,3 года), перенесших комплексное лечение, включающее оперативное лечение, ЛТ и химиотерапию, опухоли ЦНС в детстве, через год и более после окончания ЛТ (средний срок 6,9±5,4 года) для оценки развития дислипидемии.
В предшествующих исследованиях отмечена высокая распространенность дислипидемии у лиц, перенесших ЗНО в детстве [12]. В исследовании H. Y. Jin и соавт. 127 из 230 (59,6%) пациентов имели хотя бы один из критериев дислипидемии [13]. Общая краниальная доза была предиктором развития дислипидемии за счет повышения уровня ХС ЛНП (OR=2,866, p=0,003).
В обзоре S. S. Min и соавт. показана связь ЛТ с увеличением частоты развития атеросклероза, а также с местом облучения и дозой ЛТ [5]. Как и в представленном исследовании, общая краниальная доза, полученная при ЛТ, была тесно связана с дислипидемией [5][14], что свидетельствует об отрицательном влиянии высоких доз при КО на липидный профиль [15][16]. Кроме того, в исследовании F. Mainieri и соавт. отмечено влияние длительного применения ГК на сердечно-сосудистый риск и дислипидемию у лиц, перенесших онкологическое заболевание в детстве, включая тех, кто получал химиолучевую терапию [17]. В представленном исследовании у всех пациентов онкологическое лечение сопровождалось приемом ГК.
В настоящее время имеются убедительные доказательства того, что дефицит гормона роста у взрослых вызывает целый ряд нарушений: дислипидемию (в частности, повышение ОХС, ХС ЛНП), абдоминальное ожирение, снижение минеральной плотности кости, нарушение сократительной функции миокарда, уменьшение мышечной силы и выносливости, нарушения сна и ухудшение качества жизни [18]. Т. Ю. Целовальниковой и соавт. было проведено исследование, в котором были изучены метаболические нарушения у пациентов после комплексного лечения медуллобластомы и острого лимфобластного лейкоза [19][20]. Как и в настоящем исследовании, выявлена обратная корреляционная связь ИФР-1 с ОХС и ХС ЛНП (r=-0,398, p=0,018 в обоих случаях). У больных гипотиреозом ожидаемо отмечались более высокие уровни ХС ЛНП и ХС ЛОНП. Таким образом, предполагается, что причинами дислипидемии у пациентов, перенесших комплексное лечение опухоли ЦНС в детстве, может быть, в том числе применение ГК во время онкологического лечения и эндокринологические нарушения, в частности, соматотропная недостаточность и гипотиреоз.
Ограничение исследования
К ограничению исследования следует отнести небольшой размер выборки пациентов, перенесших комплексное лечение по поводу опухоли ЦНС в детстве. Одномоментное исследование не позволило изучить изменения лабораторных показателей с течением времени. Кроме того, сроки обследования после перенесенного лечения достаточно широко варьировали, что могло оказать влияние на наличие и выраженность изучаемых параметров. Также отсутствовала информация о сердечно-сосудистом статусе пациентов до лечения. На момент включения в исследование у пациентов не было медицинской документации о перенесенном сердечно-сосудистом заболевании. Тем не менее это одно из немногих исследований, которое дает представление о состоянии липидного профиля у данного контингента пациентов, позволяет проанализировать возможные механизмы выявленных изменений и может быть основой для дальнейшего наблюдения.
Заключение
У пациентов, перенесших комплексное лечение по поводу опухоли ЦНС в детстве, выявлена высокая частота дислипидемии, связанная с общей краниальной дозой ЛТ. Учитывая наличие эндокринологических нарушений у пациентов, можно предположить их влияние на развитие дислипидемии, а также нельзя исключать неблагоприятное влияние приема ГК на липидный профиль. Полученные данные подтверждают необходимость разработки практических рекомендаций для динамического наблюдения этой специфической группы пациентов и своевременного выявления бессимптомных сердечно-сосудистых заболеваний.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование. Исследование проведено в рамках диссертационной работы "Кардиальная патология и факторы риска у пациентов, перенесших комплексное лечение по поводу краниальных и краниоспинальных опухолей в детстве". Финансирование осуществлялось Сеченовским Университетом за счет средств на утвержденные научно-исследовательские работы.
Funding. The study was performed as a part of the thesis research "Cardiac pathology and risk factors in patients after complex treatment for cranial and craniospinal tumors in childhood", with financial support from the Sechenov University from the approved research budget.
Список литературы
1. Pollack IF, Agnihotri S, Broniscer A. Childhood brain tumors: current management, biological insights, and future directions. J Neurosurg Pediatr. 2019;23(3):261-73. DOI:10.3171/2018.10.PEDS18377.
2. Palmer JD, Tsang DS, Tinkle CL, et al. Late effects of radiation therapy in pediatric patients and survivorship. Pediatr Blood Cancer. 2021;68 Suppl 2:e28349. DOI:10.1002/pbc.28349.
3. Xu W, Janss A, Packer RJ, et al. Endocrine outcome in children with medulloblastoma treated with 18 Gy of craniospinal radiation therapy. Neuro Oncol. 2004;6(2):113-8. DOI:10.1215/s1152851703000462.
4. Goldberg JF, Hyun G, Ness KK, et al. Dyslipidemia and cardiovascular disease among childhood cancer survivors: a St. Jude Lifetime Cohort report. J Natl Cancer Inst. 2024;116(3):408-20. DOI:10.1093/jnci/djad222.
5. Min SS, Wierzbicki AS. Radiotherapy, chemotherapy and atherosclerosis. Curr Opin Cardiol. 2017;32(4):441-7. DOI:10.1097/HCO.0000000000000404.
6. Scott JX, Latha MS, Aruna R. Approach to metabolic syndrome in childhood cancer survivors. Indian J Cancer. 2015;52(2):169-72. DOI:10.4103/0019-509X.175840.
7. McEniery PT, Dorosti K, Schiavone WA, et al. Clinical and angiographic features of coronary artery disease after chest irradiation. Am J Cardiol. 1987;60(13):1020-4. DOI:10.1016/0002-9149(87)90345-6.
8. Darby SC, McGale P, Taylor CW, et al. Long-term mortality from heart disease and lung cancer after radiotherapy for early breast cancer: prospective cohort study of about 300,000 women in US SEER cancer registries. Lancet Oncol. 2005;6(8):557-65. DOI:10.1016/S1470-2045(05)70251-5.
9. Новикова А. И., Полтавская М. Г., Павлова М. Г. и др. Исследование факторов риска сердечно-сосудистых заболеваний у пациентов, перенесших комплексное лечение по поводу краниальных и краниоспинальных опухолей в детстве. Российский кардиологический журнал. 2022;27(11):5175. DOI:10.15829/1560-4071-2022-5175.
10. Novikova AI, Poltavskaya MG, Pavlova MG, et al. Cardiac Dysfunction and Exercise Tolerance in Patients after Complex Treatment for Cranial and Craniospinal Tumors in Childhood. J Clin Med. 2024;13(11):3045. DOI:10.3390/jcm13113045.
11. Бойцов С. А., Погосова Н. В., Аншелес А. А. и др. Кардиоваскулярная профилактика 2022. Российские национальные рекомендации. Российский кардиологический журнал. 2023;28(5):5452. DOI:10.15829/1560-4071-2023-5452.
12. Bhatnagar R, Dixit NM, Yang EH, Sallam T. Cancer therapy’s impact on lipid metabolism: Mechanisms and future avenues. Front Cardiovasc Med. 2022;9:925816. DOI:10.3389/fcvm.2022.925816.
13. Jin HY, Lee JA, Park M, Park HJ. Prevalence and Risk Factors of Metabolic Syndrome Components in Childhood Cancer Survivors. J Adolesc Young Adult Oncol. 2023;12(2):224-31. DOI:10.1089/jayao.2021.0227.
14. Cacciotti C, Chordas C, Valentino K, et al. Cardiac dysfunction in medulloblastoma survivors treated with photon irradiation. Neurooncol Pract. 2022;9(4):338-43. DOI:10.1093/nop/npac030.
15. Oeffinger KC, Buchanan GR, Eshelman DA, et al. Cardiovascular risk factors in young adult survivors of childhood acute lymphoblastic leukemia. J Pediatr Hematol Oncol. 2001;23(7):424-30. DOI:10.1097/00043426-200110000-00007.
16. Gurney JG, Ness KK, Sibley SD, et al. Metabolic syndrome and growth hormone deficiency in adult survivors of childhood acute lymphoblastic leukemia. Cancer. 2006;107(6):1303-12. DOI:10.1002/cncr.22120.
17. Mainieri F, Giannini C, Chiarelli F. Cardiovascular Risk in Childhood Cancer Survivors. Biomedicines. 2022;10(12):3098. DOI:10.3390/biomedicines10123098.
18. Doga M, Bonadonna S, Gola M, et al. Growth hormone deficiency in the adult. Pituitary. 2006;9(4):305-11. DOI:10.1007/s11102-006-0410-y.
19. Целовальникова Т. Ю., Павлова М. Г., Зилов А. В., и др. Метаболические нарушения у пациентов после комплексного лечения медуллобластомы и острого лимфобластного лейкоза. Ожирение и метаболизм. 2015;12(3):3-9. DOI:10.14341/omet201533.
20. Nottage KA, Ness KK, Li C, et al. Metabolic syndrome and cardiovascular risk among long-term survivors of acute lymphoblastic leukaemia — From the St. Jude Lifetime Cohort. Br J Haematol. 2014;165(3):364-74. DOI:10.1111/bjh.12754.
Об авторах
А. И. НовиковаРоссия
Новикова Алёна Игоревна
Москва
М. Г. Павлова
Россия
Павлова Мария Геннадиевна
Москва
Н. А. Потемкина
Россия
Потемкина Надежда Александровна
Москва
Л. Б. Фадеев
Россия
Фадеев Леонид Борисович
Москва
М. Г. Полтавская
Россия
Полтавская Мария Георгиевна
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Новикова А.И., Павлова М.Г., Потемкина Н.А., Фадеев Л.Б., Полтавская М.Г. Развитие дислипидемии у лиц, перенесших комплексное лечение опухоли центральной нервной системы в детстве. Рациональная Фармакотерапия в Кардиологии. 2024;20(6):605-609. https://doi.org/10.20996/1819-6446-2024-3118. EDN: TJMKNJ
For citation:
Novikova A.I., Pavlova M.G., Potemkina N.A., Fadeev L.B., Poltavskaya M.G. Development of dyslipidemia in patients after complex treatment of central nervous system tumors in childhood. Rational Pharmacotherapy in Cardiology. 2024;20(6):605-609. (In Russ.) https://doi.org/10.20996/1819-6446-2024-3118. EDN: TJMKNJ

















































