Перейти к:
Цитокиновый профиль оперированных пациентов с инфекционным эндокардитом
https://doi.org/10.20996/1819-6446-2025-3125
Аннотация
Цель. Изучить цитокиновый профиль макрофагов в тканях клапанов у оперированных пациентов с инфекционным эндокардитом (ИЭ), его связи с маркерами воспаления для оптимизации оценки активности ИЭ.
Материал и методы. В проспективное исследование включены 25 взрослых пациентов с активным ИЭ (критерии Duke 2015 г.) и 24 пациента с пороками сердца без ИЭ, госпитализированных для кардиохирургического лечения (2021-2022 гг.). Выполнено лабораторно- инструментальное обследование, включая верификацию возбудителя, в том числе методом полимеразной цепной реакции (ПЦР) Real Time в крови/тканях резецированных клапанов, эхокардиографическое исследование и оценку нейтрофильно- лимфоцитарного индекса. В тканях клапанов проводилось исследование фенотипических признаков макрофагов методом иммуногистохимии и оценка экспрессии генов про- и противовоспалительных цитокинов методом ПЦР Real Time.
Результаты. У пациентов с ИЭ имелась высокая доля вторичных форм ИЭ за счёт дегенеративных пороков сердца (n = 10, 40,0 %) и левосторонней локализации ИЭ (n = 16, 64,0 %). Методом иммуногистохимии выявлено преобладание неповрежденных макрофагов провоспалительного фенотипа CD 86+ у пациентов без ИЭ по сравнению с пациентами с ИЭ (0,054 (0,029-0,073) vs 0,008 (0,0071-0,0096), p < 0,05). В отношении противовоспалительного фенотипа макрофагов CD 206+ статистически значимой разницы не получено. В группе оперированных пациентов с ИЭ методом ПЦР Real Time выявлена значимая экспрессия генов ИЛ-1β (Ме (интерквартильный размах (IQR)) 0,0037 (0,0005-0,0155) vs 0,0002 (0,0001-0,0026), p < 0,05) и ИЛ-6 (Ме (IQR) 0,0034 (0,0007-0,0167) vs 0,0005 (0,0004-0,0038), p < 0,05) по сравнению с пациентами без ИЭ. В отношении противовоспалительных цитокинов статистически значимых различий не получено. Уровень экспрессии генов цитокинов тканевыми макрофагами в зависимости от наличия эмболических событий, этиологической принадлежности к S. aureus, а также госпитальной летальности и комбинированной конечной точки (смерть от всех причин или рецидив ИЭ через 6 мес. после операции) не различался между пациентами с ИЭ с эмболическими событиями или без них. Уровень ИЛ-1β имел наиболее благоприятные характеристики для оценки активности ИЭ (площадь под ROC-кривой 0,816 (p = 0,02)).
Заключение. Повышенная деструкция макрофагов с избыточным выходом провоспалительных цитокинов в ткани клапанов определяет неконтролируемое течение ИЭ и потребность в кардиохирургическом лечении. ИЛ-1β обладает высокой диагностической ценностью определения активности воспаления у оперированных пациентов с ИЭ.
Ключевые слова
Для цитирования:
Котова Е.О., Писарюк А.С., Лохонина А.В., Моисеева А.Ю., Домонова Э.А., Гусарова Т.А., Бабухина Ю.И., Кахкцян П.В., Фатхудинов Т.Х., Кобалава Ж.Д. Цитокиновый профиль оперированных пациентов с инфекционным эндокардитом. Рациональная Фармакотерапия в Кардиологии. 2025;21(1):4-13. https://doi.org/10.20996/1819-6446-2025-3125
For citation:
Kotova E.O., Pisaryuk A.S., Lokhonina A.V., Moiseeva A.Y., Domonova E.A., Gusarova T.A., Babukhina J.I., Kakhktsyan P.V., Fatkhudinov T.K., Kobalava Z.D. Cytokine profile of surgical patients with infective endocarditis. Rational Pharmacotherapy in Cardiology. 2025;21(1):4-13. (In Russ.) https://doi.org/10.20996/1819-6446-2025-3125
Введение
Инфекционный эндокардит (ИЭ) — заболевание преимущественно бактериальной природы, поражающее как нативные, так и протезированные клапаны/имплантированные внутрисердечные устройства [1][2]. В последнее десятилетие отмечены изменения профиля болезни, связанные с увеличением доли сложных форм, отличающихся трудностью визуализации клапанных изменений (ИЭ протеза клапана/внутрисердечных устройств/на фоне тяжелых дегенеративных пороков) и высокой долей ИЭ с неустановленной этиологией (в первую очередь из-за частого применения антибиотиков широкого спектра действия до постановки верного диагноза) [1-3]. Данные аспекты значительно ограничивают диагностику ИЭ, снижая чувствительность критериев Duke. В настоящее время основными диагностическими процедурами являются эхокардиография и микробиологические исследования, при этом среди критериев диагностики отсутствуют специфичные биомаркеры, способные идентифицировать ИЭ у пациентов с бактериемией. С-реактивный белок — чрезвычайно ценный, широко применяемый биомаркер, однако он обладает недостаточной чувствительностью и специфичностью, чтобы отличить пациентов с ИЭ от пациентов с бактериемией без ИЭ [4].
Ряд проведённых исследований позволяет предположить ценность воспалительных маркеров не только для мониторинга ответа на проводимую терапию, но и для ранней верификации ИЭ [5][6]. Необходимость поиска быстрых маркеров диагностики обусловлена сохраняющейся высокой летальностью при ИЭ и потребностью в своевременном начале индивидуализированной терапии [7][8].
Активированные клетки иммунной системы, в первую очередь макрофаги, выделяют цитокины, в разной степени участвующие в воспалительных процессах [9][10]. Баланс про- и противовоспалительных цитокинов во многом определяет тяжесть и исход заболевания [7][8]. В условиях постоянной бактериемии происходит непрерывная стимуляция иммунного ответа, что приводит к разному уровню концентрации цитокинов [5]. Показано, что интерлейкин 6 (ИЛ-6), интерлейкин 1β (ИЛ-1β) и фактор некроза опухоли-α (ФНО-α) играют важную роль в процессах воспаления. Известна связь провоспалительных макрофагов с неблагоприятным прогнозом у пациентов с сепсисом [11][12]. При ИЭ цитокиновый профиль исследован недостаточно, особенно при определении активности ИЭ у оперированных пациентов [13-15].
Цель исследования — изучить цитокиновый профиль макрофагов в тканях резецированных клапанов у оперированных пациентов с ИЭ, его связи с маркерами воспаления и исследовать возможность повышения эффективности оценки активности ИЭ.
Материал и методы
В проспективное исследование последовательно включены 25 взрослых пациентов с верифицированным активным ИЭ по критериям Duke 2015 г. и 24 взрослых пациента с порокам сердца без ИЭ, госпитализированных для кардиохирургического лечения с 2021 по 2022 г. Исключались пациенты с хроническими инфекционными заболевания в активной стадии процесса, сопутствующей острой патологией, аллергическими заболеваниями в стадии обострения, беременные, больные с неактивным ИЭ, небактериальным тромбоэндокардитом, активными онкологическими заболеваниями, получающие иммуносупрессивную терапию и не подписавшие письменного информированного согласия. Исследование выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice), принципами Хельсинкской декларации, одобрено локальным этическим комитетом Медицинского института Российского университета дружбы народов им. П. Лумумбы (протокол № 27 от 18.03.2021). Все пациенты подписали информированное согласие на сбор обезличенных медицинских данных.
Всем пациентам проводилось стандартное лабораторно-инструментальное обследование, предполагающее диагноз ИЭ, в том числе микробиологическое исследование крови/тканей резецированных клапанов, при необходимости дополненное молекулярно-биологическими исследованиями (полимеразная цепная реакция (ПЦР)-исследование крови/тканей резецированных клапанов), и эхокардиографическое исследование. Отдельно оценивался нейтрофильно-лимфоцитарный индекс (НЛИ), количество нейтрофилов/количество лимфоцитов. Дополнительно у каждого пациента основной группы и группы контроля в стерильных условиях операционной проводилось взятие тканей резецированных клапанов. Иссеченные ткани клапанов делили на 2 части: часть 1 фиксировали жидким азотом (-80° C) для приготовления криосрезов с исследованием фенотипических признаков макрофагов, часть 2 помещали в консервирующий буфер для проведения ПЦР Real Time с целью исследования экспрессии цитокинов макрофагами.
Исследование фенотипических признаков макрофагов
Для получения криосрезов замороженную ткань монтировали с помощью Tissue-Tek (Sakura, Нидерланды) на держателе для образцов криотома Leica СМ1900 (Leica, Германия), полученные срезы толщиной 6-7 мкм монтировали на предметные стекла с адгезивным покрытием Superfrost (Thermo Fisher Scientific, США). Далее выполняли гистологическое окрашивание гематоксилином, затем иммуногистохимическое окрашивание с раствором первичных антител anti-CD86 (PAA824Hu01) (1/200), anti-CD68 (DF7518) (1/200), anti-CD206 (ab64693) (1/200) и раствором антител Goat Anti-rabbit IgG PE (sc-3739) (1/200) с последующим докрашиванием ядра ядерным красителем — раствором 4’,6-диамидино-2-фенилиндола (DAPI) (0,004 мг/мл). Препараты фотографировали на флуоресцентном микроскопе Leica DM 4000В (Leica Microsystems, Германия) c помощью программы LAS AF v.3.1.0 (Leica Microsystems, Германия).
Исследование экспрессии цитокинов макрофагами
Методом ПЦР Real Time в тканях иссеченных клапанов сердца исследовали экспрессию генов провоспалительных (ИЛ-1β, ИЛ-6, ИЛ-23, ФНО-α) и противовоспалительных (Аргиназа 1 (Арг-1), ИЛ-10, ИЛ-4, ИЛ-13) цитокинов макрофагов. Из полученных образцов выделяли тотальную РНК с помощью набора RNeasy Plus Mini Kit (QIAGEN, Германия), далее осуществляли синтез копий ДНК (MMLV RT kit, Евроген, Россия), с которыми ставили реакцию с помощью готовых наборов реактивов (qPCRmix-HS SYBR, Евроген, Россия). Для анализа экспрессии генов использовали метод определения порогового цикла (Ct) и вычисления относительной экспрессии гена по методу M. V. Pfaffl [16] с учётом рекомендаций J. Vandesompele и соавт. [17]. В качестве эндогенного контроля выбран ген Gapdh. Дифференциальная экспрессия ключевых генов, регулирующих воспаление — провоспалительных и противовоспалительных цитокинов и маркеров макрофагов (CD 68+) позволили определить роль этой клеточной популяции для заболевания. Исследование образца от каждого пациента проведено однократно.
Для изучения значимости про- и противоспалительных маркеров оценивались следующие конечные точки: комбинированный показатель (смерть от всех причин или рецидив ИЭ в течение 6 мес. после операции), госпитальная летальность, эмболические события, этиологическая принадлежность к Staphylococcus aureus.
Статистический анализ
Статистическую обработку полученных данных проводили с применением пакетов прикладного программного обеспечения IBM SPSS Statistics, Version 27 и Excel 2016 (Microsoft, США). Для описания количественных переменных использовали среднее арифметическое значение (М) и стандартное отклонение среднего значения (SD) (для параметрических данных) или медиану (Me) и интерквартильный размах (IQR) (для непараметрических данных). С целью оценки нормальности распределения применялись критерий Шапиро–Уилка, Skewness тест. Статистическую значимость различий между двумя группами по количественным переменным оценивали при помощи U-критерия Манна–Уитни (для непараметрических данных) и t-теста Стьюдента (для параметрических данных). Качественные переменные описывали абсолютными (n) и относительными (%) частотами. Для определения статистической значимости различий качественных показателей использовали критерии хи-квадрат (χ2) и точный критерий Фишера. Корреляционный анализ проведен с расчётом коэффициентов корреляции Пирсона и Спирмена, последний рассчитывался при переменных, имеющих ненормальное распределение. Для оценки диагностической эффективности и влияния показателей использовали ROC-анализ (receiver operating characteristic) с определением площади под ROC-кривой (area under curve, AUC). Во всех видах анализа статистически значимым считалось значение p<0,05.
Результаты
Группы включённых в исследование пациентов не различались по основным клинико-демографическим и лабораторно-инструментальным параметрам, за исключением показателей воспаления, повышенных в группе пациентов с ИЭ (табл. 1).
Таблица 1. Характеристика оперированных пациентов с ИЭ и с клапанными пороками сердца без ИЭ
Показатель | ИЭ+ | ИЭ- |
Мужчины, n (%) | 18 (72,0) | 16 (66,7) |
Возраст, Ме (IQR) | 55,5 | 61,5 |
Сердечно-сосудистые заболевания, n (%) | 18 (72,0) | 24 (100,0) |
Хроническая болезнь почек, n (%) | 6 (24,0) | 7 (29,2) |
Инсульт в анамнезе, n (%) | 2 (8,0) | 2 (8,3) |
Сахарный диабет, n (%) | 4 (16,0) | 4 (16,7) |
ХОБЛ/бронхиальная астма, n (%) | 2 (8,0) | 3 (12,5) |
Индекс Чарлсон, Ме (IQR) | 3,0 | 4,0 |
Фракция выброса ЛЖ, Ме (IQR) | 60,0 | 58,0 |
Гемоглобин, г/л, Ме (IQR) | 104,8 | 116,0 |
Лейкоциты, 10⁹/л, Ме (IQR) | 10,2 | 7,8 |
НЛИ, Ме (IQR) | 5,9 | 3,0 |
Тромбоциты, 10⁹/л, Ме (IQR) | 205,0 | 208,8 |
Креатинин, мкмоль/л, Ме (IQR) | 97,5 | 83,6 |
"+" — наличие ИЭ, "–" — отсутствие ИЭ, Ме (IQR) — медиана и интерквартильный размах (25%; 75%), n — количество больных, * — p <0,05 ИЭ — инфекционный эндокардит, ЛЖ — левый желудочек, НЛИ — нейтрофильно/лимфоцитарный индекс, ХОБЛ — хроническая обструктивная болезнь легких | ||
Так как все пациенты с ИЭ были переведены из других стационаров для продолжения кардиохирургического лечения, то лихорадка и специфичные проявления заболевания встречались редко. В клинической картине преобладали аускультативные признаки и гепатоспленомегалия. В основной группе пациентов отмечалась высокая распространенность вторичных форм ИЭ, в первую очередь за счёт дегенеративных пороков сердца. Изолированный левосторонний ИЭ имелся у 16 (64,0%) пациентов, изолированный правосторонний ИЭ — у 7 (28,0%), двустороння локализация — только у 2 (8,0%) пациентов (табл. 2). В группе контроля представлены больные только с дегенеративными пороками сердца и левосторонней локализацией патологии (аортальный клапан — 20 (83,3%), митральный клапан — 2 (8,3%), аортальный клапан в сочетании с митральным клапаном — 2 (8,3%).
Таблица 2. Характеристика оперированных пациентов с ИЭ (n=25)
Показатель | Значение |
Шумы в сердце, n (%) | 25 (100) |
Одышка, n (%) | 22 (88,0) |
Гепатомегалия, n (%) | 19 (76,0) |
Спленомегалия, n (%) | 14 (56,0) |
Лихорадка, (n, %) | 3 (12,0) |
Пурпура, n (%) | 3 (12,0) |
Синкопе, n (%) | 3 (12,0) |
Пятна Лукина, n (%) | 1 (4,0) |
Первичный ИЭ, n (%) | 10 (40,0) |
Вторичный ИЭ, n (%): • миксоматозная дегенерация, n (%) • кальциноз клапана, n (%) • двустворчатый аортальный клапан, n (%) • протезированный клапан, n (%) | 15 (60,0) 5 (20,0) 5 (20,0) 3 (12,0) 2 (8,0) |
Трикуспидальный клапан, n (%) Аортальный клапан, n (%) Митральный клапан, n (%) Аортальный и митральный клапаны, n (%) Митральный и трикуспидальный клапаны, n (%) Аортальный + митральный + трикуспидальный клапаны, n (%) | 7 (28,0) 6 (24,0) 6 (24,0) 4 (16,0) 1 (4,0) 1 (4,0) |
Размер вегетаций, мм, Me (IQR) | 15,5 |
Ме (IQR) — медиана и интерквартильный размах (25; 75), ИЭ — инфекционный эндокардит | |
Медиана сроков диагностики ИЭ от появления первых симптомов составила 41 (IQR 25-64) день, а до операции — 62 (39-87) дня. Длительность госпитализации пациентов с ИЭ в кардиохирургическом стационаре составила (M±SD) 34±20,8 дня.
Этиологическая структура ИЭ среди 25 оперированных пациентов представлена Staphylococcus aureus — у 8 (32,0%), коагулазонегативными стафилококками — у 2 (8,0%), Enterococcus spp. — у 5 (20,0%), Bartonella sp. — у 3 (12,0%), Streptococcus viridans — 1 (4,0%), Streptococcus gallolyticus (bovis) — у 1 (4,0%), не выявлен патоген у 5 (20,0%).
По результатам иммуногистохимического исследования, позволившего определить наличие неповрежденных макрофагов в эндокарде оперированных пациентов с ИЭ и без ИЭ, выявлены CD 68+ (общий маркер макрофагов), СD 86+ (маркер провоспалительного фенотипа макрофагов) и CD 206+ клеток (маркер противовоспалительного фенотипа макрофагов) (рис. 1). При этом по результатам количественного анализа отмечено преобладание провоспалительного фенотипа макрофагов CD 86+ в группе оперированных пациентов без ИЭ по сравнению с пациентами с ИЭ (0,054 (0,029-0,073) vs 0,008 (0,0071-0,0096), p=0,0034), в то время как в отношении противовоспалительного фенотипа макрофагов CD 206+ статистически значимых различий не получено (0,028 (0,010-0,030) vs 0,013 (0,0095-0,016), p=0,67).
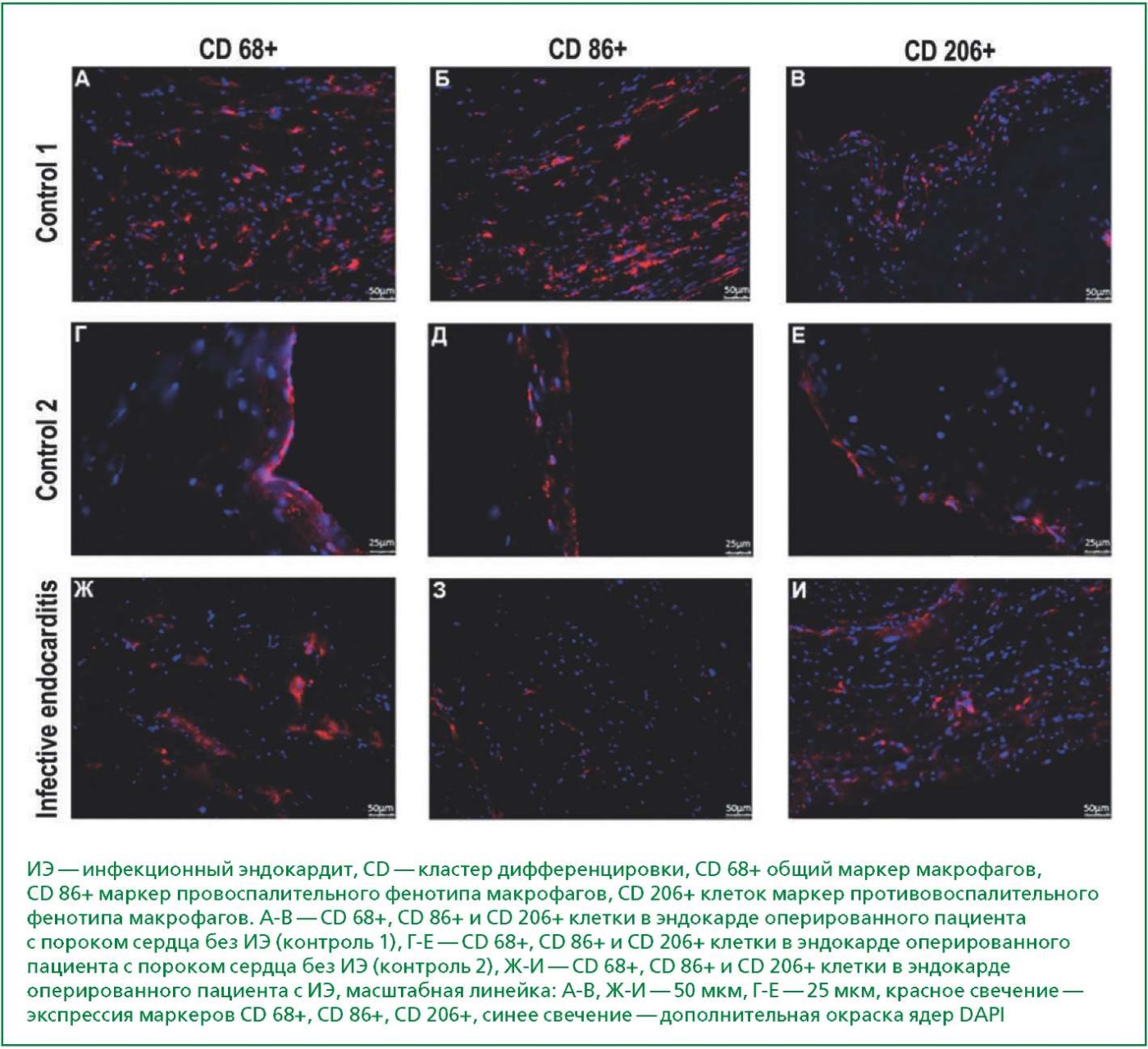
Рисунок 1. Иммуногистохимическое окрашивание эндокарда, выявление CD 68+, CD 86+ и CD 206+ клеток у оперированных пациентов с и без ИЭ.
Исследование уровней экспрессии генов цитокинов макрофагами в тканях клапанов показало, что провоспалительные цитокины ИЛ-1β, ФНО-α и ИЛ-6 были повышены в группе оперированных пациентов с ИЭ, при этом значимые различия получены только в отношении ИЛ-1β и ИЛ-6 (табл. 3). В отношении остальных провоспалительных и противовоспалительных цитокинов значимых различий между оперированными пациентами с и без ИЭ не получено.
Таблица 3. Сравнение экспрессии генов цитокинов макрофагами в тканях клапанов у оперированных пациентов с и без ИЭ
Маркеры | ИЭ+ | ИЭ- |
Провоспалительные | ||
ИЛ-1β | 0,0037* (0,0005-0,0155) | 0,0002* (0,0001-0,0026) |
ИЛ-6 | 0,0034* (0,0007-0,0167) | 0,0005* (0,0004-0,0038) |
ИЛ-23 | 0,3589 (0,1206-0,6753) | 0,4406 (0,1333-0,8147) |
ФНО-α | 0,0111 (0,0080-0,0163) | 0,0046 (0,0025-0,0191) |
Противовоспалительные | ||
ИЛ-4 | 0,0014 (0,0006-0,0023) | 0,0027 (0,0012-0,0151) |
ИЛ-10 | 0,0015 (0,0009-0,0026) | 0,0018 (0,0006-0,0083) |
ИЛ-13 | 0,0008 (0,0004-0,0026) | 0,0027 (0,0009-0,0071) |
Арг1 | 0,0145 (0,0045-0,0313) | 0,0263 (0,0089-0,0368) |
"+" — наличие ИЭ, "–" — отсутствие ИЭ, результаты представлены в виде Ме (IQR), n — количество больных, * — p <0,05 ИЭ — инфекционный эндокардит, ИЛ — интерлейкин, ФНО — фактор некроза опухоли, Арг — аргиназа 1 | ||
Исследование уровня экспрессии генов цитокинов макрофагами в зависимости от наличия эмболических событий, этиологической принадлежности к S. aureus, а также госпитальной летальности и комбинированной конечной точки (смерть от всех причин или рецидив ИЭ через 6 мес. после операции) не показало различий между оперированными пациентами с ИЭ с событиями или без (табл. 4-7).
Таблица 4. Сравнение экспрессии генов цитокинов макрофагами в тканях клапанов у оперированных пациентов с ИЭ в зависимости от наличия эмболических событий
Маркеры | ИЭ с эмболическими событиями | ИЭ без эмболических событий |
Провоспалительные | ||
ИЛ-1β | 0,0040 (0,0005-0,0567) | 0,0033 (0,0006-0,0146) |
ИЛ-6 | 0,0055 (0,0012-0,0552) | 0,0027 (0,0006-0,0141) |
ИЛ-23 | 0,3078 (0,0462-0,5279) | 0,4717 (0,1478-0,6868) |
ФНО-α | 0,0110 (0,0077-0,0450) | 0,0110 (0,0090-0,0172) |
Противовоспалительные | ||
ИЛ-4 | 0,0016 (0,0007-0,0033) | 0,0011 (0,0005-0,0021) |
ИЛ-10 | 0,0015 (0,0011-0,0037) | 0,0015 (0,0007-0,0019) |
ИЛ-13 | 0,0006 (0,0003-0,0024) | 0,0019 (0,0004-0,0031) |
Арг1 | 0,0138 (0,0020-0,0331) | 0,0145 (0,0065-0,0313) |
Результаты представлены в виде Ме (IQR), n — количество больных ИЭ — инфекционный эндокардит, ИЛ — интерлейкин, ФНО — фактор некроза опухоли, Арг — аргиназа 1 | ||
Таблица 5. Сравнение экспрессии генов цитокинов макрофагами в тканях клапанов у оперированных пациентов с ИЭ в зависимости от этиологической принадлежности к S. aureus
Маркеры | ИЭ, S. aureus | ИЭ, не S. aureus |
Провоспалительные | ||
ИЛ-1β | 0,0090 (0,0009-0,0207) | 0,0027 (0,0001-0,0085) |
ИЛ-6 | 0,0056 (0,0006-0,0184) | 0,0025 (0,0007-0,0125) |
ИЛ-23 | 0,3308 (0,0962-0,6695) | 0,3714 (0,1528-0,6868) |
ФНО-α | 0,0122 (0,0095-0,0168) | 0,0090 (0,0026-0,0172) |
Противовоспалительные | ||
ИЛ-4 | 0,0012 (0,0004-0,0032) | 0,0016 (0,0009-0,0019) |
ИЛ-10 | 0,0016 (0,0008-0,0026) | 0,0014 (0,0008-0,0027) |
ИЛ-13 | 0,0006 (0,0003-0,0063) | 0,0019 (0,0005-0,0022) |
Арг1 | 0,0148 (0,0047-0,0611) | 0,0145 (0,0033-0,0268) |
Результаты представлены в виде Ме (IQR), n — количество больных ИЭ — инфекционный эндокардит, ИЛ — интерлейкин, ФНО — фактор некроза опухоли, Арг — аргиназа 1 | ||
Таблица 6. Сравнение экспрессии генов цитокинов макрофагами в тканях клапанов у оперированных пациентов с ИЭ в зависимости от госпитальной летальности
Маркеры | ИЭ, умершие | ИЭ, выжившие |
Провоспалительные | ||
ИЛ-1β | 0,0066 (0,0001-0,0306) | 0,0037 (0,0007-0,0155) |
ИЛ-6 | 0,0007 (0,0006-0,0284) | 0,0054 (0,0012-0,0197) |
ИЛ-23 | 0,5253 (0,1361-0,6599) | 0,3240 (0,1206-0,6753) |
ФНО-α | 0,0099 (0,0043-0,0126) | 0,0110 (0,0085-0,0195) |
Противовоспалительные | ||
ИЛ-4 | 0,0017 (0,0007-0,0039) | 0,0012 (0,0006-0,0023) |
ИЛ-10 | 0,0016 (0,0008-0,0026) | 0,0014 (0,0007-0,0026) |
ИЛ-13 | 0,0007 (0,0002-0,0017) | 0,0009 (0,0004-0,0034) |
Арг1 | 0,0219 (0,0076-0,0273) | 0,0110 (0,0036-0,0346) |
Результаты представлены в виде Ме (IQR), n — количество больных ИЭ — инфекционный эндокардит, ИЛ — интерлейкин, ФНО — фактор некроза опухоли, Арг — аргиназа 1 | ||
Таблица 7. Сравнение экспрессии генов цитокинов макрофагами в тканях клапанов у оперированных пациентов с ИЭ в зависимости от комбинированной конечной точки (смерть от всех причин или рецидив ИЭ через 6 мес. после операции)
Маркеры | ИЭ+ смерть/рецидив через 6 мес. | ИЭ- смерть/рецидив через 6 мес. |
Провоспалительные | ||
ИЛ-1β | 0,0066 (0,0001-0,0306) | 0,0037 (0,0007-0,0155) |
ИЛ-6 | 0,0007 (0,0006-0,0284) | 0,0054 (0,0012-0,0197) |
ИЛ-23 | 0,5790 (0,2479-3,7290) | 0,3185 (0,1165-0,6157) |
ФНО-α | 0,0099 (0,0043-0,0126) | 0,0110 (0,0085-0,0195) |
Противовоспалительные | ||
ИЛ-4 | 0,0017 (0,0007-0,0039) | 0,0012 (0,0006-0,0023) |
ИЛ-10 | 0,0016 (0,0008-0,0026) | 0,0014 (0,0007-0,0026) |
ИЛ-13 | 0,0008 (0,0003-0,0135) | 0,0009 (0,0004-0,0027) |
Арг1 | 0,0234 (0,0119-0,0766) | 0,0102 (0,0026-0,0322) |
"+" — наличие ИЭ, "–" — отсутствие ИЭ, результаты представлены в виде Ме (IQR), n — количество больных ИЭ — инфекционный эндокардит, ИЛ — интерлейкин, ФНО — фактор некроза опухоли, Арг — аргиназа 1 | ||
Таким образом, имелась тенденция к повышенной экспрессии генов провоспалительных цитокинов (ИЛ-6, ИЛ-1β, ФНОα) макрофагами в тканях резецированных клапанов у пациентов с неблагоприятным и/или осложнённым течением ИЭ, однако статистической значимости различия не достигали, вероятно, по причине небольшой выборки пациентов.
Далее у оперированных пациентов с ИЭ изучена связь провоспалительных цитокинов (ИЛ-1β, ИЛ-6) с лабораторными маркерами воспаления. Выявлены сильные и умеренные положительные связи между ИЛ-1β и ИЛ-6, а также между интерлейкинами с уровнем лейкоцитов и НЛИ (табл. 8).
Таблица 8. Анализ взаимосвязей ИЛ-1β и ИЛ-6 с маркерами воспаления
Показатель | ИЛ-1β | ИЛ-6 |
ИЛ-1β | - | r=0,78* |
ИЛ-6 | r=0,78* | - |
Лейкоциты*10⁹/л | r=0,77* | r=0,70* |
Нейтрофильно-лимфоцитарный индекс | r=0,67* | r=0,76* |
Корреляционный анализ проведен с расчетом коэффициентов корреляции Пирсона и Спирмена, * — p <0,05 ИЛ — интерлейкин | ||
По данным ROC-анализа показано, что ИЛ-1β, лейкоцитоз и НЛИ обладают благоприятными характеристиками для применения в качестве диагностических тестов на активность ИЭ у оперированных пациентов (ИЛ-1β AUC 0,816 (p=0,02), НЛИ AUC 0,807 (p=0,03), лейкоцитоз AUC 0,714 (p=0,03)). При этом ИЛ-6 не продемонстрировал диагностической значимости у пациентов с ИЭ (рис. 2).
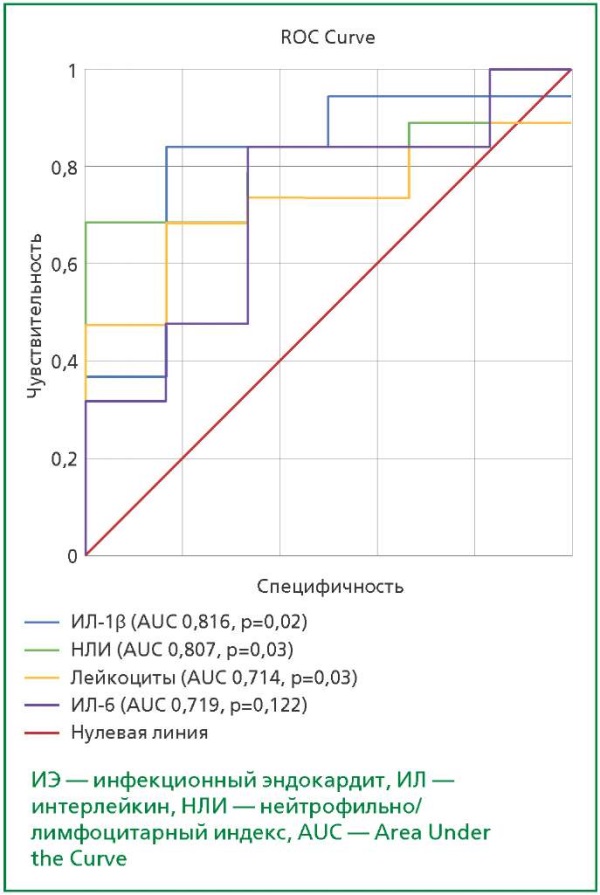
Рисунок 2. ROC-кривая диагностических характеристик ИЛ-1β, уровня лейкоцитов, НЛИ и ИЛ-6 при сравнении оперированных пациентов с и без ИЭ.
Таким образом, по результатам иммуногистохимического исследования, направленного на выявление неповрежденных макрофагов в эндокарде оперированных пациентов с и без ИЭ, выявлено преобладание провоспалительного фенотипа макрофагов среди оперированных пациентов без ИЭ. Одновременно с этим отмечена повышенная экспрессия генов провоспалительных цитокинов (ИЛ-1β и ИЛ-6) макрофагами в тканях клапанов оперированных пациентов с ИЭ. При этом не получено значимых различий по уровню экспрессии генов про- или противовоспалительных цитокинов в зависимости от наличия осложнений ИЭ. ИЛ-1β продемонстрировал высокую диагностическую ценность для определения активности воспаления у оперированных пациентов с ИЭ.
Обсуждение
Диагностика ИЭ часто затруднена и основана на совокупности клинических данных, этиологического обследования и параметров эхокардиографии. Стёртый (в ряде случаев) характер течения болезни приводит к задержке постановки диагноза и своевременного начала терапии, что неблагоприятно влияет на показатели летальности. В связи с чем изучение значения биомаркеров для диагностики ИЭ может иметь важное значение.
В представленном исследовании изучены особенности цитокинового профиля у оперированных пациентов с и без ИЭ. Выполнено иммуногистохимическое исследование тканей на предмет выявления неповрежденных макрофагов. Определены сывороточные уровни экспрессии генов про- и противовоспалительных цитокинов тканевыми макрофагами. Проведена оценка уровня воспалительных маркеров с точки зрения определения активности ИЭ у оперированных пациентов.
Морфофункциональные особенности макрофагов у пациентов с инфекциями кровотока исследованы недостаточно. Основные научные данные получены у пациентов с сепсисом, в то время как при ИЭ исследования остаются единичными. Макрофаги относятся к ключевым участникам врожденного иммунитета, представлены в разных тканях и выполняют множественные функции, включая секрецию про- и противовоспалительных цитокинов [10][18-20]. Известно, что провоспалительные цитокины ассоциированы с неблагоприятным прогнозом при тяжёлых инфекционных состояниях. Некоторыми авторами обсуждается потенциальная роль цитокинов в определении активности ИЭ, в том числе у оперированных пациентов [21-23]. Более того, существует предположение, что избыточная воспалительная реакция, вызванная рядом провоспалительных цитокинов, например, ИЛ-8, ИЛ-6, интерфероном-γ, может привести к повреждению тканей клапанов, свидетельствовать о плохом контроле течения ИЭ и неблагоприятном прогнозе [7][8][11][18].
В настоящей работе изучена экспрессия генов цитокинов тканевыми макрофагами и выявлена тенденция к преобладанию провоспалительного фенотипа у оперированных пациентов с ИЭ. Статистически значимые различия с оперированными пациентами с клапанными пороками без ИЭ получены только в отношении ИЛ-1β и ИЛ-6, что согласуется с экспериментальными данными на животных и единичными клиническими исследованиями [21-24]. При этом не получено различий по уровню экспрессии генов провоспалительных цитокинов в зависимости от осложненного течения ИЭ, что ранее отмечено в работах R. W. Watkin и соавт. [21] и P. Alter и соавт. [22].
Известно, что стафилококковый ИЭ (в первую очередь вызванный S. aureus) отличается тяжелым деструктивным поражением клапанного аппарата, в связи с чем обсуждается его патогенетическая связь с избытком образования провоспалительных цитокинов, например, ИЛ-6, ИЛ-1β и ФНО-α [14]. В настоящем исследовании не получено убедительных различий между стафилококковым и нестафилококковым ИЭ, однако отмечены повышенные более чем в 2 раза уровни провоспалительных цитокинов при ИЭ, вызванном S. aureus. Данный аспект, вероятно, объясняется недостаточной статистической мощностью исследования и определяет необходимость дальнейшего анализа.
Взаимосвязи между клетками воспаления и их влияние на степень развития воспалительной реакции остаются недостаточно изученными механизмами. В настоящем исследовании у пациентов с ИЭ выявлена корреляция провоспалительных цитокинов ИЛ-1β и ИЛ-6 между собой и с маркерами воспаления, такими как лейкоциты и НЛИ. При этом ИЛ-1β продемонстрировал наиболее благоприятные характеристики в качестве диагностического маркера активного воспаления в тканях резецированных клапанов у пациентов с ИЭ, превосходящие повышенный уровень лейкоцитов. Аналогичные данные ранее продемонстрированы только в отношении ИЛ-6 и С-реактивного белка [21]. Таким образом, ИЛ-1β может быть независимым от клеточного иммунитета диагностическим критерием активности ИЭ, обладающим потенциалом биомаркера для оценки тяжести клапанного повреждения.
При сепсисе выявлена уникальная патогенетическая связь, когда одновременно с начальной провоспалительной реакцией развивается интенсивный противовоспалительный ответ. ИЛ-10 как один самых сильных противовоспалительных цитокинов может быть обнаружен в высокой концентрации в острую фазу сепсиса [8][18]. В настоящей работе не получено значимых различий по уровню ИЛ-10 у оперированных пациентов с ИЭ ни в отношении пациентов без ИЭ, ни в отношении осложнений ИЭ или связи с S. aureus. Данный аспект согласуется с ранее проведенными исследованиями [8], а также может указывать на характерные отличия ИЭ от сепсиса, связанные с более затяжным течением и менее выраженной острой воспалительной реакцией при ИЭ, приводящей к устойчивой провоспалительной реакции и деструктивными процессам в клапанах сердца.
Также не удалось выявить значимых различий в отношении экспрессии генов ФНО-α у оперированных пациентов с и без ИЭ, а также в зависимости от осложнённого течения ИЭ, что подтверждается серией ранее выполненных исследований [21][23]. Этот феномен может быть связан с истощением активности иммунных клеток на фоне постоянной стимуляции в условиях характерного для ИЭ длительного воспаления, что приводит к снижению экспрессии некоторых цитокинов, в частности ФНО-α, однако для подтверждения данного предположения необходимы дальнейшие исследования.
Наиболее интересными оказались результаты, показавшие, что у оперированных пациентов с ИЭ при наблюдаемой значимо более высокой экспрессии генов провоспалительных цитокинов и белка CD 86+ (маркер провоспалительного фенотипа макрофагов) методом ПЦР Real time, одновременно выявлялся феномен "макрофагального провала", представленный низким количеством целых клеток провоспалительного фенотипа макрофагов CD 86+ при иммуногистохимическом исследовании. Данное явление предположительно связано со способностью нейтрофильных внеклеточных ловушек к стимулированию пироптоза макрофагов, в результате которого происходит разрушение макрофагов с неконтролируемым высвобождением внутриклеточных провоспалительных молекул во внеклеточное пространство, приводящее к чрезмерному воспалению по аналогии с сепсисом [25]. Именно данные патологические процессы у пациентов с ИЭ, вероятно, определяют развитие структурных нарушений клапанного аппарата сердца, неконтролируемого течения инфекции, формирование эмбологенных вегетаций и потребность в кардиохирургическом лечении. Однако это предположение требует дальнейшего изучения и подтверждения.
Ограничения исследования
Ограничения исследования — набор пациентов в одном центре и небольшая выборка пациентов. Также большинству обследованных проводилась активная антибактериальная терапия до кардиохирургического лечения, что могло повлиять на оценку результатов, определив относительно высокий уровень противовоспалительных цитокинов в группе ИЭ. Низкая частота развития анализируемых неблагоприятных событий в небольшой выборке пациентов, вероятно, послужила причиной отсутствия статистически значимых различий в степени экспрессии провоспалительных цитокинов у пациентов с ИЭ с событиями. Авторы имели возможность определить тенденции к преобладанию того или иного фенотипа макрофагов, а также предполагать наличие связи макрофагов с нейтрофильными внеклеточными ловушками через пироптоз, в связи с чем проведённое исследование является пилотным и необходимо дальнейшее изучение макрофагов у пациентов с ИЭ.
Заключение
В проведённом исследовании показано, что тканевые макрофаги экспрессируют высокие уровни провоспалительных цитокинов ИЛ-1β и ИЛ-6 у оперированных пациентов с ИЭ вне зависимости от этиологической принадлежности или осложнённого течения заболевания. При этом ИЛ-1β обладает высокой диагностической ценностью для определения активности клапанного воспаления при ИЭ. Деструктивные процессы в клапанах оперированных пациентов с ИЭ, по-видимому, обусловлены феноменом "макрофагального провала", приводящего к разрушению макрофагов с неконтролируемым высвобождением провоспалительных цитокинов во внеклеточное пространство с последующим чрезмерным воспалением. Таким образом, исследование цитокинового профиля является диагностическим инструментом определения активности ИЭ и выделения пациентов неблагоприятного риска.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование: Работа выполнена при поддержке гранта Российского научного фонда (проект № 22-75-10012) с использованием биоматериала человека, собранного и сохраняемого в рамках научной программы. Оборудование для сбора, хранения и транспортировки биоматериала человека, оборудование для обследования пациентов приобретено за счёт средств Программы стратегического академического лидерства РУДН.
Funding: The work was supported by a grant from the Russian Science Foundation (project No. 22-75-10012) using human biomaterial collected and preserved as part of a scientific program. Equipment for the collection, storage and transportation of human biomaterials, and equipment for examining patients were purchased with funds from the RUDN University Strategic Academic Leadership Program.
Список литературы
1. Демин А. А., Кобалава Ж. Д., Скопин И. И. и др. Инфекционный эндокардит и инфекция внутрисердечных устройств. Клинические рекомендации 2021. Российский кардиологический журнал. 2022;27(10):5233. DOI: 10.15829/1560-4071-2022-5233.
2. Delgado V, Ajmone Marsan N, de Waha S, et al.; ESC Scientific Document Group. 2023 ESC Guidelines for the management of endocarditis. Eur Heart J. 2023;44(39):3948-4042. DOI: 10.1093/eurheartj/ehad193.
3. Котова Е. О., Домонова Э. А., Кобалава Ж. Д. и др. Современные тренды этиологической диагностики инфекционного эндокардита. Рациональная Фармакотерапия в Кардиологии. 2021;17(1):153-64. DOI: 10.20996/1819-6446-2021-02-14.
4. Snipsøyr MG, Ludvigsen M, Petersen E, et al. A systematic review of biomarkers in the diagnosis of infective endocarditis. Int J Cardiol. 2016;202:564-70. DOI:10.1016/j.ijcard.2015.09.028.
5. Самойленко Е. С., Колесникова Н. В., Подсадняя А. А., Братова А. В. Цитокиновые маркеры клинических вариантов инфекционного эндокардита. Инфекция и иммунитет. 2022;12(2):271-78. DOI: 10.15789/2220-7619-CMO-1851.
6. Begum A, Modumudi S, Subramani S, et al. Novel putative biomarkers for infective endocarditis by serum proteomic analysis : a comprehensive review of literature. Ann Med Surg (Lond). 2023;85(11):5497-503. DOI: 10.1097/MS9.0000000000001249.
7. Siciliano RF, Gualandro DM, Bittencourt MS, et al. Biomarkers for prediction of mortality in left-sided infective endocarditis. Int J Infect Dis. 2020;96:25-30. DOI: 10.1016/j.ijid.2020.03.009.
8. Holub M, Džupová O, Růžková M, et al. Selected Biomarkers Correlate with the Origin and Severity of Sepsis. Mediators Inflamm. 2018;2018:7028267. DOI: 10.1155/2018/7028267.
9. Федоров А. А., Ермак Н. А., Геращенко Т. С. и др. Поляризация макрофагов: механизмы, маркеры и факторы индукции. Сибирский онкологический журнал. 2022;21(4):124-36. DOI: 10.21294/1814-4861-2022-21-4-124-136.
10. Pérez S., Rius- Pérez S. Macrophage Polarization and Reprogramming in Acute Inflammation: A Redox Perspective. Antioxidants (Basel). 2022;11(7):1394. DOI: 10.3390/antiox11071394.
11. Bozza FA, Salluh JI, Japiassu AM, et al. Cytokine profiles as markers of disease severity in sepsis: a multiplex analysis. Crit Care. 2007;11(2):R49. DOI: 10.1186/cc5783.
12. Benoit M, Desnues B, Mege JL. Macrophage polarization in bacterial infections. J Immunol. 2008;181(6):3733-9. DOI: 10.4049/jimmunol.181.6.3733.
13. Weinstock M, Grimm I, Dreier J, et al. Genetic Variants in Genes of the Inflammatory Response in Association with Infective Endocarditis. PLoS ONE. 2014;9(10):e110151. DOI: 10.1371/journal.pone.0110151.
14. Тазина С. Я., Федорова Т. А., Семененко Н. А. и др. Диагностическая и прогностическая роль маркеров воспаления и сосудистого эндотелиального фактора роста при инфекционном эндокардите. Клиническая медицина. 2017;95(7):618-22. DOI: 10.18821/0023-2149-2017-95-7-618-622.
15. Diab M, Tasar R, Sponholz C, et al. Changes in inflammatory and vasoactive mediator profiles during valvular surgery with or without infective endocarditis: A case control pilot study. PLoS One. 2020;151(2):e0228286. DOI: 10.1371/journal.pone.0228286.
16. Pfaffl MW. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Res. 2001;29(9):e45. DOI: 10.1093/nar/29.9.e45.
17. Vandesompele J, De Preter K, Pattyn F, et al. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes. Genome Biol. 2002;3(7):RESEARCH0034. DOI: 10.1186/gb-2002-3-7-research0034.
18. Chen X, Liu Y, Gao Y, et al. The roles of macrophage polarization in the host immune response to sepsis. Int Immunopharmacol. 2021;96:107791. DOI: 10.1016/j.intimp.2021.107791.
19. Artemova D, Vishnyakova P, Fomina M, et al. Polarized Macrophages As Potential Anti- Endometrioid agent [abstract]. FASEB J. 2022;36(S1):0506. DOI: 10.1096/fasebj.2022.36.S1.0R506.
20. Vishnyakova P, Poltavets A, Karpulevich E, et al. The response of two polar monocyte subsets to inflammation. Biomed Pharmacother. 2021;139:111614. DOI: 10.1016/j.biopha.2021.111614.
21. Watkin RW, Harper LV, Vernallis AB, et al. Pro-inflammatory cytokines IL 6, TNF-alpha, IL 1beta, procalcitonin, lipopolysaccharide binding protein and C-reactive protein in infective endocarditis. J Infect. 2007;55(3):220-5. DOI: 10.1016/j.jinf.2007.05.174.
22. Alter P, Hoeschen J, Ritter M, Maisch B. Usefulness of cytokines interleukin-6 and interleukin-2R concentrations in diagnosing active infective endocarditis involving native valves. Am J Cardiol. 2002;89(12):1400-04. DOI: 10.1016/s0002-9149(02)02353-6.
23. Rawczynska- Englert I, Hryniewiecki T, Dzierzanowska D. Evaluation of serum cytokine concentrations in patients with infective endocarditis. J Heart Valve Dis. 2000;9(5):705-9.
24. Christiansen JG, Jensen HE, Jensen LK, et al. Systemic infammatory response and local cytokine expression in porcine models of endocarditis. APMIS. 2014;122:292-300. DOI: 10.1111/apm.12145.
25. Qiu P, Liu Y, Zhang J. Review: the Role and Mechanisms of Macrophage Autophagy in Sepsis. Inflammation. 2019;42(1):6-19. DOI: 10.1007/s10753-018-0890-8.
Об авторах
Е. О. КотоваРоссия
Елизавета Олеговна Котова
Москва
А. С. Писарюк
Россия
Александра Сергеевна Писарюк
Москва
А. В. Лохонина
Россия
Анастасия Вячеславовна Лохонина
Москва
А. Ю. Моисеева
Россия
Александра Юрьевна Моисеева
Москва
Э. А. Домонова
Россия
Эльвира Алексеевна Домонова
Москва
Т. А. Гусарова
Россия
Татьяна Анатольевна Гусарова
Москва
Ю. И. Бабухина
Россия
Юлия Игоревна Бабухина
Москва
П. В. Кахкцян
Россия
Павел Вараздатович Кахкцян
Москва
Т. Х. Фатхудинов
Россия
Тимур Хайсамудинович Фатхудинов
Москва
Ж. Д. Кобалава
Россия
Жанна Давидовна Кобалава
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Котова Е.О., Писарюк А.С., Лохонина А.В., Моисеева А.Ю., Домонова Э.А., Гусарова Т.А., Бабухина Ю.И., Кахкцян П.В., Фатхудинов Т.Х., Кобалава Ж.Д. Цитокиновый профиль оперированных пациентов с инфекционным эндокардитом. Рациональная Фармакотерапия в Кардиологии. 2025;21(1):4-13. https://doi.org/10.20996/1819-6446-2025-3125
For citation:
Kotova E.O., Pisaryuk A.S., Lokhonina A.V., Moiseeva A.Y., Domonova E.A., Gusarova T.A., Babukhina J.I., Kakhktsyan P.V., Fatkhudinov T.K., Kobalava Z.D. Cytokine profile of surgical patients with infective endocarditis. Rational Pharmacotherapy in Cardiology. 2025;21(1):4-13. (In Russ.) https://doi.org/10.20996/1819-6446-2025-3125
JATS XML
















































