Перейти к:
Практические аспекты периоперационного ведения пациентов с неклапанной фибрилляцией предсердий, получающих прямые пероральные антикоагулянты
https://doi.org/10.20996/1819-6446-2025-3141
Аннотация
Статья посвящена периоперационному ведению пациентов с неклапанной фибрилляцией предсердий, получающих прямые оральные антикоагулянты при проведении плановых хирургических вмешательств или инвазивных процедур. Рассматриваются ключевые факторы, влияющие на тактику отмены и возобновления антикоагулянтной терапии, включая классификацию хирургических вмешательств по степени риска кровотечения, вид анестезии, клиренс креатинина и фармакокинетические свойства конкретного прямого орального антикоагулянта. Представлен унифицированный алгоритм, позволяющий определить оптимальные сроки отмены и возобновления приёма антикоагулянтов. Подробно анализируются возможные клинические сценарии, такие как эндоскопическая холецистэктомия, экстракция зубов, радикальная простатэктомия и эндопротезирование коленного сустава. Для каждого из этих случаев предлагаются практические рекомендации по периоперационному ведению, учитывающие индивидуальные особенности пациентов, риск тромбоэмболических и геморрагических осложнений, а также необходимость профилактики венозных тромбоэмболических осложнений. Отдельное внимание уделяется проблемам реальной клинической практики, таким как несогласованность действий между специалистами, различия в интерпретации рекомендаций и отсутствие единых внутрибольничных алгоритмов. Подчеркивается важность мультидисциплинарного подхода, обеспечивающего сбалансированное принятие решений. Обозначена необходимость применения индивидуального подхода при принятии решения об отмене и возобновлении антикоагулянтной терапии, а также важность стандартизированных протоколов для повышения безопасности пациентов с фибрилляцией предсердий. Рекомендуется учитывать фармакокинетические характеристики препаратов, особенности пациента и запланированного вмешательства, а также возможные риски. Использование чётких алгоритмов и активное мультидисциплинарное сотрудничество между клиницистами помогут минимизировать частоту как тромбоэмболических, так и геморрагических осложнений в периоперационном периоде.
Ключевые слова
Для цитирования:
Маркова Е.Н., Веденикин Т.Ю., Кузуб А.А., Кучиева Н.В., Навасардян А.Р., Джиоева О.Н. Практические аспекты периоперационного ведения пациентов с неклапанной фибрилляцией предсердий, получающих прямые пероральные антикоагулянты. Рациональная Фармакотерапия в Кардиологии. 2025;21(1):74-81. https://doi.org/10.20996/1819-6446-2025-3141
For citation:
Markova E.N., Vedenikin T.Yu., Kuzub A.A., Kuchieva N.V., Navasardyan A.R., Dzhioeva O.N. Practical aspects of perioperative management in patients with non-valvular atrial fibrillation receiving direct oral anticoagulants. Rational Pharmacotherapy in Cardiology. 2025;21(1):74-81. (In Russ.) https://doi.org/10.20996/1819-6446-2025-3141
Введение
Распространённость фибрилляции предсердий (ФП) у взрослых, согласно рекомендациям Европейского общества кардиологов, составляет от 2 до 4% [1]. По результатам эпидемиологического исследования ЭПОХА, проведённого в Европейской части России, показано, что 2,04% населения имеют ФП, причём частота встречаемости этого заболевания увеличивается с возрастом и достигает пика (9,6%) в возрасте от 80 до 89 лет. Кроме того, ФП более распространена у людей с сопутствующими сердечно-сосудистыми заболеваниями и сахарным диабетом, а также у тех, кто имеет статус коморбидного пациента [2]. М. Ю. Шапкина и соавт. проанализировали выборку пациентов г. Новосибирска и отметили, что среди пациентов 45-69 лет частота ФП за 13 лет наблюдения увеличилась с 1,6 до 8,3% [3]. Таким образом, частота выявления ФП повышается и ожидается её увеличение в 2,3 раза в связи с активной диагностикой и ростом продолжительности жизни населения в целом [1].
Антикоагулянтная терапия (АКТ) назначается пациентам с ФП умеренного и высокого риска тромбоэмболических событий на неопределённо долгий срок при отсутствии абсолютных противопоказаний. Пероральные антикоагулянты (ПОАК), не являющиеся антагонистами витамина К, рассматриваются в международных и Российских клинических рекомендациях по лечению ФП как предпочтительный выбор для профилактики инсульта у пациентов с данной патологией [4][5]. Однако в реальной практике только каждый четвертый российский пациент с ФП (23,9%), имеющий абсолютные показания для назначения АКТ (CHA2DS2VASc ≥2 баллов у мужчин и с CHA2DS2VASc ≥3 баллов у женщин), их получает. Более половины пациентов с ФП (56,9%), имеющих высокий риск инсульта по шкале CHA2DS2VASc, получают антитромбоцитарную терапию, несмотря на то что ацетилсалициловая кислота, клопидогрел и их комбинация не рекомендованы для профилактики инсульта и системных эмболий у пациентов с ФП [2].
Среди пациентов с ФП, которая является доминирующим показанием к назначению длительной АКТ, от 10 до 15% пациентов ежегодно нуждаются в прерывании лечения в связи с плановым хирургическим вмешательством или инвазивной процедурой [6]. Ведение таких пациентов может быть затруднительным, поскольку перед вмешательством чаще всего требуется прерывание терапии, что приводит к возрастанию риска тромбоэмболических осложнений. С другой стороны, проведение манипуляции на фоне АКТ повышает вероятность геморрагических осложнений. В подобной ситуации рекомендации каждому пациенту должны быть индивидуальными: необходимо найти оптимальный баланс между эффективностью и безопасностью АКТ, минимизировав частоту как геморрагических, так и тромботических осложнений [7][8].
Таким образом, врачи разных специальностей (в том числе работающие в амбулаторном звене) сталкиваются с необходимостью принятия решения по тактике отмены и возобновления ПОАК, которая должна включать индивидуальную оценку риска тромбоэмболических и геморрагических осложнений.
Настоящая публикация представляет собой практические рекомендации по тактике периоперационного ведения пациентов, получающих ПОАК при ФП. В статье описаны клинические ситуации, а также практические трудности и спорные вопросы, с которыми сталкивается специалист при выборе оптимальной медикаментозной терапии у коморбидного пациента.
Факторы, которые должны быть оценены у пациентов с ФП, получающих ПОАК, перед плановым внесердечным вмешательством
Тактика периоперационного ведения зависит от факторов, связанных с операцией, с пациентом и с фармакокинетическими характеристиками конкретного ПОАК.
Факторы, связанные с хирургическим вмешательством
Факторы, связанные с хирургическим вмешательством, включают срочность вмешательства (в настоящей статье рассматриваются только плановые вмешательства у пациентов с ФП), риск кровотечения во время операции (отражающий как вероятность возникновения интраоперационного кровотечения, так и риск осложнений в случае развития кровотечения, например, при нейрохирургических, больших торакальных или абдоминальных вмешательствах), а также вид анестезиологического пособия.
В то время как одни инвазивные хирургические вмешательства требуют временного прекращения приема ПОАК ввиду большой травматичности и высокой вероятности кровопотери во время операции, другие сопряжены с относительно низким риском кровотечения и могут проводиться без отмены/на фоне АКТ [4][8]. Таким образом, при принятии решения о тактике периоперационного ведения в первую очередь необходимо определить к какому типу относится запланированное вмешательство (табл. 1) [8].
Таблица 1. Стратификация внесердечных хирургических вмешательств по степени риска кровотечений
Минимальный риск кровотечения | Низкий риск кровотечения | Высокий риск кровотечения |
Хирургическое лечение катаракты и глаукомы | Абдоминальная хирургия: холецистэктомия, грыжесечение, резекция толстой кишки | Абдоминальная хирургия с биопсией печени, экстракорпоральной ударноволновой литотрипсией |
Стоматологические процедуры: удаление (1-3 зуба), пародонтальная хирургия, установка имплантов, эндодонтические процедуры (депульпирование), субдесневая чистка | Грудная хирургия | Обширная хирургия рака (например, поджелудочной железы, печени) |
Эндоскопия без биопсии или резекции | Сложные стоматологические процедуры (удаление >3 зубов) | Нейроаксиальная (спинальная или эпидуральная) анестезия |
Поверхностная хирургия (например, вскрытие абсцесса, небольшие разрезы кожи/биопсия) | Эндоскопия с простой биопсией | Нейрохирургия (внутричерепная, спинальная) |
Гастроскопия или колоноскопия с простой биопсией | Обширные ортопедические операции | |
Процедуры с использованием игл большого диаметра (например, биопсия костного мозга или лимфатических узлов) Офтальмологическая хирургия (за исключением катаракты) | Процедуры с биопсией васкуляризированных органов (почки или простаты) | |
Малая ортопедическая хирургия (артроскопия стопы или кисти) | Реконструктивная пластическая хирургия | |
Специфические вмешательства (полипэктомия толстой кишки, люмбальная пункция, эндоваскулярное лечение аневризмы) | ||
Торакальная хирургия, резекция легкого | ||
Урологические вмешательства (простатэктомия, резекция опухоли мочевого пузыря) | ||
Сосудистая хирургия (например, лечение аневризмы брюшной аорты, сосудистое шунтирование) |
Для оценки сроков отмены и возобновления ПОАК также необходимо учитывать тип анестезиологического пособия. При использовании регионарной анестезии нейроаксиального типа (спинномозговая, эпидуральная) увеличивается риск кровотечений в месте проведения пункции, развития эпидуральных гематом, которые могут приводить к стойкому или необратимому параличу. С одной стороны, многие руководства относят нейроаксиальную анестезию к вмешательствам с высоким риском кровопотери, а с другой, они же предлагают руководствоваться ещё более продолжительными периодами предоперационной отмены ПОАК, чем при операциях с высоким геморрагическим риском [7-10]. Таким образом, при решении вопроса о сроках отмены АКТ важно отметить тип анестезиологического пособия.
При применении ПОАК время отмены каждого препарата до проведения манипуляции рассчитывается отдельно с учётом индивидуальной фармакокинетики и составляет не менее 5 интервалов полувыведения. При этом сроки отмены дабигатрана также зависят от функции почек (табл. 2) [7][11].
Таблица 2. Сроки отмены ПОАК при проведении нейроаксиальной анестезии
ПОАК | Клиренс креатинина, мл/мин | Срок отмены, ч |
Ривароксбан/апиксабан | ≥15 | 72 |
Дабигатран | ≥80 | 72 |
50-79 | 96 | |
30-49 | 120 | |
ПОАК — прямые оральные антикоагулянты | ||
Важно отметить, что позиции экспертов по срокам отмены дабигатрана расходятся. Так, например, согласно рекомендациям Российского кардиологического общества (РКО) (2023 г.) и Европейского общества кардиологов (European Society of Cardiology (ESC) (2022 г.) дабигатран должен быть отменен не менее, чем за 4-5 дней до нейроаксиальной анестезии без учёта функции почек [8][9].
Возобновление АКТ рекомендовано спустя 6-24 ч после извлечения катетера [7-10].
При проведении оперативного вмешательства с использованием общей анестезии сроки отмены и возобновления АКТ зависят от конкретного пациента, объёма операции и фармакокинетических свойств ПОАК.
Факторы, связанные с пациентом
Факторы, связанные с пациентом, включают возраст, индивидуальный риск развития тромботических осложнений, наличие ишемических или геморрагических осложнений в анамнезе, приём лекарственных препаратов, сопутствующую патологию (заболевания печени или почек) и др. [9]. Факторы, связанные с пациентом, наиболее трудны с точки зрения объективной оценки, а также полноты их учёта, так как всегда остаётся вероятность того, что какой-то параметр не учтён или скрыт пациентом (приём биологических активных добавок, злоупотребление алкоголем и др.).
Так, недавно перенесённый инсульт (в предшествующие 3 мес.), тромб в полости левого желудочка или очень высокий риск тромбоэмболических событий по шкале CHA2DS2-VASc (≥7 баллов) говорят о высоком тромбоэмболическом риске пациента, а недавнее геморрагическое осложнение (≤3 мес.) может повышать вероятность развития повторного эпизода [11][12].
Приём антиагрегантных или нестероидных противовоспалительных препаратов (НПВП) способствует повышению геморрагического риска [12].
Перед оперативным вмешательством крайне важно оценить функцию почек пациента, рассчитав клиренс креатинина с использование формулы Кокрофта–Голта, поскольку наличие хронической болезни почек (ХБП) может повышать геморрагический риск [4]. В случае, если у пациента функция почек сохранена — выполнение инвазивных процедур, ассоциированных c минимальным риском кровотечений, рекомендуется без отмены ПОАК. У больных с нормальной функцией почек и низким геморрагическим риском рекомендуется прекратить терапию ПОАК за 24 ч до операции, при высоком геморрагическом риске — не менее чем за 48 ч [4][7].
Если у пациента есть ХБП, то сроки отмены будут зависеть от степени нарушения функции почек, типа хирургического вмешательства по степени риска кровотечений и конкретного ПОАК.
У пациентов, получающих терапию ривароксабаном, апиксабаном с клиренсом креатинина 30-79 мл/мин по формуле Кокрофта–Голта, рекомендуется прекратить их приём за 48 ч до операции при высоком геморрагическом риске и за 24 ч при низком геморрагическом риске [4][7].
У пациентов, принимающих ривароксабан, апиксабан, с клиренсом креатинина 15-29 мл/мин, терапию рекомендуется прекратить за 48 ч до операции при высоком геморрагическом риске и за 36 ч при низком геморрагическом риске [4][7].
У пациентов, принимающих дабигатран, с клиренсом креатинина 50-79 мл/мин, рекомендуется прекратить приём препарата за 72 ч до операции при высоком геморрагическом риске и за 36 ч при низком геморрагическом риске. У пациентов с клиренсом креатинина 30-49 мл/мин терапию дабигатраном рекомендуется прекратить за 96 ч до операции при высоком геморрагическом риске и за 48 ч при низком геморрагическом риске [4][7].
У пациентов после хирургического вмешательства с низким геморрагическим риском рекомендуется начать приём ПОАК через 6-12 ч, у пациентов после хирургического вмешательства с высоким геморрагическим риском рекомендуется начать приём ПОАК через 48 ч [7][9].
Независимо от функции почек, риска кровопотери во время операции и применяемого ПОАК терапия "моста" не требуется.
В 2022 г. были опубликованы результаты пилотного исследования применения методики Failure Mode and Effects Analysis (FMEA) для разработки алгоритма периоперационного ведения пациентов, принимающих пероральные антикоагулянтны. FMEA — "превентивная" методика, позволяющая выявить потенциальный риск процедуры/методики [13]. Согласно результатам исследования, наиболее критичными с точки зрения вероятности развития нежелательных явлений при периоперационном ведении пациента являются некорректный выбор времени приостановки АКТ (ввиду отсутствия учета состояния функции почек) и её возобновления, а также неправильная или неполная оценка риска интраоперационной кровопотери. Именно эти аспекты рекомендуют учитывать при составлении внутрибольничных алгоритмов назначения антикоагулянтов.
Алгоритм отмены АКТ при внесердечном хирургическом вмешательстве представлен на рис. 1.
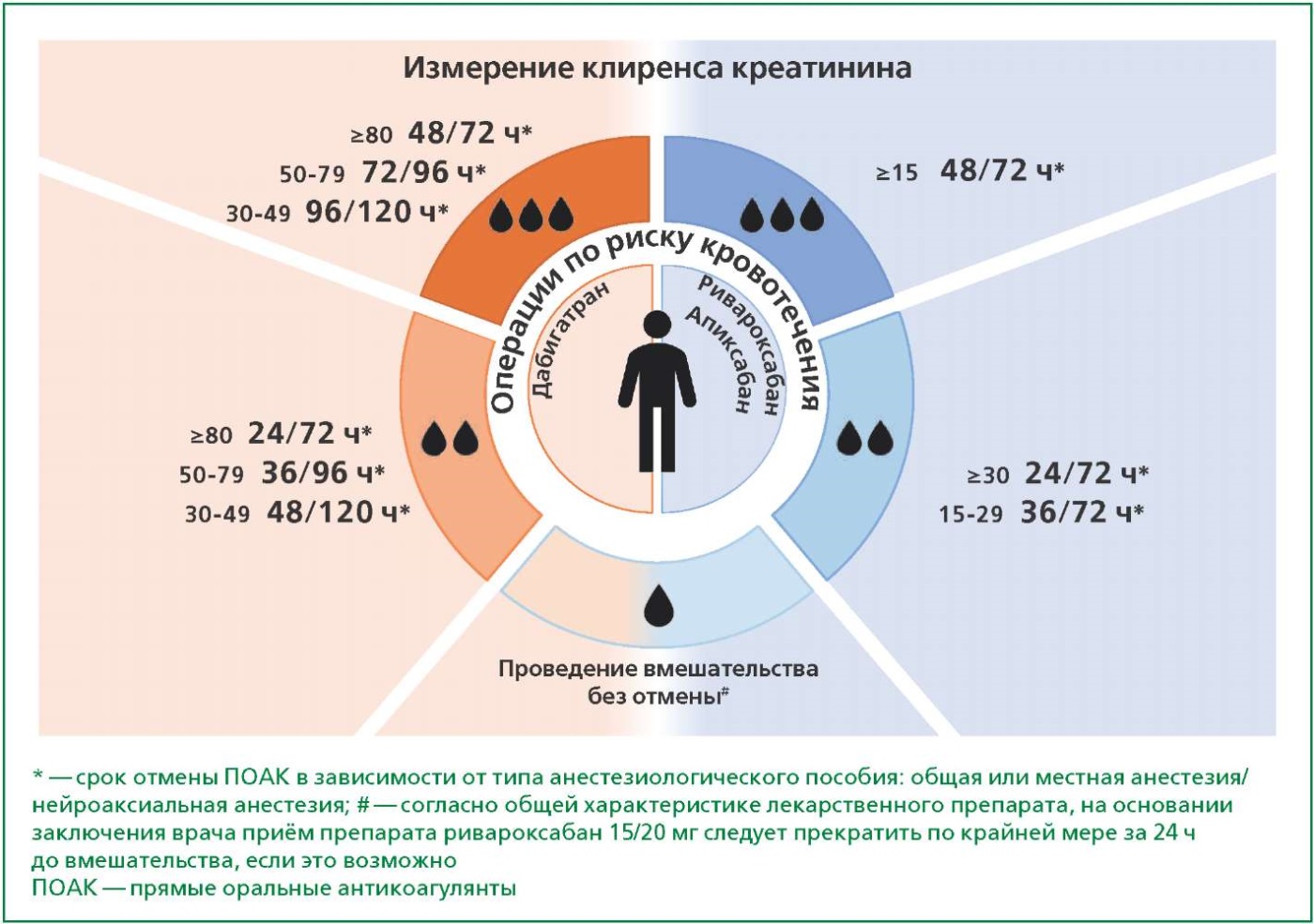
Рисунок. Алгоритм отмены антикоагулянтной терапии при внесердечном хирургическом вмешательстве.
Нерешённые вопросы
Несмотря на многочисленные алгоритмы и рекомендации, в реальной практике каждая клиника продолжает работать "по-своему". Именно поэтому и решено осветить этот вопрос в статье с точки зрения тех трудностей, с которыми сталкивается практикующий врач, принимая решение о тактике периоперационного ведения конкретного пациента.
Возможные клинические сценарии назначения антикоагулянтных препаратов
Для конкретизации рассмотрены несколько типичных клинических сценариев и предложены соответствующие подходы к периоперационной антикоагуляции. В качестве примера представлен ингибитор X фактора ривароксабан, поскольку препарат применяется один раз в сутки и с точки зрения сроков отмены по данной группе ПОАК информация не столь противоречива, как у пациентов, принимающих ингибитор тромбина дабигатран.
Пациентка с ФП, которой планируется проведение холецистэктомии
Пациентка, 68 лет, индекс массы тела 36,4 кг/м², в анамнезе гипертоническая болезнь (ГБ) 3 стадии (достигнуты целевые значения артериального давления), пароксизмальная форма ФП, сердечная недостаточность с сохраненной фракцией выброса левого желудочка, неалкогольная жировая болезнь печени, гиперурикемия. Постоянно получает: фиксированная комбинация периндоприл + амлодипин + индапамид 5 мг + 5 мг + 1,25 мг, соталол 160 мг/сут., ривароксабан 20 мг/сут. (клиренс креатинина 55 мл/мин), дапаглифлозин 10 мг/сут., аллопуринол 100 мг/сут.
Планируется плановое хирургическое вмешательство: эндоскопическая холецистэктомия. Анестезиологическое пособие: эндотрахеальная анестезия.
В соответствии с предложенным алгоритмом (см. рис. 1) необходимо определить, к какому типу вмешательства по риску кровотечения относится эндоскопическая холецистэктомия. Согласно рекомендациям РКО по оценке и коррекции сердечно-сосудистых рисков при несердечных операциях (2023 г.) (см. табл. 1), такая операция относится к вмешательствам с низким уровнем кровопотери [8]. При этом в более ранних документах любые абдоминальные вмешательства относили к операциям с высоким риском кровопотери [4][7]. На следующем этапе необходимо оценить функцию почек пациентки — клиренс креатинина ≥30 мл/мин. Последний вопрос, ответ на который необходим для принятия решения о сроке отмены АКТ — тип анестезиологического пособия. У пациентки запланировано оперативное вмешательство под эндотрахеальной анестезией. Соответственно можно отменить антикоагулянт за 24 ч до операции, не переводя пациентку на парентеральные формы (без терапии "моста"). Возобновить АКТ при стабильном гемостазе можно будет спустя 24 ч после операции.
Практические аспекты: пациентка относится к старшей возрастной группе, имеет сердечно-сосудистую коморбидность (ожирение, ГБ, ХБП, cердечная недостаточность с сохраненной фракцией выброса), а также неалкогольную жировую болезнь печени. Принимая во внимание отмену антикоагулянтов перед операцией, а также наличие триггеров (стресс, инфузионная терапия) периоперационной ФП, больная относится к категории высокого тромбоэмболического риска. Наличие ожирения может искажать картину ультразвукового исследования (визуализация у пациентов с ожирением нередко значительно снижена, например, ультразвуковая картина калькулезного холецистита или мочекаменной болезни напрямую зависит от качества изображения), и интраоперационные находки могут удлинить время операции, что повышает градацию риска кровотечений. Также потребность в послеоперационном обезболивании и приеме препаратов, повышающих риск кровотечений у таких коморбидных пациентов встречается довольно часто. Функция почек у больных с сопутствующей сердечной недостаточностью на фоне анальгетиков также может снижаться. Поэтому существует вероятность реклассификации данного вмешательства в операцию с высоким риском кровопотери [14].
Важен вопрос по возобновлению АКТ. Если риск тромбоэмболических осложнений (как артериальных, так и венозных событий) высок, но могут быть интраоперационные факторы и послеоперационные последствия, не позволяющие восстановить прежний режим приёма ПОАК, тогда возможно использование парентеральных форм низкомолекулярного гепарина (НМГ)/нефракционированного гепарина (НФГ) до того момента, когда станет возможным возобновление терапии ПОАК (в данном случае речь идет не о терапии "моста", а о первичной профилактике венозных тромбоэмболических осложнений (ВТЭО)). Все это должно иметь отражение в истории болезни и зафиксировано как мнение консилиума междисциплинарной команды (хирург, терапевт, клинический фармаколог). Специалист амбулаторного звена в своих рекомендациях должен отразить, что время возобновления терапии будет установлено после оперативного вмешательства через 12–24 ч, а препарат, дозы и формы введения определены в раннем послеоперационном периоде.
Пациент с ФП, принимающий ПОАК, которому требуется плановая экстракция зуба (зубов)
Пациент, 65 лет, в анамнезе ГБ (контролируемая), сахарный диабет 2 типа, пароксизмальная форма ФП, планируется удаление разрушенного зуба с последующей имплантацией. Постоянно получает лозартан 50 мг + гидрохлоротиазид 12,5 мг, ривароксабан 20 мг/сут., метформин 2000 мг/сут., амиодарон 200 мг/сут.
В соответствии с предложенным алгоритмом (см. рис. 1) необходимо определить, к какому типу вмешательства по степени риска кровотечения относится экстракция зуба. Экстракция 1-3 зубов относится к вмешательствам с минимальным риском кровопотери, поэтому в рутинной ситуации может проводиться на фоне приёма АКТ.
Практические аспекты: в реальной практике проблема экстракции зубов у пациентов, получающих ПОАК, стоит довольно остро. Специалисты по дентальной хирургии нередко отменяют антикоагулянты вне сроков и регламентов клинических рекомендаций, без учёта риска тромбоэмболических осложнений. Поэтому целесообразно принимать это во внимание в работе кабинетов медицинской профилактики, и, если процедура экстракции зуба плановая, то для пожилого пациента, принимающего ПОАК, лучшей стратегией будет предварительная консультация терапевта по алгоритмам перипроцедуральной отмены ПОАК.
Однако нередко экстракция зуба возникает при острой боли с сопутствующей воспалительной инфильтрацией тканей. Если есть вероятность, что экстракция зуба может проходить с определёнными сложностями, например назначением антибактериальной терапии, приёмом НПВП, может быть сопряжена с отсутствием быстрого и стабильного гемостаза из-за длительно текущего воспалительного процесса, тогда следует рассмотреть периоперационную отмену ПОАК за 24 ч до вмешательства. В случае, если предполагается терапия НПВП продолжительностью от 3 до 10 дней на фоне приёма антикоагулянта, необходимо назначение ингибиторов протонной помпы (ИПП) с целью профилактики кровотечений из желудочно-кишечного тракта. Следует отдать предпочтение назначению селективного НПВП и назначить ИПП на срок приема НПВП при отсутствии других показаний к продолжению приема ИПП [15]. Таким образом, при принятии решения по тактике периоперационного ведения такого пациента необходимо минимизировать геморрагический риск и отменять АКТ строго по показаниям.
Пациент с ФП, у которого запланирована радикальная простатэктомия
Пациент, 75 лет, в анамнезе ГБ, пароксизмальная форма ФП. Постоянно получает периндоприл 5 мг + индапамид 1,25 мг/сут., ривароксабан 20 мг/сут., состоит на диспансерном учете у онколога. Направлен на консультацию терапевта перед плановой радикальной простатэктомией.
В соответствии с предложенным алгоритмом (см. рис. 1) необходимо определить, к какому типу вмешательства по риску кровотечения относится планируемая операция. Согласно рекомендациям ESC 2022 г. и РКО 2023 г., простатэктомия относится к вмешательствам с высоким риском кровопотери [8][9]. Учитывая, что пациент принимает ривароксабан, предполагается периоперационная отмена за 48 ч до вмешательства. Однако в этой ситуации важно учитывать планируемый тип анестезиологического пособия. В случае применения общей анестезии антикоагулянт должен быть отменён за 48 ч, при этом в случае применения нейроаксиального пособия срок отмены будет увеличиваться и составит 72 ч. В ситуациях, когда есть расхождение по срокам отмены, целесообразно руководствоваться более продолжительным периодом для снижения риска развития осложнений. При этом важно подчеркнуть, что терапия "моста" при отмене ПОАК даже за 72 ч не требуется.
Стоит отметить, что при решении вопроса о периоперационном ведении представленного пациента возникает вопрос о первичной профилактике ВТЭО при онкологической патологии (на практике рекомендовано использовать шкалу Хорана) и у пациентов хирургического профиля (шкала Каприни). У больных, принимающих ПОАК, введение НФГ или НМГ в периоперационном периоде было ассоциировано с повышением риска кровотечения без снижения частоты тромбоэмболических осложнений [8]. Поэтому большинству пациентов терапия "моста" не рекомендуется, за исключением тех, которые имеют высокий риск тромбообразования: больные с недавним (в течение 3 мес.) тромбоэмболическим событием (инсульт, системная эмболия или ВТЭО); пациенты, перенёсшие ВТЭО во время предыдущего перерыва в терапии ПОАК. Однако профилактику тромбозов в послеоперационном периоде с применением НМГ следует использовать у пациентов, у которых быстрое возобновление терапии ПОАК невозможно. У пациентов, находящихся на терапии "моста" с применением НМГ, может быть рассмотрен мониторинг анти-FXa активности с коррекцией дозы до целевого уровня 0,5-1,0 ЕД/мл [8].
В реальной практике в стационаре возможно перипроцедуральное назначение НМГ или НФГ в профилактических дозах с целью профилактики ВТЭО, однако такое назначение не является терапией "моста". Терапию ПОАК можно будет возобновить через 48 ч при условии достижения удовлетворительного гемостаза.
Пациент с ФП, которому планируется плановое эндопротезирование коленного сустава
Пациент, 60 лет, 3 года назад перенес плановое чрескожное коронарное вмешательство, стентирование ветви тупого края. В анамнезе пароксизмальная форма ФП, выполнена криобаллонная аблация, приступы не рецидивируют. Принимает ривароксабан 20 мг/сут., бисопролол 5 мг/сут., аторвастатин 40 мг + эзетимиб 10 мг. Направлен на консультацию терапевта перед плановой операцией (эндопротезирование левого коленного сустава).
Согласно рекомендациям ESC 2022 г. и РКО 2023 г., эндопротезирование коленного сустава относится к вмешательствам с высоким риском кровопотери, поэтому прерывание терапии ривароксабаном должно осуществляться за 48 ч при условии, если операция планируется под общей анестезией [8][9]. Достаточно часто замена коленного сустава проводится под эпидуральной анестезией. Согласно Российским рекомендациям, при нейроаксиальной анестезии пациентам, принимающим ривароксабан в терапевтических дозах, рекомендовано прерывание терапии за 72 ч до манипуляции [7][8]. Одновременно важно помнить, что большие ортопедические операции относятся к факторам высокого риска ВТЭО. Поэтому решение о необходимости первичной профилактики ВТЭО находится в зоне ответственности врачебной комиссии с записью в историю болезни. Возобновление терапии при проведении операций с высоким риском кровопотери происходит спустя 48 ч. В рекомендациях, которые кардиолог/терапевт дает по периоперационному ведению такого пациента, важно подчеркнуть, что при возобновлении терапии доза ривароксабана должна соответствовать таковой по показанию "фибрилляция предсердий" 20/15 мг (а не 10 мг по показанию "первичная профилактика ВТЭО при больших ортопедических операциях").
Заключение
Периоперационное ведение пациентов, получающих ПОАК при ФП, представляет сложную клиническую задачу. Врачам разных специальностей и уровней оказания медицинской помощи необходимо учитывать фармакокинетические особенности конкретных ПОАК, а также факторы, связанные с пациентом, планируемой хирургической процедурой и типом анестезиологического пособия при решении вопроса о периоперационном ведении пациента. Подход к отмене и возобновлению АКТ должен быть тщательно обоснован, учитывая риск тромбоэмболических и геморрагических осложнений. В неоднозначных случаях рекомендована мультидисциплинарная оценка для определения оптимальной тактики ведения пациента. Представленные в статье клинические сценарии демонстрируют необходимость индивидуального подхода к каждому случаю и важность учёта множества факторов при принятии решений о периоперационном ведении.
Отношения и деятельность. Маркова Е. Н., Кучиева Н. В., Навасардян А. Р. — сотрудники АО "Байер". Публикация статьи поддержана АО "Байер", что не повлияло на собственное мнение авторов.
Relationships and Activities. Markova E. N., Kuchieva N. V., Navasardyan A. R. is an employee of JSC Bayer. The publication of the article was supported by JSC Bayer, which did not affect the authors’ own opinion.
Финансирование: Нет.
Funding: None.
Список литературы
1. Hindricks G, Potpara T, Dagres N, et al. ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio- Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021;42(5):373-498. DOI: 10.1093/eurheartj/ehaa612.
2. Мареев Ю. В., Поляков Д. С., Виноградова Н. Г. и др. ЭПОХА: Эпидемиология фибрилляции предсердий в репрезентативной выборке Европейской части Российской Федерации. Кардиология. 2022;62(4):12-9. DOI: 10.18087/cardio.2022.4.n1997.
3. Шапкина М. Ю., Маздорова Е. В., Авдеева Е. М. и др. Динамика частоты фибрилляции предсердий в российской популяционной выборке за 13 лет наблюдения. Кардиоваскулярная терапия и профилактика. 2022;21(8):3108]. DOI: 10.15829/1728-8800-2022-3108.
4. Steffel J, Collins R, Antz M, et al.; External reviewers. 2021 European Heart Rhythm Association practical guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation. Europace. 2021;23(10):1612-76. DOI: 10.1093/europace/euab065.
5. Аракелян М. Г., Бокерия Л. А., Васильева Е. Ю. и др. Фибрилляция и трепетание предсердий. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(7):4594]. DOI: 10.15829/1560-4071-2021-4594.
6. Beyer-Westendorf J, Gelbricht V, Forster K, et al. Peri-interventional management of novel oral anticoagulants in daily care: results from the prospective Dresden NOAC registry. Eur Heart J. 2014;35(28):1888-96. DOI: 10.1093/eurheartj/eht557.
7. Заболотских И. Б., Киров М. Ю., Афончиков В. С. и др. Периоперационное ведение пациентов, получающих длительную антитромботическую терапию. Методические рекомендации Общероссийской общественной организации "Федерация анестезиологов и реаниматологов". Вестник интенсивной терапии им. А. И. Салтанова. 2021;(3):7-26. DOI: 10.21320/1818-474X-2021-3-7-26.
8. Сумин А. Н., Белялов Ф. И. Новые Российские рекомендации по оценке и коррекции сердечно- сосудистых рисков при несердечных операциях. Российский кардиологический журнал. 2023;28(4S):5704. DOI: 10.15829/1560-4071-2023-5704.
9. Halvorsen S, Mehilli J, Cassese S, et al.; ESC Scientific Document Group. 2022 ESC Guidelines on cardiovascular assessment and management of patients undergoing non-cardiac surgery. Eur Heart J. 2022;43(39):3826-924. DOI: 10.1093/eurheartj/ehac270.
10. Horlocker TT, Vandermeuelen E, Kopp SL, et al. Regional Anesthesia in the Patient Receiving Antithrombotic or Thrombolytic Therapy: American Society of Regional Anesthesia and Pain Medicine Evidence-Based Guidelines (Fourth Edition). Reg Anesth Pain Med. 2018;43(3):263-309. DOI: 10.1097/AAP.0000000000000763.
11. Doherty JU, Gluckman TJ, Hucker WJ, et al. 2017 ACC Expert Consensus Decision Pathway for Periprocedural Management of Anticoagulation in Patients With Nonvalvular Atrial Fibrillation: A Report of the American College of Cardiology Clinical Expert Consensus Document Task Force. J Am Coll Cardiol. 2017;69(7):871-98. DOI: 10.1016/j.jacc.2016.11.024.
12. Joglar JA, Chung MK, Armbruster AL, et al.; Peer Review Committee Members. 2023 ACC/AHA/ACCP/HRS Guideline for the Diagnosis and Management of Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2024;149(1):e1-156. DOI: 10.1161/CIR.0000000000001193.
13. Micheletta F, Ferrara M, Bertozzi G, et al. Proactive Risk Assessment through Failure Mode and Effect Analysis (FMEA) for Perioperative Management Model of Oral Anticoagulant Therapy: A Pilot Project. Int J Environ Res Public Health. 2022;19(24):16430. DOI: 10.3390/ijerph192416430.
14. Randall JA, Dennis SO, Brody F. Non-Cardiac Perioperative Mortality Factors at a Single Urban Veterans Affairs Medical Center. J Laparoendosc Adv Surg Tech A. 2024;34(11):980-84. DOI: 10.1089/lap.2024.0213.
15. Abrignani MG, Gatta L, Gabrielli D, et al. Gastroprotection in patients on antiplatelet and/or anticoagulant therapy: a position paper of National Association of Hospital Cardiologists (ANMCO) and the Italian Association of Hospital Gastroenterologists and Endoscopists (AIGO). Eur J Intern Med. 2021;85:1-13. DOI: 10.1016/j.ejim.2020.11.014.
Об авторах
Е. Н. МарковаРоссия
Елена Николаевна Маркова
Москва
Т. Ю. Веденикин
Россия
Тимофей Юрьевич Веденикин
Москва
А. А. Кузуб
Россия
Алина Александровна Кузуб
Псков
Н. В. Кучиева
Россия
Наталья Валерьевна Кучиева
Москва
А. Р. Навасардян
Россия
Артур Рубенович Навасардян
Москва
О. Н. Джиоева
Россия
Ольга Николаевна Джиоева
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Маркова Е.Н., Веденикин Т.Ю., Кузуб А.А., Кучиева Н.В., Навасардян А.Р., Джиоева О.Н. Практические аспекты периоперационного ведения пациентов с неклапанной фибрилляцией предсердий, получающих прямые пероральные антикоагулянты. Рациональная Фармакотерапия в Кардиологии. 2025;21(1):74-81. https://doi.org/10.20996/1819-6446-2025-3141
For citation:
Markova E.N., Vedenikin T.Yu., Kuzub A.A., Kuchieva N.V., Navasardyan A.R., Dzhioeva O.N. Practical aspects of perioperative management in patients with non-valvular atrial fibrillation receiving direct oral anticoagulants. Rational Pharmacotherapy in Cardiology. 2025;21(1):74-81. (In Russ.) https://doi.org/10.20996/1819-6446-2025-3141
JATS XML
















































