Перейти к:
Успешное лечение острой воспалительной кардиомиопатии у молодого пациента с новой коронавирусной инфекцией (клинический случай)
https://doi.org/10.20996/1819-6446-2025-3158
Аннотация
Миокардиальное повреждение при новой коронавирусной инфекции (COronaVIrus Disease 2019, COVID-19) преимущественно возникает у мужчин молодого возраста и сопряжено с тяжёлым течением, сомнительным прогнозом и высокой госпитальной летальностью, особенно в сочетании с повышением уровня тропонина и мозгового натрийуретического пептида. Кардиоваскулярные проявления могут возникать как в острый период заболевания, так и отсрочено, иметь краткосрочные (кардиогенный шок, тахиаритмия, острая сердечная недостаточность) и долгосрочные последствия (трансформация в дилатационную кардиомиопатию, хроническая сердечная недостаточность), предопределяя неблагоприятный исход. Представлено клиническое наблюдение пациента молодого возраста, госпитализированного в отделение реанимации и интенсивной терапии в связи с впервые развившейся острой левожелудочковой недостаточностью в виде отека лёгких на фоне тяжёлого течения COVID-19. В ходе обследования выявлено повышение маркеров миокардиального повреждения, дилатация всех камер сердца, снижение фракции выброса левого желудочка (ЛЖ) до 30 %, что свидетельствовало о миокардиальной дисфункции, а увеличение концентраций провоспалительных маркеров доказывало её воспалительный генез. Значительно повышенный уровень N-концевого фрагмента натрийуретического гормона и клинические признаки отека легких свидетельствовали об острой левожелудочковой недостаточности Killip III. Установлен заключительный клинический диагноз: острая воспалительная кардиомиопатия, осложнённая острой сердечной недостаточностью Killip III, тромб в полости ЛЖ на фоне COVID-19, внебольничной двухсторонней полисегментарной пневмонии, дыхательная недостаточность 3 ст. Вследствие своевременно начатой патогенетической терапии состояние пациента удалось стабилизировать и, несмотря на потенциально неблагоприятный прогноз, избежать летального исхода. Мониторинг клинического состояния пациента в течение 3 мес. после выписки выявил положительную динамику в виде рассасывания тромба в полости сердца, исчезновения признаков воспаления, незначительное увеличение фракции выброса ЛЖ, что позволяет думать о постепенном регрессе миокардиального повреждения.
Ключевые слова
Для цитирования:
Солдатова О.В., Горянская И.Я. Успешное лечение острой воспалительной кардиомиопатии у молодого пациента с новой коронавирусной инфекцией (клинический случай). Рациональная Фармакотерапия в Кардиологии. 2025;21(1):89-93. https://doi.org/10.20996/1819-6446-2025-3158
For citation:
Soldatova O.V., Goryanskaya I.Ya. Successful treatment of acute inflammatory cardiomyopathy in a young patient with COVID-19: a clinical case. Rational Pharmacotherapy in Cardiology. 2025;21(1):89-93. (In Russ.) https://doi.org/10.20996/1819-6446-2025-3158
Введение
Частота развития острого миокардиального повреждения, ассоциированного с новой коронавирусной инфекцией (COronaVIrus Disease 2019, COVID-19), весьма разнится, зависит от используемых диагностических критериев, составляя от 5 до 62% [1]. В условиях пандемии схожесть клинической симптоматики COVID-19 и миокардиального повреждения, наряду с диагностическими трудностями в проведении магнитно-резонансной томографии и эндомиокардиальной биопсии как основных методов верификации воспалительных заболеваний миокарда, непосредственно влияют на частоту диагностирования этого осложнения. Согласно опубликованным в 2021 г. результатам метаанализа, объединившим 26 исследований, миокардиальное повреждение возникало с частотой от 17 до 23% [1]. Первоначально считалось, что вирус SARS-CoV-2 (severe acute respiratory syndrome-related coronavirus-2) поражает респираторную систему, а появление симптоматики со стороны других органов и систем считается осложнением основного заболевания. Доказана возможность прямого инфицирования SARS-CoV-2 других органов, в тканях которых экспрессируется рецептор ангиотензинпревращающего фермента 2 (АПФ-2), ответственный за проникновение вируса в клетки человеческого организма [2]. Рецептор АПФ-2 не является тканеспецифичным и его экспрессия происходит в 72 различных типах клеток, расположенных в желудочно-кишечном тракте, печени, кардиоваскулярной, эндокринной, мочевыводящей и респираторной системах [3]. Прямое повреждающее действие SARS-CoV-2 на миокард может повлечь развитие миокардита, кардиомиопатии такоцубо либо инфаркта миокарда 1 типа [4]; опосредованное же действие может приводить к развитию нарушений ритма сердца, гипотонии, кардиогенного шока, остановки сердца, тромбоэмболий [5]. Так, по результатам немецкого исследования, при появлении острых кардиоваскулярных событий в период госпитализации по поводу COVID-19 госпитальная летальность возрастала почти в 5 раз [6].
Представлено клиническое наблюдение пациента молодого возраста с впервые развившейся острой левожелудочковой недостаточностью на фоне тяжёлого течения COVID-19.
Описание клинического случая
Пациент Д., мужчина 27 лет, переведён в отделение реанимации и интенсивной терапии Республиканского клинического кардиологического диспансера в тяжелом состоянии, обусловленном сердечно-лёгочной недостаточностью на фоне воспалительной кардиомиопатии, тяжёлой пневмонией, необходимостью проведения неинвазивной искусственной вентиляции лёгких, интоксикационным синдромом. При поступлении предъявлял жалобы на общую слабость, одышку в покое, усиливающуюся при движении, кровохарканье, учащённое сердцебиение, дискомфорт в левой половине грудной клетки.
Из анамнеза известно, что в течение недели до настоящей госпитализации больной находился на стационарном лечении по поводу COVID-19 (вирус SARS-CoV-2 идентифицирован) тяжёлого течения, внебольничной двухсторонней полисегментарной пневмонии, осложнённой дыхательной недостаточностью (ДН) 3 ст. По данным обследования, экспресс-тест антиген SARS-CoV-2 положительный; повышенные воспалительные маркеры крови; компьютерная томография органов грудной клетки (КТ ОГК) с внутривенным усилением — двухсторонняя полисегментарная пневмония, КТ-признаки альвеолярного отёка лёгких; эхокардиография (ЭхоКГ) — тромб в полости левого желудочка (ЛЖ), признаки перегрузки правых отделов сердца расценены как проявления тромбоэмболии мелких ветвей лёгочной артерии. Лечение осуществлялось согласно 16-й версии временных методических рекомендаций по профилактике, диагностике и лечению COVID-19. Из-за дальнейшего прогрессирования ДН и развития отёка лёгких переведён в клинический кардиологический диспансер с диагнозом: острый миокардит, осложнённый острой левожелудочковой недостаточность и формированием тромба в полости ЛЖ, тромбоэмболия лёгочной артерии мелких ветвей высокого риска (клинически), лёгочная гипертензия, ДН 3 степени.
Состояние пациента на момент поступления: сознание ясное, адекватен. Индекс массы тела — 27,1 кг/м². Кожный покров и видимые слизистые бледные, чистые, цианоз губ, отёков нет, тургор сохранён. Температура тела — 36,5° С. Проводится неинвазивная искусственная вентиляция лёгких. Частота дыхательных движений — 26 в мин. Сатурация кислорода (SaО2) — 80% без кислородной поддержки, 99% — при доле вдыхаемого кислорода (FiO2) 0,7. Аускультативно в лёгких дыхание жёсткое, фокусы влажных мелкопузырчатых хрипов в небольшом количестве с обеих сторон. Гемодинамика стабильная: тоны сердца приглушены, ритм правильный с частотой 102 уд./мин., артериальное давление — 110/60 мм рт.ст.
Лабораторные исследования при поступлении: в клиническом анализе крови — лейкоцитоз (лейкоциты — 23,88×10⁹/л), лимфопения (лимфоциты — 6%); гемостазиограмма: активированное частичное тромбопластиновое время — 29,3 с, протромбиновый индекс — 62%, международное нормализованное отношение — 1,61, фибриноген — 3,5 г/л, D-димер — 24 830 нг/мл. В биохимическом анализе крови отмечено повышение уровня С-реактивного белка — 57,8 мг/л, ферритина — 82,0 мкг/л, глюкозы — 7,12 ммоль/л, креатинина — 139 мкмоль/л, мочевины — 8,5 мкмоль/л, аланиновой трансферазы 58 МЕ/л, аспарагиновой трансферазы — 57 МЕ/л. Прокальцитонин — 0,02 нг/мл (норма <0,07 нг/мл). Бактериологический анализ крови стерилен. Маркеры миокардиального повреждения: миоглобин — 107,0 нг/мл (норма <70 нг/мл), тропонин I — 0,14 нг/мл (норма <0,01 нг/мл), миокардиальная фракция креатинфосфокиназы — 2,50 нг/мл. Антиядерные антитела (RNP/Sm, Sm, SS-A, Ro-52, SS-B, Scl-70, Jo-1, сentromere B, dsDNA, nucleosomes, histones, rib. P-prot) не обнаружены. N-концевой фрагмент натрийуретического пропептида В-типа (NT-proBNP) — 7137 пг/мл; другие значения лабораторных показателей были в пределах референсных значений.
Инструментальные исследования: на электрокардиограмме (ЭКГ) — синусовая тахикардия, электрическая ось сердца не отклонена, элевация сегмента ST в V4, V5, V6 на 0,5-1,5 мм с инверсией зубца Т (рис. 1). Данные трансторакальной ЭхоКГ: левое предсердие (ЛП) — 43 мм, индекс объёма ЛП — 40 мл/м², конечно-диастолический размер ЛЖ — 74 мм, конечно-систолический размер ЛЖ — 63 мм, индекс конечно-диастолического объёма ЛЖ — 138 мл/м², толщина задней стенки ЛЖ — 8 мм, толщина межжелудочковой перегородки — 8 мм, фракцией выброса ЛЖ по Simpson — 30%, правый желудочек — 18 мм. Умеренная дилатация ЛП, выраженная дилатация ЛЖ, клапаны интактны. В полости ЛЖ визуализируется подвижное фрагментированное эхо-негомогенное объёмное образование, фиксированное к задней стенке размером 28×27×26 мм — тромб в полости ЛЖ (рис. 2), сократительная способность миокарда резко диффузно снижена. Свободной жидкости в полости перикарда и плевральных полостях не выявлено.
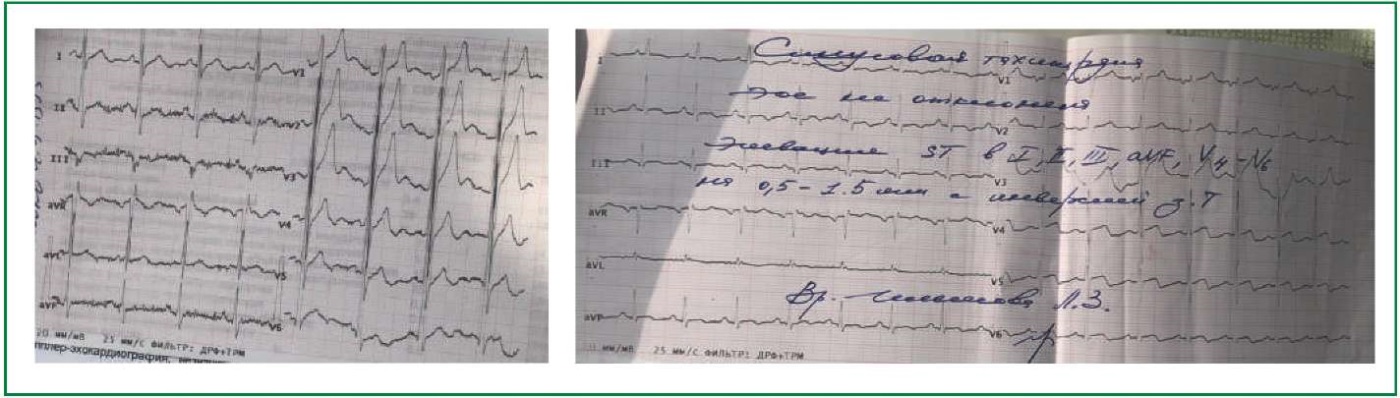
Рисунок 1. ЭКГ при поступлении.
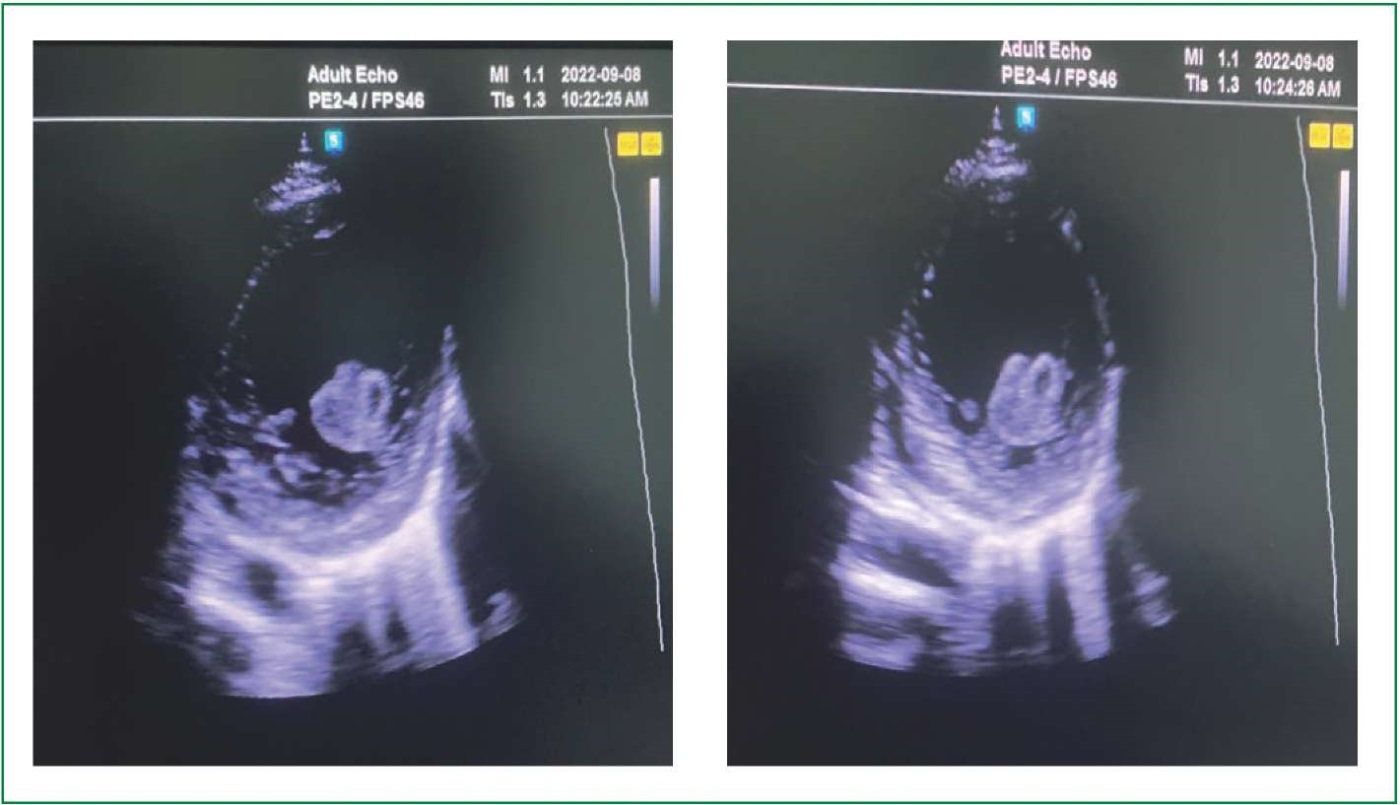
Рисунок 2. Фиксированный тромб в полости ЛЖ при трансторакальной ЭхоКГ (парастернальная позиция по короткой оси).
При проведении КТ ОГК выявлены консолидирующие участки лёгочной ткани в виде "матового стекла" более чем в 75% лёгких (КТ-4), подтверждена двусторонняя полисегментарная пневмония, признаков тромбоэмболии лёгочной артерии не выявлено.
Ультразвуковое триплексное ангиосканирование вен нижних конечностей: тромботических масс в просвете вен не выявлено.
Установлен клинический диагноз: острая воспалительная кардиомиопатия. Осложнения: острая сердечная недостаточность Killip III, тромб в полости ЛЖ на фоне COVID-19, внебольничной двухсторонней полисегментарной пневмонии, ДН 3 ст.
Начата соответствующая клиническим рекомендациям и стандартам оказания медицинской помощи терапия, включающая антикоагулянтную терапию (эноксапарин 0,8 мл/сут.), противовоспалительную (дексаметазон 8 мг/сут.), антибактериальную терапию (меропенем 3 г/сут.), лечение сердечной недостаточности (фуросемид 80 мг/сут., спиронолактон 50 мг/сут., метопролол 50 мг/сут., сакубитрил/валсартан 100 мг/сут., дапаглифлозин 10 мг/сут.). На фоне проводимой терапии состояние пациента удалось стабилизировать, и на 10 день госпитализации наблюдалось клиническое улучшение: уменьшилась выраженность симптомов сердечной недостаточности, разрешились лабораторные и клинические признаки интоксикации и воспаления, количество лейкоцитов, лимфоцитов, биохимические показателей крови и маркеры миокардиального воспаления достигли референсных значений, за исключением D-димера — 973 нг/мл и NT-proBNP — 3856 пг/мл. ЭКГ-картина оставалась стабильной: сохранялся синусовый ритм, не регистрировалась элевация сегмента ST, отмечалось нарушение процессов реполяризации в I, II, III, AVF, V4, V5, V6. Эхокардиографическая картина в динамике оставалась без существенных изменений показателей структурно-функционального состояние сердца; размеры тромба в полости ЛЖ сперва увеличились до 43×30×26 мм, эхоструктура его стала более гомогенной, а контуры — нечёткими, а затем фиксированный пристеночный тромб фрагментировался по меньшей мере на две части размерами 33×18×17 и 17×13×13 мм; сократительная способность миокарда ЛЖ оставалась резко сниженной.
На 21-й день госпитализации на фоне сохраняющегося умеренно выраженного астенического синдрома достигнута положительная динамика течения заболевания: уменьшились признаки сердечной недостаточности, в кислородной поддержке больной не нуждался, гемодинамика стабильная, данные ЭКГ без динамики. ЭхоКГ-показатели: нормализация размеров и объёмов всех камер сердца, за исключением сохраняющейся дилатации ЛЖ, некоторое уменьшение размеров до 28×26×19 мм и выраженности фрагментации тромба ЛЖ, сократительная способность миокарда ЛЖ резко диффузно снижена (фракция выброса — 33%). Проведена коррекция терапии: перевод на варфарин 5 мг/сут. под контролем протромбинового индекса и международного нормализованного отношения (целевое значение 2-3), отменены петлевые диуретики, уменьшена доза спиронолактона до 25 мг/сут., назначен метилпреднизолон 4 мг/сут. Пациент выписан в удовлетворительном состоянии под наблюдение кардиолога по месту жительства, рекомендации даны.
Спустя 3 мес. после выписки на контрольном амбулаторном приеме отмечается значительное улучшение клинических показателей: жалобы практически отсутствуют, сохраняется незначительная слабость при умеренной физической нагрузке, лабораторные показатели в пределах референсных значений (за исключением NT-proBNP — 1623 пг/мл), при суточном мониторировании ЭКГ: синусовый ритм со средней частотой сердечных сокращений 78 уд./мин., 2 одиночные желудочковые экстрасистолы, инверсия зубца Т в отведениях II, III, aVF; V4-V6; ST-T без диагностически значимой динамики. По данным ЭхоКГ: ЛП — 34 мм, индекс объёма ЛП — 20 мл/м², конечно-диастолический размер ЛЖ — 68 мм, конечно-систолический размер ЛЖ — 57 мм, индекс конечно-диастолического объёма ЛЖ — 122 мл/м², толщина задней стенки ЛЖ — 9 мм, толщина межжелудочковой перегородки — 9 мм, ФВ (по Simpson) — 38%, диаметр правого желудочка — 20 мм; сохранялась выраженная дилатация ЛЖ; клапаны интактны; патологические эхомассы/тромбы в полостях сердца не визуализируются, сократительная способность миокарда резко диффузно снижена; свободной жидкости в полости перикарда и плевральных полостях не выявлено. Рекомендовано продолжить четырёхкомпонентрую терапию сердечной недостаточности, которая включает эплеренон 25 мг/сут., метопролол 50 мг/сут., сакубитрил/валсартан 100 мг/сут., дапаглифлозин 10 мг/сут., под контролем уровня артериального давления и пульса, креатинина, калия в сыворотке крови.
Обсуждение
Воспалительное поражение миокарда согласно проекту Российских клинических рекомендаций1 2023 г. является миокардитом, а миокардит, повлекший развитие миокардиальной дисфункции, то есть систолической и/или диастолической дисфункцией ЛЖ — воспалительной кардиомиопатией.
У представленного пациента дебютом кардиоваскулярных проявлений был отёк легких как проявление декомпенсации левожелудочковой недостаточности на фоне острого инфекционного миокардита, ассоциированного с тяжёлым течением COVID-19. Повышенные сывороточные уровни маркеров воспаления и миокардиального повреждения, одновременно с неспецифическими ЭКГ-изменениями (элевация сегмента ST с инверсией зубца Т) и структурно-анатомическими изменениями сердца по ЭхоКГ: дилатация левых отделов со снижением его сократительной функции, подтвердили развитие воспалительной кардиомиопатии. Аутоиммунный характер повреждения миокарда был исключен из-за отсутствия сывороточных кардиальных аутоантител и отсутствия других клинических проявлений системных заболеваний соединительной ткани. Следовательно, вероятной причиной развития воспалительной кардиомиопатии рассматривалась смешанная инфекция. Во-первых, вирусная — COVID-19 (вирус SARS-CoV-2 идентифицирован) с достаточной доказательной базой кардиотропности вируса, во-вторых — бактериальная, в пользу которой свидетельствуют данные КТ ОГК (полисегментарная пневмония) и эффективность антибактериальной терапии. Из-за отсутствия возможности проведения магнитно-резонансной томографии и эндомиокардиальной биопсии не получено гистологическое подтверждение воспалительного заболевания миокарда и этиологическая идентификация генома вируса, что не является исключением и совпадает с данными литературы, где наиболее доступными методами верификации диагноза являлись ЭКГ, ЭхоКГ и лабораторные маркеры [7].
У пациента отмечалось значительное повышение сывороточной концентрации NT-proBNP вследствие острого миокардильного повреждения и дилатации левых отделов сердца (до 7137 пг/мл при поступлении), что свидетельствовало о тяжелом течении заболевания [8]. Однако на фоне проводимой патогенетической терапии концентрация данного маркера неуклонно снижалась до 3856 пг/мл на 10-й день госпитализации и 1623 пг/мл через 3 мес. как свидетельство регресса воспалительного повреждения, дилатации камер сердца и миокардиальной дисфункции. По результатам ЭхоКГ отмечалось уменьшение выраженности дилатации левых отделов сердца наряду с небольшим повышением фракции выброса ЛЖ с 30 до 38%, что также является результатом своевременно начатой эффективной патогенетической терапии хронической сердечной недостаточности и возможным залогом улучшения прогноза.
Заключение
Несмотря на доказанную высокую госпитальную летальность пациентов с миокардиальным повреждением на фоне COVID-19, сопровождающееся значительным повышением кардиальных маркеров, представленный клинический случай доказывает важность своевременной оценки функциональной способности кардиоваскулярной системы, маркеров воспаления и миокардиального повреждения у данной категории пациентов для профилактики, своевременной диагностики возникновения и эффективного применения патогенетических методов лечения миокардиального повреждения и предупреждения неблагоприятных исходов.
У пациента было получено письменное информированное согласие.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование: Нет.
Funding: None.
1. Клинические рекомендации. Миокардиты. 2023. https://scardio.ru/content/Guidelines/Proekt_2023_M.pdf
Список литературы
1. Chilazi M, Duffy EY, Thakkar A, Michos ED. COVID and Cardiovascular Disease: What We Know in 2021. Curr Atheroscler Rep. 2021;23(7):37. DOI: 10.1007/s11883-021-00935-2.
2. Shang J, Wan Y, Luo C, et al. Cell entry mechanisms of SARS-CoV-2. Proc Natl Acad Sci USA. 2020;117(21):11727-34. DOI: 10.1073/pnas.2003138117.
3. Harmer D, Gilbert M, Borman R, Clark KL. Quantitative mRNA expression profiling of ACE 2, a novel homologue of angiotensin converting enzyme. FEBS Lett. 2002;532(1-2):107-10. DOI: 10.1016/s0014-5793(02)03640-2.
4. Akhmerov A, Marbán E. COVID-19 and the Heart. Circ Res. 2020;126(10): 1443-55. DOI: 10.1161/CIRCRESAHA.120.317055.
5. Tavazzi G, Pellegrini C, Maurelli M, et al. Myocardial localization of coronavirus in COVID-19 cardiogenic shock. Eur J Heart Fail. 2020;22(5):911-5. DOI: 10.1002/ejhf.1828.
6. Gessler N, Gunawardene MA, Wohlmuth P, et al. Clinical outcome, risk assessment, and seasonal variation in hospitalized COVID-19 patients- Results from the CORONA Germany study. PLOS One. 2021;16(6):e0252867. DOI: 10.1371/journal.pone.0252867.
7. Castiello T, Georgiopoulos G, Finocchiaro G, et al. COVID-19 and myocarditis : a systematic review and overview of current challenges. Heart Fail Rev. 2022;27(1):251-61. DOI:10.1007/s10741-021-10087-9.
8. Gao L, Jiang D, Wen XS, et al. Prognostic value of NT-proBNP in patients with severe COVID-19. Respir Res. 2020;21(1):83. DOI: 10.1186/s12931-020-01352-w.
Об авторах
О. В. СолдатоваРоссия
Ольга Валериевна Солдатова
Симферополь
И. Я. Горянская
Россия
Ирина Ярославовна Горянская
Симферополь
Дополнительные файлы
Рецензия
Для цитирования:
Солдатова О.В., Горянская И.Я. Успешное лечение острой воспалительной кардиомиопатии у молодого пациента с новой коронавирусной инфекцией (клинический случай). Рациональная Фармакотерапия в Кардиологии. 2025;21(1):89-93. https://doi.org/10.20996/1819-6446-2025-3158
For citation:
Soldatova O.V., Goryanskaya I.Ya. Successful treatment of acute inflammatory cardiomyopathy in a young patient with COVID-19: a clinical case. Rational Pharmacotherapy in Cardiology. 2025;21(1):89-93. (In Russ.) https://doi.org/10.20996/1819-6446-2025-3158
JATS XML
















































