Перейти к:
Функциональное состояние терминальных мышечных артерий и распределительных артериол у мужчин с различным уровнем психосоциального стресса
https://doi.org/10.20996/1819-6446-2025-3217
EDN: IHECFM
Аннотация
Цель. Изучить функциональное состояние терминальных мышечных артерий и распределительных артериол кожи методом фотоплетизмографии (ФПГ) «на просвет» у мужчин трудоспособного возраста с различным уровнем психосоциального стресса (ПС).
Материал и методы. 200 мужчинам (50,9±1,0 лет) проведены: объективный осмотр, антропометрия, оценка уровня ПС с помощью теста Ридера (Reeder) в адаптации Копиной О. С., биохимический анализ крови (холестерин и липидный профиль, глюкоза, С-реактивный белок), суточное мониторирование артериального давления и ФПГ «на просвет» указательного пальца левой кисти. Все обследуемые были классифицированы на 5 упорядоченных групп в зависимости от распределения показателей стресса по квинтилям: 1-ю группу составили 43 мужчины с низким уровнем стресса (3,57-4,0 балла), 2-ю – 38 мужчин со средне-низким уровнем (3,28-3,43 балла), 3-ю – 41 мужчина со средним уровнем (2,9-3,14 балла), 4-ю – 47 мужчин со средне-высоким уровнем (2,57-2,9 балла) и 5-ю – 31 мужчина с высоким уровнем стресса (1,43-2,57 балла).
Результаты. Продемонстрировано статистически значимое увеличение скорости распространения пульсовой волны (aSI) у мужчин трудоспособного возраста по мере увеличения уровня ПС (р=0,042), а также незначимый тренд к большей сосудистой жесткости (Alp75) терминальных мышечных артерий и распределительных артериол в группах среднего и средне-высокого уровня ПС (р=0,089). Далее был проведен множественный регрессионный анализ с поправкой на индекс массы тела, суточное мониторирование артериального давления, курение, уровень холестерина, лекарственную терапию, который продемонстрировал, что артериальная жесткость (Alp75) больше в группах среднего (В=6,18; р=0,026) и средне-высокого (В=6,27; р=0,023) уровня ПС по сравнению с высоким. Значимых ассоциаций уровня ПС со скоростью распространения пульсовой волны (aSI) и тонусом гладкомышечных клеток (RI) терминальных мышечных артерий и распределительных артериол кожи у мужчин трудоспособного возраста не выявлено.
Заключение. У мужчин трудоспособного возраста со средним и средне-высоким уровнем ПС увеличение сосудистой жесткости, помимо эластических и крупно-эластических артерий, может развиваться и на уровне терминальных мышечных артерий и распределительных артериол кожи. Снижение уровня ПС с возможным сопутствующим уменьшением артериальной жесткости с целью снижения риска развития и прогрессирования сердечно-сосудистых заболеваний и улучшения качества жизни пациентов представляется актуальной терапевтической задачей.
Ключевые слова
Для цитирования:
Исайкина О.Ю., Королев А.И., Котова М.Б., Чащин М.Г., Черноусов П.А., Максимов С.А., Федорович А.А., Горшков А.Ю., Горбунов В.М. Функциональное состояние терминальных мышечных артерий и распределительных артериол у мужчин с различным уровнем психосоциального стресса. Рациональная Фармакотерапия в Кардиологии. 2025;21(4):327-334. https://doi.org/10.20996/1819-6446-2025-3217. EDN: IHECFM
For citation:
Isaykina O.Yu., Korolev A.I., Kotova M.B., Chashchin M.G., Chernousov P.A., Maksimov S.A., Fedorovich A.A., Gorshkov A.Yu., Gorbunov V.M. Functional state of terminal muscular arteries and distributing arterioles in men with different levels of psychosocial stress. Rational Pharmacotherapy in Cardiology. 2025;21(4):327-334. (In Russ.) https://doi.org/10.20996/1819-6446-2025-3217. EDN: IHECFM
Введение
По данным Всемирной организации здравоохранения, хронические неинфекционные заболевания, в структуре которых лидирующую позицию по-прежнему занимают сердечно-сосудистые заболевания (ССЗ) [1], являются ведущей причиной смерти во всем мире, определяя 74% от общего числа смертей в мире ежегодно1. Основные факторы риска (ФР), такие как повышенное артериальное давление (АД), курение и дислипидемия, во многом объясняют риск ССЗ, однако к настоящему времени накоплены убедительные данные, свидетельствующие о том, что психоэмоциональные факторы, и в первую очередь психосоциальный стресс (ПС), могут выступать не только медиаторами, но и служить причиной ССЗ [2-4]. Результаты исследований демонстрируют, что хронический ПС является одним из основных ФР развития широкого спектра хронических неинфекционных заболеваний, и в первую очередь артериальной гипертензии (АГ), а также аутоиммунных, нейродегенеративных заболеваний, психических расстройств и серьезного ухудшения здоровья и качества жизни, оказывая негативное влияние на трудоспособность [4][5]. Важность психосоциальных ФР, их раннего выявления и коррекции, была признана как европейскими [6], так и отечественными исследователями [7].
Известно, что ПС изменяет гемодинамические показатели, воздействует на гемостатические параметры, активирует провоспалительные реакции, вызывает нарушение обмена веществ [8]. Сосудистая система организма играет решающую роль в развитии функциональных и структурных изменений, ответственных за повреждение тканей и органов не только во время болезни и естественного старения, но, также, в ответ на стресс. Исследования показывают, что и физический, и эмоциональный стресс вызывают значительные гемодинамические изменения [9]. По данным зарубежных метаанализов и серьезных международных исследований, стресс связан с двукратным, а в некоторых работах и трехкратным увеличением риска развития ишемической болезни сердца [6], АГ, нарушения мозгового кровообращения [10], а в исследовании «MONICA-PSYCHOSOCIAL» и с 5-7-кратным риском развития АГ [11].
Дисрегуляция автономной нервной системы, наблюдаемая при хроническом стрессе, может играть свою роль [12]. Было обнаружено, что увеличение жесткости крупных артерий быстро развивается после стресс-индуцированной активации автономной нервной системы, крупные артериальные сосуды на стресс реагируют повышенным пульсовым давлением, которое, в свою очередь, влияет на эндотелий сосудов периферического и микроциркуляторного кровообращения, на уровне которых формируется большая часть общего периферического сосудистого сопротивления [9]. Однако, несмотря на имеющиеся убедительные данные о взаимосвязи повышения ПС с увеличением жесткости сосудистой стенки эластических и мышечно-эластических артерий, вопрос о наличии структурно-функциональных изменений терминальных мышечных артерий и распределительных артериол, где доминирует нейрогенный симпатический механизм регуляции сосудистого тонуса, у лиц с различным уровнем ПС остается недостаточно изученным.
Цель настоящего исследования — изучить функциональное состояние терминальных мышечных артерий и распределительных артериол методом фотоплетизмографии (ФПГ) «на просвет» у мужчин трудоспособного возраста с различным уровнем ПС.
Материал и методы
Объект исследования
В 1984 г. была сформирована репрезентативная популяционная выборка для длительного проспективного наблюдения динамики основных ФР ССЗ, в которую вошли школьники 11-12 лет (пятый класс), проживающие в г. Москве. Исходно были отобраны случайным образом 23 из 79 московских школ, в которых обучались 1182 мальчика указанного возраста, однако, в итоге были обследованы 1005 человек, что составило 85% от избранной популяции. За 40 лет проспективного наблюдения было проведено 8 обследований. В 2023-2024 гг. (8-й визит) в рамках государственного задания «Выявление ранних предикторов сердечно-сосудистых заболеваний и ассоциированных состояний по данным 40-летнего наблюдения за лицами мужского пола», проводимого в ФГБУ «НМИЦ ТПМ» Минздрава России были обследованы 227 представителя исходной популяционной выборки, из которых в анализ включены 200 мужчин (50,9±1,0 лет). Исследование выполнено в соответствии со стандартами надлежащей клинической практики (GCP) и принципами Хельсинкской декларации. Протокол исследования одобрен локальным этическим комитетом. Все субъекты дали письменное согласие на участие в исследовании.
Исследование включало: опрос по стандартной анкете (паспортные данные, сведения об образовании, социальном положении, личный и семейный анамнез, сведения о физической активности и вредных привычках — курении, потреблении алкоголя); объективный осмотр; измерение АД, роста, массы тела, окружности талии и бедер с вычислением индекса массы тела (ИМТ) по формуле Кеттле: Кетле=масса тела (кг)/рост (м2); биохимический анализ крови; ФПГ «на просвет» указательного пальца левой кисти; определение уровня ПС; суточное мониторирование АД.
Биохимический анализ крови
Уровни общего холестерина, триглицеридов, холестерина (ХС) липопротеинов высокой плотности, С-реактивного белка, глюкозы определяли в сыворотке крови с помощью автоматического анализатора Architect C8000 («Abbott», США); уровень ХС липопротеинов низкой плотности — расчетным методом по Фридвальду, уровень ХС липопротеинов очень низкой плотности — расчетным методом по формуле: ХС липопротеинов очень низкой плотности=триглицериды/2,18.
ФПГ
Функциональное состояние терминальных мышечных артерий и распределительных артериол изучали методом ФПГ «на просвет» с использованием программно-аппаратного комплекса «Ангиоскан-01» (ООО «Ангиоскан», Москва, Россия). В основе метода лежит регистрация пульсовой волны (ПВ) объема (рис. 1Б) с помощью оптического датчика, который устанавливается на ногтевой фаланге пальцев конечностей. В приборе в качестве источников излучения применяются светодиоды с двумя длинами волн в ближней инфракрасной области спектра (680 нм и 870 нм), что позволяет фотонам проходить через все толщу ногтевой фаланги пальца и захватывать более крупные артериолы, в которых доминирует нейрогенный механизм регуляции вазомоторной активности. Оптический датчик устанавливался на концевую фалангу указательного пальца левой кисти (рис. 1А). Исследование проводили в лаборатории с постоянно поддерживаемым микроклиматом (температура воздуха +23±1 °C; влажность воздуха 40-60%).
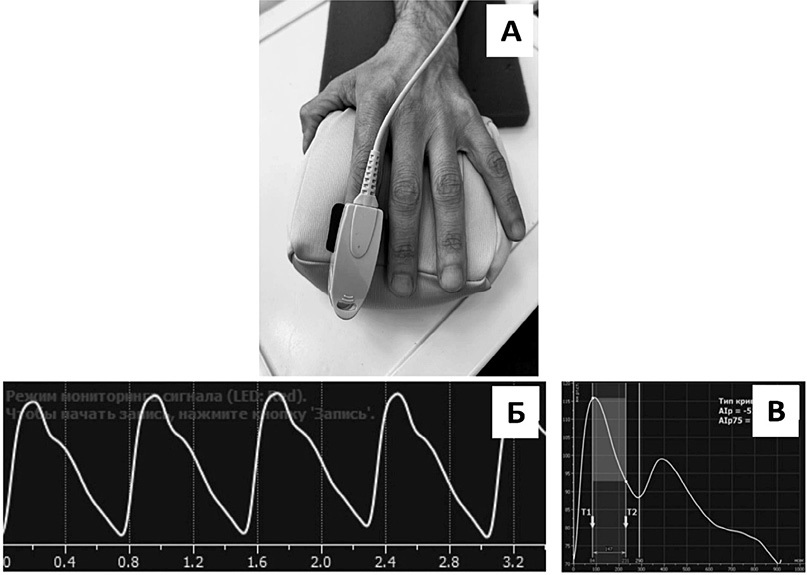
Рисунок 1. Фотоплетизмография.
А — расположение датчика на ногтевой фаланге указательного пальца левой кисти; Б — фотоплетизмограмма; В — контурный анализ пульсовой волны
По результатам контурного анализа ПВ (рис. 1В) на протяжении 10 мин определяли следующие параметры: 1) Alp75 (%) — расчетный индекс аугментации, корригированный по частоте сердечных сокращений 75 уд./мин, который характеризует вклад давления отраженной ПВ в пульсовое АД и жесткость сосудистой стенки; 2) индекс жесткости (aSI) (м/с) — расчетный показатель, отражающий среднюю скорость распространения ПВ (СРПВ); 3) индекс отражения (RI) (%) — расчетный параметр, характеризующий тонус гладкомышечных клеток (ГМК) терминальных мышечных артерий и распределительных артериол.
Суточное мониторирование АД
Суточное мониторирование АД производилось в амбулаторных условиях с использованием аппарата BpLab (ООО «Петр Телегин», Россия) согласно стандартной методике после проведения всех этапов обследования (начало мониторинга в 12:00–13:00). Манжета тонометра располагалась на левом плече. Интервал измерения АД в активное время суток составлял 15 мин, в ночные часы — 30 мин. Метод регистрации — осциллометрический.
Оценка ПС
В качестве метода экспресс-диагностики уровня ПС использовали тест Ридера (Reeder) в адаптации О. С. Копиной и соавт. (1996 г.) [13]. В целях обеспечения сопоставимости и достаточного числа субъектов в сравниваемых группах все участники исследования были классифицированы на 5 упорядоченных групп в зависимости от распределения показателей стресса по квинтилям: 1-ю группу составили 43 мужчины с низким уровнем стресса (3,57-4,0 балла), 2-ю — 38 мужчин со средне-низким уровнем стресса
(3,28-3,43 балла), 3-ю — 41 мужчина со средним уровнем стресса (2,9-3,14 балла), 4-ю — 47 мужчин со средне-высоким уровнем (2,57-2,9 балла) и 5-ю — 31 мужчина с высоким уровнем стресса (1,43-2,57 балла).
Статистические методы
Статистическую обработку данных выполняли с помощью программного пакета SPSS 22. Проверка количественных показателей на нормальность распределения осуществлялась с использованием критерия Колмогорова–Смирнова с коррекцией Лильефорса. Количественные данные представлены средним значением и стандартным отклонением (m±SD), качественные данные — в виде абсолютных и относительных величин n (%). Для оценки различий количественных показателей применялся критерий Краскела—Уоллиса, с последующим апостериорным сравнением с помощью критерия Манна—Уитни. Для оценки различий качественных показателей использовался критерий χ2 Пирсона, при малом числе наблюдений в ячейках таблиц сопряженности применялся точный критерий Фишера. Для оценки ассоциаций уровня стресса с показателями ФПГ применялись обобщенные линейные модели регрессии, рассчитывался В-коэффициент эластичности и уровень статистической значимости. В регрессионные модели для корректировки на возможное модифицирующее влияние вводилась поправка на суточное мониторирование АД, статус курения, лекарственную терапию, ИМТ и уровень ХС. Статистическая значимость определена на уровне ошибки первого рода и соответствовала 5%.
Результаты
Основные характеристики участников исследования представлены в табл. 1. Статистически значимых различий социально-демографических и клинических характеристик выборки в связи с различным уровнем стресса обнаружено не было, кроме показателя «курение».
Таблица 1. Распределение социально-демографических характеристик и клинических показателей в группах лиц мужского пола с различным уровнем ПС
Группа, n | Уровень стресса, ٪ (n) | Р-уровень | |||||
Низкий | Средне-низкий | Средний | Средне-высокий | Высокий | |||
Семейный статус | Есть семья, n=154 | 20,1 (31) | 18,8 (29) | 22,1 (34) | 23,4 (36) | 15,6 (24) | 0,842 |
Нет семьи, n=46 | 26,1 (12) | 19,6 (9) | 15,2 (7) | 23,9 (11) | 15,2 (7) | ||
Социальное положение | «Белые воротнички», n=152 | 19,7 (30) | 19,7 (30) | 19,7 (30) | 25,7 (39) | 15,1 (23) | 0,585 |
«Синие воротнички», n=39 | 25,6 (10) | 17,9 (7) | 20,5 (8) | 20,5 (8) | 15,4 (6) | ||
Не работают, n=5 | 60 (3) | 0 | 20 (1) | 0 | 20 (1) | ||
Образование | Высшее, n=128 | 19,5 (25) | 22,7 (29) | 18,0 (23) | 21,9 (28) | 18,0 (23) | 0,195 |
Не высшее,n=72 | 25,0 (18) | 12,5 (9) | 25,0 (18) | 26,4 (19) | 11,1 (8) | ||
Наличие детей | Есть дети, n=173 | 22,0 (38) | 20,2 (35) | 20,2 (35) | 22,5 (39) | 15 (26) | 0,758 |
Нет детей, n=27 | 18,5 (5) | 11,1 (3) | 22,2 (6) | 29,6 (8) | 18,5 (5) | ||
Курение | Курит | 60,5 (26) | 26,3 (10) | 31,7 (13) | 36,2 (17) | 25,8 (8) | 0,008 |
Курил, но бросил | 18,6 (8) | 28,9 (11) | 46,3 (19) | 25,5 (12) | 38,7 (12) | ||
Никогда не курил | 20,9 (9) | 44,7 (17) | 22,0 (9) | 38,3 (18) | 35,5 (11) | ||
Прием АГТ препаратов | Да | 32,6 (14) | 39,5 (15) | 34,1 (14) | 29,8 (14) | 19,4 (6) | 0,484 |
Нет | 67,4 (29) | 60,5 (23) | 65,9 (27) | 70,2 (33) | 80,6 (25) | ||
АГ (по СМАД) | Есть | 83,8 (14) | 63,6 (15) | 75,0 (14) | 82,9 (14) | 14,1 (19) | 0,236 |
Нет | 16,2 (29) | 36,4 (23) | 25,0 (27) | 17,1 (33) | 18,6 (8) | ||
Холестерин (m±SD) | 5,8±1,3 | 5,4±1,2 | 5,5±1,0 | 5,5±1,2 | 5,6±1,2 | 0,456 | |
АГТ — антигипертензивная терапия, СМАД — суточное мониторирование артериального давления, ПС — психосоциальный стресс
Результаты ФПГ представлены в табл. 2. Из полученных данных видно, что у мужчин трудоспособного возраста по мере увеличения уровня ПС наблюдается статистически значимое повышение СРПВ (aSI) терминальных мышечных артерий и распределительных артериол (р=0,042). Также отмечен статистически незначимый тренд к большей сосудистой жесткости (Alp75) терминальных мышечных артерий и распределительных артериол в группах среднего и средне-высокого уровня стресса (р=0,089). Статистически значимых межгрупповых различий по величине тонуса ГМК (RI) изучаемых сосудов в зависимости от уровня ПС не выявлено.
Таблица 2. Распределение показателей ФПГ в группах лиц мужского пола с различным уровнем ПС
Показатель (m±SD) | Группы стресса | р | ||||
Низкий | Средне-низкий | Средний | Средне- высокий | Высокий | ||
Alp75 (%) | 3,33±11,56 | 2,34±11,27 | 7,54±12,67 | 6,23±11,18 | 0,86±12,24 | 0,089 |
aSI (м/с) | 8,76±2,34 | 7,73±1,04 | 7,60±1,87 | 8,07±1,84 | 8,45±2,17 | 0,042 |
RI (%) | 33,16±12,64 | 32,94±12,73 | 30,41±12,86 | 33,58±11,53 | 30,93±10,31 | 0,709 |
Alp75 (%) — расчетный индекс аугментации в %, корригированный по частоте сердечных сокращений 75 уд./мин; aSI (м/сек) — индекс жесткости; RI (%) — индекс отражения, ФПГ — фотоплетизмография
С учетом предполагаемого влияния на функциональное состояние терминальных мышечных артерий и распределительных артериол кожи таких факторов, как уровень АД, курение, прием антигипертензивной терапии, ИМТ, ХС, был проведен множественный регрессионный анализ с корректировкой на вышеуказанные показатели. Результаты проведенного анализа (табл. 3) продемонстрировали, что артериальная жесткость (Alp75) больше в группах среднего (В=6,18; р=0,026) и средне-высокого (В=6,27; р=0,023) уровня ПС по сравнению с высоким. Значимых ассоциаций уровня ПС с СРПВ (aSI) и тонусом ГМК (RI) изучаемых сосудов у мужчин трудоспособного возраста не выявлено.
Таблица 3. Результаты линейного регрессионного анализа ассоциации уровня ПС с показателями ФПГ
Зависимая переменная | Уровень стресса | ||||||||
Низкий | Средне-низкий | Средний | Средне-высокий | Высокий | |||||
B-коэфф. | р | B-коэфф. | p | B-коэфф. | p | B-коэфф. | p | ||
Alp75 (%) | 1,51 | 0,601 | 2,55 | 0,38 | 6,18 | 0,026 | 6,27 | 0,023 | референс |
aSI (м/с) | 0,156 | 0,740 | -0,486 | 0,298 | -0,719 | 0,111 | -0,231 | 0,606 | референс |
RI (%) | 3,189 | 0,293 | 1,880 | 0,533 | 0,281 | 0,923 | 3,517 | 0,224 | референс |
Поправка на СМАД, курение, лекарственную терапию, ИМТ, ХС; Alp75 (%) — расчетный индекс аугментации в %, корригированный по частоте сердечных сокращений 75 уд./мин; aSI (м/сек) — индекс жесткости; RI (%) — индекс отражения, ПС — психосоциальный стресс, ФПГ — фотоплетизмография
Обсуждение
В настоящее время признано, что наряду с классическими ФР ССЗ, такими как курение, АГ, дислипидемия и др., ПС играет немаловажную, и, вероятно, сопоставимую по значимости роль в развитии заболеваний сердечно-сосудистой системы [7][11][14-16]. Это обусловлено тем, что ПС приводит к активации симпатической нервной системы (СНС) с одномоментным угнетением активности парасимпатической регуляции, увеличению уровня циркулирующих катехоламинов, что не только повышает тонус ГМК, но и способствует повреждению экзосом и выделению молекулярных фрагментов, ассоциированных с повреждением, которые могут инициировать и поддерживать неинфекционный воспалительный ответ [17]. Подобные патологические изменения являются причиной митохондриального повреждения, эндотелиальной дисфункции [18] и ремоделирования сосудистой стенки, что влечет за собой увеличение сосудистой жесткости [19] и способствует развитию АГ [20] и атеросклероза [21]. Помимо поражения крупных мышечно-эластических артерий, в патологический процесс могут вовлекаться и сосуды периферического, и микроциркуляторного кровообращения [17], в частности, терминальные мышечные артерии и распределительные артериолы, в которых доминирующим механизмом регуляции сосудистого тонуса является нейрогенный. Однако работы, посвященные изучению функционального состояния вышеназванных артериальных звеньев у лиц с различным уровнем ПС, при поиске в библиографических базах данных выявить не удалось.
В настоящей работе впервые изучено функциональное состояние терминальных мышечных артерий и распределительных артериол кожи методом ФПГ «на просвет» у мужчин трудоспособного возраста с различным уровнем ПС. Результаты первичного анализа данных ФПГ продемонстрировали увеличение СРПВ (aSI) изучаемых звеньев артериальной системы у мужчин трудоспособного возраста по мере возрастания уровня ПС. Парадоксально, но мужчины группы низкого стресса имели наибольшие значения данного показателя, что может быть связано с большей распространенностью курения (60,5%) в данной группе как одного из доступных способов расслабления и уменьшения уровня стресса, но в то же время оказывающего еще более негативное воздействие на сосудистую стенку. Подтверждением этому являются результаты исследований, в ходе которых продемонстрированы негативные эффекты курения в виде повышения сосудистой жесткости как эластических и крупных мышечно-эластических артерий, так и сосудов периферического артериального русла у условно здоровых лиц и у пациентов с различными ССЗ [22-25].
Проведенный в настоящем исследовании регрессионный анализ с корректировкой на курение, уровень АД, ИМТ, ХС и антигипертензивную терапию показал резкое, статистически значимое, увеличение артериальной жесткости (Alp75) в группах мужчин со средним и средне-высоким уровнем ПС, что указывает на высокую вероятность влияния стресса на функциональное состояние изучаемых сосудов, и в данном исследовании, на повышение сосудистой жесткости терминальных мышечных артерий и распределительных артериол кожи у мужчин среднего возраста. Однако значимых различий по СРПВ (SI) и тонусу ГМК (RI) изучаемых сосудов не выявлено, что возможно связано с недостаточным количеством наблюдений.
Таким образом, результаты настоящего исследования могут указывать на то, что средний и средне-высокий уровень ПС является самостоятельным ФР повышения сосудистой жесткости терминальных мышечных артерий и распределительных артериол кожи у мужчин трудоспособного возраста.
Многочисленные исследования показывают, что сосудистая жесткость является показателем функционального состояния артерий и зависит от множества параметров, среди которых особое значение придается вазодилататорной и вазоконстрикторной функции эндотелия [26]; тонусу, пролиферации и эутрофии/гипертрофии ГМК [27][28]; соотношению эластических компонентов и коллагена в сосудистой стенке [29], которые в совокупности со множеством других факторов и определяют эластические свойства и диаметр просвета сосудов. В свою очередь, автономная нервная система, и, в частности, ее симпатическая часть, является ключевым модулятором сосудистого тонуса, что осуществляется за счет регуляции сократительной активности ГМК путем активации α- и β-адренорецепторов на их мембране циркулирующими в системном кровотоке катехоламинами или норадреналином на уровне нейромышечных синапсов [30]. Продемонстрировано, что гиперактивация СНС, которая наблюдается в условиях повышенного ПС, может не только непосредственно вызывать увеличение тонуса ГМК, но и оказывать негативное влияние и на другие вышеперечисленные параметры, определяющие сосудистую жесткость. Так, M.L. Goodson и соавт. на экспериментальной животной модели продемонстрировали, что хронический стресс вызывает увеличение артериальной жесткости эластических артерий, обусловленное повышенным отложением коллагена в адвентиции и их ремоделированием, что сопровождается повышением пульсового давления в покое [31]. Результаты клинических исследований демонстрируют, что хроническая гиперактивация СНС снижает вазодилататорную функцию эндотелия в различных клинических ситуациях, ассоциированных с повышенным риском ССЗ [32][33], а показатели сосудистой жесткости, такие как индекс аугментации, индекс ПВ или СРПВ, артериальных звеньев разного калибра повышаются с ростом активности СНС как у здоровых лиц, так и у лиц, страдающих ССЗ [34-37]. Результаты настоящего исследования свидетельствуют о том, что увеличение сосудистой жесткости у мужчин трудоспособного возраста со средним и средне-высоким уровнем ПС помимо эластических и мышечно-эластических артерий, состояние которых в настоящей работе не оценивалось, может развиваться и на уровне терминальных мышечных артерий и распределительных артериол, которые регулируют поступление крови в микроциркуляторное русло, где осуществляются обменные процессы. Учитывая то, что в настоящем исследовании значимых межгрупповых различий по уровню тонуса ГМК (RI) не выявлено, можно сделать вывод, что увеличение уровня ПС не оказывает влияние на базальный тонус ГМК терминальных мышечных артерий и распределительных артериол кожи, а увеличение сосудистой жесткости может быть обусловлено другими причинами, такими как эндотелиальная дисфункция и ремоделирование артерий. Подтверждение данной гипотезы требует проведения дальнейших исследований, однако, следует отметить, что артериолы кожи не подвержены системной барорефлекторной регуляции, в связи с чем они могут не отражать в полной мере системное влияние СНС на сократительную активность ГМК при ее гиперактивации в условиях повышения ПС.
Интересным является то, что мужчины трудоспособного возраста с наибольшим уровнем ПС продемонстрировали меньшую артериальную жесткость по сравнению с группами среднего и средне-высокого ПС. Это может указывать на еще достаточную адаптационную способность сосудов реагировать на довольно большие стрессовые нагрузки. Тем более возраст наших обследованных сравнительно молодой. Однако при повышении возраста стрессовая нагрузка, особенно хроническая, может стать крайне вредной, т.к. способствует долгосрочной дисрегуляции гомеостаза и может рассматриваться как кумулятивный «износ» организма, что в дальнейшем приведет к увеличению жесткости сосудов и серьезным ССЗ. Для подтверждения данной гипотезы требуется проведение дальнейших проспективных исследований, направленных на изучение долгосрочных структурно-функциональных изменений терминальных мышечных артерий и распределительных артериол в условиях хронического ПС и их обратимости на фоне медикаментозного и немедикаментозного лечения.
Заключение
Результаты настоящего исследования продемонстрировали, что у мужчин трудоспособного возраста со средним и средне-высоким уровнем ПС увеличение сосудистой жесткости, помимо эластических и крупно-эластических артерий, может развиваться и на уровне терминальных мышечных артерий и распределительных артериол. При этом, отсутствие значимых различий по базальному тонусу ГМК может указывать на то, что повышение артериальной жесткости у данной группы обследуемых происходит вследствие эндотелиальной дисфункции и ремоделирования артерий с отложением коллагена и деструкцией эластических компонентов сосудистой стенки, и не связано с повышением базального тонуса ГМК в ответ на гиперактивацию СНС, присущую хроническому ПС. Несомненно, снижение уровня ПС с возможным сопутствующим уменьшением жесткости стенки терминальных мышечных артерий и распределительных артериол будет способствовать снижению риска развития и прогрессирования ССЗ и улучшению качества жизни пациентов. В данном контексте особенно актуальным представляется необходимость разработки рекомендаций поведенческих методов, стратегий, способов, а также фармакологических средств, которые могут предотвратить и снизить эту патологическую последовательность событий.
1. World Health Organization. Global report on hypertension: the race against a silent killer. Geneva, 2023, 276P. https://www.who.int/publications/i/item/9789240081062.
Список литературы
1. Benjamin EJ, Virani SS, Callaway CW, et al.; American Heart Association Council on Epidemiology and Prevention Statistics Committee and Stroke Statistics Subcommittee. Heart disease and stroke statistics — 2018 Update: A Report From the American Heart Association. Circulation. 2018;137(12):e67-492. DOI:10.1161/CIR.0000000000000558. Erratum in: Circulation. 2018;137(12):e493. DOI:10.1161/CIR.0000000000000573.
2. Rozanski A. Psychosocial risk factors and cardiovascular disease: epidemiology, screening, and treatment considerations. Cardiovascular Innovations and Applications. 2016;1(4):417-31. DOI:10.15212/CVIA.2016.0033.
3. Погосова Н.В., Бойцов С.А., Оганов Р.Г. и др. Психосоциальные факторы риска у амбулаторных пациентов с артериальной гипертонией и ишемической болезнью сердца в 30 городах России: по данным исследования КОМЕТА. Кардиология. 2018;58(11):5-16. DOI:10.18087/cardio.2018.11.10193.
4. Котова М.Б., Розанов В.Б., Александров А.А., Драпкина О.М. Ассоциация психосоциального стресса с социальнопсихологической средой, образом жизни и факторами риска сердечнососудистых заболеваний у мужчин среднего возраста, проживающих в г. Москве. Российский кардиологический журнал. 2021;26(5):94-102. DOI:10.15829/1560-4071-2021-4335.
5. Picard K, St-Pierre MK, Vecchiarelli HA, et al. Neuroendocrine, neuroinflammatory and pathological outcomes of chronic stress: A story of microglial remodeling. Neurochem Int. 2021;145:104987. DOI:10.1016/j.neuint.2021.104987.
6. Nielsen NR, Kristensen TS, Prescott E, et al. Perceived stress and risk of ischemic heart disease: causation or bias? Epidemiology. 2006;17(4):391-7. DOI:10.1097/01.ede.0000220556.86419.76.
7. Гоманова Л.И., Баланова Ю.А., Шальнова С.А., и др. Медико-социальный портрет человека с высоким уровнем психоэмоционального стресса — обоснование профилактики хронических неинфекционных заболеваний. Данные ЭССЕ-РФ и ЭССЕ-РФ2. Комплексные проблемы сердечно-сосудистых заболеваний. 2025;14(1):37-50. DOI:10.17802/2306-1278-2025-14-1-37-50.
8. Sara JDS, Toya T, Ahmad A. et al. Mental Stress and Its Effects on Vascular Health. Mayo Clin Proc. 2022;97(5):951-90. DOI:10.1016/j.mayocp.2022.02.004.
9. Plante GE. Vascular response to stress in health and disease. Metabolism. 2002;51(6 Suppl 1):25-30. DOI:10.1053/meta.2002.33187.
10. Gallo LC, Roesch SC, Fortmann AL, et al. Associations of chronic stress burden, perceived stress, and traumatic stress with cardiovascular disease prevalence and risk factors in the Hispanic Community Health Study/Study of Latinos Sociocultural Ancillary Study. Psychosom Med. 2014;76(6):468-75. DOI:10.1097/PSY.0000000000000069.
11. Гафаров В.В., Громова Е.А., Гагулин Е.А., Гафарова А.В. Изучение влияния стресса на риск артериальной гипертензии в открытой популяции среди мужчин 25-64 лет (эпидемиологическое исследование на основе программы ВОЗ «MONICA-PSYCHOSOCIAL»). Артериальная гипертензия. 2013;19(1):27-31. DOI:10.18705/1607-419X-2013-19-1-27-31.
12. McDermott CE, Salowe RJ, Di Rosa I, O’Brien JM. Stress, Allostatic Load, and Neuroinflammation: Implications for Racial and Socioeconomic Health Disparities in Glaucoma. Int J Mol Sci. 2024;25(3):1653. DOI:10.3390/ijms25031653.
13. Копина О.С., Суслова Е.А., Заикин Е.В. Популяционные исследования психосоциального стресса как фактора риска сердечно-сосудистых заболеваний. Кардиология. 1996;(3):53-6.
14. Rosengren A, Hawken S, Ounpuu S, et al.; INTERHEART investigators. Association of psychosocial risk factors with risk of acute myocardial infarction in 11119 cases and 13648 controls from 52 countries (the INTERHEART study): case-control study. Lancet. 2004;364(9438):953-62. DOI:10.1016/S0140-6736(04)17019-0.
15. Santosa A, Rosengren A, Ramasundarahettige C, et al. Psychosocial Risk Factors and Cardiovascular Disease and Death in a Population-Based Cohort From 21 Low-, Middle-, and High-Income Countries. JAMA Netw Open. 2021;4(12):e2138920. DOI:10.1001/jamanetworkopen.2021.38920. Erratum in: JAMA Netw Open. 2022;5(4):e2210663. DOI:10.1001/jamanetworkopen.2022.10663.
16. Осипова И.В., Пырикова Н.В., Антропова О.Н. и др. Влияние психосоциального стресса на факторы риска сердечно-сосудистых заболеваний у мужчин. Кардиология. 2014;54(3):42-5.
17. Fleshner M, Crane CR. Exosomes, DAMPs and miRNA: Features of Stress Physiology and Immune Homeostasis. Trends Immunol. 2017;38(10):768-76. DOI:10.1016/j.it.2017.08.002.
18. Mocayar Marón FJ, Ferder L, Saraví FD, Manucha W. Hypertension linked to allostatic load: from psychosocial stress to inflammation and mitochondrial dysfunction. Stress. 2019;22(2):169-81. DOI:10.1080/10253890.2018.1542683.
19. Massamba VK, Talbot D, Milot A, et al. Association between psychosocial work-related factors at midlife and arterial stiffness at older age in a prospective cohort of 1736 white-collar workers. BMJ Open. 2023;13(9):e073649. DOI:10.1136/bmjopen-2023-073649.
20. Liu MY, Li N, Li WA, Khan H. Association between psychosocial stress and hypertension: a systematic review and meta-analysis. Neurol Res. 2017;39(6):573-80. DOI:10.1080/01616412.2017.1317904.
21. Kaplan JR, Pettersson K, Manuck SB, Olsson G. Role of sympathoadrenal medullary activation in the initiation and progression of atherosclerosis. Circulation. 1991;84(6 Suppl):VI23-32.
22. Rhee MY, Na SH, Kim YK, et al. Acute effects of cigarette smoking on arterial stiffness and blood pressure in male smokers with hypertension. Am J Hypertens. 2007;20(6):637-41. DOI:10.1016/j.amjhyper.2006.12.017.
23. Adamopoulos D, Argacha JF, Gujic M, et al. Acute effects of nicotine on arterial stiffness and wave reflection in healthy young non-smokers. Clin Exp Pharmacol Physiol. 2009;36(8):784-9. DOI:10.1111/j.1440-1681.2009.05141.x.
24. Argacha JF, Adamopoulos D, Gujic M, et al. Acute effects of passive smoking on peripheral vascular function. Hypertension. 2008;51(6):1506-11. DOI:10.1161/HYPERTENSIONAHA.107.104059.
25. Goebel I, Mohr T, Axt PN, et al. Impact of Heated Tobacco Products, E-Cigarettes, and Combustible Cigarettes on Small Airways and Arterial Stiffness. Toxics. 2023;11(9):758. DOI:10.3390/toxics11090758.
26. Hooglugt A, Klatt O, Huveneers S. Vascular stiffening and endothelial dysfunction in atherosclerosis. Curr Opin Lipidol. 2022;33(6):353-63. DOI:10.1097/MOL.0000000000000852.
27. Lacolley P, Regnault V, Segers P, Laurent S. Vascular Smooth Muscle Cells and Arterial Stiffening: Relevance in Development, Aging, and Disease. Physiol Rev. 2017;97(4):1555-617. DOI:10.1152/physrev.00003.2017.
28. Durham AL, Speer MY, Scatena M, et al. Role of smooth muscle cells in vascular calcification: implications in atherosclerosis and arterial stiffness. Cardiovasc Res. 2018;114(4):590-600. DOI:10.1093/cvr/cvy010.
29. Avolio A, Jones D, Tafazzoli-Shadpour M. Quantification of alterations in structure and function of elastin in the arterial media. Hypertension. 1998;32(1):170-5. DOI:10.1161/01.hyp.32.1.170.
30. Seravalle G, Mancia G, Grassi G. Role of the sympathetic nervous system in hypertension and hypertension-related cardiovascular disease. High Blood Press Cardiovasc Prev. 2014;21(2):89-105. DOI:10.1007/s40292-014-0056-1.
31. Goodson ML, Packard AEB, Buesing DR, et al. Chronic stress and Rosiglitazone increase indices of vascular stiffness in male rats. Physiol Behav. 2017;172:16-23. DOI:10.1016/j.physbeh.2016.03.031.
32. Macefield VG. Recording and quantifying sympathetic outflow to muscle and skin in humans: methods, caveats and challenges. Clin Auton Res. 2021;31(1):59-75. DOI:10.1007/s10286-020-00700-6.
33. Quarti-Trevano F, Dell’Oro R, Cuspidi C, et al. Endothelial, Vascular and Sympathetic Alterations as Therapeutic Targets in Chronic Heart Failure. Biomedicines. 2023;11(3):803. DOI:10.3390/biomedicines11030803.
34. Egan B, Grassi G. Sympathetic activation and endothelial dysfunction as therapeutic targets in obesity-related hypertension. J Hypertens. 2013;31(2):259-60. DOI:10.1097/HJH.0b013e32835d0dcf.
35. Holwerda SW, Luehrs RE, DuBose LE, et al. Sex and age differences in the association between sympathetic outflow and central elastic artery wall thickness in humans. Am J Physiol Heart Circ Physiol. 2019;317(3):H552-60. DOI:10.1152/ajpheart.00275.2019.
36. Harvey RE, Barnes JN, Hart EC, et al. Influence of sympathetic nerve activity on aortic hemodynamics and pulse wave velocity in women. Am J Physiol Heart Circ Physiol. 2017;312(2):H340-46. DOI:10.1152/ajpheart.00447.2016.
37. Bruno RM, Ghiadoni L, Seravalle G, et al. Sympathetic regulation of vascular function in health and disease. Front Physiol. 2012;3:284. DOI:10.3389/fphys.2012.00284.
Об авторах
О. Ю. ИсайкинаРоссия
Исайкина Олеся Юрьевна
Москва
А. И. Королев
Россия
Королев Андрей Игоревич
Москва
М. Б. Котова
Россия
Котова Марина Борисовна
Москва
М. Г. Чащин
Россия
Чащин Михаил Георгиевич
Москва
П. А. Черноусов
Россия
Черноусов Павел Андреевич
Москва
С. А. Максимов
Россия
Максимов Сергей Алексеевич
Москва
А. А. Федорович
Россия
Федорович Андрей Александрович
Москва
А. Ю. Горшков
Россия
Горшков Александр Юрьевич
Москва
В. М. Горбунов
Россия
Горбунов Владимир Михайлович
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Исайкина О.Ю., Королев А.И., Котова М.Б., Чащин М.Г., Черноусов П.А., Максимов С.А., Федорович А.А., Горшков А.Ю., Горбунов В.М. Функциональное состояние терминальных мышечных артерий и распределительных артериол у мужчин с различным уровнем психосоциального стресса. Рациональная Фармакотерапия в Кардиологии. 2025;21(4):327-334. https://doi.org/10.20996/1819-6446-2025-3217. EDN: IHECFM
For citation:
Isaykina O.Yu., Korolev A.I., Kotova M.B., Chashchin M.G., Chernousov P.A., Maksimov S.A., Fedorovich A.A., Gorshkov A.Yu., Gorbunov V.M. Functional state of terminal muscular arteries and distributing arterioles in men with different levels of psychosocial stress. Rational Pharmacotherapy in Cardiology. 2025;21(4):327-334. (In Russ.) https://doi.org/10.20996/1819-6446-2025-3217. EDN: IHECFM
JATS XML
















































