Перейти к:
Изучение ассоциации нуклеотидных полиморфизмов в генах тромбоцитарных рецепторов и цитохрома Р450 с развитием резистентности к антитромбоцитарным препаратам у пациентов с ишемической болезнью сердца
https://doi.org/10.20996/1819-6446-2022-06-15
Аннотация
Цель. Изучить ассоциацию нуклеотидных полиморфизмов в генах тромбоцитарных рецепторов и цитохрома Р450 с развитием резистентности к антитромбоцитарным препаратам у пациентов с ишемической болезнью сердца (ИБС).
Материал и методы. В анализ включено 243 пациента с диагнозом ИБС после коронарного шунтирования (КШ), из них 140 пациентов в группе на терапии ацетилсалициловой кислотой (АСК) и 103 пациента – в группе на двойной антитромбоцитарной терапии (ДАТ). Всем пациентам проводилось исследование агрегации тромбоцитов на оптическом агрегометре с индукторами: АДФ 5 мМ и арахидоновой кислотой (АК) 1 мМ. С образцами ДНК была проведена аллель-специфичная ПЦР для выявления полиморфизмов rs2046934, rs1126643, rs5918, rs6065, rs4244285 в генах тромбоцитарных рецепторов и цитохрома Р450.
Результаты. При сравнении распространенности изучаемых полиморфизмов в генах тромбоцитарных рецепторов и цитохрома Р450 между группами чувствительных и резистентных к АСК пациентов, а также группами чувствительных и резистентных к клопидогрелу пациентов статистически значимых различий выявлено не было. Ассоциаций между носительством минорных и мажорных аллелей изученных полиморфизмов и развитием резистентности к антитромбоцитарным препаратам не обнаружено. В группе пациентов на терапии АСК носители аллели С полиморфизма T1565C (rs5918) ITGB3 имели более высокий показатель АК-индуцированной агрегации тромбоцитов по сравнению с носителями аллели T (18,49±25,92 против 10,43±17,34, р=0,004).
Заключение. Полиморфизмы генов P2RY12 (rs2046934), ITGA2 (rs1126643), ITGB3 (rs5918), GP1BA (rs6065), CYP2C19*2 (rs4244285) не связаны с резистентностью к антитромбоцитарным препаратам как у пациентов на терапии АСК, так и на ДАТ. Наличие минорных аллелей полиморфизмов rs2046934, rs1126643, rs6065, rs4244285 не связано с повышенной агрегационной активностью тромбоцитов до КШ. Однако в группе пациентов на терапии АСК носители аллели С полиморфизма rs5918 гена ITGB3 имели более высокий показатель АК-индуцированной агрегации тромбоцитов по сравнению с носителями аллели T.
Ключевые слова
Для цитирования:
Семащенко К.С., Монгуш Т.С., Косинова А.А., Субботина Т.Н., Гринштейн Ю.И. Изучение ассоциации нуклеотидных полиморфизмов в генах тромбоцитарных рецепторов и цитохрома Р450 с развитием резистентности к антитромбоцитарным препаратам у пациентов с ишемической болезнью сердца. Рациональная Фармакотерапия в Кардиологии. 2022;18(3):289-296. https://doi.org/10.20996/1819-6446-2022-06-15
For citation:
Semashchenko K.S., Mongush T.S., Kosinova A.A., Subbotina T.N., Grinshtein Y.I. Study the Association of Nucleotide Polymorphisms in Platelet Receptor and Cytochrome P450 Genes with the Development of Resistance to Antiplatelet Drugs in Patients with Coronary Artery Disease. Rational Pharmacotherapy in Cardiology. 2022;18(3):289-296. (In Russ.) https://doi.org/10.20996/1819-6446-2022-06-15
Введение
Заболевания системы кровообращения, в том числе – ишемическая болезнь сердца (ИБС) на протяжении многих лет возглавляют статистику смертности как в Российской Федерации, так и в большинстве стран мира [1].
Главный этиологический фактор развития ИБС – атеросклероз коронарных артерий с последующим атеротромбозом. Известно, что воспаление, развивающееся на фоне заболевания, вносит особый вклад в патогенез атеросклероза за счет рекрутирования и адгезии циркулирующих лейкоцитов к сосудистому эндотелию с последующим образованием тромбоцитарно-лейкоцитарных агрегатов [2][3]. Повышенный уровень воспаления вследствие повышенной реактивности тромбоцитов может приводить к недостаточному ответу тромбоцитов на ацетилсалициловую кислоту (АСК) у пациентов с ИБС, что снижает эффективность вторичной профилактики и повышает риск кардиоваскулярных событий [2][3].
Определенной группе пациентов с ИБС по показаниям назначается двойная антитромбоцитарная терапия (ДАТ) – комбинация АСК и ингибитора тиенопиридина P2Y12 – клопидогрела. Одновременный прием данных препаратов приводит к взаимному усилению их действия за счет ингибирования разных путей индукции агрегации тромбоцитов: тромбоксан А2-зависимого и АДФ-зависимого [4]. Однако даже на фоне ДАТ у некоторых пациентов сохраняется высокая агрегация тромбоцитов, что может повышать риск развития тромботических осложнений после хирургического вмешательства.
На развитие резистентности к антитромбоцитарным препаратам могут влиять полиморфизмы в генах основных тромбоцитарных рецепторов, которые играют роль в процессах адгезии, активации и агрегации тромбоцитов: ген АДФ-рецептора тромбоцитов P2RY12 (Н1/Н2, rs2046934), ген рецептора к коллагену ITGA2 (С807Т, rs1126643), ген рецептора к фибриногену ITGB3 (T1565C, rs5918), ген тромбоцитарного рецептора фактора Виллебранда GP1BA (C482T, rs6065) и ген цитохрома Р450 СYP2C19*2 (G681A, rs4244285). Изучение данных генов является важным для практики, поскольку наличие описанных выше полиморфизмов приводит к повышению агрегационной активности тромбоцитов, а это, в свою очередь, ведет к повышенному риску тромбообразования, воспаления, тем самым способствуя развитию резистентности к антитромбоцитарным препаратам [5].
Цель исследования – изучить ассоциацию нуклеотидных полиморфизмов в генах тромбоцитарных рецепторов и цитохрома Р450 с развитием резистентности к антитромбоцитарным препаратам у пациентов с ИБС.
Материал и методы
В анализ с 2014 по 2021 гг. было включено 243 пациента с диагнозом ИБС, стабильная стенокардия II-IV функционального класса (ФК) согласно Канадской классификации, поступивших на лечение в ФГБУ «Федеральный центр сердечно-сосудистой хирургии» (г. Красноярск).
Критерии включения: стабильная стенокардия IIIV ФК, атеросклероз коронарных артерий (КА), подтвержденный результатами коронарографии, подписанное информированное согласие. Критерии исключения: почечная недостаточность (скорость клубочковой фильтрации <60 мл/мин/1,73м2 по CKD-EPI), язвенная болезнь желудка и/или двенадцатиперстной кишки в стадии обострения, непереносимость АСК и/или клопидогрела.
Всем пациентам было выполнено коронарное шунтирование (КШ), из них у 183 (75,3%) – с искусственным кровообращением, и у 60 (24,7%) – на работающем сердце. Пациенты были разделены на две группы: 140 пациентов вошли в группу на терапии АСК после КШ и 103 пациента – в группу ДАТ (АСК+клопидогрел) после КШ. Пациенты, получавшие до включения в исследование АСК, продолжили ее прием после КШ (группа АСК). ДАТ получали пациенты, у которых с момента острого коронарного синдрома (в анамнезе) не прошло 12 мес. За 5 дней до КШ больные прекращали получать антиагреганты, с первого дня после операции назначалось 100 мг/сут АСК, пациентам с ДАТ клопидогрел добавлялся к АСК на 2-3 сут (группа ДАТ).
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики и принципами Хельсинской декларации. Протокол исследования был одобрен этическим комитетом КрасГМУ им. проф. В.Ф. Войно-Ясенецкого. Пациентами было подписано информированное согласие об участии в исследовании.
Всем пациентам при поступлении на фоне отмены антиагрегантов проводилось исследование агрегации тромбоцитов на оптическом агрегометре Chronolog 490 (США) с индукторами: АДФ 5 мМ и арахидоновой кислотой (АК) 1 мМ. Резистентность к АСК определялась при уровне агрегации тромбоцитов >20% после инкубации, обогащенной тромбоцитами плазмы с АСК и индукции с АК. Резистентность к клопидогрелу определялась как отношение изменения максимальной интенсивности агрегации тромбоцитов под действием 5 мМ АДФ по отношению к исходному значению (на фоне отмены клопидогрела минимум за 5 сут до КШ):

При значениях <29% пациенты определялись как резистентные к терапии клопидогрелом [6].
Для анализа полиморфизмов rs5819 гена ITGB3, rs6065 гена GP1BA, rs4244285 гена CYP2C19*2, rs1126643 гена ITGA2, rs2046934 гена P2RY12 использовалась геномная ДНК, выделенная из лейкоцитов цельной крови с использованием комплекта реагентов «ДНК-экспресс-кровь» (НПФ Литех). Далее с образцами выделенной ДНК была проведена ПЦР с использованием комплектов реагентов для амплификации «SNPэкспресс-РВ» (НПФ Литех) с детекцией результатов в режиме реального времени, а также «SNP-экспресс» (НПФ Литех) с электрофоретической детекцией продуктов амплификации.
Статистическую обработку результатов проводили с помощью пакета прикладных программ Statistica 10.0 (Statsoft Inc., США). Статистические расчеты количественных показателей включали в себя описательные статистики: среднее значение (М) и стандартное отклонение (SD), или медиана (Me) и межквартильный диапазон (25%; 75%). Проверка нормальности распределения значений проводилась с использованием критерия Колмогорова-Смирнова. Для сравнения средних значений двух независимых выборок при несоответствии нормальному закону распределения применялся критерий Манна-Уитни. Для качественных показателей вычислялись следующие показатели: число наблюдений и доля (в %) от общего количества пациентов или от количества пациентов в соответствующей подгруппе. Для категориальных переменных применяли χ2-тест, а также точный критерий Фишера. Соответствие распределения генотипов закону Харди-Вайнберга оценивали при помощи точного теста Фишера с использованием портала Мюнхенского института человека генетики (https://ihg.helmholtz-muenchen.de), а также критерия χ2 Пирсона. Для оценки риска развития резистентности при наличии минорной аллели изучаемых полиморфизмов производили оценку отношения шансов. Значения считали статистически значимыми при р<0,05.
Результаты
В анализ было включено 243 пациента, из них 49 (20,2%) женщин и 194 (79,8%) мужчины, средний возраст 63,4±7,2 лет. Различий по клинико-анамнестическим характеристикам среди пациентов двух групп не было, кроме наличия постинфарктного кардиосклероза (табл. 1).
Table 1. Clinical and demographic characteristics of patients in the studied groups
Таблица 1. Клинико-демографическая характеристика пациентов изучаемых групп
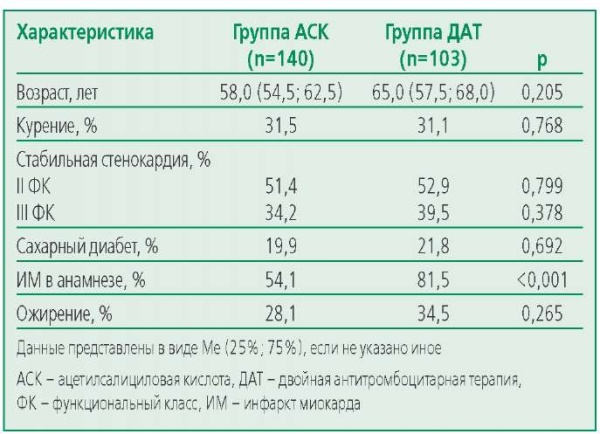
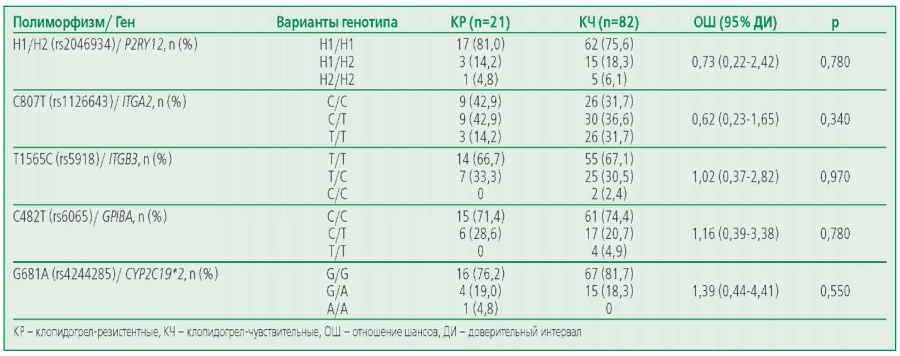
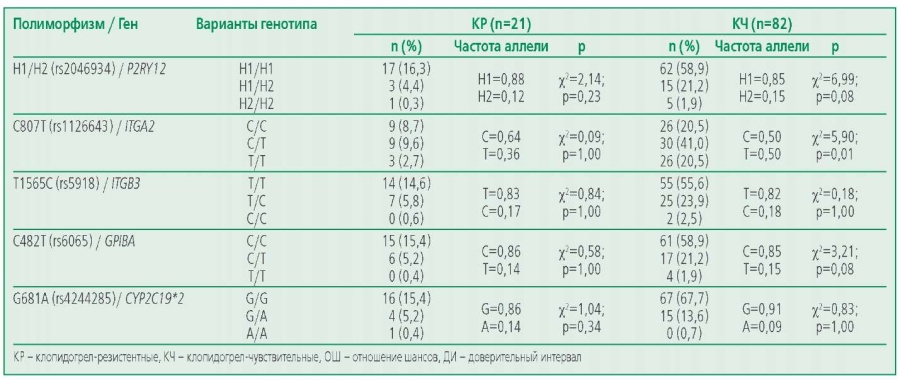
Резистентность к АСК выявлена у 12,8% пациентов до КШ в группе, получавших только АСК в послеоперационном периоде, резистентность к клопидогрелу – у 25,6% пациентов с ДАТ. В ходе генетического анализа нуклеотидных полиморфизмов rs2046934 гена P2RY12, rs1126643 гена ITGA2, rs5819 гена ITGB3, rs6065 гена GP1BA, rs4244285 гена CYP2C19*2 была изучена распространенность разных вариантов у АСК-чувствительных (АЧ) и АСК-резистентных (АР) пациентов (табл. 2), а также у чувствительных (КЧ) или резистентных (КР) к клопидогрелу пациентов (табл. 3). Статистически значимых различий между этими группами по всем анализируемым полиморфизмам не было выявлено. При оценке ассоциаций носительства минорных и мажорных аллелей изучаемых полиморфизмов генов тромбоцитарных рецепторов и цитохрома Р450 с развитием резистентности к антитромбоцитарным препаратам по каждому полиморфизму в группах на терапии АСК и ДАТ не было выявлено статистически значимых различий.
Table 2. The prevalence of allelic variants of the studied polymorphisms in ASA-sensitive and ASA-resistant patients with coronary artery disease taking ASA
Таблица 2. Распространенность аллельных вариантов изучаемых полиморфизмов у АСК-чувствительных и АСК-резистентных пациентов с ИБС на фоне приема АСК
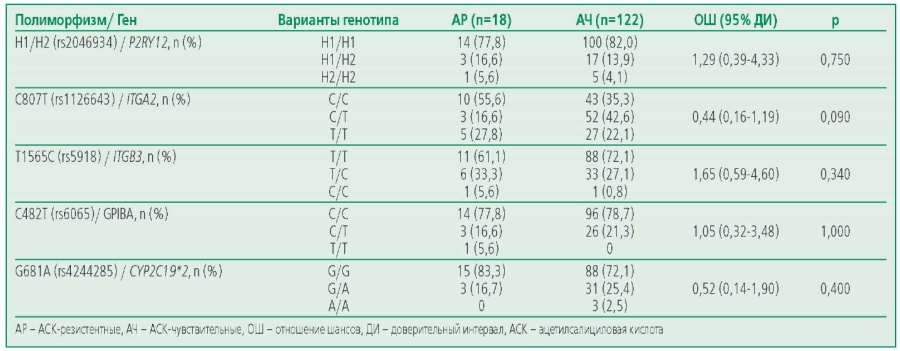
Table 3. The prevalence of allelic variants of the studied polymorphisms in clopidogrel-sensitive and clopidogrel-resistant patients receiving dual antiplatelet therapy
Таблица 3. Распространенность аллельных вариантов изучаемых полиморфизмов у КЧ и КР пациентов на ДАТ
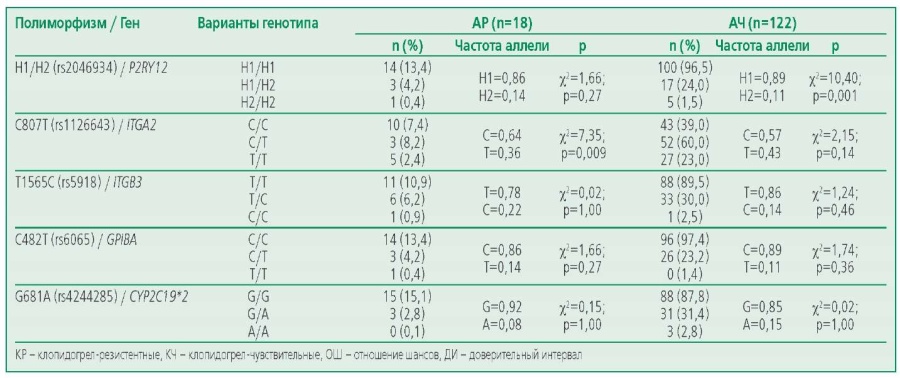
Распределение частот аллелей и генотипов в изученных генах тромбоцитарных рецепторов и цитохрома Р450 у АР и АЧ пациентов на терапии АСК проверено на соответствие равновесию Харди-Вайнберга (табл. 4). Выявлено, что в группе АР пациентов распределение генотипа полиморфизма rs1126643 гена ITGA2 (χ2=7,35; р=0,009) имеет отклонение от канонического распределения. Для генотипов полиморфизмов rs2046934 гена P2RY12, rs5819 гена ITGB3, rs6065 гена GP1BA, rs4244285 гена CYP2C19*2 отклонения от распределения Харди-Вайнберга не выявлено. В группе АЧ пациентов распределение генотипа полиморфизма rs2046934 гена P2RY12 (χ2=10,40; р=0,001) имеет отклонение от равновесия ХардиВайнберга. Для генотипов полиморфизмов rs1126643 гена ITGA2, rs5819 гена ITGB3, rs6065 гена GP1BA, rs4244285 гена CYP2C19*2 отклонений от распределения Харди-Вайнберга не выявлено.
Table 4. The results of the analysis of the consistency of genotypes with the Hardy-Weinberg law in the groups of ASA-sensitive and ASA-resistant patients while taking ASA
Таблица 4. Результаты анализа согласованности генотипов с законом Харди-Вайнберга в группе АР и АЧ пациентов на фоне приема АСК
При изучении распределения частот аллелей и генотипов полиморфных вариантов генов на соответствие закону Харди-Вайнберга в группе КР и КЧ пациентов на ДАТ определено соответствие каноническому распределению по 4 из 5 изучаемых полиморфизмов (табл. 5). Однако распределение генотипов полиморфизма rs1126643 гена ITGA2 χ2=5,90; р=0,01) имело отклонение от равновесия Харди-Вайнберга.
Table 5. The results of the analysis of the consistency of genotypes with the Hardy-Weinberg law in the group of clopidogrel-sensitive and clopidogrel-resistant patients receiving dual antiplatelet therapy
Таблица 5. Результаты анализа согласованности генотипов с законом Харди-Вайнберга в группе КР и КЧ пациентов на фоне приема ДАТ
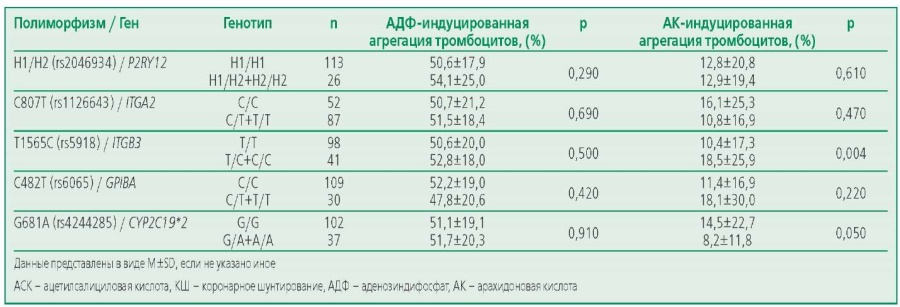
При сравнении агрегационных свойств тромбоцитов в группе пациентов с ИБС при приеме АСК до КШ среди носителей минорных аллелей и гомозигот по частой аллели по 4 из 5 изучаемых полиморфизмов статистически значимых отличий выявлено не было (табл. 6). Однако были выявлены статистически значимые различия при сравнении АК-индуцированной агрегации тромбоцитов среди носителей мажорной и минорной аллелей полиморфизма T1565C (rs5918) ITGB3: носители минорной аллели С имели более высокий показатель агрегации тромбоцитов по сравнению с носителями распространенной аллели T.
Table 6. Comparison of platelet aggregation activity in carriers of minor and major alleles of the studied polymorphisms in the group of patients treated with acetylsalicylic acid before coronary bypass surgery
Таблица 6. Сравнение агрегационной активности тромбоцитов у носителей минорной и мажорной аллелей изучаемых полиморфизмов в группе пациентов на терапии АСК до КШ
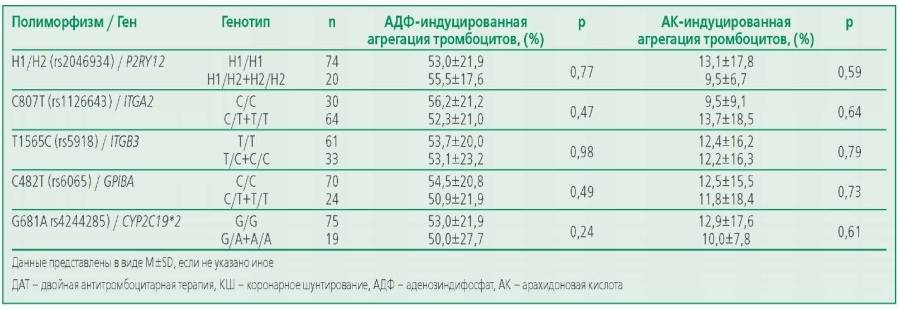
При сравнении агрегационных свойств тромбоцитов в группе пациентов с ИБС на ДАТ до КШ среди носителей минорных аллелей и гомозигот по частой аллели по всем изучаемым полиморфизмам статистически значимых отличий выявлено не было (табл. 7).
Table 7. Comparison of platelet aggregation activity in carriers of the minor and major alleles of theмstudied polymorphisms in the group of patients receiving dual antiplatelet therapy before coronary bypass surgery
Таблица 7. Сравнение агрегационной активности тромбоцитов у носителей минорной и мажорной аллелей изучаемых полиморфизмов в группе пациентов на ДАТ до КШ
Обсуждение
По литературным данным среди пациентов с ИБС жителей Западно-Сибирского региона распространенность разных вариантов генотипов полиморфизма rs2046934 гена P2RY12 составила – H1/H1 – 75,9%, Н1/Н2 – 22,9%, Н2/Н2 – 1,2%, полиморфизма rs5918 гена ITGB3 – ТТ – 62%, TС – 36,2%, СС – 1,8%, полиморфизма rs4244285 гена CYP2C19*2 – GG – 74,7%, GA – 23,5%, AA – 1,8% [7][8]. Распространенность генотипов СС, СT, ТТ полиморфизма rs1126643 гена ITGA2 среди пациентов со стабильной стенокардией напряжения составила 30,4%, 50% и 19,6%, соответственно [9]. Среди пациентов, перенесших инфаркт миокарда после 45 лет, распространенность разных вариантов генотипов полиморфизма rs6065 гена GP1BA составила: СС – 85%, СТ+ТТ – 19,5% [10]. Полученные нами результаты сопоставимы с литературными данными.
Согласно имеющимся исследованиям минорные аллели изучаемых нами полиморфизмов ассоциируют с повышением уровня агрегации тромбоцитов, развитием ИБС и резистентности к антиагрегантам, однако информация разноречива. Так, например, считается, что нуклеотидная замена C807T (rs1126643) гена ITGA2 приводит к увеличению количества рецепторов на поверхности тромбоцита, способствуя повышению агрегационной активности тромбоцитов и, как следствие, к высокому риску тромбообразования [11]. Между тем в других исследованиях было показано, что минорная аллель T не связана с высоким риском развития ИБС, а увеличение количества рецепторов GPIa/IIa не приводит к возрастанию тромботического риска [12]. Кроме того, сообщалось о возможном влиянии аллели Т на резистентность к АСК [13], однако в нашем исследовании это не подтвердилось.
Полиморфный вариант С482Т (rs6065) гена GP1BA может влиять на взаимодействие рецептора с фактором Виллебранда, тем самым способствуя тромбообразованию. Считается, что присутствие полиморфного варианта ассоциировано с риском развития инфаркта миокарда, ИБС [10], а также с развитием резистентности к АСК [14]. Однако в исследовании W. Renner и соавт. [15] ассоциаций данного варианта полиморфизма с ИБС не выявлено.
В исследовании Papp с соавт. [16] была показана ассоциация между гомозиготным генотипом по редкой аллели C полиморфизма T1565C (rs5918) гена ITGB3 и устойчивостью к антиагрегантам. Однако в работе W. Zhang и соавт. показано, что полиморфизм rs5918 не ассоциирован с резистентностью к АСК в китайской популяции [17], а также с резистентностью к клопидогрелу у жителей Западно-Сибирского региона [7].
Помимо этого, предполагается, что носительство гаплотипа H2 полиморфизма rs2046934 гена P2RY12 ассоциировано с повышенной агрегацией тромбоцитов в ответ на АДФ, а это может приводить к сниженному ответу на действие антиагрегантов [18][19]. Тем не менее, в настоящее время нет доказательств, подтверждающих подобную ассоциацию.
Полиморфизм G681A (rs4244285) в гене CYP2C19 является одним из наиболее важных и изученных механизмов резистентности к клопидогрелу, так как именно CYP2C19 играет главную роль в трансформации пролекарства [20]. Считается, что минорная аллель А полиморфизма rs4244285 приводит к сдвигу рамки считывания мРНК, в результате чего синтезируется измененный белок с низкой ферментативной активностью. Все это приводит к сниженному антиагрегантному эффекту клопидорела, а значит, и к высокому риску тромботических событий. Сообщалось о возможном влиянии аллели А на резистентность к клопидогрелу [7], однако в нашем исследовании это также не подтвердилось.
Противоречивые данные разных авторов могут быть обусловлены отсутствием стандартизации методов лабораторной диагностики агрегации тромбоцитов, что уменьшает шансы выявить генетическую связь.
В нашем исследовании в группе пациентов на терапии АСК до КШ носители минорной аллели С полиморфизма T1565C (rs5918) ITGB3 имели более высокий показатель АК-индуцированной агрегации тромбоцитов по сравнению с носителями распространенной аллели T. Нуклеотидная замена T176C гена ITGB3 приводит к изменению аминокислоты лейцина в положении 33 на пролин. Тромбоциты, несущие субъединицу β3интегрина αIIbβ3 с пролином вместо лейцина в положении 33, имеют более низкий порог активации различными агонистами, при этом наблюдается перестройка цитоскелета тромбоцитов, а также усиление сигнальных функций комплекса IIb-IIIa. Поэтому носители минорной аллели С полиморфизма T1565C (rs5918) гена ITGB3 обладают повышенным риском тромбообразования с такими последствиями, как инсульт и инфаркт миокарда [21][22].
Ограничения исследования
При интерпретации данных исследования следует учитывать его моноцентровый характер, а также небольшой размер выборки, что могло оказать влияние на мощность полученных результатов.
Заключение
Полиморфизмы генов P2RY12 (rs2046934), ITGA2 (rs1126643), ITGB3 (rs5918), GP1BA (rs6065), CYP2C19*2 (rs4244285) не ассоциированы с резистентностью к антитромбоцитарным препаратам как у пациентов на терапии АСК, так и при ДАТ. Кроме того, наличие минорных аллелей полиморфизмов rs2046934, rs1126643, rs6065, rs4244285 не связано с повышенной агрегационной активностью тромбоцитов до коронарного шунтирования. Однако в группе пациентов на терапии АСК носители минорной аллели С полиморфизма rs5918 гена ITGB3 имели более высокий показатель АК-индуцированной агрегации тромбоцитов по сравнению с носителями распространенной аллели T, что может приводить к активному тромбообразованию даже на фоне приема АСК.
Отношения и Деятельность. Нет.
Relationships and Activities. None.
Финансирование. Исследование проведено при поддержке Сибирского федерального университета, Красноярского государственного медицинского университета им. проф. В.Ф. Войно-Ясенецкого, Федерального центра сердечно-сосудистой хирургии.
Funding. The study was performed with the support of the Siberian Federal University, Professor V.F. VoynoYasenetsky Krasnoyarsk State Medical University, Federal Center for Cardiovascular Surgery.
Список литературы
1. Бойцов С.А., Зайратьянц О.В., Андреев Е.М., и др. Сравнение показателей смертности от ишемической болезни сердца среди мужчин и женщин старше 50 лет в России и США. Российский Кардиологический Журнал. 2017;6(146):100-7. DOI:10.15829/1560-4071-2017-6-100-107.
2. Шилов А.М. Ацетилсалициловая кислота – антиагрегант для профилактики и лечения сердечно-сосудистых заболеваний. Трудный Пациент. 2013;11(4):3-8.
3. McCullough PA, Vasudevan A, Sathyamoorthy M, et al. Urinary 11-Dehydro-Thromboxane B2 and Mortality in Patients With Stable Coronary Artery Disease. Am J Сardiol. 2017;119(7):972-7. DOI:10.1016/j.amjcard.2016.12.004.
4. Steg PG, James SK, Atar D, et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology (ESC). Eur Heart J. 2012;33(20): 2569-619. DOI:10.1093/eurheartj/ehs215
5. Гринштейн Ю.И., Косинова А.А., Гринштейн И.Ю. Гены-кандидаты резистентности к ацетилсалициловой кислоте и их связь с риском развития сердечно-сосудистых катастроф. Кардиоваскулярная Терапия и Профилактика. 2013;12(1):67-72. DOI:10.15829/1728-88002013-1-67-72.
6. Сулимов В.А., Мороз Е.В. Резистентность к антитромбоцитарным препаратам (аспирину, клопидогрелу) у пациентов, подвергающихся элективному стентированию коронарных артерий. Рациональная Фармакотерапия в Кардиологии. 2012;8(1):23-30. DOI:10.20996/18196446-2012-8-1-23-30.
7. Муслимова Э.Ф., Афанасьев С.А., Реброва Т.Ю., и др. Ассоциация полиморфизмов генов ITGB3, P2RY12, CYP2C19 с функциональной активностью тромбоцитов у пациентов с ишемической болезнью сердца на фоне двухкомпонентной антиагрегантной терапии. Терапевтический Архив. 2017;89(5):74-8. DOI:10.17116/terarkh201789574-78.
8. Мирзаев К.Б., Сычев Д.А., Андреев А.Б., и др. Значение фармакогенетического тестирования по CYP2C19 для персонализации применения антиагрегантов в кардиологической практике. Рациональная Фармакотерапия в Кардиологии. 2013;9(4):4048. DOI:10.20996/1819-6446-2013-9-4-404-408.
9. Пронько Т.П., Снежицкий В.А., Горчакова О.В., и др. Клинические и генетические факторы, ассоциированные с риском повторных ишемических событий у пациентов со стабильной стенокардией напряжения. Регионарное Кровообращение и Микроциркуляция. 2021;20(3):18-27. DOI:10.24884/1682-6655-2021-20-3-18-27.
10. Pina-Cabral LB, Carvalhais V, Mesquita B, et al. Myocardial infarction before and after the age of 45: Possible role of platelet receptor polymorphisms. Revista Portuguesa de Cardiologia. 2018;37(9):72735. DOI:10.1016/j.repc.2018.03.015.
11. Wu G, Xi Y, Yao L, et al. Genetic polymorphism of ITGA2 C807T can increase the risk of ischemic stroke. International Journal of Neuroscience. 2014;124(11):841-51. DOI:10.3109/00207454.2013.879718.
12. Tsantes AE, Nikolopoulos GK, Bagos PG, et al. Lack of association between the platelet glycoprotein Ia C807T gene polymorphism and coronary artery disease: a meta-analysis. Int J Cardiol. 2007;118(2):189-96. DOI:10.1016/j.ijcard.2006.06.047.
13. Ferreira M, Freitas-Silva M, Assis J, et al. The emergent phenomenon of aspirin resistance: insights from genetic association studies. Pharmacogenomics. 2020;21(2):125-40. DOI:10.2217/pgs2019-0133.
14. Fujiwara T, Ikeda M, Esumi K, et al. Exploratory aspirin resistance trial in healthy Japanese volunteers (J-ART) using platelet aggregation as a measure of thrombogenicity. The Pharmacogenomics J. 2007;7(6):395-403. DOI:10.1038/sj.tpj.6500435.
15. Renner W, Brodmann M, Winkler M, et al. The PlA1/A2 Polymorphism of Platelet Glycoprotein IIIa Is not Associated with Peripheral Arterial Disease. Thrombosis and Haemostasis. 2001;85(4):7456. DOI:10.1055/s-0037-1615664.
16. Papp E, Havasi V, Bene J, et al. Glycoprotein IIIA gene (PIA) polymorphism and aspirin resistance: Is there any correlation? Ann Pharmacother. 2005;39(6):1013-8. DOI:10.1345/aph.1E227.
17. Zhang W, Hou H, Zhao H, et al. Correlations of P2Y1 and ITGB3 polymorphisms with aspirin resistance in patients with large artery atherosclerotic stroke. International Journal of Cerebrovascular Diseases. 2017;25(11):1018-22. DOI:10.3760/cma.j.issn.1673-4165.2017.11.010.
18. Fontana P, Dupont A, Gandrille S, et al. Adenosine diphosphate–induced platelet aggregation is associated with P2Y12 gene sequence variations in healthy subjects. Circulation. 2003;108(8):98995. DOI:10.1161/01.CIR.0000085073.69189.88.
19. Айнетдинова Д.Х., Удовиченко А.Е., Сулимов В.А. Резистентность к антитромбоцитарным препаратам у больных ишемической болезнью сердца. Рациональная Фармакотерапия в Кардиологии. 2007;3(3):52-9. DOI:10.20996/1819-6446-2007-3-3-52-59.
20. Liu R, Zhou ZY, Chen YB, et al. Associations of CYP3A4, NR1I2, CYP2C19 and P2RY12 polymorphisms with clopidogrel resistance in Chinese patients with ischemic stroke. Acta Pharmacologica Sinica. 2016;37(7):882-8. DOI:10.1038/aps.2016.41.
21. Васильева O.В., Полонников А.В., Иванов М.А., и др. Молекулярно-генетические аспекты кардиоваскулярных и цереброваскулярных заболеваний. Клинико-лабораторный Консилиум. 2009;(4): 56-9.
22. Khatami M, Heidari MM, Soheilyfar S. Common rs5918 (PlA1/A2) polymorphism in the ITGB3 gene and risk of coronary artery disease. Arch Med Sci Atheroscler Dis. 2016;1(1):e9-e15. DOI:10.5114/amsad.2016.59587.
Об авторах
К. С. СемащенкоРоссия
Семащенко Ксения Сергеевна - eLibrary SPIN 3326-7769.
Красноярск
Т. С. Монгуш
Россия
Монгуш Таира Семеновна - eLibrary SPIN 3095-1506.
А. А. Косинова
Россия
Косинова Александра Александровна - eLibrary SPIN 2108-0220.
Т. Н. Субботина
Россия
Субботина Татьяна Николаевна - eLibrarySPIN9818-7718
Красноярск
Ю. И. Гринштейн
Россия
Гринштейн Юрий Исаевич - eLibrary SPIN 1219-3804
Рецензия
Для цитирования:
Семащенко К.С., Монгуш Т.С., Косинова А.А., Субботина Т.Н., Гринштейн Ю.И. Изучение ассоциации нуклеотидных полиморфизмов в генах тромбоцитарных рецепторов и цитохрома Р450 с развитием резистентности к антитромбоцитарным препаратам у пациентов с ишемической болезнью сердца. Рациональная Фармакотерапия в Кардиологии. 2022;18(3):289-296. https://doi.org/10.20996/1819-6446-2022-06-15
For citation:
Semashchenko K.S., Mongush T.S., Kosinova A.A., Subbotina T.N., Grinshtein Y.I. Study the Association of Nucleotide Polymorphisms in Platelet Receptor and Cytochrome P450 Genes with the Development of Resistance to Antiplatelet Drugs in Patients with Coronary Artery Disease. Rational Pharmacotherapy in Cardiology. 2022;18(3):289-296. (In Russ.) https://doi.org/10.20996/1819-6446-2022-06-15

















































